
СПИСОК ДОКУМЕНТОВ
2280459 Способ коррекции косметичеких дефектов
|
РОССИЙСКАЯ ФЕДЕРАЦИЯ

ФЕДЕРАЛЬНАЯ СЛУЖБА
ПО ИНТЕЛЛЕКТУАЛЬНОЙ СОБСТВЕННОСТИ
ПАТЕНТАМ И ТОВАРНЫМ ЗНАКАМ
|
Патент №2280459 |
(54) СРЕДСТВО ДЛЯ ИЗМЕНЕНИЯ СКОРОСТИ РОСТА ИЛИ РЕПРОДУКЦИИ КЛЕТОК, СПОСОБ ЕГО ПОЛУЧЕНИЯ, СПОСОБ СТИМУЛЯЦИИ ЗАЖИВЛЕНИЯ РАН ИЛИ ЛЕЧЕНИЯ ОЖОГОВ, СПОСОБ КОРРЕКЦИИ КОСМЕТИЧЕСКОГО ДЕФЕКТА, СПОСОБ ИНГИБИРОВАНИЯ СТАРЕНИЯ КОЖИ И СПОСОБ СТИМУЛЯЦИИ РОСТА ВОЛОС
(57) Реферат:
Изобретение относится к области биотехнологии. Средство содержит кондиционированную культуральную среду, полученную при культивировании эукариотических клеток в трех измерениях. Способ получения средства предусматривает: а) получение кондиционированной клеточной среды культивирования, содержащей требуемые уровни внеклеточных продуктов, путем культивирования эукариотических клеток в трех измерениях в клеточной культуральной среде in vitro; b) отделение кондиционированной клеточной среды культивирования от клеток, использованных для кондиционирования указанной среды; и, в случае необходимости, с) объединение указанной кондиционированной клеточной среды культивирования с фармацевтически приемлемым носителем. Средство используют для стимуляции заживления ран или лечения ожогов, коррекции косметического дефекта, ингибирования старения кожи и стимуляции роста волос. Изобретение позволяет модулировать скорость роста и репродукции эукариотических клеток. 6 с. и 31 з.п. ф-лы, 2 табл., 5 ил.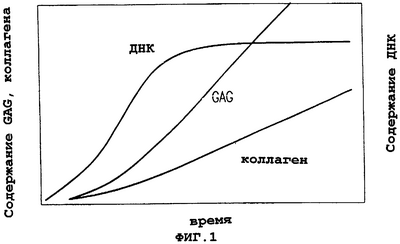
1. Введение
Настоящее изобретение относится к композициям, содержащим клеточную культуральную среду, кондиционированную клетками, выращенными в двухмерной культуре (то есть в монослое) или в трехмерной культуре. Клетки, используемые для кондиционирования среды, могут быть генетически модифицированы в целях изменения концентрации белков, присутствующих в данной среде. Кондиционированную клеточную среду обрабатывают для использования в различных целях, включая обработку ран, применение в качестве косметических добавок, пищевых добавок и добавок в корм животных, культивирование клеток, фармацевтическое применение, а также для использования в композициях и методах для стимуляции роста волос. Настоящее изобретение также относится к композициям, содержащим белки внеклеточного матрикса и/или другие очищенные белки, происходящие от данной кондиционированной среды.
2. Предпосылки создания изобретения
2.1. Кондиционированная клеточная среда
Композиции, содержащие культуральную среду, обычно включают незаменимые аминокислоты, соли, витамины, минералы, следовые количества металлов, сахара, липиды и нуклеозиды. Были сделаны попытки создать среду для культивирования клеток, являющуюся источником компонентов, необходимых для удовлетворения потребностей в питательных веществах, требующихся для роста клеток в контролируемой, искусственной и in vitro-среде. Питательные композиции, рН и осмомолярность варьируется в соответствии с такими параметрами, как тип клеток, клеточная плотность и система, используемая для культивирования. Многие композиции, содержащие клеточные культуральные среды, описаны в литературе, а некоторые среды являются коммерчески доступными. Специалистам известно, что после инкубирования культуральной среды с клетками эта среда становится "истощенной" или "кондиционированной" средой. Кондиционированные среды содержат много исходных компонентов самой среды, а также различные клеточные метаболиты и секретированные белки, включая, например, биологически активные факторы роста, медиаторы воспаления и другие внеклеточные белки. Клеточные линии растут в виде монослоя или на гранулах в отличие от клеток, растущих в трехмерной среде, в которой отсутствуют взаимодействия клеток друг с другом и клеток с внеклеточным матриксом, характерные для всех тканей in vivo. Поэтому такие клетки секретируют ряд клеточных метаболитов, хотя они необязательно должны секретировать эти метаболиты, и уровни секретированных белов приближаются к физиологическим уровням. Стандартную кондиционированную клеточную культуральную среду, то есть среду, культивированную клеточными линиями, растущими в виде монослоя или на гранулах, обычно отбрасывают, а иногда используют в манипуляциях с культурами, таких как снижение плотности клеток.
2.2. Системы для культивирования тканей
Большинство клеточных культур позвоночных выращивают in vitro в виде монослоев на искусственном субстрате, погруженном в культуральную среду. Субстраты, на которых растут указанные монослои, могут быть, по своей природе, твердыми, такими как пластик, или полутвердыми гелями, такими как коллаген или агар. В настоящее время предпочтительными субстратами, используемыми при культивировании тканей или клеток, являются пластики для одноразового применения.
Несколько специалистов провели исследования по использованию природных субстратов для компонентов базальных мембран. Базальные мембраны включают смесь гликопротеинов и протеогликанов, окружающих большинство клеток in vivo. Так, например, Reid & Rojkund, 1979, Methods in Enzymology, Vol.57, Cell Culture, Jakoby & Fasten, eds., New York, Acad. Press, pp.263-278; Viodavsky et al., 1980, Cell 19:607-617; Yang et al., 1979, Proc.Nati.Acad.Sci. USA 76:3401 использовали коллаген для культивирования гепатоцитов, эпителиальных клеток и эндотелиальной ткани. В попытке стимулировать терминальную дифференцировку использовали рост клеток на флотирующем коллагене (Michalopoulos & Pitot, 1975, Fed. Proc. 34:826) и на мембранах с нитратом целлюлозы (Savage & Bonney, 1978, Exp.Cell.Res. 114:307-315). Однако пролонгированная клеточная регенерация и культивирование таких тканей в указанных системах до сих пор не были осуществлены.
Для усиления роста клеток, а особенно при низкой плотности, были использованы культуры фибробластов эмбрионов мышей. Предполагается, что этот эффект обусловлен отчасти пополнением данной среды, но он может быть также обусловлен кондиционированием субстрата клеточными продуктами. В этих системах питающие слои фибробластов росли как конфлюентные монослои, которые делают данную поверхность подходящей для прикрепления других клеток. Так, например, сообщалось о росте глиомы на конфлюентных питающих слоях нормальных фетальных клеток кишечника (Lindsay 1979, Nature 228:80).
Хотя культивирование клеток в двухмерной среде является стандартным способом получения, наблюдения и исследования клеток в культуре, позволяющим достигать высокой степени пролиферации клеток, однако, он является нехарактерным для целых тканей In vivo. Для исследования таких функциональных и морфологических взаимодействий некоторые исследователи использовали трехмерные субстраты, такие как коллагеновый гель (Douglas et al., 1980, In Vitro 16:306-312; Yang et al., 1979, Proc. Natl. Acad. Sci. 76:3401; Yang et al., 1980, Proc. Natl. Acad. Sci. 77:2088-2092; Yang et al., 1981, Cancer Res. 41:1021-1027); целлюлозная губка, взятая отдельно (Leighton et al., 1951, J. Natl. Cancer. Inst. 12:545-561) или покрытая коллагеном (Leighton et al., 1968, Cancer Res. 28:286-296); желатиновая губка, Gelfoam (Sorour et al., 1975, J.Neurosurg. 43:742-749).
В основном эти трехмерные субстраты инокулировали культивируемыми клетками. Сообщалось, что многие клетки этих типов проникали в матрикс и создавали "тканеподобную" гистологию. Так, например, трехмерные коллагеновые гели были использованы для культивирования эпителия молочной железы (Yang efc al., 1981, Cancer. Res. 41:1021-1027) и нейронов симпатической нервной системы (Ebendal, 1978, Exp.Cell Res. 98:159-169). Кроме того, были предприняты различные попытки регенерации тканеподобной архитектуры из диспергированных культур монослоев. Kruse & Miedema (1965, J.Cell Biol. 27:273) сообщали, что перфузионные монослои могли расти до глубины более чем в десять клеток, а в том случае, когда проводили подпитку соответствующей средой в многослойных культурах могли развиваться органоидные структуры (см. также Schneider et al., 1963, Exp.Cell Res. 30:449-459; Bell et al., 1979, Proc.Natl. Acad. Sci., USA, 76:1274-1279; Green, 1979, Science 200:1385-1388). Сообщалось, что эпидермальные кератиноциты человека могут образовывать дерматоглифы (фрикционныие гребешки, если они выдерживаются в течение нескольких недель без переноса); Folkmann и Haudenschild (1980, Nature 288:551-556) сообщали об образовании капиллярных канальцев в культурах сосудистых эндотелиальных клеток, культивированных в присутствии эндотелиального фактора роста и среды, кондиционированной опухолевыми клетками; Sirica и др. (1979, Proc.Natl. Acad. Sci., USA, 76:283-287; 1980, Cancer Res. 40:3259-3267) поддерживали гепатоциты в первичной культуре в течение приблизительно 10-13 дней на найлоновых ситах, покрытых тонким слоем коллагена. Однако в таких системах не была получена долгоживущая культура и не была достигнута пролиферация клеток.
Была предпринята попытка создания долгоживущей культуры тканей, таких как костный мозг. В целом все полученные результаты были разочаровывающими, то есть, хотя слой стромальных клеток, содержащих клетки различного типа, образовывался быстро, однако, какой-либо значимый гемопоэз не мог поддерживаться в течение какого-либо реального времени (обзор см. Dexter et al., In Long Term Bone Marrow Culture, 1984, Alan R. Liss, Inc., pp.57-96).
Некоторые группы исследователей предприняли попытки вырастить ткани кожи и соединительной ткани in vitro для трансплантации in vivo. В одной из таких систем гидратированная бычья коллагеновая решетка образует субстрат, в который внедряются клетки, такие как фибробласты, что приводит к стягиванию этой решетки в ткань (Bell et al., патент США №4485096). В другой системе для культивирования клеток фибробластов использовалась пористая перекрестно сшитая коллагеновая губка (Eisenberg, WO 91/16010). Был также описан каркас, состоящий из синтетических полимеров и предназначенный для регулирования клеточного роста и пролиферации in vitro так, чтобы после начала роста фибробластов и присоединения их к матриксу, их можно было трансплантировать пациенту (Vacanti et al., патенты США №5759830; 5770193; 5736372).
В качестве каркаса для роста клеток были также сконструированы и разработаны синтетические матрицы, состоящие из биологически разлагаемых, биологически совместимых сополимеров полиэфиров и аминокислот (патент США №5654381; 5709854). Биологически неразлагаемые каркасы также способны поддерживать рост клеток. Были также разработаны трехмерные системы культивирования клеток, которые состоят из стромального матрикса, поддерживающего рост клеток из любой нужной ткани с образованием зрелой ткани (Naughton et al., патенты США №№4721096 и 5032508). Другой метод предусматривает получение медленно полимеризующихся гидрогелей, содержащих большое число клеток нужного типа, которые внедряются в матрикс после их введения пациенту (патент США №5709854). Были сконструированы внеклеточные матриксные препараты, которые состоят из стромальных клеток, обеспечивающих трехмерную систему для культивирования клеток нужного типа, и которые могут быть инъецированы пациенту для точного включения данного биоматериала в организм пациента (Naughton et al. WO 96/39101).
2.3. Клеточные цитокины и факторы роста
Секреция внеклеточных белков, таких как факторы роста, цитокины и белки стрессов, в кондиционированные клеточные среды открывает новые возможности в получении продуктов для использования в различных целях, включая репарацию тканей, например, при лечении ран и других дефектов ткани, таких как косметические дефекты, а также для использования в качестве пищевых добавок в пищу человека и в корм животных. Так, например, известно, что факторы роста играют важную роль в процессе заживления ран. В основном, очевидно, что при лечении ран желательно увеличить уровень поставляемых факторов роста путем прямого введения этих факторов.
Клеточные цитокины и факторы роста участвуют в ряде важных клеточных процессов, включая пролиферацию клеток, адгезию клеток, морфологию клеток, дифференцировку клеток, миграцию клеток, воспалительные реакции, ангиогенез и гибель клеток. Исследования продемонстрировали, что гипоксический стресс и повреждение клеток индуцирует ответную реакцию, включая повышение уровней мРНК и белков, соответствующих факторам роста, таким как PDGF (тромбоцит-производный фактор роста), VEGF (сосудистый эндотелиальный фактор роста), FGF (фактор роста тромбоцитов) и IGF (инсулиноподобный фактор роста)(Gonzalez-Rubio, M. et al., 1996, Kidney Int. 50(1):164-73; Abramovitch, R. et al., 1997, Int. J. Exp. Pathol. 78(2):57-70; Stein I. et al., 1995, Mol.Cell.Biol. 15(10):5363-8; Yang W. et al., 1997, FEBS Lett. 403(2):139-42; West, N.R. et al. 1995, J.Neurosci. Res. 40 (5):647-59).
Факторы роста, такие как трансформирующий фактор роста-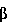 , также известные специалистам как TGF- , также известные специалистам как TGF-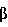 , индуцируются некоторыми белками стрессов в процессе заживления ран. Известны два белка стрессов, GRP78 и HSP90. Эти белки стабилизируют клеточные структуры и сообщают клеткам резистентность к неблагоприятным условиям. Семейство димерных белков TGF- , индуцируются некоторыми белками стрессов в процессе заживления ран. Известны два белка стрессов, GRP78 и HSP90. Эти белки стабилизируют клеточные структуры и сообщают клеткам резистентность к неблагоприятным условиям. Семейство димерных белков TGF-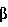 включает TGF- включает TGF-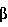 1, TGF- 1, TGF-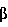 2 и TGF- 2 и TGF-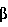 3 и регулирует рост и дифференцировку клеток многих типов. Кроме того, это семейство белков обладает рядом биологических эффектов, стимулирующих рост клеток некоторых типов (Noda et al., 1989, Endocrinology 124:2991-2995) и ингибирующих рост клеток других типов (Goey et al., 1989, J.Immunol. 143:877-880; Pietenpol et al., 1990, Proc.Natl.Acad.Sci.USA 87:3758-3762). Было также показано, что TGF- 3 и регулирует рост и дифференцировку клеток многих типов. Кроме того, это семейство белков обладает рядом биологических эффектов, стимулирующих рост клеток некоторых типов (Noda et al., 1989, Endocrinology 124:2991-2995) и ингибирующих рост клеток других типов (Goey et al., 1989, J.Immunol. 143:877-880; Pietenpol et al., 1990, Proc.Natl.Acad.Sci.USA 87:3758-3762). Было также показано, что TGF-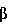 способствует повышению экспрессии белков внеклеточного матрикса, включая коллаген и фибронектин (Ignotz et al., 1986, J.Biol.Chem. 261:4337-4345), и ускорению заживления ран (Mustoe et al., 1987, Science 237:1333-1335). способствует повышению экспрессии белков внеклеточного матрикса, включая коллаген и фибронектин (Ignotz et al., 1986, J.Biol.Chem. 261:4337-4345), и ускорению заживления ран (Mustoe et al., 1987, Science 237:1333-1335).
Другим таким фактором роста является PDGF. PDGF был первоначально обнаружен как сильный митоген для мезенхимных клеток. (Ross R. et al., 1974, Proc.Natl. Acad. Sci., USA, 71(4):1207-1210; Kohler N. et al., 1974, Exp.Cell Res. 87:297-301). Последующие исследования показали, что PDGF способствует увеличению уровня насыщенности клетками и грануляции ткани при ее образовании. Раны, заживляемые с помощью PDGF, на ранней стадии имеют внешний вид воспалительного ответа, заключающегося в увеличении количества клеток типов нейтрофилов и макрофагов в области раны. В этих ранах также наблюдается повышенная функция фибробластов (Pierce G.F. et al., 1988, J.Exp.Med. 167:974-987). При исследовании животных было показано, что как PDGF, так и TGF-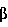 способствуют стимуляции образования коллагена, увеличению содержания ДНК и уровней белков (Grotendorst G.R. et al., 1985, J. Clin. Invest. 76:2323-2329; Sporn, M.B. et al., 1983, Science (Wash DC) 219:1329). Было показано, что PDGF является эффективным для лечения ран у человека. В ранах человека, например в пролежнях, подвергающихся заживлению, экспрессия PDGF-AA усиливается. Такое увеличение PDGF-AA соответствует увеличению активированных фибробластов, отложению межклеточного матрикса и активной васкулялизации раны. Кроме того, такое увеличение PDGF-AA не наблюдается в хронических незаживающих ранах (Principles of Tissue Engineering, R. Lanza et al. (eds.) pp.133-141 (R.G. Landes Co. TX 1997). Рядом других факторов роста, обладающих способностью к индуцированию ангиогенеза и к заживлению ран, являются VEGF, KGF и основный FGF. способствуют стимуляции образования коллагена, увеличению содержания ДНК и уровней белков (Grotendorst G.R. et al., 1985, J. Clin. Invest. 76:2323-2329; Sporn, M.B. et al., 1983, Science (Wash DC) 219:1329). Было показано, что PDGF является эффективным для лечения ран у человека. В ранах человека, например в пролежнях, подвергающихся заживлению, экспрессия PDGF-AA усиливается. Такое увеличение PDGF-AA соответствует увеличению активированных фибробластов, отложению межклеточного матрикса и активной васкулялизации раны. Кроме того, такое увеличение PDGF-AA не наблюдается в хронических незаживающих ранах (Principles of Tissue Engineering, R. Lanza et al. (eds.) pp.133-141 (R.G. Landes Co. TX 1997). Рядом других факторов роста, обладающих способностью к индуцированию ангиогенеза и к заживлению ран, являются VEGF, KGF и основный FGF.
В настоящее время не существует простых эффективных методов или композиций для применения сред, содержащих различные цитокины, факторы роста или другие регуляторные белки, обнаруживаемые в кондиционированных средах настоящего изобретения.
3. Краткое описание изобретения
Заявителями настоящего изобретения описаны новые композиции кондиционированной клеточной культуральной среды. Кроме того, настоящее изобретение относится к использованию этих новых композиций. Настоящее изобретение также относится к композициям, содержащим конкретные белковые продукты, происходящие от кондиционированной клеточной среды настоящего изобретения.
Композиции кондиционированной клеточной среды настоящего изобретения могут состоять из любой известной определенной или неопределенной среды и могут быть кондиционированы с использованием любых эукариотических клеток. Эта среда может быть кондиционирована стромальными клетками, паренхимными клетками, мезенхимными стволовыми клетками, резервными клетками печени, стволовыми нервными клетками, стволовыми клетками поджелудочной железы и/или эмбриональными стволовыми клетками. Предпочтительной является трехмерная тканевая конструкция. Клетки этого типа, независимо от того, присутствуют они в монослое или в трехмерном пространстве, будут влиять на свойства кондиционированной среды. Так, например, среда, кондиционированная астроцитами и нейронами, будет вырабатывать некоторые характерные метаболиты и белки, а поэтому такая кондиционированная среда является предпочтительной для некоторых применений в целях репарации нервной ткани. В предпочтительных вариантах осуществления изобретения среда кондиционирована трехмерной клеточной и тканевой культурой. В другом предпочтительном варианте осуществления изобретения среда кондиционирована стромальными клетками, использованными в продуцировании TransCyte (Smith & Nephew PLC., United Kingdom). В наиболее предпочтительном варианте осуществления изобретения клетками трехмерной тканевой культуры являются стромальные клетки, а конструкцией тканевой культуры является Dermagraft (Smith & Nephew PLC., United Kingdom). В наиболее предпочтительном варианте осуществления изобретения клетками трехмерной тканевой культуры являются стромальные клетки, а конструкцией тканевой культуры является Dermagraft (Advanced Tissue Sciences, Inc., La Jolla CA) с добавлением или без добавления специфических паренхимных клеток. Такая кондиционированная клеточная среда дает уникальную комбинацию факторов и конкретных отношений, которая отличается от монослойных культур и которая наиболее близка к средам, наблюдаемым in vivo. Эта трехмерная стромальная культура может быть затем культивирована с паренхимными клетками, такими как клетки кожи, кости, печени, нервной системы, поджелудочной железы и т.п., с получением кондиционированной среды, содержащей характерные внеклеточные белки и другие метаболиты тканей этого типа. Кроме того, каждая клетка этого типа может быть также генетически модифицирована. Такая генетическая модификация может быть использована для изменения концентрации одного или нескольких компонентов в указанной среде, например, для позитивной регуляции белка, для введения нового белка или для регуляции концентрации ионов. (Advanced Tissue Sciences, Inc., La Jolla CA) с добавлением или без добавления специфических паренхимных клеток. Такая кондиционированная клеточная среда дает уникальную комбинацию факторов и конкретных отношений, которая отличается от монослойных культур и которая наиболее близка к средам, наблюдаемым in vivo. Эта трехмерная стромальная культура может быть затем культивирована с паренхимными клетками, такими как клетки кожи, кости, печени, нервной системы, поджелудочной железы и т.п., с получением кондиционированной среды, содержащей характерные внеклеточные белки и другие метаболиты тканей этого типа. Кроме того, каждая клетка этого типа может быть также генетически модифицирована. Такая генетическая модификация может быть использована для изменения концентрации одного или нескольких компонентов в указанной среде, например, для позитивной регуляции белка, для введения нового белка или для регуляции концентрации ионов.
После кондиционирования клеточной среды настоящего изобретения она может быть использована в любом состоянии. Физическими вариантами этой кондиционированной среды являются, но не ограничиваются ими, жидкая или твердая среда, замороженная среда, лиофилизованная среда или среда, высушенная до порошкообразного состояния. Кроме того, эта среда может быть приготовлена в сочетании с фармацевтически приемлемым наполнителем, используемым в качестве носителя для внутреннего введения, для введенния непосредственно в пищу или пищевой продукт, для получения мази или растирания для местного применения или, например, она может быть изготовлена в виде хирургического клея или добавлена в него для ускорения заживления швов после хирургического вмешательства. Кроме того, указанная среда может быть дополнительно обработана для увеличения или уменьшения концентрации одного или нескольких факторов или компонентов, содержащихся в данной среде. Так, например, кондиционированная среда может быть обогащена факторами роста с использованием иммуноаффинной хроматографии.
В одном из вариантов настоящего изобретения кондиционированная среда настоящего изобретения используется для заживления ран. Примерами применения такой кондиционированной среды являются, но не ограничиваются ими, использование в марлевых повязках (адгезивных или неадгезивных) и местное применение для стимуляции и/или ускорения заживления ран. В этом случае указанная кондиционированная среда может быть обработана для увеличения или уменьшения концентрации одного или нескольких компонентов в целях ускорения заживления ран. Эти композиции могут быть лиофилизованы/высушены замораживанием и добавлены в наполнитель для ран, либо они могут быть добавлены в уже имеющиеся композиции для заполнения ран в целях ускорения их заживления. Альтернативно, указанная среда может быть добавлена в гидрогелевую композицию и использована в качестве пленки для местной обработки раны и в антиадгезивных компрессах. Композиции, содержащие среду настоящего изобретения, могут быть кондиционированы клетками, которые экспрессируют генные продукты с улучшенными свойствами, способствующими заживлению ран, то есть сконструированными клетками, которые экспрессируют генные продукты, обладающие свойствами, препятствующими образованию рубцов.
В другом варианте осуществления изобретения композиции, содержащие кондиционированную клеточную среду настоящего изобретения, могут быть использованы для коррекции врожденных патологий и устранения физических дефектов. Кроме того, композиции в форме препаратов для инъекций или гидрогелей могут быть использованы для разглаживания морщин и складок у бровей, устранения рубцов и других повреждений кожи. В другом варианте осуществления изобретения кондиционированная клеточная среда может быть также добавлена в тени для век, румяна, компактные пудры или в другие косметические препараты.
В еще одном варианте осуществления изобретения композиции, содержащие кондиционированную клеточную среду настоящего изобретения, могут быть использованы в качестве пищевых добавок или диетических добавок. Указанная кондиционированная среда содержит множество питательных веществ, включая незаменимые аминокислоты, витамины и минералы. Кондиционированная среда настоящего изобретения может быть, например, концентрирована и/или лиофилизована, а предпочтительно введена в капсулы или таблетки для проглатывания. Кроме того, указанные композиции могут быть также добавлены непосредственно в пищу для увеличения в ней питательных веществ.
В еще одном варианте осуществления изобретения указанные композиции могут быть использованы в качестве добавки в корм животных так, чтобы он содержал различные белки, витамины, антибиотики, полисахариды и другие факторы, благоприятно влияющие на рост крупного рогатого скота и других жвачных животных.
Еще в одном варианте осуществления изобретения композиции настоящего изобретения могут быть использованы для культивирования клеток. Кондиционированные клеточные среды настоящего изобретения содержат факторы, благоприятствующие прикреплению и росту клеток. Кроме того, клеточная среда может быть кондиционирована клетками, которые были трансформированы методами генной инженерии и которые могут, например, содержать повышенные концентрации фибронектина или коллагена, стимулирующие прикрепление клеток к каркасу или к поверхности культуры.
В еще одном варианте осуществлении изобретения композиции кондиционированной клеточной среды используются в фармацевтических целях. Настоящее изобретение относится к клеточным средам, культивируемым с трехмерными тканевыми конструкциями так, чтобы факторы роста и другие белки секретировались в данной среде в соотношениях, близких к наблюдаемым in vivo. Поэтому кондиционированные среды настоящего изобретения являются подходящими для различных фармацевтических применений.
И, наконец, композиции настоящего изобретения могут быть изготовлены в виде препаратов местного применения для стимуляции роста волос.
3.1. Определения
Используемые в настоящем описании термины имеют следующие значения:
Адгезивный слой: клетки, прикрепленные непосредственно к трехмерному носителю или связанные опосредованно путем прикрепления к клеткам, которые сами непосредственно прикреплены к носителю.
Кондиционированная среда: композиция, содержащая внеклеточный(е) белок(ки) и клеточные метаболиты, которые ранее поддерживали рост нужных эукариотических клеток любого типа, где указанные клетки были культивированы либо в двух-, либо в трехмерной среде. Эта среда иногда также называется "кондиционированной клеточной средой" или "кондиционированной средой для культивирования клеток или тканей".
Стромальные клетки: фибробласты вместе с другими клетками и/или элементами или без них, обнаруживаемые в рыхлой соединительной ткани, включая, но не ограничиваясь ими, эндотелиальные клетки, перициты, макрофаги, моноциты, клетки плазмы, тучные клетки, адипоциты, мезенхимные стволовые клетки, резервные клетки печени, нервные стволовые клетки, панкреатические стволовые клетки, хондроциты, прехондроциты и т.п.
Тканеспецифические или паренхимные клетки: клетки, которые образуют основную и отличительную ткань органа, отличающуюся от ее каркаса-носителя.
Трехмерный носитель: трехмерный каркас, состоящий из любого материала и/или имеющий любую форму, которая (а) позволяет клеткам прикрепляться к нему (либо он может быть модифицирован так, чтобы клетки могли прикрепляться к нему); и (b) способствует росту клеток более чем в одном слое. Этот носитель инокулирован стромальными клетками с образованием живой трехмерной стромальной ткани. Структура такого каркаса может быть типа сита, губки или она может быть образована из гидрогеля.
Трехмерная стромальная ткань или "живой" стромальный матрикс: трехмерный каркас, который был инокулирован стромальными клетками, выращенными на носителе. Белки внеклеточного матрикса, вырабатываемые стромальными клетками, осаждаются на указанном носителе, образуя, тем самым, "живую" стромальную ткань. Указанная живая стромальная ткань может поддерживать рост тканеспецифических клеток, которые затем инокулируют с образованием трехмерной клеточной культуры.
Тканеспецифическая трехмерная клеточная культура или тканеспецифическая трехмерная конструкция: трехмерная "живая" стромальная ткань, которая была инокулирована тканеспецифическими клетками и культивирована. В основном, тканеспецифическими клетками, используемыми для инокуляции трехмерного стромального матрикса, являются "стволовые" клетки (или "резервные" клетки) для данной ткани, то есть клетки, генерирующие новые клетки, которые при их созревании становятся "специализированными" клетками, образующими паренхиму ткани.
Нижеуказанные сокращения имеют следующие значения:
BCS = телячья сыворотка
BFU-E = эритроидная "взрывообразующая" единица
TGF-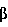 = трансформирующий фактор роста = трансформирующий фактор роста 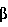
CFU-C (КОЕ-К) = колониеобразующая единица в культуре
CFU-GEMM (КОЕ-ГЭММ) = колониеобразующая единица гранулоцитов, эритроцитов, моноцитов, мегакариоцитов
CSF (КСФ) = колониестимулирующий фактор
DMEM = модифицированная по методу Дульбекко среда Игла
EDTA = этилендиамин-тетрауксусная кислота
FBS = фетальная телячя сыворотка
FGF (ФРФ) = фактор роста фибробластов
GAG = гликозаминогликан
GM-CSF = гранулоцитарный/макрофагальный колониестимулирующий фактор
HBSS = сбалансированный солевой раствор Хэнкса
HS = лошадиная сыворотка
IGF (ИПФ) = инсулиноподобный фактор
LTBMC = долгоживущая культура клеток костного мозга
MEM = минимальная поддерживающая среда
PBL (ЛПК) = лейкоциты периферической крови
PBS = забуференный фосфатом физиологический раствор
PDGF (ТФР) = тромбоцит-производный фактор роста
RPMI 1640 = среда под номером 1640, разработанная Roswell Park Memorial Institute (GIBCO, Inc., Grand Island, N.Y.)
SEM - сканирующий электронный микроскоп
VEGF = сосудистый эндотелиальный фактор роста.
4. Описание графического материала
На фиг.1 представлен график, описывающий кинетику отложения гликозаминогликанов и коллагена, осаждаемых в зависимости от времени продуктами трехмерной ткани Transcyte и Dermagraft®. Объем отложения гликозаминогликанов зависит от периода роста, тогда как отложение коллагена не зависит от периода роста. и Dermagraft®. Объем отложения гликозаминогликанов зависит от периода роста, тогда как отложение коллагена не зависит от периода роста.
На фиг.2 представлен график влияния внеклеточного матрикса (удаленного из Transcyte ) и добавленного при разведении 1:2, 1:5, 1:10 и 1:100 к монослойным культурам человеческих фибробластов и кератиноцитов. Наиболее значимый эффект проиллюстрирован при разведении матрикса в отношении 1:10. ) и добавленного при разведении 1:2, 1:5, 1:10 и 1:100 к монослойным культурам человеческих фибробластов и кератиноцитов. Наиболее значимый эффект проиллюстрирован при разведении матрикса в отношении 1:10.
На фиг.3 представлен график относительной пролиферации человеческих фибробластов и кератиноцитов, экспонированных кондиционированной средой (клеточная культуральная среда, на которой были предварительно выращены клетки в Transcyte ). Усиление клеточного ответа наблюдалось минимум через три дня. ). Усиление клеточного ответа наблюдалось минимум через три дня.
На фиг.4 представлен график влияния кондиционированной среды 1х (среда для культивирования клеток, которая ранее поддерживала рост клеток в Transcyte ) на отложение коллагена из клеток, культивированных в трех измерениях по сравнению с основной средой DMEM (содержащей среду, дополненную 10% BCS и содержащую 2 мМ L-глутамина и 1х антибиотик/противогрибковый агент), в которую была добавлена бессывороточная среда и основная среда с конечной концентрацией 1х. Отложение коллагена в культурах, обработанных кондиционированной средой в течение 10 дней, возрастало почти на 50% по сравнению с каждым контролем со статистической значимостью (р=0,05). ) на отложение коллагена из клеток, культивированных в трех измерениях по сравнению с основной средой DMEM (содержащей среду, дополненную 10% BCS и содержащую 2 мМ L-глутамина и 1х антибиотик/противогрибковый агент), в которую была добавлена бессывороточная среда и основная среда с конечной концентрацией 1х. Отложение коллагена в культурах, обработанных кондиционированной средой в течение 10 дней, возрастало почти на 50% по сравнению с каждым контролем со статистической значимостью (р=0,05).
На фиг.5 представлен график противоокислительной активности в кондиционированной клеточной среде (среда для культивирования клеток, которая ранее поддерживала рост клеток в Transcyte ) по отношению к эпидермальным кератиноцитам человека в культуре. При экспонировании кератиноцитов человека кондиционированной средой, которая ранее поддерживала рост клеток в Transcyte ) по отношению к эпидермальным кератиноцитам человека в культуре. При экспонировании кератиноцитов человека кондиционированной средой, которая ранее поддерживала рост клеток в Transcyte , в течение трех дней, было отмечено, что внутриклеточное окисление снижалось почти на 50% со статистической значимостью (р<0,0003). , в течение трех дней, было отмечено, что внутриклеточное окисление снижалось почти на 50% со статистической значимостью (р<0,0003).
5. Подробное описание изобретения
Настоящее изобретение относится к новым композициям, содержащим любую кондиционированную определенную или неопределенную среду, культивированную с использованием эукариотических клеток любого типа или трехмерной тканевой конструкции, и к способам применения указанных композиций. Указанные клетки культивируют в монослое, на гранулах (то есть в двухмерной среде) или, предпочтительно, в трехмерной среде. Указанные клетки, предпочтительно, представляют собой клетки человека для снижения риска возникновения иммунного ответа, и такими клетками являются стромальные клетки, паренхимные клетки, мезенхимные стволовые клетки, резервные клетки печени, стволовые нервные клетки, панкреатические стволовые клетки и/или эмбриональные стволовые клетки. Среда, кондиционирования клеточной и тканевой культурами, будет содержать различные естественным образом секретированные белки, такие как биологически активные факторы роста, а среды, культивированные в трех измерениях, будут содержать эти белки в соотношениях, приближающихся к физиологическим уровням. Настоящее изобретение также относится к новым композициям, содержащим конкретные продукты белков, происходящих от кондиционированной клетками среды настоящего изобретения, и к использованию этих композиций.
"Предварительно кондиционированная" клеточная культуральная среда для культивирования клеток может быть любой средой для культивирования клеток, которая адекватно соответствует потребностям культивируемых клеток в питательных элементах. Примерами таких сред являются, но не ограничиваются ими, модифицированная по методу Дульбекко среда Игла (DMEM), среда Хэма F12, RPMI 1640, среда Исков, среда Маккой и другие композиции сред, известные специалистам, включая среды, описанные в работах Methods For Preparation of Media, Supplements and Substrate For Serum-Free Animal Cell Culture Alan R.Liss, New York (1984) и Cell & Tissue Culture: Laboratory Procedures, John Wiley & Sons Ltd., Chichester, England 1996, которые во всей своей полноте вводятся в настоящее описание посредством ссылки. Указанная среда может быть дополнена любыми компонентами, необходимыми для поддержания нужной клеточной или тканевой культуры. Если это необходимо, то дополнительно может быть добавлена сыворотка, такая как бычья сыворотка, которая представляет собой комплексный раствор альбуминов, глобулинов, стимуляторов роста и ингибиторов роста. Такая сыворотка не должна содержать патогенов и должна быть тщательно скринирована на загрязнение микоплазмой, бактериями, грибками и вирусами. Эта сыворотка должна быть также получена, в основном, из Соединенных Штатов и не должна поставляться из стран, в которых местный скот несет агенты-возбудители болезней. Добавление гормонов в среду может быть желательным, а может быть и нежелательным.
Другие ингредиенты, такие как витамины, факторы роста и адгезии, белки и т.п. могут быть выбраны специалистами в соответствии с целями применения. В настоящем изобретении могут быть использованы клетки любого типа, подходящие для получения нужной кондиционированной среды. Для культивирования среды могут быть использованы генетически сконструированные клетки. Такие клетки могут быть модифицированы, например, для экспрессии нужного белка или белков так, чтобы концентрация экспрессированного белка или белков в данной среде была оптимизирована для конкретной цели применения. В соответствии с настоящим изобретением клетки и тканевые культуры, используемые для кондиционирования среды, могут быть сконструированы так, чтобы они экспрессировали нужный генный продукт, который может быть наделен широким рядом функций, включая, но не ограничиваясь ими, повышенную способность экспрессировать белки, имеющие аналогичные физиологические реакции и повышенную экспрессию конкретного белка, подходящего для конкретного применения, такого как белок, способствующий заживлению раны, или белок, ингибирующий некоторые другие белки, такие как протеаза, молочная кислота и т.п.
Указанные клетки могут быть сконструированы так, чтобы они экспрессировали нужный генный продукт, который является биологически активным и обладает выбранной биологической функцией, который действует как репортер для выбранного физиологического состояния, который усиливает недостаточную или дефектную экспрессию генного продукта или который обладает антивирусной, антибактериальной или противораковой активностью. В соответствии с настоящим изобретением целевым генным продуктом может быть пептид или белок, такой как фермент, гормон, цитокин, антиген или антитело, регуляторный белок, такой как транскрипционный фактор или ДНК-связывающий белок, структурный белок, такой как белок клеточной поверхности, либо таким целевым генным продуктом может быть нуклеиновая кислота, такая как рибосома или антисмысловая молекула. Указанными целевыми генными продуктами являются, но не ограничиваются ими, генные продукты, стимулирующие рост клеток. Так, например, генетическая модификация может обеспечивать позитивную регуляцию содержания эндогенных белков, введение нового белка или регуляцию концентрации ионов путем гетерологичной экспрессии ионных каналов или изменения функции эндогенных ионов. В качестве примеров могут служить, но не ограничиваются ими, сконструированные ткани, которые экспрессируют генные продукты для системной доставки (например, секретированные генные продукты, такие как белки, включая факторы роста, гормоны, фактор VIII, фактор IX, нейромедиаторы и энкафалины).
В соответствии с настоящим изобретением предпочтительно, чтобы указанные клетки были культивированы на трехмерном стромальном носителе и выращены в множественных слоях, образующих клеточный матрикс. Эта матриксная система в более высокой степени приближается к физиологическим условиям, наблюдаемым in vivo, чем ранее описанные монослойные системы тканевых культур. Трехмерные культуры, такие как Dermagraft® (Advanced Tissue Science, Inc., La Jolla, CA), и Transcyte (Smith & Nephew, PLC, United Kingdom), продуцируют множество факторов роста и других белков, которые секретируются в среду в физиологических отношениях и концентрациях. Dermagraft® состоит из аллогенных неонатальных фибробластов, культивированных на биологически разлагаемом полиглицине. Transcyte (Smith & Nephew, PLC, United Kingdom), продуцируют множество факторов роста и других белков, которые секретируются в среду в физиологических отношениях и концентрациях. Dermagraft® состоит из аллогенных неонатальных фибробластов, культивированных на биологически разлагаемом полиглицине. Transcyte представляет собой временной (промежуточный) заменитель "живой" кожи, состоящий из трехмерной стромальной ткани, связанной с временным покрытием, как описано в патенте США 5460939. Кроме того, трехмерные тканевые культуры, которые кондиционируют клеточную среду, могут содержать мезенхимные стволовые клетки, резервные клетки печени, нервные стволовые клетки, панкреатические стволовые клетки, и/или эмбриональные стволовые клетки, и/или паренхимные клетки, и/или паренхимные стволовые клетки, обнаруживаемые в тканях многих типов, включая, но не ограничиваясь ими, ткани костного мозга, кожи, печени, поджелудочной железы, почек, надпочечника и нервной ткани, а также ткани желудочно-кишечного тракта и мочеполовых путей. См. патенты США №№4721096, 4963489, 5032508, 5266480, 5160490 и 5559022, каждый из которых во всей своей полноте вводится в настоящее описание посредством ссылки. представляет собой временной (промежуточный) заменитель "живой" кожи, состоящий из трехмерной стромальной ткани, связанной с временным покрытием, как описано в патенте США 5460939. Кроме того, трехмерные тканевые культуры, которые кондиционируют клеточную среду, могут содержать мезенхимные стволовые клетки, резервные клетки печени, нервные стволовые клетки, панкреатические стволовые клетки, и/или эмбриональные стволовые клетки, и/или паренхимные клетки, и/или паренхимные стволовые клетки, обнаруживаемые в тканях многих типов, включая, но не ограничиваясь ими, ткани костного мозга, кожи, печени, поджелудочной железы, почек, надпочечника и нервной ткани, а также ткани желудочно-кишечного тракта и мочеполовых путей. См. патенты США №№4721096, 4963489, 5032508, 5266480, 5160490 и 5559022, каждый из которых во всей своей полноте вводится в настоящее описание посредством ссылки.
5.1. Клеточные среды
Композиции клеточных культуральных сред описаны в литературе и многие из них являются коммерчески доступными.
Ингредиентами предварительно кондиционированной среды являются, но не ограничиваются ими, ингредиенты, описанные ниже. Кроме того, концентрации этих ингредиентов хорошо известны каждому специалисту. См. например, Methods For Preparation of Media, Supplements and Substrate for Serum-free Animal Cell Culture, как указано выше. Указанными ингредиентами являются аминокислоты (D- и/или L-аминокислоты), такие как глутамин, аланин, аргинин, аспарагин, цистеин, глутаминовая кислота, глицин, гистидин, изолейцин, лейцин, лизин, метионин, фенилаланин, пролин, серин, треонин, триптофан, тирозин, валин и их производные; подгруппы растворимых кислот, таких как тиамин, аскорбиновая кислота, соединения железа(3), соединения железа(2), пурины, глутатион и одноосновные фосфаты натрия.
Другими ингредиентами являются сахара, дезоксирибоза, рибоза, нуклеозиды, водорастворимые витамины, рибофлавин, соли, металлы в следовых количествах, липиды, соли уксусной кислоты, соли фосфорной кислоты, HEPES, феноловый красный, соли пировиноградной кислоты и буферы.
Другими ингредиентами, часто используемыми в композициях сред, являются жирорастворимые витамины (включая A, D, Е и К), стероиды и их производные, холестерин, жирные кислоты и липиды, твин 80, 2-меркаптоэтанолпирамидины, а также ряд добавок, включая сыворотку (фетальную, лошадиную, телячью и т.п.), белки (инсулин, трансферрин, факторы роста, гормоны и т.п.), антибиотики (гентамицин, пенициллин, стрептамицин, амфотерицин В и т.п.), ультафильтрат цельного яйца и факторы адгезии (фибро-нектины, витронектины, коллагены, ламенины, тенасцины и т.п.).
Само собой разумеется, что в указанные среды могут или нет быть добавлены факторы роста и другие белки, такие как факторы адгезии, поскольку многие из этих клеточных конструкций, а, в частности, трехмерные конструкции клеточных и тканевых культур, описанные в настоящей заявке, сами вырабатывают такие факторы роста и факторы адгезии и другие белки, секретируемые в среды, описанные более подробно ниже, см. Раздел 5.8.
5.2. Клеточные культуры
5.2.1. Клетки
Данная среда может быть кондиционирована стромальными клетками, паренхимными клетками, мезенхимными стволовыми клетками (клетками, коммитированными или некоммитированными в отношении направления дифференцировки), резервными клетками печени, стволовыми нервными клетками, стволовыми клетками поджелудочной железы и/или эмбриональными стволовыми клетками. Такими клетками, среди прочих, являются, но не ограничиваются ими, клетки костного мозга, кожи, печени, поджелудочной железы, почек, нервной ткани, надпочечника, эпителия слизистой и гладких мышц. Фибробласты и подобные фибробластам клетки и другие клетки и/или элементы клеток, которые составляют строму, могут происходить от плода или зрелого организма и могут быть получены из соответствующих источников, таких как кожа, печень, поджелудочная железа, слизистая оболочка, артерии, вены, пупочный канатик и плацентарные ткани и т.п. Такие ткани и/или органы могут быть получены путем соответствующей биопсии или после аутопсии. Действительно, органы трупов могут быть использованы в качестве крупных источников стромальных клеток и элементов.
Эмбриональные стволовые клетки и/или другие элементы, которые составляют строму, могут быть выделены известными методами. Так, например, популяции человеческих эмбриональных стволовых клеток и методы их выделения и использования были недавно описаны Keller et al., Nature Med., 5:151-152 (1999), Smith Curr. Biol. 8:R802-804 (1998); выделенные первичные половые клетки были описаны Shamblatt et al., PNAS 95:13726-1373 (1998), клетки, выделенные из бластоцитов были описаны Thomason et al. Science 282:1145-1147 (1988). Методы выделения и культивирования мезенхимных стволовых клеток известны специалистам. См., Mackay et al. Tissue Eng. 4:415-428 (1988); William et al, Am.Surg. 65:22-26 (1999). Инокуляция этих клеток описана ниже, см. Раздел 5.3. Аналогичным образом стволовые клетки нервной ткани могут быть выделены способом, описанным Flax et al., Nature Biotechnol., 16:1033-1039 (1998); и Frisen et al., Cell. Mol. Life Sci., 54:935-945 (1998).
Эти клетки могут быть культивированы любым известным способом, например, в монослое, на гранулах или в трехмерном слое и любым другим способом (т.е. в чашках для культивирования, в роллер-флаконах, в системах с непрерывным потоком и т.п.). Методы культивирования клеток и тканей хорошо известны специалистам и описаны, например, в Cell & Tissue Culture: Laboratory Procedures, см.выше; Freshney (1987), Culture of Animal Cells: A Manual of Basic Techniques, cm. ниже.
В основном, используемые клеточные линии тщательно скринируют на патогены человека и животных. В зависимости от применения такой скрининг может иметь решающее значение, в том случае, когда пригодными являются лишь клетки, не содержащие патогенов (например, для лечения ран, для пищевых добавок и т.п.). Методы скрининга на патогены хорошо известны специалистам. Клетки такого типа, независимо от того, культивированы они в двух или в трех измерениях, будут оказывать влияние на свойства данной кондиционированной среды. Предпочтительной является трехмерная конструкция.
5.2.2. Трехмерные клеточные культуры
Стромальными клетками, используемыми в указанных трехмерных культурах, являются фибробласты, мезенхимные стволовые клетки, резервные клетки печени, нервные стволовые клетки, панкреатические стволовые клетки и/или эмбриональные стволовые клетки вместе с дополнительными клетками и/или элементами, описанными более подробно в данном описании, или без них.
Фибробласты будут поддерживать рост множества различных клеток и тканей в указанной трехмерной системе культивирования, и следовательно, они могут быть инокулированы в матрицу с образованием "общей" стромальной матрицы-основы для культивирования клеток и тканей любых типов. Однако в некоторых случаях может оказаться предпочтительным использование "специфической", а не "общей" стромальной матрицы-основы, и в данном случае стромальные клетки и элементы могут быть получены из конкретной ткани, органа или индивидуума. Кроме того, фибробласты и другие стромальные клетки и/или элементы могут быть получены из клеток того же типа, культивированных в указанной трехмерной системе. Это может быть предпочтительным при культивировании тканей, в которых "специализированные" стромальные клетки могут играть конкретную структурную/функциональную роль; например, клетки гладкой мышцы артерии, глиальные клетки нервной ткани, клетки печени Купфера и т.п.
При инокуляции на трехмерный носитель стромальные клетки будут пролиферировать на данном каркасе и выделять белки соединительной ткани, обычно секретируемые этими стромальными клетками, такие как факторы роста, регуляторные факторы и белки внеклеточного матрикса. Эти стромальные клетки и их естественнно секретируемые белки соединительной ткани, в основном, создают каркас, образуя таким образом живую стромальную ткань, которая будет поддерживать рост тканеспецифических клеток, инокулированных в данной трехмерной культуральной системе настоящего изобретения. Действительно, при инокуляции тканеспецифическими клетками данная трехмерная стромальная ткань будет поддерживать активную пролиферацию культуры в течение длительного промежутка времени. Это является очень важным фактором, поскольку поры в ситах позволяют стромальным клеткам проникать в культуру, не подвергая конфлюэнтные стромальные культуры контактному ингибированию, и стромальные клетки продолжают расти, делиться и при этом остаются функционально активными.
Факторы роста и регуляции вырабатываются стромальной тканью и секретируются в данную среду. Факторы роста (которыми являются, но не ограничиваются ими, 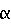 FGF, FGF, 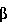 FGF, инсулиновый фактор роста или TGF-бета), либо природные или модифицированные продукты крови или другие биологически активные молекулы (которыми являются, но не ограничиваются ими, гиалуроновая кислота или гормоны) усиливают колонизацию на трехмерной матрице или каркасе и кондиционирование куль-туральной среды. FGF, инсулиновый фактор роста или TGF-бета), либо природные или модифицированные продукты крови или другие биологически активные молекулы (которыми являются, но не ограничиваются ими, гиалуроновая кислота или гормоны) усиливают колонизацию на трехмерной матрице или каркасе и кондиционирование куль-туральной среды.
Степень, с которой растут эти стромальные клетки перед использованием культур in vivo, может варьироваться в зависимости от типа ткани, культивируемой в трехмерной тканевой культуре. Живые стромальные ткани, которые кондиционируют среду, могут быть использованы в качестве корректирующих структур путем их имплантации in vivo. Эти стромальные клетки могут быть генетически модифицированы с доведением количества белковых продуктов, секретированных в культуральную среду, до такого уровня, при котором увеличивается концентрация выделенного продукта, полученного из кондиционированной среды. Таким продуктом являются противоспалительные факторы, например, антитело против GM-CSF, антитело против TNF, антитело против IL-1, IL-2 и т.п. Альтернативно, стромальные клетки могут быть генетически модифицированы для "нокаут"-экспрессии продуктов нативного гена, которые стимулируют воспаление, например, GM-CSF, TNF, IL-1, IL-2, или "нокаут"-экспрессии МНС для снижения риска отторжения.
Рост стромальных клеток в трех измерениях будет поддерживать активную пролиферацию как стромальных, так и тканеспецифических клеток в культуре в течение значительно более продолжительного времени, чем в монослойных системах. Более того, трехмерная система обеспечивает созревание, дифференцировку и сегрегацию клеток в культуре in vitro с образованием компонентов зрелых тканей, аналогичных аналогам, обнаруживаемым in vivo, и сохранение белков в кондиционированной среде в соотношениях, более близких к физиологическим отношениям.
Хотя заявители не должны или не обязаны объяснять механизм, посредством которого действует трехмерная клеточная и тканевая система, однако, успешному функционированию трехмерной культуральной системы способствуют ряд присущих ей следующих факторов:
(a) трехмерный каркас обеспечивает большую площадь поверхности для прикрепления белков, а следовательно, для адгезии стромальных клеток; и
(b) вследствие трехмерности каркаса стромальные клетки продолжают активный рост, в противоположность клеткам в монослойных культурах, которые растут до конфлюентности, испытывают контактное ингибирование и прекращают рост и деление. Продуцирование факторов роста и регуляторных факторов благодаря репликации стромальных клеток может быть частично ответственно за стимуляцию пролиферации и регуляцию дифференцировки клеток в культуре;
(c) этот трехмерный каркас позволяет осуществлять пространственное распределение клеточных элементов, которые являются более схожими с элементами, обнаруживаемыми в ткани-аналоге in vivo;
(d) увеличение потенциального объема роста для клеток в трехмерной системе может способствовать созданию локального микроокружения, стимулирующего созревание клеток;
(e) трехмерный каркас максимизирует межклеточное взаимодействие благодаря тому, что он дает больше возможностей для перемещения мигрирующих клеток, таких как макрофаги, моноциты и, возможно, лимфоциты в адгезивном слое;
(f) было установлено, что поддержание фенотипа дифференцированных клеток требует не только присутствия факторов роста/дифференцировки, но также и соответствующих клеточных взаимодействий. Настоящее изобретение позволяет эффективно воссоздавать микроокружение тканей, что приводит к образованию превосходной кондиционированной среды.
5.3. Создание трехмерной стромальной ткани
Трехмерный носитель или каркас может представлять собой любой материал и/или иметь любую форму, которые (а) позволяют клеткам прикрепляться к нему (либо он может быть модифицирован так, чтобы клетки прикреплялись к нему); и (b) позволяют клеткам расти более чем в одном слое. Для создания каркаса может быть использован ряд различных материалов, включая, но не ограничиваясь ими: биологически неразлагаемые материалы, например, найлон (полиамиды), дакрон (полиэфиры), полистирол, полипропилен, полиакрилаты, поливиниловые соединения (например, поливинилхлорид), поликарбонат (PVC), политетрафторэтилен (PTFE; тефлон), терманокс (ТРХ), нитроцеллюлоза, хлопок; и биологически разлагаемые материалы, например, полигликолевая кислота (PGA), коллаген, коллагеновые губки, кетгутовый материал для швов, целлюлоза, желатин, декстран, полиалканоаты и т.п. Любой из этих материалов может быть тканным, сплетенным, связанным и т.п. с получением сита, например, с образованием трехмерного каркаса. Этому каркасу может быть, в свою очередь, придана любая необходимая форма в качестве корректирующей структуры, например, форма трубок, шнуров, нитей и т.п. Некоторые материалы, такие как найлон, полистирол и т.п., являются плохими субстратами для прикрепления клеток. При использовании этих материалов в качестве трехмерного каркаса указанный каркас желательно предварительно обработать перед инокуляцией стромальных клеток в целях стимуляции прикрепления стромальных клеток к носителю. Так, например, перед инокуляцией стромальными клетками, найлоновые каркасы могут быть обработаны 0,1 М уксусной кислотой и инкубированы в полилизине, FBS, и/или в коллагене для покрытия ими найлона. Полистирол может быть аналогичным образом обработан с использованием серной кислоты.
При трансплантации in vivo культур, кондиционирующих среду, может оказаться предпочтительным использовать биологически разлагаемые матрицы, например, такие как полигликолевая кислота, коллаген, коллагеновые губки, тканный коллаген, материал для кетгутового шва, желатин, полимолочная кислота или полигликолевая кислота и их сополимеры. При поддерживании этих культур в течение длительных промежутков времени или при криоконсервации предпочтительными могут быть неразлагаемые материалы, такие как найлон, дакрон, полистирол, полиакрилаты, поливинилы, тефлоны, хлопок и т.п. Подходящим найлоновым ситом, которое может быть использовано в соответствии с настоящим изобретением, является нитекс (Nitex), найлоновый фильтр, имеющий средний размер пор 210 мкм и средний диаметр найлонового волокна 90 мкм (#3-210/36, Tetko, Inc., N.Y.).
Стромальные клетки, включая фибробласты, мезенхимные стволовые клетки, резервные клетки печени, нервные стволовые клетки, панкреатические стволовые клетки и/или эмбриональные стволовые клетки, вместе с дополнительными клетками и/или элементами, описанными ниже, или без них, инокулируют в каркас. Кроме того, клетки, обнаруживаемые в рыхлой соединительной ткани, могут быть инокулированы на трехмерный носитель вместе с фибробластами. Такими клетками являются, но не ограничиваются ими, клетки гладких мышц, эндотелиальные клетки, перициты, макрофаги, моноциты, клетки плазмы, тучные клетки, адипоциты и т.п. Как объяснялось ранее, фетальные фибробласты могут быть использованы для образования "общей" трехмерной стромальной матрицы, которая будет поддерживать рост различных клеток и/или тканей. Однако "специфическая" стромальная ткань может быть получена путем инокуляции трехмерного каркаса фибробластами, происходящими от культивируемой ткани того же типа и/или от конкретного индивидуума, которому позднее вводят эти клетки и/или ткани, выращенные в культуре в соответствии с трехмерной системой настоящего изобретения.
Таким образом, в одном из вариантов осуществления изобретения могут быть культивированы стромальные клетки, которые являются "специализированными" клетками для конкретной ткани. Так, например, стромальные клетки гемопоэтической ткани, включая, но не ограничиваясь ими, фибробласты, эндотелиальные клетки, макрофаги/моноциты, адипоциты и ретикулярные клетки, могут быть использованы для образования трехмерной субконфлюэнтной стромы для долгоживущей культуры костного мозга in vivo. Гемопоэтические стромальные клетки могут быть легко получены из "лейкоцитной пленки", образуемой в суспензии костного мозга путем центрифугирования при низкой центробежной силе, например при 3000 × g. В данном стромальном слое, который образует внутреннюю стенку артерии, могут быть добавлены большие количества недифференцированных клеток гладкой мышцы для получения эластичного белка. Стромальными клетками печени могут быть фибробласты, клетки Купфера и эндотелиальные клетки сосудов и желчных протоков. Аналогичным образом, в качестве стромы для поддержания пролиферации нервных клеток и тканей могут быть использованы глиальные клетки; причем глиальные клетки для этих целей могут быть получены путем трипсинизации или расщепления коллагеназой головного мозга эмбриона или взрослого индивидуума (Ponten & Westermark, 1980, in Federof, S.Hertz, L., eds, "Advances in Cellular Neurobiology, "Vol.1, New York, Academic Press, pp.209-227). Рост клеток в трехмерной стромальной клеточной культуре может быть дополнительно усилен путем добавления белков в данный каркас или путем покрытия носителя данными белками (например коллагенами, эластичными волокнами, ретикулярными волокнами), гликопротеинами, гликозаминогликанами (например гепаринсульфатом, хондроитин-4-сульфатом, хондроитин-6-сульфатом, дерматансульфатом, кератинсульфатом и т.п.), клеточным матриксом и/или другими материалами.
Кроме того, мезенхимные стволовые клетки (клетки, коммитированные или некоммитированные в отношении направления дифференцировки), являются преимущественными "стромальными" клетками для инокуляции в данный каркас. Эти клетки могут дифференцироваться в остеоциты, фибробласты сухожилий и связок, стромальные клетки костного мозга, адипоциты и другие клетки соединительной ткани, и хондроциты, в зависимости от времени, после добавления эндогенных или дополнительных факторов роста и регуляторных факторов, и других факторов, включая простагландины, интерлейкины и природные халоны, регулирующие пролиферацию и/или дифференцировку.
Фибробласты могут быть легко выделены путем дезагрегации соответствующего органа или ткани, который служит источником фибробластов. Это может быть легко осуществлено методами, известными специалистам. Так, например, данная ткань или орган могут быть дезинтегрированы механически и/или обработаны расщепляющими ферментами и/или хелатообразующими агентами, которые ослабляют связи между соседними клетками, что дает возможность диспергировать данную ткань в суспензию отдельных клеток без значительного разрушения клетки. Ферментативная диссоциация может быть осуществлена путем измельчения ткани и обработки указанной измельченной ткани любыми из ряда расщепляющих ферментов, взятых либо отдельно, либо в комбинации. Такими ферментами являются, но не ограничиваются ими, трипсин, хемотрипсин, коллагеназа, эластаза и/или гиалуронидаза, ДНКаза, проназа, диспаза и т.п. Механическое разрушение может быть также осуществлено рядом способов, включая, но не ограничиваясь ими, использование дезинтеграторов, смесителей, сит, гомогенизаторов, ячеек под давлением или ультразвуковых устройств и т.п. Обзор некоторых способов дезагрегации тканей см. Freshney, Culture of Animal Cells: A Manual of Basic Technique, 2d Ed., A.R. Liss, Inc. New York, 1987, Ch.9, pp.107-126.
После измельчения отдельных клеток с образованием суспензии эта суспензия может быть фракционирована с получением субпопуляций клеток, из которых могут быть получены фибробласты и/или другие стромальные клетки и/или элементы. Это может быть также осуществлено с использованием стандартной техники для разделения клеток, включая, но не ограничиваясь ими, клонирование и отбор клеток определенного типа, селективную деструкцию нежелательных клеток (негативный отбор), разделение на основе отличающихся агглютинирующих свойств клеток в смешанной популяции, процедуры замораживания-оттаивания, разделение на основе различных адгезивных свойств клеток в смешанной популяции, фильтрацию, стандартное и зональное центрифугирование, элютриационное центрифугирование (проточное центрифугирование), гравитационное разделение, противоточное распределение, электрофорез и сортинг флуоресцентно-активированных клеток. Обзор методов клонального отбора и разделения клеток см. Freshney, Culture of Animal Cells: A Manual of Basic Technique, 2d Ed., A.R. Liss, Inc. New York, 1987, Ch.ll and 12, pp.137-168.
Выделение фибробластов может быть, например, осуществлено следующим образом: свежие образцы ткани тщательно промывают и измельчают в сбалансированном растворе Хэнкса (HBSS) для удаления сыворотки. Измельченную ткань инкубируют 1-12 часов в свежеприготовленном растворе диссоциирующего фермента, такого как трипсин. После такого инкубирования диссоциированные клетки суспендируют, осаждают путем центрифугирования и высевают на чашки для культивирования. Все фибробласты прикрепляются раньше других клеток, а поэтому соответствующие стромальные клетки могут быть селективно выделены и выращены. Затем выделенные фибробласты могут быть культивированы до конфлюэнтности, перенесены из конфлюэнтной среды и инокулированы в трехмерный матрикс (см., Naughton et al., 1987, J.Med. 18 (3 and 4) 219-250). Инокуляция трехмерного каркаса высоконцентрированными стромальными клетками, например, приблизительно 106-5×106 клеток/мл, приводит к созданию трехмерной стромальной ткани за более короткие промежутки времени.
После инокуляции стромальных клеток трехмерный каркас должен быть инкубирован в подходящей питательной среде. Как упоминалось ранее, подходящими для использования могут быть многие коммерчески доступные среды, такие как RPMI 1640, среда Фишера, среда Исков, среда Маккой и т.п. Важно отметить, что трехмерные стромальные клеточные культуры могут быть суспендированы или флотированы в данной среде в процессе инкубирования для максимизации пролиферирующей активности. Эту культуру периодически "подпитывают", а кондиционированные среды настоящего изобретения выделяют и обрабатывают, как описано ниже в разделах 5.6 и 5.7. Таким образом, в зависимости от культивируемой ткани и от нужного типа коллагена соответствующие стромальные клетки могут быть отобраны для инокуляции трехмерного матрикса.
В процессе инкубирования трехмерных стромальных клеточных культур пролиферирующие клетки могут высвобождаться из данного матрикса. Эти высвобожденные клетки могут прилипать к стенкам сосуда для культивирования, где их пролиферация может продолжаться с образованием конфлюэнтного монослоя. Это событие должно быть предотвращено или сведено к минимуму, например, путем удаления высвобожденных клеток в процессе подпитки или путем переноса трехмерной стромальной культуры в новый сосуд для культивирования. Присутствие конфлюентного монослоя в сосуде будет "останавливать" рост клеток в трехмерном матриксе и/или культуре. Удаление конфлюэнтного монослоя или перенос культуры в новый сосуд со свежей средой будет восстанавливать пролиферирующую активность данной трехмерной культуральной системы. Следует отметить, что кондиционированные среды настоящего изобретения обрабатывают, при необходимости, так, чтобы они не содержали каких-либо целых клеток (если, конечно, эти целые клетки не используются для конкретных целей). Такое удаление или перенос должны быть проведены в любом сосуде для культивирования, который имеет стромальный монослой, конфлюэнтность которого превышает 25%. Альтернативно, указанная культуральная система может перемешиваться для предотвращения слипания высвобожденных клеток, либо вместо периодической подпитки культур, данная культуральная система может быть сформирована так, чтобы свежие среды непрерывно проходили через данную систему. Скорость потока может быть скорректирована для максимизации пролиферации в данной трехмерной культуре и для отмывки и удаления клеток, высвобожденных из этой культуры, так, чтобы они не прилипали к стенкам сосуда и не продолжали расти до конфлюэнтности.
Другие клетки, такие как паренхимные клетки, могут быть инокулированы и выращены на трехмерной живой стромальной ткани.
5.4. Инокуляция тканеспецифических клеток в трехмерный стромальный матрикс и поддерживание культур
После того, как трехмерная культура стромальных клеток достигнет соответствующего уровня роста, то дополнительные клетки, такие как тканеспецифические клетки (паренхимные клетки) или клетки поверхностного слоя, желательные для культивирования, могут быть также инокулированы в живую стромальную ткань. Эти клетки культивируют на живой стромальной ткани in vitro с образованием культивированного аналога нативной ткани и кондиционированием среды благодаря высвобождению в эту среду внеклеточных продуктов в отношениях, близких к физиологическим уровням. Высокая концентрация клеток в инокуляте будет преимущественно приводить к усилению пролиферации в культуре гораздо быстрее, чем низкая концентрация. Выбор клеток для инокуляции зависит от культивируемой ткани, которой может быть, но не ограничивается ею, костный мозг, кожа, печень, поджелудочная железа, почки, нервная ткань, надпочечник, эпителий слизистой оболочки и гладкая мышца и т.п. Эти клетки благодаря вырабатыванию в данных средах характерных внеклеточных белков, таких как определенные факторы роста, позволяют получать среды, оптимизированные для данных конкретных тканей.
В качестве неограничивающего примера может служить ряд эпителиальных клеток, которые могут быть культивированы на трехмерной живой стромальной ткани. Примерами таких эпителиальных клеток являются, но не ограничиваются ими, кератиноциты, клетки слизистой оболочки полости рта и клетки желудочно-кишечного тракта (ЖКТ). Такие эпителиальные клетки могут быть выделены ферментативной обработкой ткани известными методами с последующим размножением этих клеток в культуре и нанесением этих эпителиальных клеток на трехмерный матрикс-носитель стромальных клеток. Стромальный носитель обеспечивает присутствие факторов роста и других белков, которые стимулируют нормальное деление и дифференцировку эпителиальных клеток.
В основном, этот инокулят должен включать "стволовую" клетку (также называемую "резервной" клеткой) для этой ткани, то есть такие клетки, которые генерируют новые клетки, которые при созревании становятся специализированньми клетками, формирующими различные компоненты ткани.
Паренхимные клетки или другие клетки поверхностного слоя, используемые в данном инокуляте, могут быть получены из клеточных суспензий, приготовленных путем дезагрегации нужной ткани стандартными методами, описанными выше в Разделе 5.3 для получения стромальных клеток. Для инокуляции трехмерной живой стромальной ткани может быть использована сама суспензия целых клеток. В результате этого регенеративные клетки, содержащиеся в гомогенате, в отличие от не-регенеративных клеток, будут подвергаться пролиферации, созреванию и соответствующей дифференцировке на данной матрице. Альтернативно, клетки конкретного типа могут быть выделены из соответствующих фракций клеточной суспензии стандартными методами, описанными выше в Разделе 5.1 для фракционирования стромальных клеток. Если указанные "стволовые" клетки или "резервные" клетки могут быть легко выделены, то они могут быть использованы для преимущественной инокуляции трехмерного стромального носителя. Так, например, при культивировании костного мозга эта трехмерная строма может быть инокулирована клетками костного мозга, либо свежими клетками, либо клетками, полученными из криоконсервированного образца. При культивировании кожи трехмерная строма может быть инокулирована меланоцитами и кератиноцитами. При культивировании печени трехмерная строма может быть инокулирована гепатоцитами. При культивировании поджелудочной железы трехмерная строма может быть инокулирована эндокринными клетками поджелудочной железы. Обзор методов, которые могут быть использованы для получения паренхимных клеток из различных тканей, см. Freshney, Culture of Animal Cells: A Manual of Basic Technique, 2d Ed., A.R. Liss, Inc. New York, 1987, Ch.20, pp.257-288.
Фактически, различные соотношения коллагена различных типов, осажденного на стромальный матрикс до инокуляции, могут влиять на рост позже инокулированных тканеспецифических клеток. Так, например, для оптимального роста гемопоэтических клеток данный матрикс должен предпочтительно содержать коллаген типа III, IV и I в отношении приблизительно 6:3:1 в исходном матриксе. Для трехмерных систем культивирования клеток кожи в исходном матриксе предпочтительно осаждается коллаген типа I и III. Соотношения осажденных коллагенов различных типов могут быть изменены или увеличены путем отбора фибробластов, которые вырабатывают коллаген соответствующего типа. Это может быть осуществлено с использованием моноклональных антител соответствующего изотипа или подкласса, которые способны активировать комплемент и которые определяют коллаген данного типа. Указанные антитела и комплемент могут быть использованы для негативного отбора фибробластов, экспрессирующих коллаген нужного типа. Альтернативно, стромальные клетки, используемые для инокуляции матрицы, могут представлять собой смесь клеток, синтезирующих коллаген соответствующего типа. Распределение и происхождение коллагенов различных типов показаны в таблице 1.
|