
СПИСОК ПАТЕНТОВ С УПОМИНАНИЕМ ГИАЛУРОНОВОЙ КИСЛОТЫ
-
- 2017751 Способ получения гиалурона
- 2192150 БАД для профилактики йодной недостаточности
- 2112542 Препарат для лечения патологий соединительных тканей
- 2225206 Препарат для лечения рака молочной железы
- 2299733 Лечение опорно-двигательного аппарата
- 2299732 Способ лечения глаукомы
- 2299726 Противоинфекционная губная помада
- 2299725 Косметическое средство для ухода за кожей
- 2198878 Ароматическое соединение
- 2198702 Способ подготовки трофических язв к аутодермапластике
- 2198653 Вагинальные суппозитории
- 2197946 Композиция для ухода за волосами
- 2197923 Фармацевтическая композиция для лечения отеков роговицы
- 2298410 Биотрансплантант и способ лечения ревматических и аутоиммунных заболеваний
- 2197501 Фотоотверженный гель на основе сшитой гиалуроновой кислоты
- 2197228 Твердые лекарственные формы
- 2197222 Водная компазиция для ухода за волосами, лица и тела
- 2297425 Полипептиды
- 2297240 Композиция с гиалуроновой кислотой
- 2297230 Фармацевтическая компазиция с ксантоновой смолой
- 2196588 Глазные капли
- 2195955 Применение биологически активных веществ
- 2195926 Дерматологические композиции
- 2295954 Микрочастицы для доставки нуклеиновых кислот
- 2295951 Косметика для ухода за кожей лица и век
- 2195262 Фармакологическое средство на основе гиалуроновой кислоты
- 2194512 Способ профилактики и коррекции процесса старения кожи
- 2194478 Лечение экземы
- 2294716 Расширяемый стент
- 2194055 Сшитые сополимеры
- 2099350 Ассоциаты депротонированной гиалуроновой кислоты
- 2293557 Средство для лечения кожи и слизистых
- 2292878 Приготовление микроцастиц, содержащих метопропол
- 2292746 БАД
- 2192256 Защита кишечника
- 2191782 Получение модифицированной гиалуроновой кислоты
- 2292219 Паратиреоидный гормон человека
- 2291686 Микроцастицы
- 2191000 Косметическая маска
- 2290921 Фармацевтические и косметические средства против старения кожи
- 2290900 Модифицированный биоматериал для использования в офтальмологии
- 2290899 Получение биоматерьяла
- 2290397 Новые инданилиденовые соединения
- 2290186 Лечение сирингомиелии
- 2288702 Иррингационный раствор для офтальмологии
- 2288699 Гель для лечения стоматологических заболеваний
- 2188011 Активирующая остеогенез фармацевтическая композиция
- 2187327 Средство с антисептиком
- 2187325 Средство с радиопротекторным действием
- 2287330 Композиции миноксидила
- 2186786 Способ получения гиалуроновой кислоты
- 2186593 Лечение раненого процесса кожи
- 2286801 Очищение воды
- 2286781 Лечение ожогов пищевода у детей
- 2286764 Средство лечения воспалений полости рта
- 2185840 Лечение инфекционных заболеваний
- 2286151 Альфа-2-Дельта-Лиганда
- 2185149 Ранозаживляющий гель
- 2285527 Лечение ИЛ-6 заболеваний
- 2184448 Раствор хранения роговицы, включающий гиалуроновую кислоту
- 2090179 Крем для кожи
- 2183961 Способ лечения кожи
- 2284331 Соли алифотических аминов
- 2284187 Производные амида
- 2089191 Снизить внутрение давление
- 2283320 Получение гликозаминогликанов
- 2283129 Лечение опухолей
- 2283098 Косметические средства с Q
- 2182574 Ароматические соединения
- 2088257 Средство с гипохолестеролемическим действием
- 2088218 Состав для гигиенических салфеток
- 2088206 Способ получения препарата, создающего исскуственный загар
- 2282462 Противомикробные средства
- 2182008 Интровагинальная компазиция
- 2181999 Препарат с отсроченным высвобождением
- 2181998 Новые композиции липидов
- 2181995 Лечение болевого синдрома
- 2181295 Вирионная вакцина
- 2087144 Витамин Е
- 2379336 Способ стирки
- 2379052 Вакцинация
- 2180855Композиция в виде ионного комплекса
- 2379025 Противоинфекционный гель
- 2180825 Лечение травм роговицы
- 2281082 Способ коррекции эстетических и возрастных проблем кожи
- 2180576 Биоактивная добавка для косметических средств
- 2280459 Средство для изменения скорости роста или репродукции клеток
- 2179981 Соли переходного металла
- 2378010 Жидкие вакцины
- 2378008 Комбинированные вакцины
- 2378007 Анаболическое средство
- 2377973 Растительные экстракты
- 2280041 Способ получения водорастворимых комплексов гиалурил
- 2280038 Биополимеры
- 2323733 Йодный обмен
- 2377260 Гель
- 2178693 Противовирусное средство на основе гиалуроновой кислоты
- 2178692 Облегчающие зуд косметическое средство
- 2377022 Гемостатические спреи
- 2376982 Увлажняющая сыворотка для лица
- 2376974 Трансдермальный гель для лица
- 2362784 Гипо-и гиперацетилированные менингокковые капсульные сахариды
- 2177789 Устройство для доставки лекарства к шейке матки
- 2277954 Крем для лица омолаживающий
- 2376378 Способ получения метионина
- 2177332 Биоматериал для предотвращения послеоперационных спаек, с производной гиалуроновой кислотой
- 2177310 Способ получения таблеток
- 2376011 Средство для позвоночника
- 2277410 Косметическое средство
- 2323748 Медицинская повязка
- 2276998 Гидрогелевые композиции
- 2082416 Способ получения препарата с коллагенном из животного сырья
- 2375081 Адсорбирующее изделие
- 2375049 Охлаждающий пластырь
- 2346049 Способ получения гиалурона
- 2275913 Фармацевтические средства
- 2174985 Полисахарид с антиоксидантом
- 2373957 Носитель для лекарственных средств и биологически активных веществ
- 2373941 Способ коррекции возрастных и патологических изменений кожных покров
- 2174845 Композиции и способы доставки генетического материала
- 2174830 Средство для укрепления волос
- 2373769 Синбиотическая композиция
- 2274472 Лечение апорно-двигательного аппарата и болевых синдромов
- 2372929 Профилактическая композиция на основе веществ фенольной природы в липосомной форме
- 2173563 Способ нанесения на поверхность предметов покрытия на основе гиалуроновой кислоты, её производных и полусинтетических полимеров
- 2079304 фармацевтическая композиция, обладающая иммуносупрессорной и антимикробной активностью
- 2273645 Полипептид ожирения
- 2173154 Фракция кератансульфатолигосахаридов и содержащий ее фармацевтический препарат
- 2173136 Грязная мазь
- 2173128 Способ хирургического лечения центральных разрывов сечатки
- 2078561 Косметическое средство предотвращающее старение кожи
- 2172490 Способ прогнозирования воспалительных заболеваний молочной железы при эндопластике
- 2272645 Способ лечения ЦМВ-Инфекции у детей раннего возроста
- 2272636 Фармацевтическая композиция для местного лечения воспаления
- 2272635 Фармацевтически активная субстанция для офтальмологии
- 2272599 Биоматерьял для стабилизации прогрессирующей миопии "Коллаплант"
- 2172168 Средство для заживления ран на основе гиалуроновой кислоты
- 2371172 Фармацевтическая композиция для лечения нервной системы на основе стефаглабрина
- 2171470 Способ прогнозирования послеоперационной трансформации доброкачественных опухолей нервной системы
- 2077317 Состав для ванн
- 2271213 Комбинированные композиции, содержащие экстракты из растений и морских животных
- 2076872 Способ получения окрашенной гиалуроновой кислоты
- 2076671 Раствор для защиты роговицы
- 2370281 Конъюгаты гидроксиалкилкрахмал
- 2370275 Способ лечения (коррекции) косметических и возрастных дефектов кожи
- 2370258 Фармацевтическая композиция для парентальной доставки в форме лиофилизата
- 2270023 Способ экстракции и очистки протеогликана хрящего типа (варианты)
- 2369408 Гемостатическая композиция, включающая гиалуроновую кислоту
- 2369387 Фармацевтическая композиция для лечения нервной системы
- 2369379 Нетаблитированные жевательные формы для индивидуального введения
- 2169136 Производное коричной кислоты
- 70792 Медицинский аппликатор
- 20741717 Способ стабилизации аскорбиновой кислоты
- 2074712 Способ получения препарата, препятствующего преждевременной эякуляции
- 2367954 Способ прогнозирования развития кожной патологии у женщин с синдромом склерополикистозных яичников (СПКЯ)
- 2268075 Устройство для электрокинетической доставки
- 2268052 Средство для лечения воспалительных и дегенеративных заболеваний суставов
- 2167649 Способ получения твердой дисперсии умеренного водорастворимого лекарственного вещества
- 2167647 Гель для бритья
- 2073520 Лечение урологических инфекций
- 2367476 Биопластический материал
- 2367475 Мембрана для использования при направленной регенерации тканей
- 2367469 Фармацевтическая композиция на основе лизоамидазы
- 2367456 Фармацевтическая композиция обладающая антибактериальным и некролитическим действием
- 2367455 Фармацевтическая композиция обладающая некролитическим и антибактериальным действием
- 2267324 Применение антиадгезивных углеводов, препарат для уменьшения и /или блокирования адгезии патогенных веществ
- 2166934 Композиции включающие биологический агент
- 2166510 Псевдодипептиды
- 2366460 Композиции, имеющие высокую противовирусную и антибактериальную активность
- 2360901 Производные феноксиуксусной кислоты
- 2165749 Способ восстановления эндотелия роговицы
- 2265441 Способ укрепления склеры
- 2365382 Композиции и способы для регуляции развития сосудов
- 2070879 Соли гликозаминогликанов
- 2164914 Циклические и гетероциклические N - замещенные - иминогидроксамовые карбоновые кислоты
- 2264627 Хламидийный конъюктивит
- 2364399 Фармацевтический препарат на основе стефаглабрина
- 2264230 Препарат с замедленным высвобождением активного вещества
- 2363497 Фармацевтические композиции
- 2363496 Способ увеличения объема мягких тканей
- 2363473 Способ антифлогистической активации в эксперементе
- 2363461 Фармацевтический препарат на основе сигетина
- 2363459 Средства для введения в роговицу глаз для предотвращения офтальмологических нарушений
- 2363448 Фармацевтические композиции
- 2163123 Глазные капли
- 2162687 Усовершенствованнная лекарственная форма индуктора интерферана
- 2162343 Биосовместимый полимерный материал и способ его получения
- 2162327 Лечение рака
- 2067841 Способ получения ароматизатора
- 2161478 Способ консервированого лечения гонартроза
- 2361617 Вольфрамовые частицы в качестве рентгеноконтрастных веществ
- 2361552 Способы и устройства для дренирования жидкостей и понижения внутриглазного давления
- 2066996 Способ изготовления пленочного материала для офтальмохирургии
- 2361417 Корм с глюкозамином и экстрактом ивы для профилактики артроза у животных
- 2161002 Пищевой общеукрепляющий лечебно-профилактический продукт из хрящевой ткани акул
- 2360928 Комплексная матрица для медико-биологического применения
- 2160574 Способ лечения глаукомы
- 2360688 Способ лечения повреждений переферических нервов
- 2360670 Фармацевтическая композиция при климактерических расстройствах
- 2360646 Эндолюминальный протез
- 2260445 Способ усовершенствования транспортировки через легко прспосабливаемый полупроницаемый барьер
- 2260007 Производные амида
- 2359975 Способ получения модифицированных арабиногалактанов
- 2359974 Антигенные Пептиды
- 2159775 Псевдопептидный продукт
- 2259833 Фармацевтическая композиция для лечения роговицы глаза
- 2259816 Ранозаживляющее средство
- 2259815 Способ коррекции возрастных изменений, связанных с процессами старения кожи
- 2359706 Способ сохранения офтальмологических растворов
- 2359704 Антисептическое средство
- 2359662 Микрокапсулы
- 2159253 Катионные полимеры
- 2159111 Средство для ухода за кожей лица
- 2159105 Композиция для защиты кожи от опасных химических веществ Получение
- 2158593 Биосовместимый водный раствор
- 2358728 Способ лечения и предупреждения потери костной ткани
- 2258517 Способ хирургического лечения травмотических повреждений селезенки пленкой на основе гиалуроновой кислоты
- 2357968 Кристалические формы производной имидазола
- 2357957 Ингибиторы P38 и их применение
- 2157647 Пищевая добавка и ее получение
- 2357758 Препараты для чрескожной и чересслизистой добавки
- 2063244 Способ стабилизации растворов
- 2063140 Способ получения препарата для консервирования мяса
- 2157381 Способ получения гиалуроновой кислоты
- 2257198 Композиции микроцастиц
- 2356909 Белковый комплекс
- 2356570 Косметическая композиция
- 2256434 Способ закрытия перфорации барабанной перепонки
- 2356520 Способ лечения постконтузионного повреждения сечатки глаза
- 2156133 Гель
- 2255945 Полимерная композиция
- 2355761 Средства повторной дифференцировки
- 2061043 Способ повышения устойчивости урокиназы к нагреванию
- 2061005 Способ получения красителей для гистологических исследований
- 2355420 Зубная паста
- 2355385 Композиции пролонгированного действия с контролируемым высвобождением
- 2355240 Способ получения пищевого препарата хондропротекторного действия
- 2155057 Пихтово репейный бальзам
- 2354409 Способ производства высвобождающих лекарственные средчтва медицинских устройств
- 2254145 Раневое покрытие на основе коллаген-хитозанового комплекса
- 2254133 Лечение и профилактика ВИЧ-инфекции у человека
- 2253439 Фармацевтическая композиция для защиты и улучшения оптических свойств роговици при проведении эндовитреальных вмешательств
- 2253437 Способ омоложения кожи
- 2153352 Фармацевтическая композиция обладающая ранозаживляющим и противовоспалительным действием
- 2353354 Фармацевтический препарат на основе низкомолекулярного индуктора интерферона
- 2252787 Способ получения искусственной матрицы кожи
- 2252767 Способ нормализации иммунобиохимического гомеостаза коров в предродовом и послеродовом периодах
- 2352583 Фармацевтическая композиция содержащая Fc-область иммуноглобулина в качестве носителя
- 2152403 Модифицированные полисахариды
- 2352356 Иммуногенная композиция
- 2352342 Исскусственный физиологический солевый раствор Способ его получения
- 2352330 Фармацевтический препарат на основе низкомолекулярного индуктора интерферона
- 2352323 Фармацевтический препарат с модифицированным высвобождением
- 2152027 Способ подготовки ткани мозга для определения гликозаминогликанов
- 2251842 Интектицидный состав для борьбы с личинками оводов
- 2151580 Способ активации пролиферации эндотелия роговицы
- 2351648 Дифференцировка стромальных клеток, полученных из жировой ткани, в эндокринные клетки поджелудочной железы и их использование
- 2351595 N - гидроксиформамидные соединения в качестве ингибиторов металлопротеина
- 2251411 Косметическое средство в лиофилизированной фармацевтической форме
- 2251405 Косметика...ее композиции для косметических препаратов
- 2251367 Средство со сшитой гиалуроновой кислотой для наращивания тканей
- 2351359 Косметика для профилактики и лечения избыточной массы тела
- 2351322 Препарат на основе низкомолекулярного индуктора интерферона
- 2351153 Диета при остеортрите собак
- 2350958 Способ определения групповой принадлежности синовальной жидкости
- 2350625 Производные гиалуроновой кислоты с пониженной биодеградируемостью
- 2150266 Крем после бритья
- 2350354 Фармацевтическое средство содержащие антагонист и фактор некроза
- 2350340 Способ коррекции процессов регенерации
- 2350309 Способ лечения избыточной массы тела с помощью рефлексотерапии
- 2250047 Профилактический продукт из хрящевой ткани гидробионтов
- 2249467 Медицинский матерьял и изделия на его основе
- 2055079 Способ получения препарата гиалуроновой кислоты
- 2349599 Биоадгезив мидии
- 2054903 Способ лечения коллагеноза у бычков на откорме
- 2249210 Способ прогнозирования предрасположенности к развитию и тяжести течения деформирующего остеоартроза коленного сустава у взрослых
- 2349339 Средство для соединительной ткани
- 2148988 Человеческий интерферона
- 2148399 Лечение атеросклероза
- 2148396 Способ определения активного вещества в дифильных мазевых основах
- 2148375 Способ диагностики близорукости
- 2348415 Способ противоспаечной терапии после хирургического вмешательства
- 2348400 Препарат на основе низкомолекулярного индуктора интерферона
- 2348386 Способ непроникающего хирургического лечения первичной открытоугольной глаукомы
- 2248213 Лечение Галактозидальной А недостаточности
- 2347586 Микрофлюидизированные эмульсии типа "масло в воде" и вакцинные средства
- 2147243 Контрастное средство
- 2146526 Лечебный препарат дисбактериоза и урогенитальных инфекций
- 2146148 Терапевтическое применение фактора роста кератиноцитов (ФРК)
- 2146139 Способ повышения активности макрофагов и комбинации для его осуществления
- 2346277 Способ диагностики специфического синовита
- 2345793 Ультразвуковые контрастные вещества и их получение
- 2345782 Терапевтические комбинации на основе PORIFERA для лечения и предотвращения кожных заболеваний
- 2245131 Способ коррекции косметических недостатков кожи
- 2245130 Способ активации восстановительных процессов в коже
- 2144833 Хондроитиназа
- 2344809 Получение твердых дозированных форм с использованием сшитого нетермопластичного носителя
- 2244540 Косметический гель для ухода за кожей лица
- 2244536 Способ лечения дегенеративно-дистрофических заболеваний тазобедренного сустава
- 2344167 Хмелевый экстракт
- 2143884 Агент регулирования дифференциации клеток кожи, культурная среда для клеток или тканей и способ регулирования дифференциации клеток кожи
- 2343932 Способ получения обладающих пониженной растворимостью в воде пленночных материалов
- 2343903 Устройство доставки лекарств для контролируемого введения препаратов
- 2048817 Способ получения материала для лечения ожогов и гнойно - некронических ран
- 2048803 Гидратантный крем
- 2242974 Средства и способы лечения воспалительных заболнваний
- 2142816 Способ получения антигерпетической вакцины
- 2342923 Средство для обработки рук с увлажняющим эффектом
- 2142781 Косметика для макияжа ресниц и бровей и агент ингирирующий рост микроорганизмов в косметических средствах
- 2242251 Трансплантируемые стенты с биоактивными покрытиями
- 2142257 Способ обработки глазных имплантантов и контакных линз
- 2342389 Мононатриевая соль
- 2342107 Способ устранения западения верхнего века при анофтальме
- 2141828 Средство, пролонгирующее эффективность чесночного порошка
- 2241489 Косметическое средство матриксных протеинов для залечивания ран
- 2241443 Средство для лечения герпеса
- 2241414 Способ получения протезов кровеносных сосудов
- 2341539 Гидрогель
- 2141324 Регулятор скорости воздействия препарата для инъекций
- 2141312 Косметическое средство для ухода за кожей лица
- 2341296 Средства и способы покрытия медицинских имплантантов
- 2341272 Средство для неспецифической иммунотерапии
- 2341266 Стенты с нанесенным покрытием содержащим N - (5-(4-(4-
- 2341257 Иммуномодулирующее средство
- 2341255 Средство для лечения климактерических расстройств
- 2240821 Способ лечения урологических инфекций
- 2140786 Способ лечения лишая
- 2140243 Способ хирургического лечения диабетической ретинопатии и отслоек сечатной оболочки
- 2240140 Медицинская многослойная повязка и изделия на ее основе
- 2240135 Культура клеток, содержащая клетки - предшественники остеонегеза, имплантант на ее основе и его использование для восстановления целостности кости
- 2240123 Экзогенные биологически активные коньюгирующие вещества
- 2139886 Фотоотвержаемое производное гликозаминогликата, сшитое производное гликозаминогликата и способы их получения, способ предотвращения клеточной и тканевой адгезии
- 2139729 Вакцина. Способ стимулирования иммунной системы
- 2339386 Средство обладающее радио - и химиозащитным действием
- 2339369 Лечение офтальмологических нарушений с использованием мочевины и ее производных
- 2139041 Гидратантный регенерирующий крем и способ его получения
- 2139039 Косметический суперкрем для ухода за кожей
- 2139017 Способ получения боисовместимого материала
- 2138503 Производные камптотецина, способы их получения, уникальное средство
- 2338556 Средство содержащие антагонист Р2Х - рецептора и нестероидное противоспалительное лекарственное средство
- 2338514 Косметическое средство для профилактики старения кожи
- 2138297 Медицинские устройства, подверженные вызываемому разложению
- 2138295 Покрытие для ран
- 2337906 Ингибиторы цитозольной фосфолипазы А2 Применение физиологически допустимого корпускулярного ферримагнитного или ферромагнитного материала. Способ формирования магнитометрического изображения
- 2137501 Устройство формирования изображения
- 2137477 Способ лечения заболеваний характеризующихся аутоиммунной агрессией
- 2137467 Крем для кожи лица и тела
- 2137449 Способ коррекции дефектов преломления в глазу млекопитающего
- 2137402 Пищевая Добавка БАД
- 2336899 Способ стимуляции миелопоэза
- 2336862 Способ получения раствора для лечения роговицы
- 2336830 Способ восстановления костных структур челюсти
- 2136696 Новый полипептид и средство против ВИЧ - Инфекции
- 2336092 Биоадгезивное средство, по существу свободное от воды
- 2336089 Средство и способ лечения заболеваний периодонтальных и пульпы
- 2336074 Средства и способы лечения заднего сегмента глаза
- 2235548 Ранозаживляющее средство
- 2135186 Способ лечения рефлекторных синдромов при остеохондрозе
- 2234945 Стабилизатор водного раствора и водосодержащего сырья
- 2334762 Растворимая ассоциативная карбоксиметилцеллюлоза
- 2234514 Макропористые хитозановые гранулы и способ их получения. Способ культивирования клеток
- 2133615 Средство для лечения неврологических заболеваний
- 2233164 Способ профилактики развития послеоперационных спаек брюшной полости
- 2133127 Неткатный материал, способ его получения и способ лечения
- 2333223 Альдегидные производные сиаловой кислоты и средства на их основе
- 2333007 Полипептидные вакцины для широкой защиты против рядов поколений менингококов с повышенной вирулентностью
- 2332985 Дозированные формы анестезирующих средств с длительным высвобождением для обезболивания
- 2132677 Косметическая маска
- 38603 Пленочный аппликатор
- 2232594 Средство содержащие ингибирующие остеокластогенез фактор и полисахарид
- 2332238 Средство для прокладок, раневых повязок и других изделий, контактирующих с кожей
- 2331668 Стромальные клетки, получение из жировой ткани, для заживления дефектов роговицы и внутриглазных дефектов и их использование
- 2331438 Альфа - 2 - Дельта Лигант для лечения симптомов нижних мочевыводящих путей
- 2331411Электропряденые аморфные фармоцевтические средства
- 2331367 Способ профилактики образования спаек и их рецидива
- 2130767 Масло в воде для получения косметических и дерматологических средств, способ косметической обработки
- 2230752 Поперечносшитые гиалуроновые кислоты и их применение в медицине
- 2230558 Способ восстановления и сохранения здоровья скмьи
- 2230550 Средства длительного высвобождения, способ их получения и применения
- 2230458 Поддержания здоровья суставов
- 2330290 Способ определения состояния метаболических процессов в ткани суставного хряща
- 2230073 Способ поперечного сшивания карбоксилированных полисахаридов
- 2329059 Способ лечения полипозного риносинусита
- 2329037 Комбинированная терапия для лечения иммуновоспалительных заболеваний
- 2128666 Гиалуроновая кислота и ее соли, способ очистки гиалуроновой кислоты, способ получения гиалуроновой кислоты. Фармацевтический препарат с гиалуроновой кислотой и средства с гиалуроновой кислотой используемые в офтальмологии
- 2328740 Способ экспресс - оценки действия зубных паст
- 2128502 Косметический гель
- 2328272 Суппозитории индуктора интерферона
- 2328268 Косметика содержащая амфолитный сополимер
- 2128057 Композиционная мембрана, способ ее получения и способ направленной регенерации тканей с ее применением
- 2128055 Средство замедленного освобождения и способ его получения
- 2128049 Свечи
- 2227743 Полипептидные варианты с повышенной гепаринсвязывающей способностью
- 2326893 Ковалентное и нековалентное сшивание гидрофильных полимеров
- 2326697 Новый перевязочный материал для быстрого заживления раневой поверхности кожи
- 2126264 Фармацевтическое средство с гиалуроновой кислотой
- 2326137 Способ получения содержащих альгинат пористых формованных изделий
- 2325902 Способ выделения гликозаминогликанов из минерализованной соединительной ткани
- 2225195 Репелленты против насекомых
- 2325193 Сосудистый стент
- 2325184 Улучшенные везикулы наружной мембраны бактерий
- 2325153 Многокомпонентная фармацевтическая дозированная форма
- 2325152 Удерживаемая в желудке система регулируемой доставки лекарственного средства
- 2029955 Способ предоперационного определения помутнения задней капсулы хрусталика при экстракции катаракты
- 2324688 Производные бисбензизоселеназолонила с противоопухолевым, противовоспалительным и антитромбоническим действием
- 2323017 Устройство и способ контролируемый доставки активных веществ в кожу
- 2323011 Содержащий Коллаген I и Коллаген II способный к рассасыванию внеклеточный матрикс, предназначенный для реконструирования хряща
- 2322955 Способ изготовления имплантанта для пластики дефектов хрящевой ткани
- 2322454 Антитело против CCR5
- 2322263 Система продолжительного высвобождения растворимого лекарственного средства
- 2221561 Витамин Е и его сложные эфиры
- 2321634 Гены участвующие в метаболизме углерода и продуцировании энергии
- 2321597 Биоматерьял, способ его приготовления и его применение, медицинское средство, имплантант и вкладыш
- 2121340 Средство для похудения
- 2220737 Средство для улучшения состояния опорно-двигательного аппарата
- 2220729 Гель используемый в стоматологии
- 2320720 Способ культивирования фибропластов для заместительной терапии
- 2320378 Накожный аппликатор
- 2320369 Средства, содержащие Альфа - 2 - Дельта Лиганды и ингибиторы обратного захвата серотонина/норадреналина
- 2320362 Местные фармацевтические средства, содержащие проантоцианидины, для лечения дерматитов
- 2320322 Биоадгезивная доставка лекарств
- 2320318 Чувствительное к температуре изменяющие состояние средство гидрогеля
- 2025120 Способ получения препарата, содержащего Фактор /G-CSF/, стимулирующий рост колоний гранулоцитов
- 2319490 Средство для введения железа при лечении синдрома беспокойных ног
- 25995 Содержащее адгезив приспособление для фиксации зубных протезов в полости рта
- 2218907 Средство для ухода за кожей лица и веками
- 2318830 Способ получения модифицированного дерматансульфата
- 2118153 Косметика - туш для ресниц
- 2217441 Способ получения полимера
- 2317296 Изетионатная соль селективного ингибитора CDK4
- 2217171 Мембрана для использования при направленной регенерации тканей
- 2317095 Экстракты ECHINACEA ANGUSTIFOLIA
- 2216332 Препарат для лечения астроза
- 2216314 Крем - маска для обезвоженной кожи
- 2316333 Средство оздоровительно-восстановительных косметических панто-магниевых ванн
- 2021304 Способ получения биологически активного средства
- 2115662 Способ получения гиалуроновой кислоты
- 2315627 Впрыскиваемые имплантанты на керамической основе для заполнения морщин, кожных впадин, шрамов
- 2315623 Средство получаемое путем лиофилизации препарата
- 2114862 Способ получения гиалуроновой кислоты
- 2314791 Лечебно-Косметическое средство
- 2314791 Косметический крем-бальзам для ухода за кожей лица и шеи
- 2214600 Способ оценки эффективности лечения неврологических проявлений
- 2114602 Способ косметической обработки
- 2114587 Раствор для защиты роговицы
- 2214283 Имплантант для подкожного или внутрикожного введения
- 2313370 Медицинские протезы, имеющие улучшенную биологическую совместимость
- 2313356 Препарат для лечения демодекоза
- 2313338 Средство на основе этиллинолеата и триэтилцитрата для лечения себореи и угрей
- 2313328 Косметика содержащая тонкодисперный и пористый порошок
- 2212880 Способ получения препарата содержащего антибиотик, с замедленным высвобождением активного вещества
- 2312640 Способ лечения Блефароконьюнктивальной формы синдрома сухого глаза
- 2017751 Способ получения гиалуроновой кислоты
- 2312145 Гены CORYNEBACTERIUM GLUTAMICUM, кодирующие белки, участвующие в синтезе мембран и мембранном транспорте
- 2311458 Белки вызывающие измененную иммуногенную реакцию. Способ их получения и использования
- 2311183 Улучшенное разделение с использованием гталуроновой кислоты
- 2311177 Ингибиторы интегрина для лечения заболевания глаз
- 2300069 Косметическая маска
- 2211024 Уход за сухой кожей
- 2310440 Раствор для защиты роговицы от повреждений
- 2309684 Лечение межфалангового остеоатроза узелковой формы
- 2309406 Способ мониторинга фиброза печени у больных хроническим гепатитом с (ХГС)
- 2209088 Опосредованная рецепторами доставка генов с использованием векторов на основе бактериофагов
- 2308967 Уменьшение объема ткани
- 2308962 Средство для опорно-дигательного аппарата
- 2308957 Способ получения препарата для мезотерапии
- 2308954 Средство для лечения ран, содержащее плазму или сыворотку крови
- 2308951 Комплексный способ профилактики вагинальных дисбактериозов
- 2308937 Косметическая биологически активная добавка и косметический литофитокомплекс на ее основе
- 2208638 ДНК (варианты), способ получения белка
- 2207885 Способ подачи небольшого объема лечебного раствора к целевому месту
- 2207858 Лишенные побочных эффектов производные простагландинов для лечения глаукомы
- 2207845 Твердая лекарственная форма пролонгированного действия
- 2207844 Препарат для местного неинвазивного применения
- 2207841 Средства с антиферментативным действием
- 2306335 Стволовые клетки и решетки полученные из жировой ткани
- 2306140 Новые рецепторы для Helicobacter pylori и их применение
- 2205612 Способ эндотелизации IN VITRO протезов кровеносных сосудов
- 2105540 Депигментирующее средство
- 2304960 Косметическое средство для кожи
- 2304616 Гены участвующие в гомеостазе и адаптации
- 2204550Способ получения длинноцепочечной N-Ацилированной кислотой Аминокислот
- 2204415 Способ получения изображения
- 2204394 Средство для лечения грибковых инфекций, желудочных язв
- 2204366 Способ хирургического лечения глаукомы
- 2104034 Вагинальное увлажняющие средство, способ его получения
- 2303991 Биологически активная добавка
- 2303990 БАД
- 2303973 Адсорбирующее изделие
- 2203676 Средство обладающее иммунокорригирующим действием
- 2203672 Способ предупреждения беременности
- 2303635 Гены кодирующие белки резистентности и толерантности к стрессам
- 2303529 Способ фиксации альгинатного геля на твердой фазе, способ получения клеточного чипа на его основе
- 2203078 Способ лечения гнойных ран
- 2302412 Гидразоно-малонитрилы
- 2102400 Способ получения гиалуроновой кислоты
- 2202356 Способ стимуляции репаративных процессов длительно незаживающих ран и трофических язв
- 2202336 Средство для ухода за кожей
- 2302231 Глазные капли
- 2102082 Способ магнитометрического исследования тела человека или животного
- 2301814 Полиакриламидный гидрогель
- 2201765 Гибридные матричные имплантанты и эксплантанты
- 2301677 Биотрансплантант для лечения дегенеративных и трвматических заболеваний хрящевой ткани и способ его получения
- 2301676 Способ лечения ревматизма
- 2301674 Способ лечения больных с переломами нижней челюсти
- 2301661 Средство с регулируемым освобождением и способ его получения
- 2005488 Средство для лечения болезней соединительной ткани
- 2200001 Крем для кожи
|
РОССИЙСКАЯ ФЕДЕРАЦИЯ

ФЕДЕРАЛЬНАЯ СЛУЖБА
ПО ИНТЕЛЛЕКТУАЛЬНОЙ СОБСТВЕННОСТИ
ПАТЕНТАМ И ТОВАРНЫМ ЗНАКАМ
|
Патент №2128055 |
(54) ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ ЗАМЕДЛЕННОГО ВЫСВОБОЖДЕНИЯ И СПОСОБ ЕЕ ПОЛУЧЕНИЯ
(57) Реферат:
Изобретение относится к области медицины. Фармацевтическая композиция замедленного высвобождения, которая включает физиологически активный пептид общей формулы
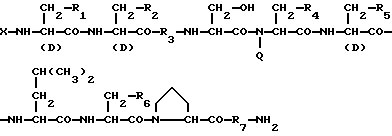
в которой X обозначает ацилгруппу; R1, R2 и R4 каждый представляет ароматическую циклическую группу; R3-D - аминокислотный остаток или группу формулы
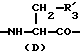
в которой R'3 обозначает гетероциклическую группу; R5 - группу формулы -(CH2)n-R'5, в которой n=2 или 3, и R'5 обозначает аминогруппу, которая необязательно может быть замещенной, ароматическую циклическую группу или 0-гликозилгруппу; R6 представляет группу формулы -(CH2)n-R'6 в которой n=2 или 3, и R6 является аминогруппой, которая может быть необязательно замещенной; R7-D - аминокислотный остаток или азаглицил - остаток, и Q обозначает водород или низшую алкилгруппу, или его соль и биоразлагаемый полимер, имеющий концевую карбоксильную группу. Композицию получают растворением смеси компонентов в растворителе, не cмешивающемся с водой с его последующим удалением. Препарат замедленного высвобождения позволяет получить непрерывное выделение пептида в течение длительного времени и не обладает начальным выбросом по сравнению с подобными композициями. 3 с. и 22 з.п. ф-лы, 10 табл. Настоящее изобретение относится к фармацевтическим композициям замедленного высвобождения, содержащим физиологически активный пептид, и способам его получения. Предшествующая техника включает, как раскрыто в EP-A-481732, препарат замедленного высвобождения содержащий лекарственное средство, полимолочную кислоту и сополимер гликолевой кислоты - оксикарбоновой кислоты [HOCH(C2-8алкил)COOH]. Раскрытый способ включает приготовление W/O (эмульсия типа "вода в масле") эмульсии, содержащей внутреннюю водную фазу включающую водный раствор физиологически активного пептида и внешнюю масляную фазу, включающую раствор биологически разлагаемого полимера в органическом растворителе, добавление названной W/O эмульсии к воде или водной среде и переработку образовавшейся W/O/W эмульсии в микрокапсулы замедленного высвобождения (способ высушивания в воде). Выложенная заявка Японии 118512/1982 описывает микрокапсулу, включающую гормонально активный полипептид, биоразлагаемый полимер и вещество, регулирующее гидролиз. Раскрытый для ее производства способ представляет способ коацервации, который включает добавление коацервирующего агента к W/O эмульсии, состоящей из водного раствора полипептида в качестве внутренней водной фазы и галоидированного органического растворителя в качестве масляной фазы с целью производства микрокапсул. Выложенная заявка Японии 121222/1989 описывает фармацевтическую композицию, включающую полилактид, полигликолид, сополимер молочной кислоты - гликолевой кислоты или смесь этих полимеров и нерастворимый в воде пептид. Раскрыт также способ производства, который включает диспергирование соли нерастворимого в воде пептида в растворе названного полилактида, полигликозида, сополимера молочной кислоты - гликолевой кислоты или смеси этих полимеров, удаление растворителя упариванием и сплавление образовавшейся смеси в твердые частицы. Выложенная заявка Японии 1506091/1982 описывает способ получения фармацевтической композиции, включающий полилактид и кислотостойкий полипептид, который, например, включает растворение тетрагастрин гидрохлорида и полилактида в водном диоксане, отливку раствора в пленку и упаривание растворителя. EP-A-0467389 дает технологию обеспечения системы отпуска лекарственного средства для протеинов и полипептидов использованием метода полимерного осаждения или метода микросфер. Однако, данная литература не содержит конкретного описания системы, включающей LH-RH производное. Высвобождающий гормоны лютенизирующий гормон, известный как LH-RH (или GnRH), выделяется гипоталамусом и связывается с рецепторами гипофиза. LH (лютенизирующий гормон) и FSH (фолликулостимулирующий гормон), которые вслед за тем высвобождаются, действуют на гонаду, синтезируя стероидные гормоны. Известно существование как агонистического, так и антагонистического пептидов в виде производных LH-RH. Когда высоко агонистический пептид вводится неоднократно, число доступных рецепторов сокращается, так что гонадо-вырабатываемые стероидные гормоны подавляются. Поэтому предполагается, что LH-RH производные будут обладать ценностью в качестве терапевтических средств при заболеваниях, связанных с гормональной зависимостью, таких как рак предстательной железы, доброкачественная гипертрофия предстательной железы, эндометриоз, миома матки, фиброма матки, преждевременное половое созревание, рак молочной железы, и т.д. или в качестве противозачаточных средств. В частности проблема гистамин-высвобождающей активности отмечалась для LH-RH антагонистов так называемых первого и второго поколений (The Pharmaceuticols 32, 1599-1605, 1990), но после этого был синтезирован ряд соединений и недавно получены LH-RH-противодействующие пептиды, имеющие незначительную гистамин-высвобождающую активность (сравни, например, Фармакопея США N 5110904). Для того, чтобы любой такой LH-RH противодействующий пептид проявил свое фармакологическое действие, необходима система, контролирующая высвобождение таким образом, чтобы конкурирующее ингибирование эндогенного LH-RH могло быть устойчивым. Кроме того, поскольку гистамин-высвобождающая активность может быть низкой, но все же присутствует в таких пептидах, возникает потребность в препарате замедленного высвобождения с ингибированным начальным импульсом, следующим непосредственно за введением. В частности, в случае препарата замедленного высвобождения (например, 1-3 месяца) важно обеспечить более надежное и постоянное высвобождение пептида с целью достижения этой заданной эффективности с большей степенью уверенности и безопасности. В то же время давно ощущается потребность в способе приготовления препарата замедленного высвобождения, имеющего высокую степень удержания пептида для физиологически активного пептида, в частности LH-RH противодействующих пептидов. Согласно настоящему изобретению обеспечивается:
1) Препарат замедленного высвобождения, который включает физиологически активный пептид общей формулы I
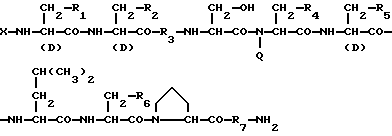
в которой X обозначает ацилгруппу;
R1, R2 и R4 каждый представляет ароматическую циклическую группу;
R3 представляет D-аминокислотный остаток или группу формулы
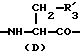
в которой R'3 обозначает гетероциклическую группу;
R5 представляет группу формулы -(CH2)n-R'5, в которой n = 2 или 3 и R'5 обозначает аминогруппу, которая необязательно может быть замещенной, ароматическую циклическую группу или O-гликозилгруппу. R6 представляет группу формулы -(CH2)n-R'6, в которой n = 2 или 3, R'6 является аминогруппой, которая может быть необязательно замещенной;
R7 обозначает D-аминокислотный остаток или азаглицил остаток;
Q обозначает водород или низшую алкилгруппу,
или его соль и биоразлагаемый полимер, имеющий концевую карбоксильную группу. 2) Препарат замедленного высвобождения по п. 1, приведенному выше, в котором X обозначает C2-7-алканоилгруппу, которая может быть необязательно замещенной 5- или 6-членной гетероциклической карбоксамидогруппой. 3) Препарат замедленного высвобождения по приведенному выше п. 2, в котором X обозначает C2-4-алканоилгруппу, которая может необязательно быть замещенной тетрагидрофурилкарбоксамидгруппой. 4) Препарат замедленного высвобождения по приведенному выше п. 1, в котором X представляет ацетил. 5) Препарат замедленного высвобождения по приведенному выше п. 1, в котором биоразлагаемый полимер является смесью (A) сополимера гликолевой кислоты и оксикарбоновой кислоты общей формулы II
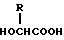
в которой R представляет алкилгруппу с 2-8 атомами углерода,
и (B) полимолочной кислоты. 6) Препарат замедленного высвобождения по приведенному выше п. 1, в котором X представляет ацетил, и биоразлагаемый полимер представляет смесь (A) сополимера гликолевой кислоты и оксикарбоновой кислоты общей формулы II. 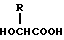
в которой R представляет алкил группу с 2-8 атомами углерода,
и (B) полимолочной кислоты. 7) Препарат замедленного высвобождения по приведенному выше п. 5, в котором сополимер имеет средневесовой молекулярный вес приблизительно от 2000 до 50000, определенный GPC (гель проникающей хроматографией). 8) Препарат замедленного высвобождения по приведенному выше п. 5, в котором сополимер имеет степень дисперсности приблизительно от 1,2 до 4,0. 9) Препарат замедленного высвобождения по приведенному выше п. 5, в котором полимолочная кислота имеет средневесовой молекулярный вес приблизительно от 1500 до 30000 определенный GPC. 10) Препарат замедленного высвобождения по приведенному выше п. 5, в котором полимолочная кислота имеет степень дисперсности приблизительно от 1,2 до 4,0. 11) Препарат замедленного высвобождения по приведенному выше п. 1, в котором биоразлагаемый полимер представляет сополимер молочной кислоты и гликолевой кислоты. 12) Препарат замедленного высвобождения по приведенному выше п. 11, в котором сополимер имеет средневесовой молекулярный вес приблизительно от 5000 до 25000, определенный GPC. 13) Препарат замедленного высвобождения по приведенному выше п. 11, в котором сополимер имеет степень дисперсности приблизительно от 1,2 до 4,0. 14) Препарат замедленного высвобождения по приведенному выше п. 1, в котором доля физиологически активного пептида находится в интервале приблизительно от 0,01 до 50% (вес/вес) относительно биоразлагаемого полимера. 15) Препарат замедленного высвобождения по приведенному выше п. 1, в котором физиологически активный пептид является LH-RH антагонистом. 16) препарат замедленного высвобождения по приведенному выше п. 1, в котором физиологически активный пептид представляет:
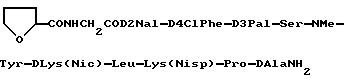
или его ацетат. 17) Препарат замедленного высвобождения по приведенному выше п. 1, в котором физиологически активный пептид представляет собой NAcD2Nal-D4ClPhe-D3Pal-Ser-NMeTyr-DLys(Nic)-Leu-Lys(Nisp)-Pro-DAlaNH2 или его ацетат. 18) Препарат замедленного высвобождения по приведенному выше п. 1, в котором физиологически активный пептид представляет собой NAcD2Nal-D4ClPhe-D3Pal-Ser-Tyr-DhArg(Et2)-Leu -hArg(Et2)-Pro-DAlaNH2 или его ацетат. 19) Способ получения препарата замедленного высвобождения, который включает растворение физиологически активного пептида общей формулы I
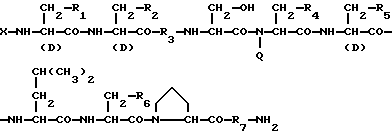
в которой X представляет ацилгруппу;
R1, R2 и R4 каждый представляет ароматическую циклическую группу;
R3 представляет D-аминокислотный остаток или группу формулы
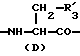
в которой R'3 обозначает гетероциклическую группу;
R5 представляет группу формулы -(CH2)n-R'5, в которой n = 2 или 3 и R'5 является аминогруппой, которая может быть необязательно замещенной, ароматической циклической или O-гликозил группой;
R6 представляет группу формулы -(CH2)n-R'6, в которой n = 2 или 3 и R'6 является аминогруппой, которая может быть необязательно замещенной;
R7 представляет D-аминокислотный остаток или азаглицил остаток; и
Q обозначает водород или низшую алкильную группу,
или его соли и биоразлагаемого полимера, имеющего концевую гидроксильную группу в растворителе, который является в основном не смешиваемым с водой, и затем удаление названного растворителя. 20) Способ по приведенному выше п. 19, в котором биоразлагаемый полимер является смесью (A) сополимера гликолевой кислоты и оксикарбоновой кислоты общей формулы II
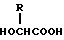
в которой R представляет алкилгруппу с 2-8 атомами углерода,
и (B) полимолочной кислоты. 21) Способ по приведенному выше п. 19, в котором X является ацетилом и биоразлагаемый полимер представляет собой смесь (A) сополимера гликолевой кислоты и оксикарбоновой кислоты общей формулы II
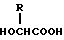
в которой R обозначает алкилгруппу с 2-8 атомами углерода,
и (B) полимолочной кислоты. 22) Способ по приведенному выше п. 19, в котором биоразлагаемый полимер является сополимером молочной кислоты и гликолевой кислоты. 23) Способ по приведенному выше п. 19, который включает растворение биоразлагаемого полимера и в основном водонерастворимого физиологически активного пептида в растворителе, который является в основном несмешиваемым с водой, и добавление полученного раствора к водной среде с целью получения O/W эмульсии (эмульсии типа "масло в воде"). 24) Способ получения препарата замедленного высвобождения, который включает растворение биоразлагаемого полимера, включающего смесь (A) сополимера гликолевой кислоты и оксикарбоновой кислоты общей формулы II
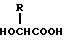
в которой R представляет алкилгруппу с 2-8 атомами углерода,
и (B) полимолочной кислоты и в основном водонерастворимого физиологически активного пептида или его соли в растворителе, который в основном является не смешиваемым с водой, и затем удаление названного растворителя, и
25) Способ по приведенному выше п. 24, который дополнительно включает после этого растворение биоразлагаемого полимера и в основном водонерастворимого физиологически активного пептида или его соли в растворителе, который является в основном не смешиваемым с водой, и затем добавление образовавшегося раствора к водной среде с целью получения O/W эмульсии. Обозначения, использованные в данном описании, имеют следующие значения:
NAcD2Nal - N-Ацетил-D-3-(2-нафтил)аланил
D4ClPhe - D-3-(4-Хлорфенил)аланил
D3Pal - D-3-(3-Пиридил)аланил
NMeTyr - N-Метилтирозил
DLys(Nic) - D-(Ипсилон-N-никотиноил)лизил
Lys(Nisp) - (Ипсилон-N-изопропил)лизил
DLys(AzaglyNic) - D-[1-Аза-(N-никотиноил)глицил]лизил
DLys(AzaglyFur) - D-[1-Аза-(N-2-фуроил)глицил]лизил
Для любых других аминокислот используются обозначения, рекомендованные IUPAC-IUB Комитетом по Биохимической номенклатуре (European Journal of Biochemistry 138, 9-37, 1984) или обозначения, общепринятые в соответствующей технике. В случае существования оптических изомеров для любого соединения, если не оговорено особо, имеется в виду L-изомер. В настоящем изобретении пептид (I) проявляет LH-RH антагонистическую активность и является эффективным при лечении гормонально-зависимых заболеваний, таких как рак предстательной железы, гипертрофия предстательной железы, эндометриоз, миома матки, фиброма матки, преждевременное половое созревание, рак молочной железы, и т.д. или в качестве противозачаточного средства. Отнесенная к формуле [I], ацилгруппа X предпочтительно является ацилгруппой карбоновой кислоты. Примеры ацилгруппы включают C2-7алканоил, C7-15 циклоалканоил (например, циклогексаноил), C1-6 алкилкарбамоил (например, этилкарбамоил), 5- или 6-членный гетероциклический карбонил (например, пиперидинокарбонил) и карбомоилгруппа, которая может необязательно быть замещенной. Ацилгруппа предпочтительно является C2-7 алканоилгруппой (например, ацетил, пропионил, бутирил, изобутирил, пентаноил, гексаноил или гептаноил), которая может необязательно быть замещенной, наиболее предпочтительно C2-4 алканоилгруппой (например, ацетил, пропионил, бутирил, изобутирил), которая может необязательно быть замещенной. Заместителями являются, например, C1-6 алкиламиногруппа (например, метиламино, этиламино, диэтиламино, пропиламино), C1-3 алканоиламиногруппа (например, формиламино, ацетиламино, пропиониламино), C7-15 циклоалканоил аминогруппа (например, циклогексеноиламино), C7-15 арилкарбонил-аминогруппа (например, бензоиламино), 5- или 6-членная гетероциклическая карбоксамидогруппа (например, тертагидрофурилкарбоксамидо, пипиридилкарбоксамидо, фурилкарбоксамидо), гидроксилгруппа, карбомоилгруппа, формилгруппа, ткарбоксилгруппа, 5- или 6-членная гетероциклическая группа (например, пиридил, морфолино). Заместителями предпочтительно являются 5- или 6-членная гетероциклическая карбоксамидогруппа (например, тетрагидрофурилкарбоксамидо, пиридилкарбоксамидо, фурилкарбоксамидо). X предпочтительно является C2-7 алканоилгруппой, которая может быть предпочтительно замещенной 5- или 6-членной гетероциклической карбоксамидогруппой. Более предпочтительно X представляет C2-4 алканоилгруппу, которая может необязательно быть замещенной тетрагидрофурил карбоксамидогруппой. Конкретными примерами X является ацетил,
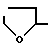 -CO HCH CO - (тетрагидрофурилкарбоксамидоацетил) и тому подобное. Ароматическая циклическая группа R1, R2 или R4 может быть, например, ароматической циклической группой с 6-12 углеродными атомами. Примерами ароматической циклической группы являются фенил, нафтил, антрил и тому подобные. Предпочтительными являются ароматические циклические группы с 6-10 углеродными атомами, такие как фенил и нафтил. Эти ароматические циклические группы могут иметь каждая от 1 до 5, предпочтительно от 1 до 3, подходящих заместителей на кольце в соответствующих положениях. Такие заместители включают гидрокси, галоген, аминотриазолилзамещенный амино, алкокси и тому подобные. Предпочтительными являются гидрокси, галоген и аминотриазолилзамещенный амино. Упомянутые выше галогены включают фтор, хлор, бром и иод. Аминотриазолил составляющая названного аминотриазолилзамещенного амино включает, среди других, 3-амино-1Н-1,2,4-триазол-5-ил, 5-амино-1Н-1,3,4-триазол-2-ил, 5-амино-1Н-1,2,4-триазол-3-ил, 3-амино-2Н-1,2,4 триазол-5-ил, 4-амино-1Н-1,2,3-триазол-5-ил, 4-амино-2Н-1,2,3-триазол-5-ил и тому подобные. Алкоксигруппа предпочтительно представляет собой алкоксигруппу с 1-6 атомами углерода (например, метокси, этокси, пропокси, изопропокси, бутокси, изобутокси, и т.д.). Более предпочтительно, R1 является нафтилом или галофенилом. Более предпочтительно, R2 представляет собой галофенил. Более предпочтительно, R4 представляет собой гидроксифенил или аминотриазолиламинозамещенный фенил. D-амино кислотный остаток R3 предпочтительно является -CO HCH CO - (тетрагидрофурилкарбоксамидоацетил) и тому подобное. Ароматическая циклическая группа R1, R2 или R4 может быть, например, ароматической циклической группой с 6-12 углеродными атомами. Примерами ароматической циклической группы являются фенил, нафтил, антрил и тому подобные. Предпочтительными являются ароматические циклические группы с 6-10 углеродными атомами, такие как фенил и нафтил. Эти ароматические циклические группы могут иметь каждая от 1 до 5, предпочтительно от 1 до 3, подходящих заместителей на кольце в соответствующих положениях. Такие заместители включают гидрокси, галоген, аминотриазолилзамещенный амино, алкокси и тому подобные. Предпочтительными являются гидрокси, галоген и аминотриазолилзамещенный амино. Упомянутые выше галогены включают фтор, хлор, бром и иод. Аминотриазолил составляющая названного аминотриазолилзамещенного амино включает, среди других, 3-амино-1Н-1,2,4-триазол-5-ил, 5-амино-1Н-1,3,4-триазол-2-ил, 5-амино-1Н-1,2,4-триазол-3-ил, 3-амино-2Н-1,2,4 триазол-5-ил, 4-амино-1Н-1,2,3-триазол-5-ил, 4-амино-2Н-1,2,3-триазол-5-ил и тому подобные. Алкоксигруппа предпочтительно представляет собой алкоксигруппу с 1-6 атомами углерода (например, метокси, этокси, пропокси, изопропокси, бутокси, изобутокси, и т.д.). Более предпочтительно, R1 является нафтилом или галофенилом. Более предпочтительно, R2 представляет собой галофенил. Более предпочтительно, R4 представляет собой гидроксифенил или аминотриазолиламинозамещенный фенил. D-амино кислотный остаток R3 предпочтительно является  - -D-аминокислотным остатком с 3-12 углеродными атомами. Примерами аминокислоты являются лейцин, изолейцин, норлейцин, валин, норвалин, 2-аминомасляная кислота, фенилаланин, серин, треонин, метионин, аланин, триптофан и аминоизомасляная кислота. Эти аминокислоты могут иметь подходящие защитные группы (используемые обычно в технике защитные группы, такие как т-бутил, т-бутокси, т-бутоксикарбонил, и т.д.). Гетероциклическая группа R'3 включает 5- или 6-членные гетероциклические группы, каждую содержащую от 1 до 2 атомов азота или серы в качестве гетероатомов, которые могут необязательно быть конденсированными до бензольного кольца. В частности, могут быть упомянуты тиенил, пирролил, тиазолил, изотиазолил, имидазолил, пиразолил, пиридил, 3-пиридил, пиридавинил, пиримидинил, пиразинил, 3-бензо [b] тиенил, 3-бензо [b]-3-тиенил, индолил, 2-индолил, изоиндолил, 1Н-индазолил, бензоимидазолил, бензотиазолил, хинолил, изохинолил и т.д. Особенно предпочтительными разновидностями R'3 являются пиридил или 3-бензо[b] тиенил. Ароматическая циклическая группа R5 может быть такой же, как ароматическая циклическая группа R1, R2 или R4. Ароматическая циклическая группа может иметь от 1 до 5, предпочтительно от 1 до 3, подходящих заместителей в соответствующих положениях на кольце. Заместители могут также быть такими, как заместители, упомянутые для R1, R2 или R4. В частности, предпочтительным заместителем является аминотриазолил-замещенный амино. Гликозил группа для О-гликозил R5 предпочтительно является гексозой или ее производным. Гексоза включает D-глюкозу, D-фруктозу, D-маннозу, D-галактозу, L-галактозу и тому подобные. В качестве названного производного могут быть упомянуты деокси сахара (L- и D-фруктоза, D-хиновоза, L-рамноза, и т.д. ) и амино сахара (D-глюкозамин, D-галактозамин, и т.д.). Наиболее предпочтительными являются дезокси сахара (L- и D-фруктоза, D-хиновоза, L-рамноза, и т.д.). Еще более желательна L-рамноза. Заместитель на аминогруппе, которая может необязательно быть замещенной, R'5 включает, среди других, ацил, карбамоил, карбазоил, который может быть замещенный ацилом или амидино, который может быть моно- или ди-замещенный алкилом. Вышеупомянутый ацил и ацил для вышеупомянутого карбазоила, который может быть замещенный ацилом, включают никотиноил, фуроил, теноил и тому подобные. Упомянутая выше алкил составляющая моно- или диаламидино включает линейные или разветвленные алкилгруппы, содержащие от 1 до 4 атомов углерода, включающие т.о. метил, этил, пропил, изопропил, бутил, изобутил, втор-бутил и трет-бутил и тому подобные. Предпочтительный алкил составляющей является метил или этил. Заместитель для аминогруппы, которая может необязательно быть замещенной, R'6 включает алкил и амидино, который может необязательно быть моно- или ди-замещенный алкилом. Вышеупомянутый алкил и алкил моно- или диалкиламидино, упомянутый выше, включает те алкилгруппы, которые упомянуты для R'5. D-аминокислотный остаток R7 является предпочтительно D-аминокислотным остатком с 3-9 атомами углерода, такими как D-аланил, D-лейцил, D-валил, D-изолейцил, D-фенилаланил и тому подобные. Более предпочтительными являются D-аминокислотные остатки с 3-6 углеродными атомами, такие как D-аланил, D-валил и тому подобные. Наиболее предпочтительной разновидностью R7 является D-аланил. Низшая алкильная группа может быть алкильной группой, определенной для R'5. Наиболее предпочтительным видом Q является метил. Конкретными примерами R1 являются - -D-аминокислотным остатком с 3-12 углеродными атомами. Примерами аминокислоты являются лейцин, изолейцин, норлейцин, валин, норвалин, 2-аминомасляная кислота, фенилаланин, серин, треонин, метионин, аланин, триптофан и аминоизомасляная кислота. Эти аминокислоты могут иметь подходящие защитные группы (используемые обычно в технике защитные группы, такие как т-бутил, т-бутокси, т-бутоксикарбонил, и т.д.). Гетероциклическая группа R'3 включает 5- или 6-членные гетероциклические группы, каждую содержащую от 1 до 2 атомов азота или серы в качестве гетероатомов, которые могут необязательно быть конденсированными до бензольного кольца. В частности, могут быть упомянуты тиенил, пирролил, тиазолил, изотиазолил, имидазолил, пиразолил, пиридил, 3-пиридил, пиридавинил, пиримидинил, пиразинил, 3-бензо [b] тиенил, 3-бензо [b]-3-тиенил, индолил, 2-индолил, изоиндолил, 1Н-индазолил, бензоимидазолил, бензотиазолил, хинолил, изохинолил и т.д. Особенно предпочтительными разновидностями R'3 являются пиридил или 3-бензо[b] тиенил. Ароматическая циклическая группа R5 может быть такой же, как ароматическая циклическая группа R1, R2 или R4. Ароматическая циклическая группа может иметь от 1 до 5, предпочтительно от 1 до 3, подходящих заместителей в соответствующих положениях на кольце. Заместители могут также быть такими, как заместители, упомянутые для R1, R2 или R4. В частности, предпочтительным заместителем является аминотриазолил-замещенный амино. Гликозил группа для О-гликозил R5 предпочтительно является гексозой или ее производным. Гексоза включает D-глюкозу, D-фруктозу, D-маннозу, D-галактозу, L-галактозу и тому подобные. В качестве названного производного могут быть упомянуты деокси сахара (L- и D-фруктоза, D-хиновоза, L-рамноза, и т.д. ) и амино сахара (D-глюкозамин, D-галактозамин, и т.д.). Наиболее предпочтительными являются дезокси сахара (L- и D-фруктоза, D-хиновоза, L-рамноза, и т.д.). Еще более желательна L-рамноза. Заместитель на аминогруппе, которая может необязательно быть замещенной, R'5 включает, среди других, ацил, карбамоил, карбазоил, который может быть замещенный ацилом или амидино, который может быть моно- или ди-замещенный алкилом. Вышеупомянутый ацил и ацил для вышеупомянутого карбазоила, который может быть замещенный ацилом, включают никотиноил, фуроил, теноил и тому подобные. Упомянутая выше алкил составляющая моно- или диаламидино включает линейные или разветвленные алкилгруппы, содержащие от 1 до 4 атомов углерода, включающие т.о. метил, этил, пропил, изопропил, бутил, изобутил, втор-бутил и трет-бутил и тому подобные. Предпочтительный алкил составляющей является метил или этил. Заместитель для аминогруппы, которая может необязательно быть замещенной, R'6 включает алкил и амидино, который может необязательно быть моно- или ди-замещенный алкилом. Вышеупомянутый алкил и алкил моно- или диалкиламидино, упомянутый выше, включает те алкилгруппы, которые упомянуты для R'5. D-аминокислотный остаток R7 является предпочтительно D-аминокислотным остатком с 3-9 атомами углерода, такими как D-аланил, D-лейцил, D-валил, D-изолейцил, D-фенилаланил и тому подобные. Более предпочтительными являются D-аминокислотные остатки с 3-6 углеродными атомами, такие как D-аланил, D-валил и тому подобные. Наиболее предпочтительной разновидностью R7 является D-аланил. Низшая алкильная группа может быть алкильной группой, определенной для R'5. Наиболее предпочтительным видом Q является метил. Конкретными примерами R1 являются
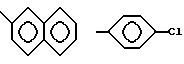
и тому подобные
Конкретными примерами R2 являются
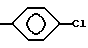
и тому подобные
Конкретными примерами R3 являются
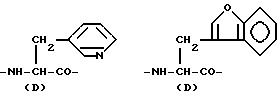
и тому подобные
Конкретными примерами R4 являются
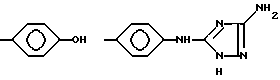
и тому подобные
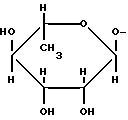
Конкретными примерами R5 являются
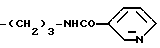
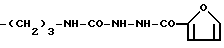
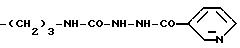
-(CH2)3-NH2
-(CH2)2-NH -CO-NH2
-(CH2)3-NH -CO-NH2
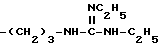
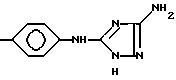
и тому подобные. Конкретными примерами R6 являются
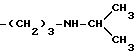
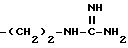
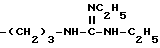
и тому подобные
Конкретными примерами R7 являются
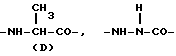
и тому подобные
Когда пептид [I] содержит один или более асимметрических углеводных атомов, существует два или более стереоизомеров. Любой из таких стереоизомеров равно, как и их смесь, находятся в рамках объема данного изобретения и приложенных пунктов. Пептид общей формулы [I] получают по существу известными способами. Типичные конкретные способы описаны в патенте США N 5110904. Пептид [I] может использоваться в форме соли, предпочтительно фармакологически приемлемой соли. В случае, когда пептид имеет основные группы, такие как амино, соль включает соли с неорганическими кислотами (например, соляной кислотой, серной кислотой, азотной кислотой, и тому подобными) или органическими кислотами (например, угольной кислотой, водородной угольной кислотой, янтарной кислотой, уксусной кислотой, пропионовой кислотой, трифторуксусной кислотой и т.д.). Когда пептид содержит кислотные группы, такие как карбоксил, соли с неорганическими основаниями (например, щелочные металлы, такие как натрий, калий, и т.д. и щелочноземельные металлы, такие как натрий, калий, и т.д., и щелочноземельные металлы, такие как кальций, магний и т.д.) или органическими основаниями (например, органические амины, такие как триэтиламин и основные аминокислоты, такие как аргинин). Пептид [I] может быть в форме комплексного соединения металла (например, комплекс меди, комплекс цинка, и т.д.). Предпочтительными солями пептида [I] являются соли с органическими кислотами (например угольной кислотой, hydrocarbonic (водородной угольной) кислотой, янтарной кислотой, уксусной кислотой, пропионовой кислотой, трифторуксусной кислотой, и т.д.). Наиболее предпочтительным является ацетат. Конкретными предпочтительными видами пептида [I] или соли являются следующие:
(1) NAcD2Nal-D4ClPhe-D3Pal-Ser-NMeTyr- DLys(Noc)-Leu-Lys(Nisp)-Pro-DAlaNH2 или его ацетат. (2) NAcD2Nal-D4ClPhe-D3Pal-Ser-NMeTyr-DLys (AzaglyNic)-Leu-Lys(Nisp)-Pro-DAlaNH2 или его ацетат. (3) NAcD2Nal-D4ClPhe-D3Pal-Ser-NMeTyr-DLys (AzaglyFur)-Leu-Lys(Nisp)-Pro-DAlaNH2 или его ацетат. (4) 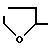 CONHCH2COD2Nal-D4ClPhe-D3Pal-Ser- NMeTyr-DLys(Noc)-Leu-Lys(Nisp)-Pro-DAlaNH2 или его ацетат. (5) NAcD2Nal-D4ClPhe-D3Pal-Ser-Tyr- DhArg(Et2)-Leu-hArg(Et2)-Pro-DAlaNH2 или его ацетат. В препарате замедленного высвобождения, соотношение пептида [I] может варьироваться, в частности, в зависимости от типа пептида, ожидаемого фармакологического эффекта и времени воздействия, и может находится в интервале приблизительно от 0,01% до 50% (вес/вес) относительно биоразлагаемого полимера. Предпочтительный интервал составляет приблизительно от 0,1 до 40% (вес/вес) и наиболее предпочтительный интервал составляет приблизительно от 1 до 30% (вес/вес). Приводим описание биоразлагаемого полимера, имеющего концевую карбоксильную группу. Биоразлагаемый полимер, приблизительно от 1 до 3 г растворили в смеси ацетона (25 мл) и метанола (5 мл) и, используя фенолфталеин в качестве индикатора, быстро оттитровали карбоксильные группы в растворе с помощью 0,05 и спиртового раствора гидроокси калия при перемешивании в условиях комнатной температуры (20oC). Затем рассчитали среднечисловой молекулярный вес на основании определения концевых групп, используя следующее уравнение. Определенный по концевым группам среднечисловой молекулярный вес = 20000 CONHCH2COD2Nal-D4ClPhe-D3Pal-Ser- NMeTyr-DLys(Noc)-Leu-Lys(Nisp)-Pro-DAlaNH2 или его ацетат. (5) NAcD2Nal-D4ClPhe-D3Pal-Ser-Tyr- DhArg(Et2)-Leu-hArg(Et2)-Pro-DAlaNH2 или его ацетат. В препарате замедленного высвобождения, соотношение пептида [I] может варьироваться, в частности, в зависимости от типа пептида, ожидаемого фармакологического эффекта и времени воздействия, и может находится в интервале приблизительно от 0,01% до 50% (вес/вес) относительно биоразлагаемого полимера. Предпочтительный интервал составляет приблизительно от 0,1 до 40% (вес/вес) и наиболее предпочтительный интервал составляет приблизительно от 1 до 30% (вес/вес). Приводим описание биоразлагаемого полимера, имеющего концевую карбоксильную группу. Биоразлагаемый полимер, приблизительно от 1 до 3 г растворили в смеси ацетона (25 мл) и метанола (5 мл) и, используя фенолфталеин в качестве индикатора, быстро оттитровали карбоксильные группы в растворе с помощью 0,05 и спиртового раствора гидроокси калия при перемешивании в условиях комнатной температуры (20oC). Затем рассчитали среднечисловой молекулярный вес на основании определения концевых групп, используя следующее уравнение. Определенный по концевым группам среднечисловой молекулярный вес = 20000  A/B A/B
где A соответствует массе биоразлагаемого полимера (г)
B представляет количество 0,05 н. спиртового раствора гидроокси калия (мл) пошедшее на титрование. Результат приведенного выше расчета дает среднечисловой молекулярный вес, определенный по концевым группам. В качестве иллюстрации, если взять полимер, имеющий концевую карбоксильную группу, синтезированный, например, из одной или более  --оксикислот по способу некаталитической дегидративной поликонденсации, то среднечисловой молекулярный вес, определенный по концевым группам, приблизительно равен средне-числовому молекулярному весу, найденному методом GPC. В противоположность этому, в случае полимера, практически не содержащего свободных концевых карбоксильных групп, полученного синтезом из циклического димера по способу полимеризационного раскрытия кольца и при использовании катализаторов, среднечисловой молекулярный вес, определенный по концевым группам, намного выше, чем среднечисловой молекулярный вес, определенный методом GPC. На основании этого различия, полимер, имеющий концевую карбоксильную группу, можно четко отличить от полимера, не имеющего концевую карбоксильную группу. Таким образом, используемый здесь термин биоразлагаемый полимер, имеющий концевую карбоксильную группу, означает биоразлагаемый полимер, показывающий существенное соответствие между среднечисловым молекулярным весом, определенным по методу GPC, и среднечисловым молекулярным весом, определенным по концевым группам. Тогда как среднечисловой молекулярный вес, определенный по концевым группам, является абсолютной величиной, среднечисловой молекулярный вес, определенный методом GPC, является относительной величиной, которая изменяется в зависимости от аналитических и технологических условий (таких как тип подвижной фазы и колонки, стандартное вещество, выбранная ширина слоя, выбранная нулевая линия, и т.д.). Поэтому два значения не могут быть численно скоррелированы на основании общих закономерностей. Однако термин "существенное соответствие" между среднечисловым молекулярным весом, определенным GPC, и среднечисловым молекулярным весом определенным по концевым группам, означает, что среднечисловой молекулярный вес, найденный по концевым группам, приблизительно в 0,4-2 раза, более предпочтительно приблизительно в 0,8-1,5 раза, наиболее желательно в 0,8-1,5 раза больше, чем среднечисловой молекулярный вес определенный методом. Термин "намного выше" в том смысле, как он использован ваше, означает, что среднечисловой молекулярный вес, определенный по концевым группам, приблизительно в два раза или более выше, чем среднечисловой молекулярный вес, определенный GPC. Предпочтительным полимером в целях настоящего изобретения является полимер, показывающий существенное соответствие между среднечисловым молекулярным весом, определенным GPC, и среднечисловым молекулярным весом, определенным по концевым группам. В качестве конкретных примеров биоразлагаемого полимера, имеющего концевую карбоксильную группу, могут быть упомянуты полимеры и сополимеры, равно как их смеси, которые синтезированы из одного или более видов --оксикислот по способу некаталитической дегидративной поликонденсации, то среднечисловой молекулярный вес, определенный по концевым группам, приблизительно равен средне-числовому молекулярному весу, найденному методом GPC. В противоположность этому, в случае полимера, практически не содержащего свободных концевых карбоксильных групп, полученного синтезом из циклического димера по способу полимеризационного раскрытия кольца и при использовании катализаторов, среднечисловой молекулярный вес, определенный по концевым группам, намного выше, чем среднечисловой молекулярный вес, определенный методом GPC. На основании этого различия, полимер, имеющий концевую карбоксильную группу, можно четко отличить от полимера, не имеющего концевую карбоксильную группу. Таким образом, используемый здесь термин биоразлагаемый полимер, имеющий концевую карбоксильную группу, означает биоразлагаемый полимер, показывающий существенное соответствие между среднечисловым молекулярным весом, определенным по методу GPC, и среднечисловым молекулярным весом, определенным по концевым группам. Тогда как среднечисловой молекулярный вес, определенный по концевым группам, является абсолютной величиной, среднечисловой молекулярный вес, определенный методом GPC, является относительной величиной, которая изменяется в зависимости от аналитических и технологических условий (таких как тип подвижной фазы и колонки, стандартное вещество, выбранная ширина слоя, выбранная нулевая линия, и т.д.). Поэтому два значения не могут быть численно скоррелированы на основании общих закономерностей. Однако термин "существенное соответствие" между среднечисловым молекулярным весом, определенным GPC, и среднечисловым молекулярным весом определенным по концевым группам, означает, что среднечисловой молекулярный вес, найденный по концевым группам, приблизительно в 0,4-2 раза, более предпочтительно приблизительно в 0,8-1,5 раза, наиболее желательно в 0,8-1,5 раза больше, чем среднечисловой молекулярный вес определенный методом. Термин "намного выше" в том смысле, как он использован ваше, означает, что среднечисловой молекулярный вес, определенный по концевым группам, приблизительно в два раза или более выше, чем среднечисловой молекулярный вес, определенный GPC. Предпочтительным полимером в целях настоящего изобретения является полимер, показывающий существенное соответствие между среднечисловым молекулярным весом, определенным GPC, и среднечисловым молекулярным весом, определенным по концевым группам. В качестве конкретных примеров биоразлагаемого полимера, имеющего концевую карбоксильную группу, могут быть упомянуты полимеры и сополимеры, равно как их смеси, которые синтезированы из одного или более видов  --окси кислот (например, гликолевая кислота, молочная кислота, оксимасляная кислота, и т.д.), оксикарбоновых кислот (например, лимонная кислота), и т.д. по реакции некаталитической дегидративной поликонденсации, поли-- --окси кислот (например, гликолевая кислота, молочная кислота, оксимасляная кислота, и т.д.), оксикарбоновых кислот (например, лимонная кислота), и т.д. по реакции некаталитической дегидративной поликонденсации, поли-- --цианоакриловых сложных эфиров, полиамино кислот (например, поли-- --цианоакриловых сложных эфиров, полиамино кислот (например, поли-- --бензил-L-глутаминовая кислота и т.д.), сополимеров малеинового ангидрида (например, сополимер стирола и малеиновой кислоты и т.д.) и тому подобных. По способу полимеризация может быть статистической, блочной или привитой. В случае, когда любая из вышеупомянутых --бензил-L-глутаминовая кислота и т.д.), сополимеров малеинового ангидрида (например, сополимер стирола и малеиновой кислоты и т.д.) и тому подобных. По способу полимеризация может быть статистической, блочной или привитой. В случае, когда любая из вышеупомянутых  --кислот, оксидикарбоновых кислот и окситрикарбоновых кислот имеют оптически активный центр в молекуле, могут использоваться любые D-, L- и DL-формы. Биоразлагаемый полимер, имеющий концевую карбоксильную группу, предпочтительно является биоразлагаемым полимером, включающим смесь (A) сополимера гликолевой кислоты и оксикарбоновой кислоты общей формулы II. --кислот, оксидикарбоновых кислот и окситрикарбоновых кислот имеют оптически активный центр в молекуле, могут использоваться любые D-, L- и DL-формы. Биоразлагаемый полимер, имеющий концевую карбоксильную группу, предпочтительно является биоразлагаемым полимером, включающим смесь (A) сополимера гликолевой кислоты и оксикарбоновой кислоты общей формулы II. 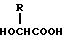
в которой R представляет алкилгруппу с 2-3 атомами углерода,
и (B) и полимолочной кислоты, или сополимера молочной кислоты - гликолевой кислоты. По отношению к общей формуле [II] линейные или разветвленные алкилгруппы с 2-3 атомами углерода, представленные P, включают, между прочих, этил, пропил, изопропил, бутил, изобутил, втор-бутил, трет-бутил, пентил, изопентил, неопентил, трет-пентил, 1-этилпропил, гексил, изогексил, 1,1-диметилбутил, 2,2-диметилбутил, 3,3-диметилбутил и 2-этилбутил. Среди них предпочтительными являются линейные или разветвленные алкилы с 2-5 атомами углерода. Особенно, этил, пропил, изопропил, бутил и изобутил предпочтительны. Оксикарбоновая кислота общей формулы II включает, среди прочих, 2-оксимасляную кислоту, 2-оксивалериановую кислоту, 2-окси-3-метилмасляную кислоту, 2-оксикапроновую кислоту, 2-оксиизокапроновую кислоту и 2-оксикапроновую кислоту. Предпочтительными являются 2- оксимасляная кислота, 2-оксивалериановая кислота, 2-окси-3-метилмасляная кислота и 2-оксикапроновая кислота. Наиболее предпочтительно оксикарбоновой кислотой общей формулы [II] являются 2-оксимасляная кислота. Хотя эти оксикарбоновые кислоты могут быть в форме D-, L- и D,L-соединений, D-/L-соотношение (мол.%) предпочтительно находится в интервале приблизительно от 75/25 до 25/75. Более предпочтительным вариантом воплощения изобретения является оксикарбоновая кислота с D-/L-соотношением (мол.%) в интервале приблизительно 60/40 до 40/60. Наиболее предпочтительной является оксикарбоновая кислота с D-/L-соотношением (мол.%) в интервале приблизительно от 55/45 до 45/55. По отношению к сополимеру гликолевой кислоты и названной оксикарбоновой кислоты общей формулы [II] (далее здесь упоминается как сополимер гликолевой кислоты) способ сополимеризации может быть статистическим, блочным или привитым. Предпочтительными являются статические сополимеры. Оксикарбоновые кислоты общей формулы [II] могут быть использованы отдельно или в комбинации. Предпочтительные соотношения гликолевой кислоты и оксикарбоновой кислоты [II] в названном сополимере гликолевой кислоты (A) составляют приблизительно от 10 до 75 мол.% и оставшиеся до 100% - оксикарбоновой кислоты. Более желательно, чтобы сополимер состоял приблизительно на 20-75 мол.% из гликолевой кислоты и в остальном из оксикарбоновой кислоты. Наиболее желательно, чтобы сополимер состоял приблизительно на 40-70% из гликолевой кислоты и в остальном из оксикарбоновой кислоты. Средневесовой молекулярный вес названного сополимера гликолевой кислоты может изменяться приблизительно от 2000 до 50000. Предпочтительный интервал составляет приблизительно от 3000 до 40000. Наиболее предпочтительный интервал составляет приблизительно от 8000 до 30000. Степень дисперсности (средневесовой молекулярный вес/среднечисловой молекулярный вес) предпочтительно находится в интервале приблизительно от 1,2 до 4,0. Особенно предпочтительными являются сополимеры со степенью дисперсности в интервале приблизительно от 1,5 до 3,5. Сополимер гликолевой кислоты (A) может быть синтезирован по известной методике, например, способом, описанным в выложенной заявке Японии N 28521/1986. Полимолочная кислота для применения в настоящем изобретении может быть L- или D-соединением и любой их смесью. Предпочтительными являются смеси с D-/L-соотношением (мол. %) в интервале приблизительно от 75/25 до 20/80. Наиболее предпочтительным является D-/L-соотношение (мол.%) полимолочной кислоты приблизительно от 60/40 до 25/75. Наилучшим соотношением D/L (мол.%) полимолочной кислоты является приблизительно от 55/45 до 25/75. Средневесовой молекулярный вес полимолочной кислоты находится предпочтительно в интервале от 1500 до 30000, наиболее предпочтительно от 2000 до 20000 и еще более желательно приблизительно от 3000 до 15000. Степень дисперсности полимолочной кислоты находится приблизительно от 1,5 до 3,5. Полимолочная кислота может быть синтезирована двумя известными альтернативными способами, а именно способом, включающим полимеризацию с раскрытием кольца лактида, который является димером молочной кислоты, и способом, включающим дегидративную поликонденсацию молочной кислоты. Для получения полимолочной кислоты сравнительно низкого молекулярного веса для применения в настоящем изобретении предпочтительным является способ, включающий прямую дегидративную поликонденсацию молочной кислоты. Этот способ описан, например, в выложенной заявке Японии 28521/1986. В фармакологической основе, применяемой в настоящем изобретении, сополимер гликолевой кислоты (A) и полимолочной кислоты (B) используется в (A)/(B) соотношении (по весу) приблизительно от 10/90 до 90/10. Предпочтительно соотношение смеси приблизительно 20/80 - 80/20. Наиболее желательное соотношение смеси составляет приблизительно от 30/70 до 70/30. Если доля либо (A), либо (B) слишком велика, конечный препарат будет показывать паттерн высвобождения лекарственного средства, незначительно отличающийся от паттерна, полученного при использовании отдельно либо (A), либо (B), что означает, что линейный паттерн высвобождения на последней стадии высвобождения, который достижим со смешанным основанием, не может быть получен. Степень и скорости выделения сополимера гликолевой кислоты и полимолочной кислоты значительно изменяются с их молекулярными весами и составом, но вообще говоря, поскольку скорости разложения и высвобождения сополимера гликолевой кислоты сравнительно высоки, период высвобождения может быть увеличен повышением молекулярного веса полимолочной кислоты или снижением соотношения смеси (A)/(B). Напротив, продолжительность высвобождения может быть сокращена снижением молекулярного веса полимолочной кислоты или увеличением (A)/(B) соотношения смеси. Кроме того, продолжительность высвобождения может регулироваться изменением вида или относительного количества оксикарбоновой кислоты общей формулы II. Когда в качестве биоразлагаемого полимера используется сополимер молочной кислоты и гликолевой кислоты, его полимеризационное отношение (молочная кислота/гликолевая кислота) (мол.%) предпочтительно приблизительно от 100/0 до 40/60. Наиболее желательно соотношение приблизительно от 90/10 до 50/50. Средневесовой молекулярный вес названного сополимера составляет предпочтительно от 5000 до 25000. Наиболее желательный интервал приблизительно от 7000 до 20000. Степень дисперсности (средневесовой молекулярный вес)/среднечисловой молекулярный вес) названного сополимера составляет предпочтительно от приблизительно 1,2 до 4,0. Более желательный интервал приблизительно от 1,5 до 3,5. Вышеупомянутый сополимер молочной кислоты и гликолевой кислоты может быть синтезирован по известной методике, например, по способу, описанному в выложенной заявке Японии 28521/86. Разложение и скорость исчезновения сополимера молочной кислоты и гликолевой кислоты значительно изменяется с составом и молекулярным весом, но вообще говоря, чем меньше доля гликолевой кислоты, тем ниже разложение и скорость исчезновения. Поэтому продолжительность высвобождения лекарственного средства может быть увеличена снижением доли гликолевой кислоты или увеличением молекулярного веса. Напротив, продолжительность высвобождения может быть уменьшена увеличением доли гликолевой кислоты или снижением молекулярного веса. Для получения препарата с длительным (например, 1-4 месяца) периодом замедленного высвобождения, предпочтительно использовать сополимер молочной кислоты и гликолевой кислоты с полимеризационным отношением, находящимся в вышеупомянутом интервале, и средневесовой молекулярный вес в упомянутом выше интервале. С сополимером молочной кислоты и гликолевой кислоты, имеющим более высокую скорость разложения, чем наблюдается для вышеупомянутых интервалов полимеризационного отношения и средневесового молекулярного веса, трудно контролироваться начальный импульс. Напротив, для сополимера молочной кислоты и гликолевой кислоты, показывающего более низкую скорость разложения, чем скорость для названных интервалов полимеризационного отношения и средневесовой молекулярный вес, возникает тенденция образования периодов, во время которых лекарственное средство не высвобождается в эффективном количестве. В настоящем описании средневесовой молекулярный вес и степень дисперсности означают молекулярный вес в отношении полистирола, определенный путем гельпроникающей хроматографии (GPC), использованием 9 полистиролов со средневесовыми молекулярными весами 120000, 52000, 22000, 9200, 5050, 2950, 1050, 580 и 162 в качестве стандартов и степень дисперсности, рассчитанную использованием полученного молекулярного веса, соответственно. Вышеприведенное определение проводили, используя GPC Колонку KF804 L 2 (Showa Denko), PI Монитор L-3300 (Hitachi) и хлороформ в качестве подвижной фазы. Препарат замедленного высвобождения настоящего изобретения получают растворением пептида [I] и биоразлагаемого полимера, имеющего концевую карбоксильную группу в растворителе, который является в основном несмешиваемым с водой, и затем удаляя названный растворитель. Растворитель, который в основном несмешиваем с водой, представляет собой растворитель, который не только по существу не смешивается с водой и способен к растворению биоразлагаемого полимера, но растворитель, который делает образовавшийся полимерный раствор способным к растворению пептида [I]. Предпочтительно, он является растворителем с растворимостью в воде не более 3% (вес/вес) при атмосферной температуре (20oC). Температура кипения такого растворителя предпочтительно не выше 120oC. Таким образом, растворитель включает галогенизированные углеводороды (например, дихлорметан, хлороформ, хлорэтан, трихлорэтан, четыреххлористый углерод и так далее), простые алкиловые эфиры с 3 или более углеродными атомами (например, изопропиловый эфир и т.д.), алкил жирной кислоты (из 4 углеродных атомов или больше), сложные эфиры (например, бутил ацетат и так далее), ароматические углеводороды (например, бензол, толуол, ксилол, и т.д.) и тому подобное. Эти растворители могут быть использованы в подходящей комбинации 2 или более разновидностей. Более желательными растворителями являются галогенизированные углеводороды (например, дихлорметан, хлороформ, хлорэтан, трихлорэтан, четыреххлористый углерод, и т.д.). Наиболее желателен дихлорметан. Удаление растворителя может быть выполнено по известным методикам. Например, способом, включающим упаривание растворителя при атмосферном давлении или при постепенном понижении давления с постоянным перемешиванием с помощью пропеллерной мешалки или магнитной мешалки, или способом, включающим упаривание растворителя при контролируемом понижении давления в роторном испарителе. Согласно способу изобретения для получения препарата замедленного высвобождения, растворение пептида [I] и биоразлагаемого полимера с концевой карбоксильной группой означает достижение таких условий, при которых в образовавшемся растворе отсутствует визуально наблюдаемый осадок нерастворившегося пептида при обычной температуре (20oC). В этой тройной системе, состоящей из пептида [I] , биоразлагаемого полимера и растворителя, количество пептида, которое может быть растворено, зависит от числа концевых карбоксильных групп на единицу веса биоразлагаемого полимера. В случае, когда пептид и концевая карбоксильная группа взаимодействуют в соотношении 1:1, теоретически может быть растворено такое же молярное количество пептида, как и количество концевой карбоксильной группы. Поэтому обобщение затруднено в связи с тем, что необходимо сочетать растворитель и молекулярный вес пептида и биоразлагаемого полимера. Однако, при получении препарата замедленного высвобождения пептид может быть растворен в интервале приблизительно от 0,1 до 100% (вес/вес), предпочтительно приблизительно от 1 до 70% (вес/вес), наиболее желательно приблизительно от 2 до 50% (вес/вес), относительно биоразлагаемого полимера, который растворяется в растворителе. Далее настоящее изобретение относится к способу получения препарата замедленного высвобождения, который включает растворение биоразлагаемого полимера, включающего смесь (A) сополимера гликолевой кислоты и оксикарбоновой кислоты общей формулы 2 (Showa Denko), PI Монитор L-3300 (Hitachi) и хлороформ в качестве подвижной фазы. Препарат замедленного высвобождения настоящего изобретения получают растворением пептида [I] и биоразлагаемого полимера, имеющего концевую карбоксильную группу в растворителе, который является в основном несмешиваемым с водой, и затем удаляя названный растворитель. Растворитель, который в основном несмешиваем с водой, представляет собой растворитель, который не только по существу не смешивается с водой и способен к растворению биоразлагаемого полимера, но растворитель, который делает образовавшийся полимерный раствор способным к растворению пептида [I]. Предпочтительно, он является растворителем с растворимостью в воде не более 3% (вес/вес) при атмосферной температуре (20oC). Температура кипения такого растворителя предпочтительно не выше 120oC. Таким образом, растворитель включает галогенизированные углеводороды (например, дихлорметан, хлороформ, хлорэтан, трихлорэтан, четыреххлористый углерод и так далее), простые алкиловые эфиры с 3 или более углеродными атомами (например, изопропиловый эфир и т.д.), алкил жирной кислоты (из 4 углеродных атомов или больше), сложные эфиры (например, бутил ацетат и так далее), ароматические углеводороды (например, бензол, толуол, ксилол, и т.д.) и тому подобное. Эти растворители могут быть использованы в подходящей комбинации 2 или более разновидностей. Более желательными растворителями являются галогенизированные углеводороды (например, дихлорметан, хлороформ, хлорэтан, трихлорэтан, четыреххлористый углерод, и т.д.). Наиболее желателен дихлорметан. Удаление растворителя может быть выполнено по известным методикам. Например, способом, включающим упаривание растворителя при атмосферном давлении или при постепенном понижении давления с постоянным перемешиванием с помощью пропеллерной мешалки или магнитной мешалки, или способом, включающим упаривание растворителя при контролируемом понижении давления в роторном испарителе. Согласно способу изобретения для получения препарата замедленного высвобождения, растворение пептида [I] и биоразлагаемого полимера с концевой карбоксильной группой означает достижение таких условий, при которых в образовавшемся растворе отсутствует визуально наблюдаемый осадок нерастворившегося пептида при обычной температуре (20oC). В этой тройной системе, состоящей из пептида [I] , биоразлагаемого полимера и растворителя, количество пептида, которое может быть растворено, зависит от числа концевых карбоксильных групп на единицу веса биоразлагаемого полимера. В случае, когда пептид и концевая карбоксильная группа взаимодействуют в соотношении 1:1, теоретически может быть растворено такое же молярное количество пептида, как и количество концевой карбоксильной группы. Поэтому обобщение затруднено в связи с тем, что необходимо сочетать растворитель и молекулярный вес пептида и биоразлагаемого полимера. Однако, при получении препарата замедленного высвобождения пептид может быть растворен в интервале приблизительно от 0,1 до 100% (вес/вес), предпочтительно приблизительно от 1 до 70% (вес/вес), наиболее желательно приблизительно от 2 до 50% (вес/вес), относительно биоразлагаемого полимера, который растворяется в растворителе. Далее настоящее изобретение относится к способу получения препарата замедленного высвобождения, который включает растворение биоразлагаемого полимера, включающего смесь (A) сополимера гликолевой кислоты и оксикарбоновой кислоты общей формулы
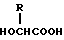
в которой R обозначает алкилгруппу из 2-8 углеродных атомов,
и (B) полимолочной кислоты и в значительной степени водонерастворимого физиологически активного пептида или его соли в растворителе, который в основном не смешивается с водой, и затем удаление названного растворителя. В значительной степени водонерастворимый физиологически активный пептид не является строго определенным и включает естественно-природные, синтетические и полусинтетические пептиды. Предпочтительны физиологически активные пептиды, содержащие одну или более ароматических групп (например, группы, являющиеся производными бензола, нафталина, фенантрена, антрацена, пиридина, пирола, индола, и т.д.) в боковых цепях. Более предпочтительными физиологически активными пептидами являются пептиды, имеющие 2 или более ароматических групп в боковых цепях. Особенно предпочтительны физиологически активные пептиды, имеющие 3 или более ароматических групп в боковых цепях. Эти ароматические группы могут быть дополнительно замещенные. Существенно водонерастворимым физиологически активным пептидом для применения в настоящем изобретении является предпочтительно пептид, обладающий растворимостью не более 1% в воде, состоящий из двух или более аминокислот и имеющий молекулярный вес приблизительно от 200 до 30000. Область более предпочтительного молекулярного веса составляет приблизительно от 300 до 20000 и еще более желательно приблизительно от 500 до 10000. В качестве примеров названных физиологически активных пептидов могут быть упомянуты антагонисты высвобождающего гормоны лютенизирующего гормона (LH-RH) (сравни патент США N 4.086.219, N 4.124.577, N 4.253.997 и N 4.317.815 и т.д.), инсулин, соматостатин, производные соматостатина (сравни патент США N 4.087.390, N 4.093.574, N 4.100.117, N 4.253.998 и т.д.), гормон роста пролактин, адренокортикотропный гормон (ACTH), меланоцит стимулирующий гормон (MSH), соли и производные гормона, высвобождающего тироидный гормон (сравни JP Kokai S-50-121273 и S-52-116465), тиреотропный гормон (TSH), лютенизирующий гормон (LH), фолликулостимулирующий гормон (FSH), вазопрессин, производные вазопрессина, окситоцин, кальцитонин, настрин, секретин, панкреозимин, холецистокинин, ангиотензин, человеческий плацентарный лактоген, человеческий хореонический гонадотропин (HCG), энкефарин, энкефалин, производные энкефалина (ср. патент США N 4.277.394, EP-A N 31.567), эндорфин, киотфин, туфтеин, тимопойэтин, тимозин, тимостимулин, тимический гуморальный фактор, ТГФ (THF), сывороточный тимический фактор, СТФ (FTS), и его производные (ср. патент США N 4.229.438), другие тимические факторы, опухолевый некрозный фактор (TNF), колониестимулирующий фактор (CSF), метилин, динорфин, бомбезин, нейротензин, церулеин, брадикинин, предсердный (натруретический) фактор, нервический фактор роста, фактор клеточного роста, нейротрофический фактор, пептиды, имеющие эндотелин антагонистическую активность (ср. EP-A N 436189, N 457195 и N 496452, JP Kokai H-3-94692 и 03-130299) и фрагменты производных этих физиологически активных пептидов. Конкретными примерами физиологически активного пептида являются физиологически активные пептиды и соли, которые являются антагонистами высвобождающего гормоны лютенизирующего гормона (LH-RН) и полезны для лечения заболеваний, связанных с гормональной зависимостью, таких как рак предстательной железы, гипертрофия предстательной железы, эндометриоз, миома матки, преждевременное половое созревание, рак молочной железы и т.д., и в качестве контрацептивов. Физиологически активный пептид для использования в настоящем изобретении может быть в форме соли, желательно фармакологически приемлемой соли. Когда названный пептид имеет основную группу, такую как амино, вышеупомянутая соль может быть, к примеру, солью с неорганической кислотой (например, хлористоводородной кислотой, серной кислотой, азотной кислотой и т.д.) или органической кислотой (например, угольной кислотой, водородной угольной кислотой, янтарной кислотой, уксусной кислотой, пропионовой кислотой, трифторуксусной кислотой и т.д.). Когда пептид имеет кислотную группу, такую как карбоксил, соль может, например, быть солью с неорганическим основанием (например, щелочные металлы, такие как кальций, магний и т.д.) или органическим основанием (например, органические амины, такие как триэтиламин и т.д., и основные аминокислоты, такие как аргинин и т.д.). Кроме того, пептид может быть в форме комплексного соединения металла (например, комплекса меди, комплекса цинка, и т.д.). Конкретные примеры физиологически активного пептида или его соли могут быть взяты в Патенте США N 5110904, Journal of Medicinal Chemistry 34, 2395-2402, 1991, Recent results in Cancer Research 124, 113-136, 1992, и другой литературе). Кроме того, среди других могут также быть упомянуты физиологически активные пептиды общей формулы [I] и их соли. Кроме того, даже когда физиологически активный пептид является водорастворимым, он может быть превращен в производное соединение, которое будет растворимым, или превращен в нерастворимую соль с водонерастворимой кислотой (например, памоевая кислота, дубильная кислота, стеариновая кислота, пальмитиновая кислота и т.д.) и использован в способе изобретения. Количество физиологически активного пептида в препаратах настоящего изобретения зависит от вида пептида, ожидаемого фармакологического эффекта и желаемой длительности действия и т.д. Однако, обычно, он используется в соотношении приблизительно от 0,001 до 50% (вес/вес), желательно приблизительно от 0,01 до 40% (вес/вес), наиболее желательно приблизительно от 0,1 до 30% (вес/вес), относительно биоразлагаемой полимерной основы. Используемый в способе растворитель является таким, как описано выше. Удаление растворителя может быть выполнено тем же способом, что описан выше. Предпочтительным способом получения препарата замедленного высвобождения настоящего изобретения является способ микрокапсуляции, использующий технологию высушивания в воде или технологию фазового разделения, которые описаны ниже, или любой аналогичный этому способ. Способ, описанный ниже, может выполняться с пептидом [I] или существенным образом водонерастворимым физиологически активным пептидом, который включает пептид [I]. Таким образом, пептид [I] добавляет к раствору биоорганического полимера в органическом растворителе в конечном весовом соотношении, упомянутом здесь ранее, для такого пептида, чтобы приготовить органический растворяющий раствор, содержащий пептид [I] и биоразлагаемый полимер. В связи с этим, концентрация биоразлагаемого полимера в органическом растворителе изменяется в соответствии с молекулярным весом биоразлагаемого полимера и типа органического растворителя, но обычно выбирается из интервала приблизительно от 0,01 до 80% (вес/вес). Предпочтительная область составляет приблизительно от 0,1 до 70% (вес/вес). Еще более желательный интервал приблизительно от 1 до 60% (вес/вес).
Затем этот раствор органического растворителя, содержащий пептид [I] и биоразлагаемый полимер (масляная фаза), добавляют к водной фазе для получения O (масляная фаза) /W (водная фаза) эмульсии. Растворитель масляной фазы затем упаривают для получения микрокапсул. Объем водной фазы для этого способа обычно выбирают из интервала приблизительно от 1- до 10000-кратного объема масляной фазы. Предпочтительный интервал составляет приблизительно от 2 до 5000-кратного и еще более желательно приблизительно от 5 до 2000-кратного. К упомянутой выше водной фазе может быть добавлен эмульгатор. Эмульгатором может обычно быть любое вещество, которое приводит к образованию стабильной O/W эмульсии. Т.о. здесь могут быть упомянуты анионные поверхностно-активные вещества (олеат натрия, стеарат натрия, лаурил сульфат натрия и т. д.), неионные поверхностно-активные вещества (полиоксиэтилен-сорбитан жирной кислоты сложный эфир /Твин 80 и Твин 60, Atlas Powder полиоксиэтилен-касторового масла производные /HCO-60 и HCO-50, Nikko Chemicals и т. д.), поливинилпирролидон, поливиниловый спирт, карбоксиметилцеллюлоза, лецитин, желатин, гиалуроновая кислота и т.д. Эти эмульгаторы могут быть использованы независимо или в комбинации. Концентрация может быть выбрана из интервала приблизительно от 0,001 до 20% (вес/вес). Предпочтительный интервал приблизительно от 0,01 до 10% (вес/вес) и еще более желательный интервал приблизительно от 0,05 до 5% (вес/вес). Образовавшиеся микрокапсулы выделяют центрифугированием или фильтрацией и промывают несколькими порциями дистиллированной воды для удаления свободного пептида, наполнителя эмульгатора с поверхности, затем повторно диспергируют в дистиллированной воде или тому подобной и лиофилизируют. Затем, если необходимо, микрокапсулы нагревают при пониженном давлении для дальнейшего удаления оставшейся воды и органического растворителя из внутренней части микрокапсул. Предпочтительно, этот способ осуществляют нагреванием микрокапсул при температуре несколько (5oC или более) выше срединной температуры стеклования биоразлагаемого полимера, определенной с помощью дифференциального сканирующего калориметра при инкрементах температуры от 10 до 20oC/мин, обычно не более 1 недели или 2-3 дней, предпочтительно не более 24 часов, затем капсулы достигают температуры мишени. При получении микрокапсул способом фазового разделения коацервирующий агент постепенно добавляют к раствору названного физиологически активного пептида и биоразлагаемого полимера в органическом растворителе с постоянным перемешиванием т. о., чтобы биоразлагаемый полимер мог быть отделен и превращен в твердый продукт. Этот коацервирующий агент добавляют в объеме приблизительно от 0,01 до 1000 кратного объема раствора в органическом растворителе пептида [I] и биоразлагаемого полимера. Предпочтительный интервал приблизительно от 0,05 до 500-кратного и еще более желательно приблизительно от 0,1 до 200-кратного. Коацервирующий агент должен быть соединением полимера типа минерального масла или растительного масла, которое смешивается с растворителем для биоразлагаемого полимера, но в то же время не растворяет полимер. В частности, могут быть упомянуты силиконовое масло, кунжутное масло, соевое масло, кукурузное масло, масло хлопкового семени, кокосовое масло, льняное масло, минеральное масло, н-гексен, н-гептан и т.д. Эти вещества могут быть использованы в комбинации. Образовавшиеся микрокапсулы выделяют фильтрацией и промывают повторно гептаном или тому подобным с целью удаления коацервирующего агента. Затем свободный пептид и растворитель удаляют по способу высушивания в воде, как описано ранее. В способе высушивания в воде или при коацервативном способе может быть добавлен ингибитор агрегации для предотвращения агрегации частиц. Ингибитор агрегации включает водорастворимые полисахариды, такие как маннитол, лактол, глюкоза, крахмал (например, кукурузный крахмал) и т.д., глицин, протеины, такие как фибрин, коллаген и т.д., и неорганические соли, такие как хлорид натрия, кислый фосфат натрия и тому подобные. В производстве микрокапсул способом распылительного высушивания названный органический растворяющий раствор пептида (I) и биоразлагаемого полимера впрыскивают в виде тумана через сопло и высушивающую камеру распылительного сушильного аппарата с целью выпаривания органического растворителя из мельчайших разделительных жидкий каплей за короткое время для получения мелких капсул. Сопло может быть двухжидкостным, пневматическим, вращающимся дисковым и т.д. Целесообразно в способе распылять водный раствор названного ингибитора агрегации из другого сопла с целью предотвращения межкапсульной агрегации во временном согласовании с названным распылением органического растворяющего раствора пептида (I) и биоразлагаемого полимера. При необходимости остаточная вода и органический растворитель удаляются нагреванием образовавшихся микрокапсул при пониженном давлении тем же способом, как описано здесь ранее. Микрокапсулы могут вводиться как они есть либо перерабатываться в разнообразные фармацевтические препараты для введения путями, отличными от перорального (например, внутримышечно, подкожно и инъекциями внутрь органа или как имплантаты, как назальные, ректальные или маточные трансмукозальные отпускающие системы и т.д.) или для перрорального введения (например, твердые препараты, такие как капсулы, например, жесткие капсулы, мягкие капсулы и т. д. ) гранулы, порошки и т.д. и жидкие препараты, такие как сиропы, эмульсии, суспензии и т.д.). Для получения микрокапсул для инъекции, например, микрокапсулы могут быть составлены с дисперсантом (например, сурфактант, такой как Твин 80, HCO-60 и т. д. , карбоксиметилцеллюлоза, полисахарид, такой как альгинат натрия и т.д.), консервантом (например, метилпарабен, пропилпарабен и т.д.), или вещества для получения изотонического раствора (например, хлористый натрий, маннитол, сорбитол, глюкоза, и т.д.) с целью приготовления водной суспензии или они могут быть диспергированы в растительном масле, таком как кунжутное масло, кукурузное масло или тому подобном, для получения масляной суспензии для применения в качестве инъекции с контролируемым высвобождением. Размер частиц микрокапсул для таких инъекционных суспензий должен быть в интервале, необходимом для того, чтобы они могли образовывать дисперсию, и определяемом необходимым пропускным оборудованием и может быть, например, в интервале приблизительно от 0,1 до 500,0 мкм. Предпочтительная область размера частиц составляет приблизительно от 1 до 300 мкм и еще более желательно приблизительно от 2 до 200 мкм. Для производства микрокапсул в виде стерильного продукта весь способ производства подвергается контролю на стерильность, микрокапсулы стерилизуют путем гамма-облучения или добавляют консервант, хотя эти методики не являются эксклюзивными. Помимо вышеупомянутых микрокапсул, для получения препарата замедленного высвобождения настоящего изобретения, биоразлагаемая полимерная композиция, содержащая пептид в качестве активного ингредиента, хорошо диспергированный подходящим способом, может быть сплавлена или спрессована в сферическую, полоскообразную, игольчатую форму, в форму гранул или форму пленки. Вышеупомянутая биоразлагаемая полимерная композиция может быть получена по методике, описанной в JP Publication S-50-17525. Конкретнее, пептидное лекарственное средство и полимер растворяют в растворителе и растворитель удаляют подходящим методом (например, распылительная сушка, мгновенное испарение, и т.д.) для получения заданной биоразлагаемой полимерной композиции. Препарат замедленного высвобождения настоящего изобретения может вводиться в качестве внутримышечной, подкожной инъекции или инъекции внутрь органов, или в качестве имплантата, как трансмукозальная отпускающая система для назальной полости, прямой кишки или матки, или пероральный препарат, например, твердый препарат, такой как капсула (например, жесткая или мягкая), гранула, порошок, и т.д., или жидкий препарат, такой как сироп, эмульсия, суспензия и т.д.. Препарат замедленного высвобождения настоящего изобретения имеет низкую токсичность и может быть использован успешно для млекопитающих (например, человека, коровы, свиньи, собак, кошки, мышей, крысы и кролика). Дозировка препарата замедленного высвобождения зависит от типа и процентного содержания активного лекарственного пептида, конечной дозированной формы, длительности высвобождения пептида, цели обработки (такая как гормонально-зависимые заболевания, например, рак предстательной железы, гипертрофия предстательной железы, эндометриоз, фиброма матки, преждевременное половое созревание, рак молочной железы и т. д., или для контрацепции) и конкретных видов животных, но в любом случае необходимо, чтобы эффективное количество пептида доставлялось непрерывно. Стандартная доза активного лекарственного пептида взятой в качестве приема системы доставки лекарства в течение одного месяца может быть выбрана преимущественно из интервала приблизительно от 0,01 до 100 мг/кг веса тела для взрослого человека. Предпочтительно интервал составляет приблизительно от 0,05 до 50 мг/кг веса тела. Наиболее желательный интервал составляет от 0,1 до 10 мг/кг веса тела. Кроме того, стандартная доза препарата замедленного высвобождения на взрослого человека может быть выбрана из интервала приблизительно от 0,1 до 500 мг/кг веса тела. Предпочтительный интервал составляет приблизительно от 0,2 до 300 мг/кг веса тела. Частота введения может, например, изменяться в зависимости от одного раза в несколько недель, месяцев или одного раза в несколько месяцев, и может быть выбрана в соответствии с типом и процентным содержанием активного лекарственного пептида, конечной дозированной формы, предполагаемой продолжительности высвобождения пептида, заболевания, которым управляют, и повергаемого лечению животного. Следующие справочные и рабочие примеры приведены с целью более детального описания изобретения и не должны рассматриваться как ограничивающие рамки объема изобретения и приложенных пунктов. (Если не оговорено особо, % означает весовой %). Используемые далее обозначения имеют следующие значения:
BOC - трет-бутоксикарбонил
FMOC - 9-фторенилметоксикарбонил
Cbz - бензилоксикарбонил
Справочный пример 1
В 1000 мл четырехгорлую колбу, снабженную трубкой для ввода азота и холодильником, внесли 300 г 90%-ного водного раствора D, L-молочной кислоты и 100 г 90%-ного водного раствора L-молочной кислоты и содержимое нагревали при пониженном давлении в токе газообразного азота от 100oC/500 мм Hg до 150oC/30 мм Hg в течение 4 часов с постоянным удалением дистиллятной воды. Далее реакционную смесь нагревали при пониженном давлении при 3-5 мм Hg /150-180oC в течение 7 часов, после чего ее охладили, получив полимолочную кислоту янтарного цвета. Этот полимер растворили в 1000 мл дихлорметана и раствор вылили в теплую воду при 60oC при постоянном перемешивании. Образовавшийся вязкий полимерный осадок собрали и высушили при пониженном давлении при 30oC. Средневесовой молекулярный вес и среднечисловой молекулярный вес, определенные GPC, и среднечисловой молекулярный вес, найденный путем определения концевых групп вышеупомянутой молочной кислоты, составили 3000; 1790 и 1297 соответственно. Эти данные показали, что полимер имел концевые карбоксильные группы. Справочный пример 2
В 1000 мл четырехгорлую колбу, снабженную трубкой для ввода азота и холодильником, внесли 500 г 90%-ного водного раствора D,L-молочной кислоты и содержимое нагревали при пониженном давлении в токе газообразного азота от 100oC/500 мм Hg до 150oC/30 мм Hg в течение 4 часов с постоянным удалением дистиллятной воды. Далее реакционную смесь нагревали при пониженном давлении при 3-5 мм Hg/150-180oC в течение 12 часов, после чего ее охладили, получив полимолочную кислоту янтарного цвета. Этот полимер растворили в 1000 мл дихлорметана и раствор вылили в теплую воду при 60oC при постоянном перемешивании. Образовавшийся вязкий полимерный осадок собрали и высушили при пониженном давлении при 30oC. Средневесовой молекулярный вес и среднечисловой молекулярный вес, определенные GPC, среднечисловой молекулярный вес, найденный путем определения концевых групп вышеупомянутой молочной кислоты, составили 5000; 2561 и 1830 соответственно. Эти данные показали, что полимер имел концевые карбоксильные группы. Справочный пример 3
В 1000 мл четырехгорлую колбу, снабженную трубкой для ввода азота и холодильником, внесли 300 г 90%-ного водного раствора D,L-молочной кислоты и 100 г 90%-ного водного раствора L-молочной кислоты и содержимое нагревали при пониженном давлении в токе газообразного азота от 100oC/500 мм Hg до 150oC/30 мм Hg в течение 5 часов с постоянным удалением дистиллированной воды. Далее реакционную смесь нагревали при пониженном давлении при 5-7 мм Hg/150-180oC в течение 18 часов, после чего ее охладили, получив полимолочную кислоту янтарного цвета. Этот полимер растворили в 1000 мл дихлорметана и раствор вылили в теплую воду при 60oC при постоянном перемешивании. Образовавшийся вязкий полимерный осадок собрали и высушили при пониженном давлении при 30oC. Средневесовой молекулярный вес и среднечисловой молекулярный вес, определенные GPC, среднечисловой молекулярный вес, найденный путем определения концевых групп вышеупомянутой молочной кислоты, составили 7500; 3563 и 2301 соответственно. Эти данные показали, что полимер имел концевые карбоксильные группы. Справочный пример 4
В 1000 мл четырехгорлую колбу, снабженную трубкой для ввода азота и холодильником, внесли 300 г 90%-ного водного раствора D,L-молочной кислоты и 100 г 90%-ного водного раствора L-молочной кислоты и содержимое нагревали при пониженном давлении в токе газообразного азота от 100oC/500 мм Hg до 150oC/30 мм Hg в течение 5 часов с постоянным удалением дистиллятной воды. Далее реакционную смесь нагревали при пониженном давлении при 5-7 мм Hg/150-180oC в течение 26 часов, после чего ее охладили, получив полимолочную кислоту янтарного цвета. Этот полимер растворили в 1000 мл дихлорметана и раствор вылили в теплую воду при 60oC при постоянном перемешивании. Образовавшийся вязкий полимерный осадок собрали и высушили при пониженном давлении при 30oC. Средневесовой молекулярный вес и среднечисловой молекулярный вес, определенные GPC, и среднечисловой молекулярный вес, найденный путем определения концевых групп вышеупомянутой молочной кислоты составили 9000; 3803 и 2800 соответственно. Эти данные показали, что полимер имел концевые карбоксильные группы. Справочный пример 5
В 1000 мл четырехгорлую колбу, снабженную трубкой для ввода азота и холодильником, внесли 182,5 г гликолевой кислоты и 166,6 D,L-2-сксимасляной кислоты и содержимое нагревали при пониженном давлении в токе газообразного азота от 100oC/500 мм Hg до 150oC/30 мм Hg в течение 3,5 часов с постоянным удалением дистиллятной воды. Далее реакционную смесь нагревали при пониженном давлении при 5-7 Hg 150-180oC в течение 26 часов, после чего ее охладили, получив сополимер гликолевой кислоты-2-оксимасляной кислоты янтарного цвета. Этот полимер растворили в 1000 мл дихлорметана и раствор вылили в теплую воду при 60oC при постоянном перемешивании. Образовавшийся вязкий полимерный осадок собрали и высушили при пониженном давлении при 25oC. Средневесовой молекулярный вес, определенный GPC, образовавшегося сополимера гликолевой кислоты-2-оксимасляной кислоты составил 13000. Справочный пример 6
В 1000 мл четырехгорлую колбу, снабженную трубкой для ввода азота и холодильником, внесли 197,7 гликолевой кислоты и 145,8 г D,L-2-оксимасляной кислоты и содержимое нагревали при пониженном давлении в токе газообразного азота от 100oC/500 мм Hg до 155oC/30 мм Hg в течение 4 часов с постоянным удалением дистиллированной воды. Далее реакционную смесь нагревали при пониженном давлении при 3-6 мм Hg/150-185oC в течение 27 часов, после чего ее охладили, получив сополимер гликолевой кислоты - 2-оксимасляной кислоты янтарного цвета. Этот полимер растворили в 1000 мл дихлорметана и раствор вылили в теплую воду при 60oC при постоянном перемешивании. Образовавшийся вязкий полимерный осадок собрали и высушили при пониженном давлении при 25oC. Средневесовой молекулярный вес, определенный GPC, образовавшегося сополимера гликолевой кислоты-2-оксимасляной кислоты составил 13000. Справочный пример 7
В 1000 мл четырехгорлую колбу, снабженную трубкой для ввода азота и холодильником, внесли 212,9 г гликолевой кислоты и 124,9 г D,L-2-оксимасляной кислоты и содержимое нагревали при пониженном давлении в токе газообразного азота от 100oC/500 мм Hg до 160oC/30 мм Hg в течение 3,5 часов с постоянным удаление дистиллятной воды. Далее реакционную смесь нагревали при пониженном давлении при 3-6 мм Hg/160-180oC в течение 27часов, после чего ее охладили, получив сополимер гликолевой кислоты-2-оксимасляной кислоты янтарного цвета. Этот полимер растворили в 1000 мл дихлорметана и раствор вылили в теплую воду при 60oC при постоянном перемешивании. Образовавшийся вязкий полимерный осадок собрали и высушили при пониженном давлении при 25oC. Средневесовой молекулярный вес, определенный GPC, образовавшегося сополимера гликолевой кислоты - 2- оксимасляной кислоты составил 11000. Справочный пример 8
В 1000 мл четырехгорлую колбу, снабженную трубкой для ввода азота и холодильником, внесли 300 г 90% водного раствора D,L-молочной кислоты и 100 г 90% водного раствора L-молочной кислоты и содержимое нагревали при пониженном давлении в токе газообразного азота от 100oC/500 мм Hg до 150oC/30 мм Hg в течение 4 часов с постоянным удалением дистиллированной воды. Далее реакционную смесь нагревали при пониженном давлении при 3-5 мм Hg и 150-180oC в течение 10 часов, после чего ее охладили, получив полимолочную кислоту янтарного цвета. Этот полимер растворили в 1000 мл дихлорметана и раствор вылили в теплую воду при 60oC при постоянном перемешивании. Образовавшийся вязкий полимерный осадок собрали и высушили при пониженном давлении при 30oC. Средневесовой молекулярный вес и среднечисловой молекулярный вес, определенные GPC, и среднечисловой молекулярный вес, найденный путем определения концевых групп, вышеупомянутой полимолочной кислоты, составили 4200; 2192 и 1572 соответственно. Эти данные показали, что полимер имел концевые карбоксильные группы. Справочный пример 9
В 1000 мл четырехгорлую колбу, снабженную трубкой для ввода азота и холодильником, внесли 182,5 г гликолевой кислоты и 166,6 D,L-2-оксимасляной кислоты и содержимое нагревали при пониженном давлении в токе газообразного азота от 100oC/500 мм Hg до 150oC/30 мм Hg в течение 3,5 часов с постоянным удалением дистиллированной воды. Далее реакционную смесь нагревали при пониженном давлении при 5-7 мм Hg и 150-180oC в течение 32 часов, после чего ее охладили, получив сополимер гликолевой кислоты-2-оксимасляной кислоты янтарного цвета. Этот полимер растворили в 1000 мл дихлорметана и раствор вылили в теплую воду при 60oC при постоянном перемешивании. Образовавшийся вязкий полимерный осадок собрали и высушили при пониженном давлении при 25oC. Средневесовой молекулярный вес и среднечисловой молекулярный вес, определенные GPC, и среднечисловой молекулярный вес, найденный путем определения концевых групп, образовавшегося сополимера гликолевой кислоты - 2 -оксимасляной кислоты составили 16300; 5620 и 2904 соответственно. Эти данные показали, что полимер имел концевые карбоксильные группы. Справочный пример 10
Синтез NacD2Nal-D4ClPhe-D3Pal-Ser-NMeTyr- DLys(AzaglyFur)-Leu-Lys(Nisp)-Pro-DAlaNH2
Справочные примеры 10 и 11 выполнены в соответствии с описанием патента США N 5.110.904 и патентной заявки США N 07/987.921. С целью синтеза названного в заглавии пептида в реактор аппарата для синтеза пептидов добавили 1 г D-Ala-NH-смолы (4-метил-бензогидриламин смола) и далее последовательно добавляли аминокислоты по следующей методике синтеза. 1. Реакция снятия защитных групп. Для удаления защитной BOC группы из альфа-аминокислоты пептида использовали раствор, содержащий 45% трифторуксусной кислоты (обозначена здесь позднее как TFA), 2,5% анизола, 2,0% диметил фосфита и 50,5% дихлорметана. После предварительного промывания смолы раствором в течение 1 минуты реакция по снятию защитной группы проводилась в течение 20 минут. 2. Промывание основным раствором. С целью удаления и нейтрализации трифторуксусной кислоты использовали раствор дихлорметана, содержащий 10% N,N'-диизопропилэтиламина. В каждой реакции по снятию защитной группы смолу промывали трижды по 1 минуте. 3. Реакция присоединения
Реакцию присоединения проводили, используя в качестве активаторов 3-кратное молярное количество 0,3 М диизопропилкарбодиимид/дихлорметан раствора и 3-кратное молярное количество 0,3 М раствора BOC производного аминокислоты /ДМФ (N,N-диметилформамида). Активированная аминокислота присоединялась к свободной альфа-аминогруппе пептида на смоле. Время взаимодействия приведено ниже. 4. Промывание
После завершения каждого реакционного процесса смолу промывали дихлорметаном, дихлорметаном/ДМФ и ДМФ, каждым в течение 1 минуты. Протокол синтеза
Аминокислоты с защищенными аминогруппами присоединялись к смоле в порядке, с частотой и в течение времени, указанных в табл.А. После завершения синтетической реакции смолу обрабатывали 30%-ным раствором пиперидина в ДМФ в течение от 4 до 24 часов с целью удаления защитной FMOC-группы. Смолу промывали несколько раз дихлорметаном и затем подвергали взаимодействию с карбонилдиимидазолом (0,9 г) растворенным в ДМФ (18 мл) в течение 15 минут и промывали трижды дихлорметаном, после чего оставляли на ночь реагировать с гидразидом 2-фуранкарбоновой кислоты (0,53 г), растворенным в ДМФ (18 мл). Образовавшуюся пептидную смолу промывали трижды дихлорметаном и затем высушили в присутствии пятиокиси фосфора за ночь, после чего смолу обрабатывали сухим фтористым водородом при 0oC в течение 1 часа в присутствии анизола, чтобы отделить пептид от смолы. Избыток взаимодействующего реагента удалили в условиях пониженного давления. Полученную таким образом смолу промывали сначала диэтиловым эфиром, затем перемешивали при комнатной температуре сначала диэтиловым эфиром, затем перемешивали при комнатной температуре в течение 15 минут в 50 мл смеси вода/ацетонитрил/уксусная кислота (1: 1: 0,1) и отфильтровывали. Фильтрат лиофилизировали, получив очищенный пептид в виде рыхлого порошка. Этот пептид очистили жидкостной хроматографией с высокими рабочими характеристиками (HP C), используя следующие условия:
1) Колонка: динамакс C-18 (25 2,5 см, 8 мкм) 2,5 см, 8 мкм)
2) Растворитель: ацетонитрильный градиент восхождения составляет 20 минут из смеси 89% воды/11% ацетонитрила/0,1% TFA
3) Определение при длине волны: 260 нм (УФ-метод)
Пептид, определенный по отдельному пику при 25,7 минутах времени удерживания, собрали и лиофилизировали, получив очищенный продукт NacD2Nal-D4ClPhe-D3Pal-Ser-NMeTyr-DLys(AzaglyFur)-Leu-Lys(Nisp)-Pro -DAlaNH2 в виде трифторацетата. Данные по физическим свойствам для очищенного продукта следующие:
FAB (быстрая бомбардировка атомами, такая же применена ниже) масс спектрометрия: m/e 1591 (M+H)+
Анализ аминокислот: 0,98 Ala, 1,02 Pro, 1,58 Lys, 1,00 Leu, 1,12 NMeTyr, 0,52 Ser. Вышеупомянутый трифторацетат пептида превратили в ацетат, используя колонку для гель-фильтрации, предварительно уравновешенную 1 н. уксусной кислотой. Условия гель-фильтрации следующие:
1) Надосадочный материал: Сефадекс G-25, внутренний диаметр колонки 16 мм, высота слоя насадки 40 мм)
2) Растворитель: 1 н. уксусная кислота
3) Определение при длине волны: 254 нм (УФ-метод). Фракция первого вымываемого пика была собрана и лиофилизована, что дало очищенный продукт NacD2Nal-D4ClPhe-D3Pal-Ser-NMeTyr- DLys(AzaglyFur)-Leu-Lys(Nisp)-Pro-DAlaNH2 в виде ацетата. Справочный пример 11
Синтез NAcD2Nal-D4ClPhe-D3Pal-Ser-NMeTyr-DLys (AzaglyNic)-Leu-Lys(Nisp)-Pro-DAlaNH2
Названный в заглавии пептид синтезировали по той же методике, что в Справочном примере 10, за тем исключением, что гидразид 2-фуранкарбоновой кислоты заменен на гидразид-2-никотиновой кислоты (0,575 г). Полученное при этом MPLC время удержания очищенного продукта составило 16,0 минут. Данные по физическим свойствам очищенного продукта следующие:
FAB масс-спектрометрия: m/e 1592 (M+H); анализ аминокислоты 1,02 Ala, 1,01 Pro, 1,61 Lys, 0,99 Leu, 1,12 NMeTyr, 0,48 Ser. Вышеприведенный трифторацетат пептида превратили в ацетат по приведенной выше методике Примера 10. Справочный пример 12
В 1000 мл четырехгорлую колбу, снабженную трубкой для ввода азота и холодильником, внесли 322 г 90% водного раствора D,L-молочной кислоты и 133 г гликолевой кислоты и используя накидной колбонагреватель (So-go Rikagaku Glass Co. ), содержимое нагревали при пониженном давлении в токе азота от 100oC/500 мм Hg до 150oC/30 мм Hg в течение 4 часов с постоянным удалением дистиллятной воды. Далее реакционную смесь нагревали при пониженном давлении при 3-30 мм Hg/150-185oC в течение 23 часов, после чего ее охладили, получив сополимер молочной кислоты-гликолевой кислоты. Этот полимер растворили в 1000 мл дихлорметана и раствор вылили в теплую воду при 60oC при постоянном перемешивании. Образовавшийся вязкий полимерный осадок собрали и высушили при пониженном давлении при 30oC. Средневесовой молекулярный вес и среднечисловой молекулярный вес, определенные GPC, и среднечисловой молекулярный вес, найденный путем определения концевых групп, образовавшегося сополимера молочной кислоты - гликолевой кислоты составили 10000; 4000 и 4000 соответственно. Эти данные показали, что сополимер имел концевые карбоксильные группы. Справочный пример 13
В 1000 мл четырехгорлую колбу, снабженную трубкой для ввода азота и холодильником, внесли 347 г 90%-ного водного раствора D,L-молочной кислоты и 266 г гликолевой кислоты, используя колбонагреватель (So-go Rikagaku Galss Co.), содержимое нагревали при пониженном давлении в токе азота от 100oC/500 мм Hg до 150oC/30 Hg мм в течение 5 часов с постоянным удалением дистиллятной воды. Далее реакционную смесь нагревали при пониженном давлении при 3-30 мм Hg/150-185oC в течение 23 часов, после чего ее охладили, получив сополимер молочной кислоты - гликолевой кислоты. Этот полимер растворили в 1000 мл дихлорметана и раствор вылили в теплую воду при 60oC при постоянном перемешивании. Образовавшийся вязкий полимерный осадок собрали и высушили при пониженном давлении при 30oC. Средневесовой молекулярный вес и среднечисловой молекулярный вес, определенные GPC, и среднечисловой молекулярный вес, найденный путем определения концевых групп, образовавшегося сополимера молочной кислоты - гликолевой кислоты составили 10000, 3700 и 3900 соответственно. Эти данные показали, что сополимер имел концевые группы. Пример 14
NAcD2Nal-D4ClPhe-D3Pal-Ser-NMeTyr- DLys(Nic)-Leu-Lys(Nisp)-Pro-DAlaNH2 (изготовлен путем TAP, далее здесь называется для краткости физиологически активным пептидом A) ацетат, 200 мг растворили в растворе смеси 50:50 (3,8 г) сополимера гликолевой кислоты - 2-оксимасляной кислоты, полученного в справочном примере 5, и полимолочной кислоты, полученной в справочной примере 1 в 5,3 г (4,0 мл) дихлорметана. Образовавшийся раствор охладили до 17oC и вылили в 1000 мл 0.1% (вес/вес) водного раствора поливинилового спирта (EG-40, Nippon Synthetic Chemical Industry Co., Ltd), предварительно доведенного до 10oC, и смесь эмульгировали, используя турбинный гомосмеситель при 7000 об/мин для приготовления O/W эмульсии. Эту O/W эмульсию перемешивали при комнатной температуре в течение 3 часов с целью упаривания дихлорметана. Масляной фазе дали затвердеть и собрали центрифугированием (05PR-22, Hitachi, Ltd) при 2000 об/мин. Этот твердый продукт повторно диспергировали в дистиллированной воде и дополнительно центрифугировали, чтобы смыть свободное лекарственное средство и т.д. Собранные микрокапсулы повторно диспергировали в небольшом количестве дистиллированной воды с последующим добавлением 0.3 г D-маннитола и подвергли сушке при температуре ниже точки замерзания для получения порошка. Распределение частиц по размерам и содержание физиологически активного пептида A для микрокапсул составили от 5 до 60 мкм и 4,7% (вес/вес) соответственно. Описанным выше способом изготовлены препараты следующих физиологически активных пептидов (1) и (2). (1) NAcD2Nal-D4ClPhe-D3Pal-Ser-NMeTyr- DLys(AzaglyNic)-Leu-Lys(Nisp)-Pro-DAlaNH2
(2) NAcD2Nal-D4ClPhe-D3Pal-Ser-NMeTyr- DLys(AzaglyFur)-Leu-Lys(Nisp)-Pro-DAlaNH2
Пример 15 В растворе 50:50 смеси (3,8 г) сополимера гликолевой кислоты-2-оксимасляной кислоты, полученного в Справочном примере 5, и полимолочной кислоты, полученной в Справочной примере 2 в 6,7 г (5,0 мл) дихлорметана, растворили 200 мг ацетата физиологически активного пептида A. Этот раствор охладили до 17oC и вылили в 1000 мл 0,1%-ного водного раствора поливинилового спирта, предварительно доведенного до 17oC, и смесь обработали как в примере 1 с целью получения микрокапсул. Распределение частиц по размеру и содержание физиологически активного пептида A для микрокапсул составили от 5 до 65 мкм в 5.0% (вес/вес) соответственно. Пример 16. В растворе 50:50 смеси (3,8 г) сополимера гликолевой кислоты - 2 - оксимасляной кислоты, полученного в Справочном примере 5, и полимолочной кислоты, полученной в справочном примере 3 в 6,7 г (5.0 мл) дихлорметана, растворили 200 мг ацетата физиологически активного пептида A. Этот раствор охладили до 17oC и вылили в 1000 мл 0,1%-ного водного раствора поливинилового спирта, предварительно доведенного до 17oC, и смесь обработали как в примере 1 с целью получения микрокапсул. Распределение частиц по размеру и содержание физиологически активного пептида A для микрокапсул составили от 10 до 60 мкм и 4,8% (вес/вес) соответственно. Пример 17. В растворе 50:50 смеси (3,8 г) сополимера гликолевой кислоты - 2-оксимасляной кислоты, полученного в справочном примере 5, и полимолочной кислоты, полученной в справочном примере 4 в 6,7 г (5,0 мл) дихлорметана, растворили 200 г ацетата физиологически активного пептида A. Этот раствор охладили до 17oC и вылили в 1000 мл 0,1%-ного водного раствора поливинилового спирта, предварительно доведенного до 17oC и смесь обработали как в примере 1 с целью получения микрокапсул. Распределение частиц по размеру и содержание физиологически активного пептида A для микрокапсул составили от 10 до 75 мкм и 4,6% (вес/вес) соответственно. Пример 18. В растворе 50:50 смеси (3,8 г) сополимера гликолевой кислоты - 2-оксимасляной кислоты, полученного в справочном примере 6, и полимолочной кислоты, полученной в справочном примере 2 в 6,0 г (4,5 мл) дихлорметана, растворили 200 г ацетата физиологически активного пептида A. Этот раствор охладили до 17oC и вылили в 1000 мл 0,1%-ного водного раствора поливинилового спирта, предварительно доведенного до 10oC, и смесь обработали как в примере 1 с целью получения микрокапсул. Распределение частиц по размеру и содержание физиологически активного пептида A для микрокапсул составили от 5 до 60 мкм и 4,9% (вес/вес) соответственно. Пример 19. В растворе 50:50 смеси (3,8 г) сополимера гликолевой кислоты - 2-оксимасляной кислоты, полученного в справочном примере 7, и полимолочной кислоты, полученной в справочном примере 2 в 6,0 г (4,5 мл) дихлорметана, растворили 200 г ацетата физиологически активного пептида A. Этот раствор охладили до 17oC и вылили в 1000 мл 0,1%-ного водного раствора поливинилового спирта, предварительно доведенного до 17oC и смесь обработали как в примере 1 с целью получения микросфер. Распределение частиц по размеру и содержание физиологически активного пептида A в микрокапсулах составили от 10 до 65 мкм и 4,9% (вес/вес) соответственно. Пример 20. В растворе 50:50 смеси (3,6 г) сополимера гликолевой кислоты - 2-оксимасляной кислоты, полученного в справочном примере 9, и полимолочной кислоты, полученной в справочном примере 8 в 7,0 г (5,3 мл) дихлорметана, растворили 400 г ацетата физиологически активного пептида A. Этот раствор охладили до 17oC и вылили в 1000 мл 0,1%-ного водного раствора поливинилового спирта, предварительно доведенного до 17oC, и смесь обработали как в примере 1 с целью получения микрокапсул. Распределение частиц по размеру и содержание физиологически активного пептида A для микрокапсул составили от 5 до 65 мкм и 7,2% (вес/вес) соответственно. Пример 21
240 мг ацетата NAcD2Nal-D4ClPhe-D3Pal-Ser-NMeTyr-DLys(AzaglyNic)- Leu-Lys(Nisp)-Pro-DAlaNH2 (далее называемого для краткости физиологически активным пептидом B), полученного в справочном примере 11, растворили в растворе 50: 50 смеси (1,76 г) сополимера гликолевой кислоты-2-оксимасляной кислоты, полученного в справочном примере 9, и полимолочной кислоты, полученной в справочном примере 8 в 3,2 г (2,4 мл) дихлорметана. Образовавшийся раствор охладили до 18oC и вылили в 400 мл 0,1%-ного водного раствора поливинилового спирта, предварительно доведенного до 16oC, и смесь обработали как в примере 1 с целью получения микрокапсул. Распределение частиц по размеру и содержание физиологически активного пептида B для микрокапсул составили от 5 до 70 мкм и 10,3% (вес/вес) соответственно. Пример 21
240 мг ацетата NAcD2Nal-D4ClPhe-D3Pal-Ser-NMeTyr-DLys(AzaglyFur)- Leu-Lys(Nisp)-Pro-DAlaNH2 (далее называемого для краткости физиологически активным пептидом C), полученного в справочном примере 10, растворили в растворе 50: 50 смеси (1,76 г) сополимера гликолевой кислоты-2-оксимасляной кислоты, полученного в справочном примере 9, и полимолочной кислоты, полученной в справочном примере 8 в 3,2 г (2,4 мл) дихлорметана. Образовавшийся раствор охладили до 18oC и вылили в 400 мл 0,1%-ного водного раствора поливинилового спирта, предварительно доведенного до 16oC и смесь обработали как в примере 1 с целью получения микрокапсул. Распределение частиц по размеру и содержание физиологически активного пептида C для микрокапсул составили от 5 до 65 мкм и 10,9% (вес/вес) соответственно. Пример 22
N-Тетрагидрофур-2-оил-Gly-D2Nal-D4ClPhe-D3Pal-Ser-NMeTyr- DLys(Nic)-Leu-Lys(Nisp)-Pro-DAlaNH2 (изготавливаемый в промышленности TAP; далее называемый здесь для краткости физиологически активным пептидом D) ацетат [FAB масс-спектрометрии: m/e 1647 (M+H)+], 240 мг, растворили в растворе 50:50 смеси (1,76 г) сополимера гликолевой кислоты-2-оксимасляной кислоты, полученного в справочном примере 9, и полимолочной кислоты, полученной в справочном примере 8 в 3,2 г (2,4 мл) дихлорметана. Образовавшийся раствор охладили до 18oC и вылили в 400 мл 0,1%-ного водного раствора поливинилового спирта, предварительно доведенного до 16oC, и смесь обработали как в примере 1 с целью получения микрокапсул. Распределение частиц по размеру и содержание физиологически активного пептида D для микрокапсул составили от 5 до 70 мкм и 10,5% (вес/вес) соответственно. Пример 23
200 мг ацетата физиологически активного пептида A добавили и растворили в растворе сополимера молочной кислоты-гликолевой кислоты (молочная кислота/гликолевая кислота = 75/25 (мол.%), GPC средневесовой молек. вес = 5000, GPC среднечисловой молек. вес. = 2000, среднечисловой молекулярный вес, определенный по концевым группам = 2200; производитель Wakо Pure Chemical (Lot. 920729)) в 5,3 г (4,0 мл) дихлорметана. Образовавшийся раствор охладили до 17oC и вылили в 1000 мл 0,1%-ного водного раствора поливинилового спирта (EG-40, Nippon Synthetic Chemical Industry Co., Ltd), предварительно доведенного до 16oC, и смесь эмульгировали, используя турбинный смеситель при 7000 об/мин для получения O/W эмульсии. Эту O/W эмульсию перемешивали при комнатной температуре в течение 3 часов для упаривания дихлорметана. Масляной фазе дали затвердеть и собрали с помощью центрифуги (05PR-22, Hitachi) при 2000 об/мин. Этот твердый продукт повторно диспергировали в дистиллированной воде и дополнительно центрифугировали для вымывания свободного лекарственного средства и т.д. Собранные микрокапсулы повторно диспергировали в небольшом количестве дистиллированной воды с последующим добавлением 0,3 г D-маннитола и подвергли сушке при температуре ниже точки замерзания для получения порошка. Распределение частиц по размеру и содержание физиологически активного пептида A для микрокапсул составили от 5 до 60 мкм и 4,7% (вес/вес) соответственно. Приведенным выше способом изготовлен препарат замедленного высвобождения следующих пептидов (1) и (2):
1) ацетат физиологически активного пептида B;
2) ацетат физиологически активного пептида C. Пример 24
200 мг ацетата физиологически активного пептида A добавили и растворили в растворе 3,8 г сополимера молочной кислоты-гликолевой кислоты (молочная кислота/гликолевая кислота = 75/25 (мол.%), GPC средневесовой молек. вес = 10000, GPC среднечисловой молек. вес = 4400, среднечисловой молек. вес, определенный по концевым группам, 4300; изготовитель Wako Pure Chemical (Lot. 880530)) в 6.7 г (5,0 мл) дихлорметана. Образовавшийся раствор охладили до 17oC и вылили в 1000 мл 0,1%-ного водного раствора поливинилового спирта, предварительно доведенного до 11oC. Затем повторили методику примера 11 с целью получения микрокапсул. Распределение частиц по размеру и содержание физиологически активного пептида А для микрокапсул составили от 5 до 65 мкм и 4,5% (вес/вес) соответственно. Пример 25
400 мг ацетата физиологически активного пептида A растворили в растворе сополимера молочной кислоты-гликолевой кислоты, полученного в справочном примере 12, 3,6 г в 8,0 г (6,0 мл) дихлорметана. Образовавшийся раствор охладили до 15oC и вылили в 1000 мл 0,1%-ного раствора поливинилового спирта, предварительно доведенного до 14oC. Далее, повторили методику примера 11 для получения микрокапсул. Распределение частиц по размеру и содержание физиологически активного пептида A для микрокапсул составили от 5 до 65 мкм и 8,2% (вес/вес) соответственно. Пример 26
400 мг ацетата физиологически активного пептида A растворили в растворе сополимера молочной кислоты-гликолевой кислоты, полученного в справочном примере 13, 3,6 г в 8,0 г (6,0 мл) дихлорметана. Образовавшийся раствор охладили до 15oC и вылили в 1000 мл 0,1%-ного раствора поливинилового спирта, предварительно доведенного до 15oC. После этого повторили методику примера 11 для получения микрокапсул. Распределение частиц по размеру и содержание физиологически активного пептида A для микрокапсул составили от 5 до 65 мкм и 8,4% (вес/вес) соответственно. Пример 27
Ацетат лейпролерина (изготовитель: Takeda Chemical Industries), 400 мг добавили к раствору того же сополимера молочной кислоты-гликолевой кислоты, который использован в примере 12, 3,6 г в 8,0 (6,0 мл) дихлорметана для приготовления прозрачного гомогенного раствора. Образовавшийся раствор охладили до 15oC и вылили в 1000 мл 0,1%-ного раствора поливинилового спирта, предварительно доведенного до 15oC. После этого повторили методику примера 11 для получения микрокапсул. Экспериментальный пример 28
Приблизительно 30 мг микрокапсул, полученных в примере 1, диспергировали в дисперсионной среде (раствор 2,5 мг карбоксиметилцеллюлозы, 0,5 мг полисорбата 80 и 25 мг маннитола в дистиллированной воде) и дисперсию впрыснули подкожно в спину 10-недельных самцов SD крыс, используя 22C-иглу (дозировка микрокапсул составляла 60 мкг/кг). Последовательно после введения крыс умерщвляли, остатки микрокапсул извлекали из участка введения и определяли количество физиологически активного пептида A в микрокапсулах. Результаты показаны в табл. 1. Экспериментальные примеры 29-33
Используя микрокапсулы, полученные в примерах 2-6, были определены остаточные количества физиологически активного пептида A также, как в экспериментальном примере 28. Результаты также показаны в табл. 1. Из табл. 1 ясно, что все микрокапсулы согласно изобретению характеризуются в значительной степени постоянным высвобождением физиологически активного пептида и кроме того, характеризуются значительной степенью свободы от начального импульса. Табл. 2 показывает модели линейной регрессии, коэффициенты корреляции и периоды высвобождения, рассчитанные как X-отрезок, отсекаемый на оси координат, которые определены по способу биопробы (автор Akira Sakuma, Tokyo University Press, June 5, 1978, p. 111)
Из табл. 2 ясно, что путем изменения средневесового молекулярного веса полимолочной кислоты, смешиваемой с сополимером гликолевой кислоты-2-оксимасляной кислоты, продолжительность высвобождения может легко контролироваться в интервале приблизительно от 3,5 недель до 11,5 недель. Табл. 3 показывает модели линейной регрессии, коэффициенты корреляции и периоды высвобождения как отрезок, отсекаемый кривой на оси X-координат, которые определены из данных табл. 1 тем же способом, что использован в табл. 2. Из табл. 3 ясно, что путем изменения мольной доли гликолевой кислоты в сополимере гликолевой кислоты-2-оксимасляной кислоты, продолжительность высвобождения может легко контролироваться в интервале приблизительно от 3,1 недель до 6,6 недель. Экспериментальные примеры 34-36
Используя микрокапсулы, полученные в примерах 34-36, остаточные количества физиологически активного пептида в микрокапсулах определили как в справочном примере 1, за тем исключением, что дозировка микрокапсул составляла приблизительно 30 мг/кг. Результаты показаны в табл. 4. Табл. 5 показывает модели линейной регрессии, коэффициенты корреляции и периоды высвобождения, рассчитанные как X-отрезок на оси координат, которые определены в данных табл. 4 по той же методике, что использована в табл. 2. Из табл. 4 и 5 ясно, что микрокапсулы согласно настоящему изобретению характеризуются в основном постоянным высвобождением физиологически активного пептида и, кроме того, характеризуются значительной степенью свободы от начального импульса. Экспериментальный пример 37
Использованием микрокапсул, полученных в примере 37, определены остаточные количества физиологически активного пептида также, как в Экспериментальном примере 34. Результаты показаны в табл. 6. Табл. 7 показывает модели линейной регрессии, коэффициенты корреляции и периоды высвобождения, рассчитанные как X-отрезки на оси координат, которые определены из данных табл. 6 по методике, использованной в табл. 2. Из табл. 6 и 7 ясно, что микрокапсулы согласно настоящему изобретению характеризуются в основном постоянным высвобождением физиологически активного пептида и, кроме того, характеризуются значительной степенью свободы от начального импульса. Экспериментальный пример 38
Около 30 мг капсул, полученных в примере 38, диспергировали в 0,5 мл дисперсионной среды (приготовленной растворением карбоксиметилцеллюлозы (2,5 мг), полисорбата 80 (0,5 мг) и маннитола (25 мг) в дистиллированной воде) и дисперсию впрыснули подкожно в спину 10-недельных самцов SD крыс, используя 22G иглу (дозировка микрокапсул составляла 60 мг/кг). Последовательно после введения крыс умерщвляли, остатки микрокапсул извлекали из участка введения и определяли количество физиологически активного пептида A в микрокапсулах. Результаты показаны в табл. 8. Экспериментальный пример 39
Используя микрокапсулы, полученные в примере 39, в остальном повторили методику экспериментального примера 38 и исследовали остаток физиологически активного пептида A. Результаты показаны в табл. 8. Экспериментальный пример 40
Используя микрокапсулы, полученные в экспериментальном примере 40, в остальном повторили методику экспериментального примера 38 и исследовали остаток физиологически активного пептида A. Результаты показаны в табл. 8. Экспериментальный пример 41
Используя микрокапсулы, полученные в примере 41, в остальном повторили методику экспериментального примера 38 и исследовали физиологически активный пептид A. Результаты показаны в табл. 8. Табл. 9 показывает модели линейной регрессии, коэффициенты корреляции и периоды высвобождения, как X-отрезки на оси координат, которые определены из данных табл. 8 по тем же методикам, что использованы в табл. 2. Из табл. 8 и 9 ясно, что препарат замедленного высвобождения согласно настоящему изобретению неизменно обеспечивает в значительной степени постоянное высвобождение пептида на различных отрезках времени. Пример сравнения 42
400 мг ацетата физиологически активного пептида A добавили в раствору сополимера молочной кислоты/гликолевой кислоты ((молочная кислота/гликолевая кислота = 50/50 (мол.%), GPC средневесовой молекул. вес = 58000, GPC среднечисловой молек. вес = 14000, среднечисловой молек. вес, определенный по концевым группам = 45000; производитель: Boehringer-Ingelheim (Lot. RG 505-05077), 3,6 г, в 33,2 г (25,0 мл) дихлорметана, но ацетат физиологически активного пептида A может быть не полностью растворенным. Пример сравнения 43
400 мг ацетата физиологически активного пептида A добавили к раствору сополимера молочной кислоты-гликолевой кислоты (молочная кислота/гликолевая кислота = 75/25 (мол.%), GPC средневесовой молекул. вес = 18000, GPC среднечисловой молек. вес = 8400, среднечисловой молек. вес, определенный по концевым группам = 30000; изготовитель: Boehringer-Ingelheim (Lot. RG 752-15057), 3,6 г, в 8,0 г (6,0 мл) дихлорметана, но физиологически активный пептид A может быть не полностью растворенным. Эту дисперсию охладили до 17oC и вылили в 1000 мл 0,1%-ного водного раствора поливинилового спирта, предварительного доведенного до 15oC для приготовления микрокапсул по той же методике, что описана в примере 38. Распределение частиц по размеру и содержание физиологически активного пептида A для микрокапсул составили от 10 до 90 мкм и 2,5% (вес/вес) соответственно. Пример сравнения 44
400 мг ацетата физиологически активного пептида A добавили к раствору сополимера молочной кислоты/гликолевой кислоты (молочная кислота/гликолевая кислота = 75/25 (мол.%), GPC средневесовой молек. вес = 58000. GPC среднечисловой молек. вес = 15000, среднечисловой молек. вес, определенный по концевым группам = 53000; изготовитель: Boehringer-Ingelheim (Lot. RG 755-05019), 3,6 г, в 21,1 г (16,0 мл) дихлорметана, но физиологически активный пептид A может быть не полностью растворен. Эту дисперсию охладили до 17oC и вылили в 1000 мл 0,1%-ного водного раствора поливинилового спирта, предварительного доведенного до 16oC с целью получения микрокапсул тем же способом, что в примере 38. Распределение частиц по размеру и содержание физиологически активного пептида A для микрокапсул составили от 10 до 90 мкм и 3,6% (вес/вес) соответственно. Как показывают примеры сравнения 42-44, пептид [I] настоящего изобретения не может быть успешно растворен с сополимером молочной кислоты-гликолевой кислоты, имеющим в основном не концевую карбоксильную группу. Пример сравнения 44
Ацетат лейпролерина (изготовитель: Takeda Chemical Industries) 400 мг, добавили к раствору того же самого сополимера молочной кислоты-гликолевой кислоты, что использован в примере сравнения 43, 3,6 г, в 8,0 г (6,0 мл) дихлорметана, но ацетат лейпролерина может быть не полностью растворен. Препарат замедленного высвобождения настоящего изобретения показывает постоянное высвобождение лекарственного средства, особенно пептид [I] на протяжении длительного времени, обеспечивая таким образом длительный и стабильный эффект. Кроме того, продолжительность высвобождения лекарственного средства легко можно контролировать и чрезмерное высвобождение непосредственно после введения можно ингибировать. В частности, гистамин-высвобождающая активность пептида [I] после введения препарата замедленного высвобождения ингибируется. Препарат замедленного высвобождения обладает прекрасной способностью к образованию дисперсии. Кроме того, препарат стабилен (например, по отношению к свету, нагреванию, влажности, окрашиванию) и низко токсичен, надежен при введении. В соответствии с предложенным в настоящем изобретении способом производства препарат замедленного высвобождения, содержащий фармакологически активный пептид, может быть легко получен с хорошим выходом. Полученный таким образом препарат замедленного высвобождения имеет гладкую поверхность и обладает прекрасной мобильностью.
Формула изобретения
Фармацевтическая композиция замедленного высвобождения, которая включает физиологически активный пептид и биоразлагаемый полимер, отличающийся тем, что в качестве физиологически активного пептида она содержит пептид общей формулы I
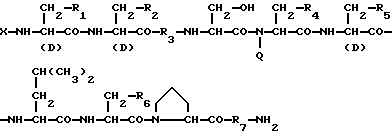
в которой X представляет собой ацилгруппу;
R1, R2 и R4 каждый представляет ароматическую циклическую группу;
R3 представляет D-аминокислотный остаток или группу формулы (II)
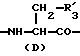
в которой 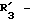 гетероциклическая группа; гетероциклическая группа;
R5 представляет группу формулы 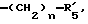 в которой n = 2 или 3, и в которой n = 2 или 3, и 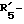 аминогруппу, которая необязательно может быть замещенной, ароматическую циклическую группу или O-гликозил; аминогруппу, которая необязательно может быть замещенной, ароматическую циклическую группу или O-гликозил;
R6 представляет группу формулы 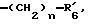 в которой n = 2 или 3, и в которой n = 2 или 3, и 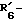 аминогруппу, которая может быть необязательно замещенной; аминогруппу, которая может быть необязательно замещенной;
R7 представляет D-аминокислотный или азаглицильный остаток;
Q - водород или низший алкил,
или его соль и в качестве биоразлагаемого полимера полимер, имеющий концевую карбоксильную группу, где значение среднего молекулярного веса этого полимера, определенного по концевым группам, от 0,4 до 2 раз больше, чем значение среднего молекулярного веса, определенного гельпроникающей хроматографией. 2. Композиция по п.1, отличающаяся тем, что содержит пептид формулы (I), где X - C2-C7-алканоил, необязательно замещенный 5- или 6-членной гетероциклической карбоксамидогруппой. 3. Композиция по п.2, отличающаяся тем, что X - C2-4-алканоил, необязательно замещенный тетрагидрофурилкарбоксамидогруппой. 4. Композиция по п.1, отличающаяся тем, что содержит пептид формулы I, где X - ацетил. 5. Композиция по п.1, отличающаяся тем, что в качестве биоразлагаемого полимера содержит смесь (А) сополимера гликолевой кислоты и оксикарбоновой кислоты общей формулы II
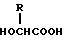
в которой R - алкил, содержащий от 2 до 8 атомов углерода;
и (В) полимолочной кислоты. 6. Композиция по п.1, отличающаяся тем, что содержит пептид формулы I, где X - ацетил, а в качестве биоразлагаемого полимера - смесь (А) сополимера гликолевой кислоты и оксикарбоновой кислоты общей формулы II
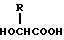
в которой R - алкил, содержащий от 2 до 8 атомов углерода,
и (В) полимолочной кислоты. 7. Композиция по п.5, отличающаяся тем, что сополимер имеет средневесовую молекулярную массу 2000 - 50000, определенную методом гельпроникающей хроматографии (ГПХ). 8. Композиция по п. 5, отличающаяся тем, что сополимер имеет степень дисперсности 1,2 - 4,0. 9. Композиция по п.5, отличающаяся тем, что полимолочная кислота имеет средневесовую молекулярную массу 1500 - 30000, определенную методом ГПХ. 10. Композиция по п.5, отличающаяся тем, что полимолочная кислота имеет степень дисперсности 1,2 - 4,0. 11. Композиция по п.1, отличающаяся тем, что в качестве биоразлагаемого полимера содержит сополимер молочной кислоты и гликолевой кислоты. 12. Композиция по п.11, отличающаяся тем, что сополимер имеет средневесовую молекулярную массу 5000 - 25000, определенную методом ГПХ. 13. Композиция по п.11, отличающаяся тем, что сополимер имеет степень дисперсности 1,2 - 4,0. 14. Композиция по п. 1, отличающаяся тем, что содержит физиологически активный пептид в интервале 0,01 - 50% (вес/вес) относительно содержания биоразлагаемого полимера. 15. Композиция по п.1, отличающаяся тем, что физиологически активным пептидом является LH - RH - антагонист. 16. Композиция по п.1, отличающаяся тем, что в качестве физиологического активного пептида содержит пептид, представляющий собой
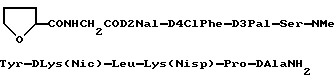
или его ацетат. 17. Композиция по п.1, отличающаяся тем, что в качестве физиологически активного пептида содержит пептид, представляющий собой NAcD2Nal-D4ClPhe-D3Pal-Ser-NMeTyr-DLys(Nic)-Leu-Lys(Nisp)-Pro-DAlaNH2, или его ацетат. 18. Композиция по п.1, отличающаяся тем, что в качестве физиологически активного пептида содержит пептид, представляющий собой NAcD2Nal-D4ClPhe-D3Pal-Ser-Tyr-DhArg(Et2)-Leu-hArg(Et2)-Pro-DAlaNH2, или его ацетат. 19. Способ получения фармацевтической композиции замедленного высвобождения, отличающийся тем, что растворяют физиологически активный пептид общей формулы
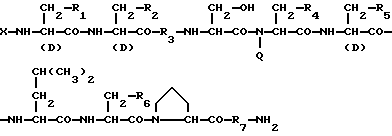
в которой X представляет собой ацилгруппу;
R1, R2 и R4 каждый представляет ароматическую циклическую группу;
R3 представляет D-аминокислотный остаток или группу формулы
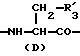
в которой 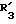 обозначает гетероциклическую группу; обозначает гетероциклическую группу;
R5 представляет группу формулы 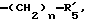 в которой n = 2 или 3 и в которой n = 2 или 3 и 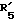 является аминогруппой, которая может быть необязательно замещенной ароматической циклической группой или O-гликозилгруппой; является аминогруппой, которая может быть необязательно замещенной ароматической циклической группой или O-гликозилгруппой;
R6 представляет группу формулы 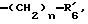 в которой n = 2 или 3 и в которой n = 2 или 3 и 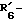 является аминогруппой, которая может быть необязательно замещенной; является аминогруппой, которая может быть необязательно замещенной;
R7 представляет D-аминокислотный остаток или азаглицил остаток;
Q обозначает водород или низшую алкильную группу,
или его соли и биоразлагаемый полимер, имеющий концевую карбоксильную группу, где значение среднего молекулярного веса, определенного по концевым группам, от 0,4 до 2 раза больше, чем значение среднего молекулярного веса, определенного гельпроникающей хроматографией, в несмешивающемся с водой растворителе с последующим удалением растворителя. 20. Способ по п.19, отличающийся тем, что биоразлагаемый полимер является смесью (A) сополимера гликолевой кислоты и оксикарбоновой кислоты общей формулы II
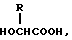
в которой R - алкил, содержащий 2 - 8 атомов углерода,
и (B) полимолочной кислоты. 21. Способ по п.19, отличающийся тем, что растворяют пептид формулы I, где X - ацетил, и биоразлагаемый полимер, который представляет собой смесь (A) сополимера гликолевой кислоты и гидроксикарбоновой кислоты формулы II
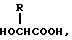
в которой R - алкил, содержащий 2 - 8 атомов углерода,
и (B) полимолочной кислоты. 22. Способ по п.19, отличающийся тем, что биоразлагаемый полимер представляет собой сополимер молочной и гликолевой кислот. 23. Способ по п.19, отличающийся тем, что используют не растворимый в воде физиологически активный пептид, а перед удалением растворителя получают эмульсию типа "масло в воде" путем добавления полученного раствора к водной среде. 24. Способ получения фармацевтической композиции замедленного высвобождения, отличающийся тем, что растворяют биоразлагаемый полимер, включающий смесь (A) сополимера гликолевой кислоты и гидрокарбоновой кислоты общей формулы II
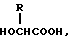
где R представляет алкил, содержащий 2 - 8 атомов углерода,
и (B) полимолочной кислоты при значении среднего молекулярного веса этих полимеров, определенного по концевым группам, от 0,4 до 2 раз больше, чем значение среднего молекулярного веса, определенного гельпроникающей хроматографией, и не растворимого в воде физиологически активного пептида общей формулы I
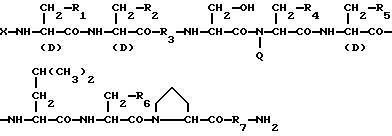
в которой X представляет собой ацилгруппу;
R1, R2 и R4 каждый представляет ароматическую циклическую группу;
R3 представляет D-аминокислотный остаток или группу формулы (2)
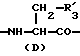
в которой 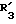 гетероциклическая группа; гетероциклическая группа;
R5 представляет группу формулы 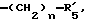 в которой n = 2 или 3 и в которой n = 2 или 3 и 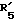 аминогруппу, которая необязательно может быть замещенной, ароматическую циклическую группу или O-гликозил; аминогруппу, которая необязательно может быть замещенной, ароматическую циклическую группу или O-гликозил;
R6 представляет группы формулы  в которой n = 2 или 3, и в которой n = 2 или 3, и 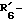 аминогруппу, которая может быть необязательно замещенной; аминогруппу, которая может быть необязательно замещенной;
R7 представляет D-аминокислотный или азаглицильный остаток;
Q - водород или низший алкил;
или его соли в растворителе, не смешивающемся с водой, и удаляют растворитель. 25. Способ по п.24, отличающийся тем, что образовавшийся раствор перед удалением растворителя добавляют к водной среде для получения эмульсии типа "масло в воде". Приоритет
07.12.93. по п.1 - 3, 5, 7 - 14, 16, 18 - 20, 22, 24 и 25;
07.12.92 по п.4, 6, 17, 21 и 23
05.02.93 по п.15. |