
СПИСОК ПАТЕНТОВ С УПОМИНАНИЕМ ГИАЛУРОНОВОЙ КИСЛОТЫ
-
- 2017751 Способ получения гиалурона
- 2192150 БАД для профилактики йодной недостаточности
- 2112542 Препарат для лечения патологий соединительных тканей
- 2225206 Препарат для лечения рака молочной железы
- 2299733 Лечение опорно-двигательного аппарата
- 2299732 Способ лечения глаукомы
- 2299726 Противоинфекционная губная помада
- 2299725 Косметическое средство для ухода за кожей
- 2198878 Ароматическое соединение
- 2198702 Способ подготовки трофических язв к аутодермапластике
- 2198653 Вагинальные суппозитории
- 2197946 Композиция для ухода за волосами
- 2197923 Фармацевтическая композиция для лечения отеков роговицы
- 2298410 Биотрансплантант и способ лечения ревматических и аутоиммунных заболеваний
- 2197501 Фотоотверженный гель на основе сшитой гиалуроновой кислоты
- 2197228 Твердые лекарственные формы
- 2197222 Водная компазиция для ухода за волосами, лица и тела
- 2297425 Полипептиды
- 2297240 Композиция с гиалуроновой кислотой
- 2297230 Фармацевтическая компазиция с ксантоновой смолой
- 2196588 Глазные капли
- 2195955 Применение биологически активных веществ
- 2195926 Дерматологические композиции
- 2295954 Микрочастицы для доставки нуклеиновых кислот
- 2295951 Косметика для ухода за кожей лица и век
- 2195262 Фармакологическое средство на основе гиалуроновой кислоты
- 2194512 Способ профилактики и коррекции процесса старения кожи
- 2194478 Лечение экземы
- 2294716 Расширяемый стент
- 2194055 Сшитые сополимеры
- 2099350 Ассоциаты депротонированной гиалуроновой кислоты
- 2293557 Средство для лечения кожи и слизистых
- 2292878 Приготовление микроцастиц, содержащих метопропол
- 2292746 БАД
- 2192256 Защита кишечника
- 2191782 Получение модифицированной гиалуроновой кислоты
- 2292219 Паратиреоидный гормон человека
- 2291686 Микроцастицы
- 2191000 Косметическая маска
- 2290921 Фармацевтические и косметические средства против старения кожи
- 2290900 Модифицированный биоматериал для использования в офтальмологии
- 2290899 Получение биоматерьяла
- 2290397 Новые инданилиденовые соединения
- 2290186 Лечение сирингомиелии
- 2288702 Иррингационный раствор для офтальмологии
- 2288699 Гель для лечения стоматологических заболеваний
- 2188011 Активирующая остеогенез фармацевтическая композиция
- 2187327 Средство с антисептиком
- 2187325 Средство с радиопротекторным действием
- 2287330 Композиции миноксидила
- 2186786 Способ получения гиалуроновой кислоты
- 2186593 Лечение раненого процесса кожи
- 2286801 Очищение воды
- 2286781 Лечение ожогов пищевода у детей
- 2286764 Средство лечения воспалений полости рта
- 2185840 Лечение инфекционных заболеваний
- 2286151 Альфа-2-Дельта-Лиганда
- 2185149 Ранозаживляющий гель
- 2285527 Лечение ИЛ-6 заболеваний
- 2184448 Раствор хранения роговицы, включающий гиалуроновую кислоту
- 2090179 Крем для кожи
- 2183961 Способ лечения кожи
- 2284331 Соли алифотических аминов
- 2284187 Производные амида
- 2089191 Снизить внутрение давление
- 2283320 Получение гликозаминогликанов
- 2283129 Лечение опухолей
- 2283098 Косметические средства с Q
- 2182574 Ароматические соединения
- 2088257 Средство с гипохолестеролемическим действием
- 2088218 Состав для гигиенических салфеток
- 2088206 Способ получения препарата, создающего исскуственный загар
- 2282462 Противомикробные средства
- 2182008 Интровагинальная компазиция
- 2181999 Препарат с отсроченным высвобождением
- 2181998 Новые композиции липидов
- 2181995 Лечение болевого синдрома
- 2181295 Вирионная вакцина
- 2087144 Витамин Е
- 2379336 Способ стирки
- 2379052 Вакцинация
- 2180855Композиция в виде ионного комплекса
- 2379025 Противоинфекционный гель
- 2180825 Лечение травм роговицы
- 2281082 Способ коррекции эстетических и возрастных проблем кожи
- 2180576 Биоактивная добавка для косметических средств
- 2280459 Средство для изменения скорости роста или репродукции клеток
- 2179981 Соли переходного металла
- 2378010 Жидкие вакцины
- 2378008 Комбинированные вакцины
- 2378007 Анаболическое средство
- 2377973 Растительные экстракты
- 2280041 Способ получения водорастворимых комплексов гиалурил
- 2280038 Биополимеры
- 2323733 Йодный обмен
- 2377260 Гель
- 2178693 Противовирусное средство на основе гиалуроновой кислоты
- 2178692 Облегчающие зуд косметическое средство
- 2377022 Гемостатические спреи
- 2376982 Увлажняющая сыворотка для лица
- 2376974 Трансдермальный гель для лица
- 2362784 Гипо-и гиперацетилированные менингокковые капсульные сахариды
- 2177789 Устройство для доставки лекарства к шейке матки
- 2277954 Крем для лица омолаживающий
- 2376378 Способ получения метионина
- 2177332 Биоматериал для предотвращения послеоперационных спаек, с производной гиалуроновой кислотой
- 2177310 Способ получения таблеток
- 2376011 Средство для позвоночника
- 2277410 Косметическое средство
- 2323748 Медицинская повязка
- 2276998 Гидрогелевые композиции
- 2082416 Способ получения препарата с коллагенном из животного сырья
- 2375081 Адсорбирующее изделие
- 2375049 Охлаждающий пластырь
- 2346049 Способ получения гиалурона
- 2275913 Фармацевтические средства
- 2174985 Полисахарид с антиоксидантом
- 2373957 Носитель для лекарственных средств и биологически активных веществ
- 2373941 Способ коррекции возрастных и патологических изменений кожных покров
- 2174845 Композиции и способы доставки генетического материала
- 2174830 Средство для укрепления волос
- 2373769 Синбиотическая композиция
- 2274472 Лечение апорно-двигательного аппарата и болевых синдромов
- 2372929 Профилактическая композиция на основе веществ фенольной природы в липосомной форме
- 2173563 Способ нанесения на поверхность предметов покрытия на основе гиалуроновой кислоты, её производных и полусинтетических полимеров
- 2079304 фармацевтическая композиция, обладающая иммуносупрессорной и антимикробной активностью
- 2273645 Полипептид ожирения
- 2173154 Фракция кератансульфатолигосахаридов и содержащий ее фармацевтический препарат
- 2173136 Грязная мазь
- 2173128 Способ хирургического лечения центральных разрывов сечатки
- 2078561 Косметическое средство предотвращающее старение кожи
- 2172490 Способ прогнозирования воспалительных заболеваний молочной железы при эндопластике
- 2272645 Способ лечения ЦМВ-Инфекции у детей раннего возроста
- 2272636 Фармацевтическая композиция для местного лечения воспаления
- 2272635 Фармацевтически активная субстанция для офтальмологии
- 2272599 Биоматерьял для стабилизации прогрессирующей миопии "Коллаплант"
- 2172168 Средство для заживления ран на основе гиалуроновой кислоты
- 2371172 Фармацевтическая композиция для лечения нервной системы на основе стефаглабрина
- 2171470 Способ прогнозирования послеоперационной трансформации доброкачественных опухолей нервной системы
- 2077317 Состав для ванн
- 2271213 Комбинированные композиции, содержащие экстракты из растений и морских животных
- 2076872 Способ получения окрашенной гиалуроновой кислоты
- 2076671 Раствор для защиты роговицы
- 2370281 Конъюгаты гидроксиалкилкрахмал
- 2370275 Способ лечения (коррекции) косметических и возрастных дефектов кожи
- 2370258 Фармацевтическая композиция для парентальной доставки в форме лиофилизата
- 2270023 Способ экстракции и очистки протеогликана хрящего типа (варианты)
- 2369408 Гемостатическая композиция, включающая гиалуроновую кислоту
- 2369387 Фармацевтическая композиция для лечения нервной системы
- 2369379 Нетаблитированные жевательные формы для индивидуального введения
- 2169136 Производное коричной кислоты
- 70792 Медицинский аппликатор
- 20741717 Способ стабилизации аскорбиновой кислоты
- 2074712 Способ получения препарата, препятствующего преждевременной эякуляции
- 2367954 Способ прогнозирования развития кожной патологии у женщин с синдромом склерополикистозных яичников (СПКЯ)
- 2268075 Устройство для электрокинетической доставки
- 2268052 Средство для лечения воспалительных и дегенеративных заболеваний суставов
- 2167649 Способ получения твердой дисперсии умеренного водорастворимого лекарственного вещества
- 2167647 Гель для бритья
- 2073520 Лечение урологических инфекций
- 2367476 Биопластический материал
- 2367475 Мембрана для использования при направленной регенерации тканей
- 2367469 Фармацевтическая композиция на основе лизоамидазы
- 2367456 Фармацевтическая композиция обладающая антибактериальным и некролитическим действием
- 2367455 Фармацевтическая композиция обладающая некролитическим и антибактериальным действием
- 2267324 Применение антиадгезивных углеводов, препарат для уменьшения и /или блокирования адгезии патогенных веществ
- 2166934 Композиции включающие биологический агент
- 2166510 Псевдодипептиды
- 2366460 Композиции, имеющие высокую противовирусную и антибактериальную активность
- 2360901 Производные феноксиуксусной кислоты
- 2165749 Способ восстановления эндотелия роговицы
- 2265441 Способ укрепления склеры
- 2365382 Композиции и способы для регуляции развития сосудов
- 2070879 Соли гликозаминогликанов
- 2164914 Циклические и гетероциклические N - замещенные - иминогидроксамовые карбоновые кислоты
- 2264627 Хламидийный конъюктивит
- 2364399 Фармацевтический препарат на основе стефаглабрина
- 2264230 Препарат с замедленным высвобождением активного вещества
- 2363497 Фармацевтические композиции
- 2363496 Способ увеличения объема мягких тканей
- 2363473 Способ антифлогистической активации в эксперементе
- 2363461 Фармацевтический препарат на основе сигетина
- 2363459 Средства для введения в роговицу глаз для предотвращения офтальмологических нарушений
- 2363448 Фармацевтические композиции
- 2163123 Глазные капли
- 2162687 Усовершенствованнная лекарственная форма индуктора интерферана
- 2162343 Биосовместимый полимерный материал и способ его получения
- 2162327 Лечение рака
- 2067841 Способ получения ароматизатора
- 2161478 Способ консервированого лечения гонартроза
- 2361617 Вольфрамовые частицы в качестве рентгеноконтрастных веществ
- 2361552 Способы и устройства для дренирования жидкостей и понижения внутриглазного давления
- 2066996 Способ изготовления пленочного материала для офтальмохирургии
- 2361417 Корм с глюкозамином и экстрактом ивы для профилактики артроза у животных
- 2161002 Пищевой общеукрепляющий лечебно-профилактический продукт из хрящевой ткани акул
- 2360928 Комплексная матрица для медико-биологического применения
- 2160574 Способ лечения глаукомы
- 2360688 Способ лечения повреждений переферических нервов
- 2360670 Фармацевтическая композиция при климактерических расстройствах
- 2360646 Эндолюминальный протез
- 2260445 Способ усовершенствования транспортировки через легко прспосабливаемый полупроницаемый барьер
- 2260007 Производные амида
- 2359975 Способ получения модифицированных арабиногалактанов
- 2359974 Антигенные Пептиды
- 2159775 Псевдопептидный продукт
- 2259833 Фармацевтическая композиция для лечения роговицы глаза
- 2259816 Ранозаживляющее средство
- 2259815 Способ коррекции возрастных изменений, связанных с процессами старения кожи
- 2359706 Способ сохранения офтальмологических растворов
- 2359704 Антисептическое средство
- 2359662 Микрокапсулы
- 2159253 Катионные полимеры
- 2159111 Средство для ухода за кожей лица
- 2159105 Композиция для защиты кожи от опасных химических веществ Получение
- 2158593 Биосовместимый водный раствор
- 2358728 Способ лечения и предупреждения потери костной ткани
- 2258517 Способ хирургического лечения травмотических повреждений селезенки пленкой на основе гиалуроновой кислоты
- 2357968 Кристалические формы производной имидазола
- 2357957 Ингибиторы P38 и их применение
- 2157647 Пищевая добавка и ее получение
- 2357758 Препараты для чрескожной и чересслизистой добавки
- 2063244 Способ стабилизации растворов
- 2063140 Способ получения препарата для консервирования мяса
- 2157381 Способ получения гиалуроновой кислоты
- 2257198 Композиции микроцастиц
- 2356909 Белковый комплекс
- 2356570 Косметическая композиция
- 2256434 Способ закрытия перфорации барабанной перепонки
- 2356520 Способ лечения постконтузионного повреждения сечатки глаза
- 2156133 Гель
- 2255945 Полимерная композиция
- 2355761 Средства повторной дифференцировки
- 2061043 Способ повышения устойчивости урокиназы к нагреванию
- 2061005 Способ получения красителей для гистологических исследований
- 2355420 Зубная паста
- 2355385 Композиции пролонгированного действия с контролируемым высвобождением
- 2355240 Способ получения пищевого препарата хондропротекторного действия
- 2155057 Пихтово репейный бальзам
- 2354409 Способ производства высвобождающих лекарственные средчтва медицинских устройств
- 2254145 Раневое покрытие на основе коллаген-хитозанового комплекса
- 2254133 Лечение и профилактика ВИЧ-инфекции у человека
- 2253439 Фармацевтическая композиция для защиты и улучшения оптических свойств роговици при проведении эндовитреальных вмешательств
- 2253437 Способ омоложения кожи
- 2153352 Фармацевтическая композиция обладающая ранозаживляющим и противовоспалительным действием
- 2353354 Фармацевтический препарат на основе низкомолекулярного индуктора интерферона
- 2252787 Способ получения искусственной матрицы кожи
- 2252767 Способ нормализации иммунобиохимического гомеостаза коров в предродовом и послеродовом периодах
- 2352583 Фармацевтическая композиция содержащая Fc-область иммуноглобулина в качестве носителя
- 2152403 Модифицированные полисахариды
- 2352356 Иммуногенная композиция
- 2352342 Исскусственный физиологический солевый раствор Способ его получения
- 2352330 Фармацевтический препарат на основе низкомолекулярного индуктора интерферона
- 2352323 Фармацевтический препарат с модифицированным высвобождением
- 2152027 Способ подготовки ткани мозга для определения гликозаминогликанов
- 2251842 Интектицидный состав для борьбы с личинками оводов
- 2151580 Способ активации пролиферации эндотелия роговицы
- 2351648 Дифференцировка стромальных клеток, полученных из жировой ткани, в эндокринные клетки поджелудочной железы и их использование
- 2351595 N - гидроксиформамидные соединения в качестве ингибиторов металлопротеина
- 2251411 Косметическое средство в лиофилизированной фармацевтической форме
- 2251405 Косметика...ее композиции для косметических препаратов
- 2251367 Средство со сшитой гиалуроновой кислотой для наращивания тканей
- 2351359 Косметика для профилактики и лечения избыточной массы тела
- 2351322 Препарат на основе низкомолекулярного индуктора интерферона
- 2351153 Диета при остеортрите собак
- 2350958 Способ определения групповой принадлежности синовальной жидкости
- 2350625 Производные гиалуроновой кислоты с пониженной биодеградируемостью
- 2150266 Крем после бритья
- 2350354 Фармацевтическое средство содержащие антагонист и фактор некроза
- 2350340 Способ коррекции процессов регенерации
- 2350309 Способ лечения избыточной массы тела с помощью рефлексотерапии
- 2250047 Профилактический продукт из хрящевой ткани гидробионтов
- 2249467 Медицинский матерьял и изделия на его основе
- 2055079 Способ получения препарата гиалуроновой кислоты
- 2349599 Биоадгезив мидии
- 2054903 Способ лечения коллагеноза у бычков на откорме
- 2249210 Способ прогнозирования предрасположенности к развитию и тяжести течения деформирующего остеоартроза коленного сустава у взрослых
- 2349339 Средство для соединительной ткани
- 2148988 Человеческий интерферона
- 2148399 Лечение атеросклероза
- 2148396 Способ определения активного вещества в дифильных мазевых основах
- 2148375 Способ диагностики близорукости
- 2348415 Способ противоспаечной терапии после хирургического вмешательства
- 2348400 Препарат на основе низкомолекулярного индуктора интерферона
- 2348386 Способ непроникающего хирургического лечения первичной открытоугольной глаукомы
- 2248213 Лечение Галактозидальной А недостаточности
- 2347586 Микрофлюидизированные эмульсии типа "масло в воде" и вакцинные средства
- 2147243 Контрастное средство
- 2146526 Лечебный препарат дисбактериоза и урогенитальных инфекций
- 2146148 Терапевтическое применение фактора роста кератиноцитов (ФРК)
- 2146139 Способ повышения активности макрофагов и комбинации для его осуществления
- 2346277 Способ диагностики специфического синовита
- 2345793 Ультразвуковые контрастные вещества и их получение
- 2345782 Терапевтические комбинации на основе PORIFERA для лечения и предотвращения кожных заболеваний
- 2245131 Способ коррекции косметических недостатков кожи
- 2245130 Способ активации восстановительных процессов в коже
- 2144833 Хондроитиназа
- 2344809 Получение твердых дозированных форм с использованием сшитого нетермопластичного носителя
- 2244540 Косметический гель для ухода за кожей лица
- 2244536 Способ лечения дегенеративно-дистрофических заболеваний тазобедренного сустава
- 2344167 Хмелевый экстракт
- 2143884 Агент регулирования дифференциации клеток кожи, культурная среда для клеток или тканей и способ регулирования дифференциации клеток кожи
- 2343932 Способ получения обладающих пониженной растворимостью в воде пленночных материалов
- 2343903 Устройство доставки лекарств для контролируемого введения препаратов
- 2048817 Способ получения материала для лечения ожогов и гнойно - некронических ран
- 2048803 Гидратантный крем
- 2242974 Средства и способы лечения воспалительных заболнваний
- 2142816 Способ получения антигерпетической вакцины
- 2342923 Средство для обработки рук с увлажняющим эффектом
- 2142781 Косметика для макияжа ресниц и бровей и агент ингирирующий рост микроорганизмов в косметических средствах
- 2242251 Трансплантируемые стенты с биоактивными покрытиями
- 2142257 Способ обработки глазных имплантантов и контакных линз
- 2342389 Мононатриевая соль
- 2342107 Способ устранения западения верхнего века при анофтальме
- 2141828 Средство, пролонгирующее эффективность чесночного порошка
- 2241489 Косметическое средство матриксных протеинов для залечивания ран
- 2241443 Средство для лечения герпеса
- 2241414 Способ получения протезов кровеносных сосудов
- 2341539 Гидрогель
- 2141324 Регулятор скорости воздействия препарата для инъекций
- 2141312 Косметическое средство для ухода за кожей лица
- 2341296 Средства и способы покрытия медицинских имплантантов
- 2341272 Средство для неспецифической иммунотерапии
- 2341266 Стенты с нанесенным покрытием содержащим N - (5-(4-(4-
- 2341257 Иммуномодулирующее средство
- 2341255 Средство для лечения климактерических расстройств
- 2240821 Способ лечения урологических инфекций
- 2140786 Способ лечения лишая
- 2140243 Способ хирургического лечения диабетической ретинопатии и отслоек сечатной оболочки
- 2240140 Медицинская многослойная повязка и изделия на ее основе
- 2240135 Культура клеток, содержащая клетки - предшественники остеонегеза, имплантант на ее основе и его использование для восстановления целостности кости
- 2240123 Экзогенные биологически активные коньюгирующие вещества
- 2139886 Фотоотвержаемое производное гликозаминогликата, сшитое производное гликозаминогликата и способы их получения, способ предотвращения клеточной и тканевой адгезии
- 2139729 Вакцина. Способ стимулирования иммунной системы
- 2339386 Средство обладающее радио - и химиозащитным действием
- 2339369 Лечение офтальмологических нарушений с использованием мочевины и ее производных
- 2139041 Гидратантный регенерирующий крем и способ его получения
- 2139039 Косметический суперкрем для ухода за кожей
- 2139017 Способ получения боисовместимого материала
- 2138503 Производные камптотецина, способы их получения, уникальное средство
- 2338556 Средство содержащие антагонист Р2Х - рецептора и нестероидное противоспалительное лекарственное средство
- 2338514 Косметическое средство для профилактики старения кожи
- 2138297 Медицинские устройства, подверженные вызываемому разложению
- 2138295 Покрытие для ран
- 2337906 Ингибиторы цитозольной фосфолипазы А2 Применение физиологически допустимого корпускулярного ферримагнитного или ферромагнитного материала. Способ формирования магнитометрического изображения
- 2137501 Устройство формирования изображения
- 2137477 Способ лечения заболеваний характеризующихся аутоиммунной агрессией
- 2137467 Крем для кожи лица и тела
- 2137449 Способ коррекции дефектов преломления в глазу млекопитающего
- 2137402 Пищевая Добавка БАД
- 2336899 Способ стимуляции миелопоэза
- 2336862 Способ получения раствора для лечения роговицы
- 2336830 Способ восстановления костных структур челюсти
- 2136696 Новый полипептид и средство против ВИЧ - Инфекции
- 2336092 Биоадгезивное средство, по существу свободное от воды
- 2336089 Средство и способ лечения заболеваний периодонтальных и пульпы
- 2336074 Средства и способы лечения заднего сегмента глаза
- 2235548 Ранозаживляющее средство
- 2135186 Способ лечения рефлекторных синдромов при остеохондрозе
- 2234945 Стабилизатор водного раствора и водосодержащего сырья
- 2334762 Растворимая ассоциативная карбоксиметилцеллюлоза
- 2234514 Макропористые хитозановые гранулы и способ их получения. Способ культивирования клеток
- 2133615 Средство для лечения неврологических заболеваний
- 2233164 Способ профилактики развития послеоперационных спаек брюшной полости
- 2133127 Неткатный материал, способ его получения и способ лечения
- 2333223 Альдегидные производные сиаловой кислоты и средства на их основе
- 2333007 Полипептидные вакцины для широкой защиты против рядов поколений менингококов с повышенной вирулентностью
- 2332985 Дозированные формы анестезирующих средств с длительным высвобождением для обезболивания
- 2132677 Косметическая маска
- 38603 Пленочный аппликатор
- 2232594 Средство содержащие ингибирующие остеокластогенез фактор и полисахарид
- 2332238 Средство для прокладок, раневых повязок и других изделий, контактирующих с кожей
- 2331668 Стромальные клетки, получение из жировой ткани, для заживления дефектов роговицы и внутриглазных дефектов и их использование
- 2331438 Альфа - 2 - Дельта Лигант для лечения симптомов нижних мочевыводящих путей
- 2331411Электропряденые аморфные фармоцевтические средства
- 2331367 Способ профилактики образования спаек и их рецидива
- 2130767 Масло в воде для получения косметических и дерматологических средств, способ косметической обработки
- 2230752 Поперечносшитые гиалуроновые кислоты и их применение в медицине
- 2230558 Способ восстановления и сохранения здоровья скмьи
- 2230550 Средства длительного высвобождения, способ их получения и применения
- 2230458 Поддержания здоровья суставов
- 2330290 Способ определения состояния метаболических процессов в ткани суставного хряща
- 2230073 Способ поперечного сшивания карбоксилированных полисахаридов
- 2329059 Способ лечения полипозного риносинусита
- 2329037 Комбинированная терапия для лечения иммуновоспалительных заболеваний
- 2128666 Гиалуроновая кислота и ее соли, способ очистки гиалуроновой кислоты, способ получения гиалуроновой кислоты. Фармацевтический препарат с гиалуроновой кислотой и средства с гиалуроновой кислотой используемые в офтальмологии
- 2328740 Способ экспресс - оценки действия зубных паст
- 2128502 Косметический гель
- 2328272 Суппозитории индуктора интерферона
- 2328268 Косметика содержащая амфолитный сополимер
- 2128057 Композиционная мембрана, способ ее получения и способ направленной регенерации тканей с ее применением
- 2128055 Средство замедленного освобождения и способ его получения
- 2128049 Свечи
- 2227743 Полипептидные варианты с повышенной гепаринсвязывающей способностью
- 2326893 Ковалентное и нековалентное сшивание гидрофильных полимеров
- 2326697 Новый перевязочный материал для быстрого заживления раневой поверхности кожи
- 2126264 Фармацевтическое средство с гиалуроновой кислотой
- 2326137 Способ получения содержащих альгинат пористых формованных изделий
- 2325902 Способ выделения гликозаминогликанов из минерализованной соединительной ткани
- 2225195 Репелленты против насекомых
- 2325193 Сосудистый стент
- 2325184 Улучшенные везикулы наружной мембраны бактерий
- 2325153 Многокомпонентная фармацевтическая дозированная форма
- 2325152 Удерживаемая в желудке система регулируемой доставки лекарственного средства
- 2029955 Способ предоперационного определения помутнения задней капсулы хрусталика при экстракции катаракты
- 2324688 Производные бисбензизоселеназолонила с противоопухолевым, противовоспалительным и антитромбоническим действием
- 2323017 Устройство и способ контролируемый доставки активных веществ в кожу
- 2323011 Содержащий Коллаген I и Коллаген II способный к рассасыванию внеклеточный матрикс, предназначенный для реконструирования хряща
- 2322955 Способ изготовления имплантанта для пластики дефектов хрящевой ткани
- 2322454 Антитело против CCR5
- 2322263 Система продолжительного высвобождения растворимого лекарственного средства
- 2221561 Витамин Е и его сложные эфиры
- 2321634 Гены участвующие в метаболизме углерода и продуцировании энергии
- 2321597 Биоматерьял, способ его приготовления и его применение, медицинское средство, имплантант и вкладыш
- 2121340 Средство для похудения
- 2220737 Средство для улучшения состояния опорно-двигательного аппарата
- 2220729 Гель используемый в стоматологии
- 2320720 Способ культивирования фибропластов для заместительной терапии
- 2320378 Накожный аппликатор
- 2320369 Средства, содержащие Альфа - 2 - Дельта Лиганды и ингибиторы обратного захвата серотонина/норадреналина
- 2320362 Местные фармацевтические средства, содержащие проантоцианидины, для лечения дерматитов
- 2320322 Биоадгезивная доставка лекарств
- 2320318 Чувствительное к температуре изменяющие состояние средство гидрогеля
- 2025120 Способ получения препарата, содержащего Фактор /G-CSF/, стимулирующий рост колоний гранулоцитов
- 2319490 Средство для введения железа при лечении синдрома беспокойных ног
- 25995 Содержащее адгезив приспособление для фиксации зубных протезов в полости рта
- 2218907 Средство для ухода за кожей лица и веками
- 2318830 Способ получения модифицированного дерматансульфата
- 2118153 Косметика - туш для ресниц
- 2217441 Способ получения полимера
- 2317296 Изетионатная соль селективного ингибитора CDK4
- 2217171 Мембрана для использования при направленной регенерации тканей
- 2317095 Экстракты ECHINACEA ANGUSTIFOLIA
- 2216332 Препарат для лечения астроза
- 2216314 Крем - маска для обезвоженной кожи
- 2316333 Средство оздоровительно-восстановительных косметических панто-магниевых ванн
- 2021304 Способ получения биологически активного средства
- 2115662 Способ получения гиалуроновой кислоты
- 2315627 Впрыскиваемые имплантанты на керамической основе для заполнения морщин, кожных впадин, шрамов
- 2315623 Средство получаемое путем лиофилизации препарата
- 2114862 Способ получения гиалуроновой кислоты
- 2314791 Лечебно-Косметическое средство
- 2314791 Косметический крем-бальзам для ухода за кожей лица и шеи
- 2214600 Способ оценки эффективности лечения неврологических проявлений
- 2114602 Способ косметической обработки
- 2114587 Раствор для защиты роговицы
- 2214283 Имплантант для подкожного или внутрикожного введения
- 2313370 Медицинские протезы, имеющие улучшенную биологическую совместимость
- 2313356 Препарат для лечения демодекоза
- 2313338 Средство на основе этиллинолеата и триэтилцитрата для лечения себореи и угрей
- 2313328 Косметика содержащая тонкодисперный и пористый порошок
- 2212880 Способ получения препарата содержащего антибиотик, с замедленным высвобождением активного вещества
- 2312640 Способ лечения Блефароконьюнктивальной формы синдрома сухого глаза
- 2017751 Способ получения гиалуроновой кислоты
- 2312145 Гены CORYNEBACTERIUM GLUTAMICUM, кодирующие белки, участвующие в синтезе мембран и мембранном транспорте
- 2311458 Белки вызывающие измененную иммуногенную реакцию. Способ их получения и использования
- 2311183 Улучшенное разделение с использованием гталуроновой кислоты
- 2311177 Ингибиторы интегрина для лечения заболевания глаз
- 2300069 Косметическая маска
- 2211024 Уход за сухой кожей
- 2310440 Раствор для защиты роговицы от повреждений
- 2309684 Лечение межфалангового остеоатроза узелковой формы
- 2309406 Способ мониторинга фиброза печени у больных хроническим гепатитом с (ХГС)
- 2209088 Опосредованная рецепторами доставка генов с использованием векторов на основе бактериофагов
- 2308967 Уменьшение объема ткани
- 2308962 Средство для опорно-дигательного аппарата
- 2308957 Способ получения препарата для мезотерапии
- 2308954 Средство для лечения ран, содержащее плазму или сыворотку крови
- 2308951 Комплексный способ профилактики вагинальных дисбактериозов
- 2308937 Косметическая биологически активная добавка и косметический литофитокомплекс на ее основе
- 2208638 ДНК (варианты), способ получения белка
- 2207885 Способ подачи небольшого объема лечебного раствора к целевому месту
- 2207858 Лишенные побочных эффектов производные простагландинов для лечения глаукомы
- 2207845 Твердая лекарственная форма пролонгированного действия
- 2207844 Препарат для местного неинвазивного применения
- 2207841 Средства с антиферментативным действием
- 2306335 Стволовые клетки и решетки полученные из жировой ткани
- 2306140 Новые рецепторы для Helicobacter pylori и их применение
- 2205612 Способ эндотелизации IN VITRO протезов кровеносных сосудов
- 2105540 Депигментирующее средство
- 2304960 Косметическое средство для кожи
- 2304616 Гены участвующие в гомеостазе и адаптации
- 2204550Способ получения длинноцепочечной N-Ацилированной кислотой Аминокислот
- 2204415 Способ получения изображения
- 2204394 Средство для лечения грибковых инфекций, желудочных язв
- 2204366 Способ хирургического лечения глаукомы
- 2104034 Вагинальное увлажняющие средство, способ его получения
- 2303991 Биологически активная добавка
- 2303990 БАД
- 2303973 Адсорбирующее изделие
- 2203676 Средство обладающее иммунокорригирующим действием
- 2203672 Способ предупреждения беременности
- 2303635 Гены кодирующие белки резистентности и толерантности к стрессам
- 2303529 Способ фиксации альгинатного геля на твердой фазе, способ получения клеточного чипа на его основе
- 2203078 Способ лечения гнойных ран
- 2302412 Гидразоно-малонитрилы
- 2102400 Способ получения гиалуроновой кислоты
- 2202356 Способ стимуляции репаративных процессов длительно незаживающих ран и трофических язв
- 2202336 Средство для ухода за кожей
- 2302231 Глазные капли
- 2102082 Способ магнитометрического исследования тела человека или животного
- 2301814 Полиакриламидный гидрогель
- 2201765 Гибридные матричные имплантанты и эксплантанты
- 2301677 Биотрансплантант для лечения дегенеративных и трвматических заболеваний хрящевой ткани и способ его получения
- 2301676 Способ лечения ревматизма
- 2301674 Способ лечения больных с переломами нижней челюсти
- 2301661 Средство с регулируемым освобождением и способ его получения
- 2005488 Средство для лечения болезней соединительной ткани
- 2200001 Крем для кожи
|
РОССИЙСКАЯ ФЕДЕРАЦИЯ

ФЕДЕРАЛЬНАЯ СЛУЖБА
ПО ИНТЕЛЛЕКТУАЛЬНОЙ СОБСТВЕННОСТИ
ПАТЕНТАМ И ТОВАРНЫМ ЗНАКАМ
|
Патент №2347586 |
54) МИКРОФЛЮИДИЗИРОВАННЫЕ ЭМУЛЬСИИ ТИПА "МАСЛО В ВОДЕ" И ВАКЦИННЫЕ КОМПОЗИЦИИ
(57) Реферат:
Группа изобретений относится к области биотехнологии. Вакцинная композиция содержит гликозид сапонина, стерин и антиген, где указанный гликозид сапонина и указанный стерин ассоциируют друг с другом с образованием комплексов в форме спиралевидных мицелл. Указанный антиген смешан с указанными спиралевидными мицеллами, но не включен в их состав. Вакцина содержит гликозид сапонина и стерин при количественном весовом соотношении сапонина к стерину от 1:100 до 5:1. Указанный гликозид сапонина и указанный стерин ассоциируют друг с другом с образованием комплексов в форме спиралевидных мицелл, обладающих иммуностимулирующей активностью. Вакцина дополнительно содержит иммунологически эффективное количество антигена. Указанный антиген смешан с указанными спиралевидными мицеллами, но не включен в их состав. Адъювантная композиция «масло в воде» содержит Quil А и холестерин при количественном весовом отношении сапонина к стерину от 1:100 до 5:1 в приемлемом в ветеринарии носителе. Указанные Quil А и холестерин ассоциируют друг с другом с образованием комплексов в форме спиралевидных мицелл, обладающих иммуностимулирующей активностью, где масло представлет собой неметаболизируемое масло. Причем указанные спиралевидные мицеллы микрофлюидизированы с приемлемым в ветеринарии носителе с образованием субмикронной эмульсии «масло в воде». Способ получения вакцины включает: a) получение композиции антигена в буфере; b) добавление сапонина к композиции со стадии а) и c) добавление стерина в спирте к композиции со стадии b). Это изобретение относится к субмикронным эмульсиям типа "масло в воде", приемлемым в качестве адъюванта вакцины для повышения иммуногенности антигенов. Также настоящее изобретение относится к композициям вакцин, содержащим антиген, комбинированный непосредственно в составе такой эмульсии или отдельно. Также настоящее изобретение относится к способам получения эмульсий и вакцин. 4 н. и 8 з.п. ф-лы, 17 табл., 12 ил.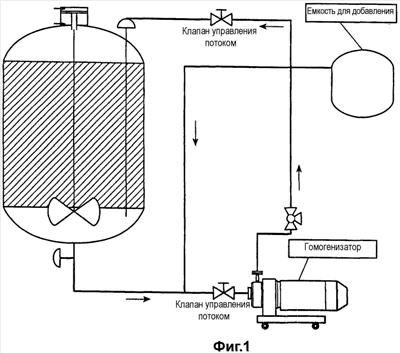
ОБЛАСТЬ ИЗОБРЕТЕНИЯ
Это изобретение относится, в основном, к области вакцин и, в частности, к препаратам адъювантов для повышения иммунного ответа у животных в ветеринарии. В частности, это изобретение относится к использованию субмикронных эмульсий типа "масло в воде" в качестве вакцинного адъюванта для увеличения иммуногенности антигенов. Настоящее изобретение относится к препаратам субмикронной эмульсии типа "масло в воде", вакцинным композициям, содержащим включенный в состав таких эмульсий антиген, а также к способам получения эмульсий и вакцин. Также настоящее изобретение относится к композициям, содержащим комплексы, образованные пригодными для использования в вакцинах гликозидом сапонина и стерином.
ПРЕДПОСЫЛКИ ИЗОБРЕТЕНИЯ
Бактериальные, вирусные, паразитарные и микоплазменные инфекции часто встречаются у животных, таких как крупный рогатый скот, свиньи и животные-компаньоны. Заболевания, вызванные этими инфекционными агентами, часто не поддаются противомикробной фармацевтической терапии, что не оставляет эффективных способов лечения. Таким образом, подходы вакцинологии все более широко используются для контроля инфекционного заболевания у животных в ветеринарии. Для использования в вакцине можно сделать пригодным цельный инфекционный патоген после химической инактивации или соответствующей генетической манипуляции. Альтернативно, для использования в вакцинном препарате можно экспрессировать белковую субчастицу патогена в рекомбинантной экспрессирующей системе и очистить.
К адъюванту обычно относится любое вещество, усиливающее гуморальный и/или клеточный иммунный ответ на антиген. Традиционные вакцины состоят из неочищенного препарата убитых патогенных микроорганизмов, и примеси, ассоциированные с культурами патогенных микроорганизмов, могут действовать в качестве адъюванта для повышения иммунного ответа. Однако когда гомогенные препараты патогенных микроорганизмов или очищенных белковых субчастиц используют в качестве антигенов для вакцинации, иммунитет, вызванный такими антигенами, является недостаточным, и поэтому добавление определенных экзогенных веществ в качестве адъюванта становится необходимым. Кроме того, производство синтетических вакцин и вакцин из субчастиц является дорогостоящим. Следовательно, с помощью адъювантов для стимуляции иммунного ответа могут требоваться меньшие дозы антигена, таким образом снижается стоимость производства вакцин.
Известно, что к усилению иммунного ответа приводит ряд различных способов действия адъювантов. Большое количество адъювантов модифицируют систему цитокинов, ассоциированных с иммунным ответом. Такие иммуномодулирующие адъюванты могут оказывать свое действие, даже если они находятся не совместно с антигенами. Как правило, иммуномодулирующие адъюванты вызывают общую позитивную регуляцию определенных цитокинов и сопутствующую негативную регуляцию других, приводя к клеточному Th1 и/или гуморальному Th2 ответу.
Некоторые адъюванты обладают способностью поддерживать конформационную целостность антигена, так что антигены могут эффективно презентироваться соответствующим иммунным эффекторным клеткам. В результате поддержания конформации антигена составом адъюванта вакцина может обладать увеличенным сроком хранения, как это показано для иммуностимулирующих комплексов (ISCOM). Ozel M., et. al.; Quarternary Structure of the Immunestimmulating Complex (Iscom), J. of Ultrastruc. and Molec. Struc. Res. 102, 240-248 (1989).
Некоторые адъюванты обладают способностью задерживать антиген в виде депо в области инъекции. В результате этого депо-эффекта антиген не выводится быстро посредством печеночного клиренса. Соли алюминия и эмульсии типа "вода в масле" действуют посредством этого депо-эффекта более кратковременно. Например, можно получить долговременные депо, используя полный адъювант Фрейнда (FCA), который представляет собой эмульсию типа "вода в масле". Как правило, FCA сохраняется в области инъекции до тех пор, пока биологическая деградация не обеспечит удаление антигена антиген-представляющими клетками.
На основании физической природы адъюванты можно разделить на две очень широкие группы, а именно дисперсные адъюванты и недисперсные адъюванты. Дисперсные адъюванты существуют в виде микрочастиц. Иммуноген способен либо встраиваться внутрь, либо ассоциировать с микрочастицами. Соли алюминия, эмульсии типа "вода в масле", эмульсии типа "масло в воде", иммуностимулирующие комплексы, липосомы, нано- и микрочастицы являются примерами дисперсных адъювантов. Недисперсные адъюванты, как правило, представляют собой иммуномодуляторы, и их, как правило, используют в сочетании с дисперсными адъювантами. Мурамилдипептид (обладающий адъювантной активностью компонент пептидогликана, экстрагированный из микобактерий), неионные блок-сополимеры, сапонины (комплексная смесь тритерпеноидов, экстрагированная из коры дерева Quillaja saponaria), липид А (дисахарид глюкозамина с двумя фосфатными группами и пятью или шестью цепями жирных кислот, как правило, длиной от C12 до C16), цитокины, углеводные полимеры, производные полисахаридов и бактериальные токсины, такие как холерный токсин и лабильный токсин (LT) E. coli, являются примерами недисперсных адъювантов.
Некоторые из общеизвестных адъювантов представляют собой сочетание недисперсных иммуномодуляторов и дисперсных веществ, которые могут придавать депо-эффект составу адъюванта. Например, FCA сочетает в себе иммуномодулирующие свойства компонентов Mycobacterium tuberculosis, а также кратковременный депо-эффект масляных эмульсий.
Масляные эмульсии в течение длительного времени использовали в качестве вакцинного адъюванта. Le Moignic и Pinoy в 1916 году обнаружили, что суспензия убитых Salmonella typhimurium в минеральном масле усиливает иммунный ответ. Затем в 1925 году Ramon описал масло на основе крахмала в качестве одного из веществ, усиливающих антитоксический ответ на дифтерийный анатоксин. Однако масляные эмульсии не были распространены до 1937 года, когда появился состав адъюванта Фрейнда, известный в настоящее время как полный адъювант Фрейнда (FCA). FCA представляет собой эмульсию типа "вода в масле", состоящую из минерального (парафинового) масла, смешанного с убитыми микобактериями и Arlacel A. Arlacel A представляет собой, главным образом, моноолеат маннида и используется в качестве эмульгирующего вещества. Несмотря на то, что FCA является превосходным в отношении стимуляции образования антител, он вызывает сильную боль, образование абсцесса, лихорадку и гранулематозное воспаление. Чтобы избежать этих нежелательных побочных реакций, был разработан неполный адъювант Фрейнда (IFA). IFA сходен с FCA по составу, за исключением отсутствия микобактериальных компонентов. IFA действует посредством депонирования состава в области инъекции и медленного высвобождения антигена со стимуляцией антител-продуцирующих клеток.
Другой подход для улучшения FCA основан на том, что замена минерального масла биологически совместимым маслом может способствовать устранению реакций, ассоциированных с FCA в области инъекции. Также считалось, что эмульсия должна быть эмульсией типа "масло в воде", а не "вода в масле", так как последняя создает долговременное депо в области инъекции. Hilleman et al. описали адъювант на основе масла "адъювант 65", состоящий на 86% из арахисового масла, на 10% из Arlacel A в качестве эмульгатора и на 4% из моностеарата алюминия в качестве стабилизатора. Hilleman, 1966, Prog. Med. Virol. 8: 131-182; Hilleman and Beale, 1983, in New Approaches to Vaccine Development (Eds. Bell, R. and Torrigiani, G.), Schwabe, Basel. Адъювант 65 был безопасным и эффективным для человека, но проявлял меньшие адъювантные свойства, чем IFA. Тем не менее, использование адъюванта 65 было прекращено вследствие реактогенности у человека определенного количества вакцин и снижения адъювантных свойств, если вместо Arlacel A использовали очищенный или синтетический эмульгатор. В патентах США 5718904 и 5690942 показано, что в целях улучшения профиля безопасности минеральное масло в эмульсии типа "масло в воде" можно заменять метаболизирующимся маслом.
Кроме адъювантных свойств и безопасности, также существенное коммерческое значение имеют физические свойства эмульсии. Физические свойства эмульсии зависят от стабильности эмульсии. Расслоение, образование осадка и коалесценция являются показателями нестабильности эмульсии. Расслоение происходит, если масляная и водная фазы эмульсии имеют различный удельный вес. Расслоение также происходит, если первоначальный размер капель эмульсии большой и эмульсионные капли не осуществляют какого-либо броуновского движения. Если размер капель большой, то существует тенденция к межфазному распределению и капли сливаются в крупные частицы. Стабильность эмульсии определяется рядом факторов, таких как тип и количество используемых эмульгаторов, величина размера капель в эмульсии и различие по плотности между масляной и водной фазами.
Эмульгаторы обеспечивают стабилизацию дисперсных капель посредством снижения межфазной свободной энергии и создания физических или электростатических барьеров для коалесценции капель. В качестве эмульгаторов можно использовать как неионные, так и ионные детергенты. Неионные эмульгаторы упорядочиваются на границе раздела и создают относительно крупные структуры, которые приводят к пространственному разделению дисперсных капель. Анионные или катионные эмульгаторы приводят к образованию электрического двойного слоя притягивающимися противоионами; силы отталкивания в двойном слое приводят к отталкиванию капель при их сближении.
Кроме использования эмульгаторов, стабильности эмульсии также можно добиться уменьшением размера капель эмульсии механическими способами. Как правило, для получения эмульсий используют пропеллерные мешалки, турбинные роторы, коллоидные мельницы, гомогенизаторы и ультразвуковые устройства. Микрофлюидизация представляет собой еще один способ повышения гомогенности размера капель в эмульсии. Микрофлюидизацией можно получить превосходную физически стабильную эмульсию с постоянным размером капель субмикронного порядка. Кроме повышения стабильности эмульсии, процесс микрофлюидизации позволяет осуществлять терминальную фильтрацию, что является предпочтительным способом обеспечения стерильности конечного продукта. Кроме того, субмикронные масляные частицы могут проникать из области инъекции в лимфатические сосуды, а затем в лимфатические узлы дренажной системы, кровь и селезенку. Это снижает вероятность образования в области инъекции масляного депо, которое может привести к местному воспалению и значительной реакции в области инъекции.
Микрофлюидизаторы в настоящее время являются коммерчески доступными. Образование эмульсии происходит в микрофлюидизаторе при взаимодействии в камере для взаимодействия двух флюидизированных потоков при высоких скоростях. Микрофлюидизатор является пневматическим или азотным и может работать при внутреннем давлении, превышающем 20000 фунт/кв. дюйм. В патенте США 4908154 описано применение микрофлюидизатора для получения эмульсий, по существу свободных от любых эмульгирующих веществ.
В литературе описан ряд составов субмикронных адъювантов типа "масло в воде". В патенте США 5376369 описан состав адъюванта на основе субмикронной эмульсии типа "масло в воде", известный как Syntax Adjuvant Formulation (SAF). SAF содержит сквален или сквалан в качестве масляного компонента, образующее эмульсию количество Pluronic L121 (блок-сополимер полиоксипропилена и полиоксиэтилена) и иммуностимулирующее количество мурамилдипептида. Сквален представляет собой линейный углеводородный предшественник холестерина, обнаруживаемый во многих тканях, особенно в печени акул и других рыб. Сквалан получают гидрогенизацией сквалена, и он является полностью насыщенным. Сквален и сквалан могут метаболизироваться и обладают хорошими данными токсикологических исследований. Эмульсии на основе сквалена или сквалана использовали у человека в вакцинах против злокачественной опухоли с умеренными побочными эффектами и желательной эффективностью. См., например, Anthony C. Allison, 1999, Squalene and Squalane emulsions as adjuvants, Methods 19: 87-93.
В патенте США 6299884 и международной публикации WO 90/14837 описано, что блок-сополимеры полиоксипропилена и полиоксиэтилена не являются необходимыми для состава субмикронной эмульсии типа "масло в воде". Кроме того, в этих документах описано использование нетоксичного метаболизирующегося масла и намеренное исключение использования в составах эмульсий минерального масла и токсичных петролейных дистиллятных масел.
В патенте США 5961970 описана еще одна субмикронная эмульсия типа "масло в воде" для использования в качестве вакцинного адъюванта. В эмульсии, описанной в этом патенте, гидрофобный компонент выбран из группы, состоящей из масла на основе триглицерида средней цепи, растительного масла и их смеси. Поверхностно-активное вещество, включенное в состав этой эмульсии, может представлять собой природное биологически совместимое поверхностно-активное вещество, такое как фосфолипид (например, лецитин), или фармацевтически приемлемое неприродное поверхностно-активное вещество, такое как TWEEN-80. В этом патенте также описано включение антигена в состав эмульсии во время образования эмульсии, в отличие от смешивания антигена с эмульсией после того, как эмульсия самостоятельно и отдельно сформирована.
В патенте США 5084269 описано, что состав адъюванта, содержащий лецитин в сочетании с минеральным маслом, приводит к снижению раздражения у животного-хозяина и одновременно вызывает повышение системного иммунитета. Состав адъюванта, полученный в соответствии с патентом США 5084269, коммерчески используется в ветеринарных вакцинах под товарным наименованием AMPHIGEN®. Состав AMPHIGEN® состоит из мицелл - масляных капель, окруженных лецитином. Эти мицеллы позволяют добиться связывания большего количества цельных клеточных антигенов, чем традиционные адъюванты на основе масла. Кроме того, вакцинные препараты на основе AMPHIGEN® содержат пониженное содержание масла, составляющее от 2,5 до 5% минерального масла, по сравнению с другими вакцинными препаратами, содержащими масляные адъюванты, которые, как правило, содержат от 10% до 20% масла. Такое низкое содержание масла приводит к тому, что этот вакцинный препарат на основе адъюванта в меньшей степени раздражает ткани в области инъекции, что приводит к уменьшению участка повреждения и к уменьшению сроков до забоя. Кроме того, лецитиновая оболочка, окружающая капли, дополнительно снижает реакции в области инъекции, что приводит к вакцине, которая безопасна и эффективна.
Состав AMPHIGEN® используют в качестве адъюванта в ряде ветеринарных вакцин, и существует необходимость сохранять физические свойства вакцинного продукта в течение коротких или длительных периодов хранения, а также во время разбавления. Кроме того, лиофилизированный антиген смешивают с предварительно изготовленным составом адъюванта непосредственно перед инъекцией. Этот способ не всегда гарантирует, что распределение антигена в эмульсии типа "масло в воде" является равномерным и свойства эмульсии могут быть непригодными. Кроме того, после стояния в гомогенизированной эмульсии можно увидеть разделение фаз. Таким образом, существует необходимость в стабильном составе адъюванта, для которого не показано разделение фаз в течение длительного срока хранения. Один способ для предотвращения разделения фаз представляет собой уменьшение размера капель и повышение гомогенности частиц эмульсии. В то время как процессы микрофлюидизации метаболизирующихся составов эмульсий на основе масла были документированы, микрофлюидизация эмульсий типа "масло в воде", таких как состав AMPHIGEN®, еще не была осуществлена.
В настоящем изобретении микрофлюидизацию использовали для доведения размеров окруженных лецитином капель минерального масла до субмикронного размера. Неожиданно авторами настоящего изобретения было обнаружено, что микрофлюидизация вакцинных препаратов с адъювантами на основе эмульсии типа "масло в воде", содержащими смесь лецитина и масла, не только улучшает физические свойства препаратов, но также усиливает иммунизирующие эффекты препаратов. Также микрофлюидизированные препараты характеризуются улучшенным профилем безопасности.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Неожиданно авторами настоящего изобретения было обнаружено, что адъювантную активность и профиль безопасности эмульсий типа "масло в воде" на основе неметаболизирующегося масла можно улучшить посредством микрофлюидизации. Антигены, включенные в состав микрофлюидизированных эмульсий, являются стабильными, даже если антигены включают непосредственно в состав эмульсий перед микрофлюидизацией.
Таким образом, в одном варианте осуществления настоящее изобретение относится к составу субмикронной эмульсии типа "масло в воде", пригодному в качестве адъюванта вакцины. Субмикронные эмульсии типа "масло в воде" по настоящему изобретению состоят из неметаболизирующегося масла, по меньшей мере одного поверхностно-активного вещества и водного компонента, где масло диспергировано в водном компоненте со средним размером масляных капель субмикронного порядка. Предпочтительным неметаболизирующимся маслом является легкое минеральное масло. Предпочтительные поверхностно-активные вещества включают в себя лецитин, TWEEN®-80 и SPAN®-80.
Предпочтительная эмульсия типа "масло в воде", предоставленная в настоящем изобретении, состоит из состава AMPHIGEN®.
Эмульсии типа "масло в воде" по настоящему изобретению могут включать в себя пригодные и желательные дополнительные компоненты, включая консерванты, осмотические средства, биоадгезивные молекулы и иммуностимулирующие молекулы. Предпочтительные иммуностимулирующие молекулы включают в себя, например, Quil A, холестерин, GPI-0100, бромид диметилдиоктадециламмония (DDA).
В другом варианте осуществления настоящее изобретение относится к способам получения субмикронной эмульсии типа "масло в воде". В соответствии с настоящим изобретением различные компоненты эмульсии, включая масло, одно или несколько поверхностно-активных веществ, водный компонент и любой другой компонент, пригодный для использования в эмульсии, смешивают. Смесь подвергают предварительному процессу эмульгирования с получением эмульсии типа "масло в воде", которую затем пропускают через микрофлюидизатор с получением эмульсии типа "масло в воде" с диаметром капель менее 1 микрона, предпочтительно со средним размером капель менее 0,5 микрон.
В еще одном варианте осуществления настоящее изобретение относится к вакцинным композициям, которые содержат антиген и субмикронную эмульсию типа "масло в воде", описанную выше. Антиген включают как непосредственно в состав эмульсии, так и отдельно, предпочтительно непосредственно в состав эмульсии. Антиген, который может быть включен в состав вакцинных композиций по настоящему изобретению, может представлять собой бактериальный, грибковый или вирусный антиген или их комбинацию. Антиген может находиться в форме инактивированного цельного или частичного клеточного или вирусного препарата или в форме антигенных молекул, полученных обычными способами очистки белка, способами генетической инженерии или химическим синтезом.
В следующем варианте осуществления настоящее изобретение относится к способам получения вакцинных композиций, содержащих антиген или антигены, комбинированные с субмикронной эмульсией типа "масло в воде".
Для получения вакцинных композиций по настоящему изобретению антиген(ы) можно комбинировать с компонентами эмульсии типа "масло в воде" либо непосредственно (например перед микрофлюидизацией), либо отдельно (например после микрофлюидизации). Предпочтительно антиген комбинируют непосредственно с компонентами эмульсии типа "масло в воде".
В еще одном варианте осуществления настоящее изобретение относится к вакцинным композициям, которые содержат микроинкапсулированный антиген и субмикронную эмульсию типа "масло в воде", описанную выше, где микроинкапсулированный антиген комбинируют с эмульсией отдельно.
Также было неожиданно обнаружено, что при комбинировании в растворе сапонин и стерин ассоциируют друг с другом с образованием комплексов в форме спиралевидных мицелл. В соответствии с настоящим изобретением эти спиралевидные комплексы мицелл обладают иммуностимулирующей активностью и являются особенно пригодными в качестве адъювантов в вакцинных композициях.
Таким образом, настоящее изобретение относится к вакцинным композициям, содержащим сапонин и стерин, где сапонин и стерин образуют комплексы в форме спиралевидных мицелл. Настоящее изобретение также относится к композициям, содержащим сапонин, стерин и антиген, где сапонин и стерин образуют комплексы в форме спиралевидных мицелл и где антиген смешан со спиралевидными мицеллами, но не включен в состав спиралевидных мицелл.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
Фигура 1 иллюстрирует процесс серийного получения немикрофлюидизированных вакцинных композиций. В этом процессе различные компоненты вакцины добавляют в емкость для добавления слева, а затем перекачивают в емкость для смешивания, где компоненты смешиваются друг с другом простыми механическими способами.
Фигура 2 иллюстрирует процесс получения микрофлюидизированных вакцинных композиций, содержащих антиген, непосредственно включенный в состав вакцины. Различные компоненты вакцин добавляют в емкость для добавления и переносят в отделение для смешивания пре-эмульсии для смешивания простыми механическими способами. Затем эмульсию пропускают через микрофлюидизатор и собирают в постмикрофлюидизационной камере.
Фигура 3 иллюстрирует распределение размеров капель немикрофлюидизированной вакцины на основе состава AMPHIGEN®, микрофлюидизированной вакцины на основе состава AMPHIGEN® и вакцинного препарата, смешанного с помощью настольного смесителя.
Фигура 4 иллюстрирует отсутствие разделения фаз в микрофлюидизированном вакцинном препарате.
Фигура 5 иллюстрирует сравнение стабильности антигенов, включенных непосредственно в состав микрофлюидизированного вакцинного препарата на основе состава AMPHIGEN® (A907505), и трех контрольных немикрофлюидизированных вакцинных препаратов на основе состава AMPHIGEN® (A904369, A904370, и A904371). Все четыре вакцинных препарата хранили при 4°C в течение двух лет. На различных этапах хранения (0, 6, 12 или 24 месяцев) все четыре препарата использовали для вакцинации коров в возрасте трех месяцев. Вакцинацию на 0 и 21 сутки проводили вакциной в дозе 2 мл и через две недели после второй вакцинации осуществляли забор сыворотки. Титр нейтрализующих антител против вируса BVD II типа определяли в каждом образце сыворотки. Данные представлены в виде среднего геометрического значения для 5 животных.
Фигура 6 иллюстрирует среднеквадратичную ректальную температуру у коров до и после введения микрофлюидизированных и немикрофлюидизированных вакцин. T01: группа плацебо - единичная доза; T02: группа плацебо - двойная доза; T03: немикрофлюидизированный состав - единичная доза; T04: немикрофлюидизированный состав - двойная доза; T05: микрофлюидизированный состав - единичная доза; T06: микрофлюидизированный состав - двойная доза.
Фигура 7 иллюстрирует среднеквадратичный размер реакции в области инъекции, наблюдаемой у коров после введения немикрофлюидизированных и микрофлюидизированных вакцинных составов. T03: немикрофлюидизированный состав - единичная доза; T04: немикрофлюидизированный состав - двойная доза; T05: микрофлюидизированный состав - единичная доза; T06: микрофлюидизированный состав - двойная доза.
Фигура 8 иллюстрирует среднее геометрическое значение титров IgG против рекомбинантного антигена PauA из Streptococcus uberis после вакцинации различными вакцинными составами, содержащими как рекомбинантный антиген PauA, так и цельный клеточный антиген E. coli.
Фигура 9 иллюстрирует среднее геометрическое значение титров IgG против цельного клеточного антигена E. coli из Streptococcus uberis после вакцинации различными вакцинными составами, содержащими как рекомбинантный антиген PauA, так и цельный клеточный антиген E. coli.
Фигуры 10A и 10B иллюстрируют распределение размеров частиц микрофлюидизированного состава Amphigen первоначально после изготовления (фигура 10A) и через 22 месяца после изготовления (фигура 10B).
Фигура 11 представляет собой электронно-микроскопическую фотографию, иллюстрирующую формирование спиралевидных мицелл с мицеллами Quil A и кристаллами холестерина.
Фигура 12 представляет собой электронно-микроскопическую фотографию, иллюстрирующую спиралевидные иммуногенные комплексы, образованные Quil A и холестерином на поверхности антигена BVD I типа.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Авторами настоящего изобретения неожиданно было обнаружено, что микрофлюидизация вакцинных препаратов с адъювантом в виде эмульсии типа "масло в воде", содержащей смесь лецитина и минерального масла, не только улучшает физические свойства вакцинного препарата, но также усиливает иммунизирующие эффекты вакцинного препарата. Также микрофлюидизированные вакцинные препараты характеризуются улучшенным профилем безопасности.
На основании этих открытий настоящее изобретение относится к субмикронным эмульсиям типа "масло в воде", пригодным в качестве адъюванта в вакцинных композициях. Также предлагаются способы получения таких субмикронных эмульсий типа "масло в воде" с применением микрофлюидизатора. Кроме того, настоящее изобретение относится к субмикронным вакцинным композициям, в которых антиген комбинирован с субмикронной эмульсией типа "масло в воде". Также предлагаются способы получения таких вакцинных композиций. Кроме того, настоящее изобретение относится к вакцинным композициям, содержащим микроинкапсулированные антигены, комбинированные с субмикронной эмульсией типа "масло в воде" и способам получения таких вакцин.
Для ясности описания, но не для ограничения, подробное описание настоящего изобретения разделено на следующие подразделы, в которых описаны или проиллюстрированы определенные характеристики, варианты осуществления или применения настоящего изобретения.
Субмикронные эмульсии типа "масло в воде"
В одном варианте осуществления настоящее изобретение относится к составам субмикронной эмульсии типа "масло в воде", пригодным в качестве адъюванта вакцины. Субмикронные эмульсии типа "масло в воде" по настоящему изобретению повышают иммуногенность антигенов в вакцинных композициях, являются безопасными для введения животным и стабильными при хранении.
Субмикронные эмульсии типа "масло в воде" по настоящему изобретению содержат неметаболизирующееся масло, по меньшей мере одно поверхностно-активное вещество и водный компонент, где масло диспергировано в водном компоненте со средним размером масляных капель субмикронного порядка.
Под термином "субмикронный" подразумевают, что размер капель составляет менее 1 мкм (микрона) и средняя величина или среднее значение размера масляных капель составляет менее 1 мкм. Предпочтительно средний размер капель эмульсии составляет менее 0,8 мкм; более предпочтительно менее 0,5 мкм и еще более предпочтительно менее 0,4 мкм или приблизительно 0,1-0,3 мкм.
Термин "средний размер капель" определяется как размер частиц среднего диаметра по объему (VMD) в пределах объемного распределения размеров частиц. VMD вычисляют умножением диаметра каждой частицы на объем всех частиц этого объема выборки и суммированием. Затем это значение делят на общий объем всех частиц.
В рамках изобретения термин "неметаболизирующееся масло" относится к маслам, которые не могут метаболизироваться в организме животного субъекта, которому вводят эмульсию.
В рамках изобретения термины "животное" и "животный субъект" относятся ко всем не относящимся к человеку животным, включая, например, крупный рогатый скот, овец и свиней.
Неметаболизирующиеся масла, приемлемые для использования в эмульсиях по настоящему изобретению, включают в себя алканы, алкены, алкины и соответствующие им кислоты и спирты, их простые и сложные эфиры и их смеси. Предпочтительно отдельные структуры масел представляют собой легкие углеводородные соединения, т.е. такие компоненты имеют от 6 до 30 атомов углерода. Масло можно получить синтетически или очисткой нефтяных продуктов. Предпочтительные для использования в эмульсиях по настоящему изобретению неметаболизирующиеся масла включают в себя, например, минеральное масло, парафиновое масло, циклопарафины.
Термин "минеральное масло" относится к смеси жидких углеводородов, полученных из вазелина способами дистилляции. Термин является синонимом терминам "жидкий парафин", "жидкий вазелин" и "белое минеральное масло". Термин также подразумевает включение термина "легкое минеральное масло", т.е. масло, которое аналогично получено дистилляцией вазелинового масла, но которое обладает более низким удельным весом, чем белое минеральное масло. См., например, Remington's Pharmaceutical Sciences, 18th Edition (Easton, Pa.: Mack Publishing Company, 1990, стр. 788 и 1323). Минеральное масло можно получать из различных коммерческих источников, например, J.T. Baker (Phillipsburg, PA), USB Corporation (Cleveland, OH). Предпочтительное минеральное масло представляет собой легкое минеральное масло, коммерчески доступное под названием DRAKEOL®.
Как правило, масляный компонент субмикронных эмульсий по настоящему изобретению представлен в количестве от 1% до 50% по объему; предпочтительно в количестве от 10% до 45%; более предпочтительно в количестве от 20% до 40%.
Эмульсии типа "масло в воде" по настоящему изобретению, как правило, включают в себя по меньшей мере одно (т.е. одно или несколько) поверхностно-активное вещество. Поверхностно-активные вещества и эмульгаторы - термины, которые используются здесь взаимозаменяемо, - представляют собой вещества, которые стабилизируют поверхность масляных капель и поддерживают масляные капли в пределах желательных размеров.
Поверхностно-активные вещества, пригодные для использования в настоящих эмульсиях, включают в себя природные биологически совместимые поверхностно-активные вещества и неприродные синтетические поверхностно-активные вещества. Биологически совместимые поверхностно-активные вещества включают в себя фосфолипидные соединения или смесь фосфолипидов. Предпочтительными фосфолипидами являются фосфатидилхолины (лецитин), такие как соевый или яичный лецитин. Лецитин можно получать в виде смеси фосфатидов и триглицеридов промыванием водой неочищенных растительных масел и разделением и высушиванием полученных гидратированных камедей. Очищенный продукт можно получать фракционированием смеси путем промывания ацетоном для получения нерастворимых в ацетоне фосфолипидов и гликолипидов, оставшихся после удаления триглицеридов и растительного масла при промывании ацетоном. Альтернативно, лецитин можно получать из различных коммерческих источников. Другие приемлемые фосфолипиды включают в себя фосфатидилглицерин, фосфатидилинозит, фосфатидилсерин, фосфатидную кислоту, кардиолипин и фосфатидилэтаноламин. Фосфолипиды можно выделять из природных источников или синтезировать обычными способами.
Неприродные синтетические поверхностно-активные вещества, пригодные для применения в субмикронных эмульсиях по настоящему изобретению, включают в себя неионные поверхностно-активные вещества на основе сорбитана, например замещенные жирными кислотами сорбитановые поверхностно-активные вещества (коммерчески доступные под названием SPAN® или ARLACEL®), сложные эфиры жирной кислоты и полиэтоксилированного сорбита (TWEEN®), сложные эфиры полиэтиленгликоля и жирных кислот из источников, таких как касторовое масло (EMULFOR); полиэтоксилированные жирные кислоты (например, стеариновая кислота, доступная под названием SIMULSOL M-53), сополимер полиэтоксилированного изооктилфенола и формальдегида (TYLOXAPOL), полиоксиэтиленовый эфир жирного спирта (BRIJ®); нонилфениловые эфиры полиоксиэтилена (TRITON® N), изооктилфениловые эфиры полиоксиэтилена (TRITON® X). Предпочтительные синтетические поверхностно-активные вещества представляют собой поверхностно-активные вещества, доступные под названием SPAN® и TWEEN®.
Предпочтительные поверхностно-активные вещества для использования в эмульсии типа "масло в воде" по настоящему изобретению включают в себя лецитин, TWEEN-80 и SPAN-80.
В общем, поверхностно-активное вещество или комбинация поверхностно-активных веществ, если используется два или более поверхностно-активных вещества, представлены в эмульсии в количестве от 0,01% до 10% по объему, предпочтительно от 0,1% до 6,0%, более предпочтительно от 0,2% до 5,0%.
Водный компонент содержит дисперсионную фазу эмульсии и может представлять собой воду, забуференный физиологический раствор или любой другой приемлемый водный раствор.
Эмульсии типа "масло в воде" по настоящему изобретению могут включать в себя пригодные и желательные дополнительные компоненты, включая консерванты, осмотические средства, биоадгезивные молекулы и стимулирующие иммунную систему молекулы.
Считается, что биоадгезивные молекулы могут увеличивать доставку и связывание антигенов на намеченные для воздействия поверхности слизистых оболочек или через намеченные для воздействия поверхности слизистых оболочек, обеспечивая слизистым оболочкам иммунитет. Примеры приемлемых биоадгезивных молекул включают в себя кислотные неприродные полимеры, такие как полиакриловая кислота и полиметакриловая кислота (например, CARBOPOL®, CARBOMER); кислотные синтетически модифицированные природные полимеры, такие как карбоксиметилцеллюлоза; нейтральные синтетически модифицированные полимеры, такие как гидроксипропилметилцеллюлоза; основные содержащие аминогруппу полимеры, такие как хитозан; кислотные полимеры, получаемые из природных источников, такие как альгиновая кислота, гиалуроновая кислота, пектин, трагакантовая камедь и камедь карайи; и нейтральные неприродные полимеры, такие как поливиниловый спирт; или их комбинации.
В рамках изобретения термин "стимулирующие иммунную систему молекулы" относится к таким молекулам, которые усиливают защитный иммунный ответ, индуцируемый антигенным компонентом в вакцинных композициях. Приемлемые вещества, стимулирующие иммунную систему, включают в себя компоненты бактериальной клеточной стенки, например производные N-ацетилмурамил-L-аланил-D-изоглутамина, такие как мурабутид, треонил-MDP и мурамилтрипептид; гликозиды сапонина и их производные, например, Quil A, QS 21 и GPI-0100; холестерин и четвертичные аммониевые соединения, например, бромид диметилдиоктадециламмония (DDA) и N,N-диоктадецил-N,N-bis-2-гидроксиэтилпропандиамин ("avridine").
Сапонины представляют собой гликозидные соединения, которые продуцируются в качестве вторичных метаболитов у большого количества видов растений. Химическая структура сапонинов обеспечивает большое разнообразие фармакологических и биологических видов активности, включая какую-либо сильную и эффективную иммунологическую активность.
Структурно сапонины состоят из любого агликона, соединенного с одной или несколькими цепями сахаров. Сапонины можно классифицировать в соответствии с их агликоновым составом: тритерпеновые гликозиды, стероидные гликозиды и стероидные алкалоидные гликозиды.
Сапонин можно выделять из коры Quillaja saponaria. Сапонин давно известен в качестве иммуностимулятора. Dalsgaard, K., "Evaluation of its adjuvant activity with a special reference to the application in the vaccination of cattle against foot-and-mouth disease", Acta. Vet. Scand. 69: 1-40 1978. Неочищенные экстракты растений, содержащие сапонин, увеличивают эффективность вакцин против ящура. Однако при использовании в вакцинах неочищенные экстракты ассоциированы с неблагоприятными побочными эффектами. Впоследствии Dalsgaard частично очистил обладающий адъювантной активностью компонент из сапонина диализом, ионообменной хроматографией и гель-фильтрацией. Dalsgaard, K. et al., "Saponin adjuvants III. Isolation of a substance from Quillaja saponaria Morina with adjuvant activity in foot-and-mouth disease vaccines", Arch. Gesamte. Virusforsch. 44: 243-254, 1974. Обладающий адъювантной активностью компонент, очищенный таким образом, известен как "Quil A". В весовом отношении Quil A демонстрирует увеличенную эффективность и выраженное снижение местных реакций по сравнению с неочищенным сапонином. Quil A широко используется в ветеринарных вакцинах.
Дополнительный анализ Quil A высокоэффективной жидкостной хроматографией (ВЭЖХ) позволил выявить гетерогенную смесь близко родственных сапонинов и привел к открытию QS21, который представляет собой сильный адъювант с уменьшенной или минимальной токсичностью. Kensil C.R. et al., "Separation and characterization of saponins with adjuvant activity from Quillaja saponaria Molina cortex", J. Immunol. 146: 431-437, 1991. В отличие от большинства других иммуностимуляторов QS21 растворим в воде, и его можно использовать в вакцинах с составами эмульсионного типа или без них. Было показано, что у мышей в ответ на субчастицы антигенов QS21 вызывает ответ по типу Th1, стимулируя продукцию антител IgG2a и IgG2b и индуцируя антиген-специфические CD8+ ЦТЛ (MHC класса I). Клинические испытания у человека подтвердили его адъювантные свойства с приемлемым токсикологическим профилем. Kensil, C.R. et al., "Structural and imunological charaterization of the vaccine adjuvant QS-21. In Vaccine Design: the subunit and Adjvuant Approach," Eds. Powell, M.F. and Newman, M. J. Plenum Publishing Corporation, New York. 1995, стр. 525-541.
В патенте США 6080725 описаны способы получения и использования сапонин-липофильного конъюгата. В этом сапонин-липофильном конъюгате липофильная группа, такая как липид, жирная кислота, полиэтиленгликоль или терпен, ковалентно связана с неацилированным или дезацилированным тритерпеновым сапонином через карбоксильную группу, находящуюся на остатке 3-O-глюкуроновой кислоты тритерпенового сапонина. Связывание липофильной группы с остатком 3-O-глюкуроновой кислоты сапонина, такого как дезацилсапонин Quillaj, lucyoside P или сапонин из Gypsophila, saponaria и Acanthophyllum, усиливает адъювантные эффекты на гуморальный и клеточно-опосредованный иммунитет. Кроме того, связывание липофильный группы с остатком 3-O-глюкуроновой кислоты неацилированного или дезацилированного сапонина позволяет получить аналог сапонина, который легче очищается, менее токсичен, химически более стабилен и обладает равными или лучшими адъювантными свойствами, чем оригинальный сапонин.
GPI-0100 представляет собой сапонин-липофильный конъюгат, описанный в патенте США 6080725. GPI-0100 получают присоединением алифатического амина к дезацилсапонину через карбоксильную группу глюкуроновой кислоты.
Четвертичные аммониевые соединения - ряд алифатических азотсодержащих оснований - были предложены для использования в качестве иммунологических адъювантов, включая амины, четвертичные аммониевые соединения, гуанидины, бензамидины и тиуронии. Конкретные такие соединения включают в себя бромид диметилдиоктадециламмония (DDA) и N,N-диоктадецил-N,N-бис(2-гидроксиэтил)пропандиамин ("avridine").
В патенте США 5951988 описан состав адъюванта, содержащий четвертичные соли аммония, такие как DDA, в сочетании с масляным компонентом. Эти составы являются пригодными в сочетании с известными иммунологическими веществами, например вирусными или бактериальными антигенами, в вакцинной композиции для усиления иммуногенного ответа. Композиция также пригодна без включения в состав антигена в качестве неспецифического иммуностимулирующего состава.
В патенте США 4310550 описано применение N,N-высший алкил-N,N'-бис(2-гидроксиэтил)пропандиамина и N,N-высший алкил-ксилилендиаминов, составляющих смесь с жировой или липидной эмульсией, в качестве адъювантов вакцины. Способ стимуляции или усиления иммуногенного ответа на антиген у человека или животных посредством парентерального введения состава адъюванта описан в патенте США 4310550.
В предпочтительном варианте осуществления настоящее изобретение относится к субмикронной эмульсии типа "масло в воде", приемлемой в качестве адъюванта вакцины, которая состоит из состава AMPHIGEN®, с размером капель менее 1 мкм и средним размером капель 0,25 мкм.
В рамках изобретения термин "состав AMPHIGEN®" относится к раствору, получаемому смешиванием масляного раствора лецитина DRAKEOL® (Hydronics, Lincoln, NE) с физиологическим раствором в присутствии TWEEN® 80 и SPAN® 80. Обычный состав AMPHIGEN® содержит 40% по объему (об./об.) легкого минерального масла, приблизительно 25% мас./об. лецитина, приблизительно 0,18% TWEEN 80 по объему (об./об.) и приблизительно 0,08% SPAN 80 по объему (об./об.).
Способы получения субмикронной эмульсии типа "масло в воде"
В другом варианте осуществления настоящее изобретение относится к способам получения субмикронной эмульсии типа "масло в воде", описанной выше.
В соответствии с настоящим изобретением различные компоненты эмульсии, включая масло, одно или несколько поверхностно-активных веществ, водный компонент и любой другой компонент, пригодный для использования в эмульсии, объединяют вместе и смешивают.
Образованную смесь подвергают процессу эмульгирования, как правило, пропуская один или два раза через один или несколько гомогенизаторов или эмульсификаторов с образованием эмульсии типа "масло в воде", которая имеет гомогенный внешний вид и средний размер капель приблизительно 0,5 мкм. Для этих целей можно использовать любой коммерчески доступный гомогенизатор или эмульсификатор, например эмульсификатор Ross (Hauppauge, NY), гомогенизатор Gaulin (Everett, MA).
Затем для получения размера капель субмикронного порядка полученную таким образом эмульсию подвергают микрофлюидизации. Микрофлюидизацию можно осуществлять, используя коммерческий микрофлюидизатор, такой как модель с номером 11OY, поставляемая Microfluidics, Newton, Mass; модель Gaulin 30CD (Gaulin, Inc., Everett, Mass.) и Rainnie Minilab Type 8.30H (Miro Atomizer Food and Dairy, Inc., Hudson, Wis.). Эти микрофлюидизаторы действуют посредством нагнетания жидкостей через маленькие отверстия под высоким давлением, так чтобы два потока жидкостей взаимодействовали при высоких скоростях в камере для взаимодействия с образованием эмульсий с каплями субмикронного размера.
Размер капель можно определять множеством известных в данной области способов, например лазерной дифракцией, с использованием коммерчески доступных устройств для измерения. Размер может варьироваться в зависимости от типа используемого поверхностно-активного вещества, соотношения поверхностно-активного вещества и масла, рабочего давления, температуры и т.п. Специалист может определить желательную комбинацию этих параметров для получения эмульсий с желательным размером капель без излишнего экспериментирования. Капли эмульсий по настоящему изобретению составляют в диаметре менее 1 мкм, предпочтительно со средним размером капель менее 0,8 мкм, более предпочтительно со средним размером капель менее 0,5 мкм и еще более предпочтительно со средним размером капель менее 0,3 мкм.
В предпочтительном варианте осуществления настоящего изобретения масляный раствор лецитина DRAKEOL, коммерчески поставляемый Hydronics (Lincoln, NE) и содержащий 25% лецитина в легком минеральном масле, объединяют и смешивают с физиологическим раствором, а также с поверхностно-активными веществами TWEEN® 80 и SPAN® 80 с получением "раствора AMPHGEN®" или "состава AMPHIGEN®". Раствор AMPHGEN® затем эмульгируют посредством эмульсификатора Ross® (Hauppauge, NY 11788) при приблизительно 3400 об/мин с получением эмульсии типа "масло в воде". Затем эмульсию пропускают один раз через микрофлюидизатор, работающий приблизительно при 4500 ± 500 фунт/кв. дюйм. Микрофлюидизированная эмульсия типа "масло в воде" имеет капли размером менее 1 мкм, со средним размером капель приблизительно 0,25 мкм.
Вакцинные композиции, содержащие антигены, включенные в состав субмикронной эмульсии типа "масло в воде"
В другом варианте осуществления настоящее изобретение относится к вакцинным композициям, содержащим антиген(ы) и субмикронную эмульсию типа "масло в воде", описанную выше. Такие вакцинные композиции характеризуются наличием усиленного иммуногенного эффекта и улучшенными физическими свойствами (например, не наблюдается разделения фаз после продолжительного периода хранения). Кроме того, вакцинные композиции по настоящему изобретению являются безопасными для введения животным.
В соответствии с настоящим изобретением антиген можно комбинировать с эмульсией отдельно или предпочтительно непосредственно в составе эмульсии. Термин "непосредственно" относится к процессу, где антиген комбинируют с компонентами эмульсии перед этапом микрофлюидизации. Термин "отдельно" относится к процессу, где антиген добавляют к эмульсии после микрофлюидизации эмульсии. Антиген, добавленный отдельно, может быть свободным антигеном или он может быть инкапсулирован в микрочастицы, как дополнительно описано ниже.
В рамках изобретения термин "антиген" относится к любой молекуле, соединению или композиции, которые являются иммуногенными для животных и которые включают в состав вакцинной композиции, чтобы вызвать защитный иммунный ответ у животных, которым вводят вакцины.
Термин "иммуногенный", используемый в отношении антигена, относится к способности антигена вызывать иммунный ответ, опосредуемый первично цитотоксическими Т-клетками, или гуморальный иммунный ответ, опосредуемый первично T-хелперами, которые, в свою очередь, активируют B-клетки, что приводит к продукции антител.
Термин "защитный иммунный ответ" определяется как любой иммунный ответ, опосредованный как антителами, так и клеточно-опосредованный, или и тем и другим, возникающий у животных, который либо предотвращает, либо заметно снижает встречаемость, или устраняет, или заметно снижает тяжесть, или заметно замедляет скорость прогрессирования нарушения или заболевания, вызванного антигеном или содержащим антиген патогеном.
Антигены, которые могут быть включены в состав вакцинной композиции по настоящему изобретению, включают в себя антигены, полученные из патогенных бактерий, таких как Mycoplasma hyopneumoniae, Haemophilus somnus, Haemophilus parasuis, Bordetella bronchiseptica, Actinobacillus pleuropneumonie, Pasteurella multocida, Manheimia hemolytica, Mycoplasma bovis, Mycoplasma galanacieum, Mycobacterium bovis, Mycobacterium paratuberculosis, Clostridial spp., Streptococcus uberis, Streptococcus suis, Staphylococcus aureus, Erysipelothrix rhusopathiae, Campylobacter spp., Fusobacterium necrophorum, Escherichia coli, Salmonella enterica serovars, Leptospira spp.; и патогенных грибов, таких как Candida; простейших, таких как Cryptosporidium parvum, Neospora canium, Toxoplasma gondii, Eimeria spp.; гельминтов, таких как Ostertagia, Cooperia, Haemonchus, Fasciola, или в форме инактивированных цельных или частичных клеточных препаратов, или в форме антигенных молекул, полученных обычными способами очистки белков, способами генетической инженерии или химическим синтезом. Дополнительные антигены включают в себя патогенные вирусы, такие как бычьи герпесвирусы-1,3,6, бычий вирус вирусной диареи (BVDV) типов 1 и 2, бычий вирус парагриппа, бычий респираторно-синцитиальный вирус, вирус бычьего лейкоза, вирус чумы, вирус ящура, бешенства, вирус чумы свиней, вирус африканской чумы свиней, парвовирус свиней, вирус PRRS, цирковирус свиней, вирус гриппа, вирус везикулярной болезни свиней, вирус лихорадки Techen, вирус псевдобешенства, либо в форме инактивированного цельного или частичного вирусного препарата, либо в форме антигенных молекул, полученных обычными способами очистки белков, способами генетической инженерии или химическим синтезом.
Количество антигена должно быть таким, чтобы антиген, который комбинирован с эмульсией типа "масло в воде", эффективно вызывал защитный иммунный ответ у животных. Точное количество антигена, являющееся эффективным, зависит от природы, активности и чистоты антигена и может быть определено специалистом в данной области.
Точное количество эмульсии типа "масло в воде", представленной в вакцинных композициях, должно быть достаточным для усиления иммуногенности антигена(ов) в вакцинных композициях. Если желательно и приемлемо, дополнительные количества поверхностно-активного вещества (веществ) или дополнительное поверхностно-активное вещество(а) можно добавлять в вакцинную композицию в дополнение к поверхностно-активному веществу(ам), представленному в эмульсии типа "масло в воде". В общем, масляный компонент представлен в конечном объеме вакцинной композиции в количестве от 1,0% до 20% по объему; предпочтительно в количестве от 1,0% до 10%; более предпочтительно в количестве от 2,0% до 5,0%. Поверхностно-активное вещество или комбинация поверхностно-активных веществ, если используются два или более поверхностно-активных вещества, находятся в конечном объеме вакцинной композиции в количестве от 0,1% до 20% по объему, предпочтительно от 0,15% до 10%, более предпочтительно от 0,2% до 6,0%.
В дополнение к антигену(ам) и эмульсии типа "масло в воде" вакцинная композиция может включать в себя другие компоненты, которые являются приемлемыми и желательными, такие как консерванты, осмотические средства, биоадгезивные молекулы и иммуностимулирующие молекулы (например, Quil A, холестерин, GPI-0100, бромид диметилдиоктадециламмония (DDA)), как описано выше в отношении эмульсии типа "масло в воде".
Вакцинные композиции по настоящему изобретению также могут включать в себя приемлемый для ветеринарии носитель. Термин "приемлемый для ветеринарии носитель" включает в себя любые и все растворители, диспергенты, покрытия, адъюванты, стабилизаторы, разбавители, консерванты, антибактериальные и противогрибковые средства, изотонические средства, замедляющие всасывание средства и т.п. Разбавители могут включать в себя воду, физиологический раствор, декстрозу, этанол, глицерин и т.п. Изотонические средства могут включать в себя, среди прочих, хлорид натрия, декстрозу, маннит, сорбит и лактозу. Стабилизаторы включают в себя, среди прочих, альбумин.
В предпочтительном варианте осуществления настоящее изобретение относится к вакцинной композиции, которая включает в себя по меньшей мере один из антигенов BVDV I типа или BVDV II типа, включенных непосредственно в состав эмульсии типа "масло в воде", которая имеет капли размером менее 1 мкм, предпочтительно со средним размером капель менее 0,8 мкм, более предпочтительно менее 0,5 мкм и еще более предпочтительно со средним размером капель приблизительно 0,5 мкм. Антиген BVDV I и/или II типа предпочтительно находится в форме инактивированного вирусного препарата. Субмикронная эмульсия типа "масло в воде" предпочтительно состоит из состава AMPHIGEN® (т.е. состава, который содержит легкое минеральное масло, лецитин, TWEEN® 80 и SPAN® 80). Также вакцинная композиция предпочтительно включает в себя Quil-A, холестерин и тимеросол.
В другом предпочтительном варианте осуществления настоящее изобретение относится к вакцинной композиции, которая включает в себя антиген лептоспир и по меньшей мере один из антигенов BVDV I типа или BVDV II типа в эмульсии типа "масло в воде". Антигены, предпочтительно в форме инактивированного клеточного или вирусного препарата, включены непосредственно в состав эмульсии типа "масло в воде", имеющей капли размером менее 1 мкм, предпочтительно со средним размером капель менее 0,8 мкм, более предпочтительно менее 0,5 мкм и еще более предпочтительно со средним размером капель приблизительно 0,5 мкм. Субмикронная эмульсия типа "масло в воде" предпочтительно состоит из состава AMPHIGEN (т.е. состава, который содержит легкое минеральное масло, лецитин, TWEEN® 80 и SPAN® 80). Также вакцинная композиция предпочтительно включает в себя один или несколько видов иммуностимулирующих молекул, выбранных из Quil-A, холестерина, DDA, GPI-100 и гидроксида алюминия (AlOH).
В еще одном предпочтительном варианте осуществления настоящее изобретение относится к вакцинной композиции, которая включает в себя по меньшей мере один бактериальный антиген, например рекомбинантный белок PauA из Streptococcus uberis, или клеточный препарат E. coli, или их сочетание, в эмульсии типа "масло в воде". Антиген(ы) комбинируют непосредственно в составе эмульсии типа "масло в воде", которая имеет капли размером менее 1 мкм, предпочтительно со средним размером капель менее 0,8 мкм, более предпочтительно менее 0,5 мкм и еще более предпочтительно со средним размером капель приблизительно 0,25 мкм. Субмикронная эмульсия типа "масло в воде" предпочтительно состоит из состава AMPHIGEN® (т.е. состава, который содержит легкое минеральное масло, лецитин, TWEEN® 80 и SPAN® 80). Также вакцинная композиция предпочтительно включает в себя один или несколько видов иммуностимулирующих молекул, выбранных из Quil A, DDA и GPI-100.
Вакцинные композиции по настоящему изобретению можно вводить животным известными способами, включая пероральный, интраназальный способы, нанесение на слизистую оболочку, местный, чрескожный и парентеральный (например, внутривенный, внутрибрюшинный, внутрикожный, подкожный или внутримышечный) способы. Введение можно осуществлять сочетанием способов, например первое введение с использованием парентерального способа и последующее введение с использованием нанесения
на слизистую оболочку.
Способы получения вакцинных композиций
В другом варианте осуществления настоящее изобретение относится к способам получения вакцинных композиций, содержащих антиген или антигены и субмикронную эмульсию типа "масло в воде".
При получении вакцинных композиций по настоящему изобретению антиген(ы) можно комбинировать или непосредственно с компонентами эмульсии типа "масло в воде", или отдельно. Предпочтительно антиген комбинируют непосредственно с компонентами эмульсии типа "масло в воде".
Антиген можно комбинировать с различными компонентами эмульсии, включающими в себя масло, одно или несколько поверхностно-активных веществ, водный компонент и любой другой приемлемый компонент, с образованием смеси. Смесь подвергают первичному процессу перемешивания, как правило, пропуская один или несколько раз через один или несколько гомогенизаторов или эмульсификаторов, с получением эмульсии типа "масло в воде", содержащей антиген. Для этих целей можно использовать любой коммерчески доступный гомогенизатор или эмульсификатор, например эмульсификатор Ross (Hauppauge, NY), гомогенизатор Gaulin (Everett, MA) или Microfluidics (Newton, MA). Альтернативно, различные компоненты эмульсионного адъюванта, включая масло, одно или несколько поверхностно-активных веществ и водный компонент, можно объединять сначала для получения эмульсии типа "масло в воде" с применением гомогенизатора или эмульсификатора; а затем к этой эмульсии добавлять антиген. Средний размер капель эмульсии типа "масло в воде" после первичного перемешивания приблизительно равен 1,0-1,2 микрон.
Затем для получения размера капель субмикронного порядка эмульсию, содержащую антиген, подвергают микрофлюидизации. Микрофлюидизацию можно осуществлять с применением коммерческого микрофлюидизатора, такого как модель с номером 11OY, поставляемая Microfluidics, Newton, Mass; Gaulin Model 30CD (Gaulin, Inc., Everett, Mass.) и Rainnie Minilab Type 8.30H (Miro Atomizer Food and Dairy, Inc., Hudson, Wis.).
Размер капель можно определять множеством известных в данной области способов, например лазерной дифракцией, с использованием коммерчески доступных измерительных устройств. Размер может варьировать в зависимости от типа используемого поверхностно-активного вещества, соотношения поверхностно-активного вещества и масла, рабочего давления, температуры и т.п. Для получения эмульсий с желательным размером капель можно определить желательную комбинацию этих параметров. Масляные капли эмульсий по настоящему изобретению имеют диаметр менее 1 мкм. Предпочтительно средний размер капель составляет менее 0,8 мкм. Более предпочтительно средний размер капель составляет менее 0,5 мкм. Еще более предпочтительно средний размер капель составляет приблизительно от 0,1 до 0,3 мкм.
В предпочтительном варианте осуществления настоящего изобретения масляный раствор лецитина DRAKEOL®, который содержит 25% лецитина в легком минеральном масле, объединяют и смешивают с поверхностно-активными веществами TWEEN® 80 и SPAN® 80 и физиологическим раствором с получением смеси, содержащей 40% легкого минерального масла, лецитин, 0,18% TWEEN® 80 и 0,08% SPAN® 80. Затем смесь эмульгируют с применением эмульсификатора Ross® (Hauppauge, NY 11788) приблизительно при 3400 об/мин с получением эмульсионного продукта, который также относится к "составу AMPHIGEN®" или "раствору AMPHIGEN®". Затем желательный антиген(ы) комбинируют с раствором AMPHIGEN® и любыми другими приемлемыми компонентами (например, иммуностимулирующими молекулами) с применением эмульсификатора, например гомогенизатора Ross, с получением эмульсии типа "масло в воде", содержащей антиген(ы). Такую эмульсию пропускают один раз через микрофлюидизатор, работающий приблизительно при 10000 ± 500 фунт/кв. дюйм. Микрофлюидизированная эмульсия типа "масло в воде" имеет капли с размером менее 1 мкм, со средним размером капель приблизительно 0,25 мкм.
В другом предпочтительном варианте осуществления перед объединением эмульсии типа "масло в воде" (например, состава AMPHIGEN®) с желательным антигеном(ами) антиген(ы) комбинируют с гликозидом сапонина, например Quil A, с получением смеси. Эту смесь антигена(ов) и сапонина подвергают гомогенизации, например, в емкости для гомогенизации. Затем к гомогенизированной смеси антигена(ов) и сапонина добавляют стерин, например холестерин. Затем смесь, содержащую антиген(ы), сапонин и стерин, подвергают дополнительной гомогенизации. Затем гомогенизированную смесь антигена(ов), сапонина и стерина комбинируют с эмульсией типа "масло в воде" (например с составом AMPHIGEN®) с применением, например, гомогенизатора. Затем гомогенизированную эмульсию типа "масло в воде", содержащую антиген(ы), сапонин и стерин, подвергают гомогенизации под высоким давлением, такой как микрофлюидизация.
Вакцинные композиции, содержащие микроинкапсулированные антигены в субмикронной эмульсии типа "масло в воде", и способы получения
В еще одном варианте осуществления настоящее изобретение относится к вакцинным композициям, которые содержат антиген, инкапсулированный в микрочастицы (или "микроинкапсулированный антиген"), где микроинкапсулированный антиген отдельно включают в состав субмикронной эмульсии типа "масло в воде", описанной выше.
Способы абсорбции или включения антигенов в носители в форме частиц известны в данной области. См., например, Pharmaceutical Particulate Carriers: Therapeutic Applications (Justin Hanes, Masatoshi Chiba and Robert Langer. Polymer microspheres for vaccine delivery. In: Vaccine design. The subunit and adjuvant approach. Eds. Michael F. Powell and Mark J. Newman, 1995 Plenum Press, New York and London). Носители в форме частиц могут презентировать множественные копии выбранного антигена иммунной системе животного субъекта и обеспечивать захват и удерживание антигенов в местных лимфатических узлах. Частицы могут быть фагоцитированы макрофагами и могут усилить презентацию антигена посредством высвобождения цитокинов. Носители в форме частиц также были описаны в данной области и включают в себя, например, носители, полученные из полимеров полиметилметакрилата, а также носители, полученные из полилактидов и сополимеров лактида и гликолида, известных как PLG. Полимеры полиметилметакрилата не являются биодеградируемыми, в то время как частицы PLG могут подвергаться биодеградации путем произвольного неферментативного гидролиза сложноэфирных связей с молочной и гликолевой кислотами, которые экскретируются естественными метаболическими путями.
Также биодеградируемые микросферы используют для осуществления контролируемого высвобождения вакцин. Например, можно добиться длительного высвобождения антигена в течение продолжительного периода времени. В зависимости от молекулярной массы полимера и соотношения молочной и гликолевой кислот в полимере полимер PLGA может обладать скоростью гидролиза от нескольких суток или недель до нескольких месяцев или года. Медленное контролируемое высвобождение может приводить к образованию высоких уровней антител, сходных с уровнями, наблюдаемыми после многократных инъекций. Альтернативно выбором полимеров с различными уровнями гидролиза можно добиваться пульсирующего высвобождения антигенов вакцин. Скорость гидролиза полимера, как правило, зависит от молекулярной массы полимера и соотношения молочной и гликолевой кислот в полимере. Микрочастицы, изготовленные из двух или более различных полимеров с различными скоростями высвобождения антигена, обеспечивают пульсирующее высвобождение антигенов и имитируют режим многократного приема при вакцинации.
В соответствии с настоящим изобретением антиген, включающий в себя любой из описанных выше антигенов, может быть абсорбирован на любом полимерном носителе в форме частиц, предпочтительно на полимере PLG, с применением любых известных в данной области процедур (таких как способ, проиллюстрированный в примере 17), с получением микроинкапсулированного препарата антигена. Затем микроинкапсулированный препарат антигена смешивают и диспергируют в субмикронной эмульсии типа "масло в воде", которая описана выше, с получением вакцинной композиции.
В предпочтительном варианте осуществления настоящее изобретение относится к вакцинной композиции, которая содержит антиген, инкапсулированный в полимере PLG, где микроинкапсулированный антиген диспергирован отдельно в микрофлюидизированной эмульсии типа "масло в воде", которая состоит из легкого минерального масла, лецитина, TWEEN 80, SPAN 80 и физиологического раствора и имеет средний размер капель менее 1,0 мкм.
Комплексы, образуемые сапонином и стерином
В одном варианте осуществления настоящее изобретение относится к композициям, содержащим сапонин и стерин, где сапонин и стерин образуют комплексы в форме спиралевидных мицелл. В соответствии с настоящим изобретением эти комплексы обладают иммуностимулирующей активностью.
Под термином "иммуностимулирующий" подразумевают, что комплексы могут усиливать иммунный ответ, индуцируемый антигенным компонентом, или что комплексы могут индуцировать иммунный ответ независимо от отдельного антигенного компонента.
В соответствии с настоящим изобретением предпочтительным для использования в композиции по настоящему изобретению сапонином является Quil A.
Предпочтительные для использования в адъювантных композициях по настоящему изобретению стерины включают в себя бета-ситостерин, стигмастерин, эргостерин, эргокальциферол и холестерин. Эти стерины хорошо известны в данной области, например холестерин описан в Merck Index, 11th Edn., стр. 341 в качестве природного стерина, находящегося в животном жире. Наиболее предпочтительным стерином является холестерин.
Соотношение сапонин:стерин в композиции составляет, как правило, приблизительно от 1:100 до 5:1 мас./мас. Предпочтительно соотношение составляет 1:1.
В другом варианте осуществления настоящее изобретение относится к вакцинным композициям, содержащим сапонин, стерин и антиген, где сапонин и стерин образуют комплексы в форме спиралевидных мицелл и где антиген смешан со спиралевидными мицеллами, но не включен в их состав.
Ниже следуют примеры частных вариантов осуществления настоящего изобретения. Примеры предлагаются только для иллюстративных целей и в любом случае не предназначены для ограничения объема настоящего изобретения.
ПРИМЕР 1
Получение состава AMPHIGEN®
Состав AMPHIGEN® получали двухстадийным процессом. На первом этапе 80 литров масляного раствора лецитина Drakeol, 116 литров столбнячного токсина в физиологическом растворе, 1,2 литра SPAN 80 и 2,8 литра TWEEN 80 смешивали и эмульгировали с применением эмульсификатора Ross. Масляный раствор лецитина Drakeol содержит 25% соевого лецитина и 75% минерального масла. Эмульгированный продукт рециркулировали в эмульсификаторе Ross минимум в 5 объемах или минимум 10 минут. Эмульгированный продукт хранили при 2-7°C максимум в течение 24 часов для дальнейшей обработки. Эмульсию из емкости эмульсификатора Ross переносили в гомогенизатор Gaulin и гомогенизировали в течение 20 минут под давлением 4500 фунт/кв. дюйм. Затем полученный в результате 40% масляный раствор лецитина Drakeol (в дальнейшем в этом документе "состав AMPHIGEN®" или "раствор AMPHIGEN®") распределяли в стерильные карбокси-полипропиленовые контейнеры. Распределение осуществляли в распределительном вытяжном шкафу класса 100, находящемся в контролируемых условиях класса 10000. Контейнеры хранили при 2-7°C. Эти составы AMPHIGEN® использовали в описанных ниже экспериментах, если нет иных указаний.
ПРИМЕР 2
Первичное смешивание вакцины BVD гомогенизацией с помощью Flashblend
Устройство, используемое для этого процесса гомогенизации, представлено на фигуре 1. Используя асептическую технику или паровые трехходовые клапаны, сосуд, содержащий антиген BVD I типа (инактивированный вирусный препарат BVD I типа), соединяли с отверстием в нижней части емкости для смешивания. После завершения перенесения необходимого объема антигена BVD I типа сосуд с BVD I типа заменяли сосудом, содержащим инактивированный вирусный препарат BVD II типа (инактивированный вирусный препарат BVD II типа). После завершения перенесения необходимого количества антигена BVD II типа с переносной емкостью соединяли гомогенизатор Ross и начинали рециркуляцию при максимальном уровне об/мин (3300 об/мин). Перемешивание содержимого емкости поддерживали при средней скорости.
Используя асептическую технику или паровой трехходовой клапан, сосуд, содержащий Quil A в концентрации 50 мг/мл, соединяли со встроенным отверстием гомогенизатора на емкости для смешивания. Необходимое количество раствора Quil A пропускали в емкость через трубу для всасывания. После завершения перенесения раствора Quil A сосуд удаляли. Таким же образом необходимое количество холестерина в растворе этанола (18 мг/мл) переносили в емкость для смешивания. Затем в сосуд для смешивания добавляли необходимое количество состава AMPHIGEN®, 10% раствор тимеросола и растворы наполнителей в базальной модифицированной среде Игла ("BME").
После завершения добавления всех компонентов перемешивание продолжали в течение 15 минут. Полученный препарат разделяли на аликвоты в 2-мл дозы, и он представлял собой немикрофлюидизированную вакцину BVD на основе состава AMPHIGEN®. Каждая доза вакцины содержала 500 мкг Quil A, 500 мкг холестерина, 2,5% состава AMPHIGEN® и 0,009% тимеросола. Концентрацию антигена для двух различных штаммов BVD определяли в единицах титра gp53 посредством ELISA.
ПРИМЕР 3
Дополнительное смешивание посредством микрофлюидизации
Фигура 2 иллюстрирует процесс, используемый для дополнительного смешивания посредством микрофлюидизации. Микрофлюидизатор стерилизовали паром. Сначала вспомогательный модуль камеры для обработки устанавливали в устройство, и пустую камеру устанавливали во вторую позицию для камеры. Емкость, содержащую вакцину BVD с полным адъювантом, полученную, как описано в примере 2, соединяли с микрофлюидизатором посредством присоединения трубки для переноса из выпускного клапана емкости для подачи к впускному отверстию микрофлюидизатора. Газообразный азот подключали к отверстию воздухоочистителя емкости для подачи и значение давления в емкости доводили до 20 +/- 5 фунт/кв.дюйм. Выпускной клапан емкости для сбора соединяли с трубкой для переноса выпускного отверстия микрофлюидизатора. После осуществления всех необходимых соединений клапаны открывали, и начиналась микрофлюидизация при рабочем давлении 10000 +/- 500 фунт/кв. дюйм. Полный состав вакцины пропускали через микрофлюидизатор один раз и собирали в пост-микрофлюидизационной камере. Этот препарат разделяли на аликвоты в дозы по 2 мл, и он представлял собой микрофлюидизированную вакцину BVD на основе состава AMPHIGEN®.
ПРИМЕР 4
Получение вакцинной композиции с помощью настольного смесителя
Состав AMPHIGEN®, полученный, как описано в примере 1, разбавляли до 2,5% добавлением антигенов BVD и наполнителя. Полученный в результате раствор смешивали с помощью настольного смесителя с применением магнитной мешалки вместо использования гомогенизатора. Конечный препарат содержал следующую композицию: антигены BVD 1 типа и 2 типа, 2,5% состав AMPHIGEN® (который содержит масло, лецитин, SPAN® и TWEEN®, как описано в примере 1) и физиологический раствор. TWEEN 80 и SPAN 80 представлены в конечном вакцинном препарате в количестве 0,18% и 0,08% по объему соответственно.
ПРИМЕР 5
Сравнение распределения размера капель между немикрофлюидизированными и микрофлюидизированными вакцинными препаратами на основе состава AMPHIGEN®
Немикрофлюидизированную вакцину на основе состава AMPHIGEN®, полученную, как описано в примере 2, микрофлюидизированную вакцину на основе состава AMPHIGEN®, полученную, как описано в примере 3, и препарат, полученный с помощью настольного смесителя, как описано в примере 4, использовали для сравнения размера капель вакцинных препаратов. Два миллилитра образца каждого из препаратов добавляли в прибор для определения путем лазерной дифракции Malvern 2000 и определяли распределение размера капель. Как представлено на фигуре 3, результаты показывают, что микрофлюидизированный вакцинный препарат на основе состава AMPHIGEN® имел максимальный размер частиц приблизительно 0,1 микрон, в то время как немикрофлюидизированный вакцинный препарат на основе состава AMPHIGEN® имел максимальный размер частиц приблизительно 1 микрон.
ПРИМЕР 6
Уменьшение разделения фаз в вакцине
Три различных вакцинных препарата: немикрофлюидизированную вакцину на основе состава AMPHIGEN®, полученную, как описано в примере 2, микрофлюидизированную вакцину на основе состава AMPHIGEN®, полученную, как описано в примере 3, и вакцину, полученную с помощью настольного смесителя, как описано в примере 4, сравнивали друг с другом для определения их свойств в отношении разделения фаз в течение длительного хранения. Все эти препараты оставляли стоять при 4°C в течение приблизительно одного месяца и определяли разделение фаз с точки зрения появления отделившегося слоя в верхней части вакцинных препаратов. Как представлено на фигуре 4, в микрофлюидизированном препарате на основе состава AMPHIGEN® не было разделения фаз, когда сравнивали с двумя другими препаратами.
ПРИМЕР 7
Получение микрофлюидизированной и немикрофлюидизированной вакцины для крупного рогатого скота против бычьего вируса вирусной диареи
Вирусный антиген вируса бычьей вирусной диареи включали непосредственно в состав AMPHIGEN® посредством микрофлюидизации. Термин "включенный непосредственно в состав" относится к процессу, где антиген добавляют к составу AMPHIGEN® до микрофлюидизации. Антиген подвергали физическому воздействию в процессе микрофлюидизации вместе с компонентами препарата адъюванта. В контрольной немикрофлюидизированной группе препарат антигена диспергировали в составе AMPHIGEN® посредством перемешивания.
Конечные композиции контрольного и микрофлюидизированного препаратов были следующими: BVD I типа c пост-инактивационным титром при ELISA, равным 2535 У.Е./доза для gp53, BVD II типа с пост-инактивационным титром при ELISA, равным 3290 У.Е./доза для gp53, Quil-A в концентрации 1,25 мг/доза, холестерин в концентрации 1,25 мг/доза, состав AMPHIGEN® в конечной концентрации 2,5% и тимеросол в конечной концентрации 0,009%. Доза вакцины составляла 5 мл.
ПРИМЕР 8
Длительная стабильность вирусных антигенов BVD, включенных непосредственно в состав микрофлюидизированного вакцинного препарата на основе состава AMPHIGEN®
Этот эксперимент осуществляли с целью определения стабильности антигена, включенного непосредственно в состав, в течение длительного хранения. Убитый вирусный антиген BVD II типа включали непосредственно в состав AMPHIGEN® в процессе микрофлюидизации с получением микрофлюидизированного вакцинного препарата (A907505). Три других вакцинных препарата, содержащих указанный антиген в немикрофлюидизированном составе AMPHIGEN® (A904369, A904370 и A904371), служили в качестве контроля. В немикрофлюидизированных препаратах антиген объединяли с составом AMPHIGEN® и смешивали посредством перемешивания в гомогенизаторе Ross. Все четыре вакцинных препарата хранили при 4°C в течение двух лет. На различных этапах хранения (0, 6, 12 или 24 месяцев) все четыре препарата использовались для вакцинации коров в возрасте трех месяцев.
На 0 и 21 сутки трехмесячных коров вакцинировали подкожным способом 2 мл вакцинного препарата. На 35 сутки осуществляли забор сыворотки вакцинированных животных и определяли серологический ответ на вакцину, выраженный в единицах титра антител против BVDV-E2 при ELISA. Как представлено на фигуре 5, микрофлюидизированный вакцинный препарат показывал более высокий титр антител на всех этапах тестирования (0, 6, 12, и 24 месяц), что позволяет предположить, что стабильность препарата антигена не теряется вследствие включения антигена непосредственно в состав в процессе микрофлюидизации. Кроме того, также неожиданно было обнаружено, что микрофлюидизированный вакцинный препарат вызывает усиленный иммунный ответ на всех этапах.
ПРИМЕР 9
Снижение индуцируемого вакциной повышения ректальной температуры после микрофлюидизации
Микрофлюидизированные и немикрофлюидизированные вакцинные препараты, полученные, как описано в примере 7, использовали для вакцинации крупного рогатого скота на нулевые сутки и определяли ректальную температуру в течение периода времени от одних суток перед вакцинацией до четырех суток после вакцинации. Доза вакцины составляла 2 мл. Группы вакцинировали однократной и двойной дозами вакцины. Ректальную температуру измеряли и записывали ежедневно с -1 по 4 сутки включительно. Ректальную температуру на 0 сутки измеряли перед введением тестируемого образца.
Как представлено не фигуре 6, результаты показывают, что у животных, вакцинированных однократной или двойной дозой немикрофлюидизированного препарата, происходил крутой подъем ректальной температуры приблизительно в течение 24 часов после вакцинации. Однако у животных, вакцинированных микрофлюидизированной формой вакцины, подъем ректальной температуры после вакцинации был минимальным и значительно более низким, чем у животных, вакцинированных немикрофлюидизированным препаратом (фигура 6).
ПРИМЕР 10
Размер реакции в области введения снижался быстрее при вакцинации микрофлюидизированными вакцинными препаратами
Микрофлюидизированные и немикрофлюидизированные вакцинные препараты, полученные, как описано в примере 7, использовали для вакцинации крупного рогатого скота на нулевые сутки. Включенные в это исследование животные представляли собой гибридный крупный рогатый скот мясного направления. В каждой группе, получавших плацебо, было по три животных (T01 и T02). В каждой группе с T03 по T06 было по шесть животных. Доза вакцины составляла 2 мл и группы на нулевые сутки вакцинировали однократной или двойной дозами вакцин. На 0 сутки тестируемый образец вводили в шею с правой стороны. Животным, которым вводили двойную дозу (4 мл) тестируемого образца (T02, T04 и T06), вводили всю двойную дозу в виде однократной инъекции с одной стороны. Обследование областей инъекции, включая определение размеров области реакции в области инъекции, проводили на правой стороне шеи с 0 по 4 сутки включительно и 6, 9 и 14 сутки. На 0 сутки области инъекции обследовали перед введением тестируемых образцов. У групп, вакцинированных одной или двумя дозами плацебо, не было показано какого-либо значительного увеличения размера реакции в области инъекции, и поэтому эти данные не представлены на фигуре 7. В случае немикрофлюидизированного вакцинного препарата происходило пропорциональное увеличение размера реакции в области инъекции между вакцинацией однократной и двойной дозой. Напротив, в случае микрофлюидизированного вакцинного препарата, несмотря на то, что единичная доза вызывала больший размер реакции в области инъекции, инъекция второй дозы не вызывала никакого дополнительного увеличения. Кроме того, в случае животных, которым вводили микрофлюидизированный вакцинный препарат, размер реакции в области инъекции снижался быстрее по сравнению с размером реакции у животных, которым вводили немикрофлюидизированный вакцинный препарат. Эти результаты представлены фигуре 7.
ПРИМЕР 11
Получение микрофлюидизированных вакцинных препаратов на основе состава AMPHIGEN® с включенными непосредственно в состав вирусными антигенами BVD и антигенами лептоспир и иммуностимулирующими молекулами, такими как Quil A и DDA
Инактивированный формалином штамм CSL Leptospira hardjo-bovis включали в состав приемлемого адъюванта в количестве при прямом подсчете приблизительно 1,4 × 109 организмов/5 мл доза. Инактивированный формалином штамм T262 Leptospira Pomona включали в состав препарата в количестве приблизительно 2400 нефелометрических единиц/5 мл доза. Нефелометрические единицы вычисляли на основе нефелометрического измерения в предварительно обработанной ферментированной жидкости. Вирус BVD 1 типа включали в состав препарата при титре E2 при ELISA, приблизительно равном 3000 условных единиц/5 мл доза. Вирус BVD 2 типа включали в состав препарата при титре E2 при ELISA, приблизительно равном 3500 условных единиц/5 мл доза. Условную единицу вычисляли на основе титра E2 при ELISA в основной жидкости перед объединением после инактивации. Quil A и холестерин использовали в концентрации 0,5 мг на дозу. Тимеросол и состав AMPHIGEN® использовали в конечной концентрации 0,009% и 2,5% соответственно. Гидроксид алюминия (Rehydragel LV) использовали в конечной концентрации 2,0%. При использовании в качестве иммуномодулятора DDA, DDA включали в состав AMPHIGEN®. Состав AMPHIGEN® (т.е. 40% маточный раствор лецитина Drakeol) содержал 1,6 мг/мл DDA и, при соответствующем разбавлении, конечный вакцинный препарат содержал 2,5% состава AMPHIGEN® и 0,1 мг/мл DDA.
При получении различных вакцинных препаратов фракции BVD, Leptos, Quil A, холестерин, тимеросол, состав AMPHIGEN® и физиологический раствор в качестве наполнителя добавляли в гомогенизатор Silverson и перемешивали в течение 15 минут при 10000 ± 500 об/мин. Затем компоненты подвергали микрофлюидизации через 200-микронную мембрану при 10000 фунт/кв. дюйм.
Если вакцинный препарат содержал гидроксид алюминия, микрофлюидизацию осуществляли без гидроксида алюминия. После завершения микрофлюидизации добавляли гидроксид алюминия и в течение одной ночи перемешивали посредством магнитной мешалки при 4°C.
ПРИМЕР 12
Получение вирусной вакцины BVD для исследований по контрольному заражению
Вакцинный препарат, используемый в этом эксперименте, содержал антигены вируса BVD 1 типа и вируса BVD 2 типа. Антиген BVD1-5960 использовали при пост-инактивационном титре при ELISA, равном 2535 У.Е./доза для gp53. Антиген BVD2-890 использовали в пост-инактивационном титре при ELISA, равном 3290 У.Е./доза для gp53. Quil A и холестерин использовали в концентрации 0,5 мг/мл. Тимеросол и состав AMPHIGEN® использовали в конечной концентрации 0,009% и 2,5% соответственно. Если DDA использовали в качестве модулятора иммунной системы, то DDA включали в состав AMPHIGEN®. Маточный раствор AMPHIGEN® (40% раствор лецитина Drakeol) содержал различные количества DDA и, при соответствующем разбавлении, конечный вакцинный препарат содержал 2,5% состава AMPHIGEN®, а концентрация DDA находилась в пределах от 0,5 мг/доза до 2,0 мг/доза. Гель алюминия (Rehydragel-LV) использовали в конечной концентрации 2%. GPI-0100 использовали в количестве 2, 3 и 5 мг/доза.
Все компоненты добавляли в гомогенизатор Silverson и перемешивали в течение 15 минут при 10500 об/мин, а затем подвергали микрофлюидизации, пропуская через 200 микронную камеру по давлением 10000 фунт/кв. дюйм. Если вакцинный препарат содержал гидроксид алюминия, микрофлюидизацию осуществляли без гидроксида алюминия. После завершения микрофлюидизации добавляли гидроксид алюминия и перемешивали в течение одной ночи посредством магнитной мешалки при 4°C.
ПРИМЕР 13
Защита против контрольного заражения лептоспирами после вакцинации микрофлюидизированным вакцинным составом Amphigen с антигенами лептоспир
Таблица 1
Группы по введению |
| Введение |
Композиция адъюванта |
| T01 |
Физиологический раствор |
| T02 |
Quil A, холестерин и состав AMPHIGEN® (QAC) |
| T03 |
Quil A, холестерин, состав AMPHIGEN® и AlOH (QAC-AlOH) |
| T04 |
DDA, холестерин и состав AMPHIGEN® (DDA) |
| T05 |
DDA, холестерин, состав AMPHIGEN® и AlOH (DDA-AlOH) |
В таблице 1 представлена композиция составов адъювантов в вакцинных препаратах, тестируемых в этом исследовании. Вакцинные препараты получали, как описано в примере 11. В каждой группе было шесть животных. В этом исследовании использовались приблизительно семимесячные гибридные телки мясного направления. Вакцинацию осуществляли на 0 сутки и на 21 сутки подкожным способом введения вакцины объемом 5 мл. Контрольное заражение проводили посредством штамма 203 L. hardjo-bovis из NADC (National agricultural Disease Center). Контрольное заражение проводили 1 мл инокулята в течение суток 57-59. Контрольное заражение осуществляли через конъюнктиву глаза и вагинально. Средство для контрольного заражения содержало 5,0 × 106 лептоспир/мл. Мочу собирали еженедельно для посева на лептоспиры, FA и ПЦР. Отбор пробы из почек проводили в течение суток 112 и 113.
Таблица 2
Результаты исследований по контрольному заражению лептоспирами |
| Введение |
Процент телят, когда-либо положительных по лептоспирам в моче и в почках по результатам посева |
Процент телят, когда-либо положительных по лептоспирам в моче и в почках по результатам FA |
Процент телят, когда-либо положительных по лептоспирам в моче и в почках по результатам ПЦР |
Процент телят, когда-либо положительных по лептоспирам в моче и в почках по результатам всех исследований |
| Физиологический раствор |
100 |
83,3 |
83,3 |
100 |
| QAC |
0 |
0 |
0 |
0 |
| QAC/AlOH |
0 |
50,0 |
0 |
50,0 |
| DDA |
0 |
0 |
0 |
0 |
| DDA/AlOH |
0 |
33,3 |
16,7 |
50,0 |
В таблице 2 представлены данные по исследованию контрольного заражения лептоспирами. Для определения процентного количества случаев инфекции лептоспирами у зараженных животных использовали следующие критерии. Если культура из почек была положительной только для одного образца, животное рассматривали как положительное по лептоспирам. Если животное было положительным только по одному образцу - либо по результатам FA, либо по результатам ПЦР - животное рассматривали как отрицательное. Если образец был положительным и по результатам FA, и по результатам PCR только в одном образце, его рассматривали как положительный по лептоспирам.
Представленные в таблице 2 результаты показывают, что при всех трех типах анализов во всех группах, получавших вакцину, продолжительность выделения микроорганизма с мочой была значительно более короткой. При рассмотрении мочевой и почечной колонизации эффективности препаратов, содержащих QAC и DDA без AlOH, были сопоставимыми. В этом исследовании по контрольному заражению AlOH не повышал и даже снижал эффективность вакцин, содержащих QAC или DDA.
Таблица 3
Диапазон титров при реакции микроагглютинации на сутки пика среднего геометрического значения титра перед контрольным заражением (сутки 35) |
| Введение |
L. Hardjo |
L. pomona |
| Физиологический раствор |
<20 |
<20 |
| QAC |
160 - 640 |
1280 - 10240 |
| QAC/AlOH |
160 - 2560 |
8- - 10240 |
| DDA |
40 - 1280 |
320 - 2560 |
| DDA/AlOH |
320 - 640 |
1280 - 5120 |
Определяли серологические ответы у вакцинированных животных на оба антигена лептоспир в вакцинных препаратах, и пик ответа был определен на 35 сутки. Не было корреляции между серологическим ответом и защитой против контрольного заражения. Наличие алюминиевого геля в вакцинном препарате снижало уровень защиты, хотя серологический ответ был усилен в присутствии алюминиевого геля в вакцине.
ПРИМЕР 14
Выявление иммунного ответа на вирусный антиген BVD и защиты против контрольного заражения вирусом BVD 2 типа после иммунизации микрофлюидизированным вакцинным препаратом, содержащим состав AMPHIGEN® и DDA
В этом эксперименте использовали серонегативных телят в возрасте от четырех до семи месяцев. Было шесть различных групп, и каждая группа состояла из десяти животных (таблица 4). На 0 сутки и на 21 сутки каждому животному вводили одну 2-мл подкожную дозу вакцины или плацебо в боковой отдел шеи приблизительно на середине расстояния между лопаткой и затылочным гребнем.
Таблица 4
Группы по введению |
| Введение |
Композиция адъюванта |
| T01 |
Физиологический раствор |
| T02 |
Quil A, состав AMPHIGEN® и холестерин |
| T03 |
Состав AMPHIGEN®, холестерин, DDA (0,5 мг/доза) и AlOH |
| T04 |
Состав AMPHIGEN®, холестерин и DDA (0,5 мг/доза) |
| T05 |
Состав AMPHIGEN®, холестерин и DDA, (1,0 мг/доза) |
| T06 |
Состав AMPHIGEN®, холестерин и DDA, (2,0 мг/доза) |
5 мл Дозы вирусного препарата для контрольного заражения (приблизительно 2,5 мл на носовое отверстие) вводили интраназально на 44 сутки исследования. В этом исследовании в качестве штамма для контрольного заражения использовали нецитопатический вирус BVD 2 типа, изолят # 24515 (штамм Ellis), серия # 46325-70. Оставшиеся образцы материала для контрольного заражения титровали (две репликации на титрование), начиная с времени начала контрольного заражения и непосредственно до его завершения. Средний титр живых вирусов на 5 мл дозы составлял 5,3 log10 FAID50/5 мл перед контрольным заражением и 5,4 log10 FAID50/5 мл после контрольного заражения (FAID эквивалентна TCID50).
Животных обследовали каждые сутки с суток -3 до суток 58. Клиническую оценку заболевания по шкале, состоящей из 0, 1, 2 или 3 баллов, на основе клинических признаков, характерных для инфекции BVD 2, проводили для каждого животного на сутки с 42 по 58. Показатели на 44 сутки записывали перед контрольным заражением. Для определения сывороточных титров нейтрализующих антител против вирусов BVD 1 типа и BVD 2 типа забирали образцы крови (две 13-мл пробирки для фракционирования сыворотки, SST) от каждого животного на 0, 21, 35, 44 и 58 сутки.
Забор образцов крови от каждого животного осуществляли на сутки с 42 по 58 включительно и определяли наличие вируса BVD в клетках лейкоцитарной пленки. На 44 сутки образцы получали перед контрольным заражением.
Для определения количества лейкоцитов забор образцов крови (одна 4-мл пробирка с ЭДТА) от каждого животного осуществляли на сутки с 42 по 58 включительно. На 44 сутки образцы получали перед контрольным заражением.
Лейкопения определялась как снижение на 40% или более количества лейкоцитов по сравнению с исходным уровнем (среднее количество лейкоцитов перед контрольным заражением в период времени от двух суток перед контрольным заражением и сутки контрольного заражения).
Для определения статуса заболевания использовали следующую клиническую шкалу оценки заболевания: если показатель составлял  1, то заболевания нет; если показатель составлял >2, то заболевание есть. 1, то заболевания нет; если показатель составлял >2, то заболевание есть.
Как показано в таблицах 5 и 6, группы, вакцинированные вакцинами, содержащими вирусные антигены BVD вместе с составом AMPHIGEN®, Quil A или DDA, и микрофлюидизированными, показывали серологическую конверсию со значительными нейтрализующими вирус титрами как для вируса BVD 1 типа, так и для BVD 2 типа. Также в этих группах было значительно снижено процентное количество животных, для которых показана виремия после контрольного заражения, в то время как в контрольной группе виремия наблюдалась у 100% животных (таблица 7). Кроме того, в этих вакцинированных группах частота заболевания также значительно снижалась (таблица 8). Аналогично, процентное количество животных, у которых показана лейкопения, также было снижено в вакцинированных группах, и снижение лейкопении было более значительным в группе, где в состав вакцины входил DDA, по сравнению с группой, где в состав вакцины входил Quil A (таблица 9). В контрольной группе был значительно снижен прирост массы по сравнению с вакцинированными группами (таблица 10).
Серология
Перед вакцинацией на 0 сутки все животные в исследовании были серонегативными (SVN <1:2) по антителам против вируса BVD 1 и 2 типов (данные не представлены). Через четырнадцать суток после повторной вакцинации (35 сутки) все животные, которым вводили плацебо (T01), оставались серонегативными по антителам против вируса BVD 1 и 2 типов; и все животные, вакцинированные ITA (испытываемые тест-антигены) (T02, T03, T04, T05 и T06), были серопозитивными (SVN  1:8) по антителам против вируса BVD 1 и 2 типов. У одного животного, которому вводили вакцину с составом AMPHIGEN® в качестве адъюванта при количестве DDA 2 мг/доза, на 35 сутки титр SVN составлял 3 для антител против вируса BVD 2 типа (таблицы 11 и 12). 1:8) по антителам против вируса BVD 1 и 2 типов. У одного животного, которому вводили вакцину с составом AMPHIGEN® в качестве адъюванта при количестве DDA 2 мг/доза, на 35 сутки титр SVN составлял 3 для антител против вируса BVD 2 типа (таблицы 11 и 12).
Перед контрольным заражением на 44 сутки все контроли (T01), за исключением одного, были серонегативными (SVN <1:2) по антителам против вируса BVD 1 и 2 типов (данные не представлены). Один контроль (#2497) был серопозитивным (SVN = 10) по антителам против вируса BVD 1 типа и серонегативным по антителам против вируса BVD 2 типа. Через четырнадцать суток после контрольного заражения все животные в этом исследовании были серопозитивными по антителам против вируса BVD 1 и 2 типов.
Таблица 5
Среднее геометрическое значение нейтрализующих вирус BVD 1 типа сывороточных титров |
| Введение |
Среднее геометрическое значение титров SVN против BVDv 1 типа на сутки исследования |
| 0 |
21 |
35 |
44 |
58 |
| T01 |
Физиологический раствор |
<2 |
<2 |
<2 |
<2 |
23,9 |
| T02 |
Amphigen, Quil A |
<2 |
39,1 |
19824,5 |
14018,2 |
27554,5 |
| T03 |
Amphigen, 0,5 мг DDA, Al |
<2 |
51,8 |
32204,8 |
22381,1 |
23170,4 |
| T04 |
Amphigen, 0,5 мг DDA |
<2 |
27,0 |
14512,4 |
8932,0 |
21996,2 |
| T05 |
Amphigen, 1,0 мг DDA |
<2 |
26,7 |
11585,2 |
8194,6 |
20882,0 |
| T06 |
Amphigen, 2,0 мг DDA |
<2 |
23,5 |
8778,7 |
6769,3 |
16961,1 |
Таблица 6
Среднее геометрическое значение нейтрализующих вирус BVD 2 типа сывороточных титров |
| Введение |
Среднее геометрическое значение титров SVN против BVDv 1 типа на сутки исследования |
| 0 |
21 |
35 |
44 |
58 |
| T01 |
Физиологический раствор |
<2 |
<2 |
<2 |
<2 |
522,0 |
| T02 |
Amphigen, Quil A |
<2 |
8,9 |
2272,4 |
2048,2 |
24833,6 |
| T03 |
Amphigen, 0,5 мг DDA, Al |
<2 |
9,5 |
3565,7 |
2702,2 |
20881,8 |
| T04 |
Amphigen,0,5 мг DDA |
<2 |
4,1 |
1260,7 |
989,1 |
18496,2 |
| T05 |
Amphigen, 1,0 мг DDA |
<2 |
6,4 |
1398,8 |
1453,9 |
30047,8 |
| T06 |
Amphigen, 2,0 мг DDA |
<2 |
7,7 |
1673,2 |
1428,9 |
16384,0 |
Таблица 7
Выделение вируса BVD после контрольного заражения |
| Введение |
Выделение вируса BVD |
| Сутки исследования |
Частота (%) животных с виремией |
Среднеквадратичное значение количества суток с виремией |
| T01 |
Физиологический раствор |
с 47 по 58 |
10/10 (100,0) |
10,4 |
| T02 |
Amphigen, Quil A |
с 50 по 53 |
1/10 (10,0) |
0,4 |
| T03 |
Amphigen, 0,5 мг DDA, Al |
- |
0/10 (0,0) |
0,0 |
| T04 |
Amphigen, 0,5 мг DDA |
48, с 50 по 52, 57 |
3/10 (30,0) |
0,5 |
| T05 |
Amphigen, 1,0 мг DDA |
с 49 по 51 |
2/10 (20,0) |
0,4 |
| T06 |
Amphigen, 2,0 мг DDA |
с 48 по 52 |
2/10 (20,0) |
0,5 |
Таблица 8
Клинические признаки заболевания BVD после контрольного заражения |
| Введение |
Частота (%) с заболеванием |
Частота (%) наблюдений с клиническим признаком заболевания BVD |
Всего наблюдений |
| 0 |
1 |
2 |
3 |
| T01 |
Физиологический раствор |
9/10 (90,0) |
75 (46) |
63 (37,5) |
29 (17,3) |
1 (0,6) |
168 |
| T02 |
Amphigen, Quil A |
1/10 (10,0) |
105 (61,8) |
63 (37,1) |
2 (1,2) |
0 (0) |
170 |
| T03 |
Amphigen, 0,5 мг DDA, Al |
2/10 (20,0) |
99 (58,2) |
67 (39,4) |
4 (2,4) |
0 (0) |
170 |
| T04 |
Amphigen, 0,5 мг DDA |
0/10 (0,0) |
118 (69,4) |
52 (30,6) |
0 (0) |
0 (0) |
170 |
| T05 |
Amphigen, 1,0 мг DDA |
0/10 (0,0) |
101 (59,4) |
69 (40,6) |
0 (0) |
0 (0) |
170 |
| T06 |
Amphigen, 2,0 мг DDA |
0/10 (0,0) |
104 (61,2) |
66 (38,8) |
0 (0) |
0 (0) |
170 |
Таблица 9
Лейкопения после контрольного заражения |
| Введение |
Лейкопения |
| Частота (%) животных с лейкозом |
Среднеквадратичное значение количества суток с лейкозом |
| T01 |
Физиологический раствор |
10/10 (100,0) |
7,8 |
| T02 |
Amphigen, Quil A |
6/10 (60,0) |
1,2 |
| T03 |
Amphigen, 0,5 мг DDA, Al |
2/10 (20,0) |
0,2 |
| T04 |
Amphigen, 0,5 мг DDA |
4/10 (40,0) |
0,8 |
| T05 |
Amphigen, 1,0 мг DDA |
3/10 (30,0) |
0,9 |
| T06 |
Amphigen, 2,0 мг DDA |
2/10 (30,0) |
0,5 |
Таблица 10
Масса тела и прирост массы тела в течение исследования |
| Введение |
Средняя масса тела (Ib.) на сутки исследования |
Прирост массы (Ib.) |
| -1 |
43 |
50 |
58 |
| T01 |
Физиологический раствор |
378,0 |
484,9 |
491,0 |
476,9 |
98,9 |
| T02 |
Amphigen, Quil A |
428,0 |
526,5 |
546,7 |
579,0 |
151,0 |
| T03 |
Amphigen, 0,5 мг DDA, AlOH |
410,5 |
514,4 |
534,2 |
579,0 |
168,5 |
| T04 |
Amphigen, 0,5 мг DDA |
373,7 |
472,3 |
492,6 |
538,1 |
164,4 |
| T05 |
Amphigen, 1,0 мг DDA |
358,9 |
451,4 |
478,9 |
507,1 |
148,2 |
| T06 |
Amphigen, 2,0 мг DDA |
408 |
513,3 |
533,9 |
560,3 |
151,6 |
Выделение вируса
Как показывают данные в таблице 13, в течение периода контрольного заражения (сутки с 44 по 58) у всех десяти животных в контроле (T01) была виремия (вирус BVD выделялся в течение одних или нескольких суток). В группах, которым вводили ITA, частота животных с виремией составляла одно, ноль, три, два и два в каждой группе из десяти животных (T02, T03, T04, T05 и T06 соответственно). Разница между контролем и группами введения ITA была статистически значимой (P 0,05). Среднеквадратичное значение количества суток с виремией также было значительно большим (10,4 суток) для контроля по сравнению с группами, которым вводили ITA (от 0,0 до 0,5 суток). 0,05). Среднеквадратичное значение количества суток с виремией также было значительно большим (10,4 суток) для контроля по сравнению с группами, которым вводили ITA (от 0,0 до 0,5 суток).
Клиника заболевания
Животных с показателем клинических признаков 2 или 3 балла рассматривали как показывающих признаки заболевания BVD. Как представлено в таблице 14, частота животных с клиническими признаками вирусного заболевания BVD составляла девять из десяти контрольной (T01) и одно, два, ноль, ноль и ноль из десяти в каждой группе, которой вводили ITA (T02, T03, T04, T05 и T06 соответственно). Различие между контрольной группой и группами, которым вводили ITA, было статистически значимым (P 0,05). 0,05).
Лейкопения
Как представлено в таблице 15, в течение периода контрольного заражения (сутки с 44 по 58) у всех десяти животных в контрольной группе (T01) был лейкоз (40% снижение количества лейкоцитов от уровня перед контрольным заражением, сутки 42-44). Частота животных с лейкозом составляла шесть, два, четыре, три и два из десяти животных в каждой из групп, которым вводили ITA (T02, T03, T04, T05 и T06 соответственно). Различие между контрольной группой и группой, которой вводили вакцину, адъювантом в которой был состав AMPHIGNEN® в количестве 0,5 мг/доза и гидроксид алюминия (T03), было статистически значимым (P 0,05). Среднеквадратичное значение количества суток с лейкозом было значительно более высоким (7,8 суток) для контроля по сравнению с группами, которым вводили ITA (от 0,2 до 1,2 суток). 0,05). Среднеквадратичное значение количества суток с лейкозом было значительно более высоким (7,8 суток) для контроля по сравнению с группами, которым вводили ITA (от 0,2 до 1,2 суток).
ПРИМЕР 15
Выявление иммунного ответа на вирусный антиген BVD и защита против контрольного заражения вирусом BVD 2 типа после иммунизации микрофлюидизированным вакцинным составом, содержащим GPI-0100
Был осуществлен ряд экспериментальных условий, как описано в примере 14, и было проведено непосредственное сравнение между Quil A и GPI-0100. Как представлено в таблицах 11 и 12, животные, вакцинированные антигенами BVD в микрофлюидизированном препарате на основе состава AMPHIGEN®, содержащем либо Quil A, либо GPI-0100, обладали значительным титром антител как против вируса BVD 1 типа, так и против вируса BVD 2 типа. Титр антител против вируса BVD 1 типа был значительно более высоким, чем титр антител против вируса BVD 2 типа. Однако последующее контрольное заражение вирусом BVD 2 типа показало сильную защиту, и значительно снижалась заболеваемость у телят, вакцинированных микрофлюидизированным вакцинным препаратом на основе состава AMPHIGEN®, содержащим GPI-0100.
Таблица 11
Среднее геометрическое значение нейтрализующих вирус BVD 1 типа сывороточных титров |
| Введение |
Среднее геометрическое значение титров SVN |
| 0 |
21 |
35 |
43 |
57 |
| T01 |
Физиологический раствор |
<2 |
<2 |
<2 |
<2 |
35,5 |
| T02 |
Amphigen, Quil A |
<2 |
98,7 |
20171,0 |
12203,4 |
44762,4 |
| T03 |
Amphigen, 2 мг GPI-0100, AlOH |
<2 |
84,6 |
10998,5 |
7383,2 |
25709,2 |
| T04 |
Amphigen, 2 мг GPI-0100 |
<2 |
106,0 |
18179,2 |
8933,2 |
28526,2 |
| T05 |
Amphigen, 3 мг GPI-0100 |
<2 |
62,9 |
15024,3 |
8780,1 |
19824,4 |
| T06 |
Amphigen, 5 мг GPI-0100 |
<2 |
71,1 |
12203,3 |
7512,0 |
16670,2 |
Таблица 12
Среднее геометрическое значение нейтрализующих вирус BVD 2 типа сывороточных титров |
| Введение |
Среднее геометрическое значение титров SVN против BVDv 1 типа на сутки исследования |
| 0 |
21 |
35 |
44 |
58 |
| T01 |
Физиологический раствор |
<2 |
<2 |
<2 |
<2 |
14,7 |
| T02 |
Amphigen, Quil A |
<2 |
12,9 |
2312,0 |
1692,5 |
1663,4 |
| T03 |
Amphigen, 2 мг GPI-0100, AlOH |
<2 |
13,2 |
1663,5 |
1116,8 |
1562,3 |
| T04 |
Amphigen, 2 мг GPI-0100 |
<2 |
20,5 |
2610,2 |
1978,2 |
2478,7 |
| T05 |
Amphigen, 3 мг GPI-0100 |
<2 |
11,4 |
1752,8 |
1305,2 |
2435,4 |
| T06 |
Amphigen, 5 мг GPI-0100 |
<2 |
12,0 |
3158,4 |
2120,2 |
1845,6 |
Таблица 13
Выделение вируса BVD после контрольного заражения |
| Введение |
Выделение вируса BVD |
| Частота (%) животных с виремией |
Среднеквадратичное значение количества суток с виремией |
| T01 |
Физиологический раствор |
10/10 (100,0) |
8,4 |
| T02 |
Amphigen, Quil A |
3/10 (30,0) |
0,3 |
| T03 |
Amphigen, 2 мг GPI-0100, AlOH |
0/10 (0,0) |
0,0 |
| T04 |
Amphigen, 2 мг GPI-0100 |
1/10 (10,0) |
0,1 |
| T05 |
Amphigen, 3 мг GPI-0100 |
3/10 (30,0) |
0,3 |
| T06 |
Amphigen, 5 мг GPI-0100 |
2/10 (20,0) |
0,2 |
Таблица 14
Клинические признаки заболевания BVD после контрольного заражения |
| Введение |
Частота (%) с заболеванием |
Частота наблюдений с показателем клинического заболевания |
Всего наблюдений |
| 0 |
1 |
2 |
|
| T01 |
Физиологический раствор |
5/10 (50,0) |
103 (60,6) |
55 (32,4) |
12 (7,1) |
170 |
| T02 |
Amphigen, Quil A |
5/10 (50,0) |
115 (67,6) |
48 (28,2) |
7 (4,1) |
170 |
| T03 |
Amphigen, 2 mg GPI-0100, AlOH |
0/10 (0,0) |
128 (75,3) |
42 (24,7) |
0 (0) |
170 |
| T04 |
Amphigen, 2 мг GPI-0100 |
0/10 (0,0) |
124 (72,9) |
46 (27,1) |
0 (0) |
170 |
| T05 |
Amphigen, 3 мг GPI-0100 |
0/10 (0,0) |
104 (61,2) |
66 (38,8) |
0 (0) |
170 |
| T06 |
Amphigen, 5 мг GPI-0100 |
0/10 (0,0) |
128 (75,3) |
42 (24,7) |
0 (0) |
170 |
Таблица 15
Лейкопения после контрольного заражения |
| Введение |
Лейкопения |
| Частота (%) животных с лейкопенией |
Среднеквадратичное значение количества суток с лейкопенией |
| T01 |
Физиологический раствор |
9/10 (90,0) |
8,7 |
| T02 |
Quil A |
6/10 (60,0) |
1,6 |
| T03 |
2 мг GPI-0100, AlOH |
7/10 (70,0) |
2,6 |
| T04 |
2 мг GPI-0100 |
4/10 (40,0) |
1,5 |
| T05 |
3 мг GPI-0100 |
7/10 (70,0) |
2,6 |
| T06 |
5 мг GPI-0100 |
8/10 (80,0) |
2,9 |
В заключение безопасность каждой вакцины была показана по отсутствию побочных реакций или смертности среди вакцинированных животных. Эффективность каждой вакцины была показана по сероконверсии (титры SVN антител против BVD-1 и BVD-2 >1:8) у 100% вакцинированных животных. Достаточная устойчивость к контрольному заражению была показана только для вакцин с адъювантом, содержащим 2 мг GPI-0100.
ПРИМЕР 16
Вакцинный препарат, содержащий микроинкапсулированный антиген в микрофлюидизированной эмульсии типа "масло в воде"
Три грамма трегалозы (Fluka) добавляли к воде с получением маточного раствора трегалозы с концентрацией 333 мг/мл. Рекомбинантный антиген PauA, растворенный в 0,8% растворе SDS (SDS/rPauA), добавляли к раствору трегалозы для получения конечной концентрации 494 мкг rPauA/мл. На следующем этапе 10 грамм сополимера молочной и гликолевой кислоты (PLG-Resomer RE 503H, Boeringher Ingelheim) растворяли в 200 мл хлористого метилена (MeCl2). Полученный в результате раствор PLG/MeCl2 объединяли с раствором SDS-rPauA/трегалоза, полученным на первом этапе. Объединенный раствор подвергали микрофлюидизации, используя микрофлюидизатор Microfluidics (модель M110EH), и микрофлюидизированный препарат сушили распылением, используя распылительную сушилку Temco (модель SD-05). Высушенный распылением продукт собирали с использованием 500-микронной мембраны.
Концентрацию rPauA в этом высушенном распылением продукте вычисляли с применением вестерн-блотт анализа. 1,04 мг высушенного распылением продукта растворяли в 50 мкл ацетона и центрифугировали при 13200 об/мин при комнатной температуре в течение 10 минут. Супернатант удаляли. Супернатант и осадочные фракции сушили в биологически безопасном вытяжном шкафу в течение 2,5 часов. Осадок ресуспендировали в 47,43 мкл раствора для образца (25 мкл буфера для образца + 10 мкл восстановителя + 65 мкл воды). Высушенную фракцию супернатанта ресуспендировали в 20 мкл раствора для образца. В вестерн-анализе для определения содержания rPauA в высушенном распылением продукте в качестве стандарта использовали очищенный PauA.
20% Маточный раствор маннита получали растворением 100 грамм маннита (Sigma) в 500 мл воды для инъекций (WFI). Раствор нагревали до 40°C на устройстве для перемешивания с подогревом и охлаждали до 30°C. Раствор в стерильных условиях фильтровали через 0,22-микронный стерильный фильтр (Millipore). 2,5% раствор карбоксиметилцеллюлозы получали растворением 12,5 грамм карбоксиметилцеллюлозы (Sigma) в 500 мл WFI и перемешиванием в течение одной ночи при 4°C. Раствор автоклавировали при 121°C.
Порошок, полученный в результате высушивания распылением, растворяли в растворе, содержащем 5% маннита, 0,3% карбоксиметилцеллюлозы и тимерослол 1:5000. Конечный раствор разделяли на аликвоты в 3 мл флаконы и лиофилизировали с использованием лиофилизатора (USIFROID). Лиофилизированный порошок представляет собой микроинкапсулированный rPauA. Микроинкапсулированный антиген из белковых субчастиц ресуспендировали в 2 мл микрофлюидизированной эмульсии типа "масло в воде", содержащей состав AMPHIGEN® (такой как микрофлюидизированная эмульсия, описанная в примере 20), и использовали в качестве вакцины.
ПРИМЕР 17
Получение микрофлюидизированного вакцинного препарата, содержащего как бактериальный цельный клеточный антиген, так и рекомбинантный белковый антиген в эмульсии типа "масло в воде"
Было получено два вакцинных препарата, которые содержали как рекомбинантный белок PauA из Streptococcus uberis, так и бактериальные клетки Escherichia coli, добавленные непосредственно в состав эмульсии "масло в воде", как описано в примерах 2 и 3. Рекомбинантный антиген PauA находился в концентрации 100 мкг на дозу, а конечное количество клеток E. coli составляло 4×109 на дозу. Эмульсионные адъювантные композиции двух вакцинных препаратов представлены в таблице 16.
Таблица 16
Вакцинные составы, содержащие как рекомбинантный белок, так и цельные клетки E. coli. |
| Введение |
Антиген |
Адъювант |
| T01 |
Плацебо |
Физиологический раствор |
| T02 |
Pau A/E. coli |
SEAM-14 |
| T03 |
Pau A/E. coli |
2,5% Amphigen, 0,5 мг GPI-0100, 0,5 мг холестерина |
| T04 |
Pau A/E. coli |
2,5% Amphigen, 0,5 мг бромида диметилдиоктадециламмония (DDA), 0,5 мг холестерина |
ПРИМЕР 18
Иммунный ответ на микрофлюидизированную вакцину, содержащую rPauA и цельные клеточные бактериальные агенты в эмульсии типа "масло в воде"
В этом эксперименте использовались взрослые молочные коровы. Во время отбора животные находились в состоянии завершения первой или второй лактации. Два мл каждого вакцинного препарата вводили подкожно три раза, первый раз во время запуска (D-0), через 28 суток (D=28) и снова с 4 по 10 сутки после отела (C+4 - C+10). Первую и третью дозу вводили в шею с левой стороны, а вторую дозу вводили в шею с правой стороны. Перед каждой вакцинацией и приблизительно через 14 суток и 32 суток после третьей вакцинации осуществляли забор крови. Титр антител против антигенов E. coli и rPauA определяли посредством ELISA. Как представлено на фигуре 8, результаты показывают, что титр антител против rPauA был выше в группе, вакцинированной вакцинным препаратом, содержащим GPI-0100 в качестве иммуностимулятора, и достигал пика на 70 сутки после первой вакцинации. Титр антител против антигена E. coli представлен на фигуре 9. Титр антител против антигена E. coli был сопоставим в обоих вакцинных препаратах, хотя наличие GPI-0100 в качестве иммуностимулятора приводило к относительно более высокому титру антител по сравнению с препаратами с DDA в качестве иммуностиммулятора.
ПРИМЕР 19
Анализ вироцидной активности микрофлюидизированного вакцинного препарата на основе состава AMPHIGEN®
Чтобы определить, инактивируется ли вирус в процессе микрофлюидизации, определяли вироцидную активность трех микрофлюидизированных вакцинных препаратов на основе состава AMPHIGEN®. Три препарата содержали три различных бычьих инфекционных вируса, а именно бычий вирус герпеса (BHV), вирус парагриппа 3 (PI3) и бычий респираторно-синцитиальный вирус(BRSV).
Определение вироцидной активности трех вакцинных препаратов осуществляли в соответствии с требованиями USDA 9CFR.113.35.
Результаты, представленные в таблице 17, показывают, что микрофлюидизация вакцинного препарата на основе состава AMPHIGEN® не вызывает никакой значительной инактивации вакцинного препарата.
Таблица 17
Анализ вироцидной активности микрофлюидизированных вакцин |
| Серия |
BRSV |
BHV |
PI3 |
| A |
0 |
0,2 |
0 |
| AM200 |
-0,2 |
0 |
-0,2 |
| AM75 |
0 |
-0,3 |
-0,3 |
| AM75@37C |
0,1 |
-0,3 |
-0,2 |
| B |
0 |
-0,1 |
-0,2 |
| BM200 |
0 |
0 |
-0,2 |
| BM75 |
-0,2 |
-0,5 |
0 |
| BM75@37C |
0,5 |
-0,5 |
0 |
| C |
0,1 |
-0,1 |
-0,2 |
| CM200 |
-0,2 |
-0,1 |
-0,2 |
| CM75 |
0,1 |
0,5 |
-0,2 |
| CM75@37C |
0,5 |
0,5 |
-0,2 |
A = холестерин, добавляемый при 650 мл/мин;
B = холестерин, добавляемый при 28 мл/мин;
C = холестерин, добавленный при 5 мл/мин;
M200 = микрофлюидизированные с 200-микронной мембраной;
M75 = микрофлюидизированные с 75-микронной мембраной;
M75@37C = Жидкости, перед микрофлюидизацией нагретые до 37°C;
Значение выше 0,7 является показателем вироцидного эффекта. |
ПРИМЕР 20
Получение микрофлюидизированного состава AMPHIGEN®
Состав AMPHIGEN® получали комбинированием масляного раствора лецитина DRAKEOL (легкое минеральное масло с 25% лецитина), TWEEN 80 (с конечной концентрацией 0,18%) и Span 80 (с конечной концентрацией 0,08%) при перемешивании в течение 8-22 часов при 36 ± 1°C. Затем масляную смесь добавляли в физиологический раствор с помощью эмульсификатора Ross® (Hauppauge, NY 11788) при приблизительно 3400 об/мин. Затем смесь пропускали через микрофлюидизатор с 200-мкм камерой для взаимодействия при 4500 ± 500 фунт/кв. дюйм. На фигурах 10A и 10B представлена стабильность микрофлюидизированного состава AMPHIGEN®. Распределение размера частиц, измеренного посредством лазерной дифракции, в начале, начальный момент времени (фигура 10A), было практически идентичным распределению размера частиц через 22 месяца хранения при 4°C (фигура 10B).
ПРИМЕР 21
Электронно-микроскопический анализ иммуногенного комплекса Quil A - холестерин
Для определения характеристик иммуногенного комплекса, образованного Quil A и холестерином, смешивание этих двух компонентов выполняли как при наличии, так и в отсутствие антигена.
В химический стакан, содержащий 50 мл буфера KR-Hals, добавляли антиген BVD I типа при перемешивании раствора посредством магнитной мешалки. Затем, при перемешивании раствора по каплям добавляли концентрированный маточный раствор Quil A (50 мг/мл) до получения конечной концентрации 50 мкг/мл. После добавления Quil A добавляли маточный раствор холестерина в этаноле (18 мг/мл) до конечной концентрации 50 мкг/мл.
Во второй химический стакан добавляли Quil A и холестерин указанным выше способом к 50 мл буфера без какого-либо антигена BVD I типа.
Для трансмиссионной электронной микроскопии 10 мкл каждого образца адсорбировали на 400-ячеичные медные сетки с подложкой на основе формвар/углерод (Electron Microscopy Sciences, Inc., Fort Washington, PA). Образцы отрицательно метили, используя 10 мкл фильтрованной 2% фосфорновольфрамовой кислоты, pH 5,2, в качестве контрастирующего вещества. Образцы исследовали, используя трансмиссионный электронный микроскоп JEOL 1230 (JEOL Inc., Tokyo, Japan) при ускоряющем напряжении 80 кВ. Цифровое изображение получали с помощью камеры Gatan BioScan 792. Снимок микроскопии осуществляли на пленку 4489 EM и печатали на бумаге Kodabrome II RC F3 (Eastman Kodak Company, Rochester, NY).
В растворе, содержащем только холестерин и Quil A без какого-либо антигена BVD I типа, спиралевидные мицеллы выявляли вместе с мицеллами Quil A и кристаллами холестерина (фигура 11). Спиралевидные мицеллы переплетались и выглядели подобно сети. В образце, содержащем антиген BVD I типа, было обнаружено, что спиралевидные мицеллы случайным образом формировали плотные области округлой формы (фигура 12). Плотные области представляют собой антиген BVD 1 типа и спиралевидный иммуногенный комплекс, образовавшийся в результате ассоциации Quil A и холестерина, которые, как обнаружено, адсорбируются на поверхности антигена BVD I типа.
Формула изобретения
1. Вакцинная композиция, содержащая гликозид сапонина, стерин и антиген, где указанный гликозид сапонина и указанный стерин ассоциируют друг с другом с образованием комплексов в форме спиралевидных мицелл, и где указанный антиген смешан с указанными спиралевидными мицеллами, но не включен в их состав.
2. Вакцинная композиция по п.1, дополнительно содержащая приемлемый в ветеринарии носитель.
3. Вакцинная композиция по п.2, где указанный приемлемый в ветеринарии носитель представляет собой эмульсию типа "масло в воде".
4. Вакцинная композиция по п.1, где указанный гликозид сапонина представляет собой тритерпеноид.
5. Вакцинная композиция по п.4, где указанный тритерпеноид представляет собой Quil A.
6. Вакцинная композиция по п.1, где указанный стерин представляет собой холестерин.
7. Вакцинная композиция по п.1, где указанный антиген включает вирусный антиген, бактериальный антиген или их комбинацию.
8. Вакцинная композиция по п.7, где указанный антиген включает антиген BVDV 1 типа или 2 типа.
9. Вакцина, содержащая гликозид сапонина и стерин при количественном весовом соотношении сапонина к стерину от 1:100 до 5:1, и где указанный гликозид сапонина и указанный стерин ассоциируют друг с другом с образованием комплексов в форме спиралевидных мицелл, обладающих иммуностимулирующей активностью, и дополнительно содержащая иммунологически эффективное количество антигена, и где указанный антиген смешан с указанными спиралевидными мицеллами, но не включен в их состав.
10. Адъювантная композиция «масло в воде», содержащая Quil А и холестерин при количественном весовом отношении сапонина к стерину от 1:100 до 5:1 в приемлемом в ветеринарии носителе, где указанные Quil А и холестерин ассоциируют друг с другом с образованием комплексов в форме спиралевидных мицелл, обладающих иммуностимулирующей активностью, и где масло представляет собой неметаболизируемое масло и где, кроме того, указанные спиралевидные мицеллы микрофлюидизированы с приемлемым в ветеринарии носителе с образованием субмикронной эмульсии «масло в воде».
11. Способ получения вакцины по п.1, включающий:
a) получение композиции антигена в буфере;
b) добавление сапонина к композиции со стадии а); и
c) добавление стерина в спирте к композиции со стадии b).
12. Способ по п.11, дополнительно включающий стадию микрофлюидизации композиции со стадии с).
|