
СПИСОК ПАТЕНТОВ С УПОМИНАНИЕМ ГИАЛУРОНОВОЙ КИСЛОТЫ
-
- 2017751 Способ получения гиалурона
- 2192150 БАД для профилактики йодной недостаточности
- 2112542 Препарат для лечения патологий соединительных тканей
- 2225206 Препарат для лечения рака молочной железы
- 2299733 Лечение опорно-двигательного аппарата
- 2299732 Способ лечения глаукомы
- 2299726 Противоинфекционная губная помада
- 2299725 Косметическое средство для ухода за кожей
- 2198878 Ароматическое соединение
- 2198702 Способ подготовки трофических язв к аутодермапластике
- 2198653 Вагинальные суппозитории
- 2197946 Композиция для ухода за волосами
- 2197923 Фармацевтическая композиция для лечения отеков роговицы
- 2298410 Биотрансплантант и способ лечения ревматических и аутоиммунных заболеваний
- 2197501 Фотоотверженный гель на основе сшитой гиалуроновой кислоты
- 2197228 Твердые лекарственные формы
- 2197222 Водная компазиция для ухода за волосами, лица и тела
- 2297425 Полипептиды
- 2297240 Композиция с гиалуроновой кислотой
- 2297230 Фармацевтическая компазиция с ксантоновой смолой
- 2196588 Глазные капли
- 2195955 Применение биологически активных веществ
- 2195926 Дерматологические композиции
- 2295954 Микрочастицы для доставки нуклеиновых кислот
- 2295951 Косметика для ухода за кожей лица и век
- 2195262 Фармакологическое средство на основе гиалуроновой кислоты
- 2194512 Способ профилактики и коррекции процесса старения кожи
- 2194478 Лечение экземы
- 2294716 Расширяемый стент
- 2194055 Сшитые сополимеры
- 2099350 Ассоциаты депротонированной гиалуроновой кислоты
- 2293557 Средство для лечения кожи и слизистых
- 2292878 Приготовление микроцастиц, содержащих метопропол
- 2292746 БАД
- 2192256 Защита кишечника
- 2191782 Получение модифицированной гиалуроновой кислоты
- 2292219 Паратиреоидный гормон человека
- 2291686 Микроцастицы
- 2191000 Косметическая маска
- 2290921 Фармацевтические и косметические средства против старения кожи
- 2290900 Модифицированный биоматериал для использования в офтальмологии
- 2290899 Получение биоматерьяла
- 2290397 Новые инданилиденовые соединения
- 2290186 Лечение сирингомиелии
- 2288702 Иррингационный раствор для офтальмологии
- 2288699 Гель для лечения стоматологических заболеваний
- 2188011 Активирующая остеогенез фармацевтическая композиция
- 2187327 Средство с антисептиком
- 2187325 Средство с радиопротекторным действием
- 2287330 Композиции миноксидила
- 2186786 Способ получения гиалуроновой кислоты
- 2186593 Лечение раненого процесса кожи
- 2286801 Очищение воды
- 2286781 Лечение ожогов пищевода у детей
- 2286764 Средство лечения воспалений полости рта
- 2185840 Лечение инфекционных заболеваний
- 2286151 Альфа-2-Дельта-Лиганда
- 2185149 Ранозаживляющий гель
- 2285527 Лечение ИЛ-6 заболеваний
- 2184448 Раствор хранения роговицы, включающий гиалуроновую кислоту
- 2090179 Крем для кожи
- 2183961 Способ лечения кожи
- 2284331 Соли алифотических аминов
- 2284187 Производные амида
- 2089191 Снизить внутрение давление
- 2283320 Получение гликозаминогликанов
- 2283129 Лечение опухолей
- 2283098 Косметические средства с Q
- 2182574 Ароматические соединения
- 2088257 Средство с гипохолестеролемическим действием
- 2088218 Состав для гигиенических салфеток
- 2088206 Способ получения препарата, создающего исскуственный загар
- 2282462 Противомикробные средства
- 2182008 Интровагинальная компазиция
- 2181999 Препарат с отсроченным высвобождением
- 2181998 Новые композиции липидов
- 2181995 Лечение болевого синдрома
- 2181295 Вирионная вакцина
- 2087144 Витамин Е
- 2379336 Способ стирки
- 2379052 Вакцинация
- 2180855Композиция в виде ионного комплекса
- 2379025 Противоинфекционный гель
- 2180825 Лечение травм роговицы
- 2281082 Способ коррекции эстетических и возрастных проблем кожи
- 2180576 Биоактивная добавка для косметических средств
- 2280459 Средство для изменения скорости роста или репродукции клеток
- 2179981 Соли переходного металла
- 2378010 Жидкие вакцины
- 2378008 Комбинированные вакцины
- 2378007 Анаболическое средство
- 2377973 Растительные экстракты
- 2280041 Способ получения водорастворимых комплексов гиалурил
- 2280038 Биополимеры
- 2323733 Йодный обмен
- 2377260 Гель
- 2178693 Противовирусное средство на основе гиалуроновой кислоты
- 2178692 Облегчающие зуд косметическое средство
- 2377022 Гемостатические спреи
- 2376982 Увлажняющая сыворотка для лица
- 2376974 Трансдермальный гель для лица
- 2362784 Гипо-и гиперацетилированные менингокковые капсульные сахариды
- 2177789 Устройство для доставки лекарства к шейке матки
- 2277954 Крем для лица омолаживающий
- 2376378 Способ получения метионина
- 2177332 Биоматериал для предотвращения послеоперационных спаек, с производной гиалуроновой кислотой
- 2177310 Способ получения таблеток
- 2376011 Средство для позвоночника
- 2277410 Косметическое средство
- 2323748 Медицинская повязка
- 2276998 Гидрогелевые композиции
- 2082416 Способ получения препарата с коллагенном из животного сырья
- 2375081 Адсорбирующее изделие
- 2375049 Охлаждающий пластырь
- 2346049 Способ получения гиалурона
- 2275913 Фармацевтические средства
- 2174985 Полисахарид с антиоксидантом
- 2373957 Носитель для лекарственных средств и биологически активных веществ
- 2373941 Способ коррекции возрастных и патологических изменений кожных покров
- 2174845 Композиции и способы доставки генетического материала
- 2174830 Средство для укрепления волос
- 2373769 Синбиотическая композиция
- 2274472 Лечение апорно-двигательного аппарата и болевых синдромов
- 2372929 Профилактическая композиция на основе веществ фенольной природы в липосомной форме
- 2173563 Способ нанесения на поверхность предметов покрытия на основе гиалуроновой кислоты, её производных и полусинтетических полимеров
- 2079304 фармацевтическая композиция, обладающая иммуносупрессорной и антимикробной активностью
- 2273645 Полипептид ожирения
- 2173154 Фракция кератансульфатолигосахаридов и содержащий ее фармацевтический препарат
- 2173136 Грязная мазь
- 2173128 Способ хирургического лечения центральных разрывов сечатки
- 2078561 Косметическое средство предотвращающее старение кожи
- 2172490 Способ прогнозирования воспалительных заболеваний молочной железы при эндопластике
- 2272645 Способ лечения ЦМВ-Инфекции у детей раннего возроста
- 2272636 Фармацевтическая композиция для местного лечения воспаления
- 2272635 Фармацевтически активная субстанция для офтальмологии
- 2272599 Биоматерьял для стабилизации прогрессирующей миопии "Коллаплант"
- 2172168 Средство для заживления ран на основе гиалуроновой кислоты
- 2371172 Фармацевтическая композиция для лечения нервной системы на основе стефаглабрина
- 2171470 Способ прогнозирования послеоперационной трансформации доброкачественных опухолей нервной системы
- 2077317 Состав для ванн
- 2271213 Комбинированные композиции, содержащие экстракты из растений и морских животных
- 2076872 Способ получения окрашенной гиалуроновой кислоты
- 2076671 Раствор для защиты роговицы
- 2370281 Конъюгаты гидроксиалкилкрахмал
- 2370275 Способ лечения (коррекции) косметических и возрастных дефектов кожи
- 2370258 Фармацевтическая композиция для парентальной доставки в форме лиофилизата
- 2270023 Способ экстракции и очистки протеогликана хрящего типа (варианты)
- 2369408 Гемостатическая композиция, включающая гиалуроновую кислоту
- 2369387 Фармацевтическая композиция для лечения нервной системы
- 2369379 Нетаблитированные жевательные формы для индивидуального введения
- 2169136 Производное коричной кислоты
- 70792 Медицинский аппликатор
- 20741717 Способ стабилизации аскорбиновой кислоты
- 2074712 Способ получения препарата, препятствующего преждевременной эякуляции
- 2367954 Способ прогнозирования развития кожной патологии у женщин с синдромом склерополикистозных яичников (СПКЯ)
- 2268075 Устройство для электрокинетической доставки
- 2268052 Средство для лечения воспалительных и дегенеративных заболеваний суставов
- 2167649 Способ получения твердой дисперсии умеренного водорастворимого лекарственного вещества
- 2167647 Гель для бритья
- 2073520 Лечение урологических инфекций
- 2367476 Биопластический материал
- 2367475 Мембрана для использования при направленной регенерации тканей
- 2367469 Фармацевтическая композиция на основе лизоамидазы
- 2367456 Фармацевтическая композиция обладающая антибактериальным и некролитическим действием
- 2367455 Фармацевтическая композиция обладающая некролитическим и антибактериальным действием
- 2267324 Применение антиадгезивных углеводов, препарат для уменьшения и /или блокирования адгезии патогенных веществ
- 2166934 Композиции включающие биологический агент
- 2166510 Псевдодипептиды
- 2366460 Композиции, имеющие высокую противовирусную и антибактериальную активность
- 2360901 Производные феноксиуксусной кислоты
- 2165749 Способ восстановления эндотелия роговицы
- 2265441 Способ укрепления склеры
- 2365382 Композиции и способы для регуляции развития сосудов
- 2070879 Соли гликозаминогликанов
- 2164914 Циклические и гетероциклические N - замещенные - иминогидроксамовые карбоновые кислоты
- 2264627 Хламидийный конъюктивит
- 2364399 Фармацевтический препарат на основе стефаглабрина
- 2264230 Препарат с замедленным высвобождением активного вещества
- 2363497 Фармацевтические композиции
- 2363496 Способ увеличения объема мягких тканей
- 2363473 Способ антифлогистической активации в эксперементе
- 2363461 Фармацевтический препарат на основе сигетина
- 2363459 Средства для введения в роговицу глаз для предотвращения офтальмологических нарушений
- 2363448 Фармацевтические композиции
- 2163123 Глазные капли
- 2162687 Усовершенствованнная лекарственная форма индуктора интерферана
- 2162343 Биосовместимый полимерный материал и способ его получения
- 2162327 Лечение рака
- 2067841 Способ получения ароматизатора
- 2161478 Способ консервированого лечения гонартроза
- 2361617 Вольфрамовые частицы в качестве рентгеноконтрастных веществ
- 2361552 Способы и устройства для дренирования жидкостей и понижения внутриглазного давления
- 2066996 Способ изготовления пленочного материала для офтальмохирургии
- 2361417 Корм с глюкозамином и экстрактом ивы для профилактики артроза у животных
- 2161002 Пищевой общеукрепляющий лечебно-профилактический продукт из хрящевой ткани акул
- 2360928 Комплексная матрица для медико-биологического применения
- 2160574 Способ лечения глаукомы
- 2360688 Способ лечения повреждений переферических нервов
- 2360670 Фармацевтическая композиция при климактерических расстройствах
- 2360646 Эндолюминальный протез
- 2260445 Способ усовершенствования транспортировки через легко прспосабливаемый полупроницаемый барьер
- 2260007 Производные амида
- 2359975 Способ получения модифицированных арабиногалактанов
- 2359974 Антигенные Пептиды
- 2159775 Псевдопептидный продукт
- 2259833 Фармацевтическая композиция для лечения роговицы глаза
- 2259816 Ранозаживляющее средство
- 2259815 Способ коррекции возрастных изменений, связанных с процессами старения кожи
- 2359706 Способ сохранения офтальмологических растворов
- 2359704 Антисептическое средство
- 2359662 Микрокапсулы
- 2159253 Катионные полимеры
- 2159111 Средство для ухода за кожей лица
- 2159105 Композиция для защиты кожи от опасных химических веществ Получение
- 2158593 Биосовместимый водный раствор
- 2358728 Способ лечения и предупреждения потери костной ткани
- 2258517 Способ хирургического лечения травмотических повреждений селезенки пленкой на основе гиалуроновой кислоты
- 2357968 Кристалические формы производной имидазола
- 2357957 Ингибиторы P38 и их применение
- 2157647 Пищевая добавка и ее получение
- 2357758 Препараты для чрескожной и чересслизистой добавки
- 2063244 Способ стабилизации растворов
- 2063140 Способ получения препарата для консервирования мяса
- 2157381 Способ получения гиалуроновой кислоты
- 2257198 Композиции микроцастиц
- 2356909 Белковый комплекс
- 2356570 Косметическая композиция
- 2256434 Способ закрытия перфорации барабанной перепонки
- 2356520 Способ лечения постконтузионного повреждения сечатки глаза
- 2156133 Гель
- 2255945 Полимерная композиция
- 2355761 Средства повторной дифференцировки
- 2061043 Способ повышения устойчивости урокиназы к нагреванию
- 2061005 Способ получения красителей для гистологических исследований
- 2355420 Зубная паста
- 2355385 Композиции пролонгированного действия с контролируемым высвобождением
- 2355240 Способ получения пищевого препарата хондропротекторного действия
- 2155057 Пихтово репейный бальзам
- 2354409 Способ производства высвобождающих лекарственные средчтва медицинских устройств
- 2254145 Раневое покрытие на основе коллаген-хитозанового комплекса
- 2254133 Лечение и профилактика ВИЧ-инфекции у человека
- 2253439 Фармацевтическая композиция для защиты и улучшения оптических свойств роговици при проведении эндовитреальных вмешательств
- 2253437 Способ омоложения кожи
- 2153352 Фармацевтическая композиция обладающая ранозаживляющим и противовоспалительным действием
- 2353354 Фармацевтический препарат на основе низкомолекулярного индуктора интерферона
- 2252787 Способ получения искусственной матрицы кожи
- 2252767 Способ нормализации иммунобиохимического гомеостаза коров в предродовом и послеродовом периодах
- 2352583 Фармацевтическая композиция содержащая Fc-область иммуноглобулина в качестве носителя
- 2152403 Модифицированные полисахариды
- 2352356 Иммуногенная композиция
- 2352342 Исскусственный физиологический солевый раствор Способ его получения
- 2352330 Фармацевтический препарат на основе низкомолекулярного индуктора интерферона
- 2352323 Фармацевтический препарат с модифицированным высвобождением
- 2152027 Способ подготовки ткани мозга для определения гликозаминогликанов
- 2251842 Интектицидный состав для борьбы с личинками оводов
- 2151580 Способ активации пролиферации эндотелия роговицы
- 2351648 Дифференцировка стромальных клеток, полученных из жировой ткани, в эндокринные клетки поджелудочной железы и их использование
- 2351595 N - гидроксиформамидные соединения в качестве ингибиторов металлопротеина
- 2251411 Косметическое средство в лиофилизированной фармацевтической форме
- 2251405 Косметика...ее композиции для косметических препаратов
- 2251367 Средство со сшитой гиалуроновой кислотой для наращивания тканей
- 2351359 Косметика для профилактики и лечения избыточной массы тела
- 2351322 Препарат на основе низкомолекулярного индуктора интерферона
- 2351153 Диета при остеортрите собак
- 2350958 Способ определения групповой принадлежности синовальной жидкости
- 2350625 Производные гиалуроновой кислоты с пониженной биодеградируемостью
- 2150266 Крем после бритья
- 2350354 Фармацевтическое средство содержащие антагонист и фактор некроза
- 2350340 Способ коррекции процессов регенерации
- 2350309 Способ лечения избыточной массы тела с помощью рефлексотерапии
- 2250047 Профилактический продукт из хрящевой ткани гидробионтов
- 2249467 Медицинский матерьял и изделия на его основе
- 2055079 Способ получения препарата гиалуроновой кислоты
- 2349599 Биоадгезив мидии
- 2054903 Способ лечения коллагеноза у бычков на откорме
- 2249210 Способ прогнозирования предрасположенности к развитию и тяжести течения деформирующего остеоартроза коленного сустава у взрослых
- 2349339 Средство для соединительной ткани
- 2148988 Человеческий интерферона
- 2148399 Лечение атеросклероза
- 2148396 Способ определения активного вещества в дифильных мазевых основах
- 2148375 Способ диагностики близорукости
- 2348415 Способ противоспаечной терапии после хирургического вмешательства
- 2348400 Препарат на основе низкомолекулярного индуктора интерферона
- 2348386 Способ непроникающего хирургического лечения первичной открытоугольной глаукомы
- 2248213 Лечение Галактозидальной А недостаточности
- 2347586 Микрофлюидизированные эмульсии типа "масло в воде" и вакцинные средства
- 2147243 Контрастное средство
- 2146526 Лечебный препарат дисбактериоза и урогенитальных инфекций
- 2146148 Терапевтическое применение фактора роста кератиноцитов (ФРК)
- 2146139 Способ повышения активности макрофагов и комбинации для его осуществления
- 2346277 Способ диагностики специфического синовита
- 2345793 Ультразвуковые контрастные вещества и их получение
- 2345782 Терапевтические комбинации на основе PORIFERA для лечения и предотвращения кожных заболеваний
- 2245131 Способ коррекции косметических недостатков кожи
- 2245130 Способ активации восстановительных процессов в коже
- 2144833 Хондроитиназа
- 2344809 Получение твердых дозированных форм с использованием сшитого нетермопластичного носителя
- 2244540 Косметический гель для ухода за кожей лица
- 2244536 Способ лечения дегенеративно-дистрофических заболеваний тазобедренного сустава
- 2344167 Хмелевый экстракт
- 2143884 Агент регулирования дифференциации клеток кожи, культурная среда для клеток или тканей и способ регулирования дифференциации клеток кожи
- 2343932 Способ получения обладающих пониженной растворимостью в воде пленночных материалов
- 2343903 Устройство доставки лекарств для контролируемого введения препаратов
- 2048817 Способ получения материала для лечения ожогов и гнойно - некронических ран
- 2048803 Гидратантный крем
- 2242974 Средства и способы лечения воспалительных заболнваний
- 2142816 Способ получения антигерпетической вакцины
- 2342923 Средство для обработки рук с увлажняющим эффектом
- 2142781 Косметика для макияжа ресниц и бровей и агент ингирирующий рост микроорганизмов в косметических средствах
- 2242251 Трансплантируемые стенты с биоактивными покрытиями
- 2142257 Способ обработки глазных имплантантов и контакных линз
- 2342389 Мононатриевая соль
- 2342107 Способ устранения западения верхнего века при анофтальме
- 2141828 Средство, пролонгирующее эффективность чесночного порошка
- 2241489 Косметическое средство матриксных протеинов для залечивания ран
- 2241443 Средство для лечения герпеса
- 2241414 Способ получения протезов кровеносных сосудов
- 2341539 Гидрогель
- 2141324 Регулятор скорости воздействия препарата для инъекций
- 2141312 Косметическое средство для ухода за кожей лица
- 2341296 Средства и способы покрытия медицинских имплантантов
- 2341272 Средство для неспецифической иммунотерапии
- 2341266 Стенты с нанесенным покрытием содержащим N - (5-(4-(4-
- 2341257 Иммуномодулирующее средство
- 2341255 Средство для лечения климактерических расстройств
- 2240821 Способ лечения урологических инфекций
- 2140786 Способ лечения лишая
- 2140243 Способ хирургического лечения диабетической ретинопатии и отслоек сечатной оболочки
- 2240140 Медицинская многослойная повязка и изделия на ее основе
- 2240135 Культура клеток, содержащая клетки - предшественники остеонегеза, имплантант на ее основе и его использование для восстановления целостности кости
- 2240123 Экзогенные биологически активные коньюгирующие вещества
- 2139886 Фотоотвержаемое производное гликозаминогликата, сшитое производное гликозаминогликата и способы их получения, способ предотвращения клеточной и тканевой адгезии
- 2139729 Вакцина. Способ стимулирования иммунной системы
- 2339386 Средство обладающее радио - и химиозащитным действием
- 2339369 Лечение офтальмологических нарушений с использованием мочевины и ее производных
- 2139041 Гидратантный регенерирующий крем и способ его получения
- 2139039 Косметический суперкрем для ухода за кожей
- 2139017 Способ получения боисовместимого материала
- 2138503 Производные камптотецина, способы их получения, уникальное средство
- 2338556 Средство содержащие антагонист Р2Х - рецептора и нестероидное противоспалительное лекарственное средство
- 2338514 Косметическое средство для профилактики старения кожи
- 2138297 Медицинские устройства, подверженные вызываемому разложению
- 2138295 Покрытие для ран
- 2337906 Ингибиторы цитозольной фосфолипазы А2 Применение физиологически допустимого корпускулярного ферримагнитного или ферромагнитного материала. Способ формирования магнитометрического изображения
- 2137501 Устройство формирования изображения
- 2137477 Способ лечения заболеваний характеризующихся аутоиммунной агрессией
- 2137467 Крем для кожи лица и тела
- 2137449 Способ коррекции дефектов преломления в глазу млекопитающего
- 2137402 Пищевая Добавка БАД
- 2336899 Способ стимуляции миелопоэза
- 2336862 Способ получения раствора для лечения роговицы
- 2336830 Способ восстановления костных структур челюсти
- 2136696 Новый полипептид и средство против ВИЧ - Инфекции
- 2336092 Биоадгезивное средство, по существу свободное от воды
- 2336089 Средство и способ лечения заболеваний периодонтальных и пульпы
- 2336074 Средства и способы лечения заднего сегмента глаза
- 2235548 Ранозаживляющее средство
- 2135186 Способ лечения рефлекторных синдромов при остеохондрозе
- 2234945 Стабилизатор водного раствора и водосодержащего сырья
- 2334762 Растворимая ассоциативная карбоксиметилцеллюлоза
- 2234514 Макропористые хитозановые гранулы и способ их получения. Способ культивирования клеток
- 2133615 Средство для лечения неврологических заболеваний
- 2233164 Способ профилактики развития послеоперационных спаек брюшной полости
- 2133127 Неткатный материал, способ его получения и способ лечения
- 2333223 Альдегидные производные сиаловой кислоты и средства на их основе
- 2333007 Полипептидные вакцины для широкой защиты против рядов поколений менингококов с повышенной вирулентностью
- 2332985 Дозированные формы анестезирующих средств с длительным высвобождением для обезболивания
- 2132677 Косметическая маска
- 38603 Пленочный аппликатор
- 2232594 Средство содержащие ингибирующие остеокластогенез фактор и полисахарид
- 2332238 Средство для прокладок, раневых повязок и других изделий, контактирующих с кожей
- 2331668 Стромальные клетки, получение из жировой ткани, для заживления дефектов роговицы и внутриглазных дефектов и их использование
- 2331438 Альфа - 2 - Дельта Лигант для лечения симптомов нижних мочевыводящих путей
- 2331411Электропряденые аморфные фармоцевтические средства
- 2331367 Способ профилактики образования спаек и их рецидива
- 2130767 Масло в воде для получения косметических и дерматологических средств, способ косметической обработки
- 2230752 Поперечносшитые гиалуроновые кислоты и их применение в медицине
- 2230558 Способ восстановления и сохранения здоровья скмьи
- 2230550 Средства длительного высвобождения, способ их получения и применения
- 2230458 Поддержания здоровья суставов
- 2330290 Способ определения состояния метаболических процессов в ткани суставного хряща
- 2230073 Способ поперечного сшивания карбоксилированных полисахаридов
- 2329059 Способ лечения полипозного риносинусита
- 2329037 Комбинированная терапия для лечения иммуновоспалительных заболеваний
- 2128666 Гиалуроновая кислота и ее соли, способ очистки гиалуроновой кислоты, способ получения гиалуроновой кислоты. Фармацевтический препарат с гиалуроновой кислотой и средства с гиалуроновой кислотой используемые в офтальмологии
- 2328740 Способ экспресс - оценки действия зубных паст
- 2128502 Косметический гель
- 2328272 Суппозитории индуктора интерферона
- 2328268 Косметика содержащая амфолитный сополимер
- 2128057 Композиционная мембрана, способ ее получения и способ направленной регенерации тканей с ее применением
- 2128055 Средство замедленного освобождения и способ его получения
- 2128049 Свечи
- 2227743 Полипептидные варианты с повышенной гепаринсвязывающей способностью
- 2326893 Ковалентное и нековалентное сшивание гидрофильных полимеров
- 2326697 Новый перевязочный материал для быстрого заживления раневой поверхности кожи
- 2126264 Фармацевтическое средство с гиалуроновой кислотой
- 2326137 Способ получения содержащих альгинат пористых формованных изделий
- 2325902 Способ выделения гликозаминогликанов из минерализованной соединительной ткани
- 2225195 Репелленты против насекомых
- 2325193 Сосудистый стент
- 2325184 Улучшенные везикулы наружной мембраны бактерий
- 2325153 Многокомпонентная фармацевтическая дозированная форма
- 2325152 Удерживаемая в желудке система регулируемой доставки лекарственного средства
- 2029955 Способ предоперационного определения помутнения задней капсулы хрусталика при экстракции катаракты
- 2324688 Производные бисбензизоселеназолонила с противоопухолевым, противовоспалительным и антитромбоническим действием
- 2323017 Устройство и способ контролируемый доставки активных веществ в кожу
- 2323011 Содержащий Коллаген I и Коллаген II способный к рассасыванию внеклеточный матрикс, предназначенный для реконструирования хряща
- 2322955 Способ изготовления имплантанта для пластики дефектов хрящевой ткани
- 2322454 Антитело против CCR5
- 2322263 Система продолжительного высвобождения растворимого лекарственного средства
- 2221561 Витамин Е и его сложные эфиры
- 2321634 Гены участвующие в метаболизме углерода и продуцировании энергии
- 2321597 Биоматерьял, способ его приготовления и его применение, медицинское средство, имплантант и вкладыш
- 2121340 Средство для похудения
- 2220737 Средство для улучшения состояния опорно-двигательного аппарата
- 2220729 Гель используемый в стоматологии
- 2320720 Способ культивирования фибропластов для заместительной терапии
- 2320378 Накожный аппликатор
- 2320369 Средства, содержащие Альфа - 2 - Дельта Лиганды и ингибиторы обратного захвата серотонина/норадреналина
- 2320362 Местные фармацевтические средства, содержащие проантоцианидины, для лечения дерматитов
- 2320322 Биоадгезивная доставка лекарств
- 2320318 Чувствительное к температуре изменяющие состояние средство гидрогеля
- 2025120 Способ получения препарата, содержащего Фактор /G-CSF/, стимулирующий рост колоний гранулоцитов
- 2319490 Средство для введения железа при лечении синдрома беспокойных ног
- 25995 Содержащее адгезив приспособление для фиксации зубных протезов в полости рта
- 2218907 Средство для ухода за кожей лица и веками
- 2318830 Способ получения модифицированного дерматансульфата
- 2118153 Косметика - туш для ресниц
- 2217441 Способ получения полимера
- 2317296 Изетионатная соль селективного ингибитора CDK4
- 2217171 Мембрана для использования при направленной регенерации тканей
- 2317095 Экстракты ECHINACEA ANGUSTIFOLIA
- 2216332 Препарат для лечения астроза
- 2216314 Крем - маска для обезвоженной кожи
- 2316333 Средство оздоровительно-восстановительных косметических панто-магниевых ванн
- 2021304 Способ получения биологически активного средства
- 2115662 Способ получения гиалуроновой кислоты
- 2315627 Впрыскиваемые имплантанты на керамической основе для заполнения морщин, кожных впадин, шрамов
- 2315623 Средство получаемое путем лиофилизации препарата
- 2114862 Способ получения гиалуроновой кислоты
- 2314791 Лечебно-Косметическое средство
- 2314791 Косметический крем-бальзам для ухода за кожей лица и шеи
- 2214600 Способ оценки эффективности лечения неврологических проявлений
- 2114602 Способ косметической обработки
- 2114587 Раствор для защиты роговицы
- 2214283 Имплантант для подкожного или внутрикожного введения
- 2313370 Медицинские протезы, имеющие улучшенную биологическую совместимость
- 2313356 Препарат для лечения демодекоза
- 2313338 Средство на основе этиллинолеата и триэтилцитрата для лечения себореи и угрей
- 2313328 Косметика содержащая тонкодисперный и пористый порошок
- 2212880 Способ получения препарата содержащего антибиотик, с замедленным высвобождением активного вещества
- 2312640 Способ лечения Блефароконьюнктивальной формы синдрома сухого глаза
- 2017751 Способ получения гиалуроновой кислоты
- 2312145 Гены CORYNEBACTERIUM GLUTAMICUM, кодирующие белки, участвующие в синтезе мембран и мембранном транспорте
- 2311458 Белки вызывающие измененную иммуногенную реакцию. Способ их получения и использования
- 2311183 Улучшенное разделение с использованием гталуроновой кислоты
- 2311177 Ингибиторы интегрина для лечения заболевания глаз
- 2300069 Косметическая маска
- 2211024 Уход за сухой кожей
- 2310440 Раствор для защиты роговицы от повреждений
- 2309684 Лечение межфалангового остеоатроза узелковой формы
- 2309406 Способ мониторинга фиброза печени у больных хроническим гепатитом с (ХГС)
- 2209088 Опосредованная рецепторами доставка генов с использованием векторов на основе бактериофагов
- 2308967 Уменьшение объема ткани
- 2308962 Средство для опорно-дигательного аппарата
- 2308957 Способ получения препарата для мезотерапии
- 2308954 Средство для лечения ран, содержащее плазму или сыворотку крови
- 2308951 Комплексный способ профилактики вагинальных дисбактериозов
- 2308937 Косметическая биологически активная добавка и косметический литофитокомплекс на ее основе
- 2208638 ДНК (варианты), способ получения белка
- 2207885 Способ подачи небольшого объема лечебного раствора к целевому месту
- 2207858 Лишенные побочных эффектов производные простагландинов для лечения глаукомы
- 2207845 Твердая лекарственная форма пролонгированного действия
- 2207844 Препарат для местного неинвазивного применения
- 2207841 Средства с антиферментативным действием
- 2306335 Стволовые клетки и решетки полученные из жировой ткани
- 2306140 Новые рецепторы для Helicobacter pylori и их применение
- 2205612 Способ эндотелизации IN VITRO протезов кровеносных сосудов
- 2105540 Депигментирующее средство
- 2304960 Косметическое средство для кожи
- 2304616 Гены участвующие в гомеостазе и адаптации
- 2204550Способ получения длинноцепочечной N-Ацилированной кислотой Аминокислот
- 2204415 Способ получения изображения
- 2204394 Средство для лечения грибковых инфекций, желудочных язв
- 2204366 Способ хирургического лечения глаукомы
- 2104034 Вагинальное увлажняющие средство, способ его получения
- 2303991 Биологически активная добавка
- 2303990 БАД
- 2303973 Адсорбирующее изделие
- 2203676 Средство обладающее иммунокорригирующим действием
- 2203672 Способ предупреждения беременности
- 2303635 Гены кодирующие белки резистентности и толерантности к стрессам
- 2303529 Способ фиксации альгинатного геля на твердой фазе, способ получения клеточного чипа на его основе
- 2203078 Способ лечения гнойных ран
- 2302412 Гидразоно-малонитрилы
- 2102400 Способ получения гиалуроновой кислоты
- 2202356 Способ стимуляции репаративных процессов длительно незаживающих ран и трофических язв
- 2202336 Средство для ухода за кожей
- 2302231 Глазные капли
- 2102082 Способ магнитометрического исследования тела человека или животного
- 2301814 Полиакриламидный гидрогель
- 2201765 Гибридные матричные имплантанты и эксплантанты
- 2301677 Биотрансплантант для лечения дегенеративных и трвматических заболеваний хрящевой ткани и способ его получения
- 2301676 Способ лечения ревматизма
- 2301674 Способ лечения больных с переломами нижней челюсти
- 2301661 Средство с регулируемым освобождением и способ его получения
- 2005488 Средство для лечения болезней соединительной ткани
- 2200001 Крем для кожи
|
РОССИЙСКАЯ ФЕДЕРАЦИЯ

ФЕДЕРАЛЬНАЯ СЛУЖБА
ПО ИНТЕЛЛЕКТУАЛЬНОЙ СОБСТВЕННОСТИ
ПАТЕНТАМ И ТОВАРНЫМ ЗНАКАМ
|
Патент №2311183 |
(54) УЛУЧШЕННОЕ РАЗДЕЛЕНИЕ
(57) Реферат:
Способ для селективного связывания и выделения, по меньшей мере, одного компонента из жидкости организма. Предложенный способ включает прохождение жидкости организма, такой как цельная кровь, через жесткую интегральную разделительную матрицу, без исключения компонентов по размерам из указанной матрицы, причем указанная матрица имеет пористую структуру с размером пор в пределах от 5 микрон до 500 микрон, а также активную поверхность в пределах от 0,5 см2 до 10 м2, связывание, по меньшей мере, одного компонента жидкости организма, по меньшей мере, с одной функциональной группой, расположенной в указанной матрице, при этом указанную матрицу получают с помощью способа, выбранного из группы, включающей в себя способы спекания, формования и вспенивания. Предложено применение остатка желчной кислоты, иммобилизованного на подложке, для устранения компонента из содержащего его водного раствора. Предложено устройство для селективного связывания и выделения, по меньшей мере, одного компонента из жидкости организма, содержащее корпус, вход, выход и, по меньшей мере, одну разделительную матрицу, причем указанная матрица является жесткой и интегральной при прохождении указанной крови или жидкости организма через нее, и указанная матрица имеет пористую структуру с размерами пор, находящимися в пределах от 5 микрон до 500 микрон, а также активную поверхность, находящуюся в пределах от 0,5 см2 до 10 м2, которая способна связывать указанный, по меньшей мере, один компонент, где указанная разделительная матрица имеет пористую структуру, полученную с помощью способа, выбранного из группы спекания, формования и вспенивания. Группа изобретений обеспечивает селективное связывание и выделение, по меньшей мере, одного компонента из жидкости организма, при этом жидкости дается возможность для прохождения через жесткую интегральную разделительную матрицу без вытеснения из нее. 3 н. и 29 з.п. ф-лы, 2 табл., 4 ил.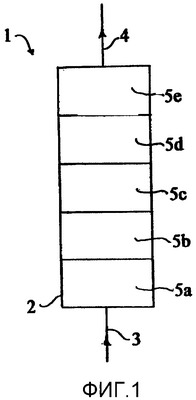
Настоящее изобретение относится к усовершенствованиям при выделении компонентов из цельной крови или телесной жидкости. Более конкретно настоящее изобретение относится к способу, где крови или телесной жидкости (или, иначе говоря, жидкости организма) дают возможность проходить через жесткую интегральную разделительную матрицу без вытеснения из нее.
Воспалительные процессы, такие как сепсис, являются основной причиной заболеваемости и смертности у людей. Согласно оценкам, только в США от 400000 до 500000 случаев сепсиса приводят к смерти 100000-175000 людей ежегодно. В Германии отмечены уровни сепсиса, достигающие 19%, у пациентов, госпитализированных в отделениях интенсивной терапии. Сепсис также становится ведущей причиной смерти в отделениях не являющихся отделениями интенсивной терапии, среди пациентов с нетравматическими заболеваниями. Несмотря на большие успехи, достигнутые в последнее десятилетие, при лечении серьезных инфекций несчастные случаи и смертность, связанные с сепсисом, продолжают расти.
Существует три главных типа сепсиса, характеризуемые типом инфицирующего организма. Грамотрицательный сепсис является наиболее распространенным. Большинство этих инфекций вызываются Escherichia coli, Klebsiella pneumoniae и Pseudomonas aeruginosa. Грамположительные патогены, такие как стафиллококки и стрептококки, являются второй главной причиной сепсиса. Третья главная группа включает в себя грибки. Грибковые инфекции составляют относительно малый процент случаев сепсиса, но они приводят к высокому уровню смертности.
Хорошо установленный механизм при сепсисе связан с токсичными компонентами грамотрицательных бактерий, то есть с липополисахаридной структурой клеточной стенки (LPS, эндотоксин), которая состоит из группы жирной кислоты, фосфатной группы и углеводной цепи.
Идентифицированы несколько откликов хозяев на эндотоксины, таких как высвобождение цитокинов, которые продуцируются локально. Однако в случае экстенсивной стимуляции имеет место выброс в периферийную кровь, и получают потенциально вредные эффекты, такие как индуцированная дисфункция органов.
Ключевыми медиаторами септического шока являются фактор некроза опухоли (TNF- ), Интерлейкин 1 (Il-1) и Интерлейкин 17 (Il-17), которые высвобождаются моноцитами и макрофагами. Они действуют синэргически, вызывая систему физиологических изменений, приводящих к коллапсу кровообращения и к множественному отказу органов. В самом деле, высокие концентрации TNF- ), Интерлейкин 1 (Il-1) и Интерлейкин 17 (Il-17), которые высвобождаются моноцитами и макрофагами. Они действуют синэргически, вызывая систему физиологических изменений, приводящих к коллапсу кровообращения и к множественному отказу органов. В самом деле, высокие концентрации TNF- могут давать те же симптомы и результаты, что и сепсис. могут давать те же симптомы и результаты, что и сепсис.
Как правило, эндотоксины удерживаются в просвете кишечника. Например, во время кардиопульмонарного шунтирования наличие ишемии (недостатка кровоснабжения) или дизоксии (недостатка кислорода) внутренних органов вызывает разрушение слизистого барьера и транслокацию (то есть перенос эндотоксинов из кишечника в систему кровообращения) эндотоксинов из просвета кишечника в портальное кровообращение.
Антибиотики различных типов широко используются для предотвращения и лечения инфекций. Однако для множества повсеместно используемых антибиотиков среди различных типов бактерий развивается резистентность (устойчивость) к антибиотикам. Это особенно верно для микробной флоры, присутствующей в больницах, где организмы находятся под постоянным селективным давлением среды, развивающим у них резистентность. Кроме того, в больнице большая плотность потенциально инфицированных пациентов и широкие контакты персонала между собой и персонала с пациентами облегчают распространение организмов, устойчивых к антибиотикам. Используемые антибиотики являются наиболее экономичными, наиболее безопасными и наиболее простыми при введении и могут и не иметь спектра действия достаточно широкого для подавления определенных инфекций. Антибиотики могут быть токсичными до разных уровней, вызывая аллергию, взаимодействие с другими лекарственными средствами и вызывая непосредственное повреждение главных органов (например, печени, почек). Многие антибиотики также изменяют нормальную флору кишечника, что может вызвать диарею и недостаточное всасывание пищи.
Определенные антибиотики, как известно, нейтрализуют действия эндотоксинов, такие как полимиксин B. Этот антибиотик связывается с липидной частью A эндотоксина и нейтрализует ее активность. Полимиксин не используется широко из-за его токсичности. Его назначают пациентам только под постоянным наблюдением и при мониторинге функции почек.
Кроме того, для преодоления некоторых ограничений, присущих активной иммунизации против бактериальных компонентов, используются различные методики для продуцирования антител, связывающих эндотоксины. Большое количество антител получают путем иммунизации людей бактериями. Для разработки более совместимых препаратов терапевтических антител были разработаны многочисленные LPS-реактивные моноклональные антитела. К сожалению, клинические испытания не привели к каким-либо преимуществам. Однако необходимо заметить, что эти исследования осуществлялись на людях после наступления симптомов сепсиса. Широко распространено мнение, что лечение антителами против эндотоксинов, назначаемое после возникновения сепсиса, может дать только небольшое преимущество, поскольку эти антитела не могут обратить вспять действие воспалительной системы, инициируемое эндотоксином.
В патенте Японии JP 06022633 описывается адсорбент для антител против липидов, который содержит соединение с анионной функциональной группой, иммобилизованной на водонерастворимом пористом материале. Пористый материал может представлять собой агарозу, целлюлозу, декстран, полиакриламид, стекло, силикагель или твердый полимер, изготовленный из сополимера стирола-дивинилбензола, и пористый материал набивают в виде слоя из отдельных частиц в разделительное устройство.
В попытках удаления компонентов из крови были получены различные материалы адсорбентов. Адсорбент для удаления эндотоксина, содержащий лиганд, иммобилизованный на твердофазной среде подложки, описывается в заявке на Международный патент WO 01/23413. Предпочтительная среда подложки находится в форме шариков. Когда ее набивают в разделительное устройство, твердофазная среда подложки является достаточно пористой для того, чтобы сделать возможным прохождение клеток крови между шариками.
В заявке на Международный патент WO 00/62836, материал адсорбента имеет размер и структуру, адаптированную для удаления микроглобулина  -2 из крови. Материал адсорбента этого документа может представлять собой макропористый синтетический полимер с поверхностью шариков и с порами, модифицированный таким образом, чтобы предотвратить адсорбцию белков и тромбоцитов. Однако отдельные сферические шарики из полимера механически разрушаются при нагрузке примерно 500 г, которую они получают, например, в колонке, набитой шариками. Такая нагрузка приводит к значительному падению давления на колонке. -2 из крови. Материал адсорбента этого документа может представлять собой макропористый синтетический полимер с поверхностью шариков и с порами, модифицированный таким образом, чтобы предотвратить адсорбцию белков и тромбоцитов. Однако отдельные сферические шарики из полимера механически разрушаются при нагрузке примерно 500 г, которую они получают, например, в колонке, набитой шариками. Такая нагрузка приводит к значительному падению давления на колонке.
Для уменьшения падения давления в Европейском патенте EP 464872 получили адсорбент, который содержит пористые твердые частицы геля, нерастворимые в воде, имеющие предел исключения 106-109 Дальтон. Слой геля используют для селективного удаления липопротеинов из крови или плазмы при лечении с помощью экстракорпоральной циркуляции.
Подобным же образом в заявке на Международный патент WO 01/23413 пористый материал подложки для удаления эндотоксина представляет собой шарики, которыми можно наполнять контейнер, причем шарики имеют размер, достаточный для создания между шариками необходимого пространства, когда их набивают в колонку или они присутствуют в виде фильтрующего слоя. Пористый материал подложки может также представлять собой полые волокна для микрофильтрации или плоские листовые мембраны для сведения к минимуму перепадов давления.
В Европейском патенте EP 424698 описывается адсорбент для устранения биологических макромолекул, который состоит из носителя из пористых сферических частиц, имеющих размер частиц 50-150 микрон, и предел исключения, равный, по меньшей мере, 105 Дальтон. Полимиксин B связывается с частицами, которыми впоследствии заполняют картридж, который должен использоваться в системе для экстракорпорального удаления эндотоксина из цельной крови.
В этих традиционных системах для экстракорпорального удаления токсичных компонентов из крови контейнер или картридж сначала заполняют жидкостью, а после этого вводят адсорбирующие пористые шарики. В патенте США № 6408894 описывается способ, который обеспечивает более однородное распределение и более плотную набивку шариков. Способ включает в себя принудительное введение смеси жидкости и шариков в контейнер таким образом, чтобы жидкость выжималась из смеси и из контейнера.
Таким образом, устранение клеток крови облегчает удаление соединений, присутствующих в плазме, как описывается выше, например, в заявке на Международный патент WO 00/62836 или в заявке на Международный патент WO 01/23413. Однако такая методика включают в себя две стадии разделения, которые обе могут вносить вклад в увеличение риска неблагоприятного активирования клеток из-за биологической несовместимости.
Целью настоящего изобретения является создание нового способа для селективного связывания и выделения, по меньшей мере, одного компонента из цельной крови или телесных жидкостей, посредством чего устраняются указанные выше проблемы, связанные с воспалительными процессами.
Другой целью является создание такого способа, при котором селективное связывание и разделение может достигаться на цельной крови, без необходимости в разделении крови на плазму и клетки крови.
Еще одной целью настоящего изобретения является создание такого способа, в котором нет зависимости от размеров, то есть компоненты крови не разделяются посредством исключения (по размерам).
Еще одной целью настоящего изобретения является создание такого способа, при котором в разделительном устройстве могут быть получены высокие скорости потока без появления со временем значительного перепада давления.
Еще одной целью является создание такого способа, в котором кровь в разделительном устройстве не подвергается воздействию сил сдвига, даже при очень высоких скоростях потока, в то время как в линии поддерживается низкое давление для предотвращения повреждений кровеносных сосудов.
Эти цели достигаются с помощью настоящего изобретения, имеющего характерные признаки по п.1 формулы изобретения. Другие преимущества настоящего изобретения станут ясны из пункта 21 формулы изобретения и зависимых пунктов формулы изобретения.
В соответствии с настоящим изобретением предусматривается способ селективного связывания и выделения, по меньшей мере, одного компонента из цельной крови или телесной жидкости. Крови или телесной жидкости дают возможность для прохождения через жесткую интегральную разделительную матрицу без вытеснения из нее, причем матрица имеет пористую структуру с размерами пор, находящимися в пределах от 5 микрон до 500 микрон, и активную поверхность, находящуюся в пределах от 0,5 см2 до 10 м2, которая способна связывать один или несколько компонентов.
В предпочтительном воплощении настоящего изобретения матрица, кроме того, содержит, по меньшей мере, одну функциональную группу, которую вводят посредством нанесения покрытия на поверхность пористой структуры и/или ее модификации. Это приводит к тому, что полученная активная поверхность сама по себе или в сочетании с ее нефункционализованными участками способна к селективному связыванию, по меньшей мере, одного компонента цельной крови или телесной жидкости. Компоненты, которые должны удаляться, могут быть как природного, так и неприродного происхождения, то есть к этому компоненту может прикрепляться конкретный лиганд, такой как антитело.
Кроме того, функциональные группы, получаемые посредством непосредственного или опосредованного селективного преобразования поверхности пористой структуры, могут впоследствии использоваться для иммобилизации лигандов. Однако могут использоваться и функциональные группы пористой структуры, поскольку они находятся в рамках способа по настоящему изобретению.
Размер пор, а также поверхность скелетообразной пористой структуры адаптируют для использования в разделительной матрице способа по настоящему изобретению в связи с очисткой цельной крови. Однако способ в соответствии с настоящим изобретением может также использоваться для удаления компонентов из других телесных жидкостей, а также из водных растворов. Важным аспектом настоящего изобретения является то, что ни один из компонентов и ни один из растворителей не исключается (не вытесняется) из матрицы в ходе процедуры разделения.
В соответствии с настоящим изобретением, жесткая интегральная матрица должна иметь доступную поверхность от 0,5 см2 до 10 м2, и плотность структуры матрицы не является ограничивающей для осуществления способа по настоящему изобретению.
В этой связи термин "жесткий" означает, что матрица не является гибкой, не изгибается или не является мягкой, но способна противостоять давлению, равному, по меньшей мере, 0,5 бар. Термин "интегральная" обозначает, что матрица с высокой площадью поверхности представляет собой единое целое.
Пористая структура матрицы способа по настоящему изобретению изготавливается из металла, оксида неорганического соединения, углерода, стекла, керамики, синтетического полимера и/или природного полимера, или из их смесей. Пористые твердые металлические структуры с хорошо определенными размерами пор и высокими площадями поверхности могут производиться путем использования строго контролируемых способов спекания, которые дают поры, однородные по размерам.
Получены различные полимеры для матрицы в виде формованного или экструдированного пористого материала с пористой структурой, имеющей желаемый размер пор, а также высокую площадь поверхности. Они также производятся в виде пены. Например, полиуретаны, полученные из изоцианатов и различных других органических соединений, имеют активные атомы водорода, которые используются для получения продуктов полиприсоединения. Этот активный водород может приходить из бифункциональных или полифункциональных соединений, таких как полиспирты, полиамины. Реакции с водой приводят к получению первичных аминов, которые используются для ковалентной иммобилизации конкретных лигандов.
Могут использоваться разнообразные металлы и сплавы, такие как нержавеющая сталь, никель, титан, никелево-медный сплав (монель), инконель, хастеллой и другие специальные материалы на основе металла. Оксиды неорганических соединений с высокой площадью поверхности, в частности оксид алюминия и оксид циркония, также могут использоваться с помощью тех же методик для получения керамических материалов с заданными структурами пор. Подобным же образом такая керамика, а также спеченное стекло, которые имеют адекватные размеры пор, могут приобретаться в продаже.
Другие жесткие природные материалы, такие как аморфная окись кремния, например цеолиты и вулканическая порода, также могут использоваться.
Природные материалы и их гибриды, которые могут использоваться в качестве материала матрицы в способе по настоящему изобретению, представляют собой полисахариды, такие как целлюлоза, и другие полимерные углеводные материалы. Другие пригодные для использования природные полимерные материалы представляют собой полиаминокислоты, также кислоты, включающие в себя синтетические аминокислоты, полимолочную кислоту, полигликолевую кислоту и ее сополимеры с молочной кислотой.
В этой связи термин «гибрид» охватывает производные таких природных материалов, например диацетатцеллюлозу, которая представляет собой предпочтительное полисахаридное производное.
Пригодные синтетические полимеры для матрицы, которая должна использоваться в настоящем изобретении, представляют собой полиолефины, такие как полиэтилен, полипропилен, полибутилен, полиметилпентен и сополимеры этилена и винилацетата; виниловые полимеры, такие как поливиниловый спирт, поливинилацетали и поливинилпирролидон; фторсодержащие полимеры, такие как политетрафторэтилен, сополимер фторированного этилена-пропилена, полихлорфторэтилен, поливинилфторид и поливинилиденфторид; полиакрилаты, такие как полиметилметакрилат, цианоакрилат, полиакрилонитрил и полиметакрилаты; полиамиды, такие как полиакриламид; полиимиды, такие как полиэтиленимины; полистирол и его сополимеры, такие как полистирол и полимеры акрилонитрила-бутадиен-стирола; силиконовые каучуки; сложные/простые полиэфиры; поликарбонаты; полиуретаны; полисульфонаты; полигликоли; полиалкиленоксиды, такие как полиэтиленоксид, полипропиленоксид; и их сополимеры или гибриды.
В предпочтительном воплощении в пористую структуру жесткой интегральной разделительной матрицы вводят, по меньшей мере, одну функциональную группу. Функциональные группы могут быть различных видов, то есть анионного, катионного или неионного типа. Функциональные группы пористой структуры используются для ковалентного связывания веществ, подобных пептидам/белкам и желчным кислотам (например, дезоксихолевой кислоты), антител и их фрагментов, а также других биологических молекул и веществ, обладающих способностью к селективному связыванию эндотоксинов и/или провоспалительных медиаторов.
Модификация поверхности, то есть функционализация поверхности опосредованным способом осуществляется посредством электроосаждения, электроиспарения, плазмостимулированного химического осаждения, осаждения из потока ионов плазмы или химического осаждения из паровой фазы (то есть плазмостимулированной полимеризации, плазмохимического поверхностного осаждения полимера). Способы модификации поверхности сами по себе известны и находятся в "Plasma surface modification and plasma polymerization" N. Inagaki, 1996, Technomic Publishing, Lancaster, USA. Различные трехмерные матричные структуры обрабатывают посредством этих способов, причем получают очень гомогенную модификацию активной поверхности.
Полимеризацию бифункциональных мономеров акрильных или аллильных двойных связей полярными группами, такими как OH, NH2, CN и COOH, используют для получения плазменных полимеров с высокой плотностью функциональных групп. Например, поверхностную функционализацию неорганических и органических поверхностей осуществляют в плазменной среде аллильных соединений, таких как аллиламин.
Это также является возможным для органических полимерных поверхностей в плазменных средах NH3, O2 или CO2, в которых образуются либо функциональные группы =NH, -NH2, =CN, -OH либо одинарная связь -COOH. Другие примеры используемых газов хорошо известны в данной области.
Плазмохимическую обработку также объединяют с классическим химическим синтезом, при этом селективность модификации поверхности для полимеров значительно повышается. Один из подходов заключается в применении функционализации поверхности конкретным газом в состоянии плазмы, после чего непосредственно следует химическая унификация сосуществующих с плазмой функциональных групп.
Другой способ введения функциональных групп осуществляют путем непосредственной функционализации, то есть нанесения на поверхность покрытия из полимерного материала. В этой связи синтетический или природный полимер наносят на металл, оксид неорганического соединения, углерод, стекло, керамику с высокой площадью поверхности, а также на другой пригодный для использования синтетический полимер и/или природный полимер, или их смеси.
Многие из указанных выше полимеров, в частности полимеры без функциональных групп, такие как полиэтилен, полипропилен, политетрафторэтилен и тому подобное, требуют дополнительной обработки для изменения их поверхностных свойств. Таким образом, обработка в плазме или коронном разряде поверхности полимера, как указано выше, будет генерировать одни и те же функциональные группы, подобные гидроксильным, карбонильным, карбоксильным, амино- и имино-группам и тому подобное, которые ковалентно присоединены к поверхности.
Нанесение также осуществляется посредством адгезии или адсорбции полимерного вещества, имеющего функциональные группы. Примерами таких веществ являются полилизин, полиаргинин и полиэтиленимин.
Путем использования, например, плазменной технологии получают на пористой поверхности вещества подобные полиэтиленимину. Когда разделительную матрицу используют в способе в соответствии с настоящим изобретением для селективного связывания и выделения, по меньшей мере, одного компонента из цельной крови или телесной жидкости, гидрофильные, а также гидрофобные участки белковых компонентов крови могут взаимодействовать с обработанной поверхностью для удаления желаемых компонентов. После функционализации, когда поверхность матрицы для селективного связывания и разделения содержит полиолефин, например полиэтилен или полипропилен, положительные заряды аминогрупп подобным же образом используются для электростатических взаимодействий, а гидрофобные участки используются для гидрофобных взаимодействий. Этот подход используют в способе по настоящему изобретению для селективного связывания различных областей соединений, например липополисахаридов.
Полимеры и металлы, имеющие, например, реакционноспособные гидроксилы, могут также быть функционилизированы посредством силанизации.
В соответствии с этим, разнообразные функциональные группы различных видов ковалентно связаны со структурой пористой матрицы с высокой площадью поверхности. После непосредственной и/или опосредованной функционализации пористая структура может иметь как гидрофильные, так и гидрофобные участки, которые могут взаимодействовать с различными компонентами крови. Таким образом, характерные свойства вещества, представляющего интерес, используются при подготовке поверхности, которая должна использоваться в способе в соответствии с настоящим изобретением.
Предпочтительно функциональные группы активной поверхности представляют собой сульфгидрилы, карбоксилаты, амины, альдегиды, кетоны, гидроксилы, галогены, гидразиды и активный водород.
В другом предпочтительном воплощении лиганд связан, по меньшей мере, с одной функциональной группой пористой структуры с высокой площадью поверхности ковалентным образом. В связи с этим лиганд представляет собой вещество с высоким сродством к компоненту, который должен удаляться из цельной крови или телесной жидкости. Таким образом, лиганд используется для повышения свойств адсорбции и эффективности связывания.
Лиганд может представлять собой белок, предпочтительно рекомбинантный белок, пептид, антитело или его фрагмент, углевод, например полисахарид, гормон, антиоксидант, гликопротеин, липопротеин, липид, жирорастворимый витамин, например витамин E, желчную кислоту, реакционноспособный краситель, аллантоин, мочевую кислоту или полимиксин, или их сочетания.
Соответствующая желчная кислота представляет собой дезоксихолевую кислоту, которая является эндогенным гидрофобным веществом. Такая желчная кислота может присоединяться либо непосредственно к функциональным группам посредством спейсера либо присоединяться через большую молекулу, а затем она используется для удаления эндотоксинов из крови, телесных жидкостей и водных растворов, как в способе в соответствии с настоящим изобретением.
В этой связи спейсер представляет собой молекулу, большую или малую, которая соединяет лиганд с поверхностью пористой структуры.
Например, если в способе по настоящему изобретению пористая структура разделительной матрицы содержит полиолефин, имеющий присоединенную аминовую группу, эта группа может иметь альбумин, присоединенный к ней, и, в свою очередь, по меньшей мере, один остаток желчной кислоты, соединенный с этой большой молекулой.
Таким образом, настоящее изобретение также относится к новому использованию остатка желчной кислоты, иммобилизованного на подложке, для устранения компонента из содержащего его водного раствора. Предпочтительно остаток желчной кислоты представляет собой остаток дезоксихолевой кислоты.
Соответственно твердая подложка, пригодная для иммобилизации остатка желчной кислоты, представляет собой жесткую интегральную разделительную матрицу, имеющую пористую структуру с размером пор в пределах от 5 микрон до 500 микрон, предпочтительно от 70 микрон до 170 микрон, и активную поверхность в пределах от 0,5 см2 до 10 м2.
Является также предпочтительным, чтобы лиганд матрицы в способе по настоящему изобретению представлял собой альбумин или альбумин, полученный посредством рекомбинантной технологии, который может использоваться вместо сывороточного альбумина, полимиксин B (то есть заряженные группы на гидрофобной структуре) или дезоксихолевую кислоту.
Таким образом, в способе по настоящему изобретению лиганд также может действовать в качестве спейсера. Например, является также возможным сначала ковалентное присоединение рекомбинантного белка человека или другой большой молекулы (например, гиалуроновой кислоты) к пористой структуре, что дает возможность для последующего связывания лиганда, специфичного к тому компоненту, который должен быть удален.
Если это необходимо, между одной, по меньшей мере, функциональной группой и лигандом ковалентным образом присоединяют кросслинкер. В связи с этим, кросслинкер представляет собой элемент, который ковалентно связывает лиганд с пористой структурой подложки, причем этот элемент является спейсером при связывании лиганда на некотором расстоянии от самой пористой структуры. Такие молекулярные спейсеры известны в данной области. Они вводятся для повышения сродства к компоненту, который должен связываться и выделяться из цельной крови или телесных жидкостей путем обеспечения лучшей доступности для лигандов. Биологическая совместимость поверхности структуры пористой матрицы также повышается путем введения этих молекулярных спейсеров.
Кросслинкер/спейсер может содержать кросслинкер нулевой длины сам по себе или в сочетании с промежуточным кросслинкером, при этом конечный полученный комплекс связывается вместе посредством химических веществ, которые добавляют структуры к поперечносшитому веществу. Эти промежуточные кросслинкеры могут быть типа гомобифункционального (например, диальдегиды), гетеробифункционального (например, аминокислоты) или трифункционального типа поперечной сшивки.
Главной задачей спейсера является повышение биологической доступности конкретного используемого лиганда.
Спейсер может представлять собой, например, силан, диизоцианат, гликолят, полиэтиленгликоль, сукцинимидиловый реагент, дигидразин, адипиновую кислоту, диамин, аминокислоту, поли- или олигоаминокислоту, полиаминокислоту, пептид или белок. Предпочтительно белок представляет собой рекомбинантный белок человека.
Функциональные группы кросслинкера предназначены для взаимодействия с аминогруппами (Lys, Arg), с сульфгидрилами (Cys) или с карбоксилами (Asp, Glu) и так далее.
В связи с химией реакционноспособных групп можно упомянуть Bioconjugate Techniques, Greg T. Hermanson, Academic Press, USA 1996.
Таким образом, активная поверхность пористой матрицы в способе по настоящему изобретению является способной к удалению, например, эндотоксинов, сама по себе или в сочетании с нефункционилизованными участками доступной поверхности пористой структуры. Активная поверхность также может использоваться в качестве инструмента для ковалентной иммобилизации реагентов, таких как биологические молекулы, подобные аминокислотам, полипетиды и антитела, для селективного улучшения устранения таких конкретных компонентов.
Разделительная матрица, которая предназначается для селективного удаления, по меньшей мере, одного компонента из цельной крови или телесных жидкостей, может быть получена с помощью пористой структуры с определенным размером пор и/или с определенным диапазоном размеров пор в зависимости от предполагаемого применения. Предпочтительно пористая структура должна давать возможность для прохождения клеток крови. Соответственно определенные типы клеток крови также могут удаляться из цельной крови посредством способа по настоящему изобретению. Такие клетки представляют собой больные клетки или клетки со специфическими поверхностными рецепторами, например активированные фагоцитирующие клетки.
Металлическая структура может для особых применений быть магнитной. Магнитная матрица может, например, получаться путем нанесения на спеченный магнетит покрытия из полимера, например полиэтилена. Затем может осуществляться эффективное удаление клеток, давая возможность антителам, имеющим магнитную метку из железа в декстране, прикрепляться к конкретным клеткам в крови.
Размер пор должен находиться в пределах от 5 микрон до 500 микрон, предпочтительно от 70 микрон до 170 микрон, наиболее предпочтительно от 80 микрон до 100 микрон, так чтобы высокие скорости потока могли поддерживаться без повреждения клеток или вытеснения клеток. Таким образом, разделение, которое осуществляют с помощью способа в соответствии с настоящим изобретением, не основывается на каком-либо распределении компонентов по размерам. Практически все компоненты цельной крови или телесной жидкости могут быть устранены посредством способа по настоящему изобретению.
После удаления одного или нескольких первичных токсичных эффекторов, то есть эндотоксинов, могут быть удалены дополнительные вторичные токсичные эффекторы. Вторичные эффекторы могут представлять собой цитокины (например, TNF- ), интерлейкины (например, Il-l), реакционноспособные радикалы кислорода и азота и тому подобное. ), интерлейкины (например, Il-l), реакционноспособные радикалы кислорода и азота и тому подобное.
Когда осуществляют способ в соответствии с настоящим изобретением, одну или несколько разделительных матриц заключают в корпус, который может иметь различные формы и изменяющиеся и/или различные входы и выходы в зависимости от применения. Затем такое устройство может использоваться для удаления эндотоксина и/или удаления цитокинов, и/или нейтрализации цитокинов. Это осуществляют путем прохождения крови или других телесных жидкостей через устройство, применяемое интра-, пара- или экстракорпорально, без вытеснения жидкости из находящейся в нем жесткой интегральной разделительной матрицы. Затем активная поверхность пористой структуры, функциональные группы и/или конкретные лиганды на ней селективно связывают и выделяют, по меньшей мере, один компонент из жидкости. Устройство также может преимущественно использоваться для удаления эндотоксинов из водных растворов.
Важной особенностью настоящего способа является то, что могут быть предусмотрены все аспекты септического шока, то есть первичные, а также вторичные токсичные эффекторы могут удаляться посредством способа по настоящему изобретению.
Обратимся к фиг.1 в связи с осуществлением способа в соответствии с настоящим изобретением. Устройство 1 содержит корпус 2, причем корпус (или картридж) устройства интегрирован в замкнутую систему циркуляции, в которой цельная кровь или телесные жидкости циркулируют посредством насоса. В корпусе 2 расположена, по меньшей мере, одна из разделительных матриц 5a, 5b,..., каждая из которых предназначена для селективного удаления одного из компонентов из цельной крови или телесных жидкостей. Корпус 2 снабжают входом 3 и выходом 4, положения которых не являются важными постольку, поскольку получается адекватный поток в разделительной матрице (матрицах) и корпусе. Предпочтительно насос располагается перед входом 3.
Таким образом, получают устройство, которое может поддерживать скорости потока от 5 мл/час до 6000 мл/мин без значительных перепадов давления. Когда его применяют экстракорпорально, получают давление в линии не больше чем 300 мм рт.ст. от насоса до канюли, даже при очень высоких скоростях потока.
Жесткая интегральная разделительная матрица для использования в способе по настоящему изобретению может быть произведена в различных формах. Например, она может быть сконструирована в виде диска, стержня, цилиндра, кольца, сферы, трубки, полой трубки, плоского листа или другой формованной формы.
Поскольку поток в каждой разделительной матрице зависит от ее пористости, время контакта компонентов в крови или телесной жидкости с активной поверхностью может контролироваться. Кроме того, желаемый градиент потока может создаваться в разделительном устройстве путем изменения пористости и конфигурации индивидуальных разделительных матриц в ней.
На фиг.2 и 3 изображены различные схематические воплощения устройств, которые могут быть использованы, когда осуществляется способ в соответствии с настоящим изобретением. Стрелки показывают поток крови или телесной жидкости в индивидуальных разделительных матрицах и их корпусах, стрелки большего размера указывают на более высокую скорость потока, чем малые стрелки. В этих примерах различных конфигураций разделительные матрицы могут иметь или одинаковую или различную пористость с одними и теми же или различными типами функциональных групп или лигандов для удаления одного или нескольких компонентов из крови или телесной жидкости, или без них.
Разделительные матрицы предпочтительно составляют единое целое с корпусами (каждый имеет вход 3 и выход 4) для предотвращения того, что какая-либо жидкость или компоненты в ней не могут поступать в матрицу или матрицы, то есть исключаются из нее. На фиг.2(a) и (b) приведены примеры разделительной матрицы 5 внутри корпуса 2, при этом матрица имеет различные конфигурации. Примеры двух разделительных матриц 5a, 5b внутри корпуса 2 изображены на фиг.2 (c) и (d). В устройстве на фиг.2(c) непроницаемое покрытие 6, такое как нанесенная пленка, на наружной периферии разделительной матрицы 5a обеспечивает то, что весь материал, поступивший в устройство, будет проходить через всю матрицу. В устройстве на фиг.2(d), с другой стороны, некоторая часть поступающего материала будет иметь более короткое время пребывания в разделительной матрице 5a, чем в разделительной матрице 5b, и наоборот.
На фиг.3 каждое устройство содержит несколько разделительных матриц 5a-5g. На фиг.3(a) разделительная стенка 7 обеспечивает поток через все матрицы. Разделительные матрицы могут располагаться продольным или поперечным образом по отношению к их продольным направлениям, как на фиг.3(b) и (c) соответственно. На фиг.3(d) устройство содержит разделительные матрицы различных размеров.
В итоге способ по настоящему изобретению может быть использован вместе с устройством, применяемым интра-, пара- или экстракорпорально, или вместе с отдельно расположенным устройством, которое при этом является способным к уменьшению количества циркулирующих эндотоксинов и потенциально вредных провоспалительных медиаторов, в частности TNF- , IL-1 и IL-17, предпочтительно в крови. Является также возможным селективное удаление эндотоксинов из других водных растворов. Компоненты, как считают, связываются с активной поверхностью жесткой интегральной разделительной матрицы посредством адгезии. , IL-1 и IL-17, предпочтительно в крови. Является также возможным селективное удаление эндотоксинов из других водных растворов. Компоненты, как считают, связываются с активной поверхностью жесткой интегральной разделительной матрицы посредством адгезии.
ПРИМЕРЫ
Настоящее изобретение теперь будет дополнительно описываться и иллюстрироваться путем ссылок на следующие далее примеры, которые были тщательно отобраны для того, чтобы они охватывали настоящее изобретение. Соответственно они не должны рассматриваться как ограничивающие настоящее изобретение каким-либо образом.
Способы модификации поверхности
Пример 1
Поверхность матрицы из пористого полиэтилена (Porex Technologies, Germany), имеющего пористость 350 микрон и активную поверхность 10 см2, модифицируют посредством плазмостимулированного химического осаждения из паровой фазы с использованием O2 (Plasma Science, USA, Type PS 0350 Plasma Surface Treatment System).
Формирование гидроксильных групп на поверхности пористой структуры полученной матрицы анализируют с помощью исследования с использованием красителя, при этом ее гидрофильность подтверждается.
Пример 2
Поверхность матрицы из пористого полиэтилена (Porex Technologies, Germany), имеющего пористость 100 микрон и активную поверхность 20 см2, модифицируют посредством плазмостимулированного химического осаждения из паровой фазы с использованием CO2 (Plasma Science, USA, Type PS 0350 Plasma Surface Treatment System).
Формирование карбоксильных групп и их количество на поверхности пористой структуры полученной матрицы определяют путем преобразования в гидроксамовые кислоты. В этой связи все гидроксамовые кислоты дают красный или фиолетовый цвет с хлоридом железа (III) в кислотном растворе, как описывается в Feigel et al.; Microchemie 15:18, 1934.
Пример 3
Поверхность матрицы из пористого полиэтилена (Porex Technologies, Germany), имеющего пористость 170 микрон и активную поверхность 0,04 м2, модифицируют посредством плазмостимулированной полимеризации с использованием аллиламина (Plasma Science, USA, Type PS 0350 Plasma Surface Treatment System).
Количество первичных аминов на поверхности пористой структуры полученной матрицы определяют посредством анализа с использованием тринитробензолсульфоновой кислоты (TNBS).
Пример 4
Поверхность матрицы из пористого полиэтилена (Porex Technologies, Germany), имеющего пористость 70 микрон и активную поверхность 0,26 м2, модифицируют посредством плазмостимулированной полимеризации с использованием акриловой кислоты (Plasma Science, USA, Type PS 0350 Plasma Science Treatment System).
Количество карбоксильных групп на поверхности пористой структуры полученной матрицы анализируют, как описывается в примере 2.
Пример 5
Поверхность матрицы из пористого полиэтилена (Porex Technologies, Germany), имеющего пористость 5 микрон и активную поверхность 0,9 м2, модифицируют посредством плазмостимулированной полимеризации с использованием NH3 (Plasma Science, USA, Type PS 0350 Plasma Surface Treatment System).
Количество первичных аминов на поверхности пористой структуры полученной матрицы анализируют, как описывается в примере 3.
Пример 6
Поверхность матрицы из пористого политетрафторэтилена, PTFE (W.L. Gore & Associates Inc., USA), имеющего пористость 10 микрон и активную поверхность 100 см2, модифицируют посредством плазмостимулированного химического осаждения из паровой фазы с использованием NH3 (Plasma Science, USA, Type PS 0350 Plasma Surface Treatment System).
Количество первичных аминов на поверхности пористой структуры полученной матрицы анализируют, как описывается в примере 3.
Пример 7
Поверхность матрицы из пористого полистирола (Dow Chemical, USA), имеющего пористость 10 микрон и активную поверхность 300 см2, модифицируют посредством плазмостимулированного химического осаждения из паровой фазы с использованием CO2 (Plasma Science, USA, Type PS 0350 Plasma Surface Treatment System).
Количество карбоксильных групп на поверхности пористой структуры полученной матрицы анализируют, как описывается в примере 2.
Пример 8
Поверхность матрицы из пористого полиуретана (Polymers Unlimited, Sweden), имеющего пористость 80 микрон и активную поверхность 100 см2, модифицируют посредством 2% раствора Aldehydic Alkoxy Silane, Art No. (PSX 1050, United Chemical Technologies Inc., USA) в 95% этаноле. pH раствора доводится до pH 5,5 с помощью уксусной кислоты и раствор заливают в матрицу, которую инкубируют в течение ночи при комнатной температуре, а затем промывают 0,9% физиологическим солевым раствором.
Функциональную группу альдегида полученной матрицы оценивают путем использования каталитического ускорения окисления п-фенилендиамина с помощью перекиси водорода, п-фенилендиамин окисляется под действием перекиси водорода в кислотном растворе, который известен как основание Бандровского.
Пример 9
Поверхность матрицы из пористого силикона (Nusil, France), имеющего пористость 200 микрон и активную поверхность 0,5 м2, модифицируют посредством 2% раствора Amine-Silane (Art No. 0750, United Chemical Technologies Inc., USA) в 95% этаноле. Раствор заливают в матрицу, которую инкубируют в течение ночи при комнатной температуре и, наконец, промывают 0,9% физиологическим солевым раствором.
Количество первичных аминов на поверхности пористой структуры полученной матрицы анализируют, как описывается в примере 3.
Нанесение покрытия посредством ковалентного связывания
Пример 10
Poly-Lysine (полилизин) (200 мг) растворяют в 10 мл 50 мМ раствора карбоната натрия, а затем матрицу из пористого поликарбоната с пористостью 100 микрон (MicroPore Plastics, USA) погружают в раствор и поддерживают при 4°C в течение 24 часов для получения ковалентного связывания между полилизином и поликарбонатной матрицей. Наконец, пористую матрицу промывают избытком дистиллированной воды.
Количество первичных аминов на поверхности пористой структуры полученной матрицы анализируют, как описывается в примере 3.
Пример 11
Пористую полиэтиленовую матрицу, полученную в соответствии с примером 4, заливают водным раствором 1-циклогексил-3-(2-морфолиноэтил)карбодиимид-мета-п-толуолсульфоната (WCCM) (Aldrich) при скорости потока 5 мл/мин в замкнутом контуре при комнатной температуре в течение 6 часов. Затем ее промывают водой и, наконец, добавляют раствор полиэтиленимина (Sigma) (10 мг/мл, pH 7,0) и матрицу инкубируют в течение ночи.
Количество первичных аминов на поверхности пористой структуры полученной матрицы анализируют, как описывается в примере 3.
Пример 12
Пористую полиэтиленовую матрицу, полученную в соответствии с примером 3, конъюгируют с использованием 1,0% глутарового диальдегида в 0,2 M фосфатном буфере, pH 7,5, и заливают со скоростью потока 1 мл/мин в течение 6 часов при комнатной температуре. Затем матрицу промывают буфером перед инкубированием с раствором гиалуроновой кислоты (2 мг/мл) в течение 16 часов при комнатной температуре. Наконец, избыток гиалуроновой кислоты отмывают.
Содержание гиалуроновой кислоты на поверхности пористой структуры полученной матрицы проверяют и определяют с помощью Alcian Blue (Sigma).
Нанесение покрытия посредством адгезии
Пример 13
Матрицу из пористого полиэтилена (Porex Technologies, Germany), имеющего пористость 70 микрон и активную поверхность 0,18 м2, заливают при скорости потока 1 мл/мин в замкнутом контуре в течение 16 часов при комнатной температуре 2 мг/мл раствором гиалуроновой кислоты (BioHyos, Sweden, 12-106 Да) при pH, равном 3,3, которую устанавливают с помощью 0,1 M HCl.
Содержание гиалуроновой кислоты на поверхности пористой структуры полученной матрицы проверяют как в примере 12.
Пример 14
Матрицу из пористого полиэтилена (Porex Technologies, Germany), имеющего пористость 70 микрон и активную поверхность 7,0 м2, помещают в стеклянную пробирку. Пробирку с пористой матрицей внутри заполняют раствором 0,13% полилизина Poly-lysine (Sigma) в 350 мл воды и pH доводят до pH 3,3 с помощью 0,1 M HCl. Затем раствор полилизина рециркулируют через пробирку с ее фильтрующей матрицей в течение 16 часов при комнатной температуре при скорости потока <5 мл/мин. Наконец пористую матрицу промывают водой, очищенной с помощью обратного осмоса.
Количество первичных аминов на поверхности пористой структуры полученной матрицы анализируют, как описывается в примере 3.
Пример 15
Матрицу из пористого полиэтилена (Porex Technologies, Germany), имеющего пористость 70 микрон и активную поверхность 3,4 м2, помещают в стеклянную пробирку. Пробирку с пористой матрицей внутри заполняют раствором 0,2% Recombumin (рекомбинантный сывороточный альбумин человека, Hoechst-Pharma, USA) в 350 мл воды, очищенной с помощью обратного осмоса, а затем доводят до pH 3,3 с помощью 0,1 M HC1. (рекомбинантный сывороточный альбумин человека, Hoechst-Pharma, USA) в 350 мл воды, очищенной с помощью обратного осмоса, а затем доводят до pH 3,3 с помощью 0,1 M HC1.
Затем раствор Recombumin рециркулируют через пробирку с ее фильтрующей матрицей в течение 16 часов, при комнатной температуре с использованием насоса, при скорости потока <5 мл/мин. Наконец пористую матрицу промывают водой, очищенной с помощью обратного осмоса. рециркулируют через пробирку с ее фильтрующей матрицей в течение 16 часов, при комнатной температуре с использованием насоса, при скорости потока <5 мл/мин. Наконец пористую матрицу промывают водой, очищенной с помощью обратного осмоса.
Содержание белка на поверхности пористой структуры полученной матрицы определяют с использованием Coomassie Brilliant Blue (BioRad, USA).
Пример 16
Пористую полиэтиленовую матрицу, полученную в соответствии с примером 4, заливают раствором полиэтиленимина (Sigma), 10 мг/мл, в течение ночи, при скорости потока 5 мл/мин, в замкнутом контуре. Затем пористую матрицу промывают водой.
Количество первичных аминов на поверхности пористой структуры полученной матрицы анализируют, как описывается в примере 3.
Непосредственное конъюгирование лигандов
Пример 17
Пористую полиэтиленовую матрицу, полученную в соответствии с примером 5, конъюгируют дезоксихолатом (DOC) путем использования водного раствора WCCM. Раствор из 300 мл 40% диметилформамида (DMF) (Sigma) в воде, который содержит 1 ммоль дезоксихолата натрия, добавляют к пористому поликарбонату при перемешивании, при этом доводят pH с помощью 0,3 M HCl до pH 4,8. Затем раствор 6 мМ WCCM в DMF:воде (1:1,8) добавляют в течение 10 минут. Суспензию выдерживают при pH 4,8 в течение 3 часов путем добавления 0,3 M HCl.
Содержание DOC на поверхности пористой структуры полученной матрицы определяют путем использования набора Bile Acid Kit (Sigma).
Пример 18
Пористую полиэтиленовую матрицу, полученную в соответствии с примером 3, конъюгируют с использованием 12% глутарового диальдегида в 0,15 M фосфатном буфере, pH 7,0, в течение 24 часов, при комнатной температуре. Матрицу промывают 0,15 M фосфатным буфером, а затем добавляют антитела против CD14 (DAKO, Denmark) при концентрации 1 мг/мл и инкубируют при 8°C в течение 24 часов. Следующее далее восстановление цианоборгидридом натрия осуществляют для получения стабильных связей вторичных аминов.
Содержание антител на поверхности пористой структуры полученной матрицы определяют опосредованно, посредством УФ-спектроскопии буферного раствора антител, до и после инкубирования с пористой матрицей.
Пример 19
Пористую полиэтиленовую матрицу, полученную в соответствии с примером 8, промывают 0,15 M фосфатным буфером, а затем добавляют рекомбинантный рецептор IL-1 (Kineret, Amgen, USA) при концентрации 1 мг/мл и инкубируют при 8°C, в течение 24 часов. Следующее далее восстановление цианоборгидридом натрия осуществляют для получения стабильных связей вторичных аминов.
Содержание рецепторов IL-1 на поверхности пористой структуры полученной матрицы определяют опосредованно посредством УФ-спектроскопии буферного раствора рецепторов IL-1 до и после инкубирования вместе с пористой матрицей.
Пример 20
Пористую полиэтиленовую матрицу, полученную в соответствии с примером 5, конъюгируют с использованием 1,0% глутарового диальдегида и 0,2 M фосфатного буфера, pH 7,5. Матрицу инкубируют с этим раствором в течение 3 часов. После промывки фосфатным буфером матрицу инкубируют в растворе сульфата Polymyxin B (Sigma), 1 мг/мл, в течение ночи, при рециркулировании. Наконец матрицу промывают 0,1 M фосфатным буфером, pH 7,4.
Пример 21
Пористую полиэтиленовую матрицу, полученную в соответствии с примером 2, конъюгируют рекомбинантным рецептором TNF- (Enbrel, Wyeth, UK) при концентрации 5 мг/мл, в 0,1 M буфере с 2-(N-морфолино)этансульфоновой кислотой (MES) (Sigma), pH 4,8. Добавляют тридцать мг/мл водного раствора WCCM, и матрицу инкубируют в течение ночи, при 8°C. Наконец матрицу промывают 0,1 M фосфатным буфером, pH 7,4. (Enbrel, Wyeth, UK) при концентрации 5 мг/мл, в 0,1 M буфере с 2-(N-морфолино)этансульфоновой кислотой (MES) (Sigma), pH 4,8. Добавляют тридцать мг/мл водного раствора WCCM, и матрицу инкубируют в течение ночи, при 8°C. Наконец матрицу промывают 0,1 M фосфатным буфером, pH 7,4.
Содержание рецептора TNF- на поверхности пористой структуры полученной матрицы определяют опосредованно, посредством УФ-спектроскопии буферного раствора рецептора TNF- на поверхности пористой структуры полученной матрицы определяют опосредованно, посредством УФ-спектроскопии буферного раствора рецептора TNF- , до и после инкубирования с пористой матрицей. , до и после инкубирования с пористой матрицей.
Пример 22
Пористую полиэтиленовую матрицу, полученную в соответствии с примером 3, конъюгируют с антителом против TNF- человека (Sigma) с использованием 1,0% глутарового диальдегида в 0,2 M фосфатном буфере, pH 7,5. Матрицу инкубируют вместе с буферным раствором с антителом к TNF- человека (Sigma) с использованием 1,0% глутарового диальдегида в 0,2 M фосфатном буфере, pH 7,5. Матрицу инкубируют вместе с буферным раствором с антителом к TNF- в течение 3 часов. После промывки пористой матрицы фосфатным буфером добавляют антитело против TNF- в течение 3 часов. После промывки пористой матрицы фосфатным буфером добавляют антитело против TNF- человека (1 мг/мл) в фосфатном буфере и инкубируют при комнатной температуре в течение 6 часов, при рециркулировании, при скорости потока 1 мл/мин. Наконец матрицу промывают 0,1 M фосфатным буфером, pH 7,4. человека (1 мг/мл) в фосфатном буфере и инкубируют при комнатной температуре в течение 6 часов, при рециркулировании, при скорости потока 1 мл/мин. Наконец матрицу промывают 0,1 M фосфатным буфером, pH 7,4.
Содержание антитела TNF- на поверхности пористой структуры полученной матрицы определяют опосредованно, посредством УФ-спектроскопии буферного раствора антитела TNF- на поверхности пористой структуры полученной матрицы определяют опосредованно, посредством УФ-спектроскопии буферного раствора антитела TNF- , до и после инкубирования с пористой матрицей. , до и после инкубирования с пористой матрицей.
Пример 23
Пористую полиэтиленовую матрицу, полученную в соответствии с примером 5, конъюгируют с белком человека, усиливающим бактерицидную проницаемость (BPI) (Wieslab, Sweden), при концентрации 2 мг/мл, в 0,1 M буфере MES, pH 4,8. К этой матрице добавляют водный раствор WCCM при концентрации 15 мг/мл, и матрицу инкубируют в течение ночи при 8°C. Наконец матрицу промывают 0,1 M фосфатным буфером, pH 7,4.
Содержание BPI на поверхности пористой структуры полученной матрицы определяют опосредованно, посредством УФ-спектроскопии буферного раствора BPI, до и после инкубирования с пористой матрицей.
Пример 24
Пористую полиэтиленовую матрицу, полученную в соответствии с примером 15, инкубируют в растворе DOC, в 0,1 M буфере MES, pH 4,8, при концентрации 1 мг/мл. Затем добавляют водный раствор WCCM, и матрицу инкубируют в течение ночи при 8°C. Наконец матрицу промывают 0,1 M фосфатным буфером, pH 7,4.
Содержание DOC на поверхности пористой структуры полученной матрицы определяют, как в примере 17.
Конъюгирование лигандов со спейсером
Пример 25
Пористую полиэтиленовую матрицу получают в соответствии с примером 3 и активируют 1,2% глутаровым диальдегидом в 0,2 M фосфатном буфере, pH 7,0, в течение 24 часов при комнатной температуре. Матрицу промывают буфером, а затем инкубируют в течение 24 часов в 1,6-диаминогексане (DAH) (Sigma), 50 мг/мл, в 0,2 M фосфатном буфере, pH 7,0. После этого к раствору добавляют 10 мг/мл цианоборгидрида натрия (Sigma). Пористую матрицу промывают 0,1 M фосфатным буфером, а затем инкубируют в растворе DOC (1 мг/мл), в 0,1 M буфере MES, pH 4,8. Затем добавляют водный раствор WCCM и матрицу инкубируют в течение ночи при 8°C. Наконец матрицу промывают 0,1 M фосфатным буфером, pH 7,4.
Содержание DOC на поверхности пористой структуры полученной матрицы определяют как в примере 17.
Пример 26
Пористую полиэтиленовую матрицу, полученную в соответствии с примером 5, активируют в течение 24 часов, при комнатной температуре 1,2% глутаровым диальдегидом в 0,2 M фосфатном буфере, pH 7,0. Матрицу промывают буфером, а затем инкубируют в течение 24 часов с дигидразидом адипиновой кислоты (Aldrich) при концентрации 10 мг/мл, в 0,2 M фосфатном буфере, pH 7,4. Затем в раствор добавляют 10 мг/мл цианоборгидрида натрия (Sigma).
Пористую матрицу промывают 0,1 M фосфатным буфером, а затем инкубируют с раствором DOC, при концентрации 1 мг/мл, в 0,1 M буфере MES, pH 4,8. Затем добавляют водный раствор WCCM и матрицу инкубируют в течение ночи при 8°C. Наконец матрицу промывают 0,1 M фосфатным буфером, pH 7,4.
Содержание DOC на поверхности пористой структуры полученной матрицы определяют как в примере 17.
Пример 27
Матрицу, полученную в соответствии с примером 10, конъюгируют с DOC путем использования водного раствора WCCM. Водный раствор 300 мл 40% DMF (Sigma), содержащий 1 ммоль дезоксихолата натрия, добавляют к пористой поликарбонатной матрице при перемешивании. pH суспензии доводят до 4,8 с помощью 0,3 M HCl. Добавляют 6 мМ раствор WCCM в DMF:воде (1:1,8), в течение 10 минут, и суспензию выдерживают при pH 4,8, в течение 3 часов путем периодического добавления 0,3 M HCl. Затем ее выдерживают при комнатной температуре в течение 24 часов.
Содержание DOC на поверхности пористой структуры полученной матрицы определяют как в примере 17.
Пример 28
Матрицу, полученную в соответствии с примером 14, активируют в течение 10 часов при комнатной температуре 1,2% глутаровым диальдегидом в 0,2 M фосфатном буфере, pH 7,0, а затем промывают избыточными количествами буфера. Полиэтиленимин (Sigma) при концентрации 10 мг/мл в 0,1 M бикарбонатном буфере, pH 8,0, вводят в пористую матрицу, и матрицу инкубируют раствором в течение 16 часов.
Затем матрицу промывают буфером и конъюгируют с DOC с использованием водного раствора WCCM. Раствор 300 мл 40% DMF в воде, содержащий 1 ммоль дезоксихолата натрия, добавляют к пористой матрице при перемешивании. pH доводят до 4,8 с помощью 0,3 M HCl. Затем добавляют 6 мМ раствор WCCM в DMF:воде (1:1,8) в течение 10 минут. Суспензию выдерживают при pH 4,8 в течение 3 часов путем периодического добавления 0,3 M HCl. Затем ее выдерживают при комнатной температуре в течение 24 часов.
Содержание DOC на поверхности пористой структуры полученной матрицы определяют как в примере 17.
Пример 29
Пористую полиэтиленовую матрицу, полученную в соответствии с примером 3, активируют в течение 24 часов при комнатной температуре 1,2% глутаровым диальдегидом в 0,2 M фосфатном буфере, pH 7,0. Затем матрицу промывают буфером и инкубируют в течение 24 часов с 1,6-диаминогексаном (DAH) (Sigma) при концентрации 50 мг/мл в 0,2 M фосфатном буфере, pH 7,0. Затем пористую матрицу промывают 0,1 M фосфатным буфером и инкубируют в течение 12 часов при 8°C в виде суспензии в растворе рецептора TNF- (Enbrel, Wyeth, UK) с концентрацией 10 мг/мл, в 0,1 M фосфатном буфере, pH 7,4. Затем к суспензии добавляют раствор цианоборгидрида натрия (Sigma) при концентрации 10 мг/мл. Наконец матрицу промывают 0,1 M фосфатным буфером, pH 7,4. (Enbrel, Wyeth, UK) с концентрацией 10 мг/мл, в 0,1 M фосфатном буфере, pH 7,4. Затем к суспензии добавляют раствор цианоборгидрида натрия (Sigma) при концентрации 10 мг/мл. Наконец матрицу промывают 0,1 M фосфатным буфером, pH 7,4.
Содержание рецептора TNF- на поверхности пористой структуры полученной матрицы определяют опосредованно, посредством УФ-спектроскопии буферного раствора рецептора TNF- на поверхности пористой структуры полученной матрицы определяют опосредованно, посредством УФ-спектроскопии буферного раствора рецептора TNF- до и после инкубирования с пористой матрицей. до и после инкубирования с пористой матрицей.
Селективное связывание и разделение компонентов крови
Разделение клеток осуществляют, давая возможность цельной крови проходить через фильтр из матрицы, имеющей форму диска и имеющей активную поверхность 0,02 м2.
Удаление эндотоксинов и цитокинов осуществляют с помощью исследовательской системы, изображенной на фиг.4. Контейнер 8, заполненный цельной кровью или плазмой в объеме вплоть до 2 л, соединяют с насосом 9, монитором давления 10 и фильтрующим устройством 1, содержащим до 40 пластинок матрицы, то есть обеспечивается активная поверхность до 7 м2, имеющая пористость, находящуюся в пределах между 70 и 130 микронами.
Разделение клеток
Пример 30
Пористую магнитную матрицу, содержащую смесь полиэтилена и магнитного феррита (80% FeO, 20% BaO2, Porex Technologies, Germany), которая имеет пористость 100 микрон, используют для выделения лейкоцитов из цельной крови путем использования специфично меченых антител против CD45+ (MACS Antibody Microbeads; Miltenyi Biotec, Germany). После магнитного мечения лейкоцитов такими антителами крови дают возможность для прохождения через пористую матрицу.
Счет клеток лейкоцитов осуществляют путем использования автоматического цитометра, который после проведения разделения показывает уменьшение содержания лейкоцитов в крови на 90%.
Пример 31
Поверхность матрицы из пористой диацетат целлюлозы (Tenite, Eastman Chemicals, USA), имеющей пористость 200 микрон и активную поверхность 0,2 м2, используют для выделения фагоцитирующих клеток крови человека в качестве нейтрофилов и моноцитов. Цельную кровь человека собирают в пробирках EDTA vacutainer (B&D, UK) и крови дают возможность для прохождения через пористую матрицу.
Уменьшение количество нейтрофилов и моноцитов в собранной крови составляет 50% и 35% соответственно, что определяется микроскопически путем дифференциального подсчета клеток в гемоцитометре Бюркнера, путем использования Turks Reagent.
Удаление цитокинов
Пример 32
Матрицу, полученную в соответствии с примером 22, которая имеет покрытие с группами для удаления эндотоксинов, используют в виде пористых дисков в исследовательской системе, изображенной на фиг.4.
Устранение TNF- из цельной крови исследуют после иммобилизации поликлональных антител против TNF- из цельной крови исследуют после иммобилизации поликлональных антител против TNF- на аминогруппах на пористой полимерной структуре с помощью глутарового диальдегида. Выработку TNF- на аминогруппах на пористой полимерной структуре с помощью глутарового диальдегида. Выработку TNF- индуцируют путем добавления в кровь LPS, и активированную цельную кровь заливают на иммобилизованный фильтр в устройстве. индуцируют путем добавления в кровь LPS, и активированную цельную кровь заливают на иммобилизованный фильтр в устройстве.
Количества TNF- в цельной крови (фиг.5) определяют до ( в цельной крови (фиг.5) определяют до ( ) и после ( ) и после ( ) иммуноферментного анализа (Enzymimmuno-assay, Milenia Biotec GmbH, Germany) в устройстве для исследования поглощения TNF- ) иммуноферментного анализа (Enzymimmuno-assay, Milenia Biotec GmbH, Germany) в устройстве для исследования поглощения TNF- фильтрующими дисками. Как видно, может быть получено значительное понижение патологических концентраций TNF- фильтрующими дисками. Как видно, может быть получено значительное понижение патологических концентраций TNF- в цельной крови. в цельной крови.
Удаление эндотоксинов
Пример 33
Матрица, полученная в соответствии с примером 25, то есть модифицированная с помощью плазмы полиэтиленовая матрица имеет на себе DOC, иммобилизованный на ней посредством спейсера из диаминогексана, который сначала связывают с матрицей посредством глутарового диальдегида, а затем с дезоксихолатом с использованием карбодиимида. Полученную матрицу используют в виде пористых дисков в фильтрующем устройстве системы, изображенной на фиг.4.
Устранение LPS из плазмы осуществляется способом, подобным примеру 32.
Количество LPS в плазме определяют посредством средств Limulus Amebocyte Lysate assay (Endochrome-K, Charles River Laboratories Inc. USA) в объеме через различные интервалы времени, во время рециркулирования через фильтрующее устройство.
На фиг.6 изображено уменьшение количества эндотоксина (пг/мл) со временем. После рециркулирования в течение 2 часов нагрузка эндотоксина уменьшается от 75 пг/мл в начале до 15 пг/мл, что представляет собой предел детектирования.
Пример 34
Матрицы, полученные в соответствии с примером 3 (неиммобилизованные аминогруппы) и примером 17 (иммобилизованный DOC), соответственно используют в виде пористых дисков и сравнивают в отношении их способности к устранению LPS. Исследования с рециркулированием, подобные примеру 33, осуществляют с тем различием, что LPS растворяют в дистиллированной воде.
Устранение LPS из водного раствора определяют как показано на фиг.4, при рециркулировании со скоростью потока 0,22 мл/мин по 10 мл через каждый фильтр в устройстве.
В таблице 1 ниже значения для устранения LPS с помощью двух матриц из примера 3 и примера 17 соответственно приводят как процент от начальной концентрации LPS после рециркулирования в течение 120 мин.
| Таблица 1 |
| |
Пример 3 |
Пример 17 |
| Устранение LPS (%) |
81 |
96 |
Различия в степени устранения между плазмой (пример 34) и водой (пример 35) могут объясняться конкурентными взаимодействиями белков, LPS и лиганда.
Комбинированное удаление
Пример 35
Матрицы, полученные в соответствии с примером 19 и примером 29, используют для комбинированного удаления TNF- и IL-1 соответственно. и IL-1 соответственно.
Две матрицы с различной специфичностью объединяют последовательно в тестовую систему из двух фильтрующих устройств типа замкнутой петли, как показано на фиг.4. Цельную кровь в контейнере, выдерживаемом при 37°C, активируют путем добавления LPS и вводят в систему. Отбор образцов для анализа цитокинов осуществляют через различные интервалы времени одновременно из выходов контейнера и фильтра.
Результаты демонстрируют понижение концентраций цитокинов для обеих матриц на 70% и 55% для TNF- и IL- и IL- соответственно. соответственно.
Таблица 2 ниже демонстрирует сводку многосторонней применимости и значительной эффективности способа по настоящему изобретению для селективного связывания и выделения различных компонентов из цельной крови или телесной жидкости. Для этой цели различные пористые матрицы используют в качестве подложек для присоединения лигандов либо со спейсером либо без него. Таким образом, способы иммобилизации осуществляют с глутаровым диальдегидом, используя две конечных группы -NH2, и с 1-этил-3-(3-диметиламинопропил)карбодиимидом, с одной конечной группой -NH2 и одной конечной группой -OH или -COOH соответственно. Также используется силанизация посредством связывающих реагентов на основе альдегида или аминофункциональных силанов для специфичного связывания аминогрупп, антител, ферментов, пептидов, белков, причем альдегидные группы спонтанно взаимодействуют с аминами, пептидами и белками.
| Таблица 2 |
| Пористая матрица |
Способ |
Спейсер |
Лиганд |
Компонент |
Эффективность |
| Полиэтилен |
- |
HA |
DOC |
LPS |
80,1 |
| Полиэтилен |
- |
Poly-Lys |
DOC |
LPS |
12,8 |
| Полиэтилен |
-NH2 |
DAH |
DOC |
LPS |
29,6 |
| Полиэтилен |
-NH2 |
- |
DOC |
LPS |
12,5 |
| Полиэтилен |
-NH2 |
DAH |
Полимиксин B |
LPS |
16,3 |
| Полиэтилен |
-NH2 |
DAH |
Аргинин |
LPS |
14,3 |
| Полиэтилен |
-NH2 |
DAH |
Recombumin |
LPS |
18,3 |
| Полиэтилен |
-NH2 |
- |
Anti-TNF- Ab Ab |
TNF- |
63,2 |
| Полиэтилен |
Аллил-амин |
PEI |
DOC |
LPS |
33,4 |
| Полиэтилен |
Аллил-амин |
Poly-Lys |
DOC |
LPS |
85,5 |
| Полиэтилен |
-COOH |
- |
Рецептор TNF- |
TNF- |
59,2 |
| Полиэтилен |
-COOH |
- |
Рецептор Интерлейкина-1 |
IL-l |
64,0 |
| Полиэтилен |
-COOH |
- |
Тромбомодулин |
Тромбин |
70,8 |
| Полиэтилен |
-COOH |
- |
BPI |
LPS |
91,2 |
| Полиэтилен |
-OH |
Sil.ald |
Рецептор TNF- |
TNF- |
61,8 |
| Полиэтилен |
-OH |
Sil.ald. |
Рецептор Интерлейкина-1 |
IL-1 |
62,0 |
| Полиэтилен |
-OH |
Sil.ald. |
Тромбомодулин |
Тромбин |
73,7 |
| Полиэтилен |
-OH |
Sil.ald. |
BPI |
LPS |
89,3 |
| Полиэтилен |
HA |
DAH |
DOC |
LPS |
29,6 |
| Полиэтилен |
Poly-Lys |
DAH |
DOC |
LPS |
73,3 |
| Полиэтилен |
Recom-bumin |
- |
DOC |
LPS |
20,8 |
| Полиэтилен |
-NH2 |
GDA |
Anti CD 11b Ab |
Гранулоциты и моноциты |
50,2 |
| Полиэтилен |
-OH |
Sil.ald. |
Anti CD lib Ab |
Гранулоциты и моноциты |
56,1 |
| Поликарбонат |
- |
Poly-Lys |
DOC |
LPS |
44,4 |
| Поликарбонат |
-OH |
Sil.Ald |
Рецептор TNF- |
TNF- |
75,9 |
| Поликарбонат |
-COOH |
- |
Тромбомодулин |
Тромбин |
72,0 |
| Полиуретан |
- |
DAH |
DOC |
LPS |
30,2 |
| Полиуретан |
- |
DAH |
Recombumin |
LPS |
18,5 |
| Полиуретан |
- |
Poly-Lys |
DOC |
LPS |
14,8 |
| Полиуретан |
- |
Sil.Ald |
Рецептор TNF- |
TNF- |
56,7 |
| Полиуретан |
- |
Sil.Ald |
BPI |
LPS |
88,0 |
| Силикон |
- |
Sil.Ald |
Рецептор TNF- |
TNF- |
55,3 |
| Силикон |
- |
Sil.Ald |
Тромбомодулин |
Тромбин |
68,2 |
| Цеолит |
- |
Sil.Ald |
Рецептор TNF- |
TNF- |
63,9 |
| Цеолит |
- |
Sil.-NH2 |
DOC |
LPS |
48,3 |
| Цеолит |
|
Sil.Ald |
Рецептор Интерлейкина-1 |
IL-1 |
60,1 |
| Целлюлоза |
CNBr |
DAH |
DOC |
LPS |
28,5 |
| Целлюлоза |
CNBr |
Poly-Lys |
DOC |
LPS |
39,2 |
| PTFE |
Аллил-амин |
DAH |
Рецептор TNF- |
TNF- |
73,0 |
| PTFE |
-COOH |
- |
Рецептор Интерлейкина-1 |
IL-1 |
77,7 |
Аббревиатуры: BPI = белок, повышающий бактерицидную проницаемость; DAH = 1,6-диамино-гексан; DOC = дезоксихолат; EDC = 1-этил-3(3-диметиламинопропил)карбодиимид; GDA = глутаровый диальдегид; HA = гиалуроновая кислота; IL-1 = Интерлейкин-1; PEI = полиэтиленимин; Recombumin = рекомбинантный альбумин человека; Sil.ald. = связывающий реагент с альдегид-функциональным силаном; Sil.-NH2 = связывающий реагент с аминофункциональным силаном; TNF- = фактор некроза опухоли - = фактор некроза опухоли -  . .
Формула изобретения
1. Способ селективного связывания и выделения, по меньшей мере, одного компонента из жидкости организма, включающий в себя
прохождение жидкости организма, такой как цельная кровь, через жесткую интегральную разделительную матрицу, без исключения компонентов по размерам указанной матрицей, причем указанная матрица имеет пористую структуру с размером пор в пределах от 5 до 500 мкм, а также активную поверхность в пределах от 0,5 см2 до 10 м2,
связывание, по меньшей мере, одного компонента жидкости организма, по меньшей мере, с одной функциональной группой, расположенной в указанной матрице, где указанная функциональная группа размещена на указанной матрице путем покрытия или поверхностной модификации указанной пористой структуры указанной матрицы, для размещения указанной, по меньшей мере, одной функциональной группы на указанной матрице,
при этом указанную матрицу получают с помощью способа, выбранного из группы, включающей в себя способы спекания, формования и вспенивания.
2. Способ по п.1, где, по меньшей мере, одна функциональная группа, сама по себе или в сочетании с нефункционализованными участками указанной пористой структуры, способна связывать указанный, по меньшей мере, один компонент.
3. Способ по п.1, где указанную матрицу изготавливают из материала, выбранного из группы, включающей в себя металл, оксид неорганического соединения, углерод, стекло, керамику, синтетический полимер и природный полимер, и их сочетания.
4. Способ по п.3, где указанную матрицу изготавливают из ферромагнитного металла.
5. Способ по п.3, где синтетический или природный полимер наносят в виде покрытия на указанный материал.
6. Способ по п.3 или 5, где указанный синтетический полимер выбирают из группы, включающей в себя полиолефин, виниловый полимер, фторсодержащий полимер, полиакрилат, полиамид, полиимид, полиимин, полистирол и его сополимеры, силиконовый каучук, сложный полиэфир, поликарбонат, полиуретан, полисульфонат, полигликоль, простой полиэфир и полиалкиленоксид и их сополимеры и гибриды.
7. Способ по п.3 или 5, где указанный природный полимер выбирают из группы, включающей в себя полисахарид, полиуглевод, полиаминокислоту, полимолочную кислоту или полигликолевую кислоту и их сополимеры и гибриды.
8. Способ по п.2, где указанную модификацию поверхности выбирают из группы, включающей в себя электроосаждение, электроиспарение, плазмостимулированное химическое осаждение, осаждение из потока ионов плазмы, плазменную полимеризацию, осаждение полимера на поверхность, улучшенную обработкой плазмой, и химическое осаждение из паровой фазы.
9. Способ по п.2, где указанную, по меньшей мере, одну функциональную группу выбирают из группы, включающей в себя сульфгидрил, карбоксилат, амин, альдегид, кетон, гидроксил, галоген, гидразид или активный водород.
10. Способ по п.2, где лиганд связан с указанной, по меньшей мере, одной функциональной группой ковалентным образом.
11. Способ по п.10, где указанный лиганд выбирают из группы, включающей в себя белок, пептид, антитело или его фрагмент, углевод, полисахарид, гормон, антиоксидант, гликопротеин, липопротеин, липид, жирорастворимый витамин, желчную кислоту, реакционноспособный краситель, аллантоин, мочевую кислоту или полимиксин и их сочетания.
12. Способ по п.10, где кросслинкер ковалентно связан между указанной, по меньшей мере, одной функциональной группой и указанным лигандом.
13. Способ по п.12, где указанный кросслинкер выбирают из группы, включающей в себя гомобифункциональный, гетеробифункциональный и трифункциональный кросслинкер.
14. Способ по п.12, где указанный кросслинкер ковалентно связан в качестве спейсера между указанной, по меньшей мере, одной функциональной группой и указанным лигандом.
15. Способ по п.14, где указанный спейсер выбирают из группы, включающей в себя силан, диизоцианат, гликолят, полиэтиленгликоль, сукцинимидиловый реагент, дигидразин, адипиновую кислоту, диамин, аминокислоту, олигоаминокислоту, полиаминокислоту, пептид и белок.
16. Способ по п.1, где указанная разделительная матрица имеет форму, выбранную из группы, включающей в себя диск, стержень, цилиндр, кольцо, сферу, трубку и полую трубку.
17. Способ по п.1, где указанный размер пор составляет от 50 до 500 мкм.
18. Способ по п.1, который осуществляется в устройстве (1), содержащем корпус (2), вход (3), выход (4) и указанную, по меньшей мере, одну разделительную матрицу (5а, 5b, ...).
19. Способ по п.18, где указанное устройство имеет, по меньшей мере, две разделительных матрицы (5а, 5b, ...), каждая из которых селективно и отдельно от других удаляет, по меньшей мере, один компонент из жидкости организма.
20. Способ по п.19, где указанные, по меньшей мере, две разделительные матрицы (5а, 5b, ...) удаляют, по меньшей мере, два компонента из жидкости организма.
21. Способ по п.20, где первая разделительная матрица удаляет первый компонент, а вторая разделительная матрица удаляет второй компонент из жидкости организма.
22. Способ по п.19, 20 или 21, в котором, по меньшей мере, одна из указанных разделительных матриц имеет размер пор от 50 до 500 мкм.
23. Способ по п.16, где скорость потока через указанное устройство составляет от 5 мл/час до 6000 мл/мин.
24. Применение остатка желчной кислоты, иммобилизованного на подложке, для устранения компонента из жидкости организма с помощью способа по п.1.
25. Применение по п.24, где указанный остаток желчной кислоты представляет собой остаток дезоксихолевой кислоты.
26. Устройство для селективного связывания и выделения, по меньшей мере, одного компонента из жидкости организма в соответствии со способом по любому из пп.1-21, содержащее корпус (2), вход (3), выход (4) и, по меньшей мере, одну разделительную матрицу (5а, 5b, ...), причем указанная матрица является жесткой и интегральной при прохождении указанной крови или жидкости организма через нее, и указанная матрица имеет пористую структуру с размерами пор, находящимися в пределах от 5 до 500 мкм, а также активную поверхность, находящуюся в пределах от 0,5 см2 до 10 м2, которая способна связывать указанный, по меньшей мере, один компонент, где указанная разделительная матрица имеет пористую структуру, полученную с помощью способа, выбранного из группы спекания, формования и вспенивания.
27. Устройство по п.26, где указанная матрица имеет размер пор от 50 до 500 мкм.
28. Устройство по п.26, где указанное устройство имеет, по меньшей мере, две разделительные матрицы (5а, 5b, ...), каждая из которых селективно и отдельно от других удаляет, по меньшей мере, один компонент из цельной крови или жидкости организма.
29. Устройство по п.28, где указанные, по меньшей мере, две разделительные матрицы (5а, 5b, ...) удаляют, по меньшей мере, два компонента из жидкости организма.
30. Устройство по пп.28 или 29, где, по меньшей мере, одна из указанных матриц имеет размер пор от 50 до 500 мкм.
31. Устройство по любому из пп.26-29, где указанная разделительная матрица имеет форму диска, стержня, цилиндра, кольца, сферы, трубки или полой трубки.
32. Устройство по любому из пп.26-29, где модификацию поверхности осуществляют с помощью способа, выбранного из группы, состоящей из электроосаждения, электроиспарения, плазмостимулированного химического осаждения, осаждения из потоков ионов плазмы, плазменной полимеризации, осаждения полимера на поверхность, улучшенную обработкой плазмой, и химического осаждения из паровой фазы.
|