(54) СПОСОБ ПОЛУЧЕНИЯ ПИЩЕВОГО ПРЕПАРАТА ХОНДРОПРОТЕКТОРНОГО ДЕЙСТВИЯ
(57) Реферат:
Изобретение относится к рыбной промышленности, в частности способу получения поликомпонентного функционального препарата хондропротекторного действия. Способ получения препарата хондропротекторного действия включает измельчение, обезжиривание и обработку ферментами протеолитического действия из гепатопанкреаса камчатского краба хряще-костно-коллагеновая ткань рыб. При этом соотношение хрящевой, костной и коллагеновой тканей составляет соответственно 1:(19±7):(30±10). Обработку ферментами проводят в водном экстракте плодов шиповника или цветов ромашки аптечной или листьев шалфея с массовой долей сухих веществ 2÷5%. Изобретение позволяет повысить качества препарата и эффективности процесса. 1 табл.
Изобретение относится к рыбной промышленности, в частности способу получения поликомпонентного функционального препарата хондропротекторного действия с широким спектром биологической активности, и может быть использовано при производстве биологически активных добавок и продуктов, предназначенных для профилактики остеопорозных и артрозных заболеваний, в том числе артрологических и ревматических, включая дегенеративные возрастные изменения суставов и позвоночника.
Известен способ получения хондроитинсульфата (Патент RU  2089557, МПК С08В 37/08, опубл. 10.09.1997), обладающего хондропротекторным действием, из бычьих трахей. Способ включает ферментативный гидролиз бычьих трахей 2-3 объемами 0,5-1%-ного раствора пепсина при 38-40°С и рН 1,5-2 в течение 4-6 ч, инактивацию пепсина, отделение образовавшегося осадка с последующим его растворением в воде, перед осаждением гидролизат хроматографируют на колонке с диэтиламиноэтилцеллюлозой в элюирующем растворе 1-2%-ной соляной кислоты, при этом для высушивания используют диализованный водный раствор целевого продукта. 2089557, МПК С08В 37/08, опубл. 10.09.1997), обладающего хондропротекторным действием, из бычьих трахей. Способ включает ферментативный гидролиз бычьих трахей 2-3 объемами 0,5-1%-ного раствора пепсина при 38-40°С и рН 1,5-2 в течение 4-6 ч, инактивацию пепсина, отделение образовавшегося осадка с последующим его растворением в воде, перед осаждением гидролизат хроматографируют на колонке с диэтиламиноэтилцеллюлозой в элюирующем растворе 1-2%-ной соляной кислоты, при этом для высушивания используют диализованный водный раствор целевого продукта.
Недостатком данного способа является сложность процесса, использование дорогих реактивов, специально обработанных растворов, а также специфического хроматографического оборудования, требующего высококвалифицированного обслуживания и специальных сорбентов. При этом происходит получение высокомолекулярной фракции хондроитинсульфата, который разлагается уже в желудочно-кишечном тракте человека, не достигая пораженных участков организма (суставов, позвоночника). Препараты хондроитинсульфата, полученные вышеуказанным способом, пригодны только для внутривенного применения, что ограничивает сферу и эффективность их использования. Кроме того, в целевом продукте отсутствуют такие ценные компоненты, необходимые для профилактики и подавления остеопорозных, артрологических и ревматических заболеваний, как кальций, фосфор, магний, составные части коллагена и др. вещества, участвующие в синтезе новой хряще-костной ткани. Минеральные компоненты удаляются с осадком, как и олигопептиды, и другие фрагменты натурального белка коллагена, отделяемые хроматографически. Препарат также мало эффективен при приеме в случае воспалительных процессов в суставах, сопровождающих остеопорозные и артрозные заболевания, по причине отсутствия биологически активных веществ направленного действия, обусловливающих синергический эффект воздействия хондроитинсульфата.
Известен также способ получения комплексного продукта (Патент RU 2250047) из хрящевой ткани гидробионтов (акул, скатов, осетровых, лососевых рыб и головоногих моллюсков). Способ включает гомогенизацию хрящевой ткани, экстракцию 0,9-2,0% хлористым натрием, ферментативный гидролиз в течение 7-8 ч, инактивацию ферментов, осаждение липидов 0,2-0,3% раствором хитозана в 2-4% уксусной кислоте в течение 9-15 ч, кислотный гидролиз соляной кислотой, отделение конечного продукта и его сушку.
Недостатком известного способа является его неприменимость для переработки коллагено-хряще-костных тканей костистых видов рыб из-за низкого выхода целевого продукта. Кроме того, в конечном продукте отсутствуют в необходимом количестве минеральные вещества и продукты распада коллагена, необходимые для эффективной регенерации поврежденных участков хряще-костной системы человека, а также биологически активные вещества направленного действия, обусловливающих синергический эффект препарата.
Другим недостатком способа является использование дефицитного в промысловом отношении сырья. Акулы, скаты сегодня являются лишь приловом на промысле, а осетровые и лососевые рыбы, а также головоногие моллюски относятся к дефицитному и относительно дорогостоящему сырью. Кроме того, в технологии препарата необходима операция десорбции липидной фракции сырья хитозаном, что трудоемко (ручное диспергирование), проблемно в последующей очистке хитозана (нет соответствующих технологий), но необходимо по причине обеспечения надлежащей хранимоспособности продукта (жир гидробионтов быстро окисляется и делает препарат непригодным и даже опасным для использования).
Следует также отметить, что готовый препарат имеет специфический рыбный запах, что не способствует его гастрономической привлекательности, ограничивает круг использования.
Способ также предполагает повышенный расход химических реагентов (уксусной и соляной кислот, хлорида кальция), в том числе дефицитных (хитозана), что в конечном итоге приводит к увеличению себестоимости и рыночной стоимости готового продукта и, как следствие, его малой доступности широким слоям населения.
Невысокая технологичность процесса, обусловленная химическими загрязнениями производственных стоков и дополнительными мерами по экологизации производства, также затрудняет внедрение способа.
Наиболее близким техническим решением является способ получения препарата хондропротекторного действия из хрящевой ткани хрящевых рыб - акулы-катран, ската звездчатого, русского осетра (опубл. в журнале «Рыбпром»,  3, 2007, стр.18-20), включающий измельчение хрящевой ткани, обезжиривание, обработку ткани ферментами протеолитического действия из гепатопанкреаса камчатского краба, инактивацию ферментов, отделение продуктов ферментации с последующей их сушкой. Ферментативный гидролиз проводят с использованием коллагеназы активностью 773 ЕД/мг при концентрации фермента в суспензии 0,1%; температурный режим поддерживают при 42°С; продолжительность гидролиза - 24 ч. Осаждение липидов проводят 1%-ным раствором хитозана в соляной кислоте, далее гидролизат можно дополнительно очищать от солей диализом при температуре 20-22°С в течение 48 ч против дистиллированной воды. Полученный раствор препарата сушат. 3, 2007, стр.18-20), включающий измельчение хрящевой ткани, обезжиривание, обработку ткани ферментами протеолитического действия из гепатопанкреаса камчатского краба, инактивацию ферментов, отделение продуктов ферментации с последующей их сушкой. Ферментативный гидролиз проводят с использованием коллагеназы активностью 773 ЕД/мг при концентрации фермента в суспензии 0,1%; температурный режим поддерживают при 42°С; продолжительность гидролиза - 24 ч. Осаждение липидов проводят 1%-ным раствором хитозана в соляной кислоте, далее гидролизат можно дополнительно очищать от солей диализом при температуре 20-22°С в течение 48 ч против дистиллированной воды. Полученный раствор препарата сушат.
Недостатком данного способа является невысокая эффективность использования сырья в связи с малым выходом продукта (5-7%), а также большая продолжительность гидролиза (24 ч), осуществляемого при достаточно высокой температуре (42°С) в отсутствии консервирующих средств, что неизбежно приводит к микробиальной порче. В результате целевой продукт существенно бактериологически обсеменяется, в том числе санитарно-опасными (патогенными) микроорганизмами, образуются соответствующие продукты метаболизма, становятся явными признаки гнилостной порчи, что выражается в появлении неприятных органолептических (вкусоароматических) и физиологических ощущений (при приеме продукта внутрь). В последнем случае высока вероятность появления повреждающего эффекта (взамен оздоравливающего), вплоть до отравления организма.
Нетехнологичность процесса сказывается также в том, что при известных режимах получения целевого продукта нет комплексного использования ценного биологического сырья (хрящевых тканей), так как практически не подлежит дальнейшему применению твердая и жировая (сорбированная хитозаном) части гидролизата. Последнее обстоятельство аналогично связано с наличием в оставшейся нерастворимой части системы санитарно-опасных продуктов гидролиза, обладающих отрицательными микробиологическими и органолептическими характеристиками, а также с отсутствием технологий обработки хитозана, наполненного жиром.
Следует также отметить, что сырьем для получения целевого продукта являются практически не добываемые в России объекты (осетровые в настоящее время запрещены к вылову; акулы и скаты являются «штучным» случайным приловом), что, безусловно, сказывается как на «жизнеспособности» технологии, так и на себестоимости конечного продукта. Последнее обстоятельство также обусловлено низким выходом готовой продукции.
Продукт, полученный описанным способом, обладает узким спектром биологической активности, так как предложенные операции и режимы, а также итоговый химический состав не гарантируют полифункциональный эффект от его применения. Полученный продукт, вследствие удаления диализом из него минеральных веществ и низкомолекулярных азотистых соединений, имеет невысокое содержание кальция, магния, фосфора и других «строительных» элементов костей и хрящей, а также составляющих коллагена. Кроме того, в нем нет биологически активных веществ направленного действия, обусловливающих синергический эффект при получении и применении препарата. В итоге такой препарат нельзя назвать препаратом хондропротекторного действия с широким спектром биологической активности.
Изобретение решает задачу улучшения качества препарата, включая его органолептические признаки, с одновременным повышением эффективности процесса.
Техническим результатом является синергический эффект ферментов и кислот растительного происхождения, выражающийся в ускорении и модифицировании процесса деградации коллагеновой, костной и хрящевой тканей рыб.
Для достижения поставленной цели в предлагаемом способе получения препарата хондропротекторного действия, включающем использование в качестве сырья хрящевой ткани рыб, измельчение, обезжиривание, обработку ферментами протеолитического действия из гепатопанкреаса камчатского краба, инактивацию ферментов, отделение продуктов ферментации с последующей их сушкой, предлагается дополнительно в сырье ввести костные и коллагенсодержащие ткани рыб в соотношении «хрящевая»:«костная»:«коллагенновая», как 1:(19±7):(30±10), а обработку ферментами проводить в водных экстрактах лекарственных растений с массовой долей сухих веществ 2÷5%. В качестве лекарственных растений предлагается использовать плоды шиповника, цветы ромашки аптечной, листья шалфея.
Введение в сырье для получения препарата, помимо хрящевой ткани (хрящи головы, плавников), костных (позвоночная, реберные, головные и другие кости), коллагенсодержащих (кожа, чешуя, плавательные пузыри) тканей рыб позволяет получить препарат хондропротекторного действия, в состав которых входят не только продукты распада полисахаридов хрящевых тканей (хондроитинсульфат, олигосахара, гиалуроновая кислота, глюкозамин и др.), но и продукты деградации коллагена (олигопептиды, три-, дипептиды, аминокислоты и т.д.), а также ценные составляющие костных тканей - минеральные вещества, находящиеся в биологически усвояемой форме (кальций, магний, фосфор и др.), которые мягко выделяются из костных тканей костистых рыб при гидролизе коллагеназой. Наличие названных веществ существенно повышают эффективность всасывания в кровь целевого полиаминосахарида хондроитинсульфата, вследствие образования его комплекса с двухвалентными кальцием и магнием, в составе которого он более устойчив к воздействию ферментов желудочно-кишечного тракта. При этом возрастает степень регенерации поврежденных опорно-двигательных тканей, так как обогащенный хондроитинсульфатный комплекс «попадает» в поврежденное место организма за счет включения синергического эффекта.
Названное повышение эффективности такого препарата обусловлено наличием биологически активных веществ направленного действия, обеспечивающих синергический эффект, появляющийся вследствие факторов его получения. Такие вещества образуются в системе в результате одновременного присутствия в ней низкомолекулярных компонентов - продуктов распада хряще-костно-коллагеновой ткани и водорастворимых веществ, экстрагируемых из лекарственных растений (ферменты, органические кислоты, витамины, гликозиды, флавоноиды, эфирные масла, алкалоиды и др.).
Фитовещества - ферменты непосредственно участвуют в гидролизе тканей субстрата, причем, вследствие своей полифункциональности, расщепляют не только пептиды (как коллагеназа), но и другие структурные элементы тканей (полисахариды, липиды, пептид-липидные комплексы). Это - альфа-амилаза, бета-амилаза, протеаза I, протеаза II, протеаза III, пептидаза, липаза, целлюлаза, лактаза, мальтаза, инвертаза и др., входящие в состав таких растений, как плоды шиповника, цветы ромашки аптечной, листьев шалфея. Они проявляют как экзо-, так и эндодеградирующий эффект органических полимеров, причем разрывают не только пептидные, но и гликозидные, сульфгидрильные и др. связи, а также модифицируют строение полимеров. Следует отметить, что фермент эластаза, присутствующий в растительном экстракте названных растений, эффективно гидролизует эластин, сопутствующий коллагену в коллагеновых тканях, усиливая таким образом работу коллагеназы из гепатопанкреаса камчатского краба в части увеличения содержания действенных веществ, присутствие которых желательно в препарате. В итоге в нем появляются продукты как традиционного, так и нетрадиционного (модифицированного) состава, обладающие выраженными функциональными свойствами.
Фитокомпоненты - кислоты, появляясь в системе, стимулируют активность коллагеназы гепатопанкреаса краба, проявляющей свой оптимум активности в кислой среде. Это - каприловая, изовалериановая, уксусная, яблочная, лимонная, пировиноградная, янтарная, салициловая и др. органические кислоты, в изобилии присутствующие практически во всех фитосборах.
В итоге, за счет синергического эффекта ферментов и кислот растительного происхождения, в системе существенно ускоряется, а также качественно модифицируется процесс деградации хрящевой, костной и коллагеновой тканей рыб, повышается скорость перехода в растворимое низкомолекулярное состояние органических веществ, обуславливающих функциональные свойства целевого продукта, и, таким образом, обеспечивается повышение качества препарата и его количественный выход. Росту последнего также способствуют присутствие водорастворимых компонентов экстракта растений, находящихся в существенных количествах (2-5% массы) в жидкой части системы. В совокупности повышается эффективность способа получения препарата в целом.
Фитокомпоненты - органические кислоты способствуют также образованию устойчивых форм некоторых биологически активных веществ системы (а, значит, препарата). Речь идет, прежде всего, о минеральных компонентах, так как кислоты легко образуют с ними соответствующие соли. Данные соединения имеют более устойчивый характер по отношению к различным повреждающим факторам (кислород, высокая температура, повышенная влажность и т.д.), что в итоге повышает хранимоспособность препарата. Срок хранения увеличивается до 4 лет по сравнению с 3-х летним сроком хранения существующих препаратов. Кроме того, ионные связи, имеющие место в новых соединениях - солях, легко разрушаются под действием пищеварительных ферментов человека в его желудочно-кишечном тракте, что повышает всасываемость названных биологически активных веществ и направленность их действия в организме.
Важным обстоятельством описанного эффекта является также рост действенности препарата в организме в целом за счет обогащения его витаминами, т.к. понижена реакционная активность минеральных веществ по отношению к витаминам (например, натрий, калий, кальций, магний и др. активно взаимодействуют с аскорбиновой, никотиновой, пантотеновой кислотами (соответственно, витамины С, РР и Р) и многими другими витаминами, появляющимися в системе из лекарственных растений. Это взаимодействие вследствие более низкой энергии связи может наблюдаться лишь по завершении реакций микроэлементов с органическими кислотами (яблочной, уксусной и т.д.). При предлагаемых условиях способа такое взаимодействие практически исключено, а следовательно, не снижается биологическая эффективность витаминов и препарата в целом.
Кроме названных, в данной биологической системе, образующейся при определенных режимах и параметрах способа, проходят химические взаимодействия между аминокислотами и олигопептидами (продукты ферментативного распада коллагена), низкомолекулярными углеводами (продукты распада хрящевой ткани) и веществами лекарственных растений (карбонильные соединения, флавоноиды, эфирные масла, спирты, алкалоиды и др. ингредиенты экстракта), что имеет следствием образование новых веществ, положительно влияющих на изменение состава препарата вследствие оказания синергического воздействия на процесс его получения.
Схема образования новых веществ функционального действия в результате реакций между аминокислотой глицин (образуется при деградации коллагена и гликолевым альдегидом (компонент эфирных масел названных лекарственных растений) следующая:
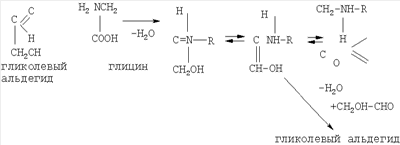
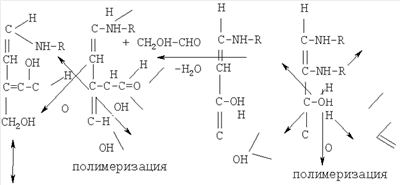
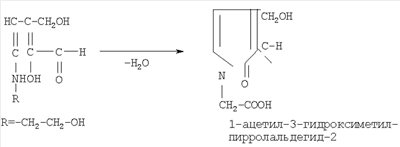
Кислотные, фенольные и карбонильные соединения растений из-за наличия реакционно-способных функциональных групп кислотного характера (-OH, -СООН, -СО и др.) участвуют практически во всех взаимодействиях с продуктами распада хряще-костно-коллагеновой ткани, имеющих основной характер (за счет аминогрупп -NH, - NH2, минеральных веществ), и данные реакции, обуславливающие дополнительные биологические эффекты, а также органолептические свойства готового продукта, необратимы. Общая схема участия водорастворимых фитокомпонентов в образовании новых соединений в препарате следующая:
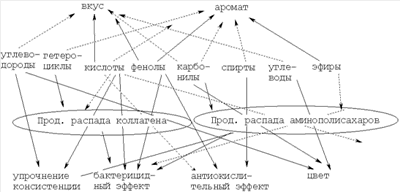
Как видно, в результате реакций, происходящих при осуществлений способа, упрочняется консистенция препарата, осуществляется бактерицидный и антиокислительный эффект препарата, улучшаются его вкус, цвет и запах.
Образующиеся новые вещества усиливают действие натуральных фитовеществ экстрактов лекарственных растений (алкалоиды, флавоноиды, органические кислоты, эфирные масла и др.), которые сами по себе также обладают выраженными антисептической и антиокислительной активностями. В результате надежно подавляются нежелательные гнилостные и окислительные процессы, сопровождающие ферментацию и сушку биотканей при изготовлении препарата. В итоге в предлагаемом способе отпадает необходимость в десорбции жировой фракции из сырья, повышается эффективность применения готового препарата за счет присутствия в нем биологически активных липидов гидробионтов (полиненасыщенных жирных кислот, прежде всего, класса омега 3), играющих синергическую роль при регенерации костно-хрящевой ткани. Названные процессы также способствуют повышению хранимоспособности готового препарата, что является синергическим эффектом его получения.
Важным обстоятельством является факт, что компоненты лекарственных растений, как и вновь образованные продукты реакций, имеют приятные органолептические свойства (светло-золотистый цвет, специфический аромат, характерный вкус и т.д.), что способствует улучшению сенсорной привлекательности препарата, а следовательно, повышению секреторной деятельности человека при его приеме. Следствием названных эффектов является повышение уровня всасывания компонентов препарата в кровь, что также можно назвать синергическим действием от взаимодополняемости компонентов его состава.
Таким образом, достижение поставленной цели изобретения обуславливается совокупностью предлагаемых состава сырья и условий его обработки. В результате улучшается качественный состав целевого продукта (за счет повышения содержания биологически активных веществ направленного действия, органолептической привлекательности), а также существенно сокращается продолжительность процесса при его упрощении в целом.
При названных операциях, проводимых при указанных параметрах и режимах, получается пищевой препарат хондропротекторного действия, обладающий широким спектром биологической активности, что обусловлено его эффективным поликомпонентным составом. Готовый препарат с приятными вкусоароматическими свойствами адекватно удовлетворяет потребность деградированных тканей больных остеопорозными, артрозными и ревматическими заболеваниями в таких комплексных веществах, как кальций-хондроитинсульфат, хондроитинсульфат-фосфат, магниевые соли янтарной, салициловой, изовалерьяновой и других кислот, фтористоводородный глюкозамин ацетил, купрум-галактпираноза, оксипролин-метилглиоксаль, пролин-фурфурол, глицин-галактоза, аланин-гиалуранидаза, глюкозаминаскорбат и др., обеспечивающих синергический эффект строительства и регенерации поврежденных тканей. Данные соединения образуются при управляемом ускоренном гидролизе натуральных хряще-костной и коллагеновой тканей костистых рыб, протекаемом в среде растительных экстрактов при определенных условиях предлагаемого способа.
Реализация способа при указанных параметрах также повышает технологичность производства, так как позволяет практически безотходно перерабатывать ценное биологическое сырье, каким являются кости, кожа, чешуя и др. хряще-костно-коллагеновые ткани рыб. Это обстоятельство обусловлено тем, что полностью используется не только жидкая часть системы, направляемая на получение препарата, но и твердая часть гидролизата, образующегося при ферментации тканей. Последняя представляет собой ценный субстрат натуральных водонерастворимых (негидролизованных) частей хряще-костно-коллагеновых тканей, направляемых на получение кормовой добавки (сушкой и измельчением данного полуфабриката).
Эффективность процесса, осуществляемого по предлагаемому способу, обусловлена также фактом использования недефицитного сырья, так как в обработку направляются отходы от разделки рыбы, идущей на производство пищевой продукции. При этом не требуется дорогостоящих препаратов и химических реактивов, процесс идет в натуральной среде, без применения кислот и щелочей. В итоге производство становится практически безотходным, в нем отпадает необходимость дополнительных мер по экологической защите процесса или продукта.
Соотношение тканей «хрящевая:костная:коллагенновая», как 1:(19±7):(30±10), является рациональным ввиду образования в итоговой композиции физиологически действенных веществ в качественно-количественном составе, эффективном при лечении заболеваний остеопорозного и артрозного характеров. Оно близко соотношению этих субстанций в поврежденных хряще-костно-коллагеновых тканях у человека. При изменении данного соотношения в сторону увеличения «костной» составляющей в итоговой композиции преобладают вещества минерального характера, а вещества белковой природы - продукты распада коллагена - присутствуют недостаточно, что сказывается на неэффективности регенерации поврежденных костных участков, требующих названных веществ. При этом минеральные вещества появляются в избытке в системе и начинают активно взаимодействовать с витаминами, содержащимися в экстрактах растений, в результате чего целевая активность препарата в целом понижается.
При увеличении данного соотношения в сторону «коллагеновой» составляющей в препарате, наоборот, наблюдается рост содержания поли- и олигопептидов, аминокислот и деградированных коллагеновых молекул, что снижает удельный весь хондроитинсульфата, без которого целевое применение препарата не эффективно. В итоге препарат не может положительно влиять на «строительство» поврежденных хрящевых участков организма, требующих комплексного углеводно-минерально-белкового питания.
При увеличении соотношения тканей в сторону хрящевой составляющей существенно вырастит стоимость препарата и появятся значительные отходы при производстве препарата, это связано с наличием небольшого количества хрящевой ткани по отношению к коллагеновой и костной у костистых рыб.
В качестве среды для ферментирования используют водные экстракты таких лекарственных растений, как плоды шиповника, цветы ромашки аптечной, листья шалфея, компоненты которых обладают не только направленной биологической активностью, но и синергическим эффектом по отношению к характеру получения и применения препарата. Приготовленные при указанных параметрах экстракты содержат ферменты, гликозиды, аминокислоты, белки, сахара, эфирные масла (хамазулен, флавоноиды, кадиен), ликопин, азулен, каприловую, изовадериановую, бензойную, салициловую, пировиноградную, муравьиную, уксусную, яблочную и другие органические кислоты, витамины С, Р, РР и К, Е, каротин и др., флавоноиды, соли железа, марганца, фосфора, магния, кальция, меди, алюминия и др. минеральных веществ. В них также найдены никотиновая кислота, холин, кумарины, фитостерин, матрицин, апигенин, апиин и др. биологически активные вещества. Все эти вещества участвуют в образовании функциональных свойств целевого препарата, сокращении процесса его приготовления и других положительных эффектах, имеющих место при получении и применении препаратов хондропротекторного действия. В итоге расширяется спектр биологического действия готового препарата.
Так, витамин С, содержащийся в экстрактах плодов шиповника, при предлагаемых условиях получения препарата находится в активной (не солевой) форме, что позволяет ему быть эффективным регулятором углеводного и азотистого обменов, способствовать его нормализации при остеопорозных и артрозных заболеваниях; он также является природным антиоксидантом, предотвращая окислительный характер деградации липидов препарата, препятствуя разрушению хрящевой и костной тканей; повышает эффективность применения препарата функция витамина по поддержанию естественной и приобретенной сопротивляемости организма вредным факторам среды.
Витамин Е, широко присутствующий в шиповнике, попадая в препарат в активной форме, существенно замедляет окислительные процессы как в самом целевом продукте, так и в организме, стимулирует также синтез новых тканей, необходимых при остеопорозе и артрозе.
Витамин Р, встречающийся в шиповнике, аптечной ромашке и др. растениях, является усилителем эффективности витамина С, регулятором проницаемости мембран, что существенно ускоряет биопроцессы, находящиеся в основе регенерации поврежденных тканей.
Флавоноиды, алкалоиды и ряд ферментов растительных экстрактов (желательно назвать их) выступают в роли ингибиторов сериновых протеиназ и металлопротеиназ, активность которых наблюдается в период деструкции хрящевой ткани при воспалительных процессах в организме. Одни из самых целебных групп флавоноидов (присутствуют в экстрактах названных растений) - проантоцианиды, препятствующие синтезу гистамина, серинпротеазы, лейкотриенов, - существенно улучшают качество и эффективность применения готового препарата именно за счет серин-, антиметаллопротеазного и антигистаминного воздействия. Это существенно снижает интенсивность воспалительных процессов и проявление болевых ощущений в организме.
При этом натуральные, а также образующиеся вещества гарантируют надежное подавление нежелательных микробиологических процессов, сопровождающих ферментацию хряще-костно-коллагеновых тканей рыб при обычных условиях, а также придают готовой продукции приятные специфические характерные натуральные аромат и вкус.
Внесение водных растворов лекарственных растений с содержанием сухих веществ 2-5% является оптимальным, так как позволяет получить достоверные ускорение и синергический эффект приготовления и применения препарата, надежно предотвратить микробиальную порчу в системе, сбалансировано улучшить органолептические свойства продукта. Итоговая композиция по химическому составу является биологически активной, близкой к рекомендуемой для целей профилактики остеопорозных и артрозных заболеваний при выраженных воспалительных процессах в суставах и костях организма. Экстракты с данным количественным содержанием сухих веществ приводят к образованию достоверного количества новых ингредиентов, участвующих в синтезе биологически активных веществ направленного действия, исчезновению болевых ощущений при приеме внутрь препарата, а также увеличению скорости получения целевого продукта.
Водные экстракты лекарственных растений с содержанием сухих веществ менее 2% не обусловливают достоверного ускорения процесса и синергического эффекта при получении и применении препарата. В итоге процесс не обладает достаточным антисептическим эффектом при ферментации, практически не улучшаются органолептические свойства конечного продукта, в нем появляются признаки порчи (гнилостный запах и т.д.), факторы пищевой опасности. Содержание веществ направленного действия в препарате не значительно, проявление биологического эффекта не достоверно, болевые ощущения при приеме внутрь в организме не исчезают. Срок хранения такого препарата не увеличивается относительно стандартного.
Использование экстрактов с содержанием сухих веществ более 5% нецелесообразно, так как положительные эффекты ускорения, синергической активности, предотвращения микробиальной порчи не значительны, хранимоспособность препарата существенно не увеличивается, а проявление органолептических свойств фитокомпозиций «перекошено» в сторону нехарактерных запаха и привкусов («химико-лекарственных»). При этом существенно увеличиваются расход растительного сырья, а также себестоимость готовой продукции.
Таким образом, в предлагаемом изобретении при обоснованном сочетании операций и параметров достигается получение пищевого препарата хондропротекторного действия, обладающего широким спектром биологической активности, при этом имеет место:
- ускоренное изготовление эффективного целевого продукта, обладающего повышенным биологическим эффектом, улучшенными органолептическими свойствами, безопасностью;
- протекание процесса без химических реагентов, его полная безотходность, экологическая безопасность;
- существенное аппаратурное упрощение технологического процесса;
- комплексное использование отходов от разделки костистых рыб (кости, хрящи, кожа, плавники, чешуя);
- снижение себестоимости целевого продукта, повышение доступности препарата широким слоям населения.
Сущность изобретения поясняется следующими примерами.
Пример 1. 9,5 кг костной, 0,5 кг хрящевой ткани (кости, плавники, голова) и 15 кг коллагеновой ткани (кожа, чешуя, плавательный пузырь), образующихся при разделке балтийского судака на обесшкуренное филе, измельчали и обезжиривали варкой с последующим сливом жировой ткани, плавающей сверху. Полученную смесь подвергали ферментированию коллагеназой из гепатопанкреаса камчатского краба активностью 706 ЕД/мг и концентрацией фермента в суспензии 0,1%. Ферментирование проводили при температуре 42°С в течение 7 ч в водной среде экстракта шиповника, массовая доля сухих веществ в экстракте составляла 3,5%. Активность ферментов экстракта по отношению к коллагену составляла 1,5 ЕД. Образующийся полуфабрикат препарата разделяли на жидкую и твердую фракции фильтрованием через плотный бумажный фильтр. Полученный бульон направляли на сушку лиофильным методом при температуре 12°С до массовой доли воды в продукте 12%.
Полученный гидролизат имел специфический, свойственный сушеной морепродукции запах с приятными своеобразными ароматами, характерными для продуктов взаимодействия компонентов плодов шиповника и веществ тканей рыбы, желтовато-коричневый цвет, рассыпчатую консистенцию. Достаточно высокий выход готового продукта (18,7% от массы субстрата) свидетельствовал о высокой эффективности ферментативных процессов, сопровождающихся переходом нерастворимых биовеществ костно-хрящевой и коллагеновых тканей в растворимое состояние, необходимое для эффективного биологического воздействия целевого продукта.
Твердая часть фильтрата после сушки обычным способом была направлена на измельчение и сушку, после чего он представлял собой светло-желтый порошок со специфическим запахом, в котором присутствовали оттенки приятной характерной «цветочной кислинки». Продукт использован в качестве компонента корма для пушных зверей.
Нерастворившаяся часть жира сливалась с жидкой частью после удаления взвешенных частиц и использовалась для получения пищевого рыбного жира и препаратов поленовых жирных кислот, содержащихся в его составе. Готовая продукция обладала оранжево-красным цветом, приятными ароматом и вкусом с цветочными оттенками, ее срок хранения увеличился по сравнению с нестабилизированным рыбным жиром на 30%.
Химический состав поликомпонентного препарата хондропротекторного действия был следующим (% сухого вещества): содержание хондроитинсульфатов - 5,8%, коллагеновых (азотсодержащих) составляющих - 68,1%, минеральных веществ - 19%; витаминов группы С - 0,8%; гликозидов - 3,6%; органических кислот - 1,8%, флавоноидов - 0,4%, алкалоидов - 0,2%. Показатель микробиологической обсемененности КМАФАнМ составил 2,7×102 кл/г, патогенные и условно-патогенные микроорганизмы отсутствовали. Признаков микробиальной порчи не наблюдалось. Срок хранения препарата - 4 года.
Результаты испытания препарата на модели инфекционно-аллергического псевдотуберкулезного артрита показали, что округлость конфигурации коленного сустава спала, сплошные мелкоточечные кровоизлияния в суставной сумке стали единичными, синовиальная жидкость в полости сустава отсутствовала. Отрицательных побочных эффектов не наблюдалось.
Биологические испытания на тест-инфузории Тетрахимона пуриформис, примененной в качестве индикаторной системы по биологической ценности продукта, показали прирост количества данных объектов против контрольных на 7,8%, что свидетельствует о достоверном повышении сбалансированности их питания по хондро-коллагено-минеральному составу, а также проявлению синергического эффекта, выраженному в росте защитных сил данных модельных организмов в результате их витаминизации.
Способ по данным параметрам рекомендуется, так как цель изобретения достигается.
Пример 2. Способ по приемам и операциям идентичен указанному в примере 1, за исключением того, что для ферментации берут 13 кг костной, 0,5 хрящевой ткани и 10 кг коллагенновой ткани судака, при этом массовая доля сухих веществ в экстракте лекарственных растений составляла 5%. Активность ферментов экстракта по отношению к коллагену составляла 1,7 ЕД. Продолжительность гидролиза при этом, определяемая достижением однородности в системе, сокращена до 6 ч. Выход готового продукта составил 19,4% от массы субстрата.
По органолептическим показателям полученный продукт был близок к описанному препарату в примере 1, однако оттенки цветочно-ягодного аромата в нем были выражены сильнее.
Химический состав поликомпонентного препарата хондропротекторного действия был следующим (% сухого вещества: содержание хондроитинсульфатов - 6,2%, коллагеновых составляющих - 59%, минеральных веществ - 26,9%; витаминов группы С - 0,9%; гликозидов - 4,2%; органических кислот - 2,1%, флавоноидов - 0,7%, алкалоидов - 0,2%. Показатель микробиологической обсемененности КМАФАнМ составил 1,4×102 кл/г, патогенные и условно-патогенные микроорганизмы отсутствовали. Признаков микробиальной порчи не наблюдалось. Срок хранения - 4 года.
Результаты испытания препарата на модели инфекционно-аллергического псевдотуберкулезного артрита показали, что округлость конфигурации коленного сустава немного спала, сплошные мелкоточечные кровоизлияния в суставной сумке немного исчезли, синовиальная жидкость в полости сустава отсутствовала. Отрицательных побочных эффектов не наблюдалось.
Биологические испытания на инфузории Тетрахимона пуриформис показали ее количественный прирост против контрольных образцов на 3,1%, что свидетельствует о достоверном повышении защитных сил данных модельных организмов, вызванных их витаминизацией.
Способ по данным параметрам рекомендуется, так как цель изобретения достигается.
Пример 3. Способ по приемам и операциям идентичен описанному в примере 1, за исключением того, что для ферментолиза использовали 6 кг костной, 0,5 хрящевой и 20 кг коллагенновой тканей судака. Ферментирование проводили в течение 8 ч, а массовая доля сухих веществ в экстракте составила 2%. Активность ферментов экстракта по отношению к коллагену составляла 1,0 ЕД.
Полученный гидролизат имел специфический, свойственный сушеной рыбной продукции запах со слабыми цветочно-ягодными ароматами, характерными для сушеного шиповника, имел светло-желтоватый цвет, рассыпчатую консистенцию. Выход готового продукта составил 17,2% от массы субстрата.
Химический состав поликомпонентного препарата хондропротекторного действия был следующим (% сухого вещества: содержание хондроитинсульфатов - 3,1%, коллагеновых составляющих - 81,2%, минеральных веществ - 13,1%; витаминов группы С - 0,3%; гликозидов - 1,6%; органических кислот - 0,5%, флавоноидов - 0,3%, алкалоидов - 0,1%. Показатель микробиологической обсемененности КМАФАнМ составил 5,2×103 кл/г, патогенные и условно-патогенные микроорганизмы отсутствовали. Признаков микробиальной порчи не наблюдалось. Срок хранения препарата - 4 года.
Результаты испытания препарата на модели инфекционно-аллергического псевдотуберкулезного артрита показали, что округлость конфигурации коленного сустава немного спала, сплошные мелкоточечные кровоизлияния в суставной сумке стали раздельными, синовиальная жидкость в полости сустава отсутствовала. Отрицательных побочных эффектов не наблюдалось.
Биологические испытания на моделях инфузории Тетрахимоны пуриформис показали прирост данных объектов против контрольных на 2,3%, что свидетельствует о достоверном повышении защитных сил данных модельных организмов, вызванных их витаминизацией.
Способ по данным параметрам рекомендуется, так как цель изобретения достигается.
Пример 4. Способ по приемам и операциям идентичен описанному в примере 1, за исключением того, что в качестве лекарственного растения используют ромашку аптечную. Активность ферментов экстракта по отношению к коллагену составляла 1,1 ЕД.
Полученный гидролизат имел специфический, свойственный сушеной рыбной продукции запах с приятными ароматами аптечной ромашки, имел желтый цвет, рассыпчатую консистенцию. Выход готового продукта составил 18,1% от массы субстрата. Химический состав поликомпонентного препарата хондропротекторного действия был следующим (% сухого вещества: содержание хондроитинсульфатов - 6,7%, коллагеновых составляющих - 69%, минеральных веществ - 19%; витаминов группы С - 0,2%; гликозидов - 3,1%; органических кислот - 1,1%, флавоноидов - 0,5%, алкалоидов - 0,2%. Показатель микробиологической обсемененности КМАФАнМ составил 2,7×102 кл/г, патогенные и условно-патогенные микроорганизмы отсутствовали. Признаков микробиальной порчи не наблюдалось. Срок хранения - 4 года.
Результаты испытания препарата на модели инфекционно-аллергического псевдотуберкулезного артрита показали, что округлость конфигурации коленного сустава спала, сплошные мелкоточечные кровоизлияния в суставной сумке стали единичными, синовиальная жидкость в полости сустава отсутствовала. Отрицательных побочных эффектов не наблюдалось.
Биологические испытания на моделях инфузории Тетрахимоны пуриформис показали прирост данных объектов против контрольных на 6,4%, что свидетельствует о достоверном повышении защитных сил данных модельных организмов, вызванных их витаминизацией.
Способ по данным параметрам рекомендуется, так как цель изобретения достигается.
Пример 5. Способ по приемам и операциям идентичен описанному в примере 1, за исключением того, что в качестве лекарственного растения используют листья шалфея. Активность ферментов экстракта по отношению к коллагену составляла 1,2 Ед.
Полученный гидролизат имел специфический, свойственный сушеной рыбной продукции запах с приятными лекарственными ароматами шалфея, имел светло-коричневый цвет, рассыпчатую консистенцию. Выход готового продукта составил 17,2% массы субстрата.
Химический состав поликомпонентного препарата хондропротекторного действия был следующим (% сухого вещества): содержание хондроитинсульфатов - 5,9%, коллагеновых составляющих - 68,1%, минеральных веществ - 20,3%; витаминов группы С - 0,6%; гликозидов - 3,4%; органических кислот - 0,91%, флавоноидов - 0,7%, алкалоидов - 0,4%. Показатель микробиологической обсемененности КМАФАнМ составил 21,4×102 кл/г, патогенные и условно-патогенные микроорганизмы отсутствовали. Признаков микробиальной порчи не наблюдалось. Срок хранения - 4 года.
Результаты испытания препарата на модели инфекционно-аллергического псевдотуберкулезного артрита показали, что округлость конфигурации коленного сустава спала, сплошные мелкоточечные кровоизлияния в суставной сумке стали единичными, синовиальная жидкость в полости сустава отсутствовала. Отрицательных побочных эффектов не наблюдалось.
Биологические испытания на моделях инфузории Тетрахимоны пуриформис показали прирост данных объектов против контрольных на 6,4%, что свидетельствует о достоверном повышении защитных сил данных модельных организмов, вызванных их витаминизацией.
Способ по данным параметрам рекомендуется, так как цель изобретения достигается.
Пример 6. Способ по приемам и операциям идентичен описанному в примере 1, за исключением того, что для ферментации использовали 14 кг костной, 0,5 кг хрящевой ткани и 9,5 кг коллагеновой. Содержание сухих веществ в экстракте лекарственной травы составило 1%. Активность ферментов экстракта по отношению к коллагену составляла 0,8 ЕД.
Ферментатирование проводили в течение 12 ч. Выход готового продукта составил 14,6% массы субстрата, что свидетельствует о недостаточной активности работы фермента коллагеназы.
По органолептическим показателям полученный продукт имел специфические признаки, не совсем свойственные сушеному качественному пищевому продукту из рыбного хряще-коллагено-костного сырья. Присутствовали внешние оттенки запаха гниющей массы, характерные для объектов с очагами микробиальной порчи; цвет продукта был темно-коричневым, консистенция - не рассыпчатой.
Химический состав поликомпонентного препарата хондропротекторного действия был следующим (% сухого вещества: содержание хондроитинсульфатов - 4,1%, коллагеновых составляющих - 59,2%, минеральных веществ - 17,9%; витаминов группы С - 0,1%; гликозидов - 0,2%; органических кислот - 0,2%, флавоноидов - 0,1%, алкалоидов - 0,1%. Показатель микробиологической обсемененности КМАФАнМ составил 1,4×105 кл/г, выявлена незначительное содержание условно-патогенных микроорганизмов (сульфатредуцирующие клостридии содержались 0,2 кл/в 1 г). Срок хранения - не оговаривается.
Результаты испытания препарата на модели инфекционно-аллергического псевдотуберкулезного артрита показали, что округлость конфигурации коленного сустава не спала, сплошные мелкоточечные кровоизлияния в суставной сумке не исчезли, синовиальная жидкость в полости сустава присутствовала. Имели место отрицательные побочные эффекты (признаки микробиологической интоксикации).
Биологические испытания на моделях инфузории Тетрахимоны пуриформис показали прирост данных объектов против контрольных на 0,1%, что не может свидетельствовать о достоверности повышения защитных сил данных модельных организмов (разница не превышает ошибки опыта), что объясняется их недостаточной витаминизацией.
Способ по данным параметрам не рекомендуется, так как цель изобретения не достигается.
Пример 7. Способ по приемам и операциям идентичен описанному в примере 1, за исключением того, что для ферментации использовали 9,5 кг костной, 0,5 хрящевой ткани и 9,5 кг коллагенновой. Содержание сухих веществ в водном растворе лекарственного шиповника составило 6,2%. Активность ферментов экстракта по отношению к коллагену составляла 1,8 ЕД.
Выход готового продукта составил 13,4% от массы субстрата, что меньше суммарного содержания биологически активных веществ в исходной системе.
По органолептическим показателям полученный продукт имел специфические свойства, обладал сильно выраженным кислым запахом. Цвет продукта был темно-коричневым, консистенция - не рассыпчатой.
Химический состав поликомпонентного препарата хондропротекторного действия был следующим (% сухого вещества: содержание хондроитинсульфатов - 2,6%, коллагеновых составляющих - 53,2%, минеральных веществ - 16,3%; витаминов группы С - 4,1%; гликозидов - 0,4%; органических кислот - 1,2%, флавоноидов - 1,3%, алкалоидов - 0,7%. Показатель микробиологической обсемененности КМАФАнМ составил 2,4×102 кл/г, условно-патогенных микроорганизмов не выявлено.
Результаты испытания препарата на модели инфекционно-аллергического псевдотуберкулезного артрита показали, что округлость конфигурации коленного сустава не спала, сплошные мелкоточечные кровоизлияния в суставной сумке практически не исчезли, синовиальная жидкость в полости сустава присутствовала. Отрицательные побочные эффекты выражались в повышенной кислотности процессов пищеварения.
Биологические испытания на моделях инфузории Тетрахимоны пуриформис показали прирост данных объектов против контрольных на 0,2%, что свидетельствует о некотором повышении защитных сил данных организмов, которых оказывается недостаточно для проявления целевого эффекта ввиду недостаточной витаминизации.
Способ по данным параметрам не рекомендуется, так как цель изобретения не достигается.
Пример 8. Способ по приемам и операциям идентичен описанному в примере 1, за исключением того, что ферментолиз проводят в водной среде без использования экстрактов лекарственных трав.
Полученный гидролизат имел специфические признаки, не совсем свойственные качественному сушеному пищевому продукту из рыбного хряще-коллагено-костного сырья. Присутствовали характерные оттенки запаха гниющей массы, характерные для объектов с очагами микробиальной порчи; цвет продукта был темно-коричневым, консистенция - не рассыпчатой. Выход готового продукта составил 11,6% массы субстрата, что значительно меньше суммарного содержания биологически активных веществ в исходной системе.
Химический состав поликомпонентного препарата хондропротекторного действия был следующим (% сухого вещества): содержание хондроитинсульфатов - 1,4%, коллагеновых составляющих - 51,1%, минеральных веществ - 15,1%; витаминов группы С - отсутствуют; гликозидов - 3,4%; органических кислот - отсутствуют, флавоноиды, алкалоиды - отсутствуют. Показатель микробиологической обсемененности КМАФАнМ составил 1,1×106 кл/г, выявлено незначительное содержание условно-патогенных микроорганизмов (сульфатредуцирующие клостридии содержались 0,2 кл/в 1 г). Срок хранения - не подлежит установлению.
Результаты испытания препарата на модели инфекционно-аллергинеского псевдотуберкулезного артрита показали, что округлость конфигурации коленного сустава не спала, сплошные мелкоточечные кровоизлияния в суставной сумке не исчезли. Имели место признаки микробиологической интоксикации.
Биологические испытания на моделях инфузории Тетрахимоны пуриформис показали прирост данных объектов против контрольных на 0,1%, что не может свидетельствовать о достоверности повышения защитных сил данных модальных организмов (разница не превышает ошибки опыта) из-за их недостаточной витаминизации.
Способ по данным параметрам не рекомендуется, так как цель изобретения не достигается.
Пример 9, 10, 11, 12. Способы, по приемам и операциям идентичные приведенным в примере 1, но отличающиеся соотношением вводимых в систему тканей, соответственно, как, 1:28:41, 1:10:19, 1:10:30, 1:10:30. Результаты оценки качества процесса и готовой продукции, представленные в таблице, свидетельствуют о том, что цель изобретения не достигается. Способы по данным параметрам не рекомендуются.
Параметры и результаты осуществления способа, приведенные в примерах, отражены в таблице.
| Таблица |
 опыта п/п опыта п/п |
продолжительность, ч |
x:y:z* |
 %, сухих лек. трав. %, сухих лек. трав. |
общий выход, % |
мин. вещ-ва, % |
вит. С.% |
хондроитинсульфат, % |
КМАФАнМ, Кл/г |
| 1 |
7 |
1:19:30 |
3,5 |
18,7 |
19 |
0,8 |
5,8 |
2,7·102 |
| 2 |
6 |
1:26:20 |
5 |
19,4 |
26,9 |
0,9 |
6,2 |
1,4·102 |
| 3 |
8 |
1:12:40 |
2 |
17,2 |
13,1 |
0,3 |
3,1 |
5,2·103 |
| 4 |
7 |
1:19:30 |
3,5 |
18,1 |
19 |
0,2 |
6,7 |
2,7·102 |
| 5 |
7 |
1:19:30 |
3,5 |
17,2 |
20,3 |
0,6 |
5,9 |
21,7·102 |
| 6 |
12 |
1:28:19 |
1 |
14,6 |
17,9 |
0,1 |
4,1 |
1,4·105 + клостридии (0,2) |
| 7 |
7 |
1:19:19 |
6,2 |
13,4 |
16,3 |
4,1 |
2,6 |
2,4·102 |
| 8 |
7 |
1:19:30 |
- |
11,6 |
15,1 |
- |
1,4 |
1,1·106 + клостридии (0,2) |
| 9 |
7 |
1:28:41 |
3,5 |
16,9 |
27,0 |
0,4 |
5,7 |
2,7·102 |
| 10 |
7 |
1:10:19 |
3,5 |
17,0 |
11,2 |
0,8 |
3,0 |
2,7·102 |
| 11 |
7 |
1:10:30 |
3,5 |
17,6 |
11,4 |
0,8 |
3,2 |
2,7·102 |
| 12 |
7 |
1:10:30 |
3,5 |
17,7 |
11,6 |
0,8 |
3,3 |
2,7·102 |
| х:у:z* - соотношение тканей хрящевой, костной и коллагеновой соответственно. |
Из таблицы наглядно видно усиление синергического эффекта при оптимальном соотношении тканей и обоснованном наличии экстрактивных фитовеществ (примеры 1-5). Выход за рамки пропорций ткани (пример 6) или концентраций фитоэкстрактов ведет к заметному уменьшению активных биовеществ (минеральных веществ, витамина С, хондроитинсульфатов), к тому же (примеры 6, 8) возрастает количество гнилостной микрофлоры, что не допустимо при получении пищевого препарата к пище. Из результатов примера 2 видно, что при увеличении минеральных веществ снижается содержание витамина С (свободное количество минеральных веществ, оставшихся после реакций с органическими кислотами начинает реагировать с аскорбиновой кислотой, в результате чего количество последней в конечном продукте снижается), что является не рациональным и объясняется использованием превышенного количества костной ткани, а также безрезультативным увеличением в данном случае растительных компонентов в экстракте (содержание сухих веществ 5% и более). Из примера 12 видно, что при выходе за рекомендуемые рамки по соотношению тканей в сторону увеличения костной ткани, резко снижается содержание витамина С, что является не желательным эффектом. При уменьшении количества костной ткани, снижается выход основного активного вещества хондроитинсульфата, поэтому данные примеры не рекомендуемы. Исходя из полученных данных оптимальным можно считать пропорцию тканей, направляемых на производство целевого препарата, как 1:(19±7):(30±10) = «хрящевая»: «костная»: «коллагеновая», соответственно.
Данные сводной таблицы наглядно доказывают рациональность предложенного сочетания операций и параметров способа получения пищевого препарата хондропротекторного действия, обладающего широким спектром биологической активности.
Преимуществом предлагаемого способа является возможность получения упрощенным путем эффективного профилактического продукта хондропротекторного действия, обладающего широким спектром биологической активности, из дешевого доступного сырья - вторичных отходов от разделки костистых рыб, в состав которых входит природный набор заданных биологически-активных веществ. Также привлекательным является факт получения продукта с полифункциональными свойствами за счет комплексного присутствия ценных натуральных биологически активных компонентов не только хрящевой, но и коллагеновой и костной тканей рыб.
Важным фактором полифункциональности является присутствие в продукте природных и вновь образованных биологически активных веществ (компоненты лекарственных трав - витамины групп С, РР, А, Р, И, фолиевая, пантотеновая кислоты, гликозиды, алкалоиды, флавоноиды и др., а также компоненты, образующиеся при взаимодействии веществ растительного сырья и продуктов ферментативного распада отходов от разделки рыб), суммарно ответственных за направленный синергический эффект получения и применения препарата.
Повышение эффективности процесса обусловлено тем, что в процессе получения препарата исключена микробиологическая порча полуфабриката и готового продукта на всех его стадиях, что гарантируется присутствием надежных консервирующих веществ. Использование фитоэкстрактов в процессе получения препарата приводит к обогащению системы ферментами и активаторами природного происхождения, что существенно ускоряет гидролиз исходного сырья, сокращает время процесса, способствует повышению целевого антиостеопорозного и антиартритного (хондропротекторного) эффектов готового препарата.
Немаловажным преимуществом способа является повышение экологического уровня производства за счет комплексной переработки отходов от разделки рыбы и ликвидации химических стоков. Получаемый конечный продукт из-за низких затрат на производство имеет невысокую себестоимость, что обусловлено, прежде всего, использованием доступного вторичного сырья, в больших количествах, образующегося при переработке рыб на пищевые цели, а также простыми методами обработки. При этом в основе технологии находится не жесткий химический, а мягкий биотехнологический процесс, который протекает гарантированно направленно и безопасно в ускоренном режиме, что обусловлено присутствием в среде заданных компонентов растительной природы.
Реализация предложенного способа позволяет получить простым путем качественный, чрезвычайно востребованный, относительно дешевый (доступный) пищевой препарат хондропротекторного действия из так называемых отходов рыбоперерабатывающих производств по комплексной безотходной экологически безопасной технологии.
Формула изобретения
Способ получения пищевого препарата хондропротекторного действия, включающий использование в качестве сырья хрящевой ткани рыб, измельчение, обезжиривание, обработку ферментами протеолитического действия из гепатопанкреаса камчатского краба, инактивацию ферментов, отделение продуктов ферментации с последующей их сушкой, отличающийся тем, что дополнительно в сырье вводят коллагенсодержащие и костные ткани рыб в соотношении «хрящевая»:«костная»:«коллагеновая» как 1:(19±7):(30±10), а обработку ферментами проводят в водном экстракте плодов шиповника, или цветов ромашки аптечной, или листьев шалфея с массовой долей сухих веществ 2-5%. |
|