
СПИСОК ПАТЕНТОВ С УПОМИНАНИЕМ ГИАЛУРОНОВОЙ КИСЛОТЫ
-
- 2017751 Способ получения гиалурона
- 2192150 БАД для профилактики йодной недостаточности
- 2112542 Препарат для лечения патологий соединительных тканей
- 2225206 Препарат для лечения рака молочной железы
- 2299733 Лечение опорно-двигательного аппарата
- 2299732 Способ лечения глаукомы
- 2299726 Противоинфекционная губная помада
- 2299725 Косметическое средство для ухода за кожей
- 2198878 Ароматическое соединение
- 2198702 Способ подготовки трофических язв к аутодермапластике
- 2198653 Вагинальные суппозитории
- 2197946 Композиция для ухода за волосами
- 2197923 Фармацевтическая композиция для лечения отеков роговицы
- 2298410 Биотрансплантант и способ лечения ревматических и аутоиммунных заболеваний
- 2197501 Фотоотверженный гель на основе сшитой гиалуроновой кислоты
- 2197228 Твердые лекарственные формы
- 2197222 Водная компазиция для ухода за волосами, лица и тела
- 2297425 Полипептиды
- 2297240 Композиция с гиалуроновой кислотой
- 2297230 Фармацевтическая компазиция с ксантоновой смолой
- 2196588 Глазные капли
- 2195955 Применение биологически активных веществ
- 2195926 Дерматологические композиции
- 2295954 Микрочастицы для доставки нуклеиновых кислот
- 2295951 Косметика для ухода за кожей лица и век
- 2195262 Фармакологическое средство на основе гиалуроновой кислоты
- 2194512 Способ профилактики и коррекции процесса старения кожи
- 2194478 Лечение экземы
- 2294716 Расширяемый стент
- 2194055 Сшитые сополимеры
- 2099350 Ассоциаты депротонированной гиалуроновой кислоты
- 2293557 Средство для лечения кожи и слизистых
- 2292878 Приготовление микроцастиц, содержащих метопропол
- 2292746 БАД
- 2192256 Защита кишечника
- 2191782 Получение модифицированной гиалуроновой кислоты
- 2292219 Паратиреоидный гормон человека
- 2291686 Микроцастицы
- 2191000 Косметическая маска
- 2290921 Фармацевтические и косметические средства против старения кожи
- 2290900 Модифицированный биоматериал для использования в офтальмологии
- 2290899 Получение биоматерьяла
- 2290397 Новые инданилиденовые соединения
- 2290186 Лечение сирингомиелии
- 2288702 Иррингационный раствор для офтальмологии
- 2288699 Гель для лечения стоматологических заболеваний
- 2188011 Активирующая остеогенез фармацевтическая композиция
- 2187327 Средство с антисептиком
- 2187325 Средство с радиопротекторным действием
- 2287330 Композиции миноксидила
- 2186786 Способ получения гиалуроновой кислоты
- 2186593 Лечение раненого процесса кожи
- 2286801 Очищение воды
- 2286781 Лечение ожогов пищевода у детей
- 2286764 Средство лечения воспалений полости рта
- 2185840 Лечение инфекционных заболеваний
- 2286151 Альфа-2-Дельта-Лиганда
- 2185149 Ранозаживляющий гель
- 2285527 Лечение ИЛ-6 заболеваний
- 2184448 Раствор хранения роговицы, включающий гиалуроновую кислоту
- 2090179 Крем для кожи
- 2183961 Способ лечения кожи
- 2284331 Соли алифотических аминов
- 2284187 Производные амида
- 2089191 Снизить внутрение давление
- 2283320 Получение гликозаминогликанов
- 2283129 Лечение опухолей
- 2283098 Косметические средства с Q
- 2182574 Ароматические соединения
- 2088257 Средство с гипохолестеролемическим действием
- 2088218 Состав для гигиенических салфеток
- 2088206 Способ получения препарата, создающего исскуственный загар
- 2282462 Противомикробные средства
- 2182008 Интровагинальная компазиция
- 2181999 Препарат с отсроченным высвобождением
- 2181998 Новые композиции липидов
- 2181995 Лечение болевого синдрома
- 2181295 Вирионная вакцина
- 2087144 Витамин Е
- 2379336 Способ стирки
- 2379052 Вакцинация
- 2180855Композиция в виде ионного комплекса
- 2379025 Противоинфекционный гель
- 2180825 Лечение травм роговицы
- 2281082 Способ коррекции эстетических и возрастных проблем кожи
- 2180576 Биоактивная добавка для косметических средств
- 2280459 Средство для изменения скорости роста или репродукции клеток
- 2179981 Соли переходного металла
- 2378010 Жидкие вакцины
- 2378008 Комбинированные вакцины
- 2378007 Анаболическое средство
- 2377973 Растительные экстракты
- 2280041 Способ получения водорастворимых комплексов гиалурил
- 2280038 Биополимеры
- 2323733 Йодный обмен
- 2377260 Гель
- 2178693 Противовирусное средство на основе гиалуроновой кислоты
- 2178692 Облегчающие зуд косметическое средство
- 2377022 Гемостатические спреи
- 2376982 Увлажняющая сыворотка для лица
- 2376974 Трансдермальный гель для лица
- 2362784 Гипо-и гиперацетилированные менингокковые капсульные сахариды
- 2177789 Устройство для доставки лекарства к шейке матки
- 2277954 Крем для лица омолаживающий
- 2376378 Способ получения метионина
- 2177332 Биоматериал для предотвращения послеоперационных спаек, с производной гиалуроновой кислотой
- 2177310 Способ получения таблеток
- 2376011 Средство для позвоночника
- 2277410 Косметическое средство
- 2323748 Медицинская повязка
- 2276998 Гидрогелевые композиции
- 2082416 Способ получения препарата с коллагенном из животного сырья
- 2375081 Адсорбирующее изделие
- 2375049 Охлаждающий пластырь
- 2346049 Способ получения гиалурона
- 2275913 Фармацевтические средства
- 2174985 Полисахарид с антиоксидантом
- 2373957 Носитель для лекарственных средств и биологически активных веществ
- 2373941 Способ коррекции возрастных и патологических изменений кожных покров
- 2174845 Композиции и способы доставки генетического материала
- 2174830 Средство для укрепления волос
- 2373769 Синбиотическая композиция
- 2274472 Лечение апорно-двигательного аппарата и болевых синдромов
- 2372929 Профилактическая композиция на основе веществ фенольной природы в липосомной форме
- 2173563 Способ нанесения на поверхность предметов покрытия на основе гиалуроновой кислоты, её производных и полусинтетических полимеров
- 2079304 фармацевтическая композиция, обладающая иммуносупрессорной и антимикробной активностью
- 2273645 Полипептид ожирения
- 2173154 Фракция кератансульфатолигосахаридов и содержащий ее фармацевтический препарат
- 2173136 Грязная мазь
- 2173128 Способ хирургического лечения центральных разрывов сечатки
- 2078561 Косметическое средство предотвращающее старение кожи
- 2172490 Способ прогнозирования воспалительных заболеваний молочной железы при эндопластике
- 2272645 Способ лечения ЦМВ-Инфекции у детей раннего возроста
- 2272636 Фармацевтическая композиция для местного лечения воспаления
- 2272635 Фармацевтически активная субстанция для офтальмологии
- 2272599 Биоматерьял для стабилизации прогрессирующей миопии "Коллаплант"
- 2172168 Средство для заживления ран на основе гиалуроновой кислоты
- 2371172 Фармацевтическая композиция для лечения нервной системы на основе стефаглабрина
- 2171470 Способ прогнозирования послеоперационной трансформации доброкачественных опухолей нервной системы
- 2077317 Состав для ванн
- 2271213 Комбинированные композиции, содержащие экстракты из растений и морских животных
- 2076872 Способ получения окрашенной гиалуроновой кислоты
- 2076671 Раствор для защиты роговицы
- 2370281 Конъюгаты гидроксиалкилкрахмал
- 2370275 Способ лечения (коррекции) косметических и возрастных дефектов кожи
- 2370258 Фармацевтическая композиция для парентальной доставки в форме лиофилизата
- 2270023 Способ экстракции и очистки протеогликана хрящего типа (варианты)
- 2369408 Гемостатическая композиция, включающая гиалуроновую кислоту
- 2369387 Фармацевтическая композиция для лечения нервной системы
- 2369379 Нетаблитированные жевательные формы для индивидуального введения
- 2169136 Производное коричной кислоты
- 70792 Медицинский аппликатор
- 20741717 Способ стабилизации аскорбиновой кислоты
- 2074712 Способ получения препарата, препятствующего преждевременной эякуляции
- 2367954 Способ прогнозирования развития кожной патологии у женщин с синдромом склерополикистозных яичников (СПКЯ)
- 2268075 Устройство для электрокинетической доставки
- 2268052 Средство для лечения воспалительных и дегенеративных заболеваний суставов
- 2167649 Способ получения твердой дисперсии умеренного водорастворимого лекарственного вещества
- 2167647 Гель для бритья
- 2073520 Лечение урологических инфекций
- 2367476 Биопластический материал
- 2367475 Мембрана для использования при направленной регенерации тканей
- 2367469 Фармацевтическая композиция на основе лизоамидазы
- 2367456 Фармацевтическая композиция обладающая антибактериальным и некролитическим действием
- 2367455 Фармацевтическая композиция обладающая некролитическим и антибактериальным действием
- 2267324 Применение антиадгезивных углеводов, препарат для уменьшения и /или блокирования адгезии патогенных веществ
- 2166934 Композиции включающие биологический агент
- 2166510 Псевдодипептиды
- 2366460 Композиции, имеющие высокую противовирусную и антибактериальную активность
- 2360901 Производные феноксиуксусной кислоты
- 2165749 Способ восстановления эндотелия роговицы
- 2265441 Способ укрепления склеры
- 2365382 Композиции и способы для регуляции развития сосудов
- 2070879 Соли гликозаминогликанов
- 2164914 Циклические и гетероциклические N - замещенные - иминогидроксамовые карбоновые кислоты
- 2264627 Хламидийный конъюктивит
- 2364399 Фармацевтический препарат на основе стефаглабрина
- 2264230 Препарат с замедленным высвобождением активного вещества
- 2363497 Фармацевтические композиции
- 2363496 Способ увеличения объема мягких тканей
- 2363473 Способ антифлогистической активации в эксперементе
- 2363461 Фармацевтический препарат на основе сигетина
- 2363459 Средства для введения в роговицу глаз для предотвращения офтальмологических нарушений
- 2363448 Фармацевтические композиции
- 2163123 Глазные капли
- 2162687 Усовершенствованнная лекарственная форма индуктора интерферана
- 2162343 Биосовместимый полимерный материал и способ его получения
- 2162327 Лечение рака
- 2067841 Способ получения ароматизатора
- 2161478 Способ консервированого лечения гонартроза
- 2361617 Вольфрамовые частицы в качестве рентгеноконтрастных веществ
- 2361552 Способы и устройства для дренирования жидкостей и понижения внутриглазного давления
- 2066996 Способ изготовления пленочного материала для офтальмохирургии
- 2361417 Корм с глюкозамином и экстрактом ивы для профилактики артроза у животных
- 2161002 Пищевой общеукрепляющий лечебно-профилактический продукт из хрящевой ткани акул
- 2360928 Комплексная матрица для медико-биологического применения
- 2160574 Способ лечения глаукомы
- 2360688 Способ лечения повреждений переферических нервов
- 2360670 Фармацевтическая композиция при климактерических расстройствах
- 2360646 Эндолюминальный протез
- 2260445 Способ усовершенствования транспортировки через легко прспосабливаемый полупроницаемый барьер
- 2260007 Производные амида
- 2359975 Способ получения модифицированных арабиногалактанов
- 2359974 Антигенные Пептиды
- 2159775 Псевдопептидный продукт
- 2259833 Фармацевтическая композиция для лечения роговицы глаза
- 2259816 Ранозаживляющее средство
- 2259815 Способ коррекции возрастных изменений, связанных с процессами старения кожи
- 2359706 Способ сохранения офтальмологических растворов
- 2359704 Антисептическое средство
- 2359662 Микрокапсулы
- 2159253 Катионные полимеры
- 2159111 Средство для ухода за кожей лица
- 2159105 Композиция для защиты кожи от опасных химических веществ Получение
- 2158593 Биосовместимый водный раствор
- 2358728 Способ лечения и предупреждения потери костной ткани
- 2258517 Способ хирургического лечения травмотических повреждений селезенки пленкой на основе гиалуроновой кислоты
- 2357968 Кристалические формы производной имидазола
- 2357957 Ингибиторы P38 и их применение
- 2157647 Пищевая добавка и ее получение
- 2357758 Препараты для чрескожной и чересслизистой добавки
- 2063244 Способ стабилизации растворов
- 2063140 Способ получения препарата для консервирования мяса
- 2157381 Способ получения гиалуроновой кислоты
- 2257198 Композиции микроцастиц
- 2356909 Белковый комплекс
- 2356570 Косметическая композиция
- 2256434 Способ закрытия перфорации барабанной перепонки
- 2356520 Способ лечения постконтузионного повреждения сечатки глаза
- 2156133 Гель
- 2255945 Полимерная композиция
- 2355761 Средства повторной дифференцировки
- 2061043 Способ повышения устойчивости урокиназы к нагреванию
- 2061005 Способ получения красителей для гистологических исследований
- 2355420 Зубная паста
- 2355385 Композиции пролонгированного действия с контролируемым высвобождением
- 2355240 Способ получения пищевого препарата хондропротекторного действия
- 2155057 Пихтово репейный бальзам
- 2354409 Способ производства высвобождающих лекарственные средчтва медицинских устройств
- 2254145 Раневое покрытие на основе коллаген-хитозанового комплекса
- 2254133 Лечение и профилактика ВИЧ-инфекции у человека
- 2253439 Фармацевтическая композиция для защиты и улучшения оптических свойств роговици при проведении эндовитреальных вмешательств
- 2253437 Способ омоложения кожи
- 2153352 Фармацевтическая композиция обладающая ранозаживляющим и противовоспалительным действием
- 2353354 Фармацевтический препарат на основе низкомолекулярного индуктора интерферона
- 2252787 Способ получения искусственной матрицы кожи
- 2252767 Способ нормализации иммунобиохимического гомеостаза коров в предродовом и послеродовом периодах
- 2352583 Фармацевтическая композиция содержащая Fc-область иммуноглобулина в качестве носителя
- 2152403 Модифицированные полисахариды
- 2352356 Иммуногенная композиция
- 2352342 Исскусственный физиологический солевый раствор Способ его получения
- 2352330 Фармацевтический препарат на основе низкомолекулярного индуктора интерферона
- 2352323 Фармацевтический препарат с модифицированным высвобождением
- 2152027 Способ подготовки ткани мозга для определения гликозаминогликанов
- 2251842 Интектицидный состав для борьбы с личинками оводов
- 2151580 Способ активации пролиферации эндотелия роговицы
- 2351648 Дифференцировка стромальных клеток, полученных из жировой ткани, в эндокринные клетки поджелудочной железы и их использование
- 2351595 N - гидроксиформамидные соединения в качестве ингибиторов металлопротеина
- 2251411 Косметическое средство в лиофилизированной фармацевтической форме
- 2251405 Косметика...ее композиции для косметических препаратов
- 2251367 Средство со сшитой гиалуроновой кислотой для наращивания тканей
- 2351359 Косметика для профилактики и лечения избыточной массы тела
- 2351322 Препарат на основе низкомолекулярного индуктора интерферона
- 2351153 Диета при остеортрите собак
- 2350958 Способ определения групповой принадлежности синовальной жидкости
- 2350625 Производные гиалуроновой кислоты с пониженной биодеградируемостью
- 2150266 Крем после бритья
- 2350354 Фармацевтическое средство содержащие антагонист и фактор некроза
- 2350340 Способ коррекции процессов регенерации
- 2350309 Способ лечения избыточной массы тела с помощью рефлексотерапии
- 2250047 Профилактический продукт из хрящевой ткани гидробионтов
- 2249467 Медицинский матерьял и изделия на его основе
- 2055079 Способ получения препарата гиалуроновой кислоты
- 2349599 Биоадгезив мидии
- 2054903 Способ лечения коллагеноза у бычков на откорме
- 2249210 Способ прогнозирования предрасположенности к развитию и тяжести течения деформирующего остеоартроза коленного сустава у взрослых
- 2349339 Средство для соединительной ткани
- 2148988 Человеческий интерферона
- 2148399 Лечение атеросклероза
- 2148396 Способ определения активного вещества в дифильных мазевых основах
- 2148375 Способ диагностики близорукости
- 2348415 Способ противоспаечной терапии после хирургического вмешательства
- 2348400 Препарат на основе низкомолекулярного индуктора интерферона
- 2348386 Способ непроникающего хирургического лечения первичной открытоугольной глаукомы
- 2248213 Лечение Галактозидальной А недостаточности
- 2347586 Микрофлюидизированные эмульсии типа "масло в воде" и вакцинные средства
- 2147243 Контрастное средство
- 2146526 Лечебный препарат дисбактериоза и урогенитальных инфекций
- 2146148 Терапевтическое применение фактора роста кератиноцитов (ФРК)
- 2146139 Способ повышения активности макрофагов и комбинации для его осуществления
- 2346277 Способ диагностики специфического синовита
- 2345793 Ультразвуковые контрастные вещества и их получение
- 2345782 Терапевтические комбинации на основе PORIFERA для лечения и предотвращения кожных заболеваний
- 2245131 Способ коррекции косметических недостатков кожи
- 2245130 Способ активации восстановительных процессов в коже
- 2144833 Хондроитиназа
- 2344809 Получение твердых дозированных форм с использованием сшитого нетермопластичного носителя
- 2244540 Косметический гель для ухода за кожей лица
- 2244536 Способ лечения дегенеративно-дистрофических заболеваний тазобедренного сустава
- 2344167 Хмелевый экстракт
- 2143884 Агент регулирования дифференциации клеток кожи, культурная среда для клеток или тканей и способ регулирования дифференциации клеток кожи
- 2343932 Способ получения обладающих пониженной растворимостью в воде пленночных материалов
- 2343903 Устройство доставки лекарств для контролируемого введения препаратов
- 2048817 Способ получения материала для лечения ожогов и гнойно - некронических ран
- 2048803 Гидратантный крем
- 2242974 Средства и способы лечения воспалительных заболнваний
- 2142816 Способ получения антигерпетической вакцины
- 2342923 Средство для обработки рук с увлажняющим эффектом
- 2142781 Косметика для макияжа ресниц и бровей и агент ингирирующий рост микроорганизмов в косметических средствах
- 2242251 Трансплантируемые стенты с биоактивными покрытиями
- 2142257 Способ обработки глазных имплантантов и контакных линз
- 2342389 Мононатриевая соль
- 2342107 Способ устранения западения верхнего века при анофтальме
- 2141828 Средство, пролонгирующее эффективность чесночного порошка
- 2241489 Косметическое средство матриксных протеинов для залечивания ран
- 2241443 Средство для лечения герпеса
- 2241414 Способ получения протезов кровеносных сосудов
- 2341539 Гидрогель
- 2141324 Регулятор скорости воздействия препарата для инъекций
- 2141312 Косметическое средство для ухода за кожей лица
- 2341296 Средства и способы покрытия медицинских имплантантов
- 2341272 Средство для неспецифической иммунотерапии
- 2341266 Стенты с нанесенным покрытием содержащим N - (5-(4-(4-
- 2341257 Иммуномодулирующее средство
- 2341255 Средство для лечения климактерических расстройств
- 2240821 Способ лечения урологических инфекций
- 2140786 Способ лечения лишая
- 2140243 Способ хирургического лечения диабетической ретинопатии и отслоек сечатной оболочки
- 2240140 Медицинская многослойная повязка и изделия на ее основе
- 2240135 Культура клеток, содержащая клетки - предшественники остеонегеза, имплантант на ее основе и его использование для восстановления целостности кости
- 2240123 Экзогенные биологически активные коньюгирующие вещества
- 2139886 Фотоотвержаемое производное гликозаминогликата, сшитое производное гликозаминогликата и способы их получения, способ предотвращения клеточной и тканевой адгезии
- 2139729 Вакцина. Способ стимулирования иммунной системы
- 2339386 Средство обладающее радио - и химиозащитным действием
- 2339369 Лечение офтальмологических нарушений с использованием мочевины и ее производных
- 2139041 Гидратантный регенерирующий крем и способ его получения
- 2139039 Косметический суперкрем для ухода за кожей
- 2139017 Способ получения боисовместимого материала
- 2138503 Производные камптотецина, способы их получения, уникальное средство
- 2338556 Средство содержащие антагонист Р2Х - рецептора и нестероидное противоспалительное лекарственное средство
- 2338514 Косметическое средство для профилактики старения кожи
- 2138297 Медицинские устройства, подверженные вызываемому разложению
- 2138295 Покрытие для ран
- 2337906 Ингибиторы цитозольной фосфолипазы А2 Применение физиологически допустимого корпускулярного ферримагнитного или ферромагнитного материала. Способ формирования магнитометрического изображения
- 2137501 Устройство формирования изображения
- 2137477 Способ лечения заболеваний характеризующихся аутоиммунной агрессией
- 2137467 Крем для кожи лица и тела
- 2137449 Способ коррекции дефектов преломления в глазу млекопитающего
- 2137402 Пищевая Добавка БАД
- 2336899 Способ стимуляции миелопоэза
- 2336862 Способ получения раствора для лечения роговицы
- 2336830 Способ восстановления костных структур челюсти
- 2136696 Новый полипептид и средство против ВИЧ - Инфекции
- 2336092 Биоадгезивное средство, по существу свободное от воды
- 2336089 Средство и способ лечения заболеваний периодонтальных и пульпы
- 2336074 Средства и способы лечения заднего сегмента глаза
- 2235548 Ранозаживляющее средство
- 2135186 Способ лечения рефлекторных синдромов при остеохондрозе
- 2234945 Стабилизатор водного раствора и водосодержащего сырья
- 2334762 Растворимая ассоциативная карбоксиметилцеллюлоза
- 2234514 Макропористые хитозановые гранулы и способ их получения. Способ культивирования клеток
- 2133615 Средство для лечения неврологических заболеваний
- 2233164 Способ профилактики развития послеоперационных спаек брюшной полости
- 2133127 Неткатный материал, способ его получения и способ лечения
- 2333223 Альдегидные производные сиаловой кислоты и средства на их основе
- 2333007 Полипептидные вакцины для широкой защиты против рядов поколений менингококов с повышенной вирулентностью
- 2332985 Дозированные формы анестезирующих средств с длительным высвобождением для обезболивания
- 2132677 Косметическая маска
- 38603 Пленочный аппликатор
- 2232594 Средство содержащие ингибирующие остеокластогенез фактор и полисахарид
- 2332238 Средство для прокладок, раневых повязок и других изделий, контактирующих с кожей
- 2331668 Стромальные клетки, получение из жировой ткани, для заживления дефектов роговицы и внутриглазных дефектов и их использование
- 2331438 Альфа - 2 - Дельта Лигант для лечения симптомов нижних мочевыводящих путей
- 2331411Электропряденые аморфные фармоцевтические средства
- 2331367 Способ профилактики образования спаек и их рецидива
- 2130767 Масло в воде для получения косметических и дерматологических средств, способ косметической обработки
- 2230752 Поперечносшитые гиалуроновые кислоты и их применение в медицине
- 2230558 Способ восстановления и сохранения здоровья скмьи
- 2230550 Средства длительного высвобождения, способ их получения и применения
- 2230458 Поддержания здоровья суставов
- 2330290 Способ определения состояния метаболических процессов в ткани суставного хряща
- 2230073 Способ поперечного сшивания карбоксилированных полисахаридов
- 2329059 Способ лечения полипозного риносинусита
- 2329037 Комбинированная терапия для лечения иммуновоспалительных заболеваний
- 2128666 Гиалуроновая кислота и ее соли, способ очистки гиалуроновой кислоты, способ получения гиалуроновой кислоты. Фармацевтический препарат с гиалуроновой кислотой и средства с гиалуроновой кислотой используемые в офтальмологии
- 2328740 Способ экспресс - оценки действия зубных паст
- 2128502 Косметический гель
- 2328272 Суппозитории индуктора интерферона
- 2328268 Косметика содержащая амфолитный сополимер
- 2128057 Композиционная мембрана, способ ее получения и способ направленной регенерации тканей с ее применением
- 2128055 Средство замедленного освобождения и способ его получения
- 2128049 Свечи
- 2227743 Полипептидные варианты с повышенной гепаринсвязывающей способностью
- 2326893 Ковалентное и нековалентное сшивание гидрофильных полимеров
- 2326697 Новый перевязочный материал для быстрого заживления раневой поверхности кожи
- 2126264 Фармацевтическое средство с гиалуроновой кислотой
- 2326137 Способ получения содержащих альгинат пористых формованных изделий
- 2325902 Способ выделения гликозаминогликанов из минерализованной соединительной ткани
- 2225195 Репелленты против насекомых
- 2325193 Сосудистый стент
- 2325184 Улучшенные везикулы наружной мембраны бактерий
- 2325153 Многокомпонентная фармацевтическая дозированная форма
- 2325152 Удерживаемая в желудке система регулируемой доставки лекарственного средства
- 2029955 Способ предоперационного определения помутнения задней капсулы хрусталика при экстракции катаракты
- 2324688 Производные бисбензизоселеназолонила с противоопухолевым, противовоспалительным и антитромбоническим действием
- 2323017 Устройство и способ контролируемый доставки активных веществ в кожу
- 2323011 Содержащий Коллаген I и Коллаген II способный к рассасыванию внеклеточный матрикс, предназначенный для реконструирования хряща
- 2322955 Способ изготовления имплантанта для пластики дефектов хрящевой ткани
- 2322454 Антитело против CCR5
- 2322263 Система продолжительного высвобождения растворимого лекарственного средства
- 2221561 Витамин Е и его сложные эфиры
- 2321634 Гены участвующие в метаболизме углерода и продуцировании энергии
- 2321597 Биоматерьял, способ его приготовления и его применение, медицинское средство, имплантант и вкладыш
- 2121340 Средство для похудения
- 2220737 Средство для улучшения состояния опорно-двигательного аппарата
- 2220729 Гель используемый в стоматологии
- 2320720 Способ культивирования фибропластов для заместительной терапии
- 2320378 Накожный аппликатор
- 2320369 Средства, содержащие Альфа - 2 - Дельта Лиганды и ингибиторы обратного захвата серотонина/норадреналина
- 2320362 Местные фармацевтические средства, содержащие проантоцианидины, для лечения дерматитов
- 2320322 Биоадгезивная доставка лекарств
- 2320318 Чувствительное к температуре изменяющие состояние средство гидрогеля
- 2025120 Способ получения препарата, содержащего Фактор /G-CSF/, стимулирующий рост колоний гранулоцитов
- 2319490 Средство для введения железа при лечении синдрома беспокойных ног
- 25995 Содержащее адгезив приспособление для фиксации зубных протезов в полости рта
- 2218907 Средство для ухода за кожей лица и веками
- 2318830 Способ получения модифицированного дерматансульфата
- 2118153 Косметика - туш для ресниц
- 2217441 Способ получения полимера
- 2317296 Изетионатная соль селективного ингибитора CDK4
- 2217171 Мембрана для использования при направленной регенерации тканей
- 2317095 Экстракты ECHINACEA ANGUSTIFOLIA
- 2216332 Препарат для лечения астроза
- 2216314 Крем - маска для обезвоженной кожи
- 2316333 Средство оздоровительно-восстановительных косметических панто-магниевых ванн
- 2021304 Способ получения биологически активного средства
- 2115662 Способ получения гиалуроновой кислоты
- 2315627 Впрыскиваемые имплантанты на керамической основе для заполнения морщин, кожных впадин, шрамов
- 2315623 Средство получаемое путем лиофилизации препарата
- 2114862 Способ получения гиалуроновой кислоты
- 2314791 Лечебно-Косметическое средство
- 2314791 Косметический крем-бальзам для ухода за кожей лица и шеи
- 2214600 Способ оценки эффективности лечения неврологических проявлений
- 2114602 Способ косметической обработки
- 2114587 Раствор для защиты роговицы
- 2214283 Имплантант для подкожного или внутрикожного введения
- 2313370 Медицинские протезы, имеющие улучшенную биологическую совместимость
- 2313356 Препарат для лечения демодекоза
- 2313338 Средство на основе этиллинолеата и триэтилцитрата для лечения себореи и угрей
- 2313328 Косметика содержащая тонкодисперный и пористый порошок
- 2212880 Способ получения препарата содержащего антибиотик, с замедленным высвобождением активного вещества
- 2312640 Способ лечения Блефароконьюнктивальной формы синдрома сухого глаза
- 2017751 Способ получения гиалуроновой кислоты
- 2312145 Гены CORYNEBACTERIUM GLUTAMICUM, кодирующие белки, участвующие в синтезе мембран и мембранном транспорте
- 2311458 Белки вызывающие измененную иммуногенную реакцию. Способ их получения и использования
- 2311183 Улучшенное разделение с использованием гталуроновой кислоты
- 2311177 Ингибиторы интегрина для лечения заболевания глаз
- 2300069 Косметическая маска
- 2211024 Уход за сухой кожей
- 2310440 Раствор для защиты роговицы от повреждений
- 2309684 Лечение межфалангового остеоатроза узелковой формы
- 2309406 Способ мониторинга фиброза печени у больных хроническим гепатитом с (ХГС)
- 2209088 Опосредованная рецепторами доставка генов с использованием векторов на основе бактериофагов
- 2308967 Уменьшение объема ткани
- 2308962 Средство для опорно-дигательного аппарата
- 2308957 Способ получения препарата для мезотерапии
- 2308954 Средство для лечения ран, содержащее плазму или сыворотку крови
- 2308951 Комплексный способ профилактики вагинальных дисбактериозов
- 2308937 Косметическая биологически активная добавка и косметический литофитокомплекс на ее основе
- 2208638 ДНК (варианты), способ получения белка
- 2207885 Способ подачи небольшого объема лечебного раствора к целевому месту
- 2207858 Лишенные побочных эффектов производные простагландинов для лечения глаукомы
- 2207845 Твердая лекарственная форма пролонгированного действия
- 2207844 Препарат для местного неинвазивного применения
- 2207841 Средства с антиферментативным действием
- 2306335 Стволовые клетки и решетки полученные из жировой ткани
- 2306140 Новые рецепторы для Helicobacter pylori и их применение
- 2205612 Способ эндотелизации IN VITRO протезов кровеносных сосудов
- 2105540 Депигментирующее средство
- 2304960 Косметическое средство для кожи
- 2304616 Гены участвующие в гомеостазе и адаптации
- 2204550Способ получения длинноцепочечной N-Ацилированной кислотой Аминокислот
- 2204415 Способ получения изображения
- 2204394 Средство для лечения грибковых инфекций, желудочных язв
- 2204366 Способ хирургического лечения глаукомы
- 2104034 Вагинальное увлажняющие средство, способ его получения
- 2303991 Биологически активная добавка
- 2303990 БАД
- 2303973 Адсорбирующее изделие
- 2203676 Средство обладающее иммунокорригирующим действием
- 2203672 Способ предупреждения беременности
- 2303635 Гены кодирующие белки резистентности и толерантности к стрессам
- 2303529 Способ фиксации альгинатного геля на твердой фазе, способ получения клеточного чипа на его основе
- 2203078 Способ лечения гнойных ран
- 2302412 Гидразоно-малонитрилы
- 2102400 Способ получения гиалуроновой кислоты
- 2202356 Способ стимуляции репаративных процессов длительно незаживающих ран и трофических язв
- 2202336 Средство для ухода за кожей
- 2302231 Глазные капли
- 2102082 Способ магнитометрического исследования тела человека или животного
- 2301814 Полиакриламидный гидрогель
- 2201765 Гибридные матричные имплантанты и эксплантанты
- 2301677 Биотрансплантант для лечения дегенеративных и трвматических заболеваний хрящевой ткани и способ его получения
- 2301676 Способ лечения ревматизма
- 2301674 Способ лечения больных с переломами нижней челюсти
- 2301661 Средство с регулируемым освобождением и способ его получения
- 2005488 Средство для лечения болезней соединительной ткани
- 2200001 Крем для кожи
|
РОССИЙСКАЯ ФЕДЕРАЦИЯ

ФЕДЕРАЛЬНАЯ СЛУЖБА
ПО ИНТЕЛЛЕКТУАЛЬНОЙ СОБСТВЕННОСТИ
ПАТЕНТАМ И ТОВАРНЫМ ЗНАКАМ
|
Патент №2297425 |
(54) ПОЛИПЕПТИДЫ, ПРОИСХОДЯЩИЕ ИЗ ТРИПТОФАНИЛ-ТРНК-СИНТЕТАЗЫ, И ИХ ПРИМЕНЕНИЕ ДЛЯ РЕГУЛЯЦИИ РАЗВИТИЯ КРОВЕНОСНЫХ СОСУДОВ
(57) Реферат:
Изобретение относится к биотехнологии. Предложены водорастворимые полипептиды (SEQ ID No.12) и (SEQ ID No.7), происходящие из полноразмерной триптофанил-тРНК-синтетазы и обладающие ангиостатической активностью в отношении неоваскуляризации глаза. Также предложены полинуклеотиды, кодирующие усеченные формы полипептидов (SEQ ID No.12) и (SEQ ID No.7), и клетка E.coli, экспрессирующая данные полипептиды. Полипептиды могут быть использованы в составе инъецируемой ангиостатической композиции и набора для ингибирования развития кровеносных сосудов глаза. Преимущество полипептидов заключается в том, что они представляют собой неиммуногенные антиангиогенные средства. 9 н. и 13 з.п. ф-лы, 5 ил., 2 табл.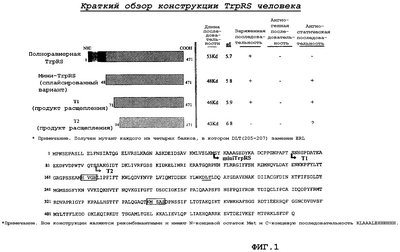
(56) (продолжение):
CLASS="b560m"synthetase shows little homoHogy to procariotic synthetase but Near identity with mammalian peptide chain release factor. BIOCHEMISTRY. 1991, 30 (31), p.7809-7817.
Притязание на приоритет
Данная заявка претендует на приоритет предварительной заявки на патент США №60/270951, поданной 23 февраля 2001 г.
Права правительства
Настоящее изобретение сделано при поддержке правительства США и Национального института здравоохранения на основании гранта GM23562; правительство США обладает определенными правами на данное изобретение.
Область техники
Настоящее изобретение относится к композициям, содержащим усеченные полипептиды тРНК-синтетазы, а также нуклеиновые кислоты, кодирующие также усеченные полипептиды процессированной тРНК-синтетазы. Данное изобретение относится также к способам получения и применения указанных композиций.
Предпосылки изобретения
Аминоацил-тРНК-синтетазы, катализирующие аминоацилирование молекул тРНК, являются древними белками, имеющими важное значение для декодирования генетической информации в процессе трансляции. В высших эукариотах девять аминоацил-тРНК-синтетаз связаны по крайней мере с тремя другими полипептидами с образованием надмолекулярного мультиферментного комплекса (Mirande et al., Eur. J. Biochem. 147:281-89 (1985)). Все эукариотические тРНК-синтетазы состоят из сердцевидного фермента, близко родственного прокариотической части тРНК-синтетазы, и дополнительного домена, присоединенного к аминоконцу или карбоксильному концу сердцевидного фермента (Mirande, Prog. Nucleic Acid Res. Mol. Biol. 40:95-142 (1991)).
В большинстве случаев присоединенные домены, по-видимому, способствуют сборке мультиферментного комплекса. Однако присутствие дополнительного домена не имеет четкой взаимосвязи с объединением синтетазы в мультиферментный комплекс.
Молекулы TrpRS млекопитающего имеют домен, присоединенный к аминоконцу. В нормальных клетках человека можно обнаружить две формы TrpRS: основную форму, включающую полноразмерную молекулу (аминокислотные остатки 1-471 SEQ ID No.1), и минорную усеченную форму ("мини-TrpRS"; аминокислотные остатки 1-424 SEQ ID No.3). Минорная форма образуется при делеции аминоконцевого домена в результате альтернативного сплайсинга пре-мРНК (Tolstrup et al., J. Biol. Chem. 270:397-403 (1995)). Как было определено, аминоконец мини-TrpRS представляет остаток "Met" в положении 48 полноразмерной молекулы RtpRS (см. выше). Усеченную TrpRS можно альтернативно получить протеолизом (Lemaire et al., Eur. J. Biochem. 51:237-52 (1975)). Например, TrpRS коровы в высокой степени экспрессируется в поджелудочной железе и секретируется в поджелудочный сок (Kisselev, Biochimie 75:1027-39 (1993)), в результате чего образуется молекула усеченной TrpRS. Полученные результаты позволяют предположить, что усеченная TrpRS может выполнять функцию, отличную от аминоацилирования тРНК (см. выше).
Развитие кровеносных сосудов или пролиферация новых капилляров из имеющихся кровеносных сосудов является основным процессом, необходимым для развития и последующего роста эмбриона и восстановления тканей. Образование кровеносных сосудов является обязательным условием для развития и дифференцировки сосудистого дерева, а также для целого ряда основных физиологических процессов, включая эмбриогенез, соматический рост, восстановление и регенерацию тканей и органов, циклический рост желтого тела и эндометрия, развитие и дифференцировку клеток нервной системы. В женской репродуктивной системе развитие кровеносных сосудов происходит в фолликуле во время его роста, в желтом теле после овуляции и плаценте для возникновения и сохранения беременности. Кроме того, развитие кровеносных сосудов представляет часть процессов восстановления организма, например, при заживлении ран и переломов. Развитие кровеносных сосудов является также показателем роста опухоли, так как опухоль должна постоянно стимулировать рост новых капилляров для своего развития. Образование кровеносных сосудов является неотъемлемой частью роста плотной злокачественной опухоли, к тому же аномальное развитие кровеносных сосудов характерно для других заболеваний, таких как ревматоидный артрит, псориаз и диабетическая ретинопатия (Folkman, J. and Klagsbrun, M., Science 235:442-447 (1987)).
Развитие кровеносных сосудов определяется несколькими факторами. Молекулы кислотного и основного фактора роста фибробластов являются митогенами для эндотелиальных клеток и клеток других типов. Ангиотропин и ангиогенин могут вызывать развитие кровеносных сосудов, хотя их действия не получили четкого обоснования (Folkman, J. Cancer Medicine, pp.153-170. Lea and Febiger Press (1993)). В высшей степени избирательным митогеном для эндотелиальных клеток сосудов является эндотелиальный фактор роста сосудов или VEGF (Ferrara, N., et al., Endocr. Rev. 13:19-32 (1992)).
Многие заболевания вызывают катастрофическую потерю зрения в результате образования новых сосудов в глазу; возрастная дегенерация желтого пятна (ARMD) наблюдается у 12-15 миллионов американцев в возрасте после 65 лет и вызывает потерю зрения у 10-15% указанных субъектов вследствие образования новых сосудов в сосудистой оболочке глаза (сетчатке). Основной причиной потери зрения у американцев в возрасте до 65 лет является диабет; 16 миллионов человек в США страдают диабетом, и у 40000 человек в год диабет вызывает осложнения, поражающие зрение, часто в результате образования новых кровеносных сосудов в сетчатке. Несмотря на то что лазерная фотокоагуляция является эффективным средством предотвращения значительной потери зрения у некоторых подгрупп страдающих диабетом пациентов с повышенным риском, статистика возникновения ретинопатии за 10 лет остается по существу неизменной. Для пациентов, страдающих образованием новых кровеносных сосудов в сосудистой оболочке глаза вследствие ARMD или воспалительного заболевания глаз, такого как гистоплазмоз, фотокоагуляция за некоторыми исключениями является неэффективной для предотвращения потери зрения. Недавно разработанные неразрушающие методы фотодинамической терапии позволяют сократить число пациентов, страдающих ранее не поддающимся лечению образованием новых кровеносных сосудов в сосудистой оболочке глаза, но лишь у 61,4% пациентов, проходящих курс лечения каждые 3-4 месяцы, улучшилось или стабилизировалось зрение по сравнению с 45,9% субъектов, получавших плацебо.
У здорового взрослого человека развитие кровеносных сосудов строго регулируется и ограничивается заживлением ран, беременностью и цикличностью функционирования матки. Процесс развития кровеносных сосудов активируется специфичными ангиогенными молекулами, такими как основный и кислотный фактор роста фибробластов (FGF), эндотелиальный фактор роста кровеносных сосудов (VEGF), ангиогенин, трансформирующий фактор роста (TGF), фактор- некроза опухоли (TNF- некроза опухоли (TNF- ) и тромбоцитарный фактор роста (PDGF). Развитие кровеносных сосудов можно подавить ингибирующими молекулами, такими как интерферон- ) и тромбоцитарный фактор роста (PDGF). Развитие кровеносных сосудов можно подавить ингибирующими молекулами, такими как интерферон- , тромбоспондин-1, ангиостатин и эндостатин. Именно баланс этих природных стимуляторов и ингибиторов регулирует нормальный процесс образования капиллярных сосудов. При нарушении указанного баланса, например в случае некоторых болезней, происходит пролиферация, миграция и в конечном счете дифференцировка эндотелиальных клеток капилляров. , тромбоспондин-1, ангиостатин и эндостатин. Именно баланс этих природных стимуляторов и ингибиторов регулирует нормальный процесс образования капиллярных сосудов. При нарушении указанного баланса, например в случае некоторых болезней, происходит пролиферация, миграция и в конечном счете дифференцировка эндотелиальных клеток капилляров.
Процесс развития кровеносных сосудов играет важную роль в ряде заболеваний, включая злокачественные опухоли и образование новых кровеносных сосудов в глазу. Установлено, что устойчивый рост различных опухолей и образование метастазов также зависит от врастания в опухоль новых кровеносных сосудов хозяина в ответ на выделяемые опухолью ангиогенные факторы. Пролиферация новых кровеносных сосудов в ответ на разные стимулы является определяющим показателем большей части глазных болезней, включая пролиферативную диабетическую ретинопатию (PDR), ARMD, глаукому с покраснением глаза, интерстициальный кератит и ретролетальную фиброплазию. При указанных болезнях поражение ткани может стимулировать высвобождение ангиогенных факторов, вызывающих пролиферацию капиллярных сосудов. VEGF играет главную роль в процессе образования новых кровеносных сосудов в радужной оболочке глаза и неоваскулярной ретинопатии. Хотя данные, приводимые в научной литературе, свидетельствуют о наличии взаимосвязи между внутриглазными уровнями VEGF и образованием новых сосудов в случае ишемической ретинопатии, в данном процессе определенную роль, по-видимому, также играет FGF. Известно, что в сетчатке здорового взрослого человека присутствует основный и кислотный FGF, даже если обнаруживаемые уровни не имеют четкой взаимосвязи с образованием новых кровеносных сосудов. Это главным образом может быть обусловлено тем, что FGF очень прочно связывается с заряженными компонентами внеклеточного матрикса и не может существовать в свободно диффундируемой форме, которую можно было бы обнаружить обычными анализами внутриглазной жидкости.
Обычная конечная форма ангиогенной реакции включает интегринопосредуемой обмен информацией между пролиферирующими эндотелиальными клетками сосудов и внеклеточным матриксом. Адгезивные рецепторы данного класса, именуемые интегринами, экспрессируются в виде гетеродимеров, имеющих  - или - или  -субъединицу во всех клетках. Один такой интегрин, -субъединицу во всех клетках. Один такой интегрин,  v v 3, является наиболее беспорядочным членом указанного семейства и позволяет эндотелиальным клеткам взаимодействовать с рядом компонентов внеклеточного матрикса. Пептидные и антительные антагонисты данного интегрина ингибируют развитие кровеносных сосудов, избирательно вызывая апоптоз пролиферирующих эндотелиальных клеток сосудов. Существуют два цитокин-зависимых пути развития кровеносных сосудов, которые можно определить с учетом их зависимости от разных интегринов, присутствующих в клетках сосудов, 3, является наиболее беспорядочным членом указанного семейства и позволяет эндотелиальным клеткам взаимодействовать с рядом компонентов внеклеточного матрикса. Пептидные и антительные антагонисты данного интегрина ингибируют развитие кровеносных сосудов, избирательно вызывая апоптоз пролиферирующих эндотелиальных клеток сосудов. Существуют два цитокин-зависимых пути развития кровеносных сосудов, которые можно определить с учетом их зависимости от разных интегринов, присутствующих в клетках сосудов,  v v 3 и 3 и  v v 5. В частности, основной FGF- и VEGF-индуцируемый процесс развития кровеносных сосудов зависит соответственно от интегрина 5. В частности, основной FGF- и VEGF-индуцируемый процесс развития кровеносных сосудов зависит соответственно от интегрина  v v 3 и 3 и  v v 5, так как антагонисты-антитела каждого интегрина избирательно блокируют один из указанных путей развития кровеносных сосудов в моделях роговицы кролика и хориоаллантоидной мембраны (САМ) цыпленка. Пептидные антагонисты, блокирующие все интегрины 5, так как антагонисты-антитела каждого интегрина избирательно блокируют один из указанных путей развития кровеносных сосудов в моделях роговицы кролика и хориоаллантоидной мембраны (САМ) цыпленка. Пептидные антагонисты, блокирующие все интегрины  v, ингибируют FGF- и VRGF-стимулируемый процесс развития кровеносных сосудов. Если в кровеносных сосудах глаза здорового человека отсутствуют интегрины v, ингибируют FGF- и VRGF-стимулируемый процесс развития кровеносных сосудов. Если в кровеносных сосудах глаза здорового человека отсутствуют интегрины  v v 3 и 3 и  v v 5, то такие интегрины избирательно присутствуют в кровеносных сосудах тканей субъектов, страдающих заболеванием глаза, сопровождающимся активным процессом образования новых сосудов. В тканях субъектов, страдающих ARMD, обнаружен только 5, то такие интегрины избирательно присутствуют в кровеносных сосудах тканей субъектов, страдающих заболеванием глаза, сопровождающимся активным процессом образования новых сосудов. В тканях субъектов, страдающих ARMD, обнаружен только  v v 3, и в тканях субъектов, страдающих PDR, обнаружены оба интегрина 3, и в тканях субъектов, страдающих PDR, обнаружены оба интегрина  v v 3 и 3 и  v v 5. Системное введение пептидных антагонистов интегринов блокировало образование новых кровеносных сосудов в модели развития сосудов сетчатки с использованием мышей. 5. Системное введение пептидных антагонистов интегринов блокировало образование новых кровеносных сосудов в модели развития сосудов сетчатки с использованием мышей.
Следовательно, антиангиогенные лекарственные средства имеют важное значение для лечения дегенерации сетчатки с целью предотвращения поражающего действия, оказываемого трофическими факторами и факторами роста. Ангиогенные лекарственные средства также играют роль в стимуляции желаемой васкуляризации для замедления дегенерации сетчатки благодаря увеличению кровотока к клеткам.
Краткое изложение существа изобретения
Полипептиды, происходящие из триптофанил-тРНК-синтетазы, которые имеют более короткую цепь по сравнению с природными полипептидами, обладают активностью хемонинов и пригодны для применения в научно-исследовательских, диагностических, прогностических и лечебных целях. В одном варианте осуществления изобретения указанные полипептиды, происходящие из тРНК-синтетазы, используют для регуляции функции эндотелиальных клеток сосудов, в частности для ингибирования развития кровеносных сосудов, особенно образования новых сосудов в глазу.
Эти усеченные полипептиды, происходящие из триптофанил-тРНК-синтетазы, укорочены у аминоконца, но могут включать нуклеотид-связывающий домен с укладкой Россмана. Такие полипептиды способны регулировать функцию эндотелиальных клеток сосудов.
Предпочтительный усеченный полипептид, происходящий из триптофанил-тРНК-синтетазы, включает полипептид, состоящий в основном из аминокислотных остатков 94-471 SEQ ID No.1, и его фрагменты, ингибирующие развитие кровеносных сосудов, в частности, фланкированные характеристическими последовательностями, показанными как SEQ ID No.10 и SEQ ID No.11, или фрагменты, включающие по крайней мере одну из указанных последовательностей. В одном предпочтительном варианте осуществления изобретения усеченный полипептид тРНК-синтетазы принадлежит млекопитающему, более предпочтительно человеку.
В соответствии с другим вариантом осуществления данное изобретение относится к выделенному полинуклеотиду, у которого нуклеотидная последовательность по крайней мере на 95% идентична последовательности полинуклеотида, выбираемого из группы, состоящей из полинуклеотида SEQ ID No.6, полинуклеотида, который гибридизуется с полинуклеотидом SEQ ID No.6, полинуклеотида, кодирующего полипептид SEQ ID No.7, полинуклеотида, кодирующего полипептид SEQ ID No.12, полинуклеотида, кодирующего эпитоп полипептида SEQ ID No.7, и полинуклеотида, который гибридизуется с полинуклеотидом, кодирующим эпитоп полипептида SEQ ID No.7. Настоящее изобретение относится также к рекомбинантному экспрессирующему вектору, содержащему выделенную молекулу нуклеиновой кислоты, кодирующую любые вышеуказанные полипептиды, происходящие из триптофанил-тРНК-синтетазы. Другой вариант осуществления изобретения относится к клетке-хозяину, содержащей такой рекомбинантный экспрессирующий вектор.
Данное изобретение далее относится к композиции и дозированным лекарственным формам, содержащим усеченные полипептиды, происходящие из триптофанил-тРНК-синтетазы, вместе с фармацевтически пригодным наполнителем. Такие композиции пригодны для введения в глаз, например в стекловидное тело, под сетчатку и т.д., а также для системного введения, например для чрескожного, тонкокишечного или парентерального введения и через слизистую оболочку.
В соответствии с другим вариантом осуществления данное изобретение относится к способу лечения глазных болезней, обусловленных образованием новых сосудов, таких как возрастная дегенерация желтого пятна, вызываемые диабетом осложнения, поражающие зрение, глаукома с покраснением глаза, ретролетальная фиброплазия, кератит, ишемическая ретинопатия (например, серповидных эритроцитов), патологическая миопия, гистоплазмоз, птеригий, внутренний хориоидит и подобные заболевания, который включает введение ингибирующего развитие кровеносных сосудов количества полипептида вместе с приемлемым, физиологически совместимым наполнителем или носителем.
Краткое описание чертежей
На фиг.1 показана последовательность аминокислотных остатков полипептида триптофанил-тРНК-синтетазы (SEQ ID No.1), включающая указанные в рамке характеристические последовательности (SEQ ID No.10 и SEQ ID No.11), которые также входят в усеченную форму (последовательности аминокислотных остатков 94-471 SEQ ID No.1).
На фиг.2 показана микрофотография, иллюстрирующая развитие сосудов в сетчатке глаза в модели с использованием мышей.
На фиг.3 графически представлены данные, приведенные в нижеследующем примере 3.
На фиг.4 графически представлены данные, приведенные в нижеследующем примере 4.
На фиг.5 показана микрофотография, иллюстрирующая место связывания фрагмента TrpRS (T2) в сетчатке глаза в модели с использованием мышей.
Подробное описание предпочтительных вариантов осуществления изобретения
Определения
Термин "усеченные полипептиды тРНК-синтетазы" означает полипептиды, у которых цепь короче, чем у соответствующей полноразмерной тРНК-синтетазы.
Термин "TrpRS" означает триптофанил-тРНК-синтетазу.
Термин "культура клеток" означает как культуральную среду, так и культивируемые клетки.
Фраза "выделение полипептида из культуры клеток" означает выделение растворимого или секретируемого полипептида из культуральной среды, а также выделение цельного мембранного белка из культивируемых клеток.
Термин "клеточный экстракт" означает культуральные среды, в частности отработанные культуральные среды, из которых удалены клетки. Клеточный экстракт, который содержит представляющую интерес ДНК или белок, означает гомогенный или бесклеточный препарат, полученный из клеток, экспрессирующих данный белок или содержащих представляющую интерес ДНК.
Термин "плазмида" означает автономную молекулу самореплицирующейся внехромосомной ДНК и обозначается строчной буквой "р", которой предшествуют и/или за которой следуют заглавные буквы и/или числа. Исходные плазмиды можно приобрести коммерческим путем на неограниченной основе или создать из имеющихся плазмид в соответствии с опубликованными методами. Кроме того, специалистам в данной области хорошо известны плазмиды, эквивалентные описанным плазмидам.
Термин "расщепление" ДНК означает каталитическое расщепление ДНК рестрикционным ферментом, который воздействует только на определенные последовательности в ДНК. Различные рестрикционные ферменты, используемые в данном изобретении, можно приобрести коммерческим путем, причем условия реакции, кофакторы и другие требования должны быть известны специалисту в данной области. Для аналитических целей обычно используют 1 мкг плазмиды или фрагмента ДНК примерно с 2 единицами фермента в приблизительно 20 мкл буферного раствора. Для выделения фрагментов ДНК с целью создания плазмиды обычно расщепляют 5-50 мкг ДНК 20-250 единицами фермента в большем объеме раствора. Соответствующие количества буферов и субстратов для конкретных рестрикционных ферментов указаны изготовителем. Время инкубации обычно равно 1 часу при 37°С, но может изменяться в соответствии с инструкциями поставщика. Расщепленную реакционную смесь подвергают электрофорезу в полиакриламидном геле для выделения требуемого фрагмента. Нуклеотиды, присутствующие в разных фрагментах ДНК и РНК, имеют в данном описании стандартные однобуквенные обозначения (А, Т, С, G, U), принятые в данной области.
"Полинуклеотид", являющийся объектом настоящего изобретения, может быть в форме РНК или ДНК, причем ДНК включает кДНК, геномную ДНК и синтетическую ДНК. ДНК может быть двухцепочечной или одноцепочечной, и в одноцепочечной ДНК указанная цепь может быть кодирующей или некодирующей (антисмысловой) цепью. Кодирующая последовательность, которая кодирует зрелый полипептид, может быть идентична кодирующей последовательности, показанной в SEQ ID No.6, или может быть другой кодирующей последовательностью, которая в результате избыточности или вырожденности генетического кода кодирует ту же самую зрелую полипептидную последовательность, показанную в SEQ ID No.7.
Термин "полинуклеотид, кодирующий полипептид" означает полинуклеотид, который включает только кодирующую последовательность для полипептида, а также полинуклеотид, имеющий дополнительную кодирующую и/или некодирующую последовательность.
Термин "олигонуклеотиды" означает одноцепочечный полинуклеотид или две комплементарные полинуклеотидные цепи, которые можно синтезировать химическим путем. Такие синтетические олигонуклеотиды не имеют 5'-концевого фосфата и таким образом не лигируют с другим олигонуклеотидом без введения фосфата с АТР в присутствии киназы. Синтетический олигонуклеотид лигирует с фрагментом, который не был дефосфорилирован.
Термин "аминокислотный остаток" означает аминокислоту, которая является частью полипептида. Описанные здесь аминокислотные остатки предпочтительно находятся в L"-изомерной форме. Однако остатки в D"-изомерной форме могут быть использованы вместо любого L-аминокислотного остатка, если при этом полипептид сохраняет требуемое функциональное свойство. NH2 означает свободную аминогруппу, находящуюся у аминоконца полипептида. СООН означает свободную карбоксильную группу, находящуюся у карбоксильного конца полипептида. В нижеследующей таблице приведены аббревиатуры аминокислотных остатков, соответствующие стандартной номенклатуре полипептидов, приведенной в J. Biol. Chem., 243:3552-59 (1969) и утвержденной в разделе 37 Свода федеральных правил §§ 1.821-1.822.
| Таблица 1 |
| Таблица соответствия аббревиатур |
| Символ |
| Однобуквенное обозначение |
Трехбуквенное обозначение |
Аминокислота |
| Y |
Tyr |
тирозин |
| G |
Gly |
глицин |
| F |
Phe |
фенилаланин |
| M |
Met |
метионин |
| A |
Ala |
аланин |
| S |
Ser |
серин |
| I |
Ile |
изолейцин |
| L |
Leu |
лейцин |
| T |
Thr |
треонин |
| V |
Val |
валин |
| P |
Pro |
пролин |
| K |
Lys |
лизин |
| H |
His |
гистидин |
| Q |
Gln |
глутамин |
| E |
Glu |
глутаминовая кислота |
| Z |
Glx |
Glu и/или Gln |
| W |
Trp |
триптофан |
| R |
Arg |
аргинин |
| D |
Asp |
аспарагиновая кислота |
| N |
Asn |
аспарагин |
| B |
Asx |
Asn и/или Asp |
| C |
Cys |
цистеин |
| X |
Xaa |
неизвестная или другая |
Все последовательности аминокислотных остатков, выраженные формулами в данном описании изобретения, читаются слева направо в обычном направлении от аминоконца к карбоксильному концу. Кроме того, фраза "аминокислотный остаток" имеет широкое определение, включая аминокислоты, приведенные в таблице 1, а также модифицированные и необычные аминокислоты, представленные в разделе 37 Свода федеральных правил §§ 1.821-1.822, который включен в данное описание изобретения в качестве ссылки. Тире в начале или в конце последовательности аминокислотных остатков означает пептидную связь с другой последовательностью одного или нескольких аминокислотных остатков, с группой у аминоконца, такой как NH2, или с группой у карбоксильного конца, такой как СООН.
Специалистам в данной области известны приемлемые консервативные замены аминокислот в пептиде или белке, которые можно обычно произвести без изменения биологической активности получаемой молекулы. Специалистам в данной области известно, что, как правило, замены отдельных аминокислот в несущественных областях полипептида по существу не изменяют биологическую активность (см., например, Watson et al. Molecular Biology of the Gene, 4th Edition, 1987, The Benjamin/Cummings Pub. Co., p.224).
Такие замены предпочтительно выполняют в соответствии со списком, приведенным в таблице 2.
| Таблица 2 |
| Исходный остаток |
Консервативная замена |
| Ala (A) |
Gly; Ser |
| Arg (R) |
Lys |
| Asn (N) |
Gln; His |
| Cys (C) |
Ser |
| Gln (Q) |
Asn |
| Glu (E) |
Asp |
| Gly (G) |
Ala; Pro |
| His (H) |
Asn; Gln |
| Ile (I) |
Leu; Val |
| Leu (L) |
Ile; Val |
| Lys (K) |
Arg; Gln; Glu |
| Met (M) |
Leu; Tyr; Ile |
| Phe (F) |
Met; Leu; Tyr |
| Ser (S) |
Thr |
| Thr (T) |
Ser |
| Trp (W) |
Tyr |
| Tyr (Y) |
Trp; Phe |
| Val (V) |
Ile; Leu |
Другие замены также допустимы и могут быть определены эмпирически или выполнены в соответствии с известными консервативными заменами.
Термин "комплементирующая плазмида" означает плазмидные векторы, которые доставляют нуклеиновые кислоты в линию упаковочных клеток для устойчивой интеграции в хромосому клеточного генома.
Термин "доставляющая плазмида" означает плазмидный вектор, который переносит или доставляет нуклеиновые кислоты, кодирующие терапевтический ген или ген, кодирующий терапевтический продукт, его предшественник, регуляторный ген или другой фактор, оказывающий терапевтическое действие при доставке in vivo в линию клеток, которая включает, не ограничиваясь ею, линию упаковочных клеток, для размножения терапевтических вирусных векторов.
В данной заявке на патент описаны разные векторы. Например, один вектор используют для доставки молекул определенных нуклеиновых кислот в линию упаковочных клеток для устойчивой интеграции в хромосому. Векторы указанных типов обычно определяются как комплементирующие плазмиды. Описанный здесь вектор другого типа переносит или доставляет молекулы нуклеиновых кислот в линию клеток (например, в линию упаковочных клеток) с целью размножения терапевтических вирусных векторов; поэтому указанные векторы обычно определяются как доставляющие плазмиды. Описанный здесь вектор третьего "типа" используют для переноса молекул нуклеиновых кислот, кодирующих терапевтические белки, полипептиды или регуляторные белки или являющихся регуляторными последовательностями, в специфические клетки или типы клеток нуждающегося в лечении субъекта; указанные векторы обычно определяются в данном описании как терапевтические вирусные векторы, рекомбинантные аденовирусные векторы или Ad-происходящие векторы и представляют вирусную частицу, инкапсулирующую нуклеиновую кислоту вируса, содержащую экспрессионный кластер для экспрессии терапевтического гена.
Термин "гомолог ДНК или нуклеиновой кислоты" означает нуклеиновую кислоту, которая включает заранее выбранную консервативную нуклеотидную последовательность, например последовательность, кодирующую терапевтический полипептид. Термин "по существу гомологичный" означает имеющий по крайней мере 80%, предпочтительно по крайней мере 90%, наиболее предпочтительно по крайней мере 95% гомологии, а также меньшее процентное значение гомологии или идентичности и сохраненную биологическую активность или функцию.
Термины "гомология" и "идентичность" часто используются взаимозаменяемо. Степень гомологии или идентичности можно определить, например, сравнивая информацию о последовательности при помощи компьютерной программы GAP. В программе GAP использован метод сравнительного анализа первичной структуры Needleman and Wunsch, J. Mol. Biol. 48:443 (1970), усовершенствованный Smith and Waterman, Adv. Appl. Math. 2:482 (1981). Кратко, программа GAP определяет сходство в виде количества одинаковых сравниваемых символов (то есть нуклеотидов или аминокислот), деленного на общее число символов в более короткой из двух последовательностей. Используемые по умолчанию предпочтительные параметры программы GAP включают: (1) единичную матрицу сравнения (включающую 1 для обозначения идентичности и 0 для обозначения отсутствия идентичности) и взвешенную матрицу сравнения Gribskov and Burgess, Nucl. Acids Res. 14:6745 (1986), описанную в издании Schwartz and Dayhoff, eds., Atlas of Protein Sequence and Structure, National Biomedical Research Foundation, pp.353-358 (1979); (2) штраф, равный 3,0, за каждый разрыв и дополнительный штраф, равный 0,10, за каждый символ в каждом разрыве; и (3) отсутствие штрафа за концевые разрывы. Две любые молекулы нуклеиновых кислот, имеющие нуклеотидные последовательности, "идентичные" по крайней мере на 80%, 85%, 90%, 95%, 96%, 97%, 98% или 99%, можно определить при помощи известных компьютерных алгоритмов, таких как программа "FAST A", используя, например, параметры по умолчанию, приведенные в статье Pearson and Lipman, Proc. Natl. Acad. Sci. USA 85:2444 (1988). Альтернативно для определения идентичности можно использовать функцию BLAST из базы данных Национального центра биотехнологической информации. Как правило, последовательности сравнивают с достижением согласования высшего порядка. Термин "идентичность" сам по себе имеет принятое в данной области значение, и величина идентичности может быть вычислена при помощи опубликованных методов. (См., например: Computational Molecular Biology, Lesk, A.M., ed., Oxford University Press, New York (1988); Smith, D.W., ed., Biocomputing: Informatics and Genome Projects, Academic Press, New York (1993); Griffin, A.M. and Griffin, H.G., eds., Computer Analysis of Sequence Data, Part I, Humana Press, New Jersey (1994); von Heinje, G., Sequence Analysis in Molecular Biology, Academic Press (1987); and Gribskov, M. and Devereux, J., eds., Sequence Analysis Primer, M Stockton Press, New York (1991)). Поскольку существует много методов определения идентичности между двумя полинуклеотидными или полипептидными последовательностями, термин "идентичность" хорошо известен специалистам в данной области (Carillo, H. & Lipton, D., SIAM J. Applied Math. 48:1073 (1988)). Методы, обычно используемые для определения идентичности или сходства между двумя последовательностями, включают, не ограничиваясь ими, методы, описанные в публикации Martin J. Bishop, ed., Guide to Huge Computers, Academic Press, San Diego (1994), and Carillo, H. & Lipton, D., SIAM J. Applied Math. 48:1073 (1988). Методы определения идентичности и сходства записаны в компьютерных программах. Компьютерные программы, содержащие предпочтительные методы определения идентичности и сходства между двумя последовательностями, включают, не ограничиваясь ими, пакет программ GCG (Devereux, J., et al., Nucleic Acids Research 12 (I):387 (1984)), BLASTP, BLASTN, FASTA (Atschul, S.F., et al., J. Molec. Biol. 215:403 (1990)).
Термин "идентичность" представляет сравнение между испытуемым и эталонным полипептидом или полинуклеотидом. Например, испытуемым полипептидом может быть любой полипептид, который на 90% или больше идентичен эталонному полипептиду. В используемом здесь значении термин "идентичен по крайней мере на 90%" означает процентную идентичность от 90 до 99,99 по отношению к эталонным полипептидам. В иллюстративных целях можно рассмотреть сравнение испытуемого и эталонного полинуклеотидов с длиной цепи 100 аминокислот, которые идентичны на уровне 90%. Не более 10% (то есть 10 из 100) аминокислот в испытуемом полипептиде отличается от аминокислот эталонных полипептидов. Аналогичное сравнение можно произвести между испытуемыми и эталонными полинуклеотидами. Такие различия можно представить в виде точковых мутаций, произвольно распределенных по всей длине аминокислотной последовательности, или их можно сгруппировать на одном или нескольких участках разной длины вплоть до максимально допустимых различий, например 10/100 аминокислот (примерно 90% идентичность). Различия определяются как замены или делеции нуклеотидов или аминокислот.
Термины "генотерапия" и "генная терапия" означают перенос гетерологичной ДНК в определенные клетки, клетки-мишени, млекопитающего, в частности человека, страдающего заболеванием или нарушением, которое хотят вылечить. ДНК вводят в выбранные клетки-мишени так, чтобы экспрессировать гетерологичную ДНК и продуцировать кодированный терапевтический продукт. Альтернативно гетерологичная ДНК может некоторым образом опосредовать экспрессию ДНК, кодирующей терапевтический продукт, такой как пептид или РНК, которая прямо или косвенно опосредует экспрессию терапевтического продукта. Генотерапию можно также использовать для замены дефектного гена нуклеиновой кислотой, кодирующей генный продукт, или для восполнения генного продукта, продуцируемого млекопитающим или клеткой, в которую введена нуклеиновая кислота. Введенная нуклеиновая кислота может кодировать терапевтическое соединение, такое как ингибитор фактора роста, фактор некроза опухоли или его ингибитор, например его рецептор, который обычно не продуцируется в организме млекопитающего, не продуцируется в терапевтически эффективных количествах или в терапевтически полезное время. Гетерологичную ДНК, кодирующую терапевтический продукт, можно модифицировать до введения в клетки пораженного хозяина, чтобы усилить или каким-либо другим образом изменить продукт или его экспрессию.
Термин "гетерологичная ДНК" означает ДНК, кодирующую РНК и белки, которые обычно не продуцируются in vivo клеткой, в которой она экспрессируется, или опосредующую или кодирующую посредники, которые изменяют экспрессию эндогенной ДНК, влияя на транскрипцию, трансляцию или других регулируемые биохимические процессы. Гетерологичную ДНК можно также определить как чужеродную ДНК. Любая ДНК, которую специалист в данной области считает гетерологичной или чужеродной для клетки, в которой она экспрессируется, является гетерологичной ДНК. Примеры гетерологичной ДНК включают, не ограничиваясь ими, ДНК, кодирующую прослеживаемые белки-маркеры, в частности белки, сообщающие лекарственную устойчивость, ДНК, кодирующую терапевтически эффективные вещества, например противораковые средства, ферменты и гормоны, и ДНК, кодирующую белки других типов, например антитела. Антитела, кодированные гетерологичной ДНК, могут быть секретированы или экспрессированы на поверхности клетки, в которую введена гетерологичная ДНК. Поэтому термин "гетерологичная ДНК" или "чужеродная ДНК" означает молекулу ДНК, отсутствующую в данной ориентации и положении, по сравнению с молекулой ДНК, обнаруженной в соответствующем аденовирусе дикого типа. Указанный термин может также означать молекулу ДНК из другого организма или вида (то есть экзогенную) или из другого серотипа аденовируса (Ad).
Термин "терапевтически эффективный продукт ДНК" означает продукт, кодированный гетерологичной ДНК, который экспрессируется после введения данной ДНК хозяину, эффективно ослабляя или устраняя симптомы и проявления наследственной или приобретенной болезни или излечивая указанное заболевание. Обычно ДНК, кодирующую требуемую гетерологичную ДНК, клонируют в плазмидном векторе и вводят обычными методами, такими как опосредуемое фосфатом кальция поглощение ДНК или микроинъекция ДНК в продуцирующие клетки, такие как упаковочные клетки. После амплификации в продуцирующих клетках векторы, содержащие гетерологичную ДНК, вводят в выбранные клетки-мишени.
Термин "экспрессирующий или доставляющий вектор" означает любую плазмиду или вирус, в который можно ввести чужеродную или гетерологичную ДНК для экспрессии в приемлемой клетке-хозяине, то есть белок или полипептид, кодированный данной ДНК, синтезируется в системе клетка-хозяин. Векторы, способные регулировать экспрессию сегментов ДНК (генов), кодирующих один или несколько белков, определяются в данном описании как "экспрессирующие векторы". Данное определение включает также векторы, которые позволяют клонировать кДНК (комплементарную ДНК), продуцированной из мРНК при помощи обратной транскриптазы.
Термин "ген" означает молекулу нуклеиновой кислоты, нуклеотидная последовательность которой кодирует РНК или полипептид. Ген может представлять РНК или ДНК. Гены могут включать области, предшествующие и следующие за кодирующей областью (лидерная и замыкающая последовательности), а также вставочные последовательности (интроны) между отдельными кодирующими сегментами (экзонами).
Термин "выделенный", используемый для определения молекулы нуклеиновой кислоты, полипептида или другой биомолекулы, означает, что нуклеиновая кислота или полипептид отделены от генного окружения, из которого получены данный полипептид или нуклеиновая кислота. Указанный термин означает также изменение по сравнению с естественным состоянием. Например, полинуклеотид или полипептид, обычно имеющийся в организме животного, не выделен, но тот же полинуклеотид или полипептид, отделенный от веществ, окружающих его в естественном состоянии, является "выделенным" в используемом здесь значении. Таким образом, полипептид или полинуклеотид, продуцированный и/или находящийся в рекомбинантной клетке-хозяине, считается выделенным. Кроме того, "выделенный полипептид" или "выделенный полинуклеотид" представляют полипептиды или полинуклеотиды, частично или полностью очищенные от рекомбинантной клетки-хозяина или от источника происхождения. Например, рекомбинантно продуцированный вариант соединения может быть в значительной степени очищен при помощи одностадийного метода, описанного в публикации Smith and Johnson, Gene 67:31-40 (1988). Термины "выделенный" и "очищенный" иногда употребляются взаимозаменяемо. Такой полинуклеотид может быть частью вектора и/или такой полинуклеотид или полипептид может быть частью композиции и все же оставаться выделенным, так как такой вектор или композиция не являются частью его естественного окружения.
Термин "выделенный полинуклеотид" означает нуклеиновую кислоту без кодирующих последовательностей тех генов, которые в природном геноме организма (если такие имеются) в непосредственной близости фланкируют ген, кодирующий представляющую интерес нуклеиновую кислоту. Выделенная ДНК может быть одноцепочечной или двухцепочечной и может представлять геномную ДНК, кДНК, рекомбинантную гибридную ДНК или синтетическую ДНК. Выделенная ДНК может быть идентична нативной последовательности ДНК или может отличаться от такой последовательности в результате делеции, добавления или замены одного или нескольких нуклеотидов.
Термин "выделенный" или "очищенный", относящийся к препаратам, полученным из биологических клеток или хозяев, означает любой клеточный экстракт, содержащий указанную ДНК или белок, включая неочищенный экстракт представляющей интерес ДНК или белка. Например, в случае белка очищенный препарат может быть получен при помощи одного метода или нескольких препаративных или биохимических методов, и представляющие интерес ДНК или белок могут присутствовать в указанных препаратах с разной степенью чистоты. Указанные методы могут включать, например, не ограничиваясь ими, фракционирование сульфатом аммония, гель-фильтрацию, ионообменную хроматографию, аффинную хроматографию, центрифугирование в градиенте плотности и электрофорез.
Препарат "в основной чистой" или "выделенной" ДНК или белка означает препарат, не содержащий природных веществ, с которыми такая ДНК или белок обычно взаимосвязаны в природе. Термин "по существу чистый" означает хорошо очищенный препарат, содержащий по крайней мере 95% представляющей интерес ДНК или белка.
Термин "линия упаковочных клеток" означает линию клеток, которая предоставляет недостающий генный продукт или его эквивалент.
Термин "вирусная частица аденовируса" означает минимальную структурную или функциональную единицу вируса. Вирус может представлять одну частицу, совокупность частиц или вирусный геном. Частица аденовируса (Ad) является относительно сложной и может быть разделена на разные субструктуры.
Термин "посттранскрипционный регуляторный элемент (PRE)" означает регуляторный элемент, обнаруженный в вирусной или клеточной матричной РНК, не подвергнутой сплайсингу, то есть представляет безинтронный транскрипт. Примеры включают, не ограничиваясь ими, вирус гепатита человека, вирус гепатита сурков, ген ТК и ген гистона мышей. PRE может находиться перед полиА-последовательностью и после последовательности гетерологичной ДНК.
Термин "псевдотипирование" означает получение аденовирусных векторов, имеющих модифицированный капсидный белок или капсидные белки из серотипа, отличающегося от серотипа самого вектора. В качестве примера можно привести получение векторной частицы на основе аденовируса 5, содержащей белок нити Ad37. Указанный процесс можно осуществлять, продуцируя аденовирусный вектор в линиях упаковочных клеток, экспрессирующих разные белки нитей.
"Представляющие интерес промоторы" могут быть индуцируемыми или конститутивными. Индуцируемые промоторы инициируют транскрипцию только в присутствии дополнительной молекулы; конститутивные промоторы не требуют присутствия какой-либо дополнительной молекулы для регуляции экспрессии гена. Регулируемый или индуцируемый промотор можно также определить как промотор, в котором скорость или степень связывания РНК-полимеразы и инициирования модулируются внешними стимулами. Такие стимулы включают, не ограничиваясь ими, разные соединения или композиции, свет, тепло, стресс и источники химической энергии. Индуцируемые, супрессируемые и репрессируемые промоторы считаются регулируемыми промоторами. Предпочтительными для данного изобретения промоторами являются промоторы, которые избирательно экспрессируются в клетках глаза, в частности в клетках фоторецепторов.
Термин "рецептор" означает биологически активную молекулу, которая специфически связывается с другими молекулами. Термин "рецепторный белок" можно использовать для более специального обозначения белковой природы специфичного рецептора.
Термин "рекомбинант" означает любое потомство, полученное методами рекомбнантных ДНК. Указанный термин можно также использовать для описания вируса, полученного рекомбинацией плазмид в упаковочной клетке.
Термин "трансген" или "терапевтическая молекула нуклеиновой кислоты" включает молекулы ДНК и РНК, кодирующие РНК или полипептид. Такие молекулы могут быть "нативными" или природными последовательностями; указанные молекулы могут быть также "ненативными" или "чужеродными", полученными из природного источника или рекомбинантными методами. Термин "трансген", который можно использовать взаимозаменяемо с термином "терапевтическая молекула нуклеиновой кислоты", часто используют для описания гетерологичного или чужеродного (экзогенного) гена, переносимого вирусным вектором и трансдуцируемого в клетку-хозяина. Терапевтические молекулы нуклеиновой кислоты включают антисмысловые последовательности или нуклеотидные последовательности, которые могут быть транскрибированы в антисмысловые последовательности. Все терапевтические нуклеотидные последовательности (или трансгены) включают молекулы нуклеиновых кислот, которые создают требуемый эффект в клетке или ядре клетки, в которую введены указанные терапевтические последовательности. Например, терапевтическая молекула нуклеиновой кислоты может включать последовательность нуклеотидов, кодирующую функциональный белок, предназначенный для введения в клетку, которая не способна продуцировать указанный функциональный белок.
Термин "стекловидное тело глаза" означает вещество, заполняющее камеру позади хрусталика глаза (то есть жидкая часть стекловидного тела или стекловидное тело).
Термин "промоторная область" означает часть ДНК гена, регулирующую транскрипцию ДНК, с которой она оперативно связана. Промоторная область включает специфические последовательности ДНК, которые достаточны для узнавания, связывания и инициации транскрипции РНК-полимеразой. Указанная часть промоторной области определяется как промотор. Кроме того, промоторная область включает последовательности, которые модулируют указанное узнавание, связывание и инициацию транскрипции РНК-полимеразой. Такие последовательности могут быть цис-действующими или реагирующими на транс-действующие факторы. В зависимости от характера регуляции промоторы могут быть конститутивными или регулируемыми.
Термин "оперативно связанный" означает, что последовательности или сегменты ковалентно связаны в один участок одноцепочечной или двухцепочечной ДНК, благодаря чему регуляторные последовательности в одном сегменте регулируют экспрессию, репликацию или подобные функции других сегментов. Однако два сегмента необязательно являются смежными.
Термин "упаковка" означает твердую матрицу или вещество, такое как стекло, пластик (например, полиэтилен, полипропилен или поликарбонат), бумагу, фольгу и подобный материал, способный удерживать внутри себя определенное количество полипептида, поликлонального антитела или моноклонального антитела по настоящему изобретению. Так, например, упаковка может представлять стеклянную пробирку, вмещающую миллиграммовые количества соответствующего полипептида, или такая упаковка может представлять лунку микротитрационного планшета, с поверхностью которой могут оперативно связываться микрограммовые количества соответствующего полипептида или антитела с возможностью иммунологического связывания антителом или антигеном, соответственно.
"Инструкции по использованию" обычно представляют материально представленное описание концентрации реагента или по крайней мере одного параметра метода исследования, такого как относительные количества смешиваемого реагента и образца, время выдерживания смесей реагента/образца, температура, условия использования буфера и тому подобные.
Термин "диагностическая система" в контексте настоящего изобретения включает также метку или индикатор, способный сигнализировать об образовании иммунного комплекса, содержащего молекулу полипептида или антитела по настоящему изобретению.
Термин "комплекс" в используемом здесь значении означает продукт реакции специфического связывания, такой как реакция между антителом и антигеном или реакция между рецептором и лигандом. Типичными комплексами являются продукты иммунной реакции.
Термины "метка" и "индикатор" в разных грамматических формах означают отдельные атомы и молекулы, которые прямо или косвенно участвуют в формировании обнаруживаемого сигнала, свидетельствующего о присутствии комплекса. Любая метка или индикатор могут быть присоединены или включены в молекулу экспрессированного белка, полипептида или антитела, которая является частью композиции, содержащей антитело или моноклональное антитело по настоящему изобретению, или использованы отдельно, и указанные атомы или молекулы могут быть использованы отдельно или в сочетании с дополнительными реагентами. Такие метки хорошо известны в клинической диагностической химии и входят в объем данного изобретения лишь тогда, когда они используются с методами и/или системами, включающими применение новых белков.
Обсуждение
В объем настоящего изобретения входит полипептид, показанный на фиг.1 в виде аминокислотных остатков 94-471 SEQ ID No.1 (например, SEQ ID No.12), а также полипептид, имеющий аминокислотную последовательность SEQ ID No.7, или полипептид, кодированный кДНК SEQ ID No.6. Помимо вариантов вышеуказанных полипептидов настоящее изобретение относится также к разным вариантам полинуклеотидов. Входящие в объем изобретения варианты полинуклеотидов могут представлять природный аллельный вариант полинуклеотида или неприродный вариант полинуклеотида. Таким образом, объектами настоящего изобретения являются полинуклеотид, кодирующий один и тот же полипептид, показанный в SEQ ID No.7, SEQ ID No.12, и полипептид, кодированный кДНК с SEQ ID No.6, а также варианты таких полинуклеотидов, которые кодируют ингибирующий развитие кровеносных сосудов фрагмент, производное или аналог полипептидов SEQ ID No.7 и SEQ ID No.12. Такие варианты нуклеотидов включают варианты с делецией, заменой, добавлением или инсерцией.
Как указывалось выше, полинуклеотид может иметь кодирующую последовательность, которая является природным аллельным вариантом кодирующей последовательности, показанной в SEQ ID No.6. Как известно в данной области, аллельный вариант представляет альтернативную форму полинуклеотидной последовательности с заменой, делецией или добавлением одного или нескольких нуклеотидов, которые по существу не изменяют функцию кодированного полипептида.
В используемом здесь значении термин Т1 относится как к полипептиду, имеющему аминокислотную последовательность SEQ ID No.13, так и к His6-меченому полипептиду, имеющему аминокислотную последовательность SEQ ID No.5. Термин Т2 в используемом здесь значении относится как к полипептиду, имеющему аминокислотную последовательность SEQ ID No.12, так и к His6-меченому полипептиду, имеющему аминокислотную последовательность SEQ ID No.7. Термин TrpRS в используемом здесь значении относится как к полипептиду, имеющему аминокислотную последовательность остатков 1-471 SEQ ID No.1, так и к His6-меченому полипептиду, имеющему аминокислотную последовательность SEQ ID No.1.
В объем настоящего изобретения входят также полинуклеотиды, в которых последовательность, кодирующая зрелый полипептид, может быть слита в одной рамке считывания с полинуклеотидом, который стимулирует экспрессию и секрецию полипептида из клетки-хозяина, например лидерная последовательность, которая действует в качестве секреторной последовательности, контролируя перенос полипептида из клетки. Полипептид, имеющий лидерную последовательность, является предбелком и может иметь лидерную последовательность, отщепляемую клеткой-хозяином с образованием зрелой формы полипептида. Полинуклеотиды могут также кодировать пробелок, который представляет зрелый белок плюс дополнительные 5'-концевые аминокислотные остатки. Зрелый белок, имеющий пропоследовательность, представляет пробелок и является неактивной формой белка. После отщепления пропоследовательности остается активный зрелый белок.
Так, например, полинуклеотид по настоящему изобретению может кодировать зрелый белок, белок, имеющий пропоследовательность, или белок, имеющий пропоследовательность и предпоследовательность (лидерная последовательность).
Полинуклеотиды по настоящему изобретению могут также иметь кодирующую последовательность, слитую в рамке считывания с маркерной последовательностью, которая позволяет производить очистку полипептида по настоящему изобретению. Маркерная последовательность может представлять гексагистидиновую метку, предоставляемую вектором pQE-9 для очистки зрелого полипептида, слитого с маркером в случае бактериального хозяина, либо маркерная последовательность может представлять гемагглютининовую (НА) метку в случае хозяина, являющегося млекопитающим, например, при использовании клеток COS-7. НА-метка соответствует эпитопу, происходящему из белка гемагглютинина гриппа (Wilson, I., et al., Cell, 37:767 (1984)).
Настоящее изобретение далее относится к полинуклеотидам, которые гибридизируются с вышеописанными последовательностями при наличии по крайней мере 50%, предпочтительно 70% идентичности между указанными последовательностями. Настоящее изобретение, в частности, относится к полинуклеотидам, которые гибридизируются в жестких условиях с вышеописанными полинуклеотидами. В используемом здесь значении термин "жесткие условия" означает, что гибридизация происходит только при наличии по крайней мере 95%, предпочтительно по крайней мере 97%, идентичности между последовательностями. Полинуклеотиды, которые гибридизируются с вышеописанными полинуклеотидами, в предпочтительном варианте осуществления изобретения кодируют полипептиды, которые сохраняют по существу такую же биологическую функцию или активность, что и зрелый полипептид, кодированный кДНК с SEQ ID No.6.
В случае полипептида SEQ ID No.7, SEQ ID No.12 или полипептида, кодированного полинуклеотидом SEQ ID No.6, термины "фрагмент", "производное" и "аналог" означают часть полипептида, которая сохраняет по существу такую же ангиостатическую (то есть ингибирующую развитие кровеносных сосудов) функцию или активность, что и указанный полипептид. Таким образом, термин "аналог" включает пробелок, который можно активировать отщеплением части пробелка для продуцирования ангиостатически активного зрелого полипептида.
Полипептид по настоящему изобретению может быть рекомбинантным полипептидом, природным полипептидом или синтетическим полипептидом, предпочтительно рекомбинантным полипептидом.
Ингибирующий развитие кровеносных сосудов фрагмент, производное или аналог полипептида SEQ ID No.7, SEQ ID No.12 либо полипептид, кодированный полинуклеотидом SEQ ID No.6, может представлять (i) элемент, в котором один или несколько аминокислотных остатков заменены консервативным или неконсервативным аминокислотным остатком (предпочтительно консервативным аминокислотным остатком), и такой замененный аминокислотный остаток может быть или не быть остатком, кодированным генетическим кодом, (ii) элемент, в котором один или несколько аминокислотных остатков включают заменяющую группу, (iii) элемент, в котором полипептид слит с другим соединением, таким как соединение, увеличивающее период полураспада полипептида (например, полиэтиленгликоль), или (iv) элемент, в котором дополнительные аминокислоты слиты с полипептидом, например, в виде лидерной или секреторной последовательности или последовательности, используемой для очистки полипептида или последовательности пробелка. Такие фрагменты, производные и аналоги должны быть известны специалистам в данной области на основании представленного описания изобретения.
Полипептиды и полинуклеотиды по настоящему изобретению предпочтительно получают в выделенной форме и очищают до гомогенного состояния.
В объем настоящего изобретения входят также векторы, включающие полинуклеотиды по данному изобретению, клетки-хозяева, созданные методами рекомбинантных ДНК при помощи векторов по данному изобретению, и способы получения полипептидов по данному изобретению методами рекомбинантных ДНК.
Клетки-хозяева создают методами рекомбинантных ДНК (трансдуцируют, трансформируют или трансфецируют) при помощи векторов по данному изобретению, которые могут представлять, например, клонирующий вектор или экспрессирующий вектор. Вектор может иметь, например, форму плазмиды, вирусной частицы, фага и т.д. Созданные указанными методами клетки-хозяева можно культивировать в обычных питательных средах, модифицированных должным образом для активации промоторов, отбора трансформантов или амплификации генов полипептида тРНК-синтетазы. Условия культивирования, такие как температура, рН и тому подобные, аналогичны ранее используемым для экспрессии в выбранных клетках-хозяевах и должны быть известны специалистам в данной области.
Полинуклеотиды по настоящему изобретению можно использовать для получения соответствующих полипептидов методами рекомбинантных ДНК. Так, например, полинуклеотидная последовательность может быть введена в любой из целого ряда экспрессирующих векторов, таких как векторы или плазмиды, предназначенные для экспрессии полипептида. Такие векторы включают хромосомные, нехромосомные и синтетические последовательности ДНК, например производные SV40, бактериальные плазмиды, фаговую ДНК, дрожжевые плазмиды, векторы, полученные из комбинаций плазмид и фаговой ДНК, вирусную ДНК, выделенную из таких вирусов как вирус коровьей оспы, аденовирус, поксвирус птиц и вирус псевдобешенства. Предпочтительным вектором является рЕТ20b. Однако можно использовать любую другую плазмиду или вектор, если они реплицируются и сохраняют жизнеспособность в данном хозяине.
Как указывалось выше, соответствующая последовательность ДНК может быть введена в вектор разными методами. Как правило, последовательность ДНК вводят в соответствующие сайты рестрикции эндонуклеазы методами, известными в данной области. Такие методы и многие другие должны быть известны специалистам в данной области.
Последовательность ДНК в экспрессирующем векторе оперативно связана с одной или несколькими соответствующими регулирующими экспрессию последовательностями (промотор) для управления синтезом мРНК. Типичные примеры таких промоторов включают промотор LTR или SV40, lac- или trp-промоторы E.coli, фаговый промотор лямбда-РL и другие промоторы, которые, как известно, регулируют экспрессию генов в прокариотических или эукариотических клетках или их вирусах. Экспрессирующий вектор имеет также сайт связывания рибосомы для инициации трансляции и терминатор транскрипции. Вектор может также включать соответствующие последовательности для амплификации экспрессии.
Кроме того, экспрессирующие векторы предпочтительно содержат ген для создания фенотипического признака с целью отбора трансформированных клеток-хозяев, такого как устойчивость к дигидрофолат-редуктазе или неомицину для культуры эукариотических клеток или устойчивость к тетрациклину или ампициллину в E.coli.
Вектор, содержащий соответствующую последовательность ДНК, описанную выше, а также соответствующий промотор или регуляторную последовательность можно использовать для трансформации соответствующего хозяина с целью экспрессии белка. Типичными примерами соответствующих хозяев являются бактериальные клетки, такие как E.coli, Salmonella typhimurium Streptomyces; клетки грибов, такие как дрожжи; клетки насекомых, такие как Drosophila и Sf9; животные клетки, такие как СНО, COS или меланома Бауса; растительные клетки и т.д. Принципы выбора соответствующего хозяина должны быть известны специалистам в данной области на основании представленного описания изобретения.
В объем настоящего изобретения, в частности, входят рекомбинантные конструкции, включающие одну или несколько последовательностей, всесторонне описанных выше. Указанные конструкции включают вектор, такой как плазмида или вирусный вектор, в который вводят последовательность по данному изобретению в прямой или обратной ориентации. В соответствии с предпочтительным объектом данного изобретения указанная конструкция далее включает регуляторные последовательности, в том числе, например, промотор, оперативно связанный с данной последовательностью. Специалистам в данной области известно большое число приемлемых векторов и промоторов, которые можно приобрести коммерческим путем. В качестве примера можно привести нижеследующие векторы, а именно бактериальные векторы: pQE70, pQE-9 (Qiagen), pBs, phagescript, PsiX174, pBluescript SK, pBsKS, pNH8a, pNH16a, pNH18a, pNH46a (Stratagene); pTrc99A, pKK223-3, pKK233-3, pDR540, PRIT5, (Pharmacia); эукариотические: pWLneo, pSV2cat, pOG44, pXT1, pSG (Stratagene), pSVK3, pBPV, PMSG, pSVL (Pharmacia) и pET20B. В одном предпочтительном варианте осуществления изобретения вектор представляет собой рЕТ20В. Однако можно использовать любую другую плазмиду или вектор, если они реплицируются и сохраняют жизнеспособность в данном хозяине.
Промоторные области можно выбрать из любого требуемого гена, используя хлорамфеникол-трансферазные (САТ) векторы или другие векторы с селектируемыми маркерами. Двумя приемлемыми векторами являются рКК232-8 и рСМ7. В частности, бактериальные промоторы включают lacI, lacZ, T3, Т7, gpt, лямбда-PR, PL и trp. Эукариотические промоторы включают предранний промотор CMV, тимидин-киназу HSV, ранний и поздний промотор SV40, LTR из ретровирусов и металлотионеин-I мышей. Принципы выбора соответствующего вектора и промотора хорошо известны специалисту в данной области.
В соответствии с другим вариантом осуществления настоящее изобретение относится к клеткам-хозяевам, содержащим вышеописанную конструкцию. Клетка-хозяин может представлять эукариотическую клетку высшего организма, такую как клетка млекопитающего, или эукариотическую клетку низшего организма, такую как дрожжевая клетка, либо клетка-хозяин может быть прокариотической клеткой, такой как бактериальная клетка. Указанную конструкцию можно ввести в клетку-хозяина при помощи трансфекции фосфатом кальция, трансфекции, опосредуемой DEAE-декстраном, или электропорации (Davis, L., Dibner, M., Battey, I., Basic Methods in Molecular Biology, (1986)).
Конструкции в клетках-хозяевах можно использовать обычным образом для продуцирования генного продукта, кодированного рекомбинантной последовательностью. Альтернативно полипептиды по данному изобретению можно получить синтетическим путем при помощи известных синтезаторов пептидов.
Белки могут быть экспрессированы в клетках млекопитающих, дрожжей, бактерий или других клетках под контролем соответствующих промоторов. Такие белки можно также получить в бесклеточных системах трансляции, используя РНК, происходящую от ДНК-конструкций по настоящему изобретению. Соответствующие клонирующие и экспрессирующие векторы, используемые с прокариотическими и эукариотическими клетками-хозяевами, описаны в публикации Sambrook, et al., Molecular Cloning: A Laboratory Manual, Second Edition, Cold Spring Harbor, N.Y., (1989), которая включена в данное описание изобретения в качестве ссылки.
Транскрипция ДНК, кодирующей полипептиды по настоящему изобретению, высшими эукариотами увеличивается при введении в вектор энхансерной последовательности. Энхансеры являются цис-действующими элементами ДНК, обычно имеющими длину от 10 до около 300 пар нуклеотидов (п.н.), которые воздействуют на промотор с целью увеличения его транскрипции. Примеры включают энхансер SV40 с поздней стороны начала репликации (100-270 п.н.), энхансер раннего промотора цитомегаловируса, энхансер полиомы с поздней стороны начала репликации и аденовирусные энхансеры.
Рекомбинантные экспрессирующие векторы обычно имеют начало репликации и селектируемые маркеры, обеспечивающие трансформацию клетки-хозяина, например устойчивый к ампициллину ген E.coli и ген TRP1 S.cerevisiae, и промотор, происходящий из сильно экспрессированного гена для управления транскрипцией структурной последовательности в «правой» области. Такие промоторы могут происходить из оперонов, кодирующих гликолитические ферменты, такие как 3-фосфоглицераткиназа (PGK),  -фактор, кислая фосфатаза или белки теплового шока. Гетерологичную структурную последовательность собирают в соответствующей фазе при помощи последовательностей, инициирующих и терминирующих трансляцию, и предпочтительно лидерной последовательности, способной регулировать секрецию транслированного белка в периплазматическое пространство или внеклеточную среду. Гетерологичная последовательность может необязательно кодировать слитый белок, включающий N-концевой идентифицирующий пептид, сообщающий требуемые характеристики, например стабилизацию или упрощенную очистку экспрессированного рекомбинантного продукта. -фактор, кислая фосфатаза или белки теплового шока. Гетерологичную структурную последовательность собирают в соответствующей фазе при помощи последовательностей, инициирующих и терминирующих трансляцию, и предпочтительно лидерной последовательности, способной регулировать секрецию транслированного белка в периплазматическое пространство или внеклеточную среду. Гетерологичная последовательность может необязательно кодировать слитый белок, включающий N-концевой идентифицирующий пептид, сообщающий требуемые характеристики, например стабилизацию или упрощенную очистку экспрессированного рекомбинантного продукта.
После трансформации приемлемого штамма-хозяина и выращивания указанного штамма до требуемой плотности клеток выбранный промотор активируют известными методами (например, путем изменения температуры или химической индукции), и клетки культивируют в течение дополнительного периода времени.
Клетки обычно собирают центрифугированием, разрушают физическими или химическими средствами и полученный неочищенный экстракт сохраняют для последующей очистки.
Микробные клетки, используемые для экспрессии белков, могут быть разрушены любым удобным методом, включая циклическое замораживание-оттаивание, обработку ультразвуком, механическое разрушение или использование веществ, лизирующих клетки.
Для экспрессии рекомбинантного белка можно также использовать разные системы культур клеток млекопитающих. Примеры экспрессирующих систем млекопитающих включают линии клеток COS-7 фибробластов почки обезьяны, описанные Gluzman, Cell, 23:175 (1981), и другие линии клеток, способные экспрессировать совместимый вектор, например линии клеток С127, 3Т3, СНО, HeLa и ВНК. Экспрессирующие векторы млекопитающих включают начало репликации, приемлемый промотор и энхансер, а также любые необходимые сайты связывания рибосомы, сайт полиаденилирования, донорский и акцепторный сайты сплайсинга, терминирующие транскрипцию последовательности и 5'-концевые фланкирующие нетранскрибируемые последовательности. Последовательности ДНК, происходящие из вирусного генома SV40, например начало SV40, ранний промотор, энхансер, сайты сплайсинга и полиаденилирования, можно использовать для получения требуемых нетранскрибируемых генетических элементов.
Полипептиды выделяют и очищают из культур рекомбинантных клеток описанными выше методами, включая преципитацию сульфатом аммония или этанолом, кислотную экстракцию, анионо- или катионообменную хроматографию, хроматографию на колонках с фосфоцеллюлозой, гидрофобную хроматографию, аффинную хроматографию, хроматографию на колонках с гидроксиапатитом и хроматографию на колонках с лектином. Во время очистки желательно использовать низкие концентрации (примерно 0,1-5 мМ) иона кальция (Price, et al., J. Biol. Chem., 244:917 (1969)). Для достройки конфигурации зрелого белка при необходимости можно использовать стадии повторной укладки белка. И наконец, на последних стадиях очистки можно использовать высокоэффективную жидкостную хроматографию (ВЭЖХ).
Полипептиды по настоящему изобретению могут представлять естественно очищенный продукт, продукт химического синтеза или продукт, полученный методами рекомбинантных ДНК из прокариотического или эукариотического хозяина (например, при помощи культуры бактериальных клеток, дрожжевых клеток, клеток высших растений, насекомых и млекопитающих). В зависимости от хозяина, используемого для продуцирования рекомбинантного продукта, полипептиды по настоящему изобретению могут быть гликозилированы углеводами млекопитающего или другого эукариота или не гликозилированы.
Полипептиды по настоящему изобретению могут быть модифицированы с целью улучшения стабильности и увеличения эффективности способами, известными в данной области. Например, L-аминокислоты могут быть заменены D-аминокислотами, аминоконец может быть ацетилирован или карбоксильный конец может быть модифицирован, например кэппирован этиламиногруппой (Dawson, D.W., et al., Mol. Pharmacol., 55:332-338 (1999)).
Полипептид по настоящему изобретению можно также использовать в генотерапии, осуществляя экспрессию такого полипептида in vivo.
Различные вирусные векторы, которые можно использовать в генотерапии, включают аденовирус, вирус герпеса, вирус коровьей оспы, аденоассоциированный вирус (AAV) или предпочтительно РНК-вирус, такой как ретровирус. Ретровирусный вектор предпочтительно является производным ретровируса мышей или птиц или представляет лентивирусный вектор. Предпочтительным ретровирусным вектором является лентивирусный вектор. Примеры ретровирусных векторов, в которые может быть введен один чужеродный ген, включают, не ограничиваясь ими: вирус лейкемии мышей Молонея (MoMuLV), вирус саркомы мышей Харвея (HaMuSV), вирус опухоли молочной железы мышей (MuMTV), SIV, BIV, HIV или вирус саркомы Рауса (RSV). Ряд дополнительных ретровирусных векторов может включать несколько генов. Все указанные векторы могут переносить или включать ген для селектируемого маркера, благодаря чему могут быть созданы и идентифицированы трансдуцированные клетки. Вводя представляющую интерес полипептидную последовательность, связывающую ДНК, выделенную из цинкового фингерпринта, в вирусный вектор вместе с другим геном, кодирующим лиганд для рецептора на специфической клетке-мишени, можно сделать данный вектор специфическим для мишени. Ретровирусные векторы можно сделать мишень-специфическими, вставляя, например, полинуклеотид, кодирующий белок. Предпочтительное направленное воздействие достигается благодаря использованию антитела, определяющего направление воздействия ретровирусного вектора. Специалисты в данной области должны знать или легко определить без ненужного экспериментирования специфические полинуклеотидные последовательности, которые можно вставить в ретровирусный геном для достижения специфически направленной доставки ретровирусного вектора, содержащего полинуклеотид белка, связывающего нуклеотид цинкового фингерпринта.
Так как рекомбинантные ретровирусы являются дефектными, они требуют помощи для продуцирования частиц инфекционного вектора. Такая помощь может быть предоставлена, например, при использовании линий клеток-хелперов, содержащих плазмиды, кодирующие все структурные гены ретровируса под контролем регуляторных последовательностей в LTR. В указанных плазмидах может отсутствовать нуклеотидная последовательность, которая позволяет упаковочному механизму распознавать транскрипт РНК для капсидирования. Линии клеток-хелперов с делециями упаковочного сигнала включают, не ограничиваясь ими, например,  2, РА317 и РА12. Указанные линии клеток продуцируют пустые вирионы, поскольку отсутствует упакованный геном. Если ретровирусный вектор введен в клетки, в которых присутствует упаковочный сигнал, но структурные гены заменены другими представляющими интерес генами, вектор может быть упакован и продуцирован в векторный вирион. Векторные вирионы, полученные указанным методом, затем можно использовать для инфицирования линии тканевых клеток, таких как клетки NIH 3T3, с целью продуцирования большого количества химерных ретровирусных вирионов. 2, РА317 и РА12. Указанные линии клеток продуцируют пустые вирионы, поскольку отсутствует упакованный геном. Если ретровирусный вектор введен в клетки, в которых присутствует упаковочный сигнал, но структурные гены заменены другими представляющими интерес генами, вектор может быть упакован и продуцирован в векторный вирион. Векторные вирионы, полученные указанным методом, затем можно использовать для инфицирования линии тканевых клеток, таких как клетки NIH 3T3, с целью продуцирования большого количества химерных ретровирусных вирионов.
Другой системой направленной доставки для полинуклеотидов, кодирующих полипептиды, связывающие ДНК, выделенную из цинкового фингерпринта, является система на основе коллоидной дисперсии. Системы на основе коллоидной дисперсии включают макромолекулярные комплексы, нанокапсулы, микросферы, гранулы и липидные системы, включая эмульсии масла в воде, мицеллы, смешанные мицеллы и липосомы. Предпочтительной коллоидной системой по данному изобретению является липосома. Липосомы представляют собой искусственные мембранные везикулы, которые являются полезными носителями in vitro и in vivo. Установлено, что крупные однослойные везикулы (LUV) размером 0,2-4,9 мкм могут инкапсулировать достаточное количество водного буфера, содержащего большие макромолекулы. РНК, ДНК и интактные вирионы могут быть инкапсулированы в водной среде внутри липосом для доставки в клетки в биологически активной форме (Fraley, et al., Trends Biochem. Sci., 6:77, (1981)). Помимо клеток млекопитающих липосомы использовали для доставки полинуклеотидов в растительные, дрожжевые и бактериальные клетки. Чтобы липосома была эффективным носителем гена, должны быть выполнены нижеследующие требования: (1) представляющие интерес гены должны быть инкапсулированы с высокой степенью эффективности без уменьшения их биологической активности; (2) предпочтительное и значительное связывание должно происходить с клеткой-мишенью по сравнению с клетками, не являющимся мишенями; (3) доставка водного содержимого везикулы в цитоплазму клетки-мишени должна производиться с высокой степенью эффективности; и (4) должна быть обеспечена точная и эффективная экспрессия генетической информации (Mannino, et al., Biotechniques, 6:682, (1988)).
Композиция, содержащая липосомы, обычно представляет комбинацию фосфолипидов, в частности фосфолипидов с высокой температурой фазового перехода, со стероидами, такими как холестерин. Можно также использовать другие фосфолипиды или липиды. Физические характеристики липосом зависят от рН, ионной силы и наличия двухвалентных катионов.
Примеры липидов, используемых для получения липосом, включают фосфатидильные соединения, такие как фосфатидилглицерин, фосфатидилхолин, фосфатидилсерин, фосфатидилэтаноламин, сфинголипиды, цереброзиды и ганглиозиды. Особенно полезными являются диацилфосфатидилглицерины, в которых липидная часть имеет 14-18 атомов углерода, в частности 16-18 атомов углерода, и является насыщенной. Иллюстративные фосфолипиды включают яичный фосфатидилхолин, дипальмитоилфосфатидилхолин и дистеароилфосфатидилхолин.
Направленное воздействие липосом классифицировано с учетом анатомических и механистических факторов. Анатомическая классификация основана на уровне селективности, такой как, например, органоспецифическая, клеткоспецифическая и органеллоспецифическая селективность. Различают пассивное или активное механистическое направленное воздействие. В пассивном направленном воздействии использована природная тенденция липосом распространяться в клетках ретикулоэндотелиальной системы (RES) органов, содержащих синусоидальные капилляры. Активное направленное воздействие, с другой стороны, включает изменения липосомы путем связывания указанной липосомы со специфическим лигандом, таким как моноклональное антитело, сахар, гликолипид или белок, либо путем изменения состава или величины липосомы для достижения направленного воздействия на органы и клетки, не являющиеся природными местами локализации.
Поверхность системы направленной доставки можно модифицировать разными способами. В случае липосомной системы направленной доставки липидные группы могут быть введены в липидный бислой липосомы для сохранения устойчивой связи направляющего лиганда с липосомным бислоем. Для присоединения липидных цепей к направляющему лиганду можно использовать разные связующие группы.
Соединения, связанные с поверхностью системы направленной доставки, как правило, представляют лиганды и рецепторы, которые позволяют системе направленной доставки находить требуемые клетки и проникать внутрь указанных клеток. Лиганд может быть любым представляющим интерес соединением, связывающимся с другим соединением, таким как рецептор.
Поверхностные мембранные белки, связывающиеся с конкретными молекулами-эффекторами, обычно определяются как рецепторы. В настоящем изобретении предпочтительными рецепторами являются антитела. Антитела можно использовать для нацеливания липосом в специфические лиганды на поверхности клеток. Например, некоторые антигены, экспрессируемые в опухолевых клетках и определяемые как опухолевоспецифические антигены (ТАА), можно использовать для нацеливания липосом, содержащих антитело и белок, связывающий нуклеотид цинкового фингерпринта, непосредственно на злокачественную опухоль. Так как генный продукт белка, связывающего нуклеотид цинкового фингерпринта, может неизбирательно воздействовать на клетки разного типа, система направленной доставки является более эффективной по сравнению с произвольно инъецируемыми неспецифическими липосомами. Поликлональные или моноклональные антитела можно ковалентно связывать с бислоем липосомы разными способами. Антителоспецифические липосомы могут включать моноклональные или поликлональные антитела или их фрагменты, такие как Fab или F(ab')2, если они эффективно связываются с антигенным эпитопом на клетках-мишенях. Липосомы могут также направленно воздействовать на клетки, экспрессирующие рецепторы гормонов или других сывороточных факторов.
Специалистам в данной области известны вирусные и невирусные методы, приемлемые для введения молекулы нуклеиновой кислоты в клетку-мишень. В данной области хорошо известен метод генетического воздействия на первичные опухолевые клетки. Клетка может быть генетически модифицирована при помощи одного или нескольких методов, хорошо известных в области генотерапии (Mulligan, R.C.Human Gene Therapy, 5 (4):543-563 (1993)). Методы вирусной трансдукции могут включать использование рекомбинантного ДНК- или РНК-вируса, содержащего нуклеотидную последовательность, которая вызывает или ингибирует экспрессию белка, обладающего активностью сиалилтрансферазы, для инфицирования клетки-мишени. Приемлемый ДНК-вирус, пригодный для использования в настоящем изобретении, включает, не ограничиваясь ими, аденовирус (Ad), аденоассоциированный вирус (AAV), вирус герпеса, вирус коровьей оспы или вирус полиомы. Приемлемый РНК-вирус, пригодный для использования в настоящем изобретении, включает, не ограничиваясь ими, ретровирус или вирус Синдбиса. Специалистам в данной области известно о существовании нескольких таких ДНК- и РНК-вирусов, которые пригодны для использования при осуществлении настоящего изобретения.
Аденовирусные векторы пригодны для переноса гена в эукариотические клетки с целью исследования экспрессии гена в эукариотической клетке при создании вакцины и в животных моделях. Ad-опосредуемая генотерапия также находит применение для лечения людей, например для переноса муковисцидозного тела трансмембранного регулятора проводимости (CFTR) в легкое. Способы введения рекомбинантного аденовируса (Ad) в разные ткани in vivo включают, например, внутритрахеальную инстилляцию, внутримышечную инъекцию, периферическую внутривенную инъекцию и стереотактическую инокуляцию в головной мозг. Аденовирусный вектор хорошо известен специалистам в данной области и пригоден для использования при осуществлении настоящего изобретения.
Аденоассоциированный вирус (AAV) недавно был предложен в качестве системы переноса гена с возможностью применения в генотерапии. Как описано в научной литературе, AAV дикого типа характеризуется высокой эффективностью, широким кругом хозяев и специфичностью интеграции в геном клетки-хозяина. Вирус простого герпеса типа 1 (HSV-1) является привлекательным в качестве векторной системы, особенно при использовании в нервной системе, благодаря его нейротропным свойствам. Вирус коровьей оспы, относящийся к семейству поксвирусов, также был разработан в качестве экспрессирующего вектора. Все вышеуказанные векторы хорошо известны специалистам в данной области и пригодны для использования при осуществлении настоящего изобретения.
Ретровирусные векторы способны инфицировать большое количество клеток-мишеней и интегрировать в геном клеток. Ретровирусы были получены в виде векторов для переноса гена несколько раньше, чем другие вирусы, и впервые были успешно использованы для маркировки гена и трансдукции кДНК аденозиндеаминазы (ADA) в лимфоциты человека. Предпочтительными ретровирусами являются лентивирусы. В предпочтительных вариантах осуществления изобретения ретровирус выбирают из группы, включающей HIV, BIV и SIV.
"Невирусные" методы доставки, которые используются в генотерапии или предлагаются для нее, включают комплексы ДНК-лиганд, комплексы аденовирус-лиганд-ДНК, прямую инъекцию ДНК, преципитацию CaPO4, методы выстреливания гена, электропорацию, липосомы и липофекцию. Все указанные методы хорошо известны специалистам в данной области и пригодны для использования при осуществлении настоящего изобретения. Специалистам в данной области должны быть известны другие приемлемые методы, при этом совершенно очевидно, что настоящее изобретение может быть осуществлено при использовании любых имеющихся методов трансфекции. Некоторые такие методы применялись специалистами в данной области с разной степенью успеха. Для выполнения липофекции выделенную молекулу ДНК инкапсулируют в липосомной частице и указанную липосомную частицу вводят в соприкосновение с мембраной клетки-мишени. Липосомы являются самособирающимися коллоидными частицами, в которых липидный бислой, состоящий из амфифильных молекул, таких как фосфатидилсерин или фосфатидилхолин, инкапсулирует часть окружающей среды таким образом, что липидный бислой окружает гидрофильную внутреннюю часть. Можно получить однослойные или многослойные липосомы, внутри которых будет находиться требуемое химическое вещество, лекарственное средство или, как в случае настоящего изобретения, выделенная молекула ДНК.
Клетки могут быть трансфецированы in vivo, ex vivo или in vitro. Клетки могут быть трансфецированы в виде первичных клеток, взятых у субъекта, или в виде линии клеток, выделенной из первичных клеток, и необязательно аутологичных в отношении субъекта, которому указанные клетки будут в конечном счете введены. После трансфекции ex vivo или in vivo клетки могут быть имплантированы хозяину.
Для достижения транскрипции нуклеиновой кислоты по настоящему изобретению в клетке-мишени используют регуляторную область транскрипции, способную вызывать экспрессию гена в клетке-мишени. Регуляторная область транскрипции включает промотор, энхансер, молчащую последовательность или репрессор и функционально связана с нуклеиновой кислотой по настоящему изобретению. Регуляторная область транскрипции предпочтительно вызывает сильную экспрессию гена в клетке-мишени. Регуляторные области транскрипции, пригодные для использования в настоящем изобретении, включают, не ограничиваясь ими, предранний энхансер/промотор цитомегаловируса человека (CMV), ранний энхансер/промотор SV40, промотор вируса полиомы JC, промотор альбумина, промотор PGK и  -актина, связанный с энхансером CMV. -актина, связанный с энхансером CMV.
Векторы по настоящему изобретению можно создать при помощи стандартных методов рекомбинантных ДНК, хорошо известных специалистам в данной области. Описание таких методов можно найти в справочной литературе по молекулярной биологии, включающей издания Sambrook, et al., Molecular Cloning: A Laboratory Manual, Cold Spring Harbor Laboratory Press (1989), D.Goeddel, ed., Gene Expression Technology, Methods in Enzymology series, Vol.185, Academic Press, San Diego, CA (1991), and Innis, et al., PCR Protocols: A Guide to Methods and Applications, Academic Press, San Diego, CA (1990).
Полипептид или нуклеиновую кислоту по настоящему изобретению можно ввести в клетку-мишень in vivo при помощи разных методов, известных специалистам в данной области.
Векторы по настоящему изобретению можно вводить перорально, парентерально, в виде ингаляции, ректально или местно в дозированных лекарственных формах, содержащих известные фармацевтически приемлемые носители, адъюванты и наполнители. Термин "парентеральное введение" при использовании в данном описании означает подкожное, внутривенное, внутримышечное, внутригрудинное или внутрибрюшинное введение или вливание. Суппозитории для ректального введения лекарственного средства можно получить, смешивая лекарственное средство с приемлемым нераздражающим наполнителем, таким как масло какао и полиэтиленгликоли, которые являются твердыми при обычных температурах и становятся жидкими при температуре в толстой кишке, где они плавятся и высвобождают лекарственное средство.
Схему лекарственного лечения нарушения или заболевания векторами и/или композициями по данному изобретению выбирают с учетом разных факторов, которые включают тип заболевания, возраст, вес тела, пол, состояние здоровья пациента, серьезность заболевания, способ введения и используемое конкретное соединение. Таким образом, схема лекарственного лечения может изменяться в широких пределах, но может быть определена стандартными методами.
Фармацевтически активные соединения по данному изобретению могут быть подвергнуты обработке известными фармацевтическими методами для получения лекарственных композиций или средств для введения пациентам, включая человека и других млекопитающих. Фармацевтическая композиция для перорального введения может представлять, например, жидкость, глазную вкладку, капсулу, таблетку, суспензию. Такую фармацевтическую композицию предпочтительно получают в форме дозированного лекарственного средства, содержащего требуемое количество активного средства. Например, указанные средства могут содержать вектор в количестве около 103-1015 вирусных частиц, предпочтительно около 106-1012 вирусных частиц. Приемлемая суточная доза для человека или другого млекопитающего может изменяться в широких пределах в зависимости от состояния пациента и других факторов, но также может быть определена известными методами. Активное вещество можно вводить в виде инъекции в составе композиции, содержащей фармакологически приемлемые носители, такие как физиологический раствор, декстроза или вода.
Хотя нуклеиновые кислоты и/или векторы по данному изобретению можно вводить в виде единственного активного фармацевтического средства, указанные вещества можно также использовать в сочетании с одним или несколькими другими векторами по данному изобретению или другими лекарственными средствами. При комбинированной терапии терапевтические средства могут входить в состав отдельных композиций, вводимых одновременно или в разное время, или в состав одной композиции.
Полипептид по настоящему изобретению можно также использовать в сочетании с приемлемым фармацевтическим носителем. Такие композиции включают терапевтически эффективное количество белка и фармацевтически приемлемый носитель или наполнитель. Такой носитель включает, не ограничиваясь ими, физиологический раствор, забуференный физиологический раствор, декстрозу, воду, глицерин, этанол и комбинации указанных веществ. Препарат должен соответствовать способу введения.
Данное изобретение относится также к фармацевтическому набору или комплекту, включающему одну или несколько емкостей, заполненных одним или несколькими ингредиентами фармацевтических композиций по данному изобретению. Такой набор могут сопровождаться уведомлением государственного агентства, контролирующего изготовление, применение или продажу фармацевтических препаратов или биологических продуктов, о разрешении, выданном данным агентством на изготовление, применение или продажу указанного лекарственного средства для введения человеку. Кроме того, полипептид по настоящему изобретению можно использовать вместе с другими терапевтическими соединениями.
Фармацевтические композиции можно вводить обычным способом, например внутрь глаза, в виде глазных капель и системного введения. Количества полипептидов, происходящих из тРНК-синтетазы, и режимы их введения зависят от ряда факторов, таких как способ введения, характер заболевания, веса тела нуждающегося субъекта и суждение лечащего врача. Как правило, полипептид вводят в терапевтически эффективных дозах, равных по крайней мере приблизительно 10 мкг/кг массы тела. Приемлемая доза предпочтительно составляет от около 10 мкг/кг массы тела до около 1 мг/кг массы тела в сутки с учетом частоты и способов введения, симптомов заболевания и т.д.
Ангиостатическое лечение trpRS можно использовать для противодействия ангиогенной активности эндогенных и экзогенных ангиогенных факторов, предотвращения дальнейшего роста или даже достижения регрессивного развития твердых опухолей, так как развитие кровеносных сосудов и образование новых сосудов являются важными стадиями роста твердой опухоли. Такие методы лечения можно также использовать для лечения ревматоидного артрита, псориаза и диабетической ретинопатии, которые характеризуются аномальным развитием кровеносных сосудов.
Данное изобретение относится к композициям, содержащим терапевтически эффективные количества и концентрации векторов на основе рекомбинантного аденовируса для доставки терапевтических генных продуктов в клетки, экспрессирующие конкретный рецептор. Указанные клетки включают клетки глаза. Особый интерес представляют фоторецепторные клетки глаза. Введение можно осуществлять любыми способами, обеспечивающими контактирование с фоторецепторами. Для получения доступа к фоторецепторным клеткам предпочтительные режимы введения включают, не ограничиваясь ими, инъекцию под сетчатку или в стекловидное тело.
Композиции на основе рекомбинантного вируса могут быть также предназначены для имплантации в переднюю или заднюю камеру глаза, предпочтительно в полость стекловидного тела, в виде препаратов пролонгированного действия, которые адсорбируются биоразрушаемыми подложками, включающими коллагеновые губки, или в виде липосом. Препараты пролонгированного действия могут быть предназначены для высвобождения в виде многократных доз в течение определенного периода времени, например в течение месяца или до года. Так, например, можно получить липосомы, которые в результате одной инъекции позволяют ввести в общей сложности количество, составляющее от около двух до около пяти или больше однократных доз.
Векторы получают в офтальмологически приемлемом носителе для внутриглазного введения, предпочтительно для введения в стекловидное тело, в объеме от около 0,05 мл до 0,15 мл, предпочтительно от около 0,05 до 0,1 мл.
Композиции могут быть получены в запаянной стерильной ампуле, содержащей активное вещество в количестве, которое при внутриглазном введении обеспечивает достаточное количество вирусных частиц для фоторецепторов в объеме от около 50 до 150 мкл, содержащем по крайней мере около 107, более предпочтительно по крайней мере около 108 бляшкообразующих единиц. Таким образом, ампулы обычно содержат около 0,15 мл композиции.
Для получения таких композиций вирусные частицы диализуют в офтальмологически приемлемом носителе либо вирусные частицы концентрируют и/или смешивают с указанным носителем. Полученная смесь может представлять раствор, суспензию или эмульсию. Кроме того, вирусные частицы могут быть получены в виде отдельного фармацевтически активного ингредиента в композиции или могут быть объединены с другими активными средствами, предназначенными для лечения конкретного заболевания.
Для введения путем внутриглазной инъекции или в виде глазных капель используют приемлемые носители, которые включают, не ограничиваясь ими, физиологический раствор, физиологический раствор с фосфатным буфером (PBS), сбалансированный солевой раствор (BSS), раствор лактата Рингера и растворы, содержащие загустители и солюбилизаторы, такие как глюкоза, полиэтиленгликоль, полипропиленгликоль и их смеси. Липосомные суспензии также могут быть фармацевтически приемлемыми носителями. Указанные суспензии могут быть получены методами, хорошо известными специалистам в данной области. Офтальмологически приемлемые носители хорошо известны. Растворы или смеси, предназначенные для применения в офтальмологии, могут быть получены в виде 0,01%-10% изотонических растворов с рН около 5-7 при использовании соответствующих солей (см., например, патент США №5116868, в котором описаны типичные композиции офтальмологических растворов для промывания и местного применения). Такие растворы, в которых показатель рН доведен примерно до 7,4, содержат, например, 90-100 мМ хлорида натрия, 4-6 мМ двухосновного фосфата калия, 4-6 мМ двухосновного фосфата натрия, 8-12 мМ цитрата натрия, 0,5-1,5 мМ хлорида магния, 1,5-2,5 мМ хлорида кальция, 15-25 мМ ацетата натрия, 10-20 мМ D,L- -гидроксибутирата натрия и 5-5,5 мМ глюкозы. -гидроксибутирата натрия и 5-5,5 мМ глюкозы.
Композиции могут быть получены с использованием носителей, защищающих активное вещество от быстрого выведения из организма, например в виде препаратов пролонгированного действия или препаратов с покрытием. Такие носители входят в состав препаратов с регулируемым высвобождением, которые включают, не ограничиваясь ими, микроинкапсулированные системы доставки, биологически разрушаемые и биологически совместимые полимеры, такие как этиленвинилацетат, полиангидриды, полигликолевая кислота, полиортоэфиры, полимолочная кислота и имплантаты других типов, которые могут быть введены непосредственно в переднюю или заднюю камеру или полость стекловидного тела глаза. Указанные композиции можно также вводить в виде гранул, таких как гранулы ELVAX® (сополимер этилена и винилацетата, DuPont).
В качестве фармацевтически приемлемых носителей можно также использовать липосомные суспензии, включающие липосомы для направленной доставки в ткани. Например, липосомные препараты можно получить методами, хорошо известными специалистам в данной области (см., например, Kimm et al., Bioch. Bioph. Acta 728:339-398 (1983); Assil et al., Arch Ophthalmol. 105:400 (1987); и патент США №4522811). Вирусные частицы могут быть инкапсулированы в водную фазу липосомных систем.
Активные вещества или лекарственные средства могут быть также смешаны с другими активными веществами, которые не ухудшают требуемое действие, или с веществами, которые дополняют требуемое действие или оказывают другое действие, включая вязкоупругие вещества, такие как гиалуроновая кислота, продаваемая под товарным знаком HEALON® (Pharmacia, Inc), которая представляет высокомолекулярный раствор примерно 3 миллионов фракций гиалуроната натрия (см., например, патенты США №№5292362, 5282851, 5273056, 5229127, 4517295 и 4328803), смолы, продаваемые под товарным знаком VISCOAT® (фирмы Alcon Surgical, Inc), которые являются фторсодержащими (мет)акрилатами, такими как 1Н,1Н,2Н,2Н-гептадекафтордецилметакрилат (см., например, патенты США №№5278126, 5273751 и 5214080), смолы, продаваемые под товарным знаком ORCOLON® (Optical Radiation Corporation, см., например, патент США №5273056), метилцеллюлозы, метилгиалуронаты, полиакриламиды и полиметакриламиды (см., например, патент США №5273751). Вязкоупругие вещества, обычно используемые в количествах около 0,5-5,0%, предпочтительно 1-3 мас.% конъюгата, служат для нанесения покрытия и защиты подвергаемых воздействию тканей. Композиции могут также включать краситель, такой как метиленовый синий, или другой инертный краситель, благодаря чему можно видеть инъецируемую в глаз композицию. Указанная композиция может содержать дополнительные активные вещества.
Композиции могут находиться в ампулах, одноразовых шприцах или пробирках на одну или несколько доз, изготовленных из стекла, пластика или другого приемлемого материала. Упакованные таким образом композиции могут представлять наборы. Такие наборы, в частности, могут включать пробирки, ампулы или другие емкости, предпочтительно одноразовые пробирки, содержащие достаточное количество композиции для введения примерно 0,100 мл, и одноразовые иглы, предпочтительно отдельно запечатанные иглы 25-33 или меньшего калибра.
И наконец, указанные композиции могут быть упакованы как отдельные изделия, включающие упаковочный материал, обычно пробирку, в которой находится офтальмологически приемлемая композиция, содержащая полипептид по настоящему изобретению, и наклейку, указывающую на терапевтическое применение данной композиции.
Настоящим изобретением предусмотрены наборы для осуществления способов по данному изобретению. Указанные наборы включают одну или несколько емкостей, таких как запаянные ампулы, с достаточным количеством композиции для введения однократной дозы, и одну или несколько игл, таких как отдельно запечатанные иглы 25-33 или меньшего калибра, предпочтительно иглы 33 или меньшего калибра, вместе с точно откалиброванными шприцами или другим точно откалиброванным устройством для доставки лекарственного средства, пригодным для инъекций в стекловидное тело.
Композицию предпочтительно вводят в виде внутриглазной инъекции, хотя другие способы введения также могут быть эффективными, если достаточное количество соединения достигает полости стекловидного тела. Внутриглазные инъекции можно делать в стекловидное тело, жидкую часть стекловидного тела или наружные слои глаза, например, под конъюктиву или в сумку, либо наносить местно на роговицу при использовании проникающего препарата.
Для каждого конкретного пациента специфический режим лекарственного лечения подлежит адаптации с течением времени в зависимости от потребностей пациента и профессионального суждения лица, занимающегося введением или следящего за введением рекомбинантных вирусов. Приведенные в данном описании изобретения концентрации и количества являются только иллюстративными и не ограничивают объем способов, изложенных в формуле изобретения.
Нижеследующие примеры приведены для иллюстрации конкретных вариантов осуществления изобретения и разных способов их применения. Указанные примеры служат только для иллюстративных и разъяснительных целей и не ограничивают объем изобретения.
Пример 1. Получение не содержащей эндотоксина рекомбинантной TrpRS
Не содержащую эндотоксина рекомбинантную TrpRS человека продуцировали следующим образом. Получали плазмиды, кодирующие полноразмерную TrpRS (аминокислотные остатки 1-471 SEQ ID No.1) или усеченную TrpRS, далее определяемую как Т2 (SEQ ID No.12), состоящую в основном из остатков 94-471 SEQ ID No.1 (то есть остатки 94-471 полноразмерной TrpRS), и вторую усеченную TrpRS, далее определяемую как Т1 (SEQ ID No.13), состоящую в основном из остатков 71-471 SEQ ID No.1. Каждая плазмида также кодировала С-концевую метку, включающую шесть остатков гистидина (например, аминокислотные остатки 472-484 SEQ ID No.1) и начальный остаток метионина. His6-меченая Т1 имеет аминокислотую последовательность SEQ ID No.5, в то время как His6-меченая Т2 имеет аминокислотную последовательность SEQ ID No.7.
Вышеуказанные плазмиды вводили в штамм BL 21 (DE 3) E.coli (Novagen, Madison, WI). Аналогичным образом получали зрелый EMAPII человека, также кодирующий С-концевую метку из шести остатков гистидина. Сверхэкспрессию рекомбинантной TrpRS индуцировали, обрабатывая клетки изопропил- -D-тиогалактопиранозидом в течение 4 часов. Затем клетки лизировали и белки из супернатанта очищали на колонках с никелем для аффинной хроматографии HIS -D-тиогалактопиранозидом в течение 4 часов. Затем клетки лизировали и белки из супернатанта очищали на колонках с никелем для аффинной хроматографии HIS BIND® (Novagen) в соответствии с методикой, предложенной изготовителем. После очистки белки TrpRS инкубировали с физиологическим раствором с фосфатным буфером (PBS), содержащим 1 мкМ ZnSO4, и удаляли свободный Zn2+ (Kisselev et al., Eur. J. Biochem. 120:511-17 (1981)). BIND® (Novagen) в соответствии с методикой, предложенной изготовителем. После очистки белки TrpRS инкубировали с физиологическим раствором с фосфатным буфером (PBS), содержащим 1 мкМ ZnSO4, и удаляли свободный Zn2+ (Kisselev et al., Eur. J. Biochem. 120:511-17 (1981)).
Эндотоксин удаляли из образцов белка при помощи фазового разделения с использованием Тритона Х-114 (Liu et al., Clin. Biochem. 30:455-63 (1997)). Анализ коагуляции в геле E-TOXATE® (Sigma, St. Louis, MO) позволил установить, что образцы белка содержат менее 0,01 единицы эндотоксина на мл. Концентрацию белка определяли при помощи анализа Брэдфорда (Bio-Rad, Hercules, CA), используя в качестве эталона альбумин бычьей сыворотки (BSA).
Пример 2. Расщепление TrpRS человека PMN-эластазой
В данном примере исследовано расщепление полноразмерной TrpRS человека PMN-эластазой. TrpRS обрабатывали PMN-эластазой в PBS (рН 7,4) при соотношении протеаза:белок, равном 1:3000, в течение 0, 15, 30 или 60 минут. Расщепленные образцы анализировали в 12,5% полиакриламидных гелях в присутствии додецилсульфата натрия (SDS). В результате расщепления PMN-эластазой полноразмерной TrpRS с М.н. около 53 кДа, кодированной нуклеотидами 3428-4738 ДНК (SEQ ID No.2), получали главный фрагмент с М.н. около 46 кДа (SEQ ID No.5, Т1, имеющая С-концевую гистидиновую метку) и минорный фрагмент с М.н. около 43 кДа (SEQ ID No.7, Т2, имеющая С-концевую гистидиновую метку).
Результаты анализа методом Вестерн-блоттинга с использованием антител против His6-метки карбоксильного конца рекомбинантного белка TrpRS показывали, что оба фрагмента имеют His6-метку у карбоксильного конца. Таким образом, укорочен только аминоконец двух фрагментов TrpRS. Аминоконцевые последовательности фрагментов TrpRS определяли при помощи деградации по Эдману с использованием секвенатора ABI модели 494. Результаты секвенирования указанных фрагментов показали, что аминоконцевые последовательности представляли S-N-H-G-P (SEQ ID No.8) и S-A-K-G-I (SEQ ID No.9), свидетельствуя о том, что аминоконцевые остатки главного и минорного фрагментов TrpRS находятся соответственно в положениях 71 и 94 полноразмерной TrpRS. Указанные конструкции TrpRS человека показаны на фиг.1. В рамках показаны характеристические последовательности -HVGH- (SEQ ID No.10) и -KMSAS- (SEQ ID No.11).
Ангиостатическую активность главного и минорного фрагментов TrpRS исследовали при помощи анализов развития кровеносных сосудов. В указанных анализах использованы рекомбинантные формы главного и минорного фрагментов TrpRS SEQ ID No.5 и SEQ ID No.7, имеющие С-концевые гистидиновые метки (амнокислотные остатки 472-484 SEQ ID No.1). Оба фрагмента TrpRS были способны ингибировать развитие кровеносных сосудов.
Пример 3. Сильное ангиостатическое действие усеченных фрагментов TrpRS, препятствующее развитию кровеносных сосудов сетчатки
Ангиостатическую активность усеченных форм, происходящих из триптофанил-рРНК-синтетазы (TrpRS, 52 кДа, SEQ ID No.1), исследовали при помощи модели развития кровеносных сосудов в сетчатке новорожденных мышей. Фридландер и др. (Friedlander et al., Abstracts 709-В84 and 714-B89, IOVS 41 (4):138-139 (March 15, 2000) установили, что развитие кровеносных сосудов в сетчатке новорожденных мышей происходит в несколько стадий. Настоящее изобретение относится к способу анализа ингибирования развития кровеносных сосудов на основании указанной концепции постадийной васкуляризации сетчатки.
Не содержащие эндотоксина рекомбинантные мини-TrpRS (сплайсированный вариант меченного гистидином TrpRS с М.н. 48 кДа; SEQ ID No.3) и Т2 (расщепленный продукт меченного гистидином TrpRS с М.н. 43 кДа; SEQ ID No.7) получали в виде рекомбинантных белков. Указанные белки инъецировали в стекловидное тело новорожденным мышам Balb/C на 7-й или 8-й день после рождения (Р) и сетчатку удаляли на 12-й или 13-й день (Р12 или Р13). Для визуализации сосудов в тотальных препаратах сетчатки использовали антитело против коллагена IV и вторичное антитело, конъюгированное с флуоресцеином. Антиангиогенную активность определяли при помощи софокусного микроскопа с учетом воздействия инъецированных белков на образование глубоких, наружных сосудистых сплетений. Инъекцию в стекловидное тело и отделение сетчатки производили при помощи препаровальной лупы (SMZ 645, Nikon, Japan). Глазную щель образовывали у мышей на 7-ой день после рождения (Р7) при помощи тонкого лезвия, обнажая при этом глазное яблоко для инъецирования Т2 (5 пмоль) или TrpRS (5 пмоль). Образцы (0,5 мкл) инъецировали шприцем с иглой 32 калибра (Hamilton Company, Reno, NV). Инъекцию осуществляли между экватором глазного яблока и краем роговицы; во время инъекции положение конца иглы контролировали путем прямой визуализации для определения его нахождения в полости стекловидного тела. Глаза с затронутым иглой хрусталиком или повреждением роговицы исключали из исследования. После инъекции глазное яблоко возвращали в исходное положение и закрывали глазную щель.
Животных умерщвляли на 12-ый день (Р12) после рождения и глаза удаляли. Глаза помещали на 10 минут в 4% раствор параформальдегида (PFA) и через краевой разрез иссекали роговицу, хрусталик, склеру и стекловидное тело. Отделенную сетчатку готовили к окрашиванию, помещая в метанол на 10 минут на льду, и блокируют в 50% фетальной телячьей сыворотке (Gibco, Grand Island, NY) с 20% нормальной сыворотки козы (The Jackson Laboratory, Bar Harbor, ME) в PBS в течение 1 часа на льду. Кровеносные сосуды визуализировали, окрашивая сетчатку антителом кролика против коллагена IV мыши (Chemicon, Temecula, CA), разведенным в отношении 1:200 в блокирующем буфере, в течение 18 часов при 4°С. Антитело козы против IgG кролика, конъюгированное с ALEXA FLUOR® 594 (Molecular Probes, Eugene, OR) (разведенное в отношении 1:200 в блокирующем буфере), инкубировали с сетчаткой в течение 2 часов при 4°С. Получали препарат сетчатки в медленно подаваемой заливочной среде М (Molecular Probes, Eugene, OR).
Ангиостатическую активность определяли с учетом степени развития кровеносных сосудов в глубоком, наружном сосудистом слое сетчатки (вторичный слой), который формируется в период между днями Р8 и Р12. Появление внутренней сети кровеносных сосудов (первичный слой) исследовали для определения нормального развития и выявления признаков токсичности. Ни одна из белковых конструкций, используемых в данном примере, не оказала вредного влияния на первичный слой.
На фиг.2 показана микрофотография, отображающая способность Т2 ингибировать васкуляризацию вторичной глубокой сети в сетчатке мыши. На фиг.2 в ряду А показана сосудистая сеть сетчатки, подвергнутой воздействию TrpRS, в ряду В показана сосудистая сеть сетчатки, подвергнутой воздействию мини-TrpRS, и в ряду С показана сосудистая сеть сетчатки, подвергнутой воздействию полипептида Т2 по настоящему изобретению. Первый (левый) столбец иллюстрирует первичную поверхностную сеть, и второй столбец иллюстрирует вторичную глубокую сеть. Как показано на фиг.2, ни один из полипептидов не повлиял на первичную поверхностную сеть, и только Т2 существенно ингибировал васкуляризацию вторичной глубокой сети.
Большинство глаз, подвергнутых воздействию PBS, характеризовались нормальным развитием сосудов в сетчатке, при этом полное подавление наружного сосудистого слоя наблюдалось примерно в 8,2% (n=73) подвергнутых воздействию глаз. Полное ингибирование наружной сети наблюдается в 28% глаз (n=75), подвергнутых воздействию мини-TrpRS (0,5 мг/мл). Более маленькая усеченная форма (Т2) была гораздо более сильнодействующим ингибитором развития кровеносных сосудов в зависимости от вводимой дозы; 14,3% сосудистой сети было полностью ингибировано после воздействия 0,1 мг/мл Т2 (n=14), 40% было ингибировано после воздействия 0,25 мг/мл (n=20) и 69,8% было полностью ингибировано после воздействия 0,5 мг/мл (n=53). Данные для воздействия 0,5 мг/мл представлены в графической форме на фиг.3. Экстракты сетчатки мыши содержат белок с той же кажущейся молекулярной массой и иммунореактивностью, что и мини-TrpRS человека, о чем свидетельствуют результаты анализа методом электрофореза в ДСН-ПААГ и Вестерн-блоттинга. Полноразмерные TrpRS мыши и человека характеризуются идентичностью на уровне примерно 88% аминокислот и содержат соответственно 475 и 471 аминокислоту. Усеченные формы TrpRS, в частности Т2, оказывают сильное ангиостатическое действие на развитие кровеносных сосудов сетчатки.
Пример 4. Анализ развития кровеносных сосудов в матригеле
Анализ развития кровеносных сосудов в матригеле мыши использовали для исследования ангиостатической активности Т2 (SEQ ID No.7) методами, описанными в публикациях Brooks et al., Methods Mol. Biol., 129:257-269 (1999) and Eliceiri et al., Mol. Cell, 4:915-924 (1999). Указанный анализ выполнен при внесении нижеследующих модификаций. Бестимусным мышам линии wehi подкожно имплантировали 400 мкл матригеля без фактора роста (Becton Dickinson, Franklin Lakes, NJ), содержащего 20 нМ VEGF. Ангиостатическую активность Т2 сначала исследовали путем введения 2,5 мкМ Т2 в пробку из матригеля. Эффективность воздействия определяли, вводя в пробку Т2 в разных концентрациях. На 5-й день мышам внутривенно инъецировали меченный флуоресцеином лектин, связывающийся с эндотелиальными клеткам, гриффонии (Bandeiraea), симплицифолии I, изолектина В4 (Vector Laboratories, Burlingame, CA), и иссекали пробки из матригеля. Пробку измельчали в буфере RIPA (10 мМ фосфата натрия, рН 7,4, 150 мМ хлорида натрия, 1% Nonidet P-40, 0,5% дезоксихолата натрия, 0,1% додецилсульфата натрия) и производили количественное определение содержания флуоресцеина в каждой пробке при помощи спектрофотометрического анализа.
Пример 5. Локализация связывания Т2 в сетчатке
Для определения поглощения и локализации Т2, инъецированной в сетчатку, на 7-й (Р7) день после рождения мышам в стекловидное тело глаза инъецировали меченную флуоресцеином Т2 (ALEXA ® 488, Molecular Probes, Inc., Eugene OR). Глазные яблоки удаляли в дни Р8 и Р12 и фиксировали в 4% растворе PFA в течение 15 минут. Затем иссекали сетчатку без смежных тканей, не относящихся к сетчатке, помещали в 4% раствор PFA на ночь при 4°С и затем вводили в среду (TISSUE-TEK® O.C.T., Sakura FineTechnical Co., Japan) на сухом льду. Обработанные в криостате срезы (10 микрон) повторно гидратировали PBS и блокировали 5% BSA, 2% нормальной сыворотки козы в PBS. Кровеносные сосуды визуализировали антителом против коллагена IV мыши, как описано выше. Для получения препаратов ткани с покровным стеклом использовали VECTASHIELD®, содержащий ядерный краситель DAPI (Vector Laboratories, Burlingame, CA).
Альтернативно неокрашенные срезы сетчатки инкубировали с 200 нМ меченной флуоресцеином полноразмерной TrpRS или меченной флуоресцеином Т2 в блокирующем буфере в течение ночи при 4°С. Срезы промывали в PBS шесть раз в течение 5 минут и затем инкубировали с 1 мкг/мл DAPI в течение 5 минут для визуализации ядер. Предварительное ингибирование немеченой Т2 выполняли, инкубируя 1 мкМ немеченой Т2 в течение 8 часов при 4°С до инкубации с меченной флуоресцеином Т2. Сетчатку исследовали при помощи мультифотонного софокусного микроскопа BioRad MRC1024. Трехмерные изображения сосудов получали на основании ряда изображений Z-серии, используя программное обеспечение Confocal Assistant (BioRad, Hercules, CA).
Ангиостатическое действие Т2, определяемое анализом пробки из матригеля мыши.
Авторы данного изобретения исследовали Т2 (SEQ ID No.7) с целью определения, обладает ли Т2 ангиостатической активностью даже после утраты аминоацилирующей активности. Для исследования ангиостатической активности Т2 in vivo выполняли анализ с использованием матригеля мыши. VEGF165 индуцирует развитие кровеносных сосудов в пробке из матригеля мыши. Добавление к матригелю Т2 вместе с VEGF165 ингибировали развитие кровеносных сосудов в зависимости от дозы при IC50, равной 1,7 нМ, как показано на фиг.4.
Локализация меченной флуоресцеином Т2 в кровеносных сосудах сетчатки.
Для визуализации локализации Т2 (SEQ ID No.7) внутри глаза авторы данного изобретения исследовали распределение меченной флуоресцеином Т2 после выполнения инъекции в стекловидное тело на 7-й день после рождения. Сетчатку удаляли на следующий день, делали срез и исследовали при помощи софокусного микроскопа. Распределение инъецированного белка было ограничено кровеносными сосудами. Указанная локализация была подтверждена одновременным окрашиванием глаз, подвергнутых воздействию меченой Т2, меченным флуоресцеином (ALEXA® 594) антителом против коллагена IV (данные не приведены). Через пять дней после инъекции меченной флуоресцеином Т2 (Р12) все еще была видна зеленая флуоресценция меченой Т2 (фиг.5А). В указанных сетчатках на 12-й день (Р12) не был обнаружен вторичный сосудистый слой, что свидетельствует о сохранении ангиостатической активности меченной флуоресцеином Т2 по сравнению с немеченой Т2. В сетчатке, в которую на 7-й день (Р7) инъецировали меченную флуоресцеином полноразмерную TrpRS, к 12-му дню (Р12) формировался вторичный сосудистый слой, но окрашивания сосудов не наблюдалось (фиг.5В). На фиг.5 меченные флуоресцеином белки окрашены зеленым цветом, меченные коллагеном сосуды окрашены красным цветом, и ядра окрашены синим цветом.
Для дальнейшей оценки связывающих свойств меченой Т2 поперечные срезы нормальной сетчатки новорожденной мыши окрашивали меченной флуоресцеином Т2. В данных условиях меченная флуоресцеином Т2 связывалась только с кровеносными сосудами (фиг.5С). Указанное связывание было специфическим, так как оно блокировалось в результате предварительной инкубации с немеченой Т2 (данные не приведены). Сосуды сетчатки не окрашивались при нанесении на сетчатку меченной флуоресцеином полноразмерной TrpRS (фиг.5D), что соответствует отсутствию ангиостатической активности полноразмерного фермента.
Как показано на фиг.5, меченная флуоресцеином Т2 обладает ангиостатическими свойствами и локализуется в кровеносных сосудах сетчатки. Меченную флуоресцеином Т2 (фиг.5А) или полноразмерную TrpRS (фиг.5В) инъецировали (0,5 мкл, в стекловидное тело) на 7-й день (Р7) после рождения. Сетчатку удаляли на 8-й день (Р8) и окрашивали антителом против коллагена IV и ядерным красителем DAPI. Меченая Т2 (верхняя стрелка, указывающая на сосуд на фиг.5А) локализовалась в кровеносных сосудах первичной поверхностной сети (1°). Следует отметить, что вторичная глубокая сеть полностью отсутствует (2°). Хотя в глазах, в которые инъецировали меченную флуоресцеином полноразмерную TrpRS (стрелки на фиг.5В), присутствует как первичный (1°), так и вторичный (2°) сосудистые слои, окрашивание не наблюдается.
В отдельной серии экспериментов замороженные срезы сетчатки, полученной на 15-ый день (Р15), окрашивали меченной флуоресцеином Т2 (фиг.5С) или меченной флуоресцеином полноразмерной TrpRS (фиг.5D) и получали изображения при помощи софокусного сканирующего лазерного микроскопа. Меченая Т2 избирательно была локализована в кровеносных сосудах и воспроизводится в виде ярко-зеленого сосуда, проникающего через первичные и вторичные сосудистые слои сетчатки ниже метки "2°" на фиг.5С. При инъецировании полноразмерной TrpRS окрашивание не наблюдалось (фиг.5D).
Полноразмерная TrpRS имеет уникальный NH2-концевой домен и не обладает ангиостатической активностью. В результате удаления части или всего указанного домена образуется белок с ангиостатической активностью. Структуры, ответственные за ангиостатическую активность Т2, по-видимому, находятся в сердцевидном нуклеотид-связывающем домене с укладкой Россмана. NH2-концевой домен, который можно удалить альтернативным сплайсингом или протеолизом, может регулировать ангиостатическую активность TrpRS, вероятно, открывая сайт связывания, необходимый для ангиостатической активности, который недоступен в полноразмерной TrpRS.
VEGF-индуцируемое развитие кровеносных сосудов в модели матригеля мыши полностью подавлялось Т2 подобно физиологическому развитию кровеносных сосудов в сетчатке новорожденных мышей. Интересно отметить, что самое сильное антиангиогенное действие фрагментов TrpRS in vitro в моделях САМ и матригеля наблюдается в случае VEGF-стимулируемого развития кровеносных сосудов. Результаты развития сосудов в сетчатке новорожденных мышей позволяют выявить взаимосвязь между VRGF-стимулируемым развитием кровеносных сосудов и ангиостатическим действием фрагментов TrpRS; развитие кровеносных сосудов сетчатки в данной системе может быть активировано VEGF. Кроме того, ингибирование, наблюдаемое в модели сетчатки, было специфичным для вновь образующихся сосудов; ранее существовавшие (во время инъекции) сосуды первичного сосудистого слоя не изменялись в результате указанного воздействия. Хотя механизм ангиостатической активности Т2 неизвестен, специфическая локализация Т2 в сосудистой системе эндотелия сетчатки и избирательное воздействие Т2 на вновь образующиеся кровеносные сосуды позволяют предположить, что Т2 может воздействовать через рецепторы эндотелиальных клеток, экспрессированные на пролиферирующих или мигрирующих клетках. Дальнейшее объяснение механизма ангиостатической активности Т2 требует идентификации родственных клеточных рецепторов.
Клетки разных типов, которые продуцируют при стимуляции интерфероном- ангиостатическую мини-TrpRS, также продуцируют ангиостатические факторы, такие как IP-10. Таким образом, полученные результаты позволяют сделать предположение о роли TrpRS в нормальных, физиологически родственных путях развития кровеносных сосудов. Другой распространенный клеточный белок - про-EMAPII (р43) - выполняет две, очевидно, не связанные друг с другом функции, подобные функциям, рассмотренным в данном описании изобретения для TrpRS. Про-EMAPII способствует трансляции белка путем связывания с мультисинтетазным комплексом аминоацил-тРНК-синтетазы млекопитающего. Указанный белок процессируется и секретируется подобно EMAPII, и существует предположение о функционировании EMAPII в качестве ангиостатического посредника в процессе развития легкого. ангиостатическую мини-TrpRS, также продуцируют ангиостатические факторы, такие как IP-10. Таким образом, полученные результаты позволяют сделать предположение о роли TrpRS в нормальных, физиологически родственных путях развития кровеносных сосудов. Другой распространенный клеточный белок - про-EMAPII (р43) - выполняет две, очевидно, не связанные друг с другом функции, подобные функциям, рассмотренным в данном описании изобретения для TrpRS. Про-EMAPII способствует трансляции белка путем связывания с мультисинтетазным комплексом аминоацил-тРНК-синтетазы млекопитающего. Указанный белок процессируется и секретируется подобно EMAPII, и существует предположение о функционировании EMAPII в качестве ангиостатического посредника в процессе развития легкого.
Таким образом, Т2 можно использовать в моделировании физиологически родственного развития кровеносных сосудов, происходящего в нормальных или патологических условиях. В процессе нормального развития кровеносных сосудов Т2 может способствовать образованию физиологически важных бессосудистых зон, имеющихся в некоторых органах, как, например, бессосудистая зона центральной ямки сетчатки. Патологическое развитие кровеносных сосудов может происходить при ингибировании расщепления полноразмерной TrpRS, что ведет к избыточному росту сосудов.
В случае глазных болезней образование новых кровеносных сосудов может вызывать катастрофическую потерю зрения. Такие пациенты могут потенциально получить большую пользу от терапевтического ингибирования развития кровеносных сосудов. Эндотелиальный фактор роста сосудов взаимосвязан с образованием новых кровеносных сосудов и отеком пятна сетчатки, хотя считается, что другие ангиогенные стимулы также играют определенную роль в развитии кровеносных сосудов сетчатки. Авторы данного изобретения обнаружили взаимосвязь между VEGF-стимулируемым развитием кровеносных сосудов и ангиостатической активностью фрагментов TrpRS, что делает указанные молекулы полезными для лечения гипоксической и пролиферативной ретинопатии. В научной литературе отсутствует информация об антиангиогенном средстве, которое полностью ингибирует развитие 70% кровеносных сосудов, как это делает Т2 по настоящему изобретению (фиг.5). Другим преимуществом фрагментов TrpRS является то, что они представляют природные и поэтому потенциально неиммуногенные антиангиогенные средства. Указанные молекулы, таким образом, можно доставлять при помощи клеточных или вирусных векторов направленного действия. Поскольку многие пациенты с глазными болезнями, обусловленными образованием новых кровеносных сосудов, страдают системной ишемической болезнью, желательно проводить местное лечение антиангиогенными средствами на основе генетически созданных клеточных или вирусных векторов, вводимых непосредственно в глаз.
Помимо лечения ангиогенной ретинопатии фрагменты TrpRS по настоящему изобретению, в частности Т2 и его фрагменты, ингибирующие развитие кровеносных сосудов, могут также подавлять рост плотной опухоли, предотвращая васкуляризацию опухоли. Фрагменты TrpRS по настоящему изобретению блокируют VEGF-индуцируемую пролиферацию и хемотаксис эндотелиальных клеток in vitro и являются полезными для лечения любых патологий, включающих нежелательную пролиферацию и васкуляризацию эндотелиальных клеток.















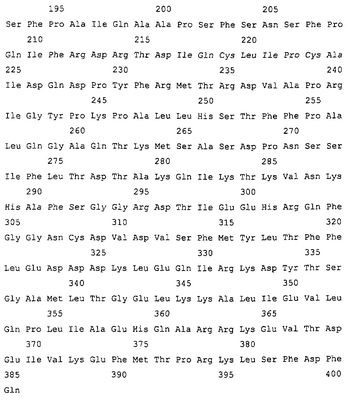
Формула изобретения
1. Выделенный водорастворимый полипептид, обладающий ангиостатической активностью в отношении неоваскуляризации глаза, который состоит из последовательности аминокислотных остатков SEQ ID NO:12.
2. Выделенный полипептид, обладающий ангиостатической активностью в отношении неоваскуляризации глаза, который состоит из последовательности аминокислотных остатков SEQ ID NO:7.
3. Способ ингибирования неоваскуляризации глаза у пациента, который предусматривает введение указанному пациенту необходимого для ингибирования неоваскуляризации глаза количества водорастворимого полипептида, обладающего ангиостатической активностью в отношении неоваскуляризации глаза и состоящего из последовательности аминокислотных остатков SEQ ID NO:12.
4. Способ по п.3, в котором указанное введение осуществляют ежедневно.
5. Способ по п.3, в котором указанное введение осуществляют один раз в неделю.
6. Способ по п.3, в котором указанное введение осуществляют один раз в месяц.
7. Способ по п.3, в котором указанное введение осуществляют один раз в три месяца.
8. Способ по п.3, в котором указанное введение осуществляют один раз в шесть месяцев.
9. Способ по п.3, в котором пациенту вводят суточную дозу полипептида, составляющую от около 20 до около 100 мкг.
10. Способ по п.3, в котором пациенту вводят трехмесячную дозу полипептида, составляющую от около 2 до около 9 мг.
11. Способ по п.3, в котором введение осуществляют в стекловидное тело.
12. Способ по п.3, в котором введение осуществляют внутрь глаза.
13. Способ по п.3, в котором введение осуществляют с помощью устройства пролонгированной доставки.
14. Способ по п.3, в котором введение осуществляют с помощью генотерапии.
15. Способ по п.3, в котором введение осуществляют с помощью клеточной терапии окулярным введением.
16. Инъецируемая ангиостатическая композиция, которая содержит эффективное количество полипептида, обладающего ангиостатической активностью в отношении неоваскуляризации глаза и состоящего из последовательности аминокислотных остатков SEQ ID NO:12, и фармацевтически приемлемый носитель.
17. Ангиостатическая композиция по п.16, в которой полипептид присутствует в концентрации от около 0,1 до около 0,5 мг на миллилитр водного экципиента.
18. Набор для ингибирования неоваскуляризации глаза, который включает полипептид по п.1 или 2 в количестве, достаточном для введения по крайней мере однократной дозы, упакованный в подходящую запаянную емкость; по крайней мере одну отдельно запечатанную иглу для шприца с калибром менее примерно 33, пригодную для инъекций в стекловидное тело; по крайней мере один точно откалиброванный шприц; напечатанную инструкцию, описывающую композицию, способ ее введения и указывающую любую требуемую информацию о безопасности и эффективности.
19. Выделенный полинуклеотид, который кодирует полипептид, обладающий ангиостатической активностью в отношении неоваскуляризации глаза, где полипептид состоит из последовательности аминокислотных остатков SEQ ID NO:12 или SEQ ID NO:7.
20. Клетка E.coli, трансфицированная нуклеиновой кислотой по п.19, которая экспрессирует полипептид, обладающий ангиостатической активностью в отношении неоваскуляризации глаза.
21. Способ ингибирования неоваскуляризации глаза у пациента, предусматривающий введение указанному пациенту необходимого для ингибирования количества водорастворимого полипептида, обладающего ангиостатической активностью в отношении неоваскуляризации глаза и состоящего из последовательности аминокислотных остатков SEQ ID NO:7.
22. Инъецируемая ангиостатическая композиция, которая содержит полипептид, обладающий ангиостатической активностью в отношении неоваскуляризации глаза и состоящий из последовательности аминокислотных остатков SEQ ID NO:7, и фармацевтически приемлемое количество водного эксципиента, где композиция содержит полипептид в концентрации по меньшей мере 0,1 мг на миллилитр водного эксципиента.
РИСУНКИ
Рисунок 1, Рисунок 2, Рисунок 3, Рисунок 4, Рисуноу 5
|