
СПИСОК ПАТЕНТОВ С УПОМИНАНИЕМ ГИАЛУРОНОВОЙ КИСЛОТЫ
-
- 2017751 Способ получения гиалурона
- 2192150 БАД для профилактики йодной недостаточности
- 2112542 Препарат для лечения патологий соединительных тканей
- 2225206 Препарат для лечения рака молочной железы
- 2299733 Лечение опорно-двигательного аппарата
- 2299732 Способ лечения глаукомы
- 2299726 Противоинфекционная губная помада
- 2299725 Косметическое средство для ухода за кожей
- 2198878 Ароматическое соединение
- 2198702 Способ подготовки трофических язв к аутодермапластике
- 2198653 Вагинальные суппозитории
- 2197946 Композиция для ухода за волосами
- 2197923 Фармацевтическая композиция для лечения отеков роговицы
- 2298410 Биотрансплантант и способ лечения ревматических и аутоиммунных заболеваний
- 2197501 Фотоотверженный гель на основе сшитой гиалуроновой кислоты
- 2197228 Твердые лекарственные формы
- 2197222 Водная компазиция для ухода за волосами, лица и тела
- 2297425 Полипептиды
- 2297240 Композиция с гиалуроновой кислотой
- 2297230 Фармацевтическая компазиция с ксантоновой смолой
- 2196588 Глазные капли
- 2195955 Применение биологически активных веществ
- 2195926 Дерматологические композиции
- 2295954 Микрочастицы для доставки нуклеиновых кислот
- 2295951 Косметика для ухода за кожей лица и век
- 2195262 Фармакологическое средство на основе гиалуроновой кислоты
- 2194512 Способ профилактики и коррекции процесса старения кожи
- 2194478 Лечение экземы
- 2294716 Расширяемый стент
- 2194055 Сшитые сополимеры
- 2099350 Ассоциаты депротонированной гиалуроновой кислоты
- 2293557 Средство для лечения кожи и слизистых
- 2292878 Приготовление микроцастиц, содержащих метопропол
- 2292746 БАД
- 2192256 Защита кишечника
- 2191782 Получение модифицированной гиалуроновой кислоты
- 2292219 Паратиреоидный гормон человека
- 2291686 Микроцастицы
- 2191000 Косметическая маска
- 2290921 Фармацевтические и косметические средства против старения кожи
- 2290900 Модифицированный биоматериал для использования в офтальмологии
- 2290899 Получение биоматерьяла
- 2290397 Новые инданилиденовые соединения
- 2290186 Лечение сирингомиелии
- 2288702 Иррингационный раствор для офтальмологии
- 2288699 Гель для лечения стоматологических заболеваний
- 2188011 Активирующая остеогенез фармацевтическая композиция
- 2187327 Средство с антисептиком
- 2187325 Средство с радиопротекторным действием
- 2287330 Композиции миноксидила
- 2186786 Способ получения гиалуроновой кислоты
- 2186593 Лечение раненого процесса кожи
- 2286801 Очищение воды
- 2286781 Лечение ожогов пищевода у детей
- 2286764 Средство лечения воспалений полости рта
- 2185840 Лечение инфекционных заболеваний
- 2286151 Альфа-2-Дельта-Лиганда
- 2185149 Ранозаживляющий гель
- 2285527 Лечение ИЛ-6 заболеваний
- 2184448 Раствор хранения роговицы, включающий гиалуроновую кислоту
- 2090179 Крем для кожи
- 2183961 Способ лечения кожи
- 2284331 Соли алифотических аминов
- 2284187 Производные амида
- 2089191 Снизить внутрение давление
- 2283320 Получение гликозаминогликанов
- 2283129 Лечение опухолей
- 2283098 Косметические средства с Q
- 2182574 Ароматические соединения
- 2088257 Средство с гипохолестеролемическим действием
- 2088218 Состав для гигиенических салфеток
- 2088206 Способ получения препарата, создающего исскуственный загар
- 2282462 Противомикробные средства
- 2182008 Интровагинальная компазиция
- 2181999 Препарат с отсроченным высвобождением
- 2181998 Новые композиции липидов
- 2181995 Лечение болевого синдрома
- 2181295 Вирионная вакцина
- 2087144 Витамин Е
- 2379336 Способ стирки
- 2379052 Вакцинация
- 2180855Композиция в виде ионного комплекса
- 2379025 Противоинфекционный гель
- 2180825 Лечение травм роговицы
- 2281082 Способ коррекции эстетических и возрастных проблем кожи
- 2180576 Биоактивная добавка для косметических средств
- 2280459 Средство для изменения скорости роста или репродукции клеток
- 2179981 Соли переходного металла
- 2378010 Жидкие вакцины
- 2378008 Комбинированные вакцины
- 2378007 Анаболическое средство
- 2377973 Растительные экстракты
- 2280041 Способ получения водорастворимых комплексов гиалурил
- 2280038 Биополимеры
- 2323733 Йодный обмен
- 2377260 Гель
- 2178693 Противовирусное средство на основе гиалуроновой кислоты
- 2178692 Облегчающие зуд косметическое средство
- 2377022 Гемостатические спреи
- 2376982 Увлажняющая сыворотка для лица
- 2376974 Трансдермальный гель для лица
- 2362784 Гипо-и гиперацетилированные менингокковые капсульные сахариды
- 2177789 Устройство для доставки лекарства к шейке матки
- 2277954 Крем для лица омолаживающий
- 2376378 Способ получения метионина
- 2177332 Биоматериал для предотвращения послеоперационных спаек, с производной гиалуроновой кислотой
- 2177310 Способ получения таблеток
- 2376011 Средство для позвоночника
- 2277410 Косметическое средство
- 2323748 Медицинская повязка
- 2276998 Гидрогелевые композиции
- 2082416 Способ получения препарата с коллагенном из животного сырья
- 2375081 Адсорбирующее изделие
- 2375049 Охлаждающий пластырь
- 2346049 Способ получения гиалурона
- 2275913 Фармацевтические средства
- 2174985 Полисахарид с антиоксидантом
- 2373957 Носитель для лекарственных средств и биологически активных веществ
- 2373941 Способ коррекции возрастных и патологических изменений кожных покров
- 2174845 Композиции и способы доставки генетического материала
- 2174830 Средство для укрепления волос
- 2373769 Синбиотическая композиция
- 2274472 Лечение апорно-двигательного аппарата и болевых синдромов
- 2372929 Профилактическая композиция на основе веществ фенольной природы в липосомной форме
- 2173563 Способ нанесения на поверхность предметов покрытия на основе гиалуроновой кислоты, её производных и полусинтетических полимеров
- 2079304 фармацевтическая композиция, обладающая иммуносупрессорной и антимикробной активностью
- 2273645 Полипептид ожирения
- 2173154 Фракция кератансульфатолигосахаридов и содержащий ее фармацевтический препарат
- 2173136 Грязная мазь
- 2173128 Способ хирургического лечения центральных разрывов сечатки
- 2078561 Косметическое средство предотвращающее старение кожи
- 2172490 Способ прогнозирования воспалительных заболеваний молочной железы при эндопластике
- 2272645 Способ лечения ЦМВ-Инфекции у детей раннего возроста
- 2272636 Фармацевтическая композиция для местного лечения воспаления
- 2272635 Фармацевтически активная субстанция для офтальмологии
- 2272599 Биоматерьял для стабилизации прогрессирующей миопии "Коллаплант"
- 2172168 Средство для заживления ран на основе гиалуроновой кислоты
- 2371172 Фармацевтическая композиция для лечения нервной системы на основе стефаглабрина
- 2171470 Способ прогнозирования послеоперационной трансформации доброкачественных опухолей нервной системы
- 2077317 Состав для ванн
- 2271213 Комбинированные композиции, содержащие экстракты из растений и морских животных
- 2076872 Способ получения окрашенной гиалуроновой кислоты
- 2076671 Раствор для защиты роговицы
- 2370281 Конъюгаты гидроксиалкилкрахмал
- 2370275 Способ лечения (коррекции) косметических и возрастных дефектов кожи
- 2370258 Фармацевтическая композиция для парентальной доставки в форме лиофилизата
- 2270023 Способ экстракции и очистки протеогликана хрящего типа (варианты)
- 2369408 Гемостатическая композиция, включающая гиалуроновую кислоту
- 2369387 Фармацевтическая композиция для лечения нервной системы
- 2369379 Нетаблитированные жевательные формы для индивидуального введения
- 2169136 Производное коричной кислоты
- 70792 Медицинский аппликатор
- 20741717 Способ стабилизации аскорбиновой кислоты
- 2074712 Способ получения препарата, препятствующего преждевременной эякуляции
- 2367954 Способ прогнозирования развития кожной патологии у женщин с синдромом склерополикистозных яичников (СПКЯ)
- 2268075 Устройство для электрокинетической доставки
- 2268052 Средство для лечения воспалительных и дегенеративных заболеваний суставов
- 2167649 Способ получения твердой дисперсии умеренного водорастворимого лекарственного вещества
- 2167647 Гель для бритья
- 2073520 Лечение урологических инфекций
- 2367476 Биопластический материал
- 2367475 Мембрана для использования при направленной регенерации тканей
- 2367469 Фармацевтическая композиция на основе лизоамидазы
- 2367456 Фармацевтическая композиция обладающая антибактериальным и некролитическим действием
- 2367455 Фармацевтическая композиция обладающая некролитическим и антибактериальным действием
- 2267324 Применение антиадгезивных углеводов, препарат для уменьшения и /или блокирования адгезии патогенных веществ
- 2166934 Композиции включающие биологический агент
- 2166510 Псевдодипептиды
- 2366460 Композиции, имеющие высокую противовирусную и антибактериальную активность
- 2360901 Производные феноксиуксусной кислоты
- 2165749 Способ восстановления эндотелия роговицы
- 2265441 Способ укрепления склеры
- 2365382 Композиции и способы для регуляции развития сосудов
- 2070879 Соли гликозаминогликанов
- 2164914 Циклические и гетероциклические N - замещенные - иминогидроксамовые карбоновые кислоты
- 2264627 Хламидийный конъюктивит
- 2364399 Фармацевтический препарат на основе стефаглабрина
- 2264230 Препарат с замедленным высвобождением активного вещества
- 2363497 Фармацевтические композиции
- 2363496 Способ увеличения объема мягких тканей
- 2363473 Способ антифлогистической активации в эксперементе
- 2363461 Фармацевтический препарат на основе сигетина
- 2363459 Средства для введения в роговицу глаз для предотвращения офтальмологических нарушений
- 2363448 Фармацевтические композиции
- 2163123 Глазные капли
- 2162687 Усовершенствованнная лекарственная форма индуктора интерферана
- 2162343 Биосовместимый полимерный материал и способ его получения
- 2162327 Лечение рака
- 2067841 Способ получения ароматизатора
- 2161478 Способ консервированого лечения гонартроза
- 2361617 Вольфрамовые частицы в качестве рентгеноконтрастных веществ
- 2361552 Способы и устройства для дренирования жидкостей и понижения внутриглазного давления
- 2066996 Способ изготовления пленочного материала для офтальмохирургии
- 2361417 Корм с глюкозамином и экстрактом ивы для профилактики артроза у животных
- 2161002 Пищевой общеукрепляющий лечебно-профилактический продукт из хрящевой ткани акул
- 2360928 Комплексная матрица для медико-биологического применения
- 2160574 Способ лечения глаукомы
- 2360688 Способ лечения повреждений переферических нервов
- 2360670 Фармацевтическая композиция при климактерических расстройствах
- 2360646 Эндолюминальный протез
- 2260445 Способ усовершенствования транспортировки через легко прспосабливаемый полупроницаемый барьер
- 2260007 Производные амида
- 2359975 Способ получения модифицированных арабиногалактанов
- 2359974 Антигенные Пептиды
- 2159775 Псевдопептидный продукт
- 2259833 Фармацевтическая композиция для лечения роговицы глаза
- 2259816 Ранозаживляющее средство
- 2259815 Способ коррекции возрастных изменений, связанных с процессами старения кожи
- 2359706 Способ сохранения офтальмологических растворов
- 2359704 Антисептическое средство
- 2359662 Микрокапсулы
- 2159253 Катионные полимеры
- 2159111 Средство для ухода за кожей лица
- 2159105 Композиция для защиты кожи от опасных химических веществ Получение
- 2158593 Биосовместимый водный раствор
- 2358728 Способ лечения и предупреждения потери костной ткани
- 2258517 Способ хирургического лечения травмотических повреждений селезенки пленкой на основе гиалуроновой кислоты
- 2357968 Кристалические формы производной имидазола
- 2357957 Ингибиторы P38 и их применение
- 2157647 Пищевая добавка и ее получение
- 2357758 Препараты для чрескожной и чересслизистой добавки
- 2063244 Способ стабилизации растворов
- 2063140 Способ получения препарата для консервирования мяса
- 2157381 Способ получения гиалуроновой кислоты
- 2257198 Композиции микроцастиц
- 2356909 Белковый комплекс
- 2356570 Косметическая композиция
- 2256434 Способ закрытия перфорации барабанной перепонки
- 2356520 Способ лечения постконтузионного повреждения сечатки глаза
- 2156133 Гель
- 2255945 Полимерная композиция
- 2355761 Средства повторной дифференцировки
- 2061043 Способ повышения устойчивости урокиназы к нагреванию
- 2061005 Способ получения красителей для гистологических исследований
- 2355420 Зубная паста
- 2355385 Композиции пролонгированного действия с контролируемым высвобождением
- 2355240 Способ получения пищевого препарата хондропротекторного действия
- 2155057 Пихтово репейный бальзам
- 2354409 Способ производства высвобождающих лекарственные средчтва медицинских устройств
- 2254145 Раневое покрытие на основе коллаген-хитозанового комплекса
- 2254133 Лечение и профилактика ВИЧ-инфекции у человека
- 2253439 Фармацевтическая композиция для защиты и улучшения оптических свойств роговици при проведении эндовитреальных вмешательств
- 2253437 Способ омоложения кожи
- 2153352 Фармацевтическая композиция обладающая ранозаживляющим и противовоспалительным действием
- 2353354 Фармацевтический препарат на основе низкомолекулярного индуктора интерферона
- 2252787 Способ получения искусственной матрицы кожи
- 2252767 Способ нормализации иммунобиохимического гомеостаза коров в предродовом и послеродовом периодах
- 2352583 Фармацевтическая композиция содержащая Fc-область иммуноглобулина в качестве носителя
- 2152403 Модифицированные полисахариды
- 2352356 Иммуногенная композиция
- 2352342 Исскусственный физиологический солевый раствор Способ его получения
- 2352330 Фармацевтический препарат на основе низкомолекулярного индуктора интерферона
- 2352323 Фармацевтический препарат с модифицированным высвобождением
- 2152027 Способ подготовки ткани мозга для определения гликозаминогликанов
- 2251842 Интектицидный состав для борьбы с личинками оводов
- 2151580 Способ активации пролиферации эндотелия роговицы
- 2351648 Дифференцировка стромальных клеток, полученных из жировой ткани, в эндокринные клетки поджелудочной железы и их использование
- 2351595 N - гидроксиформамидные соединения в качестве ингибиторов металлопротеина
- 2251411 Косметическое средство в лиофилизированной фармацевтической форме
- 2251405 Косметика...ее композиции для косметических препаратов
- 2251367 Средство со сшитой гиалуроновой кислотой для наращивания тканей
- 2351359 Косметика для профилактики и лечения избыточной массы тела
- 2351322 Препарат на основе низкомолекулярного индуктора интерферона
- 2351153 Диета при остеортрите собак
- 2350958 Способ определения групповой принадлежности синовальной жидкости
- 2350625 Производные гиалуроновой кислоты с пониженной биодеградируемостью
- 2150266 Крем после бритья
- 2350354 Фармацевтическое средство содержащие антагонист и фактор некроза
- 2350340 Способ коррекции процессов регенерации
- 2350309 Способ лечения избыточной массы тела с помощью рефлексотерапии
- 2250047 Профилактический продукт из хрящевой ткани гидробионтов
- 2249467 Медицинский матерьял и изделия на его основе
- 2055079 Способ получения препарата гиалуроновой кислоты
- 2349599 Биоадгезив мидии
- 2054903 Способ лечения коллагеноза у бычков на откорме
- 2249210 Способ прогнозирования предрасположенности к развитию и тяжести течения деформирующего остеоартроза коленного сустава у взрослых
- 2349339 Средство для соединительной ткани
- 2148988 Человеческий интерферона
- 2148399 Лечение атеросклероза
- 2148396 Способ определения активного вещества в дифильных мазевых основах
- 2148375 Способ диагностики близорукости
- 2348415 Способ противоспаечной терапии после хирургического вмешательства
- 2348400 Препарат на основе низкомолекулярного индуктора интерферона
- 2348386 Способ непроникающего хирургического лечения первичной открытоугольной глаукомы
- 2248213 Лечение Галактозидальной А недостаточности
- 2347586 Микрофлюидизированные эмульсии типа "масло в воде" и вакцинные средства
- 2147243 Контрастное средство
- 2146526 Лечебный препарат дисбактериоза и урогенитальных инфекций
- 2146148 Терапевтическое применение фактора роста кератиноцитов (ФРК)
- 2146139 Способ повышения активности макрофагов и комбинации для его осуществления
- 2346277 Способ диагностики специфического синовита
- 2345793 Ультразвуковые контрастные вещества и их получение
- 2345782 Терапевтические комбинации на основе PORIFERA для лечения и предотвращения кожных заболеваний
- 2245131 Способ коррекции косметических недостатков кожи
- 2245130 Способ активации восстановительных процессов в коже
- 2144833 Хондроитиназа
- 2344809 Получение твердых дозированных форм с использованием сшитого нетермопластичного носителя
- 2244540 Косметический гель для ухода за кожей лица
- 2244536 Способ лечения дегенеративно-дистрофических заболеваний тазобедренного сустава
- 2344167 Хмелевый экстракт
- 2143884 Агент регулирования дифференциации клеток кожи, культурная среда для клеток или тканей и способ регулирования дифференциации клеток кожи
- 2343932 Способ получения обладающих пониженной растворимостью в воде пленночных материалов
- 2343903 Устройство доставки лекарств для контролируемого введения препаратов
- 2048817 Способ получения материала для лечения ожогов и гнойно - некронических ран
- 2048803 Гидратантный крем
- 2242974 Средства и способы лечения воспалительных заболнваний
- 2142816 Способ получения антигерпетической вакцины
- 2342923 Средство для обработки рук с увлажняющим эффектом
- 2142781 Косметика для макияжа ресниц и бровей и агент ингирирующий рост микроорганизмов в косметических средствах
- 2242251 Трансплантируемые стенты с биоактивными покрытиями
- 2142257 Способ обработки глазных имплантантов и контакных линз
- 2342389 Мононатриевая соль
- 2342107 Способ устранения западения верхнего века при анофтальме
- 2141828 Средство, пролонгирующее эффективность чесночного порошка
- 2241489 Косметическое средство матриксных протеинов для залечивания ран
- 2241443 Средство для лечения герпеса
- 2241414 Способ получения протезов кровеносных сосудов
- 2341539 Гидрогель
- 2141324 Регулятор скорости воздействия препарата для инъекций
- 2141312 Косметическое средство для ухода за кожей лица
- 2341296 Средства и способы покрытия медицинских имплантантов
- 2341272 Средство для неспецифической иммунотерапии
- 2341266 Стенты с нанесенным покрытием содержащим N - (5-(4-(4-
- 2341257 Иммуномодулирующее средство
- 2341255 Средство для лечения климактерических расстройств
- 2240821 Способ лечения урологических инфекций
- 2140786 Способ лечения лишая
- 2140243 Способ хирургического лечения диабетической ретинопатии и отслоек сечатной оболочки
- 2240140 Медицинская многослойная повязка и изделия на ее основе
- 2240135 Культура клеток, содержащая клетки - предшественники остеонегеза, имплантант на ее основе и его использование для восстановления целостности кости
- 2240123 Экзогенные биологически активные коньюгирующие вещества
- 2139886 Фотоотвержаемое производное гликозаминогликата, сшитое производное гликозаминогликата и способы их получения, способ предотвращения клеточной и тканевой адгезии
- 2139729 Вакцина. Способ стимулирования иммунной системы
- 2339386 Средство обладающее радио - и химиозащитным действием
- 2339369 Лечение офтальмологических нарушений с использованием мочевины и ее производных
- 2139041 Гидратантный регенерирующий крем и способ его получения
- 2139039 Косметический суперкрем для ухода за кожей
- 2139017 Способ получения боисовместимого материала
- 2138503 Производные камптотецина, способы их получения, уникальное средство
- 2338556 Средство содержащие антагонист Р2Х - рецептора и нестероидное противоспалительное лекарственное средство
- 2338514 Косметическое средство для профилактики старения кожи
- 2138297 Медицинские устройства, подверженные вызываемому разложению
- 2138295 Покрытие для ран
- 2337906 Ингибиторы цитозольной фосфолипазы А2 Применение физиологически допустимого корпускулярного ферримагнитного или ферромагнитного материала. Способ формирования магнитометрического изображения
- 2137501 Устройство формирования изображения
- 2137477 Способ лечения заболеваний характеризующихся аутоиммунной агрессией
- 2137467 Крем для кожи лица и тела
- 2137449 Способ коррекции дефектов преломления в глазу млекопитающего
- 2137402 Пищевая Добавка БАД
- 2336899 Способ стимуляции миелопоэза
- 2336862 Способ получения раствора для лечения роговицы
- 2336830 Способ восстановления костных структур челюсти
- 2136696 Новый полипептид и средство против ВИЧ - Инфекции
- 2336092 Биоадгезивное средство, по существу свободное от воды
- 2336089 Средство и способ лечения заболеваний периодонтальных и пульпы
- 2336074 Средства и способы лечения заднего сегмента глаза
- 2235548 Ранозаживляющее средство
- 2135186 Способ лечения рефлекторных синдромов при остеохондрозе
- 2234945 Стабилизатор водного раствора и водосодержащего сырья
- 2334762 Растворимая ассоциативная карбоксиметилцеллюлоза
- 2234514 Макропористые хитозановые гранулы и способ их получения. Способ культивирования клеток
- 2133615 Средство для лечения неврологических заболеваний
- 2233164 Способ профилактики развития послеоперационных спаек брюшной полости
- 2133127 Неткатный материал, способ его получения и способ лечения
- 2333223 Альдегидные производные сиаловой кислоты и средства на их основе
- 2333007 Полипептидные вакцины для широкой защиты против рядов поколений менингококов с повышенной вирулентностью
- 2332985 Дозированные формы анестезирующих средств с длительным высвобождением для обезболивания
- 2132677 Косметическая маска
- 38603 Пленочный аппликатор
- 2232594 Средство содержащие ингибирующие остеокластогенез фактор и полисахарид
- 2332238 Средство для прокладок, раневых повязок и других изделий, контактирующих с кожей
- 2331668 Стромальные клетки, получение из жировой ткани, для заживления дефектов роговицы и внутриглазных дефектов и их использование
- 2331438 Альфа - 2 - Дельта Лигант для лечения симптомов нижних мочевыводящих путей
- 2331411Электропряденые аморфные фармоцевтические средства
- 2331367 Способ профилактики образования спаек и их рецидива
- 2130767 Масло в воде для получения косметических и дерматологических средств, способ косметической обработки
- 2230752 Поперечносшитые гиалуроновые кислоты и их применение в медицине
- 2230558 Способ восстановления и сохранения здоровья скмьи
- 2230550 Средства длительного высвобождения, способ их получения и применения
- 2230458 Поддержания здоровья суставов
- 2330290 Способ определения состояния метаболических процессов в ткани суставного хряща
- 2230073 Способ поперечного сшивания карбоксилированных полисахаридов
- 2329059 Способ лечения полипозного риносинусита
- 2329037 Комбинированная терапия для лечения иммуновоспалительных заболеваний
- 2128666 Гиалуроновая кислота и ее соли, способ очистки гиалуроновой кислоты, способ получения гиалуроновой кислоты. Фармацевтический препарат с гиалуроновой кислотой и средства с гиалуроновой кислотой используемые в офтальмологии
- 2328740 Способ экспресс - оценки действия зубных паст
- 2128502 Косметический гель
- 2328272 Суппозитории индуктора интерферона
- 2328268 Косметика содержащая амфолитный сополимер
- 2128057 Композиционная мембрана, способ ее получения и способ направленной регенерации тканей с ее применением
- 2128055 Средство замедленного освобождения и способ его получения
- 2128049 Свечи
- 2227743 Полипептидные варианты с повышенной гепаринсвязывающей способностью
- 2326893 Ковалентное и нековалентное сшивание гидрофильных полимеров
- 2326697 Новый перевязочный материал для быстрого заживления раневой поверхности кожи
- 2126264 Фармацевтическое средство с гиалуроновой кислотой
- 2326137 Способ получения содержащих альгинат пористых формованных изделий
- 2325902 Способ выделения гликозаминогликанов из минерализованной соединительной ткани
- 2225195 Репелленты против насекомых
- 2325193 Сосудистый стент
- 2325184 Улучшенные везикулы наружной мембраны бактерий
- 2325153 Многокомпонентная фармацевтическая дозированная форма
- 2325152 Удерживаемая в желудке система регулируемой доставки лекарственного средства
- 2029955 Способ предоперационного определения помутнения задней капсулы хрусталика при экстракции катаракты
- 2324688 Производные бисбензизоселеназолонила с противоопухолевым, противовоспалительным и антитромбоническим действием
- 2323017 Устройство и способ контролируемый доставки активных веществ в кожу
- 2323011 Содержащий Коллаген I и Коллаген II способный к рассасыванию внеклеточный матрикс, предназначенный для реконструирования хряща
- 2322955 Способ изготовления имплантанта для пластики дефектов хрящевой ткани
- 2322454 Антитело против CCR5
- 2322263 Система продолжительного высвобождения растворимого лекарственного средства
- 2221561 Витамин Е и его сложные эфиры
- 2321634 Гены участвующие в метаболизме углерода и продуцировании энергии
- 2321597 Биоматерьял, способ его приготовления и его применение, медицинское средство, имплантант и вкладыш
- 2121340 Средство для похудения
- 2220737 Средство для улучшения состояния опорно-двигательного аппарата
- 2220729 Гель используемый в стоматологии
- 2320720 Способ культивирования фибропластов для заместительной терапии
- 2320378 Накожный аппликатор
- 2320369 Средства, содержащие Альфа - 2 - Дельта Лиганды и ингибиторы обратного захвата серотонина/норадреналина
- 2320362 Местные фармацевтические средства, содержащие проантоцианидины, для лечения дерматитов
- 2320322 Биоадгезивная доставка лекарств
- 2320318 Чувствительное к температуре изменяющие состояние средство гидрогеля
- 2025120 Способ получения препарата, содержащего Фактор /G-CSF/, стимулирующий рост колоний гранулоцитов
- 2319490 Средство для введения железа при лечении синдрома беспокойных ног
- 25995 Содержащее адгезив приспособление для фиксации зубных протезов в полости рта
- 2218907 Средство для ухода за кожей лица и веками
- 2318830 Способ получения модифицированного дерматансульфата
- 2118153 Косметика - туш для ресниц
- 2217441 Способ получения полимера
- 2317296 Изетионатная соль селективного ингибитора CDK4
- 2217171 Мембрана для использования при направленной регенерации тканей
- 2317095 Экстракты ECHINACEA ANGUSTIFOLIA
- 2216332 Препарат для лечения астроза
- 2216314 Крем - маска для обезвоженной кожи
- 2316333 Средство оздоровительно-восстановительных косметических панто-магниевых ванн
- 2021304 Способ получения биологически активного средства
- 2115662 Способ получения гиалуроновой кислоты
- 2315627 Впрыскиваемые имплантанты на керамической основе для заполнения морщин, кожных впадин, шрамов
- 2315623 Средство получаемое путем лиофилизации препарата
- 2114862 Способ получения гиалуроновой кислоты
- 2314791 Лечебно-Косметическое средство
- 2314791 Косметический крем-бальзам для ухода за кожей лица и шеи
- 2214600 Способ оценки эффективности лечения неврологических проявлений
- 2114602 Способ косметической обработки
- 2114587 Раствор для защиты роговицы
- 2214283 Имплантант для подкожного или внутрикожного введения
- 2313370 Медицинские протезы, имеющие улучшенную биологическую совместимость
- 2313356 Препарат для лечения демодекоза
- 2313338 Средство на основе этиллинолеата и триэтилцитрата для лечения себореи и угрей
- 2313328 Косметика содержащая тонкодисперный и пористый порошок
- 2212880 Способ получения препарата содержащего антибиотик, с замедленным высвобождением активного вещества
- 2312640 Способ лечения Блефароконьюнктивальной формы синдрома сухого глаза
- 2017751 Способ получения гиалуроновой кислоты
- 2312145 Гены CORYNEBACTERIUM GLUTAMICUM, кодирующие белки, участвующие в синтезе мембран и мембранном транспорте
- 2311458 Белки вызывающие измененную иммуногенную реакцию. Способ их получения и использования
- 2311183 Улучшенное разделение с использованием гталуроновой кислоты
- 2311177 Ингибиторы интегрина для лечения заболевания глаз
- 2300069 Косметическая маска
- 2211024 Уход за сухой кожей
- 2310440 Раствор для защиты роговицы от повреждений
- 2309684 Лечение межфалангового остеоатроза узелковой формы
- 2309406 Способ мониторинга фиброза печени у больных хроническим гепатитом с (ХГС)
- 2209088 Опосредованная рецепторами доставка генов с использованием векторов на основе бактериофагов
- 2308967 Уменьшение объема ткани
- 2308962 Средство для опорно-дигательного аппарата
- 2308957 Способ получения препарата для мезотерапии
- 2308954 Средство для лечения ран, содержащее плазму или сыворотку крови
- 2308951 Комплексный способ профилактики вагинальных дисбактериозов
- 2308937 Косметическая биологически активная добавка и косметический литофитокомплекс на ее основе
- 2208638 ДНК (варианты), способ получения белка
- 2207885 Способ подачи небольшого объема лечебного раствора к целевому месту
- 2207858 Лишенные побочных эффектов производные простагландинов для лечения глаукомы
- 2207845 Твердая лекарственная форма пролонгированного действия
- 2207844 Препарат для местного неинвазивного применения
- 2207841 Средства с антиферментативным действием
- 2306335 Стволовые клетки и решетки полученные из жировой ткани
- 2306140 Новые рецепторы для Helicobacter pylori и их применение
- 2205612 Способ эндотелизации IN VITRO протезов кровеносных сосудов
- 2105540 Депигментирующее средство
- 2304960 Косметическое средство для кожи
- 2304616 Гены участвующие в гомеостазе и адаптации
- 2204550Способ получения длинноцепочечной N-Ацилированной кислотой Аминокислот
- 2204415 Способ получения изображения
- 2204394 Средство для лечения грибковых инфекций, желудочных язв
- 2204366 Способ хирургического лечения глаукомы
- 2104034 Вагинальное увлажняющие средство, способ его получения
- 2303991 Биологически активная добавка
- 2303990 БАД
- 2303973 Адсорбирующее изделие
- 2203676 Средство обладающее иммунокорригирующим действием
- 2203672 Способ предупреждения беременности
- 2303635 Гены кодирующие белки резистентности и толерантности к стрессам
- 2303529 Способ фиксации альгинатного геля на твердой фазе, способ получения клеточного чипа на его основе
- 2203078 Способ лечения гнойных ран
- 2302412 Гидразоно-малонитрилы
- 2102400 Способ получения гиалуроновой кислоты
- 2202356 Способ стимуляции репаративных процессов длительно незаживающих ран и трофических язв
- 2202336 Средство для ухода за кожей
- 2302231 Глазные капли
- 2102082 Способ магнитометрического исследования тела человека или животного
- 2301814 Полиакриламидный гидрогель
- 2201765 Гибридные матричные имплантанты и эксплантанты
- 2301677 Биотрансплантант для лечения дегенеративных и трвматических заболеваний хрящевой ткани и способ его получения
- 2301676 Способ лечения ревматизма
- 2301674 Способ лечения больных с переломами нижней челюсти
- 2301661 Средство с регулируемым освобождением и способ его получения
- 2005488 Средство для лечения болезней соединительной ткани
- 2200001 Крем для кожи
|
РОССИЙСКАЯ ФЕДЕРАЦИЯ

ФЕДЕРАЛЬНАЯ СЛУЖБА
ПО ИНТЕЛЛЕКТУАЛЬНОЙ СОБСТВЕННОСТИ
ПАТЕНТАМ И ТОВАРНЫМ ЗНАКАМ
|
Патент №2352356 |
(54) ИММУНОГЕННАЯ КОМПОЗИЦИЯ НА ОСНОВЕ АНТИГЕНА Chlamydia trachomatis (ВАРИАНТЫ) И ЕЕ ИСПОЛЬЗОВАНИЕ
(57) Реферат:
Изобретение относится к композициям, включающим в себя антигены Chlamydia trachomatis (CT) и к их применению в вакцинах. Конкретные комбинации антигенов в составе композиций могут быть выбраны из первой группы антигенов РерА, LcrE, ArtJ, DnaK и СТ398 и второй группы антигенов РерА, LcrE, ArtJ, DnaK, CT398, OmpH-подобного антигена, L7/L12, OmcA, AtoS, CT547, Eno, HtrA и MurG. Изобретение также относится к применению комбинаций адъювантов в сочетании с антигеном или антигенами, ассоциированными с переносимым половым путем заболеванием, такими как антигены Chlamydia trachomatis. Предпочтительные комбинации адъювантов включают в себя минеральные соли, такие как соли алюминия, и олигонуклеотиды, включающие в себя CpG-мотив. Комбинации антигенов CT по изобретению являются протективными в отношении заражения хламидиями, способны индуцировать антительный ответ, по меньшей мере, в плане Th1-клеточных профилей, которые могут быстро реагировать на воздействие хламидий. 11 н. и 17 з.п. ф-лы, 10 ил., 4 табл.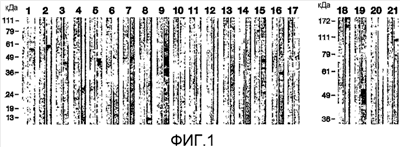
Все цитируемые здесь документы полностью включены в настоящее описание в качестве ссылки.
Перекрестная ссылка на связанные заявки, на основе которой заявляется приоритет
Данная заявка включает в себя полностью в качестве ссылки заявку на выдачу патента Великобритании  0315020.8, поданную 26 июня 2003 г.; предварительную заявку на выдачу патента США с серийным 0315020.8, поданную 26 июня 2003 г.; предварительную заявку на выдачу патента США с серийным  60/497649, поданную 25 августа 2003 г.; заявку на выдачу патента Великобритании 60/497649, поданную 25 августа 2003 г.; заявку на выдачу патента Великобритании  0402236.4, поданную 2 февраля 2004 г., и предварительную заявку на выдачу патента США с серийным 0402236.4, поданную 2 февраля 2004 г., и предварительную заявку на выдачу патента США с серийным  60/576375, поданную 1 июня 2004 г. 60/576375, поданную 1 июня 2004 г.
Область техники, к которой относится изобретение
Данное изобретение относится к области иммунологии и вакцинологии. В частности, оно относится к антигенам, происходящим из Chlamydia trachomatis, и их применению при иммунизации.
Предпосылки изобретения
Хламидии являются облигатными внутриклеточными паразитами эукариотических клеток, которые ответственны за эндемичные переносимые половым путем инфекции и различные другие патологические синдромы. Они представляют собой исключительную филогенетическую ветвь эубактерий, не имеющую близкого отношения к любым другим известным организмам.
Исторически хламидии были классифицированы в собственный порядок (Chlamydiales), составленный из единственного семейства (Chlamydiaceae), которое, в свою очередь, содержит единственный род (Chlamydia, также обозначенный как Chlamydophila). После этого данный порядок разделили по меньшей мере на четыре семейства, включающие в себя Chlamydiaceae, Parachlamydiaceae, Waddiaceae и Simkaniaceae. В данной более современной классификации семейство Chlamydiaceae включает в себя роды Chlamydophila и Chlamydia, причем Chlamydia trachomatis является видом в роде Chlamydia. См., Bush et al., (2001) Int.J. Syst. Evol. Microbiol. 51: 203-220.
Особенной характеристикой хламидий является их уникальный жизненный цикл, в котором бактерия чередует две морфологически различные формы: внеклеточная инфекционная форма (элементарные тельца, EB) и внутриклеточная неинфекционная форма (сетчатые тельца, RB). Жизненный цикл завершается реорганизацией RB в EB, которые покидают разрушенные клетки хозяина готовыми инфицировать дальнейшие клетки.
В настоящее время известны геномные последовательности по меньшей мере пяти видов хламидий или хламидофил: C. trachomatis, C. pneumoniae, C. muridarum, C. pecorum и C. psittaci (см. Kalman et al., (1999) Nature Genetics 21: 385-389; Read et al. (2000) Nucleic Acids Res. 28:1397-1406; Shirai et al. (2000) Nucleic Acids Res 28: 2311-2314; Stephens et al. (1998) Science 282: 754-759; и публикации Международного патента WO99/27105, WO00/27994 и WO99/28475).
Человеческие сероварианты ( серовары серовары ) C. trachomatis разделяются на два биоварианта ( ) C. trachomatis разделяются на два биоварианта ( биовара биовара ). Серовары A-K вызывают эпителиальные инфекции первично в тканях глаза (A-C) или в урогенитальном тракте (D-K). Серовары L1, L2 и L3 представляют собой агенты, вызывающие инвазивный паховый лимфогрануломатоз (LGV). ). Серовары A-K вызывают эпителиальные инфекции первично в тканях глаза (A-C) или в урогенитальном тракте (D-K). Серовары L1, L2 и L3 представляют собой агенты, вызывающие инвазивный паховый лимфогрануломатоз (LGV).
Хотя хламидийная инфекция сама вызывает заболевание, полагают, что тяжесть симптомов у некоторых пациентов на самом деле является следствием аномального иммунного ответа хозяина. Неспособность удалить инфекцию приводит к персистирующей иммунной стимуляции, и вместо помощи хозяина, она приводит к хронической инфекции с тяжелыми последствиями, такими как бесплодие и слепота. См., например, Ward, (1995) Apmis. 103: 769-96. Кроме того, защита, возникающая вследствие природной хламидийной инфекции, является обычно неполной, преходящей и штаммоспецифической.
Более 4 миллионов новых случаев заражения хламидийными переносящимися половым путем инфекциями диагностируются в Соединенных Штатах каждый год, и стоимость их лечения оценивается ежегодно в 4 миллиарда долларов, причем 80% относится к инфекции и заболеванию у женщин. Хотя хламидийные инфекции можно вылечить некоторыми антибиотиками, большинство женских инфекций являются бессимтомными и противомикробная терапия может задерживаться или быть неадекватной для предотвращения долгосрочных осложнений, особенно в странах с плохими условиями гигиены. Также были сообщения о штаммах Chlamydia с множественной устойчивостью к антибиотикам (Somani, et al., 2000). Более того, сообщалось, что устойчивость к лечению антибиотиками может приводить к образованию аберрантных форм C.trachomatis, которые могут реактивироваться позже (см. Hammerschlag M. R., (2002) Semin. Pediatr. Infect. Dis. 13: 239-248).
К несчастью, основные детерминанты патогенеза хламидиоза являются сложными и до сих пор не поняты, преимущественно из-за сложности работы с данным патогенным микроорганизмом и отсутствием адекватных способов генетической манипуляции с ним. В частности, очень мало известно об антигенной композиции поверхности элементарных тел, которая представляет собой участок, существенный для взаимодействий хозяин - патогенный микроорганизм и, вероятно, несет антигены, способные вызывать протективный иммунный ответ.
Из-за серьезной природы заболевания есть потребность в создании подходящих вакцин. Они могут использоваться (a) для иммунизации против хламидийной инфекции или против индуцируемого хламидиями заболевания (профилактическая вакцинация) или (b) для эрадикации установившейся хронической хламидийной инфекции (терапевтическая вакцинации). Будучи внутриклеточным паразитом, эта бактерия, однако, в общем, может избегать опосредованных антителом иммунных реакций.
Описаны различные антигенные белки C. trachomatis, и клеточная поверхность, в частности, была мишенью подробного исследования. См., например, Moulder (1991) Microbiol Rev 55(1): 143-190. Они включают в себя, например, Pgp3, MOMP, Hsp60 (GroEL) и Hsp70 (Dna-K-подобный). Ссылки, описывающие Pgp3, включают в себя Comanducci et al. (1994) Infect Immun 62 (12): 5491-5497 и публикации патентов EP 0499681 и WO95/28487). Ссылки, описывающие MOMP, включают в себя Murdin et al. (1993) Infect Immun 61: 4406-4414. Ссылки, описывающие Hsp60 (GroEL), включают в себя Cerrone et al. (1991) Infect Immun 59(1): 79-90). Ссылки, описывающие Hsp70 (DnaK-подобный), включают в себя Raulston et al. (1993) J. Biol. Chem. 268: 23139-23147. Однако не все из них подтвердились как эффективные вакцины и были идентифицированы дальнейшие кандидаты. См. WO03/049762.
Вакцины против патогенных микроорганизмов, таких как вирус гепатита B, дифтерия и столбняк, обычно содержат единственный белковый антиген (например, поверхностный HBV-антиген или столбнячный анатоксин). В отличие от них клеточные вакцины против коклюша обычно содержат по меньшей мере три белка B. pertussis, а вакцина против пневмококка Prevnar содержит семь отдельных конъюгированных сахаридных антигенов. Другие вакцины, например клеточные вакцины от коклюша, вакцины против кори, инактивированная вакцина против полиомиелита (IPV) и вакцины против менингококка OMV, представляют собой по своей истинной природе очень сложные смеси большого количества антигенов. Поэтому то, может ли защита быть вызвана единичным антигеном, маленьким количеством определенных антигенов или комплексной смесью неопределенных антигенов, зависит от данного патогенного организма. содержит семь отдельных конъюгированных сахаридных антигенов. Другие вакцины, например клеточные вакцины от коклюша, вакцины против кори, инактивированная вакцина против полиомиелита (IPV) и вакцины против менингококка OMV, представляют собой по своей истинной природе очень сложные смеси большого количества антигенов. Поэтому то, может ли защита быть вызвана единичным антигеном, маленьким количеством определенных антигенов или комплексной смесью неопределенных антигенов, зависит от данного патогенного организма.
Целью изобретения является предоставление дальнейших и улучшенных композиций для предоставления иммунитета против хламидийного заболевания и/или инфекции. Композиции основаны на комбинации двух или большего количества (например, трех или большего количества) антигенов C. trachomatis. Кроме того, композиции также могут основываться на применении антигенов C. trachomatis с комбинацией адъювантов, составленной так, чтобы они вызывали усиленный иммунный ответ. Предпочтительно комбинация адъювантов включает в себя соль алюминия и олигонуклеотид, включающий в себя CpG-мотив.
Сущность изобретения
Среди ~900 белков, ранее описанных для генома C. trachomatis (см., например, Stephens et al. (1998) Science 282: 754-759), авторы изобретения обнаружили группу из пяти антигенов Chlamydia trachomatis, которые особенно подходят для целей иммунизации, в частности, при использовании в комбинации. Поэтому изобретение относится к композиции, включающей в себя комбинацию антигенов Chlamydia trachomatis, причем указанная комбинация состоит из двух, трех, четырех или всех пяти антигенов Chlamydia trachomatis первой группы антигенов, причем указанная первая группа антигенов состоит из: (1) PepA (CT045); (2) LcrE (CT089); (3) ArtJ (CT381); (4) DnaK (CT396); и (5) CT398. Данные антигены обозначаются здесь как  первая группа антигенов первая группа антигенов . Предпочтительно данная комбинация включает в себя LcrE (CT089). . Предпочтительно данная комбинация включает в себя LcrE (CT089).
Изобретение также относится к несколько большей группе из 13 антигенов Chlamydia trachomatis, которые особенно подходят для целей иммунизации, в частности при использовании в комбинации. (Данная вторая группа антигенов включает в себя пять антигенов Chlamydia trachomatis первой группы антигенов.) Данные 13 антигенов Chlamydia trachomatis образуют вторую группу антигенов: (1) PepA (CT045); (2) LcrE (CT089); (3) ArtJ (CT381); (4) DnaK (CT396); (5) CT398; (6) OmpEI-подобный (CT242); (7) L7/L12 (CT316); (8) OmcA (CT444); (9) AtoS (CT467); (10) CT547; (11) Eno (CT587); (12) HtrA (CT823) и (13) MurG (CT761). Данные антигены обозначаются здесь как  вторая группа антигенов вторая группа антигенов . Предпочтительно комбинация включает в себя один или несколько из LcrE(CT089) и OmpH-подобный белок (CT242). . Предпочтительно комбинация включает в себя один или несколько из LcrE(CT089) и OmpH-подобный белок (CT242).
Поэтому изобретение относится к композиции, содержащей комбинацию антигенов Chlamydia trachomatis, причем указанная комбинация выбрана из группы, состоящей из двух, трех, четырех, пяти, шести, семи, восьми, девяти, десяти, одиннадцати, двенадцати или тринадцати антигенов Chlamydia trachomatis из второй группы антигенов. Предпочтительно комбинация выбрана из группы, состоящей из двух, трех, четырех или пяти антигенов Chlamydia trachomatis из второй группы антигенов. Еще более предпочтительно комбинация состоит из пяти антигенов Chlamydia trachomatis из второй группы антигенов.
Композиции согласно изобретению могут включать в себя один или несколько иммунорегуляторных средств. Такие иммунорегуляторные средства включают в себя адъюванты. Предпочтительно адъюванты выбирают из группы, состоящей из TH1-адъюванта и TH2-адъюванта. Еще более предпочтительно адъюванты выбирают из группы, состоящей из солей алюминия и олигонуклеотидов, включающих в себя CpG-мотив. Поэтому изобретение относится к композиции, состоящей из антигена Chlamydia trachomatis или антигена, ассоциированного с переносимым половым путем заболеванием олигонуклеотида, содержащего CpG-мотив, и минеральной соли, такой как соль алюминия.
Краткое описание чертежей
На фигуре 1 показан вестерн-блот-анализ общих белковых экстрактов из EB C. trachomatis, проведенный с использованием мышиных иммунных сывороток против рекомбинантных антигенов. Показаны только FACS-позитивные, не нейтрализующие сыворотки. Для идентификации антигена, пожалуйста, см. таблицу 1(a). Идентификационные номера панели соответствуют номерам, находящимся в колонке анализа WB в таблице 1(a). На каждой панели полоса справа показывает результаты, полученные с антигенспецифичной иммунной сывороткой (I), и полоса слева показывает результаты, полученные с соответствующей преиммунной сывороткой (P).
На фигуре 2 проиллюстрованы титры сывороток, дающих 50%-ную нейтрализацию инфективности для 9 описанных в тексте рекомбинантных антигенов C. trachomatis (PepA, ArtJ, DnaK, CT398, CT547, енолаза, MOMP, OmpH-подобный и AtoS). Каждый титр оценивали в 3 отдельных экспериментах (показаны значения стандартной ошибки среднего).
Фигура 3 включает в себя FACS-анализ связывания антител с цельными ЕВ C. trachomatis. Серые гистограммы (события импульсов в каналах флуоресценции) представляют собой выходные данные FACS для EB, окрашенных фоновыми контрольными антителами. Белые гистограммы представляют собой выходные данные FACS для EB, окрашенных антигенспецифичными антителами. Положительный контроль представлен мышиной гипериммунной сывороткой против цельных ЕВ C.trachomatis, с соответствующей преиммунной сывороткой мыши в качестве контроля фона; отрицательные контроли получали путем окрашивания EB мышиной гипериммунной сывороткой против HIS или против GST с соответствующей преиммунной сывороткой в качестве фонового контроля. Для каждой сыворотки фоновый контроль был представлен мышиной гипериммунной сывороткой против GST или против HIS в зависимости от белка слияния, применяемого для иммунизации. Данные вестерн-блоттинга, полученные с общим белком EB, окрашенным той же антисывороткой, что использовали для анализа FACS, также показаны в каждой панели.
На фигуре 4 показан ускоренный клиренс Chlamydia trachomatis (CT) через 21 сутки после стимуляции мышей, вакцинированных смесью CT242 (OmpH-подобного) и CT316 (L7/L12) в комбинации с CFA, по сравнению с мышами, вакцинированными только CFA.
На фигуре 5 показан ускоренный клиренс Chlamydia trachomatis (CT) через 21 сутки после стимуляции мышей, вакцинированных смесью CT467 (AtoS) и CT444(OmcA) в комбинации с CFA, по сравнению с клиренсом СТ мышей, вакцинированными только CFA.
На фигуре 6 показан ускоренный клиренс Chlamydia trachomatis (CT) через 21 сутки после стимуляции мышей, вакцинированных смесью CT812 (PmpD) and CT082 (гипотетический) в комбинации с CFA, по сравнению с клиренсом СТ мышей, вакцинированными только CFA.
На фигурах 7(a) и 7(b) показан статистически значимый клиренс Chlamydia trachomatis через 14 суток после стимуляции мышей, вакцинированных смесью CT242 и CT316 в комбинации с CFA, по сравнению с клиренсом СТ мышей, вакцинированными только CFA.
На фигуре 7(c) показан титр нейтрализации мышей, вакцинированных смесью CT242 и CT316 в комбинации с CFA.
На фигурах 8(а) и 8(b) показан ускоренный клиренс Chlamydia trachomatis через 14 суток после стимуляции мышей, вакцинированных смесью пяти антигенов СТ, которые представляют собой CT045, CT089, CT396, CT398 и CT381, в комбинации с AlOH и CpG, по сравнению с клиренсом СТ мышей, вакцинированными только AlOH и CpG.
На фигуре 8(c) показаны изотипы специфичных в отношении Chlamydia антител IgG (IgG1 и IgG2a) для сывороток перед повторной иммунизацией из (i) мышей, вакцинированных смесью пяти антигенов CT, которые представляют собой CT045, CT089, CT396, CT398 и CT381, в сочетании с AlOH и CpG, и (ii) мышей, вакцинированных смесью пяти антигенов CT, которые представляют собой CT045, CT089, CT396, CT398 и CT381, в комбинации с CFA.
На фигурах 9(a) и 9(b) показан клиренс Chlamydia trachomatis через 7, 14 и 21 сутки после стимуляции мышей, вакцинированных смесью пяти антигенов СТ, которые представляют собой CT045, CT089, CT396, CT398 and CT381, в комбинации с AlOH и CpG, по сравнению с клиренсом СТ мышей, вакцинированными только AlOH и CpG.
На фигуре 9(c) показан титр нейтрализации и изотипы специфичных в отношении Chlamydia антител IgG (IgG1 и IgG2) для сывороток перед повторной иммунизацией из мышей, вакцинированных смесью пяти антигенов СТ, которые представляют собой CT045, CT089, CT396, CT398 и CT381, в комбинации с AlOH и CpG.
На фигурах 10(a) и (b) показан титр нейтрализации для мышей, вакцинированных смесью из пяти антигенов CT, которые представляют собой CT045, CT089, CT396, CT398 и CT381, в комбинации с AlOH и CpG, по сравнению с титром нейтрализации, полученным на мышах, вакцинированных только AlOH и CpG.
Подробное описание изобретения
Как описано выше, изобретение относится к композициям, включающим в себя комбинацию антигенов Chlamydia trachomatis, где комбинации могут быть выбраны из групп антигенов, которые, как выявлено настоящими заявителями, особенно подходят для целей иммунизации, в частности при использовании в комбинации. В одном из вариантов осуществления изобретение относится к композиции, содержащей комбинацию антигенов Chlamydia trachomatis, причем указанная комбинация состоит из двух, трех, четырех или всех пяти антигенов Chlamydia trachomatis из первой группы антигенов, причем указанная первая группа антигенов состоит из: (1) PepA (CT045); (2) LcrE (CT089); (3) ArtJ (CT381); (4) DnaK (CT396); и (5) CT398. Данные антигены обозначены здесь как  первая группа антигенов первая группа антигенов . .
Предпочтительно композиция согласно изобретению содержит комбинацию антигенов Chlamydia trachomatis, причем данная комбинация выбрана из группы, состоящей из: (1) PepA & LcrE; (2) PepA & ArtJ; (3) PepA & DnaK; (4) PepA & CT398; (5) LcrE & ArtJ; (6) LcrE & DnaK; (7) LcrE &CT398; (8) ArtJ & DnaK; (9) ArtJ & CT398; (10) DnaK & CT398; (11) PepA, LcrE & ArtJ; (12) PepA, LcrE & DnaK; (13) PepA, LcrE & CT398; (14) PepA, ArtJ & DnaK; (15) PepA, ArtJ and CT398; (16) PepA, DnaK & CT398; (17) LcrE, ArtJ & DnaK; (18) LcrE, ArtJ & CT398; (19) LcrE, DnaK & CT398; (20) ArtJ, DnaK & CT398; (21) PepA, LcrE, ArtJ & DnaK; (22) PepA, LcrE, DnaK & CT398; (23) PepA, ArtJ, DnaK & CT398; (24) PepA, LcrE, ArtJ & CT398; (25) LcrE, ArtJ, DnaK & CT398; и (26) PepA, LcrE, ArtJ, DnaK & CT398. Предпочтительно композиция антигенов Chlamydia trachomatis состоит из PepA, LcrE, ArtJ, DnaK & CT398. Предпочтительно комбинация включает в себя LcrE (CT089).
Изобретение также относится к несколько большей группе из 13 антигенов Chlamydia trachomatis, которые особенно подходят для целей иммунизации, в частности, при использовании в комбинации. (Данная вторая группа антигенов включает в себя пять антигенов Chlamydia trachomatis первой группы антигенов.) Данные 13 антигенов Chlamydia trachomatis образуют вторую группу антигенов: (1) PepA (CT045); (2) LcrE (CT089); (3) ArtJ (CT381); (4) DnaK (CT396); (5) CT398; (6) OmpH-подобный (CT242); (7) L7/L12 (CT316); (8) OmcA (CT444); (9) AtoS (CT467); (10) CT547; (11) Eno (CT587); (12) HtrA (CT823) и (13) MurG (CT761). Данные антигены обозначаются здесь как  вторая группа антигенов вторая группа антигенов . .
Поэтому изобретение относится к композиции, содержащей комбинацию антигенов Chlamydia trachomatis, причем указанная комбинация выбрана из группы, состоящей из двух, трех, четырех, пяти, шести, семи, восьми, девяти, десяти, одиннадцати, двенадцати или тринадцати антигенов Chlamydia trachomatis из второй группы антигенов. Предпочтительно комбинация выбрана из группы, состоящей из двух, трех, четырех или пяти антигенов Chlamydia trachomatis из второй группы антигенов. Еще более предпочтительно комбинация состоит из пяти антигенов Chlamydia trachomatis из второй группы антигенов. Предпочтительно комбинация включает в себя один из LcrE(CT089) и OmpH-подобного белка (CT242) или оба данных белка.
Каждый из антигенов Chlamydia trachomatis из первой и второй группы более подробно описан ниже.
(1) Белок лейциламинопептидаза А PepA (CT045). Один из примеров белка  PepA PepA описан как SEQ ID NO: 71 & 72 в WO 03/049762 (инвентарный номер GenBank: AAC67636, GI:3328437; описан как SEQ ID NO: 71 & 72 в WO 03/049762 (инвентарный номер GenBank: AAC67636, GI:3328437;  CT045 CT045 ; SEQ ID NO:1 в прилагаемом списке последовательностей). Полагают, что он катализирует удаление незамещенной N-концевой аминокислоты из различных полипептидов. Предпочтительные белки PepA для применения согласно изобретению включают в себя аминокислотную последовательность: (a), которая характеризуется идентичностью 50% или более (например, 60%, 65%, 70%, 75%, 80%, 85%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99%, 99,5% или более) в отношении SEQ ID NO: 1; и/или (b), которая представляет собой фрагмент по меньшей мере из n следующих друг за другом аминокислот SEQ ID NO: 1, где n представляет собой 7 или более (например, 8, 10, 12, 14, 16, 18, 20, 25, 30, 35, 40, 50, 60, 70, 80, 90, 100, 150, 200, 250 или более). Данные белки PepA включают в себя варианты (например, аллельные варианты, гомологи, ортологи, паралоги, мутанты, и т.д.) SEQ ID NO: 1. Предпочтительные фрагменты (b) содержат эпитоп из SEQ ID NO: 1. Другие предпочтительные фрагменты лишены одной или нескольких аминокислот (например, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 15, 20, 25 или более) с C-конца и/или одной или нескольких аминокислот (например, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 15, 20, 25 или более) с N-конца SEQ ID NO: 1. Другие фрагменты лишены одного или нескольких доменов белка (например, пропуск сигнального пептида, цитоплазматического домена, трансмембранного домена или внеклеточного домена). Белок PepA может содержать ионы марганца. ; SEQ ID NO:1 в прилагаемом списке последовательностей). Полагают, что он катализирует удаление незамещенной N-концевой аминокислоты из различных полипептидов. Предпочтительные белки PepA для применения согласно изобретению включают в себя аминокислотную последовательность: (a), которая характеризуется идентичностью 50% или более (например, 60%, 65%, 70%, 75%, 80%, 85%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99%, 99,5% или более) в отношении SEQ ID NO: 1; и/или (b), которая представляет собой фрагмент по меньшей мере из n следующих друг за другом аминокислот SEQ ID NO: 1, где n представляет собой 7 или более (например, 8, 10, 12, 14, 16, 18, 20, 25, 30, 35, 40, 50, 60, 70, 80, 90, 100, 150, 200, 250 или более). Данные белки PepA включают в себя варианты (например, аллельные варианты, гомологи, ортологи, паралоги, мутанты, и т.д.) SEQ ID NO: 1. Предпочтительные фрагменты (b) содержат эпитоп из SEQ ID NO: 1. Другие предпочтительные фрагменты лишены одной или нескольких аминокислот (например, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 15, 20, 25 или более) с C-конца и/или одной или нескольких аминокислот (например, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 15, 20, 25 или более) с N-конца SEQ ID NO: 1. Другие фрагменты лишены одного или нескольких доменов белка (например, пропуск сигнального пептида, цитоплазматического домена, трансмембранного домена или внеклеточного домена). Белок PepA может содержать ионы марганца.
(2) Белок ответа на низкий уровень кальция Е LcrE (CT089). Один из примеров белка  LcrE LcrE описан как SEQ ID NO: 61 & 62 в WO 03/049762 (инвентарный номер GenBank: AAC67680, GI:3328485; описан как SEQ ID NO: 61 & 62 в WO 03/049762 (инвентарный номер GenBank: AAC67680, GI:3328485;  CT089 CT089 ; SEQ ID NO: 2 в прилагаемом списке последовательностей). Предпочтительные белки LcrE для применения согласно изобретению включают в себя аминокислотную последовательность: (a), которая характеризуется идентичностью 50% или более (например, 60%, 65%, 70%, 75%, 80%, 85%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99%, 99,5% или более) в отношении SEQ ID NO: 2; и/или (b), которая представляет собой фрагмент, по меньшей мере из n следующих друг за другом аминокислот SEQ ID NO: 2, где n представляет собой 7 или более (например, 8, 10, 12, 14, 16, 18, 20, 25, 30, 35, 40, 50, 60, 70, 80, 90, 100, 150, 200, 250 или более). Данные белки LcrE включают в себя варианты (например, аллельные варианты, гомологи, ортологи, паралоги, мутанты, и т.д.) SEQ ID NO: 2. Предпочтительные фрагменты (b) содержат эпитоп из SEQ ID NO: 2. Другие предпочтительные фрагменты лишены одной или нескольких аминокислот (например, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 15, 20, 25 или более) с C-конца и/или одной или нескольких аминокислот (например, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 15, 20, 25 или более) с N-конца SEQ ID NO: 2. Другие фрагменты лишены одного или нескольких доменов белка (например, пропуск сигнального пептида, цитоплазматического домена, трансмембранного домена или внеклеточного домена). ; SEQ ID NO: 2 в прилагаемом списке последовательностей). Предпочтительные белки LcrE для применения согласно изобретению включают в себя аминокислотную последовательность: (a), которая характеризуется идентичностью 50% или более (например, 60%, 65%, 70%, 75%, 80%, 85%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99%, 99,5% или более) в отношении SEQ ID NO: 2; и/или (b), которая представляет собой фрагмент, по меньшей мере из n следующих друг за другом аминокислот SEQ ID NO: 2, где n представляет собой 7 или более (например, 8, 10, 12, 14, 16, 18, 20, 25, 30, 35, 40, 50, 60, 70, 80, 90, 100, 150, 200, 250 или более). Данные белки LcrE включают в себя варианты (например, аллельные варианты, гомологи, ортологи, паралоги, мутанты, и т.д.) SEQ ID NO: 2. Предпочтительные фрагменты (b) содержат эпитоп из SEQ ID NO: 2. Другие предпочтительные фрагменты лишены одной или нескольких аминокислот (например, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 15, 20, 25 или более) с C-конца и/или одной или нескольких аминокислот (например, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 15, 20, 25 или более) с N-конца SEQ ID NO: 2. Другие фрагменты лишены одного или нескольких доменов белка (например, пропуск сигнального пептида, цитоплазматического домена, трансмембранного домена или внеклеточного домена).
(3) Аргининсвязывающий белок ArtJ (CT381). Один из примеров белка  ArtJ ArtJ описан как SEQ ID NO: 105 & 106 в WO 03/049762 (инвентарный номер GenBank: AAC67977, GI:3328806; описан как SEQ ID NO: 105 & 106 в WO 03/049762 (инвентарный номер GenBank: AAC67977, GI:3328806;  CT381 CT381 ; SEQ ID NO:3 в прилагаемом списке последовательностей). Предпочтительные белки ArtJ для применения согласно изобретению включают в себя аминокислотную последовательность: (a), которая характеризуется идентичностью 50% или более (например, 60%, 65%, 70%, 75%, 80%, 85%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99%, 99,5% или более) в отношении SEQ ID NO: 3; и/или (b), которая представляет собой фрагмент по меньшей мере из n следующих друг за другом аминокислот SEQ ID NO: 3, где n представляет собой 7 или более (например, 8, 10, 12, 14, 16, 18, 20, 25, 30, 35, 40, 50, 60, 70, 80, 90, 100, 150, 200, 250 или более). Данные белки ArtJ включают в себя варианты (например, аллельные варианты, гомологи, ортологи, паралоги, мутанты, и т.д.) SEQ ID NO: 3. Предпочтительные фрагменты (b) содержат эпитоп из SEQ ID NO: 3. Другие предпочтительные фрагменты лишены одной или нескольких аминокислот (например, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 15, 20, 25 или более) с C-конца и/или одной или нескольких аминокислот (например, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 15, 20, 25 или более) с N-конца SEQ ID NO: 3. Другие фрагменты лишены одного или нескольких доменов белка (например, пропуск сигнального пептида, цитоплазматического домена, трансмембранного домена или внеклеточного домена). Белок ArtJ может связываться с малой молекулой, такой как аргинин или другая аминокислота. ; SEQ ID NO:3 в прилагаемом списке последовательностей). Предпочтительные белки ArtJ для применения согласно изобретению включают в себя аминокислотную последовательность: (a), которая характеризуется идентичностью 50% или более (например, 60%, 65%, 70%, 75%, 80%, 85%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99%, 99,5% или более) в отношении SEQ ID NO: 3; и/или (b), которая представляет собой фрагмент по меньшей мере из n следующих друг за другом аминокислот SEQ ID NO: 3, где n представляет собой 7 или более (например, 8, 10, 12, 14, 16, 18, 20, 25, 30, 35, 40, 50, 60, 70, 80, 90, 100, 150, 200, 250 или более). Данные белки ArtJ включают в себя варианты (например, аллельные варианты, гомологи, ортологи, паралоги, мутанты, и т.д.) SEQ ID NO: 3. Предпочтительные фрагменты (b) содержат эпитоп из SEQ ID NO: 3. Другие предпочтительные фрагменты лишены одной или нескольких аминокислот (например, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 15, 20, 25 или более) с C-конца и/или одной или нескольких аминокислот (например, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 15, 20, 25 или более) с N-конца SEQ ID NO: 3. Другие фрагменты лишены одного или нескольких доменов белка (например, пропуск сигнального пептида, цитоплазматического домена, трансмембранного домена или внеклеточного домена). Белок ArtJ может связываться с малой молекулой, такой как аргинин или другая аминокислота.
(4) Белок теплового шока 70 (шаперон) DnaK (CT396). Один из примеров белка  DnaK DnaK описан как SEQ ID NO: 107 & 108 в WO 03/049762 (инвентарный номер GenBank: AAC67993, GI:3328822; описан как SEQ ID NO: 107 & 108 в WO 03/049762 (инвентарный номер GenBank: AAC67993, GI:3328822;  CT396 CT396 ; SEQ ID NO: 4 в прилагаемом списке последовательностей). Другие последовательности описаны в Birkelund et al. (1990) Infect Immun 58: 2098-2104; Danilition et al. (1990) Infect Immun 58: 189-196; and Raulston et al. (1993) J Biol Chem 268: 23139-23147. Предпочтительные белки DnaK для применения согласно изобретению включают в себя аминокислотную последовательность: (a), которая характеризуется идентичностью 50% или более (например, 60%, 65%, 70%, 75%, 80%, 85%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99%, 99,5% или более) в отношении SEQ ID NO: 4; и/или (b), которая представляет собой фрагмент, по меньшей мере из n следующих друг за другом аминокислот SEQ ID NO: 4, где n представляет собой 7 или более (например, 8, 10, 12, 14, 16, 18, 20, 25, 30, 35, 40, 50, 60, 70, 80, 90, 100, 150, 200, 250 или более). Данные белки DnaK включают в себя варианты (например, аллельные варианты, гомологи, ортологи, паралоги, мутанты, и т.д.) SEQ ID NO: 4. Предпочтительные фрагменты (b) содержат эпитоп из SEQ ID NO: 4. Другие предпочтительные фрагменты лишены одной или нескольких аминокислот (например, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 15, 20, 25 или более) с C-конца и/или одной или нескольких аминокислот (например, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 15, 20, 25 или более) с N-конца SEQ ID NO: 4. Другие фрагменты лишены одного или нескольких доменов белка (например, пропуск сигнального пептида, цитоплазматического домена, трансмембранного домена или внеклеточного домена). Белок DnaK может быть фосфорилирован, например, по треонину или тирозину. ; SEQ ID NO: 4 в прилагаемом списке последовательностей). Другие последовательности описаны в Birkelund et al. (1990) Infect Immun 58: 2098-2104; Danilition et al. (1990) Infect Immun 58: 189-196; and Raulston et al. (1993) J Biol Chem 268: 23139-23147. Предпочтительные белки DnaK для применения согласно изобретению включают в себя аминокислотную последовательность: (a), которая характеризуется идентичностью 50% или более (например, 60%, 65%, 70%, 75%, 80%, 85%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99%, 99,5% или более) в отношении SEQ ID NO: 4; и/или (b), которая представляет собой фрагмент, по меньшей мере из n следующих друг за другом аминокислот SEQ ID NO: 4, где n представляет собой 7 или более (например, 8, 10, 12, 14, 16, 18, 20, 25, 30, 35, 40, 50, 60, 70, 80, 90, 100, 150, 200, 250 или более). Данные белки DnaK включают в себя варианты (например, аллельные варианты, гомологи, ортологи, паралоги, мутанты, и т.д.) SEQ ID NO: 4. Предпочтительные фрагменты (b) содержат эпитоп из SEQ ID NO: 4. Другие предпочтительные фрагменты лишены одной или нескольких аминокислот (например, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 15, 20, 25 или более) с C-конца и/или одной или нескольких аминокислот (например, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 15, 20, 25 или более) с N-конца SEQ ID NO: 4. Другие фрагменты лишены одного или нескольких доменов белка (например, пропуск сигнального пептида, цитоплазматического домена, трансмембранного домена или внеклеточного домена). Белок DnaK может быть фосфорилирован, например, по треонину или тирозину.
(5) белок CT398 (гипотетический белок). Один из примеров белка  CT398 CT398 описан как SEQ ID NO: 111 & 112 в WO 03/049762 (инвентарный номер GenBank: AAC67995, GI:3328825; SEQ ID NO: 5 в прилагаемом списке последовательностей). Предпочтительные белки CT398 для применения согласно изобретению включают в себя аминокислотную последовательность: (a), которая характеризуется идентичностью 50% или более (например, 60%, 65%, 70%, 75%, 80%, 85%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99%, 99,5% или более) в отношении SEQ ID NO: 5; и/или (b), которая представляет собой фрагмент, по меньшей мере из n следующих друг за другом аминокислот SEQ ID NO: 5, где n представляет собой 7 или более (например, 8, 10, 12, 14, 16, 18, 20, 25, 30, 35, 40, 50, 60, 70, 80, 90, 100, 150, 200, 250 или более). Данные белки CT398 включают в себя варианты (например, аллельные варианты, гомологи, ортологи, паралоги, мутанты, и т.д.) SEQ ID NO: 5. Предпочтительные фрагменты (b) содержат эпитоп из SEQ ID NO: 5. Другие предпочтительные фрагменты лишены одной или нескольких аминокислот (например, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 15, 20, 25 или более) с C-конца и/или одной или нескольких аминокислот (например, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 15, 20, 25 или более) с N-конца SEQ ID NO: 5. Другие фрагменты лишены одного или нескольких доменов белка (например, пропуск сигнального пептида, цитоплазматического домена, трансмембранного домена или внеклеточного домена). описан как SEQ ID NO: 111 & 112 в WO 03/049762 (инвентарный номер GenBank: AAC67995, GI:3328825; SEQ ID NO: 5 в прилагаемом списке последовательностей). Предпочтительные белки CT398 для применения согласно изобретению включают в себя аминокислотную последовательность: (a), которая характеризуется идентичностью 50% или более (например, 60%, 65%, 70%, 75%, 80%, 85%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99%, 99,5% или более) в отношении SEQ ID NO: 5; и/или (b), которая представляет собой фрагмент, по меньшей мере из n следующих друг за другом аминокислот SEQ ID NO: 5, где n представляет собой 7 или более (например, 8, 10, 12, 14, 16, 18, 20, 25, 30, 35, 40, 50, 60, 70, 80, 90, 100, 150, 200, 250 или более). Данные белки CT398 включают в себя варианты (например, аллельные варианты, гомологи, ортологи, паралоги, мутанты, и т.д.) SEQ ID NO: 5. Предпочтительные фрагменты (b) содержат эпитоп из SEQ ID NO: 5. Другие предпочтительные фрагменты лишены одной или нескольких аминокислот (например, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 15, 20, 25 или более) с C-конца и/или одной или нескольких аминокислот (например, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 15, 20, 25 или более) с N-конца SEQ ID NO: 5. Другие фрагменты лишены одного или нескольких доменов белка (например, пропуск сигнального пептида, цитоплазматического домена, трансмембранного домена или внеклеточного домена).
(6) OmpH-подобный белок наружной мембраны (CT242). Один из примеров  OmpH-подобного OmpH-подобного белка описан как SEQ ID NO: 57 & 58 в WO 03/049762 (инвентарный номер GenBank: AAC67835, GI:3328652; белка описан как SEQ ID NO: 57 & 58 в WO 03/049762 (инвентарный номер GenBank: AAC67835, GI:3328652;  CT242 CT242 ; SEQ ID NO: 6 в прилагаемом списке последовательностей). Последовательность варианта описана в Bannantine & Rockey (1999) Microbiology 145: 2077-2085. Предпочтительные OmpH-подобные белки для применения согласно изобретению включают в себя аминокислотную последовательность: (a), которая характеризуется идентичностью 50% или более (например, 60%, 65%, 70%, 75%, 80%, 85%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99%, 99,5% или более) в отношении SEQ ID NO: 6; и/или (b), которая представляет собой фрагмент по меньшей мере из n следующих друг за другом аминокислот SEQ ID NO: 6, где n представляет собой 7 или более (например, 8, 10, 12, 14, 16, 18, 20, 25, 30, 35, 40, 50, 60, 70, 80, 90, 100, 150, 200, 250 или более). Данные OmpH-подобные белки включают в себя варианты (например, аллельные варианты, гомологи, ортологи, паралоги, мутанты, и т.д.) SEQ ID NO: 6. Предпочтительные фрагменты (b) содержат эпитоп из SEQ ID NO: 6. Другие предпочтительные фрагменты лишены одной или нескольких аминокислот (например, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 15, 20, 25 или более) с C-конца и/или одной или нескольких аминокислот (например, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 15, 20, 25 или более; предпочтительно 19 или более, для удаления сигнального пептида) с N-конца SEQ ID NO: 6. Другие фрагменты лишены одного или нескольких доменов белка (например, пропуск сигнального пептида, как описано выше, цитоплазматического домена, трансмембранного домена или внеклеточного домена). ; SEQ ID NO: 6 в прилагаемом списке последовательностей). Последовательность варианта описана в Bannantine & Rockey (1999) Microbiology 145: 2077-2085. Предпочтительные OmpH-подобные белки для применения согласно изобретению включают в себя аминокислотную последовательность: (a), которая характеризуется идентичностью 50% или более (например, 60%, 65%, 70%, 75%, 80%, 85%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99%, 99,5% или более) в отношении SEQ ID NO: 6; и/или (b), которая представляет собой фрагмент по меньшей мере из n следующих друг за другом аминокислот SEQ ID NO: 6, где n представляет собой 7 или более (например, 8, 10, 12, 14, 16, 18, 20, 25, 30, 35, 40, 50, 60, 70, 80, 90, 100, 150, 200, 250 или более). Данные OmpH-подобные белки включают в себя варианты (например, аллельные варианты, гомологи, ортологи, паралоги, мутанты, и т.д.) SEQ ID NO: 6. Предпочтительные фрагменты (b) содержат эпитоп из SEQ ID NO: 6. Другие предпочтительные фрагменты лишены одной или нескольких аминокислот (например, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 15, 20, 25 или более) с C-конца и/или одной или нескольких аминокислот (например, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 15, 20, 25 или более; предпочтительно 19 или более, для удаления сигнального пептида) с N-конца SEQ ID NO: 6. Другие фрагменты лишены одного или нескольких доменов белка (например, пропуск сигнального пептида, как описано выше, цитоплазматического домена, трансмембранного домена или внеклеточного домена).
(7) Рибосомальный белок L7/L12 (CT316). Один из примеров белка  L7/L12 L7/L12 находится в GenBank под инвентарным номером AAC67909 (GI: 3328733; находится в GenBank под инвентарным номером AAC67909 (GI: 3328733;  CT316 CT316 ; SEQ ID NO: 7 в прилагаемом списке последовательностей). Предпочтительные белки L7/L12 для применения согласно изобретению включают в себя аминокислотную последовательность: (a), которая характеризуется идентичностью 50% или более (например, 60%, 65%, 70%, 75%, 80%, 85%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99%, 99,5% или более) в отношении SEQ ID NO: 7; и/или (b), которая представляет собой фрагмент, по меньшей мере из n следующих друг за другом аминокислот SEQ ID NO: 7, где n представляет собой 7 или более (например, 8, 10, 12, 14, 16, 18, 20, 25, 30, 35, 40, 50, 60, 70, 80, 90, 100, 150, 200, 250 или более). Данные белки L7/L12 включают в себя варианты (например, аллельные варианты, гомологи, ортологи, паралоги, мутанты, и т.д.) SEQ ID NO: 7. Предпочтительные фрагменты (b) содержат эпитоп из SEQ ID NO: 7. Другие предпочтительные фрагменты лишены одной или нескольких аминокислот (например, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 15, 20, 25 или более) с C-конца и/или одной или нескольких аминокислот (например, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 15, 20, 25 или более) с N-конца SEQ ID NO: 7. Другие фрагменты лишены одного или нескольких доменов белка (например, пропуск сигнального пептида, цитоплазматического домена, трансмембранного домена или внеклеточного домена). Белок L7/L12 может модифицироваться с N-конца. ; SEQ ID NO: 7 в прилагаемом списке последовательностей). Предпочтительные белки L7/L12 для применения согласно изобретению включают в себя аминокислотную последовательность: (a), которая характеризуется идентичностью 50% или более (например, 60%, 65%, 70%, 75%, 80%, 85%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99%, 99,5% или более) в отношении SEQ ID NO: 7; и/или (b), которая представляет собой фрагмент, по меньшей мере из n следующих друг за другом аминокислот SEQ ID NO: 7, где n представляет собой 7 или более (например, 8, 10, 12, 14, 16, 18, 20, 25, 30, 35, 40, 50, 60, 70, 80, 90, 100, 150, 200, 250 или более). Данные белки L7/L12 включают в себя варианты (например, аллельные варианты, гомологи, ортологи, паралоги, мутанты, и т.д.) SEQ ID NO: 7. Предпочтительные фрагменты (b) содержат эпитоп из SEQ ID NO: 7. Другие предпочтительные фрагменты лишены одной или нескольких аминокислот (например, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 15, 20, 25 или более) с C-конца и/или одной или нескольких аминокислот (например, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 15, 20, 25 или более) с N-конца SEQ ID NO: 7. Другие фрагменты лишены одного или нескольких доменов белка (например, пропуск сигнального пептида, цитоплазматического домена, трансмембранного домена или внеклеточного домена). Белок L7/L12 может модифицироваться с N-конца.
(8) Богатый цистеином липопротеин OmcA (CT444). Один из примеров белка  OmcA OmcA описан как SEQ ID NO: 127 & 128 в WO 03/049762 (инвентарный номер GenBank: AAC68043, GI: 3328876; описан как SEQ ID NO: 127 & 128 в WO 03/049762 (инвентарный номер GenBank: AAC68043, GI: 3328876;  CT444 CT444 , ,  Omp2A Omp2A , ,  Omp3 Omp3 ; SEQ ID NO: 8 в прилагаемом списке последовательностей). Вариант последовательности описан в Allen et al. (1990) Mol. Microbiol. 4: 1543-1550. Предпочтительные белки OmcA для применения согласно изобретению включают в себя аминокислотную последовательность: (a), которая характеризуется идентичностью 50% или более (например, 60%, 65%, 70%, 75%, 80%, 85%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99%, 99,5% или более) в отношении SEQ ID NO: 8; и/или (b), которая представляет собой фрагмент, по меньшей мере из n следующих друг за другом аминокислот SEQ ID NO: 8, где n представляет собой 7 или более (например, 8, 10, 12, 14, 16, 18, 20, 25, 30, 35, 40, 50, 60, 70, 80, 90, 100, 150, 200, 250 или более). Данные белки OmcA включают в себя варианты (например, аллельные варианты, гомологи, ортологи, паралоги, мутанты, и т.д.) SEQ ID NO: 8. Предпочтительные фрагменты (b) содержат эпитоп из SEQ ID NO: 8. Другие предпочтительные фрагменты лишены одной или нескольких аминокислот (например, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 15, 20, 25 или более) с C-конца и/или одной или нескольких аминокислот (например, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 15, 20, 25 или более; предпочтительно 18 или более, для удаления сигнального пептида) с N-конца SEQ ID NO: 8. Другие фрагменты лишены одного или нескольких доменов белка (например, пропуск сигнального пептида, как описано выше, цитоплазматического домена, трансмембранного домена или внеклеточного домена). Данный белок может липоилироваться (например, N-ацилдиглицеридом) и может, таким образом, иметь N-концевой цистеин. ; SEQ ID NO: 8 в прилагаемом списке последовательностей). Вариант последовательности описан в Allen et al. (1990) Mol. Microbiol. 4: 1543-1550. Предпочтительные белки OmcA для применения согласно изобретению включают в себя аминокислотную последовательность: (a), которая характеризуется идентичностью 50% или более (например, 60%, 65%, 70%, 75%, 80%, 85%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99%, 99,5% или более) в отношении SEQ ID NO: 8; и/или (b), которая представляет собой фрагмент, по меньшей мере из n следующих друг за другом аминокислот SEQ ID NO: 8, где n представляет собой 7 или более (например, 8, 10, 12, 14, 16, 18, 20, 25, 30, 35, 40, 50, 60, 70, 80, 90, 100, 150, 200, 250 или более). Данные белки OmcA включают в себя варианты (например, аллельные варианты, гомологи, ортологи, паралоги, мутанты, и т.д.) SEQ ID NO: 8. Предпочтительные фрагменты (b) содержат эпитоп из SEQ ID NO: 8. Другие предпочтительные фрагменты лишены одной или нескольких аминокислот (например, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 15, 20, 25 или более) с C-конца и/или одной или нескольких аминокислот (например, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 15, 20, 25 или более; предпочтительно 18 или более, для удаления сигнального пептида) с N-конца SEQ ID NO: 8. Другие фрагменты лишены одного или нескольких доменов белка (например, пропуск сигнального пептида, как описано выше, цитоплазматического домена, трансмембранного домена или внеклеточного домена). Данный белок может липоилироваться (например, N-ацилдиглицеридом) и может, таким образом, иметь N-концевой цистеин.
(9) Белок гистидинкиназа, сенсор двухкомпонентной регуляторной системы, AtoS (CT467). Один из примеров белка  AtoS AtoS описан как SEQ ID NO: 129 & 130 в WO 03/049762 (инвентарный номер GenBank: AAC68067, GI:3328901; описан как SEQ ID NO: 129 & 130 в WO 03/049762 (инвентарный номер GenBank: AAC68067, GI:3328901;  CT467 CT467 ; SEQ ID NO: 9 в прилагаемом списке последовательностей). Предпочтительные белки AtoS для применения согласно изобретению включают в себя аминокислотную последовательность: (a), которая характеризуется идентичностью 50% или более (например, 60%, 65%, 70%, 75%, 80%, 85%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99%, 99,5% или более) в отношении SEQ ID NO: 9; и/или (b), которая представляет собой фрагмент, по меньшей мере из n следующих друг за другом аминокислот SEQ ID NO: 9, где n представляет собой 7 или более (например, 8, 10, 12, 14, 16, 18, 20, 25, 30, 35, 40, 50, 60, 70, 80, 90, 100, 150, 200, 250 или более). Данные белки AtoS включают в себя варианты (например, аллельные варианты, гомологи, ортологи, паралоги, мутанты, и т.д.) SEQ ID NO: 9. Предпочтительные фрагменты (b) содержат эпитоп из SEQ ID NO: 9. Другие предпочтительные фрагменты лишены одной или нескольких аминокислот (например, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 15, 20, 25 или более) с C-конца и/или одной или нескольких аминокислот (например, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 15, 20, 25 или более) с N-конца SEQ ID NO: 9. Другие фрагменты лишены одного или нескольких доменов белка (например, пропуск сигнального пептида, цитоплазматического домена, трансмембранного домена или внеклеточного домена). ; SEQ ID NO: 9 в прилагаемом списке последовательностей). Предпочтительные белки AtoS для применения согласно изобретению включают в себя аминокислотную последовательность: (a), которая характеризуется идентичностью 50% или более (например, 60%, 65%, 70%, 75%, 80%, 85%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99%, 99,5% или более) в отношении SEQ ID NO: 9; и/или (b), которая представляет собой фрагмент, по меньшей мере из n следующих друг за другом аминокислот SEQ ID NO: 9, где n представляет собой 7 или более (например, 8, 10, 12, 14, 16, 18, 20, 25, 30, 35, 40, 50, 60, 70, 80, 90, 100, 150, 200, 250 или более). Данные белки AtoS включают в себя варианты (например, аллельные варианты, гомологи, ортологи, паралоги, мутанты, и т.д.) SEQ ID NO: 9. Предпочтительные фрагменты (b) содержат эпитоп из SEQ ID NO: 9. Другие предпочтительные фрагменты лишены одной или нескольких аминокислот (например, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 15, 20, 25 или более) с C-конца и/или одной или нескольких аминокислот (например, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 15, 20, 25 или более) с N-конца SEQ ID NO: 9. Другие фрагменты лишены одного или нескольких доменов белка (например, пропуск сигнального пептида, цитоплазматического домена, трансмембранного домена или внеклеточного домена).
(10) Белок CT547 (Гипотетический белок). Один из примеров белка  CT547 CT547 описан как SEQ ID NO: 151 & 152 в WO 03/049762 (инвентарный номер GenBank: AAC67995, GI: 3328825; SEQ ID NO: 10 в прилагаемом списке последовательностей). Предпочтительные белки CT547 для применения согласно изобретению включают в себя аминокислотную последовательность: (a), которая характеризуется идентичностью 50% или более (например, 60%, 65%, 70%, 75%, 80%, 85%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99%, 99,5% или более) в отношении SEQ ID NO: 10; и/или (b), которая представляет собой фрагмент, по меньшей мере из n следующих друг за другом аминокислот SEQ ID NO: 10, где n представляет собой 7 или более (например, 8, 10, 12, 14, 16, 18, 20, 25, 30, 35, 40, 50, 60, 70, 80, 90, 100, 150, 200, 250 или более). Данные белки CT547 включают в себя варианты (например, аллельные варианты, гомологи, ортологи, паралоги, мутанты, и т.д.) SEQ ID NO: 10. Предпочтительные фрагменты (b) содержат эпитоп из SEQ ID NO: 10. Другие предпочтительные фрагменты лишены одной или нескольких аминокислот (например, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 15, 20, 25 или более) с C-конца и/или одной или нескольких аминокислот (например, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 15, 20, 25 или более) с N-конца SEQ ID NO: 10. Другие фрагменты лишены одного или нескольких доменов белка (например, пропуск сигнального пептида, цитоплазматического домена, трансмембранного домена или внеклеточного домена). описан как SEQ ID NO: 151 & 152 в WO 03/049762 (инвентарный номер GenBank: AAC67995, GI: 3328825; SEQ ID NO: 10 в прилагаемом списке последовательностей). Предпочтительные белки CT547 для применения согласно изобретению включают в себя аминокислотную последовательность: (a), которая характеризуется идентичностью 50% или более (например, 60%, 65%, 70%, 75%, 80%, 85%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99%, 99,5% или более) в отношении SEQ ID NO: 10; и/или (b), которая представляет собой фрагмент, по меньшей мере из n следующих друг за другом аминокислот SEQ ID NO: 10, где n представляет собой 7 или более (например, 8, 10, 12, 14, 16, 18, 20, 25, 30, 35, 40, 50, 60, 70, 80, 90, 100, 150, 200, 250 или более). Данные белки CT547 включают в себя варианты (например, аллельные варианты, гомологи, ортологи, паралоги, мутанты, и т.д.) SEQ ID NO: 10. Предпочтительные фрагменты (b) содержат эпитоп из SEQ ID NO: 10. Другие предпочтительные фрагменты лишены одной или нескольких аминокислот (например, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 15, 20, 25 или более) с C-конца и/или одной или нескольких аминокислот (например, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 15, 20, 25 или более) с N-конца SEQ ID NO: 10. Другие фрагменты лишены одного или нескольких доменов белка (например, пропуск сигнального пептида, цитоплазматического домена, трансмембранного домена или внеклеточного домена).
(11) Белок енолаза (2-фосфоглицератдегидратаза) (CT587). Один из примеров белка  Eno Eno описан как SEQ ID NO: 189 & 190 в WO 03/049762 (инвентарный номер GenBank: AAC68189, GI:3329030; описан как SEQ ID NO: 189 & 190 в WO 03/049762 (инвентарный номер GenBank: AAC68189, GI:3329030;  CT587 CT587 ; SEQ ID NO: 11 в прилагаемом списке последовательностей). Предпочтительные белки Eno для применения согласно изобретению включают в себя аминокислотную последовательность: (a), которая характеризуется идентичностью 50% или более (например, 60%, 65%, 70%, 75%, 80%, 85%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99%, 99,5% или более) в отношении SEQ ID NO: 11; и/или (b), которая представляет собой фрагмент, по меньшей мере из n следующих друг за другом аминокислот SEQ ID NO: 11, где n представляет собой 7 или более (например, 8, 10, 12, 14, 16, 18, 20, 25, 30, 35, 40, 50, 60, 70, 80, 90, 100, 150, 200, 250 или более). Данные белки Eno включают в себя варианты (например, аллельные варианты, гомологи, ортологи, паралоги, мутанты, и т.д.) SEQ ID NO: 11. Предпочтительные фрагменты (b) содержат эпитоп из SEQ ID NO: 11. Другие предпочтительные фрагменты лишены одной или нескольких аминокислот (например, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 15, 20, 25 или более) с C-конца и/или одной или нескольких аминокислот (например, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 15, 20, 25 или более) с N-конца SEQ ID NO: 11. Другие фрагменты лишены одного или нескольких доменов белка (например, пропуск сигнального пептида, цитоплазматического домена, трансмембранного домена или внеклеточного домена). Белок Eno может содержать ионы марганца и может находиться в виде гомодимера. ; SEQ ID NO: 11 в прилагаемом списке последовательностей). Предпочтительные белки Eno для применения согласно изобретению включают в себя аминокислотную последовательность: (a), которая характеризуется идентичностью 50% или более (например, 60%, 65%, 70%, 75%, 80%, 85%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99%, 99,5% или более) в отношении SEQ ID NO: 11; и/или (b), которая представляет собой фрагмент, по меньшей мере из n следующих друг за другом аминокислот SEQ ID NO: 11, где n представляет собой 7 или более (например, 8, 10, 12, 14, 16, 18, 20, 25, 30, 35, 40, 50, 60, 70, 80, 90, 100, 150, 200, 250 или более). Данные белки Eno включают в себя варианты (например, аллельные варианты, гомологи, ортологи, паралоги, мутанты, и т.д.) SEQ ID NO: 11. Предпочтительные фрагменты (b) содержат эпитоп из SEQ ID NO: 11. Другие предпочтительные фрагменты лишены одной или нескольких аминокислот (например, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 15, 20, 25 или более) с C-конца и/или одной или нескольких аминокислот (например, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 15, 20, 25 или более) с N-конца SEQ ID NO: 11. Другие фрагменты лишены одного или нескольких доменов белка (например, пропуск сигнального пептида, цитоплазматического домена, трансмембранного домена или внеклеточного домена). Белок Eno может содержать ионы марганца и может находиться в виде гомодимера.
(12) Белок DO-протеаза HrtA (CT823). Один из примеров белка  HrtA HrtA описан как SEQ ID NO: 229 & 230 в WO 03/049762 (инвентарный номер GenBank: AAC68420, GI:3329293; описан как SEQ ID NO: 229 & 230 в WO 03/049762 (инвентарный номер GenBank: AAC68420, GI:3329293;  CT823 CT823 ; SEQ ID NO: 12 в прилагаемом списке последовательностей). Предпочтительные белки HrtA для применения согласно изобретению включают в себя аминокислотную последовательность: (a), которая характеризуется идентичностью 50% или более (например, 60%, 65%, 70%, 75%, 80%, 85%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99%, 99,5% или более) в отношении SEQ ID NO: 12; и/или (b), которая представляет собой фрагмент, по меньшей мере из n следующих друг за другом аминокислот SEQ ID NO: 12, где n представляет собой 7 или более (например, 8, 10, 12, 14, 16, 18, 20, 25, 30, 35, 40, 50, 60, 70, 80, 90, 100, 150, 200, 250 или более). Данные белки HrtA включают в себя варианты (например, аллельные варианты, гомологи, ортологи, паралоги, мутанты, и т.д.) SEQ ID NO: 12. Предпочтительные фрагменты (b) содержат эпитоп из SEQ ID NO: 12. Другие предпочтительные фрагменты лишены одной или нескольких аминокислот (например, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 15, 20, 25 или более) с C-конца и/или одной или нескольких аминокислот (например, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 15, 20, 25 или более; предпочтительно, по меньшей мере 16, для удаления сигнального пептида) с N-конца SEQ ID NO: 12. Другие фрагменты лишены одного или нескольких доменов белка (например, пропуск сигнального пептида, как описано выше, цитоплазматического домена, трансмембранного домена или внеклеточного домена). В отношении SEQ ID NO: 12 отдельные домены представляют собой остатки: 1-16; 17-497; 128-289; 290-381; 394-485; и 394-497. ; SEQ ID NO: 12 в прилагаемом списке последовательностей). Предпочтительные белки HrtA для применения согласно изобретению включают в себя аминокислотную последовательность: (a), которая характеризуется идентичностью 50% или более (например, 60%, 65%, 70%, 75%, 80%, 85%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99%, 99,5% или более) в отношении SEQ ID NO: 12; и/или (b), которая представляет собой фрагмент, по меньшей мере из n следующих друг за другом аминокислот SEQ ID NO: 12, где n представляет собой 7 или более (например, 8, 10, 12, 14, 16, 18, 20, 25, 30, 35, 40, 50, 60, 70, 80, 90, 100, 150, 200, 250 или более). Данные белки HrtA включают в себя варианты (например, аллельные варианты, гомологи, ортологи, паралоги, мутанты, и т.д.) SEQ ID NO: 12. Предпочтительные фрагменты (b) содержат эпитоп из SEQ ID NO: 12. Другие предпочтительные фрагменты лишены одной или нескольких аминокислот (например, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 15, 20, 25 или более) с C-конца и/или одной или нескольких аминокислот (например, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 15, 20, 25 или более; предпочтительно, по меньшей мере 16, для удаления сигнального пептида) с N-конца SEQ ID NO: 12. Другие фрагменты лишены одного или нескольких доменов белка (например, пропуск сигнального пептида, как описано выше, цитоплазматического домена, трансмембранного домена или внеклеточного домена). В отношении SEQ ID NO: 12 отдельные домены представляют собой остатки: 1-16; 17-497; 128-289; 290-381; 394-485; и 394-497.
(13) Белок пептидогликантрансфераза MurG (CT761). Один из примеров белка  MurG MurG описан как SEQ ID NO: 217 & 218 в WO 03/049762 (инвентарный номер GenBank: AAC68356, GI: 3329223; описан как SEQ ID NO: 217 & 218 в WO 03/049762 (инвентарный номер GenBank: AAC68356, GI: 3329223;  CT761 CT761 ; SEQ ID NO: 13 в прилагаемом списке последовательностей). Он представляет собой UDP-N-ацетилглюкозамин-N-ацетилмурамил(пентапептид)-пирофосфорилундекапренол-N-ацетилглюкозаминтрансферазу. Предпочтительные белки MurG для применения согласно изобретению включают в себя аминокислотную последовательность: (a), которая характеризуется идентичностью 50% или более (например, 60%, 65%, 70%, 75%, 80%, 85%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99%, 99,5% или более) в отношении SEQ ID NO: 13; и/или (b), которая представляет собой фрагмент, по меньшей мере из n следующих друг за другом аминокислот SEQ ID NO: 13, где n представляет собой 7 или более (например, 8, 10, 12, 14, 16, 18, 20, 25, 30, 35, 40, 50, 60, 70, 80, 90, 100, 150, 200, 250 или более). Данные белки MurG включают в себя варианты (например, аллельные варианты, гомологи, ортологи, паралоги, мутанты, и т.д.) SEQ ID NO: 13. Предпочтительные фрагменты (b) содержат эпитоп из SEQ ID NO: 13. Другие предпочтительные фрагменты лишены одной или нескольких аминокислот (например, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 15, 20, 25 или более) с C-конца и/или одной или нескольких аминокислот (например, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 15, 20, 25 или более) с N-конца SEQ ID NO: 13. Другие фрагменты лишены одного или нескольких доменов белка (например, пропуск сигнального пептида, описано выше, цитоплазматического домена, трансмембранного домена или внеклеточного домена). Белок MurG может липоилироваться, например, ундекапренилом. ; SEQ ID NO: 13 в прилагаемом списке последовательностей). Он представляет собой UDP-N-ацетилглюкозамин-N-ацетилмурамил(пентапептид)-пирофосфорилундекапренол-N-ацетилглюкозаминтрансферазу. Предпочтительные белки MurG для применения согласно изобретению включают в себя аминокислотную последовательность: (a), которая характеризуется идентичностью 50% или более (например, 60%, 65%, 70%, 75%, 80%, 85%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99%, 99,5% или более) в отношении SEQ ID NO: 13; и/или (b), которая представляет собой фрагмент, по меньшей мере из n следующих друг за другом аминокислот SEQ ID NO: 13, где n представляет собой 7 или более (например, 8, 10, 12, 14, 16, 18, 20, 25, 30, 35, 40, 50, 60, 70, 80, 90, 100, 150, 200, 250 или более). Данные белки MurG включают в себя варианты (например, аллельные варианты, гомологи, ортологи, паралоги, мутанты, и т.д.) SEQ ID NO: 13. Предпочтительные фрагменты (b) содержат эпитоп из SEQ ID NO: 13. Другие предпочтительные фрагменты лишены одной или нескольких аминокислот (например, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 15, 20, 25 или более) с C-конца и/или одной или нескольких аминокислот (например, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 15, 20, 25 или более) с N-конца SEQ ID NO: 13. Другие фрагменты лишены одного или нескольких доменов белка (например, пропуск сигнального пептида, описано выше, цитоплазматического домена, трансмембранного домена или внеклеточного домена). Белок MurG может липоилироваться, например, ундекапренилом.
Иммуногенность других известных антигенов Chlamydia trachomatis может быть улучшена путем комбинации с двумя или большим количеством антигенов Chlamydia trachomatis из первой группы антигенов или из второй группы антигенов. Такие другие известные антигены Chlamydia trachomatis включены в третью группу антигенов, состоящую из (1) PGP3, (2) одного или нескольких PMP, (3) MOMP (CT681), (4) Cap1 (CT529); (5) GroEL-подобный белок hsp60 (Omp2); и (6) богатый цистеином белок массой 60 кДа (omcB). Данные антигены обозначаются здесь как  третья группа антигенов третья группа антигенов . .
Таким образом, изобретение относится к композиции, содержащей комбинацию антигенов Chlamydia trachomatis, причем данная комбинация выбрана из группы, состоящей из двух, трех, четырех или пяти антигенов Chlamydia trachomatis из первой группы антигенов, и одного, двух, трех, четырех, пяти или шести антигенов Chlamydia trachomatis из третьей группы антигенов. Предпочтительно комбинация выбрана из группы, состоящей из трех, четырех или пяти антигенов Chlamydia trachomatis из первой группы антигенов и трех, четырех или пяти антигенов Chlamydia trachomatis из третьей группы антигенов. Еще более предпочтительно комбинация состоит из пяти антигенов Chlamydia trachomatis из первой группы антигенов и трех, четырех или пяти антигенов Chlamydia trachomatis из третьей группы антигенов.
Изобретение далее относится к композиции, содержащей комбинацию антигенов Chlamydia trachomatis, причем указанная комбинация выбрана из группы, состоящей из двух, трех, четырех, пяти, шести, семи, восьми, девяти, десяти, одиннадцати, двенадцати или тринадцати антигенов Chlamydia trachomatis из второй группы антигенов и одного, двух, трех, четырех, пяти или шести антигенов Chlamydia trachomatis из третьей группы антигенов. Предпочтительно комбинация выбрана из группы, состоящей из трех, четырех или пяти антигенов Chlamydia trachomatis из второй группы антигенов и трех, четырех или пяти антигенов Chlamydia trachomatis из третьей группы антигенов. Еще более предпочтительно комбинация состоит из пяти антигенов Chlamydia trachomatis из второй группы антигенов и трех, четырех или пяти антигенов Chlamydia trachomatis из третьей группы антигенов.
В любой из указанных выше комбинаций антигены Chlamydia trachomatis из третьей группы антигенов предпочтительно включают в себя Cap1 (CT529). Или альтернативно в любой из указанных выше комбинаций антигены Chlamydia trachomatis из третьей группы антигенов предпочтительно включают в себя MOMP (CT681). Каждый из антигенов Chlamydia trachomatis из третьей группы антигенов более подробно описан ниже.
(1) Кодируемый плазмидой белок (PGP3). Один из примеров последовательности PGP3 описан, например, в записи Genbank GI 121541. Иммунизация pgp3 описана в Ghaem-Maghami et al., (2003) Clin. Exp. Immunol. 132: 436-442 и Donati et al., (2003) Vaccine 21: 1089-1093. Один из примеров белка PGP3 приведен в прилагаемом списке последовательностей под SEQ ID NO: 14. Предпочтительные белки PGP3 для применения согласно изобретению включают в себя аминокислотную последовательность: (a), которая характеризуется идентичностью 50% или более (например, 60%, 65%, 70%, 75%, 80%, 85%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99%, 99,5% или более) в отношении SEQ ID NO: 14; и/или (b), которая представляет собой фрагмент, по меньшей мере из n следующих друг за другом аминокислот SEQ ID NO: 14, где n представляет собой 7 или более (например, 8, 10, 12, 14, 16, 18, 20, 25, 30, 35, 40, 50, 60, 70, 80, 90, 100, 150, 200, 250 или более). Данные белки PGP3 включают в себя варианты (например, аллельные варианты, гомологи, ортологи, паралоги, мутанты, и т.д.) SEQ ID NO: 14. Предпочтительные фрагменты (b) содержат эпитоп из SEQ ID NO: 14. Другие предпочтительные фрагменты лишены одной или нескольких аминокислот (например, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 15, 20, 25 или более) с C-конца и/или одной или нескольких аминокислот (например, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 15, 20, 25 или более) с N-конца SEQ ID NO: 14. Другие фрагменты лишены одного или нескольких доменов белка (например, пропуск сигнального пептида, цитоплазматического домена, трансмембранного домена или внеклеточного домена).
(2) Полиморфные мембранные белки (PMP). Идентифицировано семейство из девяти генов Chlamydia trachomatis, кодирующих предсказанные полиморфные мембранные белки (PMP) (от pmpA до pmpI). См. Stephens et al., Science (1998) 282: 754-759, конкретно фигуру 1. Примеры аминокислотных последовательностей генов PMP приведены в виде SEQ ID NO: 15-23. (Данные последовательности также могут быть найдены в Genbank под номерами для ссылки GI 15605137 (pmpA), 15605138 (pmpB), 15605139 (pmpC), 15605546 (pmpD), 15605605 (pmpE), 15605606 (pmpF), 15605607 (pmpG), 15605608 (pmpH), и 15605610 (pmpH)). Данные гены PMP кодируют относительно большие белки (от 90 до 187 кДа по массе). Большинство данных белков PMP, как предсказано, являются белками внешней мембраны и, таким образом, также обозначены как предсказанные белки внешней мембраны. При использовании здесь, PMP относится к одному или нескольким белкам pmp Chlamydia trachomatis (pmpA до pmpI) или к их иммуногенному фрагменту. Предпочтительно белок PMP, применяемый согласно изобретению, представляет собой pmpE или pmpI. Предпочтительно белок PMP, применяемый согласно изобретению, включает в себя один или несколько фрагментов pmpE или pmpI, идентифицированных в заявке на выдачу Международного патента PCT/US01/30345 (WO 02/28998) в таблице 1 на стр. 20 (предпочтительные фрагменты pmpE) или в таблице 2 на стр. 21 (предпочтительные фрагменты pmpI).
Предпочтительные белки PMP для применения согласно изобретению включают в себя аминокислотную последовательность: (a), которая характеризуется идентичностью 50% или более (например, 60%, 65%, 70%, 75%, 80%, 85%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99%, 99,5% или более) в отношении одной из полипептидных последовательностей, приведенных в SEQ ID NO: 15-23; и/или (b), которая представляет собой фрагмент, по меньшей мере из n следующих друг за другом аминокислот одной из полипептидных последовательностей, приведенных в SEQ ID NO: 15-23, где n представляет собой 7 или более (например, 8, 10, 12, 14, 16, 18, 20, 25, 30, 35, 40, 50, 60, 70, 80, 90, 100, 150, 200, 250 или более). Данные белки PMP включают в себя варианты (например, аллельные варианты, гомологи, ортологи, паралоги, мутанты, и т.д.) полипептидных последовательностей, приведенных в SEQ ID NO: 15-23. Предпочтительные фрагменты (b) содержат эпитоп из одной из полипептидных последовательностей, приведенных в SEQ ID NO: 15-23. Другие предпочтительные фрагменты лишены одной или нескольких аминокислот (например, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 15, 20, 25 или более) с C-конца и/или одной или нескольких аминокислот (например, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 15, 20, 25 или более) с N-конца одной из полипептидных последовательностей, приведенных в SEQ ID NO: 15-23. Другие фрагменты лишены одного или нескольких доменов белка (например, пропуск сигнального пептида, цитоплазматического домена, трансмембранного домена или внеклеточного домена).
(3) Главный белок наружной мембраны (MOMP) (CT681). Один из примеров последовательности MOMP описан как SEQ ID NO: 155 и 156 в заявке на выдачу Международного патента  PCT/IB02/05761 (WO03/049762). Полипептидная последовательность, кодирующая МОМР, приведена в прилагаемом списке последовательностей под SEQ ID NO: 24. Данный белок, как полагают, функционирует in vivo как порин (см. Bavoil et al, (1984) Infection and Immunity 44:479-485), и присутствует в течение всего жизненного цикла бактерии (см. Hatch et al., (1986) J.Bacteriol. 165: 379-385). MOMP характеризуется четырьмя вариабельными доменами (VD), окруженными пятью константными областями, которые высококонсервативны среди сероваров (см. Stephens et al., (1987) J.Bacteriol. 169: 3879-3885 и Yuan et al. (1989) Infection and Immunity 57: 1040-1049). На VD картированы нейтрализующие in vitro и in vivo В-клеточные эпитопы (см. Baehr et al.,(1988) PNAS USA 85: 4000-4004; Lucero et al., (1985) Infection and Immunity 50: 595-597; Zhang et al., (1987) J. Immunol. 138: 575-581, Peterson et al., (1988) Infection and Immunity 56: 885-891, Zhang et al., (1989) Infection and Immunity 57: 636-638). В вариабельных и константных доменах идентифицированы T-клеточные эпитопы (см. Allen et al., (1991) J. Immunol. 147: 674-679 и Su et al., (1990) J. Exp. Med. 172: 203-212). PCT/IB02/05761 (WO03/049762). Полипептидная последовательность, кодирующая МОМР, приведена в прилагаемом списке последовательностей под SEQ ID NO: 24. Данный белок, как полагают, функционирует in vivo как порин (см. Bavoil et al, (1984) Infection and Immunity 44:479-485), и присутствует в течение всего жизненного цикла бактерии (см. Hatch et al., (1986) J.Bacteriol. 165: 379-385). MOMP характеризуется четырьмя вариабельными доменами (VD), окруженными пятью константными областями, которые высококонсервативны среди сероваров (см. Stephens et al., (1987) J.Bacteriol. 169: 3879-3885 и Yuan et al. (1989) Infection and Immunity 57: 1040-1049). На VD картированы нейтрализующие in vitro и in vivo В-клеточные эпитопы (см. Baehr et al.,(1988) PNAS USA 85: 4000-4004; Lucero et al., (1985) Infection and Immunity 50: 595-597; Zhang et al., (1987) J. Immunol. 138: 575-581, Peterson et al., (1988) Infection and Immunity 56: 885-891, Zhang et al., (1989) Infection and Immunity 57: 636-638). В вариабельных и константных доменах идентифицированы T-клеточные эпитопы (см. Allen et al., (1991) J. Immunol. 147: 674-679 и Su et al., (1990) J. Exp. Med. 172: 203-212).
Предпочтительные белки MOMP для применения согласно изобретению включают в себя аминокислотную последовательность: (a), которая характеризуется идентичностью 50% или более (например, 60%, 65%, 70%, 75%, 80%, 85%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99%, 99,5% или более) в отношении SEQ ID NO: 24; и/или (b), которая представляет собой фрагмент, по меньшей мере из n следующих друг за другом аминокислот SEQ ID NO: 24, где n представляет собой 7 или более (например, 8, 10, 12, 14, 16, 18, 20, 25, 30, 35, 40, 50, 60, 70, 80, 90, 100, 150, 200, 250 или более). Данные белки MOMP включают в себя варианты (например, аллельные варианты, гомологи, ортологи, паралоги, мутанты, и т.д.) SEQ ID NO: 24. Предпочтительные фрагменты (b) содержат эпитоп из SEQ ID NO: 24, предпочтительно один или несколько В- или Т-клеточных эпитопов, идентифицированных выше. Другие предпочтительные фрагменты лишены одной или нескольких аминокислот (например, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 15, 20, 25 или более) с C-конца и/или одной или нескольких аминокислот (например, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 15, 20, 25 или более) с N-конца SEQ ID NO: 24. Другие фрагменты лишены одного или нескольких доменов белка (например, пропуск сигнального пептида, цитоплазматического домена, трансмембранного домена или внеклеточного домена). Другие предпочтительные фрагменты включают в себя один или несколько консервативных константных областей, идентифицированных выше.
(4) Cap1 (CT529). Белок Cap1 Chlamydia trachomatis соответствует гипотетической рамке считывания CT 529 и относится к доступному белку-1 класса I. См. Fling et al., (2001) PNAS 98 (3): 1160-1165. Один из примеров белка Cap1 приведен здесь в SEQ ID NO: 28. Предсказанные T-клеточные эпитопы Cap1 идентифицированы в данной ссылке как SEQ ID NO: 25 CSFIGGITYL, предпочтительно SEQ ID NO: 26 SFIGGITYL, и SEQ ID NO: 27 SIIGGITYL.
Предпочтительные белки Cap1 для применения согласно изобретению включают в себя аминокислотную последовательность: (a), которая характеризуется идентичностью 50% или более (например, 60%, 65%, 70%, 75%, 80%, 85%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99%, 99,5% или более) в отношении SEQ ID NO: 28; и/или (b), которая представляет собой фрагмент, по меньшей мере из n следующих друг за другом аминокислот SEQ ID NO: 28, где n представляет собой 7 или более (например, 8, 10, 12, 14, 16, 18, 20, 25, 30, 35, 40, 50, 60, 70, 80, 90, 100, 150, 200, 250 или более). Данные белки Cap1 включают в себя варианты (например, аллельные варианты, гомологи, ортологи, паралоги, мутанты, и т.д.) SEQ ID NO: 28. Предпочтительные фрагменты (b) содержат эпитоп из SEQ ID NO: 28. Предпочтительные Т-клеточные эпитопы включают в себя один или несколько Т-клеточных эпитопов, идентифицированных выше. Другие предпочтительные фрагменты лишены одной или нескольких аминокислот (например, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 15, 20, 25 или более) с C-конца и/или одной или нескольких аминокислот (например, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 15, 20, 25 или более) с N-конца SEQ ID NO: 28. Другие фрагменты лишены одного или нескольких доменов белка (например, пропуск сигнального пептида, цитоплазматического домена, трансмембранного домена или внеклеточного домена).
(5) GroEL-подобный белок hsp60. Один из примеров GroEL-подобного белка hsp60 Chlamydia trachomatis приведен здесь в SEQ ID NO: 29. Роль Hsp60 в хламидийной инфекции далее описана, например, в Hessel, et al., (2001) Infection and Immunity 69 (8): 4996-5000; Eckert, et al., (1997) J. Infectious Disease 175: 1453-1458, Domeika et al., (1998) J. of Infectious Diseases 177: 714-719; Deane et al., (1997) Clin. Exp. Immunol. 109 (3): 439-445, и Peeling et al., (1997) J. Infect. Dis. 175 (5): 1153-1158. Иммунизация экспериментальных морских свинок рекомбинантным Hsp60 описана в Rank et al., (1995) Incest Ophthalmol. Vis. Sci. 36 (7): 1344-1351. B-клеточные эпитопы Hsp60 идентифицированы в Yi et al., (1993) Infection & Immunity 61 (3): 1117-1120.
Предпочтительные белки Hsp60 для применения согласно изобретению включают в себя аминокислотную последовательность: (a), которая характеризуется идентичностью 50% или более (например, 60%, 65%, 70%, 75%, 80%, 85%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99%, 99,5% или более) в отношении SEQ ID NO: 29; и/или (b), которая представляет собой фрагмент по меньшей мере из n следующих друг за другом аминокислот SEQ ID NO: 29, где n представляет собой 7 или более (например, 8, 10, 12, 14, 16, 18, 20, 25, 30, 35, 40, 50, 60, 70, 80, 90, 100, 150, 200, 250 или более). Данные белки Hsp60 включают в себя варианты (например, аллельные варианты, гомологи, ортологи, паралоги, мутанты, и т.д.) SEQ ID NO: 29. Предпочтительные фрагменты (b) содержат эпитоп из SEQ ID NO: 29, включая один или несколько эпитопов, идентифицированных в обсуждаемых выше ссылках. Другие предпочтительные фрагменты лишены одной или нескольких аминокислот (например, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 15, 20, 25 или более) с C-конца и/или одной или нескольких аминокислот (например, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 15, 20, 25 или более) с N-конца SEQ ID NO: 29. Другие фрагменты лишены одного или нескольких доменов белка (например, пропуск сигнального пептида, цитоплазматического домена, трансмембранного домена или внеклеточного домена). Другие предпочтительные фрагменты включают в себя полипептидную последовательность, не обладающую перекрестным взаимодействием с родственными человеческими белками.
(6) Богатый цистеином белок массой 60 кДа (OmcB) (CT443). Один из примеров богатого цистеином белка массой 60 кДа Chlamydia trachomatis приведен здесь в SEQ ID NO: 30. Данный белок также в общем обозначают как OmcB, Omp2 или CT 443. Роль OmcB в хламидийной инфекции далее описана, например, в Stephens et al., (2001) Molecular Microbiology 40 (3): 691-699; Millman, et al., (2001) J. of Bacteriology 183 (20):5997-6008; Mygind, et al., Journal of Bacteriology (1998) 180 (21):5784-5787; Bas, et al., Journal of Clinical Microbiology (2001) 39 (11):4082-4085 и Goodall, et al., Clin. Exp. Immunol. (2001) 126: 488-493.
Предпочтительные белки OmcB для применения согласно изобретению включают в себя аминокислотную последовательность: (a), которая характеризуется идентичностью 50% или более (например, 60%, 65%, 70%, 75%, 80%, 85%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99%, 99,5% или более) в отношении SEQ ID NO: 30; и/или (b), которая представляет собой фрагмент, по меньшей мере из n следующих друг за другом аминокислот SEQ ID NO: 30, где n представляет собой 7 или более (например, 8, 10, 12, 14, 16, 18, 20, 25, 30, 35, 40, 50, 60, 70, 80, 90, 100, 150, 200, 250 или более). Данные белки OmcB включают в себя варианты (например, аллельные варианты, гомологи, ортологи, паралоги, мутанты, и т.д.) SEQ ID NO: 30. Предпочтительные фрагменты (b) содержат эпитоп из SEQ ID NO: 30, включая один или несколько эпитопов, идентифицированных в обсуждаемых выше ссылках. Другие предпочтительные фрагменты лишены одной или нескольких аминокислот (например, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 15, 20, 25 или более) с C-конца и/или одной или нескольких аминокислот (например, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 15, 20, 25 или более) с N-конца SEQ ID NO: 30. Другие фрагменты лишены одного или нескольких доменов белка (например, пропуск сигнального пептида, цитоплазматического домена, трансмембранного домена или внеклеточного домена).
Иммуногенность других антигенов Chlamydia trachomatis с известной или неизвестной биологической функцией может улучшаться путем комбинации с одним или несколькими антигенами Chlamydia trachomatis из первой группы антигенов, и/или второй группы антигенов, и/или третьей группы антигенов. Такие другие антигены Chlamydia trachomatis с известной и неизвестной биологической функцией включают в себя четвертую группу антигенов, состоящую из (1) CT559 (YscJ); (2) CT600 (Pal); (3) CT541(Mip); (4) CT623 (гомолог CHLPN массой 76 кДа); (5) CT700 (гипотетический белок); (6) CT266 (гипотетический белок); (7) CT077 (гипотетический белок); (8) CT456 (гипотетический белок); (9) CT165 (гипотетический белок) и (10) CT713 (PorB). Данные антигены обозначаются как  четвертая группа антигенов четвертая группа антигенов . .
YscJ (CT559). Один из примеров белка  YscJ YscJ описан как SEQ ID NO: 199 & 200 в WO 03/049762 (инвентарный номер GenBank: AAC68161.1 GI:3329000 описан как SEQ ID NO: 199 & 200 в WO 03/049762 (инвентарный номер GenBank: AAC68161.1 GI:3329000  CT559 CT559 ; SEQ ID NO: 31 в прилагаемом списке последовательностей). Предпочтительные белки YscJ для применения согласно изобретению включают в себя аминокислотную последовательность: (a), которая характеризуется идентичностью 50% или более (например, 60%, 65%, 70%, 75%, 80%, 85%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99%, 99,5% или более) в отношении SEQ ID NO: 31; и/или (b), которая представляет собой фрагмент, по меньшей мере из n следующих друг за другом аминокислот SEQ ID NO: 31, где n представляет собой 7 или более (например, 8, 10, 12, 14, 16, 18, 20, 25, 30, 35, 40, 50, 60, 70, 80, 90, 100, 150, 200, 250 или более). Данные белки YscJ включают в себя варианты (например, аллельные варианты, гомологи, ортологи, паралоги, мутанты и т.д.) SEQ ID NO: 31. Предпочтительные фрагменты (b) содержат эпитоп из SEQ ID NO: 31. Другие предпочтительные фрагменты лишены одной или нескольких аминокислот (например, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 15, 20, 25 или более) с C-конца и/или одной или нескольких аминокислот (например, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 15, 20, 25 или более) с N-конца SEQ ID NO: 31. Другие фрагменты лишены одного или нескольких доменов белка (например, пропуск сигнального пептида, цитоплазматического домена, трансмембранного домена или внеклеточного домена). ; SEQ ID NO: 31 в прилагаемом списке последовательностей). Предпочтительные белки YscJ для применения согласно изобретению включают в себя аминокислотную последовательность: (a), которая характеризуется идентичностью 50% или более (например, 60%, 65%, 70%, 75%, 80%, 85%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99%, 99,5% или более) в отношении SEQ ID NO: 31; и/или (b), которая представляет собой фрагмент, по меньшей мере из n следующих друг за другом аминокислот SEQ ID NO: 31, где n представляет собой 7 или более (например, 8, 10, 12, 14, 16, 18, 20, 25, 30, 35, 40, 50, 60, 70, 80, 90, 100, 150, 200, 250 или более). Данные белки YscJ включают в себя варианты (например, аллельные варианты, гомологи, ортологи, паралоги, мутанты и т.д.) SEQ ID NO: 31. Предпочтительные фрагменты (b) содержат эпитоп из SEQ ID NO: 31. Другие предпочтительные фрагменты лишены одной или нескольких аминокислот (например, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 15, 20, 25 или более) с C-конца и/или одной или нескольких аминокислот (например, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 15, 20, 25 или более) с N-конца SEQ ID NO: 31. Другие фрагменты лишены одного или нескольких доменов белка (например, пропуск сигнального пептида, цитоплазматического домена, трансмембранного домена или внеклеточного домена).
Pal (CT600). Один из примеров белка  Pal Pal описан как SEQ ID NO: 173 & 174 в WO 03/049762 (инвентарный номер GenBank: AAC68202.1 GI:3329044 описан как SEQ ID NO: 173 & 174 в WO 03/049762 (инвентарный номер GenBank: AAC68202.1 GI:3329044  CT600 CT600 ; SEQ ID NO: 32 в прилагаемом списке последовательностей). Предпочтительные белки Pal для применения согласно изобретению включают в себя аминокислотную последовательность: (a), которая характеризуется идентичностью 50% или более (например, 60%, 65%, 70%, 75%, 80%, 85%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99%, 99,5% или более) в отношении SEQ ID NO: 32; и/или (b), которая представляет собой фрагмент, по меньшей мере из n следующих друг за другом аминокислот SEQ ID NO: 32, где n представляет собой 7 или более (например, 8, 10, 12, 14, 16, 18, 20, 25, 30, 35, 40, 50, 60, 70, 80, 90, 100, 150, 200, 250 или более). Данные белки Pal включают в себя варианты (например, аллельные варианты, гомологи, ортологи, паралоги, мутанты, и т.д.) SEQ ID NO: 32. Предпочтительные фрагменты (b) содержат эпитоп из SEQ ID NO: 32. Другие предпочтительные фрагменты лишены одной или нескольких аминокислот (например, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 15, 20, 25 или более) с C-конца и/или одной или нескольких аминокислот (например, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 15, 20, 25 или более) с N-конца SEQ ID NO: 32. Другие фрагменты лишены одного или нескольких доменов белка (например, пропуск сигнального пептида, цитоплазматического домена, трансмембранного домена или внеклеточного домена). ; SEQ ID NO: 32 в прилагаемом списке последовательностей). Предпочтительные белки Pal для применения согласно изобретению включают в себя аминокислотную последовательность: (a), которая характеризуется идентичностью 50% или более (например, 60%, 65%, 70%, 75%, 80%, 85%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99%, 99,5% или более) в отношении SEQ ID NO: 32; и/или (b), которая представляет собой фрагмент, по меньшей мере из n следующих друг за другом аминокислот SEQ ID NO: 32, где n представляет собой 7 или более (например, 8, 10, 12, 14, 16, 18, 20, 25, 30, 35, 40, 50, 60, 70, 80, 90, 100, 150, 200, 250 или более). Данные белки Pal включают в себя варианты (например, аллельные варианты, гомологи, ортологи, паралоги, мутанты, и т.д.) SEQ ID NO: 32. Предпочтительные фрагменты (b) содержат эпитоп из SEQ ID NO: 32. Другие предпочтительные фрагменты лишены одной или нескольких аминокислот (например, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 15, 20, 25 или более) с C-конца и/или одной или нескольких аминокислот (например, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 15, 20, 25 или более) с N-конца SEQ ID NO: 32. Другие фрагменты лишены одного или нескольких доменов белка (например, пропуск сигнального пептида, цитоплазматического домена, трансмембранного домена или внеклеточного домена).
Mip (CT541). Один из примеров белка  Mip Mip описан как SEQ ID NO: 149 & 150 в WO 03/049762 (инвентарный номер GenBank: AAC68143.1 GI:3328979 описан как SEQ ID NO: 149 & 150 в WO 03/049762 (инвентарный номер GenBank: AAC68143.1 GI:3328979  CT541 CT541 ; SEQ ID NO: 33 в прилагаемом списке последовательностей). Предпочтительные белки Mip для применения согласно изобретению включают в себя аминокислотную последовательность: (a), которая характеризуется идентичностью 50% или более (например, 60%, 65%, 70%, 75%, 80%, 85%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99%, 99,5% или более) в отношении SEQ ID NO: 33; и/или (b), которая представляет собой фрагмент, по меньшей мере из n следующих друг за другом аминокислот SEQ ID NO: 33, где n представляет собой 7 или более (например, 8, 10, 12, 14, 16, 18, 20, 25, 30, 35, 40, 50, 60, 70, 80, 90, 100, 150, 200, 250 или более). Данные белки Mip включают в себя варианты (например, аллельные варианты, гомологи, ортологи, паралоги, мутанты, и т.д.) SEQ ID NO: 33. Предпочтительные фрагменты (b) содержат эпитоп из SEQ ID NO: 33. Другие предпочтительные фрагменты лишены одной или нескольких аминокислот (например, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 15, 20, 25 или более) с C-конца и/или одной или нескольких аминокислот (например, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 15, 20, 25 или более) с N-конца SEQ ID NO: 33. Другие фрагменты лишены одного или нескольких доменов белка (например, пропуск сигнального пептида, цитоплазматического домена, трансмембранного домена или внеклеточного домена). ; SEQ ID NO: 33 в прилагаемом списке последовательностей). Предпочтительные белки Mip для применения согласно изобретению включают в себя аминокислотную последовательность: (a), которая характеризуется идентичностью 50% или более (например, 60%, 65%, 70%, 75%, 80%, 85%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99%, 99,5% или более) в отношении SEQ ID NO: 33; и/или (b), которая представляет собой фрагмент, по меньшей мере из n следующих друг за другом аминокислот SEQ ID NO: 33, где n представляет собой 7 или более (например, 8, 10, 12, 14, 16, 18, 20, 25, 30, 35, 40, 50, 60, 70, 80, 90, 100, 150, 200, 250 или более). Данные белки Mip включают в себя варианты (например, аллельные варианты, гомологи, ортологи, паралоги, мутанты, и т.д.) SEQ ID NO: 33. Предпочтительные фрагменты (b) содержат эпитоп из SEQ ID NO: 33. Другие предпочтительные фрагменты лишены одной или нескольких аминокислот (например, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 15, 20, 25 или более) с C-конца и/или одной или нескольких аминокислот (например, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 15, 20, 25 или более) с N-конца SEQ ID NO: 33. Другие фрагменты лишены одного или нескольких доменов белка (например, пропуск сигнального пептида, цитоплазматического домена, трансмембранного домена или внеклеточного домена).
CHLPN (76 кДа) (CT623). Один из примеров CHLPN (76 кДа белок) описан как SEQ ID NO: 163 & 164 в WO03/049762 (инвентарный номер GenBank: AAC68227.2 GI:6578109  CT623 CT623 ; SEQ ID NO: 34 в прилагаемом списке последовательностей). Предпочтительные белки CHLPN (76 кДа белок) для применения согласно изобретению включают в себя аминокислотную последовательность: (a), которая характеризуется идентичностью 50% или более (например, 60%, 65%, 70%, 75%, 80%, 85%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99%, 99,5% или более) в отношении SEQ ID NO: 34; и/или (b), которая представляет собой фрагмент, по меньшей мере из n следующих друг за другом аминокислот SEQ ID NO: 34, где n представляет собой 7 или более (например, 8, 10, 12, 14, 16, 18, 20, 25, 30, 35, 40, 50, 60, 70, 80, 90, 100, 150, 200, 250 или более). Данные белки CHLPN (76 кДа белок) включают в себя варианты (например, аллельные варианты, гомологи, ортологи, паралоги, мутанты, и т.д.) SEQ ID NO: 34. Предпочтительные фрагменты (b) содержат эпитоп из SEQ ID NO: 34. Другие предпочтительные фрагменты лишены одной или нескольких аминокислот (например, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 15, 20, 25 или более) с C-конца и/или одной или нескольких аминокислот (например, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 15, 20, 25 или более) с N-конца SEQ ID NO: 34. Другие фрагменты лишены одного или нескольких доменов белка (например, пропуск сигнального пептида, цитоплазматического домена, трансмембранного домена или внеклеточного домена). ; SEQ ID NO: 34 в прилагаемом списке последовательностей). Предпочтительные белки CHLPN (76 кДа белок) для применения согласно изобретению включают в себя аминокислотную последовательность: (a), которая характеризуется идентичностью 50% или более (например, 60%, 65%, 70%, 75%, 80%, 85%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99%, 99,5% или более) в отношении SEQ ID NO: 34; и/или (b), которая представляет собой фрагмент, по меньшей мере из n следующих друг за другом аминокислот SEQ ID NO: 34, где n представляет собой 7 или более (например, 8, 10, 12, 14, 16, 18, 20, 25, 30, 35, 40, 50, 60, 70, 80, 90, 100, 150, 200, 250 или более). Данные белки CHLPN (76 кДа белок) включают в себя варианты (например, аллельные варианты, гомологи, ортологи, паралоги, мутанты, и т.д.) SEQ ID NO: 34. Предпочтительные фрагменты (b) содержат эпитоп из SEQ ID NO: 34. Другие предпочтительные фрагменты лишены одной или нескольких аминокислот (например, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 15, 20, 25 или более) с C-конца и/или одной или нескольких аминокислот (например, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 15, 20, 25 или более) с N-конца SEQ ID NO: 34. Другие фрагменты лишены одного или нескольких доменов белка (например, пропуск сигнального пептида, цитоплазматического домена, трансмембранного домена или внеклеточного домена).
Гипотетический белок (CT700). Один из примеров гипотетического белка CT700 описан как SEQ ID NO: 261 & 262 в WO 03/049762 (инвентарный номер GenBank: AAC68295.1 GI:3329154  CT700 CT700 ; SEQ ID NO: 35 в прилагаемом списке последовательностей). Предпочтительные гипотетические белки CT700 для применения согласно изобретению включают в себя аминокислотную последовательность: (a), которая характеризуется идентичностью 50% или более (например, 60%, 65%, 70%, 75%, 80%, 85%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99%, 99,5% или более) в отношении SEQ ID NO: 35; и/или (b), которая представляет собой фрагмент, по меньшей мере из n следующих друг за другом аминокислот SEQ ID NO: 35, где n представляет собой 7 или более (например, 8, 10, 12, 14, 16, 18, 20, 25, 30, 35, 40, 50, 60, 70, 80, 90, 100, 150, 200, 250 или более). Данные гипотетические белки CT700 включают в себя варианты (например, аллельные варианты, гомологи, ортологи, паралоги, мутанты, и т.д.) SEQ ID NO: 35. Предпочтительные фрагменты (b) содержат эпитоп из SEQ ID NO: 35. Другие предпочтительные фрагменты лишены одной или нескольких аминокислот (например, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 15, 20, 25 или более) с C-конца и/или одной или нескольких аминокислот (например, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 15, 20, 25 или более) с N-конца SEQ ID NO: 35. Другие фрагменты лишены одного или нескольких доменов белка (например, пропуск сигнального пептида, цитоплазматического домена, трансмембранного домена или внеклеточного домена). ; SEQ ID NO: 35 в прилагаемом списке последовательностей). Предпочтительные гипотетические белки CT700 для применения согласно изобретению включают в себя аминокислотную последовательность: (a), которая характеризуется идентичностью 50% или более (например, 60%, 65%, 70%, 75%, 80%, 85%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99%, 99,5% или более) в отношении SEQ ID NO: 35; и/или (b), которая представляет собой фрагмент, по меньшей мере из n следующих друг за другом аминокислот SEQ ID NO: 35, где n представляет собой 7 или более (например, 8, 10, 12, 14, 16, 18, 20, 25, 30, 35, 40, 50, 60, 70, 80, 90, 100, 150, 200, 250 или более). Данные гипотетические белки CT700 включают в себя варианты (например, аллельные варианты, гомологи, ортологи, паралоги, мутанты, и т.д.) SEQ ID NO: 35. Предпочтительные фрагменты (b) содержат эпитоп из SEQ ID NO: 35. Другие предпочтительные фрагменты лишены одной или нескольких аминокислот (например, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 15, 20, 25 или более) с C-конца и/или одной или нескольких аминокислот (например, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 15, 20, 25 или более) с N-конца SEQ ID NO: 35. Другие фрагменты лишены одного или нескольких доменов белка (например, пропуск сигнального пептида, цитоплазматического домена, трансмембранного домена или внеклеточного домена).
Гипотетический белок (CT266). Один из примеров гипотетического белка CT266 описан как SEQ ID NO: 77 & 78 в WO 03/049762 (инвентарный номер GenBank: AAC67859.1 GI:3328678  CT266 CT266 ; SEQ ID NO: 36 в прилагаемом списке последовательностей). Предпочтительные гипотетические белки CT266 для применения согласно изобретению включают в себя аминокислотную последовательность: (a), которая характеризуется идентичностью 50% или более (например, 60%, 65%, 70%, 75%, 80%, 85%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99%, 99,5% или более) в отношении SEQ ID NO: 36; и/или (b), которая представляет собой фрагмент, по меньшей мере из n следующих друг за другом аминокислот SEQ ID NO: 36, где n представляет собой 7 или более (например, 8, 10, 12, 14, 16, 18, 20, 25, 30, 35, 40, 50, 60, 70, 80, 90, 100, 150, 200, 250 или более). Данные гипотетические белки CT266 включают в себя варианты (например, аллельные варианты, гомологи, ортологи, паралоги, мутанты, и т.д.) SEQ ID NO: 36. Предпочтительные фрагменты (b) содержат эпитоп из SEQ ID NO: 36. Другие предпочтительные фрагменты лишены одной или нескольких аминокислот (например, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 15, 20, 25 или более) с C-конца и/или одной или нескольких аминокислот (например, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 15, 20, 25 или более) с N-конца SEQ ID NO: 36. Другие фрагменты лишены одного или нескольких доменов белка (например, пропуск сигнального пептида, цитоплазматического домена, трансмембранного домена или внеклеточного домена). ; SEQ ID NO: 36 в прилагаемом списке последовательностей). Предпочтительные гипотетические белки CT266 для применения согласно изобретению включают в себя аминокислотную последовательность: (a), которая характеризуется идентичностью 50% или более (например, 60%, 65%, 70%, 75%, 80%, 85%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99%, 99,5% или более) в отношении SEQ ID NO: 36; и/или (b), которая представляет собой фрагмент, по меньшей мере из n следующих друг за другом аминокислот SEQ ID NO: 36, где n представляет собой 7 или более (например, 8, 10, 12, 14, 16, 18, 20, 25, 30, 35, 40, 50, 60, 70, 80, 90, 100, 150, 200, 250 или более). Данные гипотетические белки CT266 включают в себя варианты (например, аллельные варианты, гомологи, ортологи, паралоги, мутанты, и т.д.) SEQ ID NO: 36. Предпочтительные фрагменты (b) содержат эпитоп из SEQ ID NO: 36. Другие предпочтительные фрагменты лишены одной или нескольких аминокислот (например, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 15, 20, 25 или более) с C-конца и/или одной или нескольких аминокислот (например, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 15, 20, 25 или более) с N-конца SEQ ID NO: 36. Другие фрагменты лишены одного или нескольких доменов белка (например, пропуск сигнального пептида, цитоплазматического домена, трансмембранного домена или внеклеточного домена).
Гипотетический белок (CT077). Один из примеров гипотетического белка CT077 описан как SEQ ID NO: 65 & 66 в WO 03/049762 (инвентарный номер GenBank: AAC67668.1 GI:3328472  CT077 CT077 ; SEQ ID NO: 37 в прилагаемом списке последовательностей). Предпочтительные гипотетические белки CT077 для применения согласно изобретению включают в себя аминокислотную последовательность: (a), которая характеризуется идентичностью 50% или более (например, 60%, 65%, 70%, 75%, 80%, 85%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99%, 99,5% или более) в отношении SEQ ID NO: 37; и/или (b), которая представляет собой фрагмент, по меньшей мере из n следующих друг за другом аминокислот SEQ ID NO: 37, где n представляет собой 7 или более (например, 8, 10, 12, 14, 16, 18, 20, 25, 30, 35, 40, 50, 60, 70, 80, 90, 100, 150, 200, 250 или более). Данные гипотетические белки CT077 включают в себя варианты (например, аллельные варианты, гомологи, ортологи, паралоги, мутанты, и т.д.) SEQ ID NO: 37. Предпочтительные фрагменты (b) содержат эпитоп из SEQ ID NO: 37. Другие предпочтительные фрагменты лишены одной или нескольких аминокислот (например, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 15, 20, 25 или более) с C-конца и/или одной или нескольких аминокислот (например, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 15, 20, 25 или более) с N-конца SEQ ID NO: 37. Другие фрагменты лишены одного или нескольких доменов белка (например, пропуск сигнального пептида, цитоплазматического домена, трансмембранного домена или внеклеточного домена). ; SEQ ID NO: 37 в прилагаемом списке последовательностей). Предпочтительные гипотетические белки CT077 для применения согласно изобретению включают в себя аминокислотную последовательность: (a), которая характеризуется идентичностью 50% или более (например, 60%, 65%, 70%, 75%, 80%, 85%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99%, 99,5% или более) в отношении SEQ ID NO: 37; и/или (b), которая представляет собой фрагмент, по меньшей мере из n следующих друг за другом аминокислот SEQ ID NO: 37, где n представляет собой 7 или более (например, 8, 10, 12, 14, 16, 18, 20, 25, 30, 35, 40, 50, 60, 70, 80, 90, 100, 150, 200, 250 или более). Данные гипотетические белки CT077 включают в себя варианты (например, аллельные варианты, гомологи, ортологи, паралоги, мутанты, и т.д.) SEQ ID NO: 37. Предпочтительные фрагменты (b) содержат эпитоп из SEQ ID NO: 37. Другие предпочтительные фрагменты лишены одной или нескольких аминокислот (например, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 15, 20, 25 или более) с C-конца и/или одной или нескольких аминокислот (например, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 15, 20, 25 или более) с N-конца SEQ ID NO: 37. Другие фрагменты лишены одного или нескольких доменов белка (например, пропуск сигнального пептида, цитоплазматического домена, трансмембранного домена или внеклеточного домена).
Гипотетический белок (CT456). Один из примеров гипотетического белка CT456 описан как SEQ ID NO: 255 & 256 в WO 03/049762 (инвентарный номер GenBank: AAC68056.1 GI:3328889  CT456 CT456 ; SEQ ID NO: 38 в прилагаемом списке последовательностей). Предпочтительные гипотетические белки CT456 для применения согласно изобретению включают в себя аминокислотную последовательность: (a), которая характеризуется идентичностью 50% или более (например, 60%, 65%, 70%, 75%, 80%, 85%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99%, 99,5% или более) в отношении SEQ ID NO: 38; и/или (b), которая представляет собой фрагмент, по меньшей мере из n следующих друг за другом аминокислот SEQ ID NO: 38, где n представляет собой 7 или более (например, 8, 10, 12, 14, 16, 18, 20, 25, 30, 35, 40, 50, 60, 70, 80, 90, 100, 150, 200, 250 или более). Данные гипотетические белки CT456 включают в себя варианты (например, аллельные варианты, гомологи, ортологи, паралоги, мутанты, и т.д.) SEQ ID NO: 38. Предпочтительные фрагменты (b) содержат эпитоп из SEQ ID NO: 38. Другие предпочтительные фрагменты лишены одной или нескольких аминокислот (например, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 15, 20, 25 или более) с C-конца и/или одной или нескольких аминокислот (например, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 15, 20, 25 или более) с N-конца SEQ ID NO: 38. Другие фрагменты лишены одного или нескольких доменов белка (например, пропуск сигнального пептида, цитоплазматического домена, трансмембранного домена или внеклеточного домена). ; SEQ ID NO: 38 в прилагаемом списке последовательностей). Предпочтительные гипотетические белки CT456 для применения согласно изобретению включают в себя аминокислотную последовательность: (a), которая характеризуется идентичностью 50% или более (например, 60%, 65%, 70%, 75%, 80%, 85%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99%, 99,5% или более) в отношении SEQ ID NO: 38; и/или (b), которая представляет собой фрагмент, по меньшей мере из n следующих друг за другом аминокислот SEQ ID NO: 38, где n представляет собой 7 или более (например, 8, 10, 12, 14, 16, 18, 20, 25, 30, 35, 40, 50, 60, 70, 80, 90, 100, 150, 200, 250 или более). Данные гипотетические белки CT456 включают в себя варианты (например, аллельные варианты, гомологи, ортологи, паралоги, мутанты, и т.д.) SEQ ID NO: 38. Предпочтительные фрагменты (b) содержат эпитоп из SEQ ID NO: 38. Другие предпочтительные фрагменты лишены одной или нескольких аминокислот (например, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 15, 20, 25 или более) с C-конца и/или одной или нескольких аминокислот (например, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 15, 20, 25 или более) с N-конца SEQ ID NO: 38. Другие фрагменты лишены одного или нескольких доменов белка (например, пропуск сигнального пептида, цитоплазматического домена, трансмембранного домена или внеклеточного домена).
Гипотетический белок (CT165). Один из примеров гипотетического белка CT165 описан (инвентарный номер GenBank: AAC67756.1 GI:3328568  CT165 CT165 ; SEQ ID NO: 39 в прилагаемом списке последовательностей). Предпочтительные гипотетические белки для применения согласно изобретению включают в себя аминокислотную последовательность: (a), которая характеризуется идентичностью 50% или более (например, 60%, 65%, 70%, 75%, 80%, 85%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99%, 99,5% или более) в отношении SEQ ID NO: 39; и/или (b), которая представляет собой фрагмент, по меньшей мере из n следующих друг за другом аминокислот SEQ ID NO: 39, где n представляет собой 7 или более (например, 8, 10, 12, 14, 16, 18, 20, 25, 30, 35, 40, 50, 60, 70, 80, 90, 100, 150, 200, 250 или более). Данные гипотетические белки CT165 включают в себя варианты (например, аллельные варианты, гомологи, ортологи, паралоги, мутанты, и т.д.) SEQ ID NO: 39. Предпочтительные фрагменты (b) содержат эпитоп из SEQ ID NO: 39. Другие предпочтительные фрагменты лишены одной или нескольких аминокислот (например, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 15, 20, 25 или более) с C-конца и/или одной или нескольких аминокислот (например, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 15, 20, 25 или более) с N-конца SEQ ID NO: 39. Другие фрагменты лишены одного или нескольких доменов белка (например, пропуск сигнального пептида, цитоплазматического домена, трансмембранного домена или внеклеточного домена). ; SEQ ID NO: 39 в прилагаемом списке последовательностей). Предпочтительные гипотетические белки для применения согласно изобретению включают в себя аминокислотную последовательность: (a), которая характеризуется идентичностью 50% или более (например, 60%, 65%, 70%, 75%, 80%, 85%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99%, 99,5% или более) в отношении SEQ ID NO: 39; и/или (b), которая представляет собой фрагмент, по меньшей мере из n следующих друг за другом аминокислот SEQ ID NO: 39, где n представляет собой 7 или более (например, 8, 10, 12, 14, 16, 18, 20, 25, 30, 35, 40, 50, 60, 70, 80, 90, 100, 150, 200, 250 или более). Данные гипотетические белки CT165 включают в себя варианты (например, аллельные варианты, гомологи, ортологи, паралоги, мутанты, и т.д.) SEQ ID NO: 39. Предпочтительные фрагменты (b) содержат эпитоп из SEQ ID NO: 39. Другие предпочтительные фрагменты лишены одной или нескольких аминокислот (например, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 15, 20, 25 или более) с C-конца и/или одной или нескольких аминокислот (например, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 15, 20, 25 или более) с N-конца SEQ ID NO: 39. Другие фрагменты лишены одного или нескольких доменов белка (например, пропуск сигнального пептида, цитоплазматического домена, трансмембранного домена или внеклеточного домена).
PorB (CT713). Один из примеров белка  PorB PorB описан как SEQ ID NO: 201 & 202 в WO 03/049762 (инвентарный номер GenBank: AAC68308.1 GI:3329169 описан как SEQ ID NO: 201 & 202 в WO 03/049762 (инвентарный номер GenBank: AAC68308.1 GI:3329169  CT713 CT713 ; SEQ ID NO: 40 в прилагаемом списке последовательностей). Предпочтительные белки PorB для применения согласно изобретению включают в себя аминокислотную последовательность: (a), которая характеризуется идентичностью 50% или более (например, 60%, 65%, 70%, 75%, 80%, 85%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%,99%, 99,5% или более) в отношении SEQ ID NO: 40; и/или (b), которая представляет собой фрагмент, по меньшей мере из n следующих друг за другом аминокислот SEQ ID NO: 40, где n представляет собой 7 или более (например, 8, 10, 12, 14, 16, 18, 20, 25, 30, 35, 40, 50, 60, 70, 80, 90, 100, 150, 200, 250 или более). Данные белки PorB включают в себя варианты (например, аллельные варианты, гомологи, ортологи, паралоги, мутанты, и т.д.) SEQ ID NO: 40. Предпочтительные фрагменты (b) содержат эпитоп из SEQ ID NO: 40. Другие предпочтительные фрагменты лишены одной или нескольких аминокислот (например, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 15, 20, 25 или более) с C-конца и/или одной или нескольких аминокислот (например, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 15, 20, 25 или более) с N-конца SEQ ID NO: 40. Другие фрагменты лишены одного или нескольких доменов белка (например, пропуск сигнального пептида, цитоплазматического домена, трансмембранного домена или внеклеточного домена). ; SEQ ID NO: 40 в прилагаемом списке последовательностей). Предпочтительные белки PorB для применения согласно изобретению включают в себя аминокислотную последовательность: (a), которая характеризуется идентичностью 50% или более (например, 60%, 65%, 70%, 75%, 80%, 85%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%,99%, 99,5% или более) в отношении SEQ ID NO: 40; и/или (b), которая представляет собой фрагмент, по меньшей мере из n следующих друг за другом аминокислот SEQ ID NO: 40, где n представляет собой 7 или более (например, 8, 10, 12, 14, 16, 18, 20, 25, 30, 35, 40, 50, 60, 70, 80, 90, 100, 150, 200, 250 или более). Данные белки PorB включают в себя варианты (например, аллельные варианты, гомологи, ортологи, паралоги, мутанты, и т.д.) SEQ ID NO: 40. Предпочтительные фрагменты (b) содержат эпитоп из SEQ ID NO: 40. Другие предпочтительные фрагменты лишены одной или нескольких аминокислот (например, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 15, 20, 25 или более) с C-конца и/или одной или нескольких аминокислот (например, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 15, 20, 25 или более) с N-конца SEQ ID NO: 40. Другие фрагменты лишены одного или нескольких доменов белка (например, пропуск сигнального пептида, цитоплазматического домена, трансмембранного домена или внеклеточного домена).
Иммуногенность других антигенов Chlamydia trachomatis с известной или неизвестной биологической функцией может быть улучшена путем комбинации с двумя или большим количеством антигенов Chlamydia trachomatis из первой группы антигенов, и/или из второй группы антигенов, и/или из третьей группы антигенов, и/или из четвертой группы антигенов. Такие другие антигены Chlamydia trachomatis с известной или неизвестной биологической функцией включают в себя пятую группу антигенов, состоящую из: (1) CT082 (гипотетический); (2) CT181 (гипотетический); (3) CT050 (гипотетический); (4) CT157 (надсемейство фосфолипазы D); и (5) CT128 (аденилатциклаза AdK).
Гипотетический белок (CT082). Один из примеров гипотетического белка CT082 описан (инвентарный номер GenBank: AAC67673.1 GI:3328477  CT082 CT082 ; SEQ ID NO: 41 в прилагаемом списке последовательностей). Предпочтительные гипотетические белки CT082 для применения согласно изобретению включают в себя аминокислотную последовательность: (a), которая характеризуется идентичностью 50% или более (например, 60%, 65%, 70%, 75%, 80%, 85%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99%, 99,5% или более) в отношении SEQ ID NO: 41; и/или (b), которая представляет собой фрагмент, по меньшей мере из n следующих друг за другом аминокислот SEQ ID NO: 41, где n представляет собой 7 или более (например, 8, 10, 12, 14, 16, 18, 20, 25, 30, 35, 40, 50, 60, 70, 80, 90, 100, 150, 200, 250 или более). Данные гипотетические белки CT082 включают в себя варианты (например, аллельные варианты, гомологи, ортологи, паралоги, мутанты, и т.д.) SEQ ID NO: 41. Предпочтительные фрагменты (b) содержат эпитоп из SEQ ID NO: 41. Другие предпочтительные фрагменты лишены одной или нескольких аминокислот (например, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 15, 20, 25 или более) с C-конца и/или одной или нескольких аминокислот (например, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 15, 20, 25 или более) с N-конца SEQ ID NO: 41. Другие фрагменты лишены одного или нескольких доменов белка (например, пропуск сигнального пептида, цитоплазматического домена, трансмембранного домена или внеклеточного домена). ; SEQ ID NO: 41 в прилагаемом списке последовательностей). Предпочтительные гипотетические белки CT082 для применения согласно изобретению включают в себя аминокислотную последовательность: (a), которая характеризуется идентичностью 50% или более (например, 60%, 65%, 70%, 75%, 80%, 85%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99%, 99,5% или более) в отношении SEQ ID NO: 41; и/или (b), которая представляет собой фрагмент, по меньшей мере из n следующих друг за другом аминокислот SEQ ID NO: 41, где n представляет собой 7 или более (например, 8, 10, 12, 14, 16, 18, 20, 25, 30, 35, 40, 50, 60, 70, 80, 90, 100, 150, 200, 250 или более). Данные гипотетические белки CT082 включают в себя варианты (например, аллельные варианты, гомологи, ортологи, паралоги, мутанты, и т.д.) SEQ ID NO: 41. Предпочтительные фрагменты (b) содержат эпитоп из SEQ ID NO: 41. Другие предпочтительные фрагменты лишены одной или нескольких аминокислот (например, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 15, 20, 25 или более) с C-конца и/или одной или нескольких аминокислот (например, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 15, 20, 25 или более) с N-конца SEQ ID NO: 41. Другие фрагменты лишены одного или нескольких доменов белка (например, пропуск сигнального пептида, цитоплазматического домена, трансмембранного домена или внеклеточного домена).
Гипотетический белок (CT181). Один из примеров гипотетического белка CT181 описан как SEQ ID NO: 245 & 246 в WO 03/049762 (инвентарный номер GenBank: AAC67772.1 GI:3328585  CT181 CT181 ; SEQ ID NO: 42 в прилагаемом списке последовательностей). Предпочтительные гипотетические белки CT181 для применения согласно изобретению включают в себя аминокислотную последовательность: (a), которая характеризуется идентичностью 50% или более (например, 60%, 65%, 70%, 75%, 80%, 85%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99%, 99,5% или более) в отношении SEQ ID NO: 42; и/или (b), которая представляет собой фрагмент, по меньшей мере из n следующих друг за другом аминокислот SEQ ID NO: 42, где n представляет собой 7 или более (например, 8, 10, 12, 14, 16, 18, 20, 25, 30, 35, 40, 50, 60, 70, 80, 90, 100, 150, 200, 250 или более). Данные гипотетические белки CT181 включают в себя варианты (например, аллельные варианты, гомологи, ортологи, паралоги, мутанты, и т.д.) SEQ ID NO: 42. Предпочтительные фрагменты (b) содержат эпитоп из SEQ ID NO: 42. Другие предпочтительные фрагменты лишены одной или нескольких аминокислот (например, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 15, 20, 25 или более) с C-конца и/или одной или нескольких аминокислот (например, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 15, 20, 25 или более) с N-конца SEQ ID NO: 42. Другие фрагменты лишены одного или нескольких доменов белка (например, пропуск сигнального пептида, цитоплазматического домена, трансмембранного домена или внеклеточного домена). ; SEQ ID NO: 42 в прилагаемом списке последовательностей). Предпочтительные гипотетические белки CT181 для применения согласно изобретению включают в себя аминокислотную последовательность: (a), которая характеризуется идентичностью 50% или более (например, 60%, 65%, 70%, 75%, 80%, 85%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99%, 99,5% или более) в отношении SEQ ID NO: 42; и/или (b), которая представляет собой фрагмент, по меньшей мере из n следующих друг за другом аминокислот SEQ ID NO: 42, где n представляет собой 7 или более (например, 8, 10, 12, 14, 16, 18, 20, 25, 30, 35, 40, 50, 60, 70, 80, 90, 100, 150, 200, 250 или более). Данные гипотетические белки CT181 включают в себя варианты (например, аллельные варианты, гомологи, ортологи, паралоги, мутанты, и т.д.) SEQ ID NO: 42. Предпочтительные фрагменты (b) содержат эпитоп из SEQ ID NO: 42. Другие предпочтительные фрагменты лишены одной или нескольких аминокислот (например, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 15, 20, 25 или более) с C-конца и/или одной или нескольких аминокислот (например, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 15, 20, 25 или более) с N-конца SEQ ID NO: 42. Другие фрагменты лишены одного или нескольких доменов белка (например, пропуск сигнального пептида, цитоплазматического домена, трансмембранного домена или внеклеточного домена).
Гипотетический белок (CT050). Один из примеров гипотетического белка CT050 описан (инвентарный номер GenBank: AAC67641.1 GI:3328442  CT050 CT050 ; SEQ ID NO: 43 в прилагаемом списке последовательностей). Предпочтительные гипотетические белки CT050 для применения согласно изобретению включают в себя аминокислотную последовательность: (a), которая характеризуется идентичностью 50% или более (например, 60%, 65%, 70%, 75%, 80%, 85%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99%, 99,5% или более) в отношении SEQ ID NO: 43; и/или (b), которая представляет собой фрагмент, по меньшей мере из n следующих друг за другом аминокислот SEQ ID NO: 43, где n представляет собой 7 или более (например, 8, 10, 12, 14, 16, 18, 20, 25, 30, 35, 40, 50, 60, 70, 80, 90, 100, 150, 200, 250 или более). Данные гипотетические белки CT050 включают в себя варианты (например, аллельные варианты, гомологи, ортологи, паралоги, мутанты, и т.д.) SEQ ID NO: 43. Предпочтительные фрагменты (b) содержат эпитоп из SEQ ID NO: 43. Другие предпочтительные фрагменты лишены одной или нескольких аминокислот (например, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 15, 20, 25 или более) с C-конца и/или одной или нескольких аминокислот (например, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 15, 20, 25 или более) с N-конца SEQ ID NO: 43. Другие фрагменты лишены одного или нескольких доменов белка (например, пропуск сигнального пептида, цитоплазматического домена, трансмембранного домена или внеклеточного домена). ; SEQ ID NO: 43 в прилагаемом списке последовательностей). Предпочтительные гипотетические белки CT050 для применения согласно изобретению включают в себя аминокислотную последовательность: (a), которая характеризуется идентичностью 50% или более (например, 60%, 65%, 70%, 75%, 80%, 85%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99%, 99,5% или более) в отношении SEQ ID NO: 43; и/или (b), которая представляет собой фрагмент, по меньшей мере из n следующих друг за другом аминокислот SEQ ID NO: 43, где n представляет собой 7 или более (например, 8, 10, 12, 14, 16, 18, 20, 25, 30, 35, 40, 50, 60, 70, 80, 90, 100, 150, 200, 250 или более). Данные гипотетические белки CT050 включают в себя варианты (например, аллельные варианты, гомологи, ортологи, паралоги, мутанты, и т.д.) SEQ ID NO: 43. Предпочтительные фрагменты (b) содержат эпитоп из SEQ ID NO: 43. Другие предпочтительные фрагменты лишены одной или нескольких аминокислот (например, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 15, 20, 25 или более) с C-конца и/или одной или нескольких аминокислот (например, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 15, 20, 25 или более) с N-конца SEQ ID NO: 43. Другие фрагменты лишены одного или нескольких доменов белка (например, пропуск сигнального пептида, цитоплазматического домена, трансмембранного домена или внеклеточного домена).
Белок надсемейства фосфолипазы D (CT157). Один из примеров белка надсемейства фосфолипазы D описан (инвентарный номер GenBank: AAC67748.1 GI:3328559  CT157 CT157 ; SEQ ID NO: 44 в прилагаемом списке последовательностей). Предпочтительные белки надсемейства фосфолипазы D для применения согласно изобретению включают в себя аминокислотную последовательность: (a), которая характеризуется идентичностью 50% или более (например, 60%, 65%, 70%, 75%, 80%, 85%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%,99%, 99,5% или более) в отношении SEQ ID NO: 44; и/или (b), которая представляет собой фрагмент, по меньшей мере из n следующих друг за другом аминокислот SEQ ID NO: 44, где n представляет собой 7 или более (например, 8, 10, 12, 14, 16, 18, 20, 25, 30, 35, 40, 50, 60, 70, 80, 90, 100, 150, 200, 250 или более). Данные белки надсемейства фосфолипазы D включают в себя варианты (например, аллельные варианты, гомологи, ортологи, паралоги, мутанты, и т.д.) SEQ ID NO: 44. Предпочтительные фрагменты (b) содержат эпитоп из SEQ ID NO: 44. Другие предпочтительные фрагменты лишены одной или нескольких аминокислот (например, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 15, 20, 25 или более) с C-конца и/или одной или нескольких аминокислот (например, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 15, 20, 25 или более) с N-конца SEQ ID NO: 44. Другие фрагменты лишены одного или нескольких доменов белка (например, пропуск сигнального пептида, цитоплазматического домена, трансмембранного домена или внеклеточного домена). ; SEQ ID NO: 44 в прилагаемом списке последовательностей). Предпочтительные белки надсемейства фосфолипазы D для применения согласно изобретению включают в себя аминокислотную последовательность: (a), которая характеризуется идентичностью 50% или более (например, 60%, 65%, 70%, 75%, 80%, 85%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%,99%, 99,5% или более) в отношении SEQ ID NO: 44; и/или (b), которая представляет собой фрагмент, по меньшей мере из n следующих друг за другом аминокислот SEQ ID NO: 44, где n представляет собой 7 или более (например, 8, 10, 12, 14, 16, 18, 20, 25, 30, 35, 40, 50, 60, 70, 80, 90, 100, 150, 200, 250 или более). Данные белки надсемейства фосфолипазы D включают в себя варианты (например, аллельные варианты, гомологи, ортологи, паралоги, мутанты, и т.д.) SEQ ID NO: 44. Предпочтительные фрагменты (b) содержат эпитоп из SEQ ID NO: 44. Другие предпочтительные фрагменты лишены одной или нескольких аминокислот (например, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 15, 20, 25 или более) с C-конца и/или одной или нескольких аминокислот (например, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 15, 20, 25 или более) с N-конца SEQ ID NO: 44. Другие фрагменты лишены одного или нескольких доменов белка (например, пропуск сигнального пептида, цитоплазматического домена, трансмембранного домена или внеклеточного домена).
AdK (аденилаткиназа) (CT128). Один из примеров белка аденилаткиназы описан (инвентарный номер GenBank: AAC67719.1 GI:3328527  CT128 CT128 ; SEQ ID NO: 45 в прилагаемом списке последовательностей). Предпочтительные белки аденилаткиназы для применения согласно изобретению включают в себя аминокислотную последовательность: (a), которая характеризуется идентичностью 50% или более (например, 60%, 65%, 70%, 75%, 80%, 85%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99%, 99,5% или более) в отношении SEQ ID NO: 45; и/или (b), которая представляет собой фрагмент, по меньшей мере из n следующих друг за другом аминокислот SEQ ID NO: 45, где n представляет собой 7 или более (например, 8, 10, 12, 14, 16, 18, 20, 25, 30, 35, 40, 50, 60, 70, 80, 90, 100, 150, 200, 250 или более). Данные белки аденилаткиназы включают в себя варианты (например, аллельные варианты, гомологи, ортологи, паралоги, мутанты, и т.д.) SEQ ID NO: 45. Предпочтительные фрагменты (b) содержат эпитоп из SEQ ID NO: 45. Другие предпочтительные фрагменты лишены одной или нескольких аминокислот (например, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 15, 20, 25 или более) с C-конца и/или одной или нескольких аминокислот (например, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 15, 20, 25 или более) с N-конца SEQ ID NO: 45. Другие фрагменты лишены одного или нескольких доменов белка (например, пропуск сигнального пептида, цитоплазматического домена, трансмембранного домена или внеклеточного домена). ; SEQ ID NO: 45 в прилагаемом списке последовательностей). Предпочтительные белки аденилаткиназы для применения согласно изобретению включают в себя аминокислотную последовательность: (a), которая характеризуется идентичностью 50% или более (например, 60%, 65%, 70%, 75%, 80%, 85%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99%, 99,5% или более) в отношении SEQ ID NO: 45; и/или (b), которая представляет собой фрагмент, по меньшей мере из n следующих друг за другом аминокислот SEQ ID NO: 45, где n представляет собой 7 или более (например, 8, 10, 12, 14, 16, 18, 20, 25, 30, 35, 40, 50, 60, 70, 80, 90, 100, 150, 200, 250 или более). Данные белки аденилаткиназы включают в себя варианты (например, аллельные варианты, гомологи, ортологи, паралоги, мутанты, и т.д.) SEQ ID NO: 45. Предпочтительные фрагменты (b) содержат эпитоп из SEQ ID NO: 45. Другие предпочтительные фрагменты лишены одной или нескольких аминокислот (например, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 15, 20, 25 или более) с C-конца и/или одной или нескольких аминокислот (например, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 15, 20, 25 или более) с N-конца SEQ ID NO: 45. Другие фрагменты лишены одного или нескольких доменов белка (например, пропуск сигнального пептида, цитоплазматического домена, трансмембранного домена или внеклеточного домена).
Иммуногенность других антигенов Chlamydia trachomatis с известной или неизвестной биологической функцией может быть улучшена путем комбинации с двумя или большим количеством антигенов Chlamydia trachomatis из первой группы антигенов, и/или из второй группы антигенов, и/или из третьей группы антигенов, и/или из четвертой группы антигенов, и/или из пятой группы антигенов. Такие другие антигены Chlamydia trachomatis с известной или неизвестной биологической функцией включают в себя шестую группу антигенов с известной или неизвестной биологической функцией, состоящую из: (1) CT153 (гипотетический); (2) CT262 (гипотетический); (3) CT276 (гипотетический); (4) CT296 (гипотетический); (5) CT372 (гипотетический); (6) CT412 (PmpA); (7) CT480 (олигопептидсвязывающий белок); (8) CT548 (гипотетический); (9) CT043 (гипотетический); (10) CT635 (гипотетический); (11) CT859 (металлопротеаза); (12) CT671 (гипотетический); (13) CT016 (гипотетический); (14) CT017 (гипотетический); (15) CT043 (гипотетический); (16) CT082 (гипотетический); (17) CT548 (гипотетический); (19) CT089 (элемент, отвечающий на низкий уровень кальция); (20) CT812 (PmpD) и (21) CT869 (PmpE).
Гипотетический белок (CT153). Один из примеров гипотетического белка CT153 описан (инвентарный номер GenBank: AAC67744.1 GI:3328555  CT153 CT153 ; SEQ ID NO: 46 в прилагаемом списке последовательностей). Предпочтительные гипотетические белки CT153 для применения согласно изобретению включают в себя аминокислотную последовательность: (a), которая характеризуется идентичностью 50% или более (например, 60%, 65%, 70%, 75%, 80%, 85%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99%, 99,5% или более) в отношении SEQ ID NO: 46; и/или (b), которая представляет собой фрагмент, по меньшей мере из n следующих друг за другом аминокислот SEQ ID NO: 46, где n представляет собой 7 или более (например, 8, 10, 12, 14, 16, 18, 20, 25, 30, 35, 40, 50, 60, 70, 80, 90, 100, 150, 200, 250 или более). Данные гипотетические белки CT153 включают в себя варианты (например, аллельные варианты, гомологи, ортологи, паралоги, мутанты, и т.д.) SEQ ID NO: 46. Предпочтительные фрагменты (b) содержат эпитоп из SEQ ID NO: 46. Другие предпочтительные фрагменты лишены одной или нескольких аминокислот (например, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 15, 20, 25 или более) с C-конца и/или одной или нескольких аминокислот (например, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 15, 20, 25 или более) с N-конца SEQ ID NO: 46. Другие фрагменты лишены одного или нескольких доменов белка (например, пропуск сигнального пептида, цитоплазматического домена, трансмембранного домена или внеклеточного домена). ; SEQ ID NO: 46 в прилагаемом списке последовательностей). Предпочтительные гипотетические белки CT153 для применения согласно изобретению включают в себя аминокислотную последовательность: (a), которая характеризуется идентичностью 50% или более (например, 60%, 65%, 70%, 75%, 80%, 85%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99%, 99,5% или более) в отношении SEQ ID NO: 46; и/или (b), которая представляет собой фрагмент, по меньшей мере из n следующих друг за другом аминокислот SEQ ID NO: 46, где n представляет собой 7 или более (например, 8, 10, 12, 14, 16, 18, 20, 25, 30, 35, 40, 50, 60, 70, 80, 90, 100, 150, 200, 250 или более). Данные гипотетические белки CT153 включают в себя варианты (например, аллельные варианты, гомологи, ортологи, паралоги, мутанты, и т.д.) SEQ ID NO: 46. Предпочтительные фрагменты (b) содержат эпитоп из SEQ ID NO: 46. Другие предпочтительные фрагменты лишены одной или нескольких аминокислот (например, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 15, 20, 25 или более) с C-конца и/или одной или нескольких аминокислот (например, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 15, 20, 25 или более) с N-конца SEQ ID NO: 46. Другие фрагменты лишены одного или нескольких доменов белка (например, пропуск сигнального пептида, цитоплазматического домена, трансмембранного домена или внеклеточного домена).
Гипотетический белок (CT262). Один из примеров гипотетического белка CT262 описан (инвентарный номер GenBank: AAC67835. 1 GI:3328652  CT262 CT262 ; SEQ ID NO: 47 в прилагаемом списке последовательностей). Предпочтительные гипотетические белки CT262 для применения согласно изобретению включают в себя аминокислотную последовательность: (a), которая характеризуется идентичностью 50% или более (например, 60%, 65%, 70%, 75%, 80%, 85%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99%, 99,5% или более) в отношении SEQ ID NO: 47; и/или (b), которая представляет собой фрагмент, по меньшей мере из n следующих друг за другом аминокислот SEQ ID NO: 47, где n представляет собой 7 или более (например, 8, 10, 12, 14, 16, 18, 20, 25, 30, 35, 40, 50, 60, 70, 80, 90, 100, 150, 200, 250 или более). Данные гипотетические белки CT262 включают в себя варианты (например, аллельные варианты, гомологи, ортологи, паралоги, мутанты, и т.д.) SEQ ID NO: 47. Предпочтительные фрагменты (b) содержат эпитоп из SEQ ID NO: 47. Другие предпочтительные фрагменты лишены одной или нескольких аминокислот (например, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 15, 20, 25 или более) с C-конца и/или одной или нескольких аминокислот (например, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 15, 20, 25 или более) с N-конца SEQ ID NO: 47. Другие фрагменты лишены одного или нескольких доменов белка (например, пропуск сигнального пептида, цитоплазматического домена, трансмембранного домена или внеклеточного домена). ; SEQ ID NO: 47 в прилагаемом списке последовательностей). Предпочтительные гипотетические белки CT262 для применения согласно изобретению включают в себя аминокислотную последовательность: (a), которая характеризуется идентичностью 50% или более (например, 60%, 65%, 70%, 75%, 80%, 85%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99%, 99,5% или более) в отношении SEQ ID NO: 47; и/или (b), которая представляет собой фрагмент, по меньшей мере из n следующих друг за другом аминокислот SEQ ID NO: 47, где n представляет собой 7 или более (например, 8, 10, 12, 14, 16, 18, 20, 25, 30, 35, 40, 50, 60, 70, 80, 90, 100, 150, 200, 250 или более). Данные гипотетические белки CT262 включают в себя варианты (например, аллельные варианты, гомологи, ортологи, паралоги, мутанты, и т.д.) SEQ ID NO: 47. Предпочтительные фрагменты (b) содержат эпитоп из SEQ ID NO: 47. Другие предпочтительные фрагменты лишены одной или нескольких аминокислот (например, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 15, 20, 25 или более) с C-конца и/или одной или нескольких аминокислот (например, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 15, 20, 25 или более) с N-конца SEQ ID NO: 47. Другие фрагменты лишены одного или нескольких доменов белка (например, пропуск сигнального пептида, цитоплазматического домена, трансмембранного домена или внеклеточного домена).
Гипотетический белок (CT276). Один из примеров гипотетического белка CT276 описан (инвентарный номер GenBank: AAC67869.1 GI:3328689  CT276 CT276 ; SEQ ID NO: 48 в прилагаемом списке последовательностей). Предпочтительные гипотетические белки CT276 для применения согласно изобретению включают в себя аминокислотную последовательность: (a), которая характеризуется идентичностью 50% или более (например, 60%, 65%, 70%, 75%, 80%, 85%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%,99%, 99,5% или более) в отношении SEQ ID NO: 48; и/или (b), которая представляет собой фрагмент, по меньшей мере из n следующих друг за другом аминокислот SEQ ID NO: 48, где n представляет собой 7 или более (например, 8, 10, 12, 14, 16, 18, 20, 25, 30, 35, 40, 50, 60, 70, 80, 90, 100, 150, 200, 250 или более). Данные гипотетические белки CT276 включают в себя варианты (например, аллельные варианты, гомологи, ортологи, паралоги, мутанты, и т.д.) SEQ ID NO: 48. Предпочтительные фрагменты (b) содержат эпитоп из SEQ ID NO: 48. Другие предпочтительные фрагменты лишены одной или нескольких аминокислот (например, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 15, 20, 25 или более) с C-конца и/или одной или нескольких аминокислот (например, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 15, 20, 25 или более) с N-конца SEQ ID NO: 48. Другие фрагменты лишены одного или нескольких доменов белка (например, пропуск сигнального пептида, цитоплазматического домена, трансмембранного домена или внеклеточного домена). ; SEQ ID NO: 48 в прилагаемом списке последовательностей). Предпочтительные гипотетические белки CT276 для применения согласно изобретению включают в себя аминокислотную последовательность: (a), которая характеризуется идентичностью 50% или более (например, 60%, 65%, 70%, 75%, 80%, 85%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%,99%, 99,5% или более) в отношении SEQ ID NO: 48; и/или (b), которая представляет собой фрагмент, по меньшей мере из n следующих друг за другом аминокислот SEQ ID NO: 48, где n представляет собой 7 или более (например, 8, 10, 12, 14, 16, 18, 20, 25, 30, 35, 40, 50, 60, 70, 80, 90, 100, 150, 200, 250 или более). Данные гипотетические белки CT276 включают в себя варианты (например, аллельные варианты, гомологи, ортологи, паралоги, мутанты, и т.д.) SEQ ID NO: 48. Предпочтительные фрагменты (b) содержат эпитоп из SEQ ID NO: 48. Другие предпочтительные фрагменты лишены одной или нескольких аминокислот (например, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 15, 20, 25 или более) с C-конца и/или одной или нескольких аминокислот (например, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 15, 20, 25 или более) с N-конца SEQ ID NO: 48. Другие фрагменты лишены одного или нескольких доменов белка (например, пропуск сигнального пептида, цитоплазматического домена, трансмембранного домена или внеклеточного домена).
Гипотетический белок (CT296). Один из примеров гипотетического белка CT296 описан (инвентарный номер GenBank: AAC67889.1 GI:3328711  CT296 CT296 ; SEQ ID NO: 49 в прилагаемом списке последовательностей). Предпочтительные гипотетические белки CT296 для применения согласно изобретению включают в себя аминокислотную последовательность: (a), которая характеризуется идентичностью 50% или более (например, 60%, 65%, 70%, 75%, 80%, 85%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99%, 99,5% или более) в отношении SEQ ID NO: 49; и/или (b), которая представляет собой фрагмент, по меньшей мере из n следующих друг за другом аминокислот SEQ ID NO: 49, где n представляет собой 7 или более (например, 8, 10, 12, 14, 16, 18, 20, 25, 30, 35, 40, 50, 60, 70, 80, 90, 100, 150, 200, 250 или более). Данные гипотетические белки CT296 включают в себя варианты (например, аллельные варианты, гомологи, ортологи, паралоги, мутанты, и т.д.) SEQ ID NO: 49. Предпочтительные фрагменты (b) содержат эпитоп из SEQ ID NO: 49. Другие предпочтительные фрагменты лишены одной или нескольких аминокислот (например, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 15, 20, 25 или более) с C-конца и/или одной или нескольких аминокислот (например, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 15, 20, 25 или более) с N-конца SEQ ID NO: 49. Другие фрагменты лишены одного или нескольких доменов белка (например, пропуск сигнального пептида, цитоплазматического домена, трансмембранного домена или внеклеточного домена). ; SEQ ID NO: 49 в прилагаемом списке последовательностей). Предпочтительные гипотетические белки CT296 для применения согласно изобретению включают в себя аминокислотную последовательность: (a), которая характеризуется идентичностью 50% или более (например, 60%, 65%, 70%, 75%, 80%, 85%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99%, 99,5% или более) в отношении SEQ ID NO: 49; и/или (b), которая представляет собой фрагмент, по меньшей мере из n следующих друг за другом аминокислот SEQ ID NO: 49, где n представляет собой 7 или более (например, 8, 10, 12, 14, 16, 18, 20, 25, 30, 35, 40, 50, 60, 70, 80, 90, 100, 150, 200, 250 или более). Данные гипотетические белки CT296 включают в себя варианты (например, аллельные варианты, гомологи, ортологи, паралоги, мутанты, и т.д.) SEQ ID NO: 49. Предпочтительные фрагменты (b) содержат эпитоп из SEQ ID NO: 49. Другие предпочтительные фрагменты лишены одной или нескольких аминокислот (например, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 15, 20, 25 или более) с C-конца и/или одной или нескольких аминокислот (например, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 15, 20, 25 или более) с N-конца SEQ ID NO: 49. Другие фрагменты лишены одного или нескольких доменов белка (например, пропуск сигнального пептида, цитоплазматического домена, трансмембранного домена или внеклеточного домена).
Гипотетический белок (CT372). Один из примеров гипотетического белка CT372 описан как SEQ ID NO: 187 & 188 в WO 03/049762 (инвентарный номер GenBank: AAC67968.1 GI:3328796  CT372 CT372 ; SEQ ID NO: 50 в прилагаемом списке последовательностей). Предпочтительные гипотетические белки CT372 для применения согласно изобретению включают в себя аминокислотную последовательность: (a), которая характеризуется идентичностью 50% или более (например, 60%, 65%, 70%, 75%, 80%, 85%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99%, 99,5% или более) в отношении SEQ ID NO: 50; и/или (b), которая представляет собой фрагмент, по меньшей мере из n следующих друг за другом аминокислот SEQ ID NO: 50, где n представляет собой 7 или более (например, 8, 10, 12, 14, 16, 18, 20, 25, 30, 35, 40, 50, 60, 70, 80, 90, 100, 150, 200, 250 или более). Данные гипотетические белки CT372 включают в себя варианты (например, аллельные варианты, гомологи, ортологи, паралоги, мутанты, и т.д.) SEQ ID NO: 50. Предпочтительные фрагменты (b) содержат эпитоп из SEQ ID NO: 50. Другие предпочтительные фрагменты лишены одной или нескольких аминокислот (например, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 15, 20, 25 или более) с C-конца и/или одной или нескольких аминокислот (например, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 15, 20, 25 или более) с N-конца SEQ ID NO: 50. Другие фрагменты лишены одного или нескольких доменов белка (например, пропуск сигнального пептида, цитоплазматического домена, трансмембранного домена или внеклеточного домена). ; SEQ ID NO: 50 в прилагаемом списке последовательностей). Предпочтительные гипотетические белки CT372 для применения согласно изобретению включают в себя аминокислотную последовательность: (a), которая характеризуется идентичностью 50% или более (например, 60%, 65%, 70%, 75%, 80%, 85%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99%, 99,5% или более) в отношении SEQ ID NO: 50; и/или (b), которая представляет собой фрагмент, по меньшей мере из n следующих друг за другом аминокислот SEQ ID NO: 50, где n представляет собой 7 или более (например, 8, 10, 12, 14, 16, 18, 20, 25, 30, 35, 40, 50, 60, 70, 80, 90, 100, 150, 200, 250 или более). Данные гипотетические белки CT372 включают в себя варианты (например, аллельные варианты, гомологи, ортологи, паралоги, мутанты, и т.д.) SEQ ID NO: 50. Предпочтительные фрагменты (b) содержат эпитоп из SEQ ID NO: 50. Другие предпочтительные фрагменты лишены одной или нескольких аминокислот (например, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 15, 20, 25 или более) с C-конца и/или одной или нескольких аминокислот (например, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 15, 20, 25 или более) с N-конца SEQ ID NO: 50. Другие фрагменты лишены одного или нескольких доменов белка (например, пропуск сигнального пептида, цитоплазматического домена, трансмембранного домена или внеклеточного домена).
Предполагаемый белок внешней мембраны A (PmpA) (CT412). Один из примеров белка PmpA описан как SEQ ID NO: 89 & 90 в WO 03/049762 (инвентарный номер GenBank: AAC68009.1 GI:3328840  CT412 CT412 ; SEQ ID NO: 51 в прилагаемом списке последовательностей, и также SEQ ID NO: 15 выше). Предпочтительные белки PmpA для применения согласно изобретению включают в себя аминокислотную последовательность: (a), которая характеризуется идентичностью 50% или более (например, 60%, 65%, 70%, 75%, 80%, 85%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99%, 99,5% или более) в отношении SEQ ID NO: 51; и/или (b), которая представляет собой фрагмент, по меньшей мере из n следующих друг за другом аминокислот SEQ ID NO: 51, где n представляет собой 7 или более (например, 8, 10, 12, 14, 16, 18, 20, 25, 30, 35, 40, 50, 60, 70, 80, 90, 100, 150, 200, 250 или более). Данные белки PmpA включают в себя варианты (например, аллельные варианты, гомологи, ортологи, паралоги, мутанты, и т.д.) SEQ ID NO: 51. Предпочтительные фрагменты (b) содержат эпитоп из SEQ ID NO: 51. Другие предпочтительные фрагменты лишены одной или нескольких аминокислот (например, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 15, 20, 25 или более) с C-конца и/или одной или нескольких аминокислот (например, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 15, 20, 25 или более) с N-конца SEQ ID NO: 51. Другие фрагменты лишены одного или нескольких доменов белка (например, пропуск сигнального пептида, цитоплазматического домена, трансмембранного домена или внеклеточного домена). ; SEQ ID NO: 51 в прилагаемом списке последовательностей, и также SEQ ID NO: 15 выше). Предпочтительные белки PmpA для применения согласно изобретению включают в себя аминокислотную последовательность: (a), которая характеризуется идентичностью 50% или более (например, 60%, 65%, 70%, 75%, 80%, 85%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99%, 99,5% или более) в отношении SEQ ID NO: 51; и/или (b), которая представляет собой фрагмент, по меньшей мере из n следующих друг за другом аминокислот SEQ ID NO: 51, где n представляет собой 7 или более (например, 8, 10, 12, 14, 16, 18, 20, 25, 30, 35, 40, 50, 60, 70, 80, 90, 100, 150, 200, 250 или более). Данные белки PmpA включают в себя варианты (например, аллельные варианты, гомологи, ортологи, паралоги, мутанты, и т.д.) SEQ ID NO: 51. Предпочтительные фрагменты (b) содержат эпитоп из SEQ ID NO: 51. Другие предпочтительные фрагменты лишены одной или нескольких аминокислот (например, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 15, 20, 25 или более) с C-конца и/или одной или нескольких аминокислот (например, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 15, 20, 25 или более) с N-конца SEQ ID NO: 51. Другие фрагменты лишены одного или нескольких доменов белка (например, пропуск сигнального пептида, цитоплазматического домена, трансмембранного домена или внеклеточного домена).
Олигопептидсвязывающий липопротеин (CT480). Один из примеров олигопептидсвязывающего белка описан как SEQ ID NO: 141 & 142 в WO 03/049762 (инвентарный номер GenBank: AAC68080.1 GI:3328915  CT480 CT480 ; SEQ ID NO: 52 в прилагаемом списке последовательностей). Предпочтительные олигопептидсвязывающие белки для применения согласно изобретению включают в себя аминокислотную последовательность: (a), которая характеризуется идентичностью 50% или более (например, 60%, 65%, 70%, 75%, 80%, 85%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%,99%, 99,5% или более) в отношении SEQ ID NO: 52; и/или (b), которая представляет собой фрагмент, по меньшей мере из n следующих друг за другом аминокислот SEQ ID NO: 52, где n представляет собой 7 или более (например, 8, 10, 12, 14, 16, 18, 20, 25, 30, 35, 40, 50, 60, 70, 80, 90, 100, 150, 200, 250 или более). Данные олигопептидсвязывающие белки включают в себя варианты (например, аллельные варианты, гомологи, ортологи, паралоги, мутанты, и т.д.) SEQ ID NO: 52. Предпочтительные фрагменты (b) содержат эпитоп из SEQ ID NO: 52. Другие предпочтительные фрагменты лишены одной или нескольких аминокислот (например, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 15, 20, 25 или более) с C-конца и/или одной или нескольких аминокислот (например, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 15, 20, 25 или более) с N-конца SEQ ID NO: 52. Другие фрагменты лишены одного или нескольких доменов белка (например, пропуск сигнального пептида, цитоплазматического домена, трансмембранного домена или внеклеточного домена). ; SEQ ID NO: 52 в прилагаемом списке последовательностей). Предпочтительные олигопептидсвязывающие белки для применения согласно изобретению включают в себя аминокислотную последовательность: (a), которая характеризуется идентичностью 50% или более (например, 60%, 65%, 70%, 75%, 80%, 85%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%,99%, 99,5% или более) в отношении SEQ ID NO: 52; и/или (b), которая представляет собой фрагмент, по меньшей мере из n следующих друг за другом аминокислот SEQ ID NO: 52, где n представляет собой 7 или более (например, 8, 10, 12, 14, 16, 18, 20, 25, 30, 35, 40, 50, 60, 70, 80, 90, 100, 150, 200, 250 или более). Данные олигопептидсвязывающие белки включают в себя варианты (например, аллельные варианты, гомологи, ортологи, паралоги, мутанты, и т.д.) SEQ ID NO: 52. Предпочтительные фрагменты (b) содержат эпитоп из SEQ ID NO: 52. Другие предпочтительные фрагменты лишены одной или нескольких аминокислот (например, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 15, 20, 25 или более) с C-конца и/или одной или нескольких аминокислот (например, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 15, 20, 25 или более) с N-конца SEQ ID NO: 52. Другие фрагменты лишены одного или нескольких доменов белка (например, пропуск сигнального пептида, цитоплазматического домена, трансмембранного домена или внеклеточного домена).
Гипотетический белок (CT548). Один из примеров гипотетического белка CT548 описан как SEQ ID NO: 153 & 154 в WO 03/049762 (инвентарный номер GenBank: AAC68150.1 GI:3328987  CT548 CT548 ; SEQ ID NO: 53 в прилагаемом списке последовательностей). Предпочтительные гипотетические белки CT548 для применения согласно изобретению включают в себя аминокислотную последовательность: (a), которая характеризуется идентичностью 50% или более (например, 60%, 65%, 70%, 75%, 80%, 85%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99%, 99,5% или более) в отношении SEQ ID NO: 53; и/или (b), которая представляет собой фрагмент, по меньшей мере из n следующих друг за другом аминокислот SEQ ID NO: 53, где n представляет собой 7 или более (например, 8, 10, 12, 14, 16, 18, 20, 25, 30, 35, 40, 50, 60, 70, 80, 90, 100, 150, 200, 250 или более). Данные гипотетические белки CT548 включают в себя варианты (например, аллельные варианты, гомологи, ортологи, паралоги, мутанты, и т.д.) SEQ ID NO: 53. Предпочтительные фрагменты (b) содержат эпитоп из SEQ ID NO: 53. Другие предпочтительные фрагменты лишены одной или нескольких аминокислот (например, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 15, 20, 25 или более) с C-конца и/или одной или нескольких аминокислот (например, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 15, 20, 25 или более) с N-конца SEQ ID NO: 53. Другие фрагменты лишены одного или нескольких доменов белка (например, пропуск сигнального пептида, цитоплазматического домена, трансмембранного домена или внеклеточного домена). ; SEQ ID NO: 53 в прилагаемом списке последовательностей). Предпочтительные гипотетические белки CT548 для применения согласно изобретению включают в себя аминокислотную последовательность: (a), которая характеризуется идентичностью 50% или более (например, 60%, 65%, 70%, 75%, 80%, 85%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99%, 99,5% или более) в отношении SEQ ID NO: 53; и/или (b), которая представляет собой фрагмент, по меньшей мере из n следующих друг за другом аминокислот SEQ ID NO: 53, где n представляет собой 7 или более (например, 8, 10, 12, 14, 16, 18, 20, 25, 30, 35, 40, 50, 60, 70, 80, 90, 100, 150, 200, 250 или более). Данные гипотетические белки CT548 включают в себя варианты (например, аллельные варианты, гомологи, ортологи, паралоги, мутанты, и т.д.) SEQ ID NO: 53. Предпочтительные фрагменты (b) содержат эпитоп из SEQ ID NO: 53. Другие предпочтительные фрагменты лишены одной или нескольких аминокислот (например, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 15, 20, 25 или более) с C-конца и/или одной или нескольких аминокислот (например, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 15, 20, 25 или более) с N-конца SEQ ID NO: 53. Другие фрагменты лишены одного или нескольких доменов белка (например, пропуск сигнального пептида, цитоплазматического домена, трансмембранного домена или внеклеточного домена).
Гипотетический белок (CT043). Один из примеров гипотетического белка CT043 описан (инвентарный номер GenBank: AAC67634.1 GI:3328435  CT043 CT043 ; SEQ ID NO: 54 в прилагаемом списке последовательностей). Предпочтительные гипотетические белки CT043 для применения согласно изобретению включают в себя аминокислотную последовательность: (a), которая характеризуется идентичностью 50% или более (например, 60%, 65%, 70%, 75%, 80%, 85%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%,99%, 99,5% или более) в отношении SEQ ID NO: 54; и/или (b), которая представляет собой фрагмент, по меньшей мере из n следующих друг за другом аминокислот SEQ ID NO: 54, где n представляет собой 7 или более (например, 8, 10, 12, 14, 16, 18, 20, 25, 30, 35, 40, 50, 60, 70, 80, 90, 100, 150, 200, 250 или более). Данные гипотетические белки CT043 включают в себя варианты (например, аллельные варианты, гомологи, ортологи, паралоги, мутанты, и т.д.) SEQ ID NO: 54. Предпочтительные фрагменты (b) содержат эпитоп из SEQ ID NO: 54. Другие предпочтительные фрагменты лишены одной или нескольких аминокислот (например, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 15, 20, 25 или более) с C-конца и/или одной или нескольких аминокислот (например, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 15, 20, 25 или более) с N-конца SEQ ID NO: 54. Другие фрагменты лишены одного или нескольких доменов белка (например, пропуск сигнального пептида, цитоплазматического домена, трансмембранного домена или внеклеточного домена). ; SEQ ID NO: 54 в прилагаемом списке последовательностей). Предпочтительные гипотетические белки CT043 для применения согласно изобретению включают в себя аминокислотную последовательность: (a), которая характеризуется идентичностью 50% или более (например, 60%, 65%, 70%, 75%, 80%, 85%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%,99%, 99,5% или более) в отношении SEQ ID NO: 54; и/или (b), которая представляет собой фрагмент, по меньшей мере из n следующих друг за другом аминокислот SEQ ID NO: 54, где n представляет собой 7 или более (например, 8, 10, 12, 14, 16, 18, 20, 25, 30, 35, 40, 50, 60, 70, 80, 90, 100, 150, 200, 250 или более). Данные гипотетические белки CT043 включают в себя варианты (например, аллельные варианты, гомологи, ортологи, паралоги, мутанты, и т.д.) SEQ ID NO: 54. Предпочтительные фрагменты (b) содержат эпитоп из SEQ ID NO: 54. Другие предпочтительные фрагменты лишены одной или нескольких аминокислот (например, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 15, 20, 25 или более) с C-конца и/или одной или нескольких аминокислот (например, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 15, 20, 25 или более) с N-конца SEQ ID NO: 54. Другие фрагменты лишены одного или нескольких доменов белка (например, пропуск сигнального пептида, цитоплазматического домена, трансмембранного домена или внеклеточного домена).
Гипотетический белок (CT635). Один из примеров гипотетического белка CT635 описан (инвентарный номер GenBank: AAC68239.1 GI:3329083  CT635 CT635 ; SEQ ID NO: 55 в прилагаемом списке последовательностей). Предпочтительные гипотетические белки CT635 для применения согласно изобретению включают в себя аминокислотную последовательность: (a), которая характеризуется идентичностью 50% или более (например, 60%, 65%, 70%, 75%, 80%, 85%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%,99%, 99,5% или более) в отношении SEQ ID NO: 55; и/или (b), которая представляет собой фрагмент, по меньшей мере из n следующих друг за другом аминокислот SEQ ID NO: 55, где n представляет собой 7 или более (например, 8, 10, 12, 14, 16, 18, 20, 25, 30, 35, 40, 50, 60, 70, 80, 90, 100, 150, 200, 250 или более). Данные гипотетические белки CT635 включают в себя варианты (например, аллельные варианты, гомологи, ортологи, паралоги, мутанты, и т.д.) SEQ ID NO: 55. Предпочтительные фрагменты (b) содержат эпитоп из SEQ ID NO: 55. Другие предпочтительные фрагменты лишены одной или нескольких аминокислот (например, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 15, 20, 25 или более) с C-конца и/или одной или нескольких аминокислот (например, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 15, 20, 25 или более) с N-конца SEQ ID NO: 55. Другие фрагменты лишены одного или нескольких доменов белка (например, пропуск сигнального пептида, цитоплазматического домена, трансмембранного домена или внеклеточного домена). ; SEQ ID NO: 55 в прилагаемом списке последовательностей). Предпочтительные гипотетические белки CT635 для применения согласно изобретению включают в себя аминокислотную последовательность: (a), которая характеризуется идентичностью 50% или более (например, 60%, 65%, 70%, 75%, 80%, 85%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%,99%, 99,5% или более) в отношении SEQ ID NO: 55; и/или (b), которая представляет собой фрагмент, по меньшей мере из n следующих друг за другом аминокислот SEQ ID NO: 55, где n представляет собой 7 или более (например, 8, 10, 12, 14, 16, 18, 20, 25, 30, 35, 40, 50, 60, 70, 80, 90, 100, 150, 200, 250 или более). Данные гипотетические белки CT635 включают в себя варианты (например, аллельные варианты, гомологи, ортологи, паралоги, мутанты, и т.д.) SEQ ID NO: 55. Предпочтительные фрагменты (b) содержат эпитоп из SEQ ID NO: 55. Другие предпочтительные фрагменты лишены одной или нескольких аминокислот (например, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 15, 20, 25 или более) с C-конца и/или одной или нескольких аминокислот (например, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 15, 20, 25 или более) с N-конца SEQ ID NO: 55. Другие фрагменты лишены одного или нескольких доменов белка (например, пропуск сигнального пептида, цитоплазматического домена, трансмембранного домена или внеклеточного домена).
Металлопротеаза (CT859). Один из примеров белка металлопротеазы описан (инвентарный номер GenBank: AAC68457.1 GI:3329333  CT859 CT859 ; SEQ ID NO: 56 в прилагаемом списке последовательностей). Предпочтительные белки металлопротеазы для применения согласно изобретению включают в себя аминокислотную последовательность: (a), которая характеризуется идентичностью 50% или более (например, 60%, 65%, 70%, 75%, 80%, 85%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%,99%, 99,5% или более) в отношении SEQ ID NO: 56; и/или (b), которая представляет собой фрагмент, по меньшей мере из n следующих друг за другом аминокислот SEQ ID NO: 56, где n представляет собой 7 или более (например, 8, 10, 12, 14, 16, 18, 20, 25, 30, 35, 40, 50, 60, 70, 80, 90, 100, 150, 200, 250 или более). Данные белки металлопротеазы включают в себя варианты (например, аллельные варианты, гомологи, ортологи, паралоги, мутанты, и т.д.) SEQ ID NO: 56. Предпочтительные фрагменты (b) содержат эпитоп из SEQ ID NO: 56. Другие предпочтительные фрагменты лишены одной или нескольких аминокислот (например, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 15, 20, 25 или более) с C-конца и/или одной или нескольких аминокислот (например, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 15, 20, 25 или более) с N-конца SEQ ID NO: 56. Другие фрагменты лишены одного или нескольких доменов белка (например, пропуск сигнального пептида, цитоплазматического домена, трансмембранного домена или внеклеточного домена). ; SEQ ID NO: 56 в прилагаемом списке последовательностей). Предпочтительные белки металлопротеазы для применения согласно изобретению включают в себя аминокислотную последовательность: (a), которая характеризуется идентичностью 50% или более (например, 60%, 65%, 70%, 75%, 80%, 85%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%,99%, 99,5% или более) в отношении SEQ ID NO: 56; и/или (b), которая представляет собой фрагмент, по меньшей мере из n следующих друг за другом аминокислот SEQ ID NO: 56, где n представляет собой 7 или более (например, 8, 10, 12, 14, 16, 18, 20, 25, 30, 35, 40, 50, 60, 70, 80, 90, 100, 150, 200, 250 или более). Данные белки металлопротеазы включают в себя варианты (например, аллельные варианты, гомологи, ортологи, паралоги, мутанты, и т.д.) SEQ ID NO: 56. Предпочтительные фрагменты (b) содержат эпитоп из SEQ ID NO: 56. Другие предпочтительные фрагменты лишены одной или нескольких аминокислот (например, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 15, 20, 25 или более) с C-конца и/или одной или нескольких аминокислот (например, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 15, 20, 25 или более) с N-конца SEQ ID NO: 56. Другие фрагменты лишены одного или нескольких доменов белка (например, пропуск сигнального пептида, цитоплазматического домена, трансмембранного домена или внеклеточного домена).
Гипотетический белок (CT671). Один из примеров гипотетического белка CT671 описан (инвентарный номер GenBank: AAC68266.1 GI:3329122  CT671 CT671 ; SEQ ID NO: 57 в прилагаемом списке последовательностей). Предпочтительные гипотетические белки CT671 для применения согласно изобретению включают в себя аминокислотную последовательность: (a), которая характеризуется идентичностью 50% или более (например, 60%, 65%, 70%, 75%, 80%, 85%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99%, 99,5% или более) в отношении SEQ ID NO: 57; и/или (b), которая представляет собой фрагмент, по меньшей мере из n следующих друг за другом аминокислот SEQ ID NO: 57, где n представляет собой 7 или более (например, 8, 10, 12, 14, 16, 18, 20, 25, 30, 35, 40, 50, 60, 70, 80, 90, 100, 150, 200, 250 или более). Данные гипотетические белки CT671 включают в себя варианты (например, аллельные варианты, гомологи, ортологи, паралоги, мутанты, и т.д.) SEQ ID NO: 57. Предпочтительные фрагменты (b) содержат эпитоп из SEQ ID NO: 57. Другие предпочтительные фрагменты лишены одной или нескольких аминокислот (например, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 15, 20, 25 или более) с C-конца и/или одной или нескольких аминокислот (например, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 15, 20, 25 или более) с N-конца SEQ ID NO: 57. Другие фрагменты лишены одного или нескольких доменов белка (например, пропуск сигнального пептида, цитоплазматического домена, трансмембранного домена или внеклеточного домена). ; SEQ ID NO: 57 в прилагаемом списке последовательностей). Предпочтительные гипотетические белки CT671 для применения согласно изобретению включают в себя аминокислотную последовательность: (a), которая характеризуется идентичностью 50% или более (например, 60%, 65%, 70%, 75%, 80%, 85%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99%, 99,5% или более) в отношении SEQ ID NO: 57; и/или (b), которая представляет собой фрагмент, по меньшей мере из n следующих друг за другом аминокислот SEQ ID NO: 57, где n представляет собой 7 или более (например, 8, 10, 12, 14, 16, 18, 20, 25, 30, 35, 40, 50, 60, 70, 80, 90, 100, 150, 200, 250 или более). Данные гипотетические белки CT671 включают в себя варианты (например, аллельные варианты, гомологи, ортологи, паралоги, мутанты, и т.д.) SEQ ID NO: 57. Предпочтительные фрагменты (b) содержат эпитоп из SEQ ID NO: 57. Другие предпочтительные фрагменты лишены одной или нескольких аминокислот (например, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 15, 20, 25 или более) с C-конца и/или одной или нескольких аминокислот (например, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 15, 20, 25 или более) с N-конца SEQ ID NO: 57. Другие фрагменты лишены одного или нескольких доменов белка (например, пропуск сигнального пептида, цитоплазматического домена, трансмембранного домена или внеклеточного домена).
Гипотетический белок (CT016). Один из примеров гипотетического белка CT016 описан (инвентарный номер GenBank: AAC67606.1 GI:3328405  CT016 CT016 ; SEQ ID NO: 58 в прилагаемом списке последовательностей). Предпочтительные гипотетические белки CT016 для применения согласно изобретению включают в себя аминокислотную последовательность: (a), которая характеризуется идентичностью 50% или более (например, 60%, 65%, 70%, 75%, 80%, 85%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99%, 99,5% или более) в отношении SEQ ID NO: 58; и/или (b), которая представляет собой фрагмент, по меньшей мере из n следующих друг за другом аминокислот SEQ ID NO: 58, где n представляет собой 7 или более (например, 8, 10, 12, 14, 16, 18, 20, 25, 30, 35, 40, 50, 60, 70, 80, 90, 100, 150, 200, 250 или более). Данные гипотетические белки CT016 включают в себя варианты (например, аллельные варианты, гомологи, ортологи, паралоги, мутанты, и т.д.) SEQ ID NO: 58. Предпочтительные фрагменты (b) содержат эпитоп из SEQ ID NO: 58. Другие предпочтительные фрагменты лишены одной или нескольких аминокислот (например, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 15, 20, 25 или более) с C-конца и/или одной или нескольких аминокислот (например, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 15, 20, 25 или более) с N-конца SEQ ID NO: 58. Другие фрагменты лишены одного или нескольких доменов белка (например, пропуск сигнального пептида, цитоплазматического домена, трансмембранного домена или внеклеточного домена). ; SEQ ID NO: 58 в прилагаемом списке последовательностей). Предпочтительные гипотетические белки CT016 для применения согласно изобретению включают в себя аминокислотную последовательность: (a), которая характеризуется идентичностью 50% или более (например, 60%, 65%, 70%, 75%, 80%, 85%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99%, 99,5% или более) в отношении SEQ ID NO: 58; и/или (b), которая представляет собой фрагмент, по меньшей мере из n следующих друг за другом аминокислот SEQ ID NO: 58, где n представляет собой 7 или более (например, 8, 10, 12, 14, 16, 18, 20, 25, 30, 35, 40, 50, 60, 70, 80, 90, 100, 150, 200, 250 или более). Данные гипотетические белки CT016 включают в себя варианты (например, аллельные варианты, гомологи, ортологи, паралоги, мутанты, и т.д.) SEQ ID NO: 58. Предпочтительные фрагменты (b) содержат эпитоп из SEQ ID NO: 58. Другие предпочтительные фрагменты лишены одной или нескольких аминокислот (например, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 15, 20, 25 или более) с C-конца и/или одной или нескольких аминокислот (например, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 15, 20, 25 или более) с N-конца SEQ ID NO: 58. Другие фрагменты лишены одного или нескольких доменов белка (например, пропуск сигнального пептида, цитоплазматического домена, трансмембранного домена или внеклеточного домена).
Гипотетический белок (CT017). Один из примеров гипотетического белка CT017 описан (инвентарный номер GenBank: AAC67607.1 GI:3328406  CT017 CT017 ; SEQ ID NO: 59 в прилагаемом списке последовательностей). Предпочтительные гипотетические белки CT017 для применения согласно изобретению включают в себя аминокислотную последовательность: (a), которая характеризуется идентичностью 50% или более (например, 60%, 65%, 70%, 75%, 80%, 85%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99%, 99,5% или более) в отношении SEQ ID NO: 59; и/или (b), которая представляет собой фрагмент, по меньшей мере из n следующих друг за другом аминокислот SEQ ID NO: 59, где n представляет собой 7 или более (например, 8, 10, 12, 14, 16, 18, 20, 25, 30, 35, 40, 50, 60, 70, 80, 90, 100, 150, 200, 250 или более). Данные гипотетические белки CT017 включают в себя варианты (например, аллельные варианты, гомологи, ортологи, паралоги, мутанты, и т.д.) SEQ ID NO: 59. Предпочтительные фрагменты (b) содержат эпитоп из SEQ ID NO: 59. Другие предпочтительные фрагменты лишены одной или нескольких аминокислот (например, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 15, 20, 25 или более) с C-конца и/или одной или нескольких аминокислот (например, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 15, 20, 25 или более) с N-конца SEQ ID NO: 59. Другие фрагменты лишены одного или нескольких доменов белка (например, пропуск сигнального пептида, цитоплазматического домена, трансмембранного домена или внеклеточного домена). ; SEQ ID NO: 59 в прилагаемом списке последовательностей). Предпочтительные гипотетические белки CT017 для применения согласно изобретению включают в себя аминокислотную последовательность: (a), которая характеризуется идентичностью 50% или более (например, 60%, 65%, 70%, 75%, 80%, 85%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99%, 99,5% или более) в отношении SEQ ID NO: 59; и/или (b), которая представляет собой фрагмент, по меньшей мере из n следующих друг за другом аминокислот SEQ ID NO: 59, где n представляет собой 7 или более (например, 8, 10, 12, 14, 16, 18, 20, 25, 30, 35, 40, 50, 60, 70, 80, 90, 100, 150, 200, 250 или более). Данные гипотетические белки CT017 включают в себя варианты (например, аллельные варианты, гомологи, ортологи, паралоги, мутанты, и т.д.) SEQ ID NO: 59. Предпочтительные фрагменты (b) содержат эпитоп из SEQ ID NO: 59. Другие предпочтительные фрагменты лишены одной или нескольких аминокислот (например, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 15, 20, 25 или более) с C-конца и/или одной или нескольких аминокислот (например, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 15, 20, 25 или более) с N-конца SEQ ID NO: 59. Другие фрагменты лишены одного или нескольких доменов белка (например, пропуск сигнального пептида, цитоплазматического домена, трансмембранного домена или внеклеточного домена).
Гипотетический белок (CT043). Один из примеров гипотетического белка CT043 описан (инвентарный номер GenBank: AAC67634.1 GI:3328435  CT043 CT043 ; SEQ ID NO: 60 в прилагаемом списке последовательностей). Предпочтительные гипотетические белки CT043 для применения согласно изобретению включают в себя аминокислотную последовательность: (a), которая характеризуется идентичностью 50% или более (например, 60%, 65%, 70%, 75%, 80%, 85%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%,99%, 99,5% или более) в отношении SEQ ID NO: 60; и/или (b), которая представляет собой фрагмент, по меньшей мере из n следующих друг за другом аминокислот SEQ ID NO: 60, где n представляет собой 7 или более (например, 8, 10, 12, 14, 16, 18, 20, 25, 30, 35, 40, 50, 60, 70, 80, 90, 100, 150, 200, 250 или более). Данные гипотетические белки CT043 включают в себя варианты (например, аллельные варианты, гомологи, ортологи, паралоги, мутанты, и т.д.) SEQ ID NO: 60. Предпочтительные фрагменты (b) содержат эпитоп из SEQ ID NO: 60. Другие предпочтительные фрагменты лишены одной или нескольких аминокислот (например, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 15, 20, 25 или более) с C-конца и/или одной или нескольких аминокислот (например, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 15, 20, 25 или более) с N-конца SEQ ID NO: 60. Другие фрагменты лишены одного или нескольких доменов белка (например, пропуск сигнального пептида, цитоплазматического домена, трансмембранного домена или внеклеточного домена). ; SEQ ID NO: 60 в прилагаемом списке последовательностей). Предпочтительные гипотетические белки CT043 для применения согласно изобретению включают в себя аминокислотную последовательность: (a), которая характеризуется идентичностью 50% или более (например, 60%, 65%, 70%, 75%, 80%, 85%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%,99%, 99,5% или более) в отношении SEQ ID NO: 60; и/или (b), которая представляет собой фрагмент, по меньшей мере из n следующих друг за другом аминокислот SEQ ID NO: 60, где n представляет собой 7 или более (например, 8, 10, 12, 14, 16, 18, 20, 25, 30, 35, 40, 50, 60, 70, 80, 90, 100, 150, 200, 250 или более). Данные гипотетические белки CT043 включают в себя варианты (например, аллельные варианты, гомологи, ортологи, паралоги, мутанты, и т.д.) SEQ ID NO: 60. Предпочтительные фрагменты (b) содержат эпитоп из SEQ ID NO: 60. Другие предпочтительные фрагменты лишены одной или нескольких аминокислот (например, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 15, 20, 25 или более) с C-конца и/или одной или нескольких аминокислот (например, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 15, 20, 25 или более) с N-конца SEQ ID NO: 60. Другие фрагменты лишены одного или нескольких доменов белка (например, пропуск сигнального пептида, цитоплазматического домена, трансмембранного домена или внеклеточного домена).
Гипотетический белок (CT082). Данный гипотетический белок уже обсуждался выше как SEQ ID NO: 39.
Гипотетический белок (CT548). Один из примеров гипотетического белка CT548 описан (инвентарный номер GenBank: AAC68150.1 GI:3328987  CT548 CT548 ; SEQ ID NO: 61 в прилагаемом списке последовательностей). Предпочтительные гипотетические белки CT548 для применения согласно изобретению включают в себя аминокислотную последовательность: (a), которая характеризуется идентичностью 50% или более (например, 60%, 65%, 70%, 75%, 80%, 85%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%,99%, 99,5% или более) в отношении SEQ ID NO: 61; и/или (b), которая представляет собой фрагмент, по меньшей мере из n следующих друг за другом аминокислот SEQ ID NO: 61, где n представляет собой 7 или более (например, 8, 10, 12, 14, 16, 18, 20, 25, 30, 35, 40, 50, 60, 70, 80, 90, 100, 150, 200, 250 или более). Данные гипотетические белки CT548 включают в себя варианты (например, аллельные варианты, гомологи, ортологи, паралоги, мутанты, и т.д.) SEQ ID NO: 61. Предпочтительные фрагменты (b) содержат эпитоп из SEQ ID NO: 61. Другие предпочтительные фрагменты лишены одной или нескольких аминокислот (например, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 15, 20, 25 или более) с C-конца и/или одной или нескольких аминокислот (например, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 15, 20, 25 или более) с N-конца SEQ ID NO: 61. Другие фрагменты лишены одного или нескольких доменов белка (например, пропуск сигнального пептида, цитоплазматического домена, трансмембранного домена или внеклеточного домена). ; SEQ ID NO: 61 в прилагаемом списке последовательностей). Предпочтительные гипотетические белки CT548 для применения согласно изобретению включают в себя аминокислотную последовательность: (a), которая характеризуется идентичностью 50% или более (например, 60%, 65%, 70%, 75%, 80%, 85%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%,99%, 99,5% или более) в отношении SEQ ID NO: 61; и/или (b), которая представляет собой фрагмент, по меньшей мере из n следующих друг за другом аминокислот SEQ ID NO: 61, где n представляет собой 7 или более (например, 8, 10, 12, 14, 16, 18, 20, 25, 30, 35, 40, 50, 60, 70, 80, 90, 100, 150, 200, 250 или более). Данные гипотетические белки CT548 включают в себя варианты (например, аллельные варианты, гомологи, ортологи, паралоги, мутанты, и т.д.) SEQ ID NO: 61. Предпочтительные фрагменты (b) содержат эпитоп из SEQ ID NO: 61. Другие предпочтительные фрагменты лишены одной или нескольких аминокислот (например, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 15, 20, 25 или более) с C-конца и/или одной или нескольких аминокислот (например, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 15, 20, 25 или более) с N-конца SEQ ID NO: 61. Другие фрагменты лишены одного или нескольких доменов белка (например, пропуск сигнального пептида, цитоплазматического домена, трансмембранного домена или внеклеточного домена).
LcrE (CT089). Данный элемент ответа на низкий уровень кальция обсуждается выше как SEQ ID NO: 2 и SEQ ID NO 41.
PmpD (CT812). Данный полиморфный мембранный белок D осуждается выше как SEQ ID NO: 18 (CT812).
PmpE (CT869). Данный полиморфный мембранный белок Е обсуждался выше как SEQ ID NO: 19.
Изобретение относится к композиции, содержащей комбинацию антигенов Chlamydia trachomatis, причем указанная комбинация выбрана из группы, состоящей из двух, трех, четырех или пяти антигенов Chlamydia trachomatis из первой группы антигенов и одного, двух, трех, четырех или пяти антигенов из четвертой группы антигенов.
Изобретение относится к композиции, содержащей комбинацию антигенов Chlamydia trachomatis, причем указанная комбинация выбрана из группы, состоящей из двух, трех, четырех или пяти антигенов Chlamydia trachomatis из первой группы антигенов и одного, двух, трех, четырех или пяти антигенов из пятой группы антигенов.
Изобретение относится к композиции, содержащей комбинацию антигенов Chlamydia trachomatis, причем указанная комбинация выбрана из группы, состоящей из двух, трех, четырех или пяти антигенов Chlamydia trachomatis из первой группы антигенов и одного, двух, трех, четырех или пяти антигенов из шестой группы антигенов.
Изобретение относится к композиции, содержащей комбинацию антигенов Chlamydia trachomatis, причем указанная комбинация выбрана из группы, состоящей из двух, трех, четырех или пяти антигенов Chlamydia trachomatis из второй группы антигенов и одного, двух, трех, четырех или пяти антигенов из четвертой группы антигенов.
Изобретение относится к композиции, содержащей комбинацию антигенов Chlamydia trachomatis, причем указанная комбинация выбрана из группы, состоящей из двух, трех, четырех или пяти антигенов Chlamydia trachomatis из второй группы антигенов и одного, двух, трех, четырех или пяти антигенов из пятой группы антигенов.
Изобретение относится к композиции, содержащей комбинацию антигенов Chlamydia trachomatis, причем указанная комбинация выбрана из группы, состоящей из двух, трех, четырех или пяти антигенов Chlamydia trachomatis из второй группы антигенов и одного, двух, трех, четырех или пяти антигенов из шестой группы антигенов.
Таким образом, изобретение относится к композиции, содержащей комбинацию антигенов Chlamydia trachomatis, причем указанная комбинация выбрана из группы, состоящей из двух, трех, четырех или пяти антигенов Chlamydia trachomatis из первой группы антигенов, и одного, двух, трех, четырех, пяти или шести антигенов Chlamydia trachomatis из третьей группы антигенов, и одного, двух, трех, четырех, пяти, шести, семи, восьми, девяти или десяти антигенов из четвертой группы антигенов, и одного, двух, трех, четырех или пяти антигенов Chlamydia trachomatis из пятой группы антигенов, и одного, двух, трех, четырех, пяти, шести, семи, восьми, девяти, десяти, одиннадцати или двенадцати антигенов из шестой группы антигенов.
Предпочтительно комбинация выбрана из группы, состоящей из трех, четырех или пяти антигенов Chlamydia trachomatis из первой группы антигенов, и трех, четырех или пяти антигенов Chlamydia trachomatis из третьей группы антигенов, и трех, четырех или пяти антигенов Chlamydia trachomatis из четвертой группы антигенов, и одного, двух, трех, четырех или пяти антигенов Chlamydia trachomatis из пятой группы антигенов, и одного, двух, трех, четырех, пяти, шести, семи, восьми, девяти, десяти, одиннадцати или двенадцати антигенов из шестой группы антигенов.
Еще более предпочтительно комбинация состоит из пяти антигенов Chlamydia trachomatis из первой группы антигенов, и трех, четырех или пяти антигенов Chlamydia trachomatis из третьей группы антигенов, и трех, четырех или пяти антигенов из четвертой группы антигенов, и одного, двух, трех, четырех, пяти или шести антигенов Chlamydia trachomatis из пятой группы антигенов, и одного, двух, трех, четырех, пяти, шести, семи, восьми, девяти, десяти, одиннадцати или двенадцати антигенов из шестой группы антигенов.
Изобретение далее относится к композиции, содержащей комбинацию антигенов Chlamydia trachomatis, причем указанная комбинация выбрана из группы, состоящей из двух, трех, четырех, пяти, шести, семи, восьми, девяти, десяти, одиннадцати, двенадцати или тринадцати антигенов Chlamydia trachomatis из второй группы антигенов, и одного, двух, трех, четырех, пяти или шести антигенов Chlamydia trachomatis из третьей группы антигенов, и одного, двух, трех, четырех, пяти, шести, семи, восьми или девяти антигенов из четвертой группы антигенов. Предпочтительно комбинация выбрана из группы, состоящей из трех, четырех или пяти антигенов Chlamydia trachomatis из второй группы антигенов, и трех, четырех или пяти антигенов Chlamydia trachomatis из третьей группы антигенов, и трех, четырех или пяти антигенов из четвертой группы антигенов. Еще более предпочтительно комбинация состоит из пяти антигенов Chlamydia trachomatis из второй группы антигенов, и трех, четырех или пяти антигенов Chlamydia trachomatis из третьей группы антигенов, и трех, четырех или пяти антигенов из четвертой группы антигенов.
Имеется верхний предел числа антигенов Chlamydia trachomatis, которые содержатся в композиции согласно изобретению. Предпочтительно число антигенов Chlamydia trachomatis в композиции согласно изобретению составляет менее 20, менее 19, менее 18, менее 17, менее 16, менее 15, менее 14, менее 13, менее 12, менее 11, менее 10, менее 9, менее 8, менее 7, менее 6, менее 5, менее 4 или менее 3. Еще более предпочтительно число антигенов Chlamydia trachomatis в композиции согласно изобретению составляет менее 6, менее 5 или менее 4. Антигены Chlamydia trachomatis, применяемые согласно изобретению, предпочтительно выделены, т.е. находятся отдельно и дискретно от целого организма, в котором данная молекула находится в природе, или, когда данный полинуклеотид или полипептид не встречается в природе, он в достаточной степени лишен других биологических макромолекул, так что данный полинуклеотид или полипептид может применяться для своей предназначенной цели.
Предпочтительно композиция по настоящему изобретению содержит комбинацию антигенов Chlamydia trachomatis, где указанная комбинация выбрана из группы, состоящей из: (1) CT016, и CT128, и CT671, и CT262; (2) CT296, и CT372, и CT635, и CT859; (3) CT412, и CT480, и CT869, и CT871; (4) CT050, и CT153, и CT157, и CT165; (5) CT276, и CT296, и CT456, и CT480; (6) CT089, и CT381, и CT396, и CT548; (7) CT635, и CT700, и CT711, и CT859; (8) CT812, и CT869, и CT552, и CT671; (9) CT713, и CT017, и CT043, и CT082; (10) CT266, и CT443, и CT559, и CT597; и (11) CT045, и CT089, и CT396, и CT398, и CT39 (12) CT681, и CT547; (13) CT623, и CT414; или других комбинаций данных антигенов.
Предпочтительно композиция по настоящему изобретению содержит комбинацию антигенов Chlamydia trachomatis, причем указанная комбинация выбрана из группы, состоящей из: (1) CT016, и CT128, и CT671, и CT262; (2) CT296, и CT372, и CT635, и CT859; (3) CT412, и CT480, и CT869, и CT871; (4) CT050, и CT153, и CT157, и CT165; (5) CT276, и CT296, и CT456, и CT480; (6) CT089, и CT381, и CT396, и CT548; (7) CT635, и CT700, и CT711, и CT859; (8) CT812, и CT869, и CT552, и CT671; (9) CT713, и CT017, и CT043, и CT082; (10) CT266, и CT443, и CT559, и CT597; и (11) CT045, и CT089, и CT396, и CT398, и CT39 (12) CT681 и CT547; (13) CT623 и CT414; или других комбинаций данных антигенов; в комбинации с иммунорегуляторным средством, которое выбрано из группы, состоящей из CFA, алюминиевых квасцов, CpG, AlOH, алюминиевых квасцов и CpG, AlOH и CpG, LTK63, и LTK63 и CpG.
Предпочтительно композиция по настоящему изобретению содержит комбинацию антигенов Chlamydia trachomatis, причем указанная комбинация выбрана из группы, состоящей из: 1) CT016, и CT128, и CT671, и CT262; (2) CT296, и CT372, и CT635, и CT859; (3) CT412, и CT480, и CT869, и CT871; (4) CT050, и CT153, и CT157, и CT165; (5) CT276, и CT296, и CT456, и CT480; (6) CT089, и CT381, и CT396, и CT548; (7) CT635, и CT700, и CT711, и CT859; (8) CT812, и CT869, и CT552, и CT671; (9) CT713, и CT017, и CT043, и CT082; (10) CT266, и CT443, и CT559, и CT597; и (11) CT045, и CT089, и CT396, и CT398, и CT39 (12) CT681 и CT547; (13) CT623 и CT414; или других комбинаций данных антигенов; в комбинации с алюминиевыми квасцами и CpG или AlOH и CpG.
Предпочтительно композиция по настоящему изобретению содержит комбинацию антигенов Chlamydia trachomatis, причем указанная комбинация выбрана из группы, состоящей из (1) CT242 и CT316; (2) CT467 и CT444; и (3) CT812 и CT082; или других комбинаций данных антигенов.
Предпочтительно композиция по настоящему изобретению содержит комбинацию антигенов Chlamydia trachomatis, причем указанная комбинация выбрана из группы, состоящей из (1) CT242 и CT316; (2) CT467 и CT444; и (3) CT812 и CT082; или других комбинаций данных антигенов; в комбинации с иммунорегуляторным средством, которое выбрано из группы, состоящей из CFA, алюминиевых квасцов, CpG, AlOH, алюминиевых квасцов и CpG, AlOH и CpG, LTK63, и LTK63 и CpG.
Предпочтительно композиция по настоящему изобретению содержит комбинацию антигенов Chlamydia trachomatis, причем указанная комбинация выбрана из группы, состоящей из (1) CT242 и CT316; (2) CT467 и CT444; и (3) CT812 и CT082; или других комбинаций данных антигенов; в комбинации с алюминиевыми квасцами и CpG или AlOH и CpG.
Иммуногенные композиции по настоящему изобретению могут включать в себя один или несколько антигенов, выбранных из  четвертой группы антигенов четвертой группы антигенов , состоящей из: (1) CT559 (YscJ); (2) CT600 (Pal); (3) CT541 (Mip); (4) CT623 (гомолог CHLPN массой 76 кДа) (5) CT700 (гипотетический белок), (6) CT266 (гипотетический белок); (7) CT077 (гипотетический белок); (8) CT456 (гипотетический белок); (9) CT165 (гипотетический белок) и (10) CT713 (PorB). , состоящей из: (1) CT559 (YscJ); (2) CT600 (Pal); (3) CT541 (Mip); (4) CT623 (гомолог CHLPN массой 76 кДа) (5) CT700 (гипотетический белок), (6) CT266 (гипотетический белок); (7) CT077 (гипотетический белок); (8) CT456 (гипотетический белок); (9) CT165 (гипотетический белок) и (10) CT713 (PorB).
Предпочтительно иммуногенные композиции по настоящему изобретению могут включать в себя один или несколько антигенов, выбранных из  четвертой группы антигенов четвертой группы антигенов , состоящей из: (1) CT559 (YscJ); (2) CT600 (Pal); (3) CT541(Mip); (4) CT623 (гомолог CHLPN массой 76 кДа) (5) CT700 (гипотетический белок). (6) CT266 (гипотетический белок); (7) CT077 (гипотетический белок); (8) CT456 (гипотетический белок); (9) CT165 (гипотетический белок) и (10) CT713 (PorB); или других комбинаций данных антигенов, в комбинации с иммунорегуляторным средством, которое выбрано из группы, состоящей из CFA, алюминиевых квасцов, CpG, AlOH, алюминиевых квасцов и CpG, AlOH и CpG, LTK63, и LTK63 и CpG. , состоящей из: (1) CT559 (YscJ); (2) CT600 (Pal); (3) CT541(Mip); (4) CT623 (гомолог CHLPN массой 76 кДа) (5) CT700 (гипотетический белок). (6) CT266 (гипотетический белок); (7) CT077 (гипотетический белок); (8) CT456 (гипотетический белок); (9) CT165 (гипотетический белок) и (10) CT713 (PorB); или других комбинаций данных антигенов, в комбинации с иммунорегуляторным средством, которое выбрано из группы, состоящей из CFA, алюминиевых квасцов, CpG, AlOH, алюминиевых квасцов и CpG, AlOH и CpG, LTK63, и LTK63 и CpG.
Еще более предпочтительно иммуногенные композиции по настоящему изобретению могут включать в себя один или несколько антигенов, выбранных из  четвертой группы антигенов четвертой группы антигенов , состоящей из: (1) CT559 (YscJ); (2) CT600 (Pal); (3) CT541(Mip); (4) CT623 (гомолог CHLPN массой 76 кДа) (5) CT700 (гипотетический белок). (6) CT266 (гипотетический белок); (7) CT077 (гипотетический белок); (8) CT456 (гипотетический белок); (9) CT165 (гипотетический белок) и (10) CT713 (PorB); или других комбинаций данных антигенов; в комбинации с алюминиевыми квасцами и CpG или AlOH и CpG. , состоящей из: (1) CT559 (YscJ); (2) CT600 (Pal); (3) CT541(Mip); (4) CT623 (гомолог CHLPN массой 76 кДа) (5) CT700 (гипотетический белок). (6) CT266 (гипотетический белок); (7) CT077 (гипотетический белок); (8) CT456 (гипотетический белок); (9) CT165 (гипотетический белок) и (10) CT713 (PorB); или других комбинаций данных антигенов; в комбинации с алюминиевыми квасцами и CpG или AlOH и CpG.
Иммуногенные композиции по настоящему изобретению могут включать в себя один или несколько антигенов, выбранных из  пятой группы антигенов пятой группы антигенов , состоящей из: 1) CT082 (гипотетический); (2) CT181 (гипотетический); (3) CT050 (гипотетический); (4) CT157 (надсемейство фосфолипазы D); и (5) CT128 (аденилатциклаза AdK). , состоящей из: 1) CT082 (гипотетический); (2) CT181 (гипотетический); (3) CT050 (гипотетический); (4) CT157 (надсемейство фосфолипазы D); и (5) CT128 (аденилатциклаза AdK).
Предпочтительно иммуногенные композиции по настоящему изобретению могут включать в себя один или несколько антигенов, выбранных из  пятой группы антигенов пятой группы антигенов , состоящей из: 1) CT082 (гипотетический); (2) CT181 (гипотетический); (3) CT050 (гипотетический); (4) CT157 (надсемейство фосфолипазы D); и (5) CT128 (аденилатциклаза AdK), или других комбинаций данных антигенов; в комбинации с иммунорегуляторным средством, которое выбрано из группы, состоящей из CFA, алюминиевых квасцов, CpG, AlOH, алюминиевых квасцов и CpG, AlOH и CpG, LTK63, и LTK63 и CpG. , состоящей из: 1) CT082 (гипотетический); (2) CT181 (гипотетический); (3) CT050 (гипотетический); (4) CT157 (надсемейство фосфолипазы D); и (5) CT128 (аденилатциклаза AdK), или других комбинаций данных антигенов; в комбинации с иммунорегуляторным средством, которое выбрано из группы, состоящей из CFA, алюминиевых квасцов, CpG, AlOH, алюминиевых квасцов и CpG, AlOH и CpG, LTK63, и LTK63 и CpG.
Еще более предпочтительно иммуногенные композиции по настоящему изобретению могут включать в себя один или несколько антигенов, выбранных из  пятой группы антигенов пятой группы антигенов , состоящей из: 1) CT082 (гипотетический); (2) CT181 (гипотетический); (3) CT050 (гипотетический); (4) CT157 (надсемейство фосфолипазы D); и (5) CT128 (аденилатциклаза AdK), или других комбинаций данных антигенов; в комбинации с алюминиевыми квасцами и CpG или AlOH и CpG. , состоящей из: 1) CT082 (гипотетический); (2) CT181 (гипотетический); (3) CT050 (гипотетический); (4) CT157 (надсемейство фосфолипазы D); и (5) CT128 (аденилатциклаза AdK), или других комбинаций данных антигенов; в комбинации с алюминиевыми квасцами и CpG или AlOH и CpG.
Иммуногенные композиции по настоящему изобретению могут включать в себя один или несколько антигенов, выбранных из  шестой группы антигенов шестой группы антигенов , состоящей из: (1) CT153 (гипотетический); (2) CT262 (гипотетический); (3) CT276 (гипотетический); (4) CT296 (гипотетический); (5) CT372 (гипотетический); (6) CT412 (PmpA); (7) CT480 (олигопептидсвязывающий белок); (8) CT548 (гипотетический); (9) CT043 (гипотетический); (10) CT635 (гипотетический); (11) CT859 (металлопротеаза); (12) CT671 (гипотетический); (13) CT016 (гипотетический); (14) CT017 (гипотетический); (15) CT043 (гипотетический); (16) CT082 (гипотетический); (17) CT548 (гипотетический); (19) CT089 (элемент, отвечающий на низкий уровень кальция); (20) CT812 (PmpD) и (21) CT869 (PmpE); или других комбинаций данных антигенов. , состоящей из: (1) CT153 (гипотетический); (2) CT262 (гипотетический); (3) CT276 (гипотетический); (4) CT296 (гипотетический); (5) CT372 (гипотетический); (6) CT412 (PmpA); (7) CT480 (олигопептидсвязывающий белок); (8) CT548 (гипотетический); (9) CT043 (гипотетический); (10) CT635 (гипотетический); (11) CT859 (металлопротеаза); (12) CT671 (гипотетический); (13) CT016 (гипотетический); (14) CT017 (гипотетический); (15) CT043 (гипотетический); (16) CT082 (гипотетический); (17) CT548 (гипотетический); (19) CT089 (элемент, отвечающий на низкий уровень кальция); (20) CT812 (PmpD) и (21) CT869 (PmpE); или других комбинаций данных антигенов.
Предпочтительно иммуногенные композиции по настоящему изобретению могут включать в себя один или несколько антигенов, выбранных из  шестой группы антигенов шестой группы антигенов , состоящей из: (1) CT153 (гипотетический); (2) CT262 (гипотетический); (3) CT276 (гипотетический); (4) CT296 (гипотетический); (5) CT372 (гипотетический); (6) CT412 (PmpA); (7) CT480 (олигопептидсвязывающий белок); (8) CT548 (гипотетический); (9) CT043 (гипотетический); (10) CT635 (гипотетический); (11) CT859 (металлопротеаза); (12) CT671 (гипотетический); (13) CT016 (гипотетический); (14) CT017 (гипотетический); (15) CT043 (гипотетический); (16) CT082 (гипотетический); (17) CT548 (гипотетический); (19) CT089 (элемент, отвечающий на низкий уровень кальция); (20) CT812 (PmpD) и (21) CT869 (PmpE); или других комбинаций данных антигенов; в комбинации с иммунорегуляторным средством, которое выбрано из группы, состоящей из CFA, алюминиевых квасцов, CpG, AlOH, алюминиевых квасцов и CpG, AlOH и CpG, LTK63, LTK63 и CpG. , состоящей из: (1) CT153 (гипотетический); (2) CT262 (гипотетический); (3) CT276 (гипотетический); (4) CT296 (гипотетический); (5) CT372 (гипотетический); (6) CT412 (PmpA); (7) CT480 (олигопептидсвязывающий белок); (8) CT548 (гипотетический); (9) CT043 (гипотетический); (10) CT635 (гипотетический); (11) CT859 (металлопротеаза); (12) CT671 (гипотетический); (13) CT016 (гипотетический); (14) CT017 (гипотетический); (15) CT043 (гипотетический); (16) CT082 (гипотетический); (17) CT548 (гипотетический); (19) CT089 (элемент, отвечающий на низкий уровень кальция); (20) CT812 (PmpD) и (21) CT869 (PmpE); или других комбинаций данных антигенов; в комбинации с иммунорегуляторным средством, которое выбрано из группы, состоящей из CFA, алюминиевых квасцов, CpG, AlOH, алюминиевых квасцов и CpG, AlOH и CpG, LTK63, LTK63 и CpG.
Еще более предпочтительно иммуногенные композиции по настоящему изобретению могут включать в себя один или несколько антигенов, выбранных из  шестой группы антигенов шестой группы антигенов , состоящей из: (1) CT153 (гипотетический); (2) CT262 (гипотетический); (3) CT276 (гипотетический); (4) CT296 (гипотетический); (5) CT372 (гипотетический); (6) CT412 (PmpA); (7) CT480 (олигопептидсвязывающий белок); (8) CT548 (гипотетический); (9) CT043 (гипотетический); (10) CT635 (гипотетический); (11) CT859 (металлопротеаза); (12) CT671 (гипотетический); (13) CT016 (гипотетический); (14) CT017 (гипотетический); (15) CT043 (гипотетический); (16) CT082 (гипотетический); (17) CT548 (гипотетический); (19) CT089 (элемент, отвечающий на низкий уровень кальция); (20) CT812 (PmpD) и (21) CT869 (PmpE); или других комбинаций данных антигенов; в комбинации с алюминиевыми квасцами и CpG или AlOH и CpG. , состоящей из: (1) CT153 (гипотетический); (2) CT262 (гипотетический); (3) CT276 (гипотетический); (4) CT296 (гипотетический); (5) CT372 (гипотетический); (6) CT412 (PmpA); (7) CT480 (олигопептидсвязывающий белок); (8) CT548 (гипотетический); (9) CT043 (гипотетический); (10) CT635 (гипотетический); (11) CT859 (металлопротеаза); (12) CT671 (гипотетический); (13) CT016 (гипотетический); (14) CT017 (гипотетический); (15) CT043 (гипотетический); (16) CT082 (гипотетический); (17) CT548 (гипотетический); (19) CT089 (элемент, отвечающий на низкий уровень кальция); (20) CT812 (PmpD) и (21) CT869 (PmpE); или других комбинаций данных антигенов; в комбинации с алюминиевыми квасцами и CpG или AlOH и CpG.
FACS-анализы, вестерн-блот-анализы и анализы нейтрализации in vitro, проводимые, как описано в примерах и в WO 03/049762, демонстрируют, что белки первой, второй, третьей, четвертой, пятой и шестой группы антигенов являются экспонированными на поверхность и доступными для иммунной системы белками и представляют собой подходящие иммуногены. Данные свойства не очевидны из одной последовательности. Кроме того, белки, описанные в четвертой, пятой и шестой группах антигенов (а также в первой, второй, третьей и четвертой группах антигенов), которые описаны как  гипотетические гипотетические , обычно не имеют известной клеточной локализации или биологической функции и в основном не имеют какого-либо бактериального гомолога, такого как гомолог Chlamydia pneumoniae. , обычно не имеют известной клеточной локализации или биологической функции и в основном не имеют какого-либо бактериального гомолога, такого как гомолог Chlamydia pneumoniae.
Иммуногенные композиции по настоящему изобретению могут включать в себя один или несколько антигенов, выбранных из  третьей группы антигенов третьей группы антигенов , состоящей из: (1) Pgp3; (2) CT412 (PmpA); (3) CT413 (PmpB); (4) CT414 (PmpC); (5) CT812 (PmpD); (6) CT869 (PmpE); (7) CT870 (PmpF); (8) CT871 (PmpG); (9) CT872 (PmpH); (10) PmpI; (11) CT681 (MOMP); (12) CT529 (Cap1); (13) Hsp-60; и (14) CT443 (OmcB). , состоящей из: (1) Pgp3; (2) CT412 (PmpA); (3) CT413 (PmpB); (4) CT414 (PmpC); (5) CT812 (PmpD); (6) CT869 (PmpE); (7) CT870 (PmpF); (8) CT871 (PmpG); (9) CT872 (PmpH); (10) PmpI; (11) CT681 (MOMP); (12) CT529 (Cap1); (13) Hsp-60; и (14) CT443 (OmcB).
Предпочтительно иммуногенные композиции по настоящему изобретению могут включать в себя один или несколько антигенов, выбранных из  третьей группы антигенов третьей группы антигенов , состоящей из: (1) Pgp3; (2) CT412 (PmpA); (3) CT413(PmpB); (4) CT414 (PmpC); (5) CT812 (PmpD); (6) CT869 (PmpE); (7) CT870 (PmpF); (8) CT871 (PmpG); (9) CT872(PmpH); (10) PmpI; (11) CT681 (MOMP); (12) CT529 (Cap1); (13) Hsp-60; и (14) CT443 (OmcB); в комбинации с иммунорегуляторным средством, которое выбрано из группы, состоящей из CFA, алюминиевых квасцов, CpG, AlOH, алюминиевых квасцов и CpG, AlOH и CpG, LTK63, и LTK63 и CpG. , состоящей из: (1) Pgp3; (2) CT412 (PmpA); (3) CT413(PmpB); (4) CT414 (PmpC); (5) CT812 (PmpD); (6) CT869 (PmpE); (7) CT870 (PmpF); (8) CT871 (PmpG); (9) CT872(PmpH); (10) PmpI; (11) CT681 (MOMP); (12) CT529 (Cap1); (13) Hsp-60; и (14) CT443 (OmcB); в комбинации с иммунорегуляторным средством, которое выбрано из группы, состоящей из CFA, алюминиевых квасцов, CpG, AlOH, алюминиевых квасцов и CpG, AlOH и CpG, LTK63, и LTK63 и CpG.
Еще более предпочтительно иммуногенные композиции по настоящему изобретению могут включать в себя один или несколько антигенов, выбранных из  третьей группы антигенов третьей группы антигенов , состоящей из: (1) Pgp3; (2) CT412 (PmpA); (3) CT413 (PmpB); (4) CT414 (PmpC); (5) CT812 (PmpD); (6) CT869 (PmpE); (7) CT870 (PmpF); (8) CT871 (PmpG); (9) CT872(PmpH); (10) PmpI; (11) CT681(MOMP); (12) CT529 (Cap1); (13) Hsp-60; (14) CT443 (OmcB); в комбинации с алюминиевыми квасцами и CpG или AlOH и CpG. , состоящей из: (1) Pgp3; (2) CT412 (PmpA); (3) CT413 (PmpB); (4) CT414 (PmpC); (5) CT812 (PmpD); (6) CT869 (PmpE); (7) CT870 (PmpF); (8) CT871 (PmpG); (9) CT872(PmpH); (10) PmpI; (11) CT681(MOMP); (12) CT529 (Cap1); (13) Hsp-60; (14) CT443 (OmcB); в комбинации с алюминиевыми квасцами и CpG или AlOH и CpG.
Иммуногенные композиции по настоящему изобретению могут включать в себя антигены Pmp: (2) CT412 (PmpA); (3) CT413 (PmpB); (4) CT414 (PmpC); (5) CT812 (PmpD); (6) CT869 (PmpE); (7) CT870 (PmpF); (8) CT871 (PmpG); (9) CT872(PmpH); и (10) PmpI.
Предпочтительно иммуногенные композиции по настоящему изобретению включают в себя антигены PmP (2) CT412 (PmpA); (3) CT413 (PmpB); (4) CT414 (PmpC); (5) CT812 (PmpD); (6) CT869 (PmpE); (7) CT870 (PmpF); (8) CT871 (PmpG); (9) CT872(PmpH); и (10) PmpI, в комбинации с иммунорегуляторным средством, которое выбрано из группы, состоящей из CFA, алюминиевых квасцов, CpG, AlOH, алюминиевых квасцов и CpG, AlOH и CpG, LTK63, и LTK63 и CpG.
Еще более предпочтительно иммуногенные композиции по настоящему изобретению включают в себя антигены PmP: (2) CT412 (PmpA); (3) CT413 (PmpB); (4) CT414 (PmpC); (5) CT812 (PmpD); (6) CT869 (PmpE); (7) CT870 (PmpF); (8) CT871 (PmpG); (9) CT872 (PmpH); и (10) PmpI; в комбинации с алюминиевыми квасцами и CpG или AlOH и CpG.
Иммуногенные композиции по настоящему изобретению могут включать в себя один или несколько антигенов, выбранных из  первой или второй группы антигенов первой или второй группы антигенов , состоящей из: (1) CT045 (PepA); (2) CT089(LcrE); (3) CT396 (DnaK); (4) CT398 (гипотетический); (5) CT381 (ArtJ); (6) CT242 (OmpH-подобный); (7) CT316 (L7/L12); (8) CT444 (OmcA); (9) CT467 (AtoS); (10) CT547 (гипотетический); (11) CT587 (енолаза); (12) CT823 (HtrA); (13) CT761 (MurG). , состоящей из: (1) CT045 (PepA); (2) CT089(LcrE); (3) CT396 (DnaK); (4) CT398 (гипотетический); (5) CT381 (ArtJ); (6) CT242 (OmpH-подобный); (7) CT316 (L7/L12); (8) CT444 (OmcA); (9) CT467 (AtoS); (10) CT547 (гипотетический); (11) CT587 (енолаза); (12) CT823 (HtrA); (13) CT761 (MurG).
Предпочтительно иммуногенные композиции по настоящему изобретению могут включать в себя один или несколько антигенов, выбранных из  первой или второй группы антигенов первой или второй группы антигенов , состоящей из: (1) CT045 (PepA); (2) CT089(LcrE); (3) CT396 (DnaK); (4) CT398 (гипотетический); (5) CT381 (ArtJ); (6) CT242 (OmpH-подобный); (7) CT316 (L7/L12); (8) CT444 (OmcA); (9) CT467 (AtoS); (10) CT547 (гипотетический); (11) CT587 (енолаза); (12) CT823 (HtrA); (13) CT761 (MurG); в комбинации с иммунорегуляторным средством, которое выбрано из группы, состоящей из CFA, алюминиевых квасцов, CpG, AlOH, алюминиевых квасцов и CpG, AlOH и CpG, LTK63, и LTK63 и CpG. , состоящей из: (1) CT045 (PepA); (2) CT089(LcrE); (3) CT396 (DnaK); (4) CT398 (гипотетический); (5) CT381 (ArtJ); (6) CT242 (OmpH-подобный); (7) CT316 (L7/L12); (8) CT444 (OmcA); (9) CT467 (AtoS); (10) CT547 (гипотетический); (11) CT587 (енолаза); (12) CT823 (HtrA); (13) CT761 (MurG); в комбинации с иммунорегуляторным средством, которое выбрано из группы, состоящей из CFA, алюминиевых квасцов, CpG, AlOH, алюминиевых квасцов и CpG, AlOH и CpG, LTK63, и LTK63 и CpG.
Еще более предпочтительно иммуногенные композиции по настоящему изобретению могут включать в себя один или несколько антигенов, выбранных из  первой или второй группы антигенов первой или второй группы антигенов , состоящей из: (1) CT045 (PepA); (2) CT089(LcrE); (3) CT396 (DnaK); (4) CT398 (гипотетический); (5) CT381 (ArtJ); (6) CT242 (OmpH-подобный); (7) CT316 (L7/L12); (8) CT444 (OmcA); (9) CT467 (AtoS); (10) CT547 (гипотетический); (11) CT587 (енолаза); (12) CT823 (HtrA); (13) CT761 (MurG), в комбинации с алюминиевыми квасцами и CpG или AlOH и CpG. , состоящей из: (1) CT045 (PepA); (2) CT089(LcrE); (3) CT396 (DnaK); (4) CT398 (гипотетический); (5) CT381 (ArtJ); (6) CT242 (OmpH-подобный); (7) CT316 (L7/L12); (8) CT444 (OmcA); (9) CT467 (AtoS); (10) CT547 (гипотетический); (11) CT587 (енолаза); (12) CT823 (HtrA); (13) CT761 (MurG), в комбинации с алюминиевыми квасцами и CpG или AlOH и CpG.
Предпочтительно иммуногенная композиция включает в себя: CT089 и CT381, и CT396 и CT548.
Предпочтительно иммуногенная композиция включает в себя: CT089 и CT381, и CT396 и CT548, в комбинации с иммунорегуляторным средством, которое выбрано из группы, состоящей из CFA, алюминиевых квасцов, CpG, AlOH, алюминиевых квасцов и CpG, AlOH и CpG, LTK63, и LTK63 и CpG.
Предпочтительно иммуногенная композиция включает в себя: CT089 и CT381, и CT396 и CT548, в комбинации с алюминиевыми квасцами и CpG или AlOH и CpG.
Предпочтительно иммуногенная композиция по настоящему изобретению включает в себя: CT045 в комбинации с алюминиевыми квасцами и CpG или AlOH и CpG.
Предпочтительно иммуногенная композиция по настоящему изобретению включает в себя: CT089 в комбинации с алюминиевыми квасцами и CpG или AlOH и CpG.
Предпочтительно иммуногенная композиция по настоящему изобретению включает в себя: CT396 в комбинации с алюминиевыми квасцами и CpG или AlOH и CpG.
Предпочтительно иммуногенная композиция по настоящему изобретению включает в себя: CT398 в комбинации с алюминиевыми квасцами и CpG или AlOH и CpG.
Предпочтительно иммуногенная композиция по настоящему изобретению включает в себя: CT381 в комбинации с алюминиевыми квасцами и CpG или AlOH и CpG.
Предпочтительно иммуногенная композиция по настоящему изобретению включает в себя: CT242 в комбинации с алюминиевыми квасцами и CpG или AlOH и CpG.
Предпочтительно иммуногенная композиция по настоящему изобретению включает в себя: CT316 в комбинации с алюминиевыми квасцами и CpG или AlOH и CpG.
Предпочтительно иммуногенная композиция по настоящему изобретению включает в себя: CT444 в комбинации с алюминиевыми квасцами и CpG или AlOH и CpG.
Предпочтительно иммуногенная композиция по настоящему изобретению включает в себя: CT467 в комбинации с алюминиевыми квасцами и CpG или AlOH и CpG.
Предпочтительно иммуногенная композиция по настоящему изобретению включает в себя: CT587 в комбинации с алюминиевыми квасцами и CpG или AlOH и CpG.
Предпочтительно иммуногенная композиция по настоящему изобретению включает в себя: CT823 в комбинации с алюминиевыми квасцами и CpG или AlOH и CpG.
Предпочтительно иммуногенная композиция по настоящему изобретению включает в себя: CT761 в комбинации с алюминиевыми квасцами и CpG или AlOH и CpG.
Белки слияния
Антигены Chlamydia trachomatis, применяемые согласно изобретению, могут присутствовать в композиции в виде индивидуальных раздельных полипептидов. В основном рекомбинантные белки слияния по настоящему изобретению получают в виде белка слияния с GST и/или белка слияния с His-меткой.
Предпочтительным, однако, является то, что по меньшей мере два (т.е. 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19 или 20) антигена экспрессируются в виде одной полипептидной цепи ( гибридный гибридный полипептид). Гибридные полипептиды имеют два главных преимущества: во-первых, полипептид, который может быть нестабильным или слабо экспрессированным сам по себе, может дополняться путем добавления подходящего гибридного партнера, который преодолевает данную проблему; во-вторых, упрощается коммерческое производство, поскольку требуется использовать только одну экспрессию и очистку для продукции двух полипептидов, которые оба могут быть антигенными. полипептид). Гибридные полипептиды имеют два главных преимущества: во-первых, полипептид, который может быть нестабильным или слабо экспрессированным сам по себе, может дополняться путем добавления подходящего гибридного партнера, который преодолевает данную проблему; во-вторых, упрощается коммерческое производство, поскольку требуется использовать только одну экспрессию и очистку для продукции двух полипептидов, которые оба могут быть антигенными.
Гибридный полипептид может включать в себя две или большее количество полипептидных последовательностей из первой группы антигенов. В соответствии с этим изобретение относится к композиции, содержащей первую аминокислотную последовательность и вторую аминокислотную последовательность, где указанная первая и вторая аминокислотные последовательности выбраны из антигена Chlamydia trachomatis или его фрагмента из первой группы антигенов. Предпочтительно первая и вторая аминокислотные последовательности гибридного полипептида содержат различные эпитопы.
Гибридный полипептид может включать в себя две или большее количество полипептидных последовательностей из второй группы антигенов. В соответствии с этим изобретение относится к композиции, содержащей первую аминокислотную последовательность и вторую аминокислотную последовательность, где указанная первая и вторая аминокислотные последовательности выбраны из антигена Chlamydia trachomatis или его фрагмента из второй группы антигенов. Предпочтительно первая и вторая аминокислотные последовательности гибридного полипептида содержат различные эпитопы.
Гибридный полипептид может включать в себя одну или несколько полипептидных последовательностей из первой группы антигенов и одну или несколько полипептидных последовательностей из второй группы антигенов. В соответствии с этим изобретение относится к композиции, содержащей первую аминокислотную последовательность и вторую аминокислотную последовательность, причем указанная первая аминокислотная последовательность выбрана из антигена Chlamydia trachomatis или его фрагмента из первой группы антигенов, и указанная вторая аминокислотная последовательность выбрана из антигена Chlamydia trachomatis или его фрагмента из второй группы антигенов. Предпочтительно первая и вторая аминокислотные последовательности гибридного полипептида содержат различные эпитопы.
Гибридный полипептид может включать в себя одну или несколько полипептидных последовательностей из первой группы антигенов и одну или несколько полипептидных последовательностей из третьей группы антигенов. В соответствии с этим изобретение относится к композиции, содержащей первую аминокислотную последовательность и вторую аминокислотную последовательность, причем указанная первая аминокислотная последовательность выбрана из антигена Chlamydia trachomatis или его фрагмента из первой группы антигенов, и указанная вторая аминокислотная последовательность выбрана из антигена Chlamydia trachomatis или его фрагмента из третьей группы антигенов. Предпочтительно первая и вторая аминокислотные последовательности гибридного полипептида содержат различные эпитопы.
Гибридный полипептид может включать в себя одну или несколько полипептидных последовательностей из второй группы антигенов и одну или несколько полипептидных последовательностей из третьей группы антигенов. В соответствии с этим изобретение относится к композиции, содержащей первую аминокислотную последовательность и вторую аминокислотную последовательность, причем указанная первая аминокислотная последовательность выбрана из антигена Chlamydia trachomatis или его фрагмента из второй группы антигенов, и указанная вторая аминокислотная последовательность выбрана из антигена Chlamydia trachomatis или его фрагмента из третьей группы антигенов. Предпочтительно первая и вторая аминокислотные последовательности гибридного полипептида содержат различные эпитопы.
Предпочтительными являются гибриды, состоящие из аминокислотных последовательностей из двух, трех, четырех, пяти, шести, семи, восьми, девяти или десяти антигенов Chlamydia trachomatis. В частности, предпочтительными являются гибриды, состоящие из аминокислотных последовательностей из двух, трех, четырех или пяти антигенов Chlamydia trachomatis. Различные гибридные полипептиды могут смешиваться в единичном препарате. В пределах таких комбинаций антиген Chlamydia trachomatis может присутствовать более чем в одном гибридном полипептиде и/или в виде негибридного полипептида. Однако является предпочтительным, чтобы антиген присутствовал в гибридном или негибридном виде, но не в обоих.
Двухантигенные гибриды для применения согласно изобретению могут включать в себя: (1) PepA & LcrE; (2) PepA & OmpH-подобный; (3) PepA & L7/L12; (4) PepA & ArtJ; (5) PepA & DnaK; (6) PepA & CT398; (7) PepA & OmcA; (8) PepA & AtoS; (9) PepA & CT547; (10) PepA & Eno; (11) PepA & HrtA; (12) PepA & MurG; (13) LcrE & OmpH-подобный; (14) LcrE & L7/L12; (15) LcrE & ArtJ; (16) LcrE & DnaK; (17) LcrE & CT398; (18) LcrE & OmcA; (19) LcrE & AtoS; (20) LcrE & CT547; (21) LcrE & Eno; (22) LcrE & HrtA; (23) LcrE & MurG; (24) OmpH-подобный & L7/L12; (25) OmpH-подобный & ArtJ; (26) OmpH-подобный & DnaK; (27) OmpH-подобный & CT398; (28) OmpH-подобный & OmcA; (29) OmpH-подобный & AtoS; (30) OmpH-подобный & CT547; (31) OmpH-подобный & Eno; (32) OmpH-подобный & HrtA; (33) OmpH-подобный & MurG; (34) L7/L12 & ArtJ; (35) L7/L12 & DnaK; (36) L7/L12 & CT398; (37)L7/L12 & OmcA; (38) L7/L12 & AtoS; (39)L7/L12 & CT547; (40)L7/L12 & Eno; (41) L7/L12 & HrtA; (42)L7/L12 & MurG; (43) ArtJ & DnaK; (44) ArtJ & CT398; (45) ArtJ & OmcA; (46) ArtJ & AtoS; (47) ArtJ & CT547; (48) ArtJ & Eno; (49) ArtJ & HrtA; (50) ArtJ & MurG; (51) DnaK & CT398; (52) DnaK & OmcA; (53) DnaK & AtoS; (54) DnaK & CT547; (55) DnaK & Eno; (56) DnaK & HrtA; (57) DnaK & MurG; (58) CT398 & OmcA; (59) CT398 & AtoS; (60) CT398 & CT547; (61) CT398 & Eno; (62) CT398 & HrtA; (63) CT398 & MurG; (64) OmcA & AtoS; (65) OmcA & CT547; (66) OmcA & Eno; (67) OmcA & HrtA; (68) OmcA & MurG; (69) AtoS & CT547; (70) AtoS & Eno; (71) AtoS & HrtA; (72) AtoS & MurG; (73) CT547 & Eno; (74) CT547 & HrtA; (75) CT547 & MurG; (76) Eno & HrtA; (77) Eno & MurG; (78) HrtA & MurG или (79) PmpD (CT812) и гипотетический (CT082).
Двухантигенные гибриды для применения по настоящему изобретению могут также включать в себя комбинации антигенов, выбранных из третьей, четвертой, пятой и шестой групп антигенов.
Гибридные полипептиды могут быть представлены формулой NH2-A-{-X-L-}n-B-COOH, в которой: X представляет собой аминокислотную последовательность антигена Chlamydia trachomatis или его фрагмента из первой группы антигенов, второй группы антигенов или третьей группы антигенов; L представляет собой необязательную линкерную аминокислотную последовательность; A представляет собой необязательную N-концевую аминокислотную последовательность; B представляет собой необязательную C-концевую аминокислотную последовательность; и n представляет собой 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14 или 15.
Если радикал -X- имеет лидерную пептидную последовательность в своей форме дикого типа, она может быть включена в гибридный белок или пропущена. В некоторых вариантах осуществления лидерные пептиды удаляют за исключением того радикала -X-, который расположен на N-конце гибридного белка, т.е. лидерный пептид X1 будет сохранен, а лидерные пептиды X2...Xn будут пропущены. Это эквивалентно удалению всех лидерных пептидов и применению лидерного пептида X1 в качестве группы -A-.
Для каждого из n вариантов {-X-L-} линкерная аминокислотная последовательность -L- может присутствовать или отсутствовать. Например, когда n=2, гибрид может представлять собой NH2-X1-L1-X2-L2-COOH, NH2-X1-X2-COOH, NH2-X1-L1-X2-COOH, NH2-X1-X2-L2-COOH, и т.д. Линкерная(-ые) аминокислотная(-ые) последовательность(-и) -L- обычно являются короткими (например, 20 или менее аминокислот, т.е. 19, 18, 17, 16, 15, 14, 13, 12, 11, 10, 9, 8, 7, 6, 5, 4, 3, 2, 1). Примеры включают в себя короткие пептидные последовательности, которые облегчают клонирование, полиглициновые линкеры (т.е. содержащие Glyn, где n=2, 3, 4, 5, 6, 7, 8, 9, 10 или более), и гистидиновые метки (т.е. Hisn, где n=3, 4, 5, 6, 7, 8, 9, 10 или более). Другие подходящие линкерные аминокислотные последовательности известны специалистам в данной области. Подходящий линкер представляет GSGGGG (SEQ ID: 1), с дипептидом Gly-Ser, образованным сайтом рестрикции BamHI, который способствует клонированию и манипуляциям, и тетрапептидом (Gly)4, который представляет собой обычный полиглициновый линкер.
-A- представляет собой необязательную N-концевую аминокислотную последовательность. Она обычно короткая (например, 40 или менее аминокислот, т.е. 39, 38, 37, 36, 35, 34, 33, 32, 31, 30, 29, 28, 27, 26, 25, 24, 23, 22, 21, 20, 19, 18, 17, 16, 15, 14, 13, 12, 11, 10, 9, 8, 7, 6, 5, 4, 3, 2, 1). Примеры включают в себя лидерные последовательности для непосредственного перемещения белков или короткие пептидные последовательности, которые облегчают клонирование или очистку (например, гистидиновая метка, т.е. Hisn, где n=3, 4, 5, 6, 7, 8, 9, 10 или более). Другие подходящие N-концевые аминокислотные последовательности известны специалистам в данной области. Если X1 не имеет своего собственного N-концевого метионина, -A- предпочтительно представляет собой олигопептид (например, с 1, 2, 3, 4, 5, 6, 7 или 8 аминокислотами), которые предоставляет N-концевой метионин.
-B- представляет собой необязательную C-концевую аминокислотную последовательность. Она обычно короткая (например, 40 или менее аминокислот, т.е. 39, 38, 37, 36, 35, 34, 33, 32, 31, 30, 29, 28, 27, 26, 25, 24, 23, 22, 21, 20, 19, 18, 17, 16, 15, 14, 13, 12, 11, 10, 9, 8, 7, 6, 5, 4, 3, 2, 1). Примеры включают в себя последовательности для непосредственного перемещения белков, короткие пептидные последовательности, которые облегчают клонирование или очистку (например, гистидиновая метка, т.е. Hisn, где n=3, 4, 5, 6, 7, 8, 9, 10 или более), или последовательности, которые усиливают стабильность белков. Другие подходящие C-концевые аминокислотные последовательности известны специалистам в данной области. Наиболее предпочтительно n представляет собой 2 или 3.
Изобретение также относится к нуклеиновой кислоте, кодирующей гибридные полипептиды согласно изобретению. Более того, изобретение относится к нуклеиновой кислоте, которая может гибридизоваться с данной нуклеиновой кислотой, предпочтительно в условиях  высокой жесткости высокой жесткости (например, 65 (например, 65 C в растворе 0,1× SSC, 0,5% SDS). Полипептиды согласно изобретению могут быть получены различными средствами (например, рекомбинантная экспрессия, очистка из клеточной культуры, химический синтез, и т.д.) и в различных формах (например, нативные, белки слияния, негликозилированные, липоилированные, и т.д.). Их предпочтительно получают, по существу, в чистом виде (т.е. по существу, лишенными других белков хламидий или клеток хозяина). C в растворе 0,1× SSC, 0,5% SDS). Полипептиды согласно изобретению могут быть получены различными средствами (например, рекомбинантная экспрессия, очистка из клеточной культуры, химический синтез, и т.д.) и в различных формах (например, нативные, белки слияния, негликозилированные, липоилированные, и т.д.). Их предпочтительно получают, по существу, в чистом виде (т.е. по существу, лишенными других белков хламидий или клеток хозяина).
Нуклеиновые кислоты согласно изобретению могут быть получены многими способами (например, путем химического синтеза, из геномных библиотек или библиотек кДНК, из самого организма, и т.д.) и могут принимать различные формы (например, одноцепочечные, двухцепочечные, векторы, зонды, и т.д.). Их предпочтительно получают, по существу, в чистом виде (т.е. по существу, лишенными других нуклеиновых кислот хламидий или клеток хозяина).
Термин  нуклеиновая кислота нуклеиновая кислота включает в себя ДНК и РНК, и также их аналоги, такие как аналоги, содержащие модифицированные остовы (например, фосфоротиоаты, и т.д.), и также пептидные нуклеиновые кислоты (ПНК), и т.д. Изобретение включает в себя нуклеиновую кислоту, включающую в себя последовательности, комплементарные описанным выше (например, для целей антисмысловой нуклеиновой кислоты или зонда). включает в себя ДНК и РНК, и также их аналоги, такие как аналоги, содержащие модифицированные остовы (например, фосфоротиоаты, и т.д.), и также пептидные нуклеиновые кислоты (ПНК), и т.д. Изобретение включает в себя нуклеиновую кислоту, включающую в себя последовательности, комплементарные описанным выше (например, для целей антисмысловой нуклеиновой кислоты или зонда).
Изобретение также относится к способу продукции полипептида согласно изобретению, включающему в себя стадию культивирования клетки хозяина, трансформированной нуклеиновой кислотой согласно изобретению в условиях, которые индуцируют экспрессию полипептида.
Изобретение относится к способу продукции полипептида согласно изобретению, включающему в себя стадию синтеза по меньшей мере части полипептида химическими средствами.
Изобретение относится к способу продукции нуклеиновой кислоты согласно изобретению, включающему в себя стадию амплификации нуклеиновой кислоты с использованием способа основанной на праймерах амплификации (например, ПЦР).
Изобретение относится к способу продукции нуклеиновой кислоты согласно изобретению, включающему в себя стадию синтеза по меньшей мере части нуклеиновой кислоты химическими средствами.
Штаммы
Предпочтительные полипептиды согласно изобретению содержат аминокислотную последовательность, находящуюся в C. trachomatis серовара D, или в одном или нескольких эпидемиологически преобладающих серотипах.
При использовании гибридных полипептидов индивидуальные антигены в пределах гибрида (т.е. индивидуальные радикалы -X-) могут происходить из одного или нескольких штаммов. Когда n=2, например, X2 может происходить из того же штамма, что X1 или из другого штамма. Когда n=3, штаммы могут представлять собой (i) X1=X2=X3 (ii) X1=X2 X3 (iii) X1 X3 (iii) X1 X2=X3 (iv) X1 X2=X3 (iv) X1 X2 X2 X3 или (v) X1=X3 X3 или (v) X1=X3 X2, и т.д. X2, и т.д.
Гетерологичный хозяин
Хотя экспрессия полипептидов согласно изобретению может иметь место в Chlamydia, изобретение предпочтительно относится к гетерологичному хозяину. Гетерологичный хозяин может быть прокариотическим (например, бактериальным) или эукариотическим. Предпочтительно он представляет собой E.coli, но другие подходящие хозяева включают в себя Bacillus subtilis, Vibrio cholerae, Salmonella typhi, Salmonella typhimurium, Neisseria lactamica, Neisseria cinerea, Mycobacteria (например, M. tuberculosis), дрожжи, и т.д.
Иммуногенные композиции и медикаменты
Композиции согласно изобретению предпочтительно представляют собой иммуногенные композиции и более предпочтительно представляют собой вакцинные композиции. pH композиции предпочтительно составляет от 6 до 8, предпочтительно около 7. pH может поддерживаться путем использования буфера. Композиция может быть стерильной и/или лишенной пирогенов. Композиции могут быть изотоническими в отношении организма людей.
Вакцины согласно изобретению могут быть профилактическими (т.е. для предотвращения инфекции) или терапевтическими (т.е. для лечения инфекции), но обычно они являются профилактическими. В соответствии с этим изобретение относится к способу терапевтического или профилактического лечения инфекции Chlamydia trachomatis у животного, чувствительного к хламидийной инфекции, включающему в себя введение указанному животному терапевтического или профилактического количества иммуногенных композиций согласно изобретению. Предпочтительно иммуногенная композиция включает в себя комбинацию антигенов Chlamydia trachomatis, причем указанная композиция выбрана из группы, состоящей двух, трех, четырех или всех пяти антигенов Chlamydia trachomatis из первой группы антигенов. Еще более предпочтительно комбинация состоит из всех пяти антигенов Chlamydia trachomatis первой группы антигенов.
Альтернативно иммуногенная композиция включает в себя комбинацию антигенов Chlamydia trachomatis, причем указанная комбинация выбрана из группы, состоящей из двух, трех, четырех, пяти, шести, семи, восьми, девяти, десяти, одиннадцати, двенадцати или тринадцати антигенов Chlamydia trachomatis из второй группы антигенов. Предпочтительно комбинация выбрана из группы, состоящей из двух, трех, четырех или пяти антигенов Chlamydia trachomatis из второй группы антигенов. Еще более предпочтительно комбинация состоит из пяти антигенов Chlamydia trachomatis из второй группы антигенов.
Альтернативно иммуногенная композиция включает в себя комбинацию антигенов Chlamydia trachomatis, причем указанная комбинация выбрана из группы, состоящей из двух, трех, четырех или пяти антигенов Chlamydia trachomatis из первой группы антигенов, и одного, двух, трех, четырех, пяти или шести антигенов Chlamydia trachomatis из третьей группы антигенов. Предпочтительно комбинация выбрана из группы, состоящей из трех, четырех или пяти антигенов Chlamydia trachomatis из первой группы антигенов и одного, двух, трех, четырех, пяти или шести антигенов Chlamydia trachomatis из третьей группы антигенов.
Альтернативно иммуногенная композиция включает в себя комбинацию антигенов Chlamydia trachomatis, причем указанная комбинация выбрана из группы, состоящей из двух, трех, четырех, пяти, шести, семи, восьми, девяти, десяти, одиннадцати, двенадцати или тринадцати антигенов Chlamydia trachomatis из второй группы антигенов и одного, двух, трех, четырех, пяти или шести антигенов Chlamydia trachomatis из третьей группы антигенов. Предпочтительно комбинация выбрана из группы, состоящей из трех, четырех или пяти антигенов Chlamydia trachomatis из второй группы антигенов и трех, четырех или пяти антигенов Chlamydia trachomatis из третьей группы антигенов. Еще более предпочтительно комбинация состоит из пяти антигенов Chlamydia trachomatis из второй группы антигенов, и трех, четырех или пяти антигенов Chlamydia trachomatis из третьей группы антигенов.
Альтернативно иммуногенная композиция включает в себя комбинацию антигенов Chlamydia trachomatis, причем указанная комбинация выбрана из группы, состоящей из двух, трех, четырех, пяти, шести, семи, восьми, девяти или десяти антигенов Chlamydia trachomatis из четвертой группы антигенов, и одного, двух, трех, четырех или пяти антигенов Chlamydia trachomatis из пятой группы антигенов, и одного, двух, трех, четырех, пяти, шести, семи, восьми, девяти, десяти, одиннадцати, двенадцати, тринадцати, четырнадцати, пятнадцати, шестнадцати, семнадцати, восемнадцати, девятнадцати, двадцати или двадцати одного антигена из шестой группы антигенов. Предпочтительно комбинация выбрана из группы, состоящей из трех, четырех или пяти антигенов Chlamydia trachomatis из четвертой группы антигенов и трех, четырех или пяти антигенов Chlamydia trachomatis из пятой группы антигенов. Еще более предпочтительно комбинация состоит из пяти антигенов Chlamydia trachomatis из четвертой группы антигенов и трех, четырех или пяти антигенов Chlamydia trachomatis из пятой группы антигенов.
Изобретение также относится к иммуногенной композиции, содержащей один или несколько иммунорегуляторных средств. Предпочтительно одно или несколько иммунорегуляторных средств включают в себя адъювант. Адъювант может быть выбран из одного или нескольких представителей группы, состоящей из адъюванта TH1 и адъюванта TH2, далее обсуждаемых ниже. Адъювант может быть выбран из группы, состоящей из минеральной соли, такой как соль алюминия, и олигонуклеотида, состоящего из CpG-мотива. Наиболее предпочтительно иммуногенная композиция включает в себя алюминиевую соль и олигонуклеотид, содержащий CpG-мотив. Альтернативно, иммуногенная композиция включает в себя ADP-рибозилирующий токсин, например, детоксифицированный ADP-рибозилирующий токсин и олигонуклеотид, содержащий CpG-мотив.
Композиции согласно изобретению могут предпочтительно вызывать клеточно-опосредованный иммунный ответ, а также гуморальный иммунный ответ для эффективного воздействия на внутриклеточную инфекцию Chlamydia. Данный иммунный ответ предпочтительно индуцирует антитела длительного действия (например, нейтрализующие) и клеточно-опосредованный иммунитет, которые могут обеспечивать быстрый ответ на воздействие Chlamydia.
Два типа T-клеток, CD4 и CD8 клетки, как в основном полагают, являются необходимыми для инициации и/или усиления клеточно-опосредованного иммунитета и гуморального иммунитета. CD8 T-клетки могут экспрессировать корецептор CD8 и обычно обозначаются как цитотоксические Т-лимфоциты (CTL). CD8 T-клетки способны распознавать или взаимодействовать с антигенами, представляемыми на молекулах MHC класса I.
CD4 T-клетки могут экспрессировать корецептор CD4 и обычно обозначаются как T-хелперные клетки. CD4 T-клетки способны распознавать антигенные пептиды, связанные с молекулами MHC класса II. После взаимодействия с молекулой MHC класса II CD4 клетки могут секретировать факторы, такие как цитокины. Данные секретируемые цитокины могут активировать B-клетки, цитотоксичные T-клетки, макрофаги и другие клетки, которые участвуют в иммунном ответе. Хелперные Т-клетки или CD4+ клетки могут далее подразделяться на два функционально различных подмножества: TH1-фенотип и TH2-фенотипы, которые отличаются по их цитокиновой и эффекторной функции.
Активированные TH1 клетки усиливают клеточный иммунитет (включая повышение антигенспецифичной продукции CTL) и поэтому особенно значимы при ответе на внутриклеточные инфекции. Активированные TH1 клетки могут секретировать один или несколько цитокинов из IL-2, IFN-гамма, и TNF-бета. Иммунный ответ TH1 может приводить к местным воспалительным реакциям путем активации макрофагов, NK-клеток (естественных киллеров) и CD8 цитотоксических T-клеток (CTL). Иммунный ответ TH1 может также действовать, распространяя иммунный ответ путем стимуляции роста B- и T-клеток за счет IL-12. TH1-стимулированные B-клетки могут секретировать IgG2a.
Активированные TH2-клетки усиливают продукцию антител и поэтому значимы при ответе на внеклеточные инфекции. Активированные TH2-клетки могут секретировать один или несколько цитокинов из IL-4, IL-5, IL-6, и IL-10. Иммунный ответ TH2 может приводить к продукции IgG1, IgE, IgA и B-клеток памяти для дальнейшей защиты.
Усиленный иммунный ответ может включать в себя один или несколько вариантов из иммунного ответа TH1 и иммунного ответа TH2.
Усиленный иммунный ответ TH1 может включать один или несколько вариантов из повышения уровня CTL, повышения уровня одного или нескольких цитокинов, ассоциированных с иммунным ответом TH1 (например, IL-2, IFN-гамма, и TNF-бета), повышения уровня активированных макрофагов, повышения активности NK или повышения продукции IgG2a. Предпочтительно повышенный иммунный ответ TH1 включает в себя повышение продукции IgG2a.
Иммунный ответ TH1 может быть вызван применением TH1-адъюванта. TH1-адъювант может в общем вызывать повышенные уровни продукции IgG2a по сравнению с иммунизацией антигеном без адъюванта. TH1-адъювант, подходящий для применения согласно изобретению, может включать в себя препараты сапонинов, виросомы и вирусоподобные частицы, нетоксичные производные энтеробактериального липополисахарида (LPS), иммуностимуляторных олигонуклеотидов. Иммуностимуляторные олигонуклеотиды, например олигонуклеотиды, содержащие CpG-мотив, являются предпочтительными TH1-адъювантами для применения согласно изобретению.
Усиленный иммунный ответ TH2 может включать в себя один или несколько вариантов повышения уровня одного или нескольких цитокинов, ассоциированных с иммунным ответом TH2 (например, IL-4, IL-5, IL-6 и IL-10), или повышения продукции IgG1, IgE, IgA и В-клеток памяти. Предпочтительно усиленный иммунный ответ TH2 включает в себя повышение продукции IgG1.
Иммунный ответ TH2 может вызываться с использованием адъюванта TH2. TH2-адъювант, в общем, вызывает повышенные уровни продукции IgG1 по отношению к иммунизации антигеном без адъюванта. TH2-адъюванты, подходящие для применения согласно изобретению, включают в себя, например, композиции, содержащие минералы, масляные эмульсии, и ADP-рибозилирующие токсины и их детоксифицирующие производные. Содержащие минералы композиции, например алюминиевые соли, предпочтительно представляют собой TH2-адъюванты для применения согласно изобретению.
Предпочтительно изобретение относится к композиции, содержащей комбинацию TH1-адъюванта и TH2-адъюванта. Предпочтительно такая композиция вызывает усиленный TH1- и усиленный TH2-ответ, т.е. повышение продукции IgG1 и IgG2a относительно иммунизации без адъюванта. Еще более предпочтительно композиция, содержащая комбинацию TH1- и TH2-адъювантов, вызывает повышенный TH1- и/или повышенный TH2-иммунный ответ относительно иммунизации одним адъювантом (т.е. относительно иммунизации одним TH1-адъювантом или иммунизацией одним TH2-адъювантом).
Как обсуждается далее в примерах, применение комбинации минеральной соли, такой как соль алюминия, и олигонуклеотида, содержащего CpG-мотив, предоставляет усиленный иммунный ответ. Данный усиленный иммунный ответ является полностью непредсказуемым и не может быть спрогнозирован на основе отдельного применения одного из данных средств. Поэтому изобретение относится к олигонуклеотиду, содержащему CpG-мотив, минеральной соли, такой как соль алюминия, и к антигену, ассоциированному с заболеванием, переносимым половым путем, например к антигену Chlamydia trachomatis. Дальнейшие примеры антигенов, ассоциированных с заболеванием, переносимым половым путем, далее обсуждаются ниже.
Изобретение также относится к композиции согласно изобретению для применения в качестве лекарственного средства. Данное лекарственное средство предпочтительно способно вызывать иммунный ответ у млекопитающего (т.е. оно представляет собой иммуногенную композицию) и более предпочтительно является вакциной. Изобретение также относится к применению композиций согласно изобретению в производстве лекарственного средства для индукции у млекопитающего иммунного ответа. Предпочтительно лекарственное средство представляет собой вакцину.
Иммунный ответ может представлять собой иммунный ответ TH1 и иммунный ответ TH2. Предпочтительно иммунный ответ предоставляет один вариант или оба варианта из усиленного ответа TH1 и усиленного ответа TH2.
Усиленный иммунный ответ может представлять собой системный иммунный ответ или иммунный ответ в слизистых оболочках или оба данных варианта. Предпочтительно иммунный ответ предоставляет усиленный системный иммунный ответ или усиленный иммунный ответ в слизистых оболочках или оба данных варианта. Предпочтительно иммунный ответ в слизистых оболочках представляет собой иммунный ответ в TH2. Предпочтительно иммунный ответ в слизистых оболочках включает в себя повышение продукции IgA.
Изобретение также относится к набору, включающему в себя первый компонент, содержащий комбинацию антигенов Chlamydia trachomatis. Комбинация антигенов Chlamydia trachomatis может быть одной или несколькими иммуногенными композициями согласно изобретению. Набор может далее включать в себя второй компонент, содержащий один или несколько из следующих компонентов: инструкции, шприц или другое устройство доставки, адъювант, или фармацевтически приемлемый раствор для получения препарата.
Изобретение также относится к устройству доставки, предварительно заполненному иммуногенными композициями согласно изобретению.
Изобретение также относится к способу индукции иммунного ответа у млекопитающего, включающему в себя стадии введения эффективного количества композиции согласно изобретению. Иммунный ответ предпочтительно является протективным и предпочтительно включает в себя антитела и/или клеточно-опосредованный иммунитет. Предпочтительно иммунный ответ включает иммунный ответ TH1 и иммунный ответ TH2 или оба варианта. Способ может вызывать стимулирующий ответ.
Млекопитающее предпочтительно представляет собой человека. Когда вакцина предназначена для профилактического применения, человек предпочтительно является ребенком (например, ребенком, начинающим ходить, или ребенком до 7 лет) или тинэйджером; когда вакцина предназначена для лечебного применения, человек предпочтительно является тинэйджером или взрослым. Вакцина, предназначенная для детей, может также вводиться взрослым, например, для оценки безопасности, дозировки, иммуногенности и т.д.
Один из путей проверки эффективности терапевтического лечения использует мониторинг инфекции C. trachomatis после введения композиций согласно изобретению. Один из путей проверки эффективности профилактического лечения использует мониторинг иммунных реакций системно (например, мониторинг уровня продукции IgG1 и IgG2a) или в слизистых оболочках (например, мониторинг уровня продукции IgA) против антигенов Chlamydia trachomatis в композициях согласно изобретению после введения композиции. Обычно реакции сывороточных антител, специфичных в отношении хламидии, определяют после первой иммунизации, но перед второй иммунизацией, в то время как реакции антител, специфичных в отношении хламидии, в слизистых оболочках определяют после первой и второй иммунизаций.
Данные варианты применения и способы предпочтительны для профилактики и/или лечения заболевания, вызванного хламидией (например, трахомы, воспалительного заболевания органов таза, эпидидимита, детской пневмонии, и т.д.). Композиции могут также быть эффективными против C. pneumoniae.
Вакцинные композиции по настоящему изобретению могут оцениваться in vitro и на экспериментальных животных in vivo перед введением хозяину, например человеку. Например, нейтрализация in vitro по Peterson et al (1988) подходит для тестирования вакцинных композиций, направленных против Chlamydia trachomatis.
Одним из примеров такого теста in vitro описан следующим образом. Гипериммунную антисыворотку разбавляют в PBS, содержащем 5% сыворотки морской свинки, в качестве дополняющего источника. Chlamydia trachomatis (104 IFU; единиц, образующих включения) добавляют к разведениям антисыворотки. Смеси антиген-антитело инкубируют при 37°C в течение 45 минут и инокулируют в дубликаты сомкнутых монослоев клеток Hep-2 или HeLa, содержащихся в стеклянных пузырьках (например, 15 на 45 мм), которые перед инокуляцией дважды промывают PBS. Клетки монослоя инфицируют центрифугированием при 1000×g в течение 1 часа с последующей стационарной инкубацией при 37°C в течение 1 часа. Инфицированные монослои инкубируют в течение 48 или 72 часов, фиксируют и окрашивают антителом, специфичным в отношении хламидии, например, анти-MOMP. Несущие включения клетки подсчитывают в десяти полях при увеличении 200×. Титром нейтрализации считали разведение, которое дает 50% ингибирования по сравнению с контрольными монослоями/IFU.
Эффективность вакцинных композиций могут также определяться in vivo путем стимуляции экспериментальных животных, инфицированных Chlamydia trachomatis, например морских свинок или мышей, вакцинными композициями. Например, могут проводиться исследования стимуляции вакцинной композицией in vivo на экспериментальных морских свинках, инфицированных Chlamydia trachomatis. Описание одного из примеров подхода данного типа последует далее. Самок морских свинок массой 450-500 г держали в помещении с контролируемыми условиями при 12-часовом цикле свет-темнота и иммунизировали вакцинными композициями различными путями иммунизации. После вакцинирования морских свинок инфицировали в половые пути агентом бленнореи морских свиной с включениями (GPIC), который выращивали в клетках HeLa или McCoy (Rank et al.(1988)). Каждое животное получает примерно 1,4×107 единиц, образующих включения (IFU), содержащихся в 0,05 мл сахарозно-фосфатно-глутаматного буфера, pH 7,4 (Schacter, 1980). Мониторинг хода инфекции вели путем определения процентной доли несущих включения клеток путем непрямой иммунофлуоресценции с специфичными в отношении GPIC антисыворотками или путем окрашивания по Гимзе мазка, взятого из половых путей (Rank et al 1988). Титры антител в сыворотке определяли путем сорбционного иммуноферментного анализа.
Альтернативно исследования стимуляции вакцинными композициями in vivo могут проводиться на мышиных моделях Chlamydia trachomatis (Morrison et al, 1995). Описание одного из примеров подхода данного типа последует далее. Самки мышей возрастом с 7 по 12 неделю получали 2,5 мг депопровера (depoprovera) подкожно за 10 и 3 суток до вагинального инфицирования. После вакцинации мышей инфицировали в половые пути 1500 образующими включения единицами Chlamydia trachomatis, содержащимися в 5 мл сахарозно-фосфатно-глутаматного буфера, pH 7,4. Мониторинг хода инфекции вели путем определения процентной доли несущих включения клеток путем непрямой иммунофлуоресценции с специфичными в отношении Chlamydia trachomatis антисыворотками или путем окрашивания по Гимзе мазка, взятого из половых путей инфицированной мыши. Присутствие титров антитела в сыворотке мыши определяли путем сорбционного иммуноферментного анализа.
Композиции согласно изобретению в основном вводят непосредственно пациенту. Прямая доставка может осуществляться парентеральной инъекцией (например, подкожно, внутрибрюшинно, внутривенно, внутримышечно или в интерстициальное пространство ткани), или в слизистые оболочки, например путем ректального, перорального (например, таблетки, спрей), вагинального, местного, трансдермального (см., например, WO99/27961) или чрескожного (см., например, WO02/074244 и WO02/064162), внутриносового (см., например, WO03/028760), глазного, ушного, легочного введения или путем другого введения через слизистые оболочки.
Изобретение может относиться к индукции системного иммунитета и/или иммунитета в слизистых оболочках, предпочтительно к индукции усиленного системного иммунитета и/или усиленного иммунитета в слизистых оболочках.
Предпочтительно усиленный системный иммунитет и/или иммунитет в слизистых оболочках отражается в усиленном иммунном ответе TH1 и/или TH2. Предпочтительно усиленный иммунный ответ включает в себя повышение продукции IgG1 и/или IgG2a, и/или IgA.
Обработка дозировками может осуществляться по схеме одной дозы или по схеме множественных доз. Множественные дозы могут использоваться в схеме первой иммунизации и/или в схеме второй иммунизации. По схеме множественных доз различные дозы могут вводиться одним или различными путями, например первая иммунизация парентерально и вторая иммунизация в слизистую оболочку, первая иммунизация в слизистую оболочку и вторая иммунизация парентерально, и т.д.
Хламидийные инфекции влияют на различные области организма, и, таким образом, композиции согласно изобретению могут быть получены в различных формах. Например, композиции могут быть получены в виде форм для инъекций, в виде жидких растворов или суспензий. Также могут быть получены твердые формы, подходящие для растворения или суспендирования в жидких носителях перед инъекцией (например, лиофилизированная композиция или высушенная вымораживанием-распылением композиция). Композиция может быть получена для местного введения, например, в виде мази, крема или порошка. Композиция может быть получена для перорального введения, например, в виде таблетки или капсулы, в виде спрея или в виде сиропа (необязательно, ароматизированного). Композиция может быть получена для легочного введения, например, в виде ингалятора, с использованием тонкого порошка или спрея. Композиция может быть получена в виде суппозитория или пессария. Композиция может быть получена для назального, ушного или глазного введения, например, в виде капель. Композиция может быть в виде набора, сконструированного так, что комбинированную композицию восстанавливают непосредственно перед введением пациенту. Такие наборы могут включать в себя один или несколько антигенов в жидкой форме и один или несколько лиофилизированных антигенов.
Иммуногенные композиции, применяемые в качестве вакцин, включают в себя иммунологически эффективное количество антигена(-ов), а также любые другие компоненты, которые требуются. Под  иммунологически эффективным количеством иммунологически эффективным количеством подразумевают, что введение такого количества субъекту, в единичной дозе или как часть серии, эффективно для лечения или профилактики. Данное количество меняется в зависимости от здоровья и физических условий подлежащего лечению субъекта, возраста, таксономической группы подлежащего лечению субъекта (например, не относящегося к человеку примата, примата, и т.д.), способности иммунной системы субъекта синтезировать антитела, степени требуемой защиты, препарата вакцины, назначения лечащего врача в конкретной медицинской ситуации и других имеющих отношения к делу факторов. Ожидается, что данное количество будет падать в относительно широком интервале, который может определяться путем рутинных испытаний. подразумевают, что введение такого количества субъекту, в единичной дозе или как часть серии, эффективно для лечения или профилактики. Данное количество меняется в зависимости от здоровья и физических условий подлежащего лечению субъекта, возраста, таксономической группы подлежащего лечению субъекта (например, не относящегося к человеку примата, примата, и т.д.), способности иммунной системы субъекта синтезировать антитела, степени требуемой защиты, препарата вакцины, назначения лечащего врача в конкретной медицинской ситуации и других имеющих отношения к делу факторов. Ожидается, что данное количество будет падать в относительно широком интервале, который может определяться путем рутинных испытаний.
Дальнейшие компоненты композиции
Композиция согласно изобретению обычно, в дополнение к указанным выше компонентам, содержит один или несколько  фармацевтически приемлемых носителей фармацевтически приемлемых носителей , которые включают в себя любой носитель, который сам по себе не индуцирует продукцию антител, вредных для субъекта, получающего композицию. Подходящие носители обычно представляют собой объемные, медленно метаболизирующиеся макромолекулы, такие как белки, полисахариды, полилактоновые кислоты, полигликолевые кислоты, полимерные аминокислоты, сополимеры аминокислот, и липидные агрегаты (например, масляные капли или липосомы). Такие носители хорошо известны обычным специалистам в данной области. Вакцины также могут содержать разбавители, такие как вода, солевой раствор, глицерин, и т.д. Кроме того, могут присутствовать вспомогательные вещества, такие как смачивающие или эмульгирующие средства, буферные в плане pH вещества, и тому подобное. Подробное обсуждение фармацевтически приемлемых наполнителей доступно в Gennaro (2000) Remington: The Science and Practice of Pharmacy.20th ed., ISBN: 0683306472. , которые включают в себя любой носитель, который сам по себе не индуцирует продукцию антител, вредных для субъекта, получающего композицию. Подходящие носители обычно представляют собой объемные, медленно метаболизирующиеся макромолекулы, такие как белки, полисахариды, полилактоновые кислоты, полигликолевые кислоты, полимерные аминокислоты, сополимеры аминокислот, и липидные агрегаты (например, масляные капли или липосомы). Такие носители хорошо известны обычным специалистам в данной области. Вакцины также могут содержать разбавители, такие как вода, солевой раствор, глицерин, и т.д. Кроме того, могут присутствовать вспомогательные вещества, такие как смачивающие или эмульгирующие средства, буферные в плане pH вещества, и тому подобное. Подробное обсуждение фармацевтически приемлемых наполнителей доступно в Gennaro (2000) Remington: The Science and Practice of Pharmacy.20th ed., ISBN: 0683306472.
Иммунорегуляторные средства
Вакцины по настоящему изобретению могут вводиться в связи с другими иммунорегуляторными средствами. В частности, композиции обычно включают в себя адъювант. Адъюванты для применения согласно изобретению включают в себя в качестве неограничивающих примеров одно или несколько из приведенных ниже:
A. Композиции, содержащие минералы
Композиции, содержащие минералы, подходящие для применения в качестве адъювантов согласно изобретению, включают в себя минеральные соли, например соли алюминия и соли кальция. Изобретение включает в себя минеральные соли, такие как гидроксиды (например, оксигидроксиды), фосфаты (например, гидроксифосфаты, ортофосфаты), сульфаты, и т.д. (например, см. главы 8 & 9 из Vaccine Design... (1995) eds. Powell & Newman. ISBN:030644867X. Plenum.), или смеси различных минеральных соединений (например, смесь фосфатного и гидроксидного адъюванта, необязательно с избытком фосфата), с соединениями, принимающими любую подходящую форму (например, гелеобразную, кристаллическую, аморфную, и т.д.), и с предпочтительной адсорбцией соли(-ей). Композиции, содержащие минералы, могут также быть составлены в виде частиц соли металла (WO00/23105).
Соли алюминия могут входить в состав иммуногенных композиций и/или вакцин согласно изобретению, так что доза Al3+ составляет от 0,2 до 1,0 мг на дозу.
Предпочтительно адъювант представляет собой алюминиевые квасцы, предпочтительно соль алюминия, например гидроксид алюминия (AlOH), или фосфат алюминия, или сульфат алюминия. Еще более предпочтительно , адъювант представляет собой гидроксид алюминия (AlOH).
Предпочтительно минеральная соль, такая как соль алюминия, комбинируется с другим адъювантом, например олигонуклеотидом, содержащим CpG-мотив или ADP-рибозилирующий токсин. Еще более предпочтительно минеральная соль комбинируется с олигонуклеотидом, содержащим CpG-мотив.
B. Масляные эмульсии
Композиции масляных эмульсий для применения в качестве адъювантов согласно изобретению включают в себя эмульсии вода-сквален, такие как MF59 (5% сквален, 0,5% Tween 80, и 0,5% Span 85, из которых образованы субмикронные частицы с использованием микрораспылителя). См. W090/14837. См. также Frey et al., "Comparison of the safety, tolerability, and immunogenicity of aMF59-adjuvanted influenza vaccine and a non- adjuvanted influenza vaccine in non-elderly adults", Vaccine (2003) 21: 4234-4237. MF59 применяют в качестве адъюванта в тривалентной субъединичной вакцине против вируса гриппа FLUAD . .
Особенно предпочтительные адъюванты для применения в композициях представляют собой субмикронные эмульсии масла в воде. Предпочтительными субмикронными эмульсиями масла в воде для применения здесь являются эмульсии сквален/вода, необязательно содержащие различные количества MTP-PE, например субмикронные эмульсии масла в воде, содержащие 4-5% мас./об. сквалена, 0,25-1,0% мас./об. Tween 80 (полиоксиэтиленсорбитан моноолеат), и/или 0,25-1,0% Span 85 (полиоксиэтиленсорбитан моноолеат), и/или 0,25-1,0% Span 85 (сорбитан триолеат), и, необязательно, N-ацетилмурамил-L-аланил-D-изоглутаминил-L-аланин-2-(1'-2'-дипальмитоил-sn-глицеро-3-гидроксифосфорилокси)этиламин (MTP-PE), например субмикронная эмульсия масла в воде, известная как (сорбитан триолеат), и, необязательно, N-ацетилмурамил-L-аланил-D-изоглутаминил-L-аланин-2-(1'-2'-дипальмитоил-sn-глицеро-3-гидроксифосфорилокси)этиламин (MTP-PE), например субмикронная эмульсия масла в воде, известная как  MF59 MF59 (Международная публикация (Международная публикация  WO90/14837; патент США WO90/14837; патент США  6299884 и 6451325, включенные сюда полностью в качестве ссылки; и Ott et al., "MF59 - Design and Evaluation of a Safe and Potent Adjuvant for Human Vaccines" in Vaccine Design: The Subunit and Adjuvant Approach (Powell, M. F. and Newman, M. J. eds. ) Plenum Press, New York, 1995, pp. 277-296). MF59 содержит 4-5% мас./об. сквалена (например, 4,3%), 0,25-0,5% мас./об. Tween 80 6299884 и 6451325, включенные сюда полностью в качестве ссылки; и Ott et al., "MF59 - Design and Evaluation of a Safe and Potent Adjuvant for Human Vaccines" in Vaccine Design: The Subunit and Adjuvant Approach (Powell, M. F. and Newman, M. J. eds. ) Plenum Press, New York, 1995, pp. 277-296). MF59 содержит 4-5% мас./об. сквалена (например, 4,3%), 0,25-0,5% мас./об. Tween 80 , и 0,5% мас./об. Span 85 , и 0,5% мас./об. Span 85 и необязательно содержит различные количества MTP-PE, преобразованные в субмикронные частицы с использованием микрофлюидизатора, такого как микрофлюидизатор модели 110Y (Microfluidics, Newton, Массачусетс). Например, MTP-PE может присутствовать в количестве, примерно равном 0-500 мкг/дозу, более предпочтительно 0-250 мкг/дозу и наиболее предпочтительно 0-100 мкг/дозу. Используемый здесь термин и необязательно содержит различные количества MTP-PE, преобразованные в субмикронные частицы с использованием микрофлюидизатора, такого как микрофлюидизатор модели 110Y (Microfluidics, Newton, Массачусетс). Например, MTP-PE может присутствовать в количестве, примерно равном 0-500 мкг/дозу, более предпочтительно 0-250 мкг/дозу и наиболее предпочтительно 0-100 мкг/дозу. Используемый здесь термин  MF59-0 MF59-0 относится к указанной выше субмикронной эмульсии масла в воде, лишенной MTP-PE, тогда как термин MF59-MTP означает препарат, который содержит MTP-PE. Например, относится к указанной выше субмикронной эмульсии масла в воде, лишенной MTP-PE, тогда как термин MF59-MTP означает препарат, который содержит MTP-PE. Например,  MF59-100 MF59-100 содержит 100 мкг MTP-PE на дозу, и так далее. MF69, другая субмикронная эмульсия масла в воде для применения здесь, содержит 4,3% мас./об. сквалена, 0,25% мас./об. Tween 80 содержит 100 мкг MTP-PE на дозу, и так далее. MF69, другая субмикронная эмульсия масла в воде для применения здесь, содержит 4,3% мас./об. сквалена, 0,25% мас./об. Tween 80 , и 0,75% мас./об. Span 85 и необязательно MTP-PE. Еще одна субмикронная эмульсия масла в воде представляет собой MF75, также известную как SAF, содержащую 10% сквалена, 0,4% Tween80 , и 0,75% мас./об. Span 85 и необязательно MTP-PE. Еще одна субмикронная эмульсия масла в воде представляет собой MF75, также известную как SAF, содержащую 10% сквалена, 0,4% Tween80 , 5% блок-сополимера полиоксиэтилена и полиоксопропилена L121, и thr-MDP, также обработанные микрофлюидизатором с образованием субмикронной эмульсии. MF75-MTP означает препарат MF75, который содержит MTP, например, от 100-400 мкг MTP-PE на дозу. , 5% блок-сополимера полиоксиэтилена и полиоксопропилена L121, и thr-MDP, также обработанные микрофлюидизатором с образованием субмикронной эмульсии. MF75-MTP означает препарат MF75, который содержит MTP, например, от 100-400 мкг MTP-PE на дозу.
Субмикронные эмульсии масла в воде, способы их получения и средства иммуностимуляции, например мурамиловые пептиды, для применения в данных композициях, подробно описаны в Международной публикации  WO90/14837 и патентах США WO90/14837 и патентах США  6299884 и 6451325, включенных сюда полностью в качестве ссылки. Полный адъювант Фрейнда (CFA) и неполный адъювант Фрейнда (IFA) могут также применяться как адъюванты согласно изобретению. 6299884 и 6451325, включенных сюда полностью в качестве ссылки. Полный адъювант Фрейнда (CFA) и неполный адъювант Фрейнда (IFA) могут также применяться как адъюванты согласно изобретению.
C. Препараты сапонина
Препараты сапонина могут также применяться в качестве адъювантов согласно изобретению. Сапонины представляют собой гетерологичную группу стероидных гликозидов и тритерпеноидных гликозидов, которые находят в коре, листьях, стеблях, корнях и даже цветах многих видов растений. Сапонин из коры дерева Quillaia saponaria Molina широко исследованы в качестве адъювантов. Сапонин также может быть получен коммерчески из Smilax ornata (сарсапарель), Gypsophilla paniculata (гипсофилла), и Saponaria officianalis (мыльный корень). Препараты сапониновых адъювантов включают в себя очищенные препараты, например липидные препараты, такие как QS21, а также липидные препараты, такие как ISCOM.
Сапониновые композиции очищали с использованием высокоэффективной тонкослойной хроматографии (HP-LC) и обращенно-фазовой высокоэффективной жидкостной хроматографии (RP-HPLC). Конкретные очищенные с использованием данных способов фракции, включая QS7, QS17, QS18, QS21, QH-A, QH-B и QH-C, были идентифицированы. Предпочтительно сапонин представляет собой QS21. Способ продукции QS21 описан в патенте США  5057540. Препараты сапонина могут также включать в себя стероидный спирт, такой как холестерин (см. WO96/33739). 5057540. Препараты сапонина могут также включать в себя стероидный спирт, такой как холестерин (см. WO96/33739).
Комбинации сапонинов и холестеринов могут использоваться для получения уникальных частиц, называемых иммуностимулирующими комплексами (ISCOM). ISCOM обычно также включают в себя фосфолипид, такой как фосфатидилэтаноламин или фосфатидилхолин. Любые известные сапонины могут использоваться в ISCOM. Предпочтительно ISCOM включает в себя один или несколько из Quil A, QHA и QHC. ISCOM далее описаны в EP0109942, WO96/11711 и WO96/33739. ISCOMS необязательно могут быть лишены дополнительных детергентов. См. WO00/07621.
Обзор разработки основанных на сапонинах адъювантов можно найти в Barr, et al., "ISCOMs and other saponin based adjuvants", Advanced Drug Delivery Reviews (1998) 32: 247- 271. См. также Sjolander, et al., "Uptake and adjuvant activity of orally delivered saponin and ISCOM vaccines", Advanced Drug Delivery Reviews(1998) 32: 321-338.
D. Виросомы и вирусоподобные частицы (VLP)
Виросомы и вирусоподобные частицы (VLP) также могут использоваться в качестве адъювантов согласно изобретению. Данные структуры в общем содержат один или несколько белков из вируса, необязательно сочетанные или составленные в препарат с фосфолипидом. Они, в общем, являются непатогенными, нереплицирующимися и, в общем, не содержат какого-либо нативного вирусного генома. Вирусные белки могут рекомбинантно продуцироваться или выделяться из целых вирусов. Данные вирусные белки, подходящие для применения в виросомах или VLP, включают в себя белки, происходящие из вируса гриппа (например, HA или NA), вируса гепатита B (например, коровые или капсидные белки), вируса гепатита E, вируса кори, вируса Синдбис, ротавируса, вируса ящура, ретровируса, вируса Норуолка, вируса папилломы человека, ВИЧ, РНК-фагов, Q -фага (например, покровные белки), GA-фага, fr-фага, фага AP205, и Ty (например, белок p1 ретротранспозона Ty). VLP обсуждаются далее в WO03/024480, WO03/024481, и Niikura et al., "Chimeric Recombinant Hepatitis E Virus-Like Particles as an Oral Vaccine Vehicle Presenting Foreign Epitopes", Virology (2002) 293: 273-280; Lenz et al.,"Papillomarivurs-Like Particles Induce Acute Activation of Dendritic Cells", Journal of Immunology (2001) 5246-5355; Pinto, et al.,"Cellular Immune Responses to Human Papillomavirus (HPV)-16 L1 Healthy Volunteers Immunized with Recombinant HPV-16 L1 Virus-Like Particles", Journal of Infectious Diseases (2003) 188: 327-338; и Gerber et al., "Human Papillomavrisu Virus-Like Particles Are Efficient Oral Immunogens when Coadministered with Escherichia coli Heat-Labile Entertoxin Mutant R192G or CpG", Journal of Virology (2001) 75 (10): 4752-4760. Virosomes are discussed further in, for example, Gluck et al., "New-Technology Platforms in the Development of Vaccines for the Future", Vaccine (2002) 20:B10-B16. Иммунопотенцирующие реконструированные виросомы гриппа (IRIV) использовали в качестве субъединичной системы доставки антигена в интраназальном тривалентном продукте INFLEXAL -фага (например, покровные белки), GA-фага, fr-фага, фага AP205, и Ty (например, белок p1 ретротранспозона Ty). VLP обсуждаются далее в WO03/024480, WO03/024481, и Niikura et al., "Chimeric Recombinant Hepatitis E Virus-Like Particles as an Oral Vaccine Vehicle Presenting Foreign Epitopes", Virology (2002) 293: 273-280; Lenz et al.,"Papillomarivurs-Like Particles Induce Acute Activation of Dendritic Cells", Journal of Immunology (2001) 5246-5355; Pinto, et al.,"Cellular Immune Responses to Human Papillomavirus (HPV)-16 L1 Healthy Volunteers Immunized with Recombinant HPV-16 L1 Virus-Like Particles", Journal of Infectious Diseases (2003) 188: 327-338; и Gerber et al., "Human Papillomavrisu Virus-Like Particles Are Efficient Oral Immunogens when Coadministered with Escherichia coli Heat-Labile Entertoxin Mutant R192G or CpG", Journal of Virology (2001) 75 (10): 4752-4760. Virosomes are discussed further in, for example, Gluck et al., "New-Technology Platforms in the Development of Vaccines for the Future", Vaccine (2002) 20:B10-B16. Иммунопотенцирующие реконструированные виросомы гриппа (IRIV) использовали в качестве субъединичной системы доставки антигена в интраназальном тривалентном продукте INFLEXAL {Mischler & Metcalfe (2002) Vaccine 20 Suppl 5: B 17-23} и в продукте INFLUVAC PLUS {Mischler & Metcalfe (2002) Vaccine 20 Suppl 5: B 17-23} и в продукте INFLUVAC PLUS . .
E. Бактериальные или микробные производные
Адъюванты, подходящие для применения согласно изобретению, включают в себя бактериальные или микробные производные, например:
(1) нетоксичные производные энтеробактериального липополисахарида (LPS)
Такие производные включают в себя монофосфориллипид A (MPL) и 3-O-деацилированный MPL (3dMPL). 3dMPL представляет собой смесь 3-де-O-ацилированного монофосфориллипида А с 4, 5 или 6 ацилированными цепями. Предпочтительная форма 3-де-O-ацилированного монофосфориллипида А  с малыми частицами с малыми частицами описана в EP 0689454. Такие описана в EP 0689454. Такие  малые частицы малые частицы 3dMPL достаточно малы, чтобы пройти стерильное фильтрование через мембрану 0,22 микрон (см. EP 0689454). Другие нетоксичные производные LPS включают в сеюя миметики монофосфориллипида A, например, производные аминоалкилглюкозаминида фосфата, например, RC-529. См. Johnson et al. (1999) Bioorg Med Chem Lett 9: 2273-2278. 3dMPL достаточно малы, чтобы пройти стерильное фильтрование через мембрану 0,22 микрон (см. EP 0689454). Другие нетоксичные производные LPS включают в сеюя миметики монофосфориллипида A, например, производные аминоалкилглюкозаминида фосфата, например, RC-529. См. Johnson et al. (1999) Bioorg Med Chem Lett 9: 2273-2278.
(2) Производные липида А
Производные липида A включают в себя производные липида А из Escherichia coli, такие как OM-174. OM-174 описан, например, в Meraldi et al., "OM-174, a New Adjuvant with a Potential for Human Use, Induces a Protective Response with Administered with the Synthetic C-Terminal Fragment 242-310 from the circumsporozoite protein of Plasmodium berghei", Vaccine (2003) 21:2485-2491; и Pajak, et al., "The Adjuvant OM-174 induces both the migration and maturation of murine dendritic cells in vivo", Vaccine (2003) 21:836-842.
(3) Иммуностимуляторные олигонуклеотиды
Иммуностимуляторные олигонуклеотиды, подходящие для применения в качестве адъювантов согласно изобретению, включают в себя нуклеотидные последовательности, содержащие CpG-мотив (последовательность, содержащую неметилированный цитозин с последующим гуанозином, связанным фосфатной связью). Бактериальная двухцепочечная РНК или олигонуклеотиды, содержащие палиндромные или поли(dG) последовательности, также, как было показано, являются иммуностимуляторными.
CpG могут включать в себя нуклеотидные модификации/аналоги, такие как фосфотиоатные модификации могут быть двухцепочечными или одноцепочечными. Гуанозин необязательно может замещаться аналогом, например, 2'-дезокси-7-деазагуанозином. См. Kandimalla, et al., "Divergent synthetic nucleotide motif recognition pattern: design and development of potent immunomodulatory oligodeoxyribonucleotide agents with distinct cytokine induction profiles", Nucleic Acids Research (2003) 31 (9): 2393-2400; WO02/26757 и WO99/62923, для примера возможных замен аналогами. Адъювантный эффект CpG-олигонуклеотидов далее обсуждается в Krieg, "CpG motifs: the active ingredient in bacterial extracts?", Nature Medicine (2003) 9 (7): 831-835; McCluskie, et al., "Parenteral and mucosal prime-boost immunization strategies in mice with hepatitis B surface antigen and CpG DNA", FEMS Immunology and Medical Microbiology (2002) 32: 179-185; в WO98/40100; в патенте США  6207646; в патенте США 6207646; в патенте США  6239116 и в патенте США 6239116 и в патенте США  6429199. 6429199.
Последовательность CpG может быть направлена на TLR9, например, мотив GTCGTT или TTCGTT. См. Kandimalla, et al., "Toll-like receptor 9: modulation of recognition and cytokine induction by novel synthetic CpG DNAs", Biochemical Society Transactions (2003) 31 (part 3): 654-658. Последовательность CpG может быть специфичной в отношении индукции иммунного ответа Th1, например CpG-A ODN, или она может быть более специфичной в отношении индукции В-клеточного ответа, например CpG-B ODN. CpG-A и CpG-B ODN обсуждаются в Blackwell, et al., "CpG-A-Induced Monocyte IFN-gamma-Inducible Protein-10 Production is Regulated by Plasmacytoid Dendritic Cell Derived IFN-alpha", J. Immunol. (2003) 170 (8): 4061-4068; Krieg, "From A to Z on CpG", TRENDS in Immunology (2002) 23 (2): 64-65 и в WO01/95935. Предпочтительно CpG представляет собой CpG-A ODN.
Предпочтительно олигонуклеотид CpG конструируется так, что 5'-конец доступен для распознавания рецептора. Необязательно, две последовательности CpG-олигонуклеотида могут быть соединены на своих 3' концах с образованием  иммуномеров иммуномеров . См., например, Kandimalla, et al., "Secondary structures in CpG oligonucleotides affect immunostimulatory activity", BBRC (2003) 306: 948-953; Kandimalla, et al., "Toll-like receptor 9: modulation of recognition and cytokine induction by novel synthetic GpG DNAs", Biochemical Society Transactions (2003)31 (part 3): 664-658; Bhagat et al., "CpG penta- and hexadeoxyribonucleotides as potent immunomodulatory agents" BBRC (2003) 300: 853-861 и WO03/035836. . См., например, Kandimalla, et al., "Secondary structures in CpG oligonucleotides affect immunostimulatory activity", BBRC (2003) 306: 948-953; Kandimalla, et al., "Toll-like receptor 9: modulation of recognition and cytokine induction by novel synthetic GpG DNAs", Biochemical Society Transactions (2003)31 (part 3): 664-658; Bhagat et al., "CpG penta- and hexadeoxyribonucleotides as potent immunomodulatory agents" BBRC (2003) 300: 853-861 и WO03/035836.
Предпочтительно адъювант представляет собой CpG. Даже более предпочтительно адъювант представляет собой алюминиевые квасцы и олигонуклеотид, содержащий CpG-мотив или AlOH и олигонуклеотид, содержащий CpG-мотив.
(4) ADP-рибозилирующие токсины и их детоксифицированные производные
Бактериальные ADP-рибозилирующие токсины и их детоксифицированные производные могут использоваться в качестве адъювантов согласно изобретению. Предпочтительно белок происходит из E. coli (т.е. термолабильный энтеротоксин E. coli  LT LT ), холеры ( ), холеры ( CT CT ) или коклюша ( ) или коклюша ( PT PT ). Применение детоксифицированных ADP-рибозилирующих токсинов в качестве адъювантов для слизистых оболочек описано в WO95/17211 и в качестве парентеральных адъювантов в WO98/42375. Предпочтительно адъювант представляет собой детоксифицированный мутант LT, например LT-K63, LT-R72, и LTR192G. Применение ADP-рибозилирующих токсинов и их детоксицированных производных, в частности LT-K63 и LT-R72, в качестве адъювантов может быть найдено в следующих ссылках, каждая из которых конкретно включена сюда полностью в качестве ссылки: Beignon, et al., "The LTR72 Mutant of Heat-Labile Enterotoxin of Escherichia coli Enhances the Ability of Peptide Antigens to Elicit CD4+ T Cells and Secrete Gamma Interferon after Coapplication onto Bare Skin", Infection and Immunity (2002) 70 (6): 3012-3019; Pizza, et al., "Mucosal vaccines: non toxic derivatives of LT and CT as mucosal adjuvants", Vaccine (2001) 19: 2534-2541; Pizza, et al., "LTK63 and LTR72, two mucosal adjuvants ready for clinical trials"Int. J. Med. Microbiol (2000) 290 (4-5): 455-461; Scharton-Kersten et al., "Transcutaneous Immunization with Bacterial ADP-Ribosylating Exotoxins, Subunits and Unrelated Adjuvants", Infection and Immunity (2000) 68 (9): 5306-5313; Ryan et al., "Mutants of Escherichia coli Heat-Labile Toxin Act as Effective Mucosal Adjuvants for Nasal Delivery of an Acellular Pertussis Vaccine: Differential Effects of the Nontoxic AB Complex and Enzyme Activity on Th1 and Th2 Cells"Infection and Immunity (1999) 67 (12): 6270-6280; Partidos et al., "Heat-labile enterotoxin of Escherichia coli and its site-directed mutant LTK63 enhance the proliferative and cytotoxic T-cell responses to intranasally co-immunized synthetic peptides", Immunol. Lett. (1999) 67 (3): 209-216; Peppoloni et al., "Mutants of the Escherichia coli heat-labile enterotoxin as safe and strong adjuvants for intranasal delivery of vaccines", Vaccines (2003) 2 (2): 285-293; и Pine et al., (2002) "Intranasal immunization with influenza vaccine and a detoxified mutant of heat labile enterotoxin from Escherichia coli (LTK63) "J. Control Release (2002) 85 (1-3): 263-270. Номерные ссылки на аминокислотные замены предпочтительно основаны на выравниваниях субъединиц ADP-рибозилиующего токсина A и B, приведенных в Domenighini et al., Mol. Microbiol (1995) 15 (6):1165-1167, причем данная публикация конкретно включена сюда полностью в качестве ссылки. ). Применение детоксифицированных ADP-рибозилирующих токсинов в качестве адъювантов для слизистых оболочек описано в WO95/17211 и в качестве парентеральных адъювантов в WO98/42375. Предпочтительно адъювант представляет собой детоксифицированный мутант LT, например LT-K63, LT-R72, и LTR192G. Применение ADP-рибозилирующих токсинов и их детоксицированных производных, в частности LT-K63 и LT-R72, в качестве адъювантов может быть найдено в следующих ссылках, каждая из которых конкретно включена сюда полностью в качестве ссылки: Beignon, et al., "The LTR72 Mutant of Heat-Labile Enterotoxin of Escherichia coli Enhances the Ability of Peptide Antigens to Elicit CD4+ T Cells and Secrete Gamma Interferon after Coapplication onto Bare Skin", Infection and Immunity (2002) 70 (6): 3012-3019; Pizza, et al., "Mucosal vaccines: non toxic derivatives of LT and CT as mucosal adjuvants", Vaccine (2001) 19: 2534-2541; Pizza, et al., "LTK63 and LTR72, two mucosal adjuvants ready for clinical trials"Int. J. Med. Microbiol (2000) 290 (4-5): 455-461; Scharton-Kersten et al., "Transcutaneous Immunization with Bacterial ADP-Ribosylating Exotoxins, Subunits and Unrelated Adjuvants", Infection and Immunity (2000) 68 (9): 5306-5313; Ryan et al., "Mutants of Escherichia coli Heat-Labile Toxin Act as Effective Mucosal Adjuvants for Nasal Delivery of an Acellular Pertussis Vaccine: Differential Effects of the Nontoxic AB Complex and Enzyme Activity on Th1 and Th2 Cells"Infection and Immunity (1999) 67 (12): 6270-6280; Partidos et al., "Heat-labile enterotoxin of Escherichia coli and its site-directed mutant LTK63 enhance the proliferative and cytotoxic T-cell responses to intranasally co-immunized synthetic peptides", Immunol. Lett. (1999) 67 (3): 209-216; Peppoloni et al., "Mutants of the Escherichia coli heat-labile enterotoxin as safe and strong adjuvants for intranasal delivery of vaccines", Vaccines (2003) 2 (2): 285-293; и Pine et al., (2002) "Intranasal immunization with influenza vaccine and a detoxified mutant of heat labile enterotoxin from Escherichia coli (LTK63) "J. Control Release (2002) 85 (1-3): 263-270. Номерные ссылки на аминокислотные замены предпочтительно основаны на выравниваниях субъединиц ADP-рибозилиующего токсина A и B, приведенных в Domenighini et al., Mol. Microbiol (1995) 15 (6):1165-1167, причем данная публикация конкретно включена сюда полностью в качестве ссылки.
Предпочтительно адъювант представляет собой ADP-рибозилирующий токсин и олигонуклеотид, содержащий CpG-мотив (см., например, WO01/34185).
Предпочтительно адъювант представляет собой детоксифицированный ADP-рибозилированный токсин и олигонуклеотид, содержащий CpG-мотив.
Предпочтительно детоксифицированный ADP-рибозилированный токсин представляет собой LTK63 или LTK72.
Предпочтительно адъювант представляет собой LTK63. Предпочтительно адъювант представляет собой LTK72.
Предпочтительно адъювант представляет собой LTK63 и олигонуклеотид, содержащий CpG-мотив.
Предпочтительно адъювант представляет собой LTK72 и олигонуклеотид, содержащий CpG-мотив.
F. Биоадгезивы и мукоадгезивы
Биоадгезивы и мукоадгезивы могут также использоваться в качестве адъювантов согласно изобретению. Подходящие биадгезивы включают в себя микросферы из гиалуроновой кислоты (Singh et al. (2001) J. Cont. Rele. 70: 267-276) или мукоадгезивы, такие как перекрестно связанные производные поли(акриловой кислоты), поливинилового спирта, поливинилпирролидона, полисахаридов и карбоксиметилцеллюлозы. Хитозан и его производные могут также использоваться в качестве адъювантов согласно изобретению. Например, WO99/27960.
G. Микрочастицы
Микрочастицы могут также использоваться в качестве адъювантов согласно изобретению. Предпочтительными являются микрочастицы (т.е. частица диаметром от ~100 нм до ~150 мкм, более предпочтительно от ~200 нм до ~30 мкм, и наиболее предпочтительно от ~500 нм до ~10 мкм), образованные из материалов, которые являются биодеградируемыми и нетоксичными (например, поли( -гидроксикислота), полигидроксимасляная кислота, полиортоэфир, полиангидрид, поликапролактон и т.д.), с поли(лактид-когликолидом), необязательно обработанные так, что они содержат отрицательно заряженную поверхность (например, обработаны SDS) или положительно заряженную поверхность (например, обработаны катионным детергентом, например, CTAB). -гидроксикислота), полигидроксимасляная кислота, полиортоэфир, полиангидрид, поликапролактон и т.д.), с поли(лактид-когликолидом), необязательно обработанные так, что они содержат отрицательно заряженную поверхность (например, обработаны SDS) или положительно заряженную поверхность (например, обработаны катионным детергентом, например, CTAB).
H. Липосомы
Примеры липосомных препаратов, подходящих для использования в качестве адъювантов, описаны в патенте США  6090406, в патенте США 6090406, в патенте США  5916588, и EP 0626169. 5916588, и EP 0626169.
L. Препараты полиоксиэтиленовых простых эфиров и полиоксиэтиленовых сложных эфиров
Адъюванты, подходящие для применения согласно изобретению, включают в себя полиоксиэтиленовые простые эфиры и полиоксиэтиленовые сложные эфиры. WO99/52549. Такие препараты далее включают в себя поверхностно-активные вещества - полиоксиэтиленовые сорбитановые сложные эфиры в комбинации с октоксинолом (WO01/21207), а также полиоксиэтиленовые алкиловые простые эфиры или сложноэфирные поверхностно-активные вещества в комбинации по меньшей мере с одним дополнительным неионным поверхностно-активным веществом, таким как октоксинол (WO01/21152).
Предпочтительные полиоксиэтиленовые простые эфиры выбраны из следующей группы: полиоксиэтилен-9-лауриловый простой эфир (laureth 9), полиоксиэтилен-9-стеариловый простой эфир, полиоксиэтилен-8-стеариловый простой эфир, полиоксиэтилен-4-лауриловый простой эфир, полиоксиэтилен-35-лауриловый простой эфир и полиоксиэтилен-23-лауриловый простой эфир.
J. Полифосфазин (PCPP)
Препараты PCPP описаны, например, в Andrianov et al., "Preparation of hydrogel microspheres by coacervation of aqueous polyphophazene solutions", Biomaterials (1998) 19(1-3): 109-115, и Payne et al., "Protein Release from Polyphosphazene Matrices", Adv. Drug. Delivery Review (1998) 31 (3): 185-196.
K. Мурамиловые пептиды
Примеры мурамиловых пептидов, подходящих для применения в качестве адъювантов согласно изобретению, включают в себя N-ацетилмурамил-L-треонил-D-изоглутамин (thr-MDP), N-ацетилнормурамил-1-аланил-D-изоглутамин (nor-MDP), и N-ацетилмурамил-1-аланил-D-изоглутаминил-1-аланин-2-(1'-2'-дипальмитоил-sn-глицеро-3-гидроксифосфорилокси)этиламин MTP-PE).
L. Соединения имидазолохинолона
Примеры соединений имидазолхинолона, подходящих для применения адъювантов согласно изобретению, включают в себя Imiquamod и его гомологи, далее описанные в Stanley, "Imiquimod and the imidazoquinolones: mechanism of action and therapeutic potential" Clin Exp Dermatol (2002) 27 (7): 571-577 и Jones, "Resiquimod 3M", Curr Opin Investig Drugs (2003) 4 (2):214-218.
Изобретение может также включать в себя комбинации аспектов одного или нескольких идентифицированных выше адъювантов. Например, согласно изобретению могут применяться следующие композиции адъювантов:
(1) сапонин и эмульсия масло в воде (WO99/11241);
(2) сапонин (например, QS21) + нетоксичное производное LPS (например, 3dMPL) (см. WO94/00153);
(3) сапонин (например, QS21) + нетоксичное производное LPS (например, 3dMPL) + холестерин;
(4) сапонин (например, QS21) + 3dMPL + IL-12 (необязательно + стероидный спирт)(WO98/57659);
(5) комбинации 3dMPL, например, с QS21 и/или эмульсии масло в воде (см. заявку на выдачу Европейского патента 0835318, 0735898 и 0761231);
(6) SAF, содержащий 10% сквален, 0,4% Tween 80, 5% блок-сополимер полиоксиэтилена и полиоксопропилена L121, и thr-MDP, обработанные микрофлюидизатором с получением субмикронной эмульсией или перемешанные на вортексе с образованием эмульсии с размером частиц большего размера.
(7) Адъювантная система Ribi (RAS) (Ribi Immunochem), содержащая 2% сквалена, 0,2% Tween 80, и один или несколько компонентов бактериальной клеточной стенки из группы, состоящей из монофосфориллипида A (MPL), димиколата трегалозы (TDM), и скелета клеточной стенки (CWS), предпочтительно MPL + CWS (Detox ); );
(8) одна или несколько минеральных солей (например, соль алюминия) + нетоксичное производное LPS (например, 3dPML); и
(9) одна или несколько минеральных солей (например, соль алюминия) + иммуностимуляторный олигонуклеотид (например, нуклеотидная последовательность, включающая в себя CpG-мотив).
Алюминиевые соли и MF59 являются предпочтительными адъювантами для применения с инъецируемыми вакцинами против гриппа. Бактериальные токсины и биоадгезивы являются предпочтительными адъювантами для применения с доставляемыми через слизистые вакцинами, например назальными вакцинами.
M. Человеческие иммуномодуляторы
Человеческие иммуномодуляторы, подходящие для применения в качестве адъювантов согласно изобретению, включают в себя цитокины, такие как интерлейкины (например, IL-1, IL-2, IL-4, IL-5, IL-6, IL-7, IL-12, и т.д.), интерфероны (например, интерферон- ), макрофагальный колониестимулирующий фактор и фактор некроза опухолей. ), макрофагальный колониестимулирующий фактор и фактор некроза опухолей.
Дальнейшие антигены
Композиции согласно изобретению могут далее включают в себя антиген, происходящий из возбудителя одного или нескольких переносимых половым путем заболеваний в дополнение к Chlamydia trachomatis. предпочтительно антиген происходит из возбудителя одного или нескольких следующих переносимых половым путем заболеваний: N. gonorrhoeae (см., например, WO99/24578, WO99/36544, WO99/57280, WO02/079243); вируса папилломы человека; Treponema pallidum; вируса простого герпеса (HSV-1 или HSV-2); ВИЧ (ВИЧ-1 или ВИЧ-2); и Haemophilus ducreyi.
Предпочтительная композиция включает в себя: (1) по меньшей мере t антигенов Chlamydia trachomatis из первой группы антигенов или из второй группы антигенов, где t представляет 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12 или 13, предпочтительно t равен пяти; (2) один или несколько антигенов из возбудителя другого переносимого половым путем заболевания. Предпочтительно переносимое половым путем заболевание выбрано из группы, состоящей из вируса простого герпеса, предпочтительно HSV-1 и/или HSV-2; человеческого папилломвируса; N. gonorrhoeae; Treponema pallidum; и Haemophilus ducreyi. Данные композиции могут, таким образом, предоставлять защиту от следующих переносимых половым путем заболеваний: хламидиоз, генитальный герпес, генитальные бородавки, гонорея, сифилис и мягкий шанкр (см. WO00/15255).
Антигены, ассоциированные N. gonorrhoeae или происходящие из нее, могут, например, включать в себя белок Por (или порин), например PorB (см. Zhu et al., Vaccine (2004) 22: 660-669), переносящий связывающий белок, например, TbpA и TbpB (см. Price et al., Infection and Immunity (2004) 71(1):277-283), белок мутности (такой как Opa), модифицируемый восстановлением белок (Rmp), и препараты везикул внешней мембраны (OMV) (см. Plante et al., J Infectious Disease (2000) 182: 848-855).
Антигены, ассоциированные с вирусом папилломы человека (HPV) или происходящие из нее, могут включать в себя, например, один или несколько из E1-E7, L1, L2 и их белки слияния. Предпочтительно композиции согласно изобретению могут включать в себя вирусоподобную частицу (VLP), содержащую главный белок капсида L1. Предпочтительно антигены HPV являются протективными в отношении одного или нескольких из серотипов HPV 6, 11, 16 и 18.
Когда используют сахаридный или углеводный антиген, он предпочтительно конъюгирован с белком носителем для усиления иммуногенности (см., например, Ramsay et al. (2001) Lancet 357 (9251): 195-196; Lindberg (1999) Vaccine 17 Suppl 2: S28-36; Buttery & Moxon (2000) J R Coll Physicians Lond 34: 163-168; Ahmad & Chapnick (1999) Infect Dis Clin North Am 13: 113-133, Goldblatt (1998) J. Med. Microbiol. 47: 563-567; Европейский патент 0477508; патент США  5306492, заявка на выдачу Международного патента W098/42721, Conjugate Vaccines (eds. Cruse et al.) ISBN 3805549326, particularly vol. 10: 48-114 Hermanson (1996) Bioconjugate Techniques ISBN: 0123423368 или 012342335X). Предпочтительными белками-носителями являются бактериальные токсины или анатоксины, такие как дифтерийные или столбнячные анатоксины. Дифтерийный анатоксин CRM197 является особенно предпочтительным (см. описание исследования, 453077 (янв. 2002 г.). Другие полипептиды-носители включают в себя белок внешней мембраны N. meningitidis (см. EP-A-0372501), синтетические пептиды (см. EP-A-0378881 и EP-A-0427347), белки теплового шока (см. WO93/17712 и W094/03208), белки коклюша (см. WO98/58668 и EP-A-0471177), белок D из H. influenzae (см. WO00/56360), цитокины (см. WO91/01146), лимфокины, гормоны, факторы роста, токсин A или B из С.difficile (см. WO00/61761), белки захвата железа (см. WO01/72337), и т.д. Когда смесь содержит сахара капсулы из серогрупп A и C, может быть предпочтительным, чтобы отношение (мас./мас.) углевод MenA: углевод MenC составляет более 1 (например, 2:1, 3:1, 4:1, 5:1, 10:1 или выше). Различные сахара могут конъюгироваться с одним или различными типами белка-носителя. Могут использоваться любые реакции конъюгации с любым подходящим линкером, где это необходимо. 5306492, заявка на выдачу Международного патента W098/42721, Conjugate Vaccines (eds. Cruse et al.) ISBN 3805549326, particularly vol. 10: 48-114 Hermanson (1996) Bioconjugate Techniques ISBN: 0123423368 или 012342335X). Предпочтительными белками-носителями являются бактериальные токсины или анатоксины, такие как дифтерийные или столбнячные анатоксины. Дифтерийный анатоксин CRM197 является особенно предпочтительным (см. описание исследования, 453077 (янв. 2002 г.). Другие полипептиды-носители включают в себя белок внешней мембраны N. meningitidis (см. EP-A-0372501), синтетические пептиды (см. EP-A-0378881 и EP-A-0427347), белки теплового шока (см. WO93/17712 и W094/03208), белки коклюша (см. WO98/58668 и EP-A-0471177), белок D из H. influenzae (см. WO00/56360), цитокины (см. WO91/01146), лимфокины, гормоны, факторы роста, токсин A или B из С.difficile (см. WO00/61761), белки захвата железа (см. WO01/72337), и т.д. Когда смесь содержит сахара капсулы из серогрупп A и C, может быть предпочтительным, чтобы отношение (мас./мас.) углевод MenA: углевод MenC составляет более 1 (например, 2:1, 3:1, 4:1, 5:1, 10:1 или выше). Различные сахара могут конъюгироваться с одним или различными типами белка-носителя. Могут использоваться любые реакции конъюгации с любым подходящим линкером, где это необходимо.
Антигены - токсичные белки могут детоксифицироваться, где это необходимо, например, как при детоксификации коклюшного токсина химическими или генетическими средствами.
Когда в композицию включается дифтерийный антиген, также предпочтительно включать в нее столбнячный антиген и коклюшные антигены. Сходным образом, когда включается коклюшный антиген, предпочтительно также включать дифтерийные и столбнячные антигены. Сходным образом, когда включается столбнячный антиген, предпочтительно также включать дифтерийные и коклюшные антигены.
Антигены в композиции обычно присутствуют в концентрации по меньшей мере равной 1 мкг/мл каждого.
В общем, концентрации какого-либо данного антигена достаточно для индукции иммунного ответа против такого антигена.
В качестве альтернативы применению белковых антигенов в композиции согласно изобретению может использоваться нуклеиновая кислота, кодирующая антиген (см., например, Robinson & Torres (1997) Seminars in Immunology 9: 271-283; Donnelly et al. (1997) Annu Rev Immunol 15: 617-648, Scott-Taylor & Dalgleish (2000) Expert Opin Investig Drugs 9:471-480, Apostolopoulos & Plebanski (2000) Curr Opin Mol Ther 2:441-447, Ilan (1999) Curr Opin Mol Ther 1:116-120Dubensky et al. (2000) Mol Med 6: 723-732; Robinson & Pertmer (2000) Adv Virus Res 55:1-74, Donnelly et al. (2000) Am J Respir Crit Care Med 162 (4 Pt 2): S190-193, Davis (1999) Mt.Sinai J. Med. 66: 84-90). Белковые компоненты композиций согласно изобретению, таким образом, могут быть заменены нуклеиновой кислотой (предпочтительно ДНК, например, в виде плазмиды), которая кодирует данный белок.
Определения
Термин  содержащий содержащий означает означает  включающий в себя включающий в себя , а также , а также  состоящий из состоящий из , например, композиция, , например, композиция,  содержащая содержащая X, может состоять исключительно из X или может включать в себя что-то добавочное, например X+Y. X, может состоять исключительно из X или может включать в себя что-то добавочное, например X+Y.
Термин  примерно примерно в отношении численного значения x означает, например, x+10%. в отношении численного значения x означает, например, x+10%.
Ссылки на процентную идентичность по последовательности сред двух аминокислотных последовательностей означает, что при выравнивании это процент аминокислот, одинаковых по сравнению двух последовательностей. Данное выравнивание и процентная гомология или идентичность по последовательности может определяться с использованием программного обеспечения, известного в данной области, например того, который описан в разделе 7.7.18 Current Protocols in Molecular Biology (F. M. Ausubel et al., eds., 1987) Supplement 30. Предпочтительное выравнивание определяют по алгоритму Смита-Ватермана для поиска гомологии с использованием поиска аффинной вставки, со штрафом за открытие вставки 12 и штрафом за продление вставки 2, матрицы BLOSUM 62. Алгоритм Смита-Ватермана для поиска гомологии описан Smith & Waterman (1981) Adv. Appl.Math. 2: 482-489
Примеры
Настоящее изобретение определяется только путем примера. Следует понимать, что изобретение описано только путем примера и могут быть сделаны его модификации, остающиеся, тем не менее, в пределах объема и сущности изобретения. В таблицах 1(a) и 1(b) ниже суммируются характеризующие данные для антигенов CT согласно изобретению. Данные таблицы также включают в себя данные, которые далее объясняются примерами, которые последуют.
В таблице 1(а) приведены следующие столбцы: идентификационный номер гена (ID гена), ID белка и соответствующая современная аннотация взяты из генома D/UW-3/CX, поданного в GenBank (инвентарный номер AE001273). Тип белка слияния: указывает на то, генерированы ли данные на основе пептида слияния с His или GST (или с обоими). Теоретическая молекулярная масса представляет собой молекулярную массу (в килодальтонах), которая была рассчитана для предсказанных зрелых форм приведенных белков. Антисыворотка: анализ путем вестерн-блоттинга (профиль WB) суммирует результаты вестерн-блоттинга, полученные путем зондирования общего белка EB антисыворотками против соответствующих рекомбинантных белков CT. Цифры в скобках относятся к номеру панели на фигуре 2. Результаты WB классифицированы следующим образом: C означает  соответствие соответствие (т.е. преобладающая наблюдаемая полоса соответствует ожидаемой молекулярной массе; также могут присутствовать дополнительные минорные полосы); PC означает (т.е. преобладающая наблюдаемая полоса соответствует ожидаемой молекулярной массе; также могут присутствовать дополнительные минорные полосы); PC означает  частичное соответствие частичное соответствие (т.е. полоса с ожидаемой молекулярной массой представлена вместе с дополнительными полосами более высокой молекулярной массы или большей интенсивности); NC представляет собой (т.е. полоса с ожидаемой молекулярной массой представлена вместе с дополнительными полосами более высокой молекулярной массы или большей интенсивности); NC представляет собой  несоответствие несоответствие (т.е. выявляемые полосы не соответствуют ожидаемой молекулярной массе); N представляет собой (т.е. выявляемые полосы не соответствуют ожидаемой молекулярной массе); N представляет собой  отрицательный результат отрицательный результат (т.е. никакого профиля не получено). Антисыворотка: FACS-анализ (коэффициент KS) включает в себя результаты FACS-анализа, выраженные в виде критерия К-С. Титры сывороток, давшие 50% нейтрализации инфекционности, для 9 рекомбинантных антигенов C. trachomatis описаны в тексте (PepA, ArtJ, DnaK, CT398, CT547, енолаза, MOMP, OmpH-подобный, Atos). Каждый титр оценивается в 3 различных экспериментах (показаны значения стандартной ошибки среднего). Антисыворотка: нейтрализующий титр (соответственный) показывает нейтрализующие титры антител для соответствующих антигенов CT. Результаты являются следующими: PepA (CT045) 1:100; ArtJ (CT381) 1:370; DnaK (CT396) 1:230; гипотетический (CT398) 1:540; гипотетический (CT547) 1:40; енолаза (CT587) 1:180; MOMP (CT681) 1:160; OmpH-подобный (CT242) 1:190; AtoS (CT467) 1:500. Все белки, которые характеризовались критерием К-С, превышающим 8,0, перечислены как FACS-положительные. Антиген: сообщение о выявлении путем 2DE/MALDI-TOF обозначено в виде результатов (т.е. никакого профиля не получено). Антисыворотка: FACS-анализ (коэффициент KS) включает в себя результаты FACS-анализа, выраженные в виде критерия К-С. Титры сывороток, давшие 50% нейтрализации инфекционности, для 9 рекомбинантных антигенов C. trachomatis описаны в тексте (PepA, ArtJ, DnaK, CT398, CT547, енолаза, MOMP, OmpH-подобный, Atos). Каждый титр оценивается в 3 различных экспериментах (показаны значения стандартной ошибки среднего). Антисыворотка: нейтрализующий титр (соответственный) показывает нейтрализующие титры антител для соответствующих антигенов CT. Результаты являются следующими: PepA (CT045) 1:100; ArtJ (CT381) 1:370; DnaK (CT396) 1:230; гипотетический (CT398) 1:540; гипотетический (CT547) 1:40; енолаза (CT587) 1:180; MOMP (CT681) 1:160; OmpH-подобный (CT242) 1:190; AtoS (CT467) 1:500. Все белки, которые характеризовались критерием К-С, превышающим 8,0, перечислены как FACS-положительные. Антиген: сообщение о выявлении путем 2DE/MALDI-TOF обозначено в виде результатов  да/нет/? (= не определено) да/нет/? (= не определено) в последнем столбце таблицы. в последнем столбце таблицы.
Сходные столбцы представлены в таблице 1(b). В данной таблице в столбце нейтрализующей активности in vitro показано  neg. neg. (отрицательная) или (отрицательная) или  ND ND (не определено). (не определено).
| Таблица 1(b). Характеристика экспрессированных белков Chlamydia trachomatis (CT) |
| ID гена |
Современная аннотация |
Тип белка слияния |
Молекулярная масса (кДа) |
Вестерн-блот (WB) |
Критерий К.-С. |
Нейтрализующая активность in vitro |
| СТ016 |
Гипотетический |
HIS |
26,63 |
Neg |
17,94 |
neg |
| СТ017 |
Гипотетический |
HIS |
47,79 |
Neg |
12,18 |
neg |
| СТ043 |
Гипотетический |
HIS |
18,38 |
Consistent |
27,53 |
neg |
| СТ082 |
Гипотетический |
HIS |
59 |
Partly C |
15,89 |
neg |
| СТ548 |
Гипотетический |
GST |
21,9 |
С |
14,78 |
neg |
 |
 |
 |
 |
 |
 |
 |
| СТ153 |
Гипотетический |
GST |
90,86 |
С |
13,33 |
neg |
| СТ262 |
Гипотетический |
HIS |
28,81 |
Neg |
19,31 |
neg |
| СТ276 |
Гипотетический |
GST |
21,37 |
Not C |
19,85 |
neg |
| СТ296 |
Гипотетический |
GST |
17,98 |
Neg |
17,70 |
neg |
| СТ372 |
Гипотетический |
HIS |
49,00 |
Partly C |
24,77 |
neg |
| СТ398 |
Гипотетический |
GST |
 |
 |
27,03 |
neg |
| СТ398 |
Гипотетический |
HIS |
 |
 |
22,96 |
neg |
| СТ548 |
Гипотетический |
GST |
 |
 |
14,78 |
neg |
| СТ043 |
Гипотетический |
HIS |
 |
 |
27,53 |
neg |
| СТ635 |
Гипотетический |
GST |
16,77 |
Neg |
11,52 |
ND |
| СТ635 |
Гипотетический |
HIS |
16,77 |
Neg |
11,62 |
ND |
| СТ671 |
Гипотетический |
HIS |
31 |
Neg |
20,91 |
ND |
| СТ671 |
Гипотетический |
GST |
31 |
Neg |
18,07 |
ND |
| СТ089 |
Элемент ответа на низкий уровень кальция (LcrE) |
GST |
44 |
С |
11,9 |
neg |
| СТ812 |
PmpD |
GST |
168 |
Not C |
23,48 |
neg |
| СТ412 |
Предполагаемый белок наружной мембраны А |
HIS |
107 |
Not C |
10,92 |
neg |
| СТ480 |
Связывающий олигопептид липопротеин |
GST |
79,89 |
С |
9,48 |
neg |
| СТ480 |
Связывающий олигопептид липопротеин |
HIS |
79,89 |
С |
27,45 |
neg |
| СТ859 |
Металлопротеаза |
GST |
34,21 |
С |
9,46 |
ND |
| СТ859 |
Металлопротеаза |
HIS |
34,21 |
С |
10,91 |
neg |
| СТ869 |
PmpE |
GST |
106 |
РС |
30,67 |
neg |
| СТ053 |
 |
 |
 |
 |
 |
ND |
ПРИМЕР 1. Исследование и анализ путем вестерн-блота, FACS и нейтрализации in vitro антигенов CT, показанных в таблице 1(a).
Исследование и анализ путем вестерн-блота, FACS и нейтрализации in vitro, показанных в таблицах 1(a) и 1(b), далее обсуждается в данном примере. Получение материалов и подробностей данных анализов приведены ниже.
Получение EB C. trachomatis и хромосомной ДНК. C. trachomatis GO/96, клинический изолят C. trachomatis серотипа D, от пациента с негонококковым уретритом из поликлиники Sant'Orsola, Болонья, Италия, выращивали в культурах клеток LLC-MK2 (ATCC CCL-7). EB собирали через 48 ч после инфекции и очищали путем градиентного центрифугирования, как описано выше (См. Schachter, J., and P. B. Wyrick. 1994. Methods Enzymol. 236: 377-390). Очищенные хламидии ресуспендировали в сахарозно-фосфатном транспортном буфере и хранили при -80°C до применения. Если требовалось, перед хранением инфекционность EB инактивировали нагреванием в течение 3 ч инкубации при 56°C. Хромосомную ДНК получали из очищенных на градиенте EB лизированием клеток в течение ночи при 37°C с 10 мМ Tris-HCl, 150 мМ NaCl, 3 мМ EDTA, 0,6% SDS, 100 мкг протеиназы K/мл, последовательной экстракцией фенолом, фенол-хлороформом, и хлороформом, преципитацией спиртом и ресуспендированием в буфере TE, pH 8.
Анализы in silico. Все 894 генов, кодирующих белки, и соответствующие пептидные последовательности, кодирующие геном C. trachomatis UW-3/Cx (Stephens et al., 1998. Science 282: 754-9), получали с веб-сайта National Center for Biotechnology Information (http://www.ncbi.nlm.nih.gov/). Предполагаемые экспонированные на поверхность белки первично выбирали на основе аннотации GenBank и сходства последовательности с белками, которые, как известно, секретируются или экспонируются на поверхность. Последовательности, аннотированные как гипотетические, которые обычно не имеют значимой гомологии в отношении хорошо охарактеризованных белков, анализировали на присутствие лидерного пептида и/или трансмембранных областей алгоритмом PSORT (Gardy et al., Nucleic Acids Res. 2003 Jul 1; 31 (13): 3613-7). После данных критериев набор из 158 пептидов выбирали для экспрессии и скрининга in vitro.
Клонирование и экспрессия рекомбинантных белков. Выбранные ORF из генома C. trachomatis UW-3/Cx (Stephens et al., выше) клонировали в плазмидные экспрессирующие векторы для получения двух типов рекомбинантных белков: (i) белков с гексагистидиновой меткой на C-конце (ct-His), и (ii) белков, слитых с глутатион-S-трансферазой (GST) с своего N-конца, и с гексагистидиновой меткой со своего C-конца (Gst-ct), как описано в (Montigiani, et al., 2002. Infect Immun 70: 368-79). Escherichia coli BL21 и BL21 (DE3) (Novagen) были реципиентами для происходящих от pET21b рекомбинантных плазмид и происходящих от pGEX плазмид соответственно. ПЦР-праймеры конструировали для амплификации гены без последовательности, кодирующей сигнальный пептид. Когда сигнальный пептид или участок процессинга явно не предсказывается, последовательность ORF клонировали в его полноразмерной форме. Рекомбинантные клоны выращивали в среде Luria-Bertani (500 мл), содержащей 100 мкг ампициллина/мл и выращивали при 37°C до достижения оптической плотности при 600 нм (OD600), равной 0,5. Затем экспрессию рекомбинантных белков индуцировали добавлением 1 мМ изопропил-D-тиогалактопиранозид (IPTG). Через три часа после индукции IPTG клетки собирали центрифугированием при 6000×g в течение 20 мин при 4°C. После очистки белка аликвоты клеточного осадка (соответствующие OD600 0,1) ресуспендировали в буфере для загрузки образца (60 мМ Tris-HCl [pH 6,8], 5% [мас./об.] SDS, 10% [об./об.] глицерина, 0,1% [мас./об.] бромфенола синего, 100 мМ дитиотреита [DTT]), кипятили в течение 5 мин и анализировали посредством SDS-электрофореза в полиакриламидном геле (SDS-PAGE).
Очистка рекомбинантных белков. Образцы осадка клеток, полученные после центрифугирования 500 мл индуцированных культур рекомбинантных E. coli, ресуспендировали с 10 мл B-PER (реагент для экстракции бактериальных белков, Pierce), 1 мМ MgCl2, 100 K единиц ДНКазы I (Sigma), и 1 мг/мл лизоцима (Sigma). Через 30 мин при комнатной температуре при осторожном встряхивании лизат осветляли путем центрифугирования при 30000 g в течение 30 мин при 4°C, и надосадочную жидкость (растворимые белки) отделяли от осадка (дебриса, нерастворимых белков и телец включения).
Растворимые меченные His белки очищали путем иммобилизованной металлоаффинной хроматографии (IMAC) с использованием миниколонок объемом 1 мл с активированной Ni хелатирующей сефарозой для быстрого потока (Amersham). После загрузки колонку промывали 20 мМ имидазола и оставшиеся белки элюировали в одну стадию 250 мМ имидазольным буфером, 50 мМ фосфатом, 300 мМ NaCl, pH 8,0.
Нерастворимые His-меченные белки очищали путем суспендирования осадка, возникшего в результате центрифугирования лизата B-PER, в 50 мМ TRIS-HCl, 1 мМ TCEP (Tris-(2-карбоксиэтил)фосфина гидрохлорид, Pierce) и 6 M гидрохлориде гуанидина, pH 8,5, и проведения IMAC очищенных солюбилизированных белков в денатурирующих условиях. В кратком изложении, ресуспендированный материал центрифугировали при 30000 g в течение 30 мин и надосадочную жидкость загружали на мини-колонках объемом 1 мл с активированной Ni хелатирующей сефарозой для быстрого потока (Pharmacia), уравновешенных 50 мМ TRIS-HC1, 1 мМ TCEP, 6 M гидрохлоридом гуанидина, pH 8,5. Колонку промывали 50 мМ буфером TRIS-HCl, 1 мМ TCEP, 6 M мочевиной, 20 мМ имидазолом, pH 8,5. Затем рекомбинантные белки элюировали тем же буфером, содержащим 250 мМ имидазол.
Растворимые белки слияния с GST очищали, подвергая растворимый лизат B-PER аффинной очистке, основанной на глутатионе, с использованием мини-колонок объемом 0,5 мл со смолой глутатион-сефарозой 4B (Amersham), уравновешенных 10 мл PBS, pH 7,4. После промывки колонки уравновешивающим буфером белки элюировали 50 мМ буфером TRIS, 10 мМ восстановленным глутатионом, pH 8,0.
Концентрацию белка определяли с использованием способа Брэдфорд.
Как демонстрируют примеры, в некоторых вариантах осуществления применяли His-меченные белки, тогда как в других осуществлениях использовали GST-меченный белок. В других примерах использовали комбинации His-меченных или GST-меченных белков. Предпочтительно иммуногенные композиции включают в себя один или несколько His-меченных белков.
Элюированные белковые фракции анализировали посредством SDS-Page и очищенные белки хранили при -20°C после добавления 2 мМ дитиотрейтола (Sigma) и 40% глицерина.
Получение мышиных антисывороток. Группы из четырех самок мышей возрастом от 5 до 6 недель CD1 (Charles River, Комо, Италия) иммунизировали внутрибрюшинно на 1, 15, и 28 сутки 20 мкг очищенного рекомбинантного белка в адъюванте Фрейнда. Преиммунные и иммунные сыворотки получали из образцов крови, собранных на 0 и 43 сутки соответственно, и объединяли перед использованием. Для снижения количества антител, возможно, индуцированных контаминирующими антигенами E. coli, иммунные сыворотки инкубировали в течение ночи при 4°C с нитроцеллюлозными полосами с адсорбированным общим белковым экстрактом E. coli BL21.
Иммунологические анализы. Для анализа путем вестерн-блота общие белки из очищенных EB C. trachomatis GO/96 серотипа D (2 мкг на полосу) разделяли SDS-PAGE и подвергали электроблоттингу на нитроцеллюлозные мембраны. Через 30 мин насыщения PBS с сухим обезжиренным молоком (5% мас./об.) мембраны инкубировали в течение ночи с преиммунными и иммунными сыворотками (стандартное разведение 1:400) и затем промывали 3× фосфатно-солевым буфером (PBS)-Tween 20 (0,1% об./об.). После 1 часа инкубации с конъюгированным с пероксидазой хрена антителом против мышиных антител (конечное разведение 1:5000 Amersham) и промывки PBS-Tween на блотах развивали окраску с использованием субстратного набора Opti-4CN (Bio-Rad).
Анализы проточной цитометрии. Анализы проводили, по существу, как описано ранее (см. Montigiani et al., выше). Очищенные в градиенте, инактивированные нагреванием EB GO/96 серотипа D (2×105 клеток) из C. trachomatis, ресуспендированные в фосфатно-солевом буфере (PBS) с 0,1% бычьим сывороточным альбумином (BSA) инкубировали в течение 30 мин при 4°C со специфическими мышиными антителами (стандартное разведение 1:400). После центрифугировании и промывки 200 мкл PBS-0,1% BSA образцы инкубировали в течение 30 минут при 4°C с антителами козы против мышиных IgG, F(ab)'2-специфичными, конъюгированными с R-фикоэритрином (Jackson Immunoresearch Laboratories Inc.). Образцы промывали PBS-0,1% BSA, ресуспендировали в 150 мкл PBS-0,1% BSA и анализировали путем проточной цитометрии с использованием аппарата FACSCalibur (Becton Dickinson, Mountain View, Калифорния). Контрольные образцы получали сходным образом. Антитела для положительного контроля представляли собой: i) коммерческое специфичное моноклональное антитело против C. pneumoniae (Argene Biosoft, Varilhes, Франция) и ii) мышиную поликлональную сыворотку, полученную путем иммунизации мышей очищенными на градиенте EB C. trachomatis.
Фоновые контрольные сыворотки получали из мышей, иммунизированных очищенным GST- или HIS-пептидом, использованным в конструкциях слияния (GST-контроль, HIS-контроль). Данные FACS анализировали с использованием программного обеспечения Cell Quest Software (Becton Dickinson, Mountain View, Калифорния). Значимость данных FACS-анализа оценивали путем расчета статистики Колмогорова-Смирнова (критерий К-С). (См. Young, I. T. 1977. J Histochem Cytochem 25: 935-41). Статистика К-С позволяет определить значимость различий между двумя перекрывающимися гистограммами, представляющими собой профили FACS тестирования антисывороток против белков и соответствующего им контроля. Все белки, которые характеризовались критерием К-С выше 8,0, указывались как FACS-позитивные, причем различие между двумя гистограммами является статистически значимым (p<0,05). Значения D/s(n) (индекс несходства между двумя кривыми) сообщаются в виде  критерия К-С критерия К-С в таблицах 1(a) и 1(b). в таблицах 1(a) и 1(b).
Анализы нейтрализации in vitro. Анализы нейтрализации in vitro проводили на культурах эпителиальных клеток LLC-MK2 (почка макака Резус). Серийные четырехкратные разведения мышиных иммунных и соответствующих преиммунных сывороток получали в буфере сахароза-фосфат-глутаминовая кислота (SPG). Мышиные поликлональные сыворотки к цельным EB применяли в качестве положительного контроля нейтрализации, в то время как только буфер SPG использовали в качестве негативного контроля нейтрализации (контроль инфекции). Очищенные инфекционные EB из C. trachomatis GO/96 серотипа D разводили в буфере SPG, так что они содержат 3×105 IFU/мл, и 10 мкл суспензии EB добавляли к разведению каждой сыворотки в конечном объеме 100 мкл. Взаимодействию антитело-EB позволяли происходить в течение 30 мин при 37°C на медленно качающейся платформе. 100 мкл реакционной смеси от каждого образца применяли для инокуляции промытых PBS сомкнутых монослоев LLC-MK2 (в трех параллелях для разведения каждой сыворотки), в 96-луночном тканевом культуральном планшете, и центрифугировали при 805×g в течение 1 часа при 37°C. После центрифугирования добавляли минимально необходимую среду Eagle, содержащие соли Earle, содержащую 20% фетальной сыворотки теленка и 1 мкг/мл циклогексимида. Инфицированные культуры инкубировали при 37°C в 5% CO2 в течение 72 часов. Монослои фиксировали метанолом, и хламидийные включения выявляли окрашиванием мышиным антихламидийным, конъюгированным с флуоресцеином моноклональным антителом (Merifluor Chlamydia, Meridian Diagnostics, Inc.) и количественно оценивали путем подсчета 5 полей на лунку при увеличении 40×. Ингибирование инфекционности вследствие взаимодействия EB с иммунными сыворотками подсчитывали в качестве процентного снижения в среднем количестве IFU по сравнению с контролем SPG (только буфер)/EB. В данном расчете число IFU, полученное с иммунными сыворотками, подвергали коррекции, чтобы учесть фоновое ингибирование инфекции соответствующей преиммунной мышиной сывороткой. Согласно общей практике сыворотки считали  нейтрализующими нейтрализующими , если они могли вызывать 50%-ное или большее снижение инфекционности. Соответствующий нейтрализующий титр определяли как разведение сыворотки, при котором наблюдалось 50% снижение инфекционности. Экспериментальную вариабельность оценивали путем расчета стандартной ошибки измерения (SEM), из трех экспериментов титрования для каждого рекомбинантного антигена, как показано на фигуре 2. , если они могли вызывать 50%-ное или большее снижение инфекционности. Соответствующий нейтрализующий титр определяли как разведение сыворотки, при котором наблюдалось 50% снижение инфекционности. Экспериментальную вариабельность оценивали путем расчета стандартной ошибки измерения (SEM), из трех экспериментов титрования для каждого рекомбинантного антигена, как показано на фигуре 2.
Результаты исследования и анализа путем вестерн-блота, FACS и нейтрализации in vitro показаны в таблицах 1(a) и 1(b) и далее обсуждаются ниже.
Селекция in silico. Геномные ORF, подлежащие экспрессии и представленные на функциональные скрининги, выбирали на основе анализов in silico и поиска в литературе с использованием инструментов биоинформатики и критериев, сходных с теми, что описаны в предыдущем сходном исследовании на C. pneumoniae (Montigiani, et al., 2002). По существу, авторы изобретения исследовали геном C. trachomatis серовара D для поиска ORF, кодирующих белки, вероятно, локализованные на поверхности EB. Для максимизации шансов на идентификацию белков бактериальной поверхности авторы вначале выбирали белки C. trachomatis, имеющие существенное сходство по последовательности с белками, которые, как обнаружено, экспонированы на поверхность в C. pneumoniae, как сообщалось ранее (Montigiani, et al., 2002). Поиск на второй стадии основывался, по существу, на присутствии распознаваемого лидерного пептида (в основном при детекции посредством программного обеспечения PSORT), на предсказанных трансмембранных областях, и/или на отдаленном сходстве последовательности с поверхностными белками других грамотрицательных бактерий, выявленном посредством запусков PSI-Blast против невырожденной белковой базы данных GenBank. Третьим критерием было добавление к панели белков, описанных как иммуногенные у экспериментальных животных и людей. С использованием данной процедуры авторы выбирали всего 158 ORF, 114 из которых имели по меньшей мере 40% идентичности в отношении белков C. pneumoniae, в то время как 44 оставались ниже такого порога и считались специфичными для C. trachomatis.
Клонирование и экспрессия антигена. 158 ORF амплифицировали путем ПЦР и клонировали в двух различных экспрессирующих векторов E. coli для получения каждого антигена в виде белка слияния с GST- и/или His-меткой. Учитывая то, что присутствие N-терминального сигнального пептида может индуцировать возможное направление рекомбинантного белка на цитоплазматическую мембрану E. coli, нуклеотидную последовательность N-концевого терминального сигнального пептида исключали из экспрессирующей конструкции. Посредством анализа экспрессии ORF авторы обнаружили, что 94% выбранных генов могут экспрессироваться и 87% из них (соответствующие 137 различным ORF) могут также очищаться с получением рекомбинантных белков слияния, которые могут использоваться в качестве антигенов для иммунизации мышей. Всего 259 рекомбинантных белков слияния C. trachomatis, происходящих из 137 различных клонированных генов, получали и анализировали их качество в плане применения в качестве антигенов для иммунизации мышей. Мышей иммунизировали 201 рекомбинантными белками слияния C. trachomatis с продукцией мышиных сывороток, которые анализировали на их способность распознавать экспонированные на поверхность белки на ЕВ C. trachomatis и на их способность препятствовать процессу инфекции in vitro культуры эпителиальных клеток.
Идентификация экспонированных на поверхность белков путем проточной цитометрии. Мышей иммунизировали 201 рекомбинантными белками слияния C. trachomatis с продукцией мышиных сывороток, которые анализировали на их способность распознавать экспонированные на поверхность белки на ЕВ C. trachomatis и на их способность препятствовать процессу инфекции in vitro культуры эпителиальных клеток. Иммунофлуоресцентное окрашивание EB C. trachomatis и анализ путем проточной цитометрии применяли для исследования способности мышиных сывороток, полученных путем иммунизации панелью из 137 различных рекомбинантных антигенов C. trachomatis, для распознавания вероятных экспонированных на поверхность антигенов. Авторы изобретения ранее показали, что проточная цитометрия может быть очень удобным инструментом для выявления связывания антител с поверхностью хламидийных EB, путем идентификации новой панели экспонированных на поверхность белком C. pneumoniae. Хотя серовар L и E C. trachomatis уже анализировали посредством проточной цитометрии (см. Waldman, et al., (1987) Cytometry 8, 55-59; и Taraktchoglou, et al., (2001). Infect Immun. 69,968-76), авторы изобретения впервые проверили, может ли также данный способ применяться в отношении анализа ЕВ C. trachomatis серовара D путем постановки серии положительных и отрицательных контролей. Как показано на фигуре 3, панель A, мышиная поликлональная сыворотка, полученная путем иммунизации мышей очищенным цельными ЕВ C. trachomatis серовара D, может значимо сдвигать профиль проточной цитометрии популяции бактериальных клеток по сравнению с отрицательной преиммунной сывороткой. В качестве положительного контроля авторы изобретения также применяли коммерческое специфичное против MOMP C. trachomatis моноклональное антитело (Argene), которое давало сходный результат на поликлональной сыворотке (данные не показаны). Авторы изобретения также поставили серию отрицательных контролей для исключения возможных перекрестных взаимодействий между мышиными сыворотками и поверхностью хламидийных клеток. В частности, сыворотки, полученные путем иммунизации мышей белковой фракцией элюированной с Ni-колонок, загруженных белковым экстрактом BL21 (pET21b+) (His-контроль, фиг.3, панель 2) и белком GST (GST-контроль, фиг.3, панель 3), сравнивали с соответствующими преиммунными сыворотками. Отрицательные контроли никогда не характеризовались сдвигом гистограммы по сравнению с преиммунными сыворотками. Результаты с контролями указывали на специфичность и надежность анализа путем проточной цитометрии разработанного авторами изобретения.
Затем авторы изобретения анализировали все сыворотки, полученные против рекомбинантных антигенов C. trachomatis, на их способность распознавать экспонированные на поверхность белки на очищенных EB, как определено посредством FACS-анализа связывания. Все белки, которые характеризовались критерием К-С выше 8,0, указывали как FACS-позитивные, причем различие между тестируемыми и контрольными гистограммами является статистически значимым (p<0,05). Из 137 проанализированных различных генных продуктов 28, как было показано, были способны индуцировать антитела, способные связываться с поверхностью очищенных EB. Белки, которые характеризовались положительным результатом, перечислены в таблицах 1(a) и 1(b). Список белков в таблице 1(a) подразделен на два раздела: (i) белки, которые давали положительный результат при FACS-анализе и/или при анализе нейтрализации, поэтому они считались, вероятно, экспонированными на поверхность и имеющими нейтрализующий эффект; (ii) белки, которые характеризовались способностью индуцировать антитела, направленные против экспонированных на поверхность белков EB, но не характеризовались выявляемым нейтрализующим эффектом. Сравнительный анализ белков, которые оказались экспонированными на поверхность при геномном скрининге C. trachomatis показало, что 21 из 28 FACS-позитивных антигенов имело степень гомологии выше 40% в отношении белков C. pneumoniae, которые, как опубликовано в предыдущей работе авторов изобретения (Montigiani, et al., 2002), вероятно, являются экспонированными на поверхность.
Анализ антисывороток против рекомбинантных антигенов путем вестерн-блота. Панель сывороток также подвергали скринингу посредством вестерн-блота цельных белковых экстрактов очищенных хламидийных EB для визуализации их способности распознавать полосу ожидаемой молекулярной массы. Результаты данного анализа сообщаются в таблицах 1(a) и 1(b), тогда как профили вестерн-блота показаны на фигуре 1. Всего 22 из 30 сывороток, описанных в таблице 1(a), в результате являлись  соответственными соответственными , то есть они, как оказалось, распознавали полосу ожидаемой молекулярной массы на экстрактах белков EB. Четыре сыворотки (анти-CT547, анти-CT266, анти-CT444, анти-CT823) классифицировали как , то есть они, как оказалось, распознавали полосу ожидаемой молекулярной массы на экстрактах белков EB. Четыре сыворотки (анти-CT547, анти-CT266, анти-CT444, анти-CT823) классифицировали как  частично соответственные частично соответственные вследствие присутствия полосы ожидаемой молекулярной массы плюс нескольких других полос более слабой интенсивности. Наконец, четыре сыворотки давали отрицательный профиль вестерн-блота (анти-CT467, анти-CT456, анти-CT812, анти-CT823). Три из четырех отрицательных по вестерн-блоту сывороток (анти-CT456, анти-CT812, анти-CT823) давали положительные результат при FACS-анализе связывания, даже если и не с очень высоким критерием К-С (К-С<15). Примечательно, что две из отрицательных по вестерн-блоту сывороток были получены против антигенов (CT812, CT823), принадлежащих семейству Pmp (PmpD и PmpG), специфичного для хламидий семейству комплексных белков, многие из которых уже локализованы на клеточной поверхности хламидий по меньшей мере в C. pneumoniae (См., например, Knudsen et al., (1999) Infect Immun 67, 375-83; Christiansen et al., (1999) Am Heart J 138, S491-5; Mygind, et al., (2000) FEMS Microbiol Lett 186, 163-9; и Vandahl, et al., (2002) BMC Microbiol 2, 36). Отрицательная по вестерн-блоту сыворотка, полученная путем иммунизации CT467 (AtoS), получила отрицательный коэффициент также при FACS-анализе, но неожиданно она характеризовалась высоким титром нейтрализации (фигура 2). вследствие присутствия полосы ожидаемой молекулярной массы плюс нескольких других полос более слабой интенсивности. Наконец, четыре сыворотки давали отрицательный профиль вестерн-блота (анти-CT467, анти-CT456, анти-CT812, анти-CT823). Три из четырех отрицательных по вестерн-блоту сывороток (анти-CT456, анти-CT812, анти-CT823) давали положительные результат при FACS-анализе связывания, даже если и не с очень высоким критерием К-С (К-С<15). Примечательно, что две из отрицательных по вестерн-блоту сывороток были получены против антигенов (CT812, CT823), принадлежащих семейству Pmp (PmpD и PmpG), специфичного для хламидий семейству комплексных белков, многие из которых уже локализованы на клеточной поверхности хламидий по меньшей мере в C. pneumoniae (См., например, Knudsen et al., (1999) Infect Immun 67, 375-83; Christiansen et al., (1999) Am Heart J 138, S491-5; Mygind, et al., (2000) FEMS Microbiol Lett 186, 163-9; и Vandahl, et al., (2002) BMC Microbiol 2, 36). Отрицательная по вестерн-блоту сыворотка, полученная путем иммунизации CT467 (AtoS), получила отрицательный коэффициент также при FACS-анализе, но неожиданно она характеризовалась высоким титром нейтрализации (фигура 2).
Оценка антисывороток на предмет свойств нейтрализации in vitro. Анализ нейтрализации in vitro на очищенных ЕВ C. trachomatis позволял авторам изобретения идентифицировать нейтрализующие антигены. Инфекционные EB предварительно инкубировали с мышиными антисыворотками, полученными с использованием рекомбинантных антигенов C. trachomatis и затем тестировали на их способность инфицировать монослой эпителиальных клеток. С использованием данного анализа, суммированного в таблице 1(a) (раздел 1), было доказано, что 9 сывороток являются эффективно нейтрализующими в разведении выше 1:30. Данные 9 сывороток получали путем иммунизации мышей рекомбинантными белками, кодируемыми следующими генами C. trachomatis: pepA (CT045), кодирующий лейциламинопептидазу; artJ (CT381), кодирующий предполагаемый внеклеточный белок, связывающий растворенное вещество (возможно, аргинин), из системы транспорта аминокислот; dnaK (CT396), кодирующий хорошо описанный шаперонин семейства hsp70; два  гипотетических гипотетических гена CT398 и CT547; eno (CT587), кодирующий белок, гомологичный бактериальным енолазам, ферментам гликолиза, которые могут также находиться на поверхности бактериальных клеток; ompA (CT681), кодирующий главный белок внешней мембраны; CT242 (OmpH-подобный), кодирующий белок-гомолог семейства бактериальных белков OmpH, некоторые представители которого, как сообщалось, являются шаперонами, участвующими в биосинтезе внешней мембраны; atoS (CT467), кодирующий предполагаемый сенсорный представитель транспортной системы. Как показано на фигуре 2 и суммировано в таблице 1(a), три рекомбинантных антигена (ArtJ (CT381), CT398 и AtoS (CT467)) способны индуцировать антитела с высокой нейтрализующей активностью (нейтрализующие титры сыворотки выше 1:300); четыре из них (DnaK (CT396), енолаза (CT587), OmpA (и OmpH-подобный (CT242)) индуцировали сыворотки с промежуточными нейтрализующими титрами (между 1:180 и 1:300), наконец, сыворотки, полученные против двух белков (PepA (CT045) и CT547), имеют титры, равные или ниже 100. На фигуре 3, на панелях 4-12, показаны профили FACS 9 белков, которые в результате были нейтрализующими, демонстрирующие, что 7 из них способны индуцировать антитела, направленные против поверхности EB, тогда как два из них (OmpH-подобный и AtoS) не показали данной способности. Профили вестерн-блота против цельных белковых экстрактов EB сывороток, полученных против FACS-положительных нейтрализующих антигенов (фигура 3), были полностью соответственными, т.е. с одной полосой ожидаемой молекулярной массы (CT045-PepA, CT381-ArtJ), или частично соответственными, т.е. характеризующимися основной полосой ожидаемой молекулярной массы помимо других полос (CT396-DnaK, CT398, CT547, CT587-енолаза, CT681-MOMP). Однако в случае CT396 (DnaK) и CT681 (MOMP) следует заметить, что предшествующие работы с использованием картирования путем 2D-электрофореза и иммуноблоттинга специфичными моноклональными антителами (Bini, et al., (1996) Electrophoresis 17,185-90) или идентификации пятен путем масс-спектрометрии (Shaw, et al., (2002) Proteomics 2, 164-86) показали, что данные белки находятся в экстрактах EB в множественных электрофорезных пятнах с разной Mw, возможно, вследствие процессинга и/или посттрансляционных модификаций. Из 3 оставшихся гена CT398 и CT547; eno (CT587), кодирующий белок, гомологичный бактериальным енолазам, ферментам гликолиза, которые могут также находиться на поверхности бактериальных клеток; ompA (CT681), кодирующий главный белок внешней мембраны; CT242 (OmpH-подобный), кодирующий белок-гомолог семейства бактериальных белков OmpH, некоторые представители которого, как сообщалось, являются шаперонами, участвующими в биосинтезе внешней мембраны; atoS (CT467), кодирующий предполагаемый сенсорный представитель транспортной системы. Как показано на фигуре 2 и суммировано в таблице 1(a), три рекомбинантных антигена (ArtJ (CT381), CT398 и AtoS (CT467)) способны индуцировать антитела с высокой нейтрализующей активностью (нейтрализующие титры сыворотки выше 1:300); четыре из них (DnaK (CT396), енолаза (CT587), OmpA (и OmpH-подобный (CT242)) индуцировали сыворотки с промежуточными нейтрализующими титрами (между 1:180 и 1:300), наконец, сыворотки, полученные против двух белков (PepA (CT045) и CT547), имеют титры, равные или ниже 100. На фигуре 3, на панелях 4-12, показаны профили FACS 9 белков, которые в результате были нейтрализующими, демонстрирующие, что 7 из них способны индуцировать антитела, направленные против поверхности EB, тогда как два из них (OmpH-подобный и AtoS) не показали данной способности. Профили вестерн-блота против цельных белковых экстрактов EB сывороток, полученных против FACS-положительных нейтрализующих антигенов (фигура 3), были полностью соответственными, т.е. с одной полосой ожидаемой молекулярной массы (CT045-PepA, CT381-ArtJ), или частично соответственными, т.е. характеризующимися основной полосой ожидаемой молекулярной массы помимо других полос (CT396-DnaK, CT398, CT547, CT587-енолаза, CT681-MOMP). Однако в случае CT396 (DnaK) и CT681 (MOMP) следует заметить, что предшествующие работы с использованием картирования путем 2D-электрофореза и иммуноблоттинга специфичными моноклональными антителами (Bini, et al., (1996) Electrophoresis 17,185-90) или идентификации пятен путем масс-спектрометрии (Shaw, et al., (2002) Proteomics 2, 164-86) показали, что данные белки находятся в экстрактах EB в множественных электрофорезных пятнах с разной Mw, возможно, вследствие процессинга и/или посттрансляционных модификаций. Из 3 оставшихся  частично соответственных частично соответственных профилей те, что получены с антисыворотками против рекомбинантных CT398 и CT547-енолазы, показывают, что антитела распознают преимущественно полосу ожидаемого размера, тогда как в случае гипотетического CT547 фактически имеется сомнение в специфичности антисыворотки. Два FACS-отрицательных и нейтрализующих антигена характеризовались различным поведением. Тогда как профиль вестерн-блота CT242 (OmpH-подобного) полностью согласуется, характеризуясь единственной полосой ожидаемой молекулярной массы (фиг.3, панель 8), блот CT467 (AtoS) дал полностью отрицательный результат (фиг. 3, панель 9). профилей те, что получены с антисыворотками против рекомбинантных CT398 и CT547-енолазы, показывают, что антитела распознают преимущественно полосу ожидаемого размера, тогда как в случае гипотетического CT547 фактически имеется сомнение в специфичности антисыворотки. Два FACS-отрицательных и нейтрализующих антигена характеризовались различным поведением. Тогда как профиль вестерн-блота CT242 (OmpH-подобного) полностью согласуется, характеризуясь единственной полосой ожидаемой молекулярной массы (фиг.3, панель 8), блот CT467 (AtoS) дал полностью отрицательный результат (фиг. 3, панель 9).
В случае сыворотки против OmpH (CT242) явное противоречие между профилями FACS и вестерн-блота может объясняться различной чувствительностью этих двух способов анализа. Однако результаты по AtoS (CT467) остаются противоречивыми. Учитывая то, что приведенные выше обнаруженные явления могут частично объясняться тем фактом, что из соображений безопасности проводили FACS-анализы на инактивированных нагреванием препаратах EB и что процедура инактивации может обеспечивать полное (анти-AtoS) или частичное (анти-OmpH) разрушение конформационных эпитопов, существенных для связывания антитела, авторы также тестировали данные антисыворотки в анализе путем дот-блота с использованием (REF) инфекционных EB, нанесенных на нитроцеллюлозную мембрану, как описано Kawa и Stephens (Kawa и Stephens, 2002). Однако результаты анализа путем дот-блота только подтверждали результаты, полученные FACS-анализом.
Дальнейшее обсуждение и анализ результатов вестерн-блота, FACS и анализов нейтрализации in vitro и анализа, показанного в таблицах 1(a) и 1(b), последуют ниже.
Таблицы 1(a) и 1(b) представляют результаты FACS и анализов  нейтрализации in vitro нейтрализации in vitro , полученные на сыворотках, индуцированных против набора рекомбинантных белков слияния C. trachomatis, из которых пока идентифицировано 9 , полученные на сыворотках, индуцированных против набора рекомбинантных белков слияния C. trachomatis, из которых пока идентифицировано 9  нейтрализующих нейтрализующих антигенов. За исключением MOMP не было сообщений о нейтрализующих свойствах данных антигенов. В предшествующей литературе также описан PorB (CT713) как второй нейтрализующий белок (см. Kawa, D. E. and Stephens, R. S. (2002)). Антигенная топология хламидийного белка PorB и идентификация мишеней для иммунной нейтрализации инфекционности описана (J. Immunol. 168, 5184-91). Однако, как показано в таблице 1(a), сыворотка против рекомбинантной формы PorB авторов изобретения не нейтрализовала инфекцию хламидий in vitro. Это несоответствие может объясняться теми соображениями, что рекомбинантный антиген авторов изобретения не растворим в воде, и поэтому он мог лишиться правильной конформации, требуемой для индукции нейтрализующих антител. Возможность сходной ситуации следует принимать во внимание также при интерпретации данных, относящихся к другим антигенов. За исключением MOMP не было сообщений о нейтрализующих свойствах данных антигенов. В предшествующей литературе также описан PorB (CT713) как второй нейтрализующий белок (см. Kawa, D. E. and Stephens, R. S. (2002)). Антигенная топология хламидийного белка PorB и идентификация мишеней для иммунной нейтрализации инфекционности описана (J. Immunol. 168, 5184-91). Однако, как показано в таблице 1(a), сыворотка против рекомбинантной формы PorB авторов изобретения не нейтрализовала инфекцию хламидий in vitro. Это несоответствие может объясняться теми соображениями, что рекомбинантный антиген авторов изобретения не растворим в воде, и поэтому он мог лишиться правильной конформации, требуемой для индукции нейтрализующих антител. Возможность сходной ситуации следует принимать во внимание также при интерпретации данных, относящихся к другим  нерастворимым нерастворимым антигенам. Также интересно отметить, что кроме MOMP другие белки в данной выбранной группы, включая PepA, DnaK, HtrA и PorB, как сообщалось, являлись белками, иммуногенными в ходе инфекции половых путей у людей. антигенам. Также интересно отметить, что кроме MOMP другие белки в данной выбранной группы, включая PepA, DnaK, HtrA и PorB, как сообщалось, являлись белками, иммуногенными в ходе инфекции половых путей у людей.
Кроме антигенов CT, для которых данные по нейтрализации in vitro не были доступны (CT635, CT671 и CT859 - обозначены как ND в таблице 1(b)), ни один из других специфичных для CT белков, описанных в таблице 1(b), не демонстрировал нейтрализующей активности in vitro. Однако данные результаты in vitro не означают или не указывают на то, что данные специфичные для CT антигены не демонстрируют или не могут демонстрировать протективное действие in vivo, особенно при использовании в комбинации с одним или несколькими другими антигенами CT, например, с дополнительным иммунологическим профилем (см., например, протективное действие против заражения CT, которое было получено при использовании комбинаций антигенов CT, таких как (CT242 и CT316), и (CT467 и CT444), и (CT812 и CT082) с дополнительными иммунологическими профилями.
ПРИМЕР 2. Исследование и анализ путем вестерн-блота, FACS и нейтрализации in vitro антигенов CT, показанных в таблице 1(b).
В таблице 1(b) также предоставлены результаты FACS, полученные на сыворотках, индуцированных против набора из 17 рекомбинантных белков слияния Chlamydia trachomatis, которые представляют собой: CT016, CT017, CT043, CT082, CT153, CT262, CT276, CT296, CT372, CT398, CT548, CT043, CT635, CT671 (все гипотетические белки), CT412 (предполагаемый белок наружной мембраны), CT480 (олигопептидсвязывающий белок), CT859 (металлопротеаза), CT089 (элемент ответа на низкий уровень кальция - LcrE), CT812 (PmpD) и CT869 (PmpE). FACS-анализ проводили на белках слияния с HIS и/или белках слияния с GST. Все данные рекомбинантные белки слияния характеризовались критерием К-С выше 8,0 и считались FACS-позитивными. За исключением CT398, CT372 и CT548 не было сообщений, что какой-либо один из данных гипотетических белков является FACS-позитивным. Кроме того, следующие белки: CT050 (гипотетический), CT165 (гипотетический), CT711 (гипотетический) и CT552 (гипотетический) также характеризовались критерием К-С выше 8,0 и считались FACS-позитивными. Не было сообщений, что какой-либо один из данных четырех белков является FACS-позитивным. Все данные гипотетические антигены CT в основном считаются специфичными в отношении CT и не имеют двойников C. pneumoniae.
ПРИМЕР 3. Иммунизация комбинациями антигенов CT из второй, третьей и пятой групп антигенов.
Следующий пример иллюстрирует иммунизацию различными комбинациями антигенов CT из второй, третьей и пятой групп антигенов в экспериментальных мышах. Конкретно в данном примере показана иммунизация комбинацией двух антигенов из второй группы антигенов (CT242 и CT316) и комбинацией одного антигена из третьей группы антигенов и одного антигена из пятой группы антигенов, соответственно (CT812 и CT082).
Способы и экспериментальные мыши, использованные в данном примере, далее обсуждаются ниже.
Экспериментальные мыши для скрининга in vivo протективных антигенов CT
Применяли модель генитальной инфекции Chlamydia trachomatis (CT) на экспериментальных мышах для определения протективного эффекта in vivo антигенов CT (разрешение первичной хламидийной инфекции). Использованная модель описана следующим образом: использовали самок мышей Balb/c в возрасте 4-6 недель. Мышей иммунизировали внутрибрюшинно (в./б.) смесью двух рекомбинантных антигенов CT в группах, как показано ниже в таблице 2. Было показано, что данные антигены CT являются FACS-позитивными и/или нейтрализующими (см. таблицу 1(a)). Вводили три дозы смеси антигенов CT. Антигены CT, использованные в группах 1 и 2, представляли собой белки слияния с HIS. Антигены CT, использованные в группах 3-6, представляли собой белки слияния с GST. Мыши получали гормональное лечение 2,5 мг DepoProvera (ацетат медроксипрогестерона) за 5 суток до стимуляции.
| Таблица 2. Схема иммунизации для примера 2 |
| Группа |
Композиция для иммунизации |
Иммунорегуляторное средство |
Путь введения |
| 1 |
CT242 (OmpH-подобный) + CT316 (L7/L12) (20 мкг каждого белка) |
CFA |
Внутрибрюшинно (в.б.) |
| 2 |
CT242 + CT316 (20 мкг каждого белка) |
AlOH (200 мкг) + CpG (10 мкг) |
Внутрибрюшинно (в.б.) |
| 3 |
CT467 (AtoS) + CT444 (OmcA) (20 мкг каждого белка) |
CFA |
Внутрибрюшинно (в.б.) |
| 4 |
CT467 + CT444 (20 мкг каждого белка) |
AlOH (200 мкг) + CpG (10 мкг) |
Внутрибрюшинно (в.б.) |
| 5 |
CT812 (PmpD) + CT082 (гипотетический) (20 мкг каждого белка) |
CFA |
Внутрибрюшинно (в.б.) |
| 6 |
CT812 + CT082 (20 мкг каждого белка) |
AlOH (200 мкг) + CpG (10 мкг) |
Внутрибрюшинно (в.б.) |
| 7 (отрицательный контроль) |
CFA |
 |
Внутрибрюшинно (в.б.) |
| 8 (отрицательный контроль) |
AlOH (200 мкг) + CpG (10 мкг) |
 |
Внутрибрюшинно (в.б.) |
| 9 (положительный контроль) |
Живые хламидийные EB |
 |
Внутрибрюшинно (в.б.) |
Тестовые заражения. Мышей заражали интравагинально 105 IFU очищенных EB (серовар D) через 2 недели после последней дозы иммунизации. Проводили считывание вагинальных мазков каждый 7 суток до 28 суток после заражения. Также на сыворотках, взятых до заражения, проводили следующие анализы: серологический анализ, включающий в себя FACS, WB, анализ нейтрализации и ELISA. ELISA проводили путем покрытия планшетов каждым рекомбинантным антигеном и тестирования взаимодействия иммунных сывороток из отдельных мышей, иммунизированных комбинациями двух антигенов CT. Данные выражали в виде среднего значения, рассчитанного для каждой группы, выраженного в виде средних единиц ELISA. Специфичный в отношении хламидии тип антитела (IgG, IgA, и т.д.) и изотип проверяли в сыворотке после иммунизации, но до заражения. Целью исследований сыворотки было определение того, как мыши отвечали на иммунизацию комбинацией антигенов CT. Целью вагинальных смывов было определение того, как мышь отвечала на заражение бактериями. На вагинальных смывах также проводили анализы специфичных в отношении хламидии антител в плане типа антител (IgG и IgA) и субтипа антител.
Отрицательные контроли. Использованным отрицательным контролем было введение только иммунорегуляторного средства (например, CFA или AlOH и/или CpG).
Положительные контроли, основанные на  живых живых EB. Использованный положительный контроль представлял собой экстракт живых элементарных телец (ЕВ) хламидии. Здесь мышей инфицировали живыми хламидийными EB в то же время, когда вводили тестируемые антигенные композиции CT. Животных положительного контроля на основе EB. Использованный положительный контроль представлял собой экстракт живых элементарных телец (ЕВ) хламидии. Здесь мышей инфицировали живыми хламидийными EB в то же время, когда вводили тестируемые антигенные композиции CT. Животных положительного контроля на основе  живых живых EB инфицировали примерно в течение 1,5 месяцев (т.е. 6 недель) (поскольку 3 дозы антигенных комбинаций CT вводили каждые 2 недели (т.е. всего в течение 6 недель). Животные (мыши), инфицированные EB инфицировали примерно в течение 1,5 месяцев (т.е. 6 недель) (поскольку 3 дозы антигенных комбинаций CT вводили каждые 2 недели (т.е. всего в течение 6 недель). Животные (мыши), инфицированные  живыми живыми EB, развивали природный иммунитет, который устранял инфекцию (поскольку хламидийная инфекция у мышей является транзиторной). Когда мышей, вакцинированных антигенными комбинациями СТ, затем заражали EB, развивали природный иммунитет, который устранял инфекцию (поскольку хламидийная инфекция у мышей является транзиторной). Когда мышей, вакцинированных антигенными комбинациями СТ, затем заражали  живыми живыми EB, также повторно заражали мышей с положительным контролем EB, также повторно заражали мышей с положительным контролем  живых живых EB (т.е. им давали вторую дозу EB (т.е. им давали вторую дозу  живых живых EB). Поскольку группа положительного контроля EB). Поскольку группа положительного контроля  живых живых EB развивала природный иммунитет, в основном ее представители быстро избавлялись от второй повторной инфекции. Скорость клиренса хламидийной инфекции в тестируемых мышах может затем сравниваться со скоростью инфекции в контрольных мышах EB. EB развивала природный иммунитет, в основном ее представители быстро избавлялись от второй повторной инфекции. Скорость клиренса хламидийной инфекции в тестируемых мышах может затем сравниваться со скоростью инфекции в контрольных мышах EB.
Результаты иммунизации комбинациями антигенов СТ согласно изобретению обсуждаются ниже.
Результаты по 3 × 2 антигенным комбинациям CT + CFA.
В таблице 2 выше показаны три комбинации двух различных антигенов CT с комплементарными иммунологическими профилями, которые могут предоставлять защиту против заражения CT в модели хламидийной генитальной инфекции мышей. Комбинации антигенов вводили в комбинации с CFA или AlOH и CpG. AlOH и CpG смешивали с антигеном непосредственно до введения.
Фигуры 4-6. На предоставленных фигурах 4-6 ось x означает недели после заражения. Ось y означает единицы Chlamydia trachomatis в плане IFU/вагинальный мазок. Результаты выражены в виде среднего количества IFU/мазок, полученного для каждой группы мышей: 1 = 1 неделя или 7 сутки. 2 = 2 недели или 14 сутки, 3=3 недели или 21 сутки. В каждом графике приводятся результаты положительного и отрицательного контроля. Отрицательный контроль = мыши, иммунизированные только адъювантом. Положительный контроль = мыши, инфицированные 106 IFU хламидийных EB и повторно зараженные (природная протекция).
Эти результаты демонстрируют, что протективный эффект всех 3 комбинаций двух антигенов CT наблюдался на 21 сутки после заражения.
Фигуры 7(a), 7(b) и 7(c). Протокол вакцинации мышей группы 1 таблицы 2 повторяли, и полученные результаты приведены на фигурах 7(a)-(c). На фигурах 7(a) и 7(b) продемонстрирована статистически значимая защита через 14 суток после заражения CT у мышей, иммунизированных комбинацией антигенов CT242 и CT316 и адъюванта CFA. На фигурах 7(a) и 7(b) ясно видно, что через 7 суток после заражения (когда хламидийная инфекция находится на своем пике), уровни хламидий в тестируемых мышах, вакцинированных (CT242 и CT316, и CFA) примерно равны тем, какие наблюдаются в контролях CFA, в то время как контроли EB характеризуются некоторым клиренсом инфекции CT. Однако через 14 суток после заражения вакцинированные мыши избавлялись от хламидийной инфекции в значительной степени, как и контрольные мыши, получавшие живые EB. Примечательно, что статистически значимый уровень защиты через 14 суток после заражения более выражено, чем то, которое наблюдается через 21 сутки после заражения, когда из вагинальных мазков получают в значительной степени сниженный уровень бактерий хламидий.
На фигуре 7(c) обозначено, что разведение сыворотки, при котором наблюдалось 50% снижение инфекции, было 1:50, указывая на присутствие низкой нейтрализующей активности in vitro комбинации CT214 и CT316. Этот результат указывает на то, что низкий титр нейтрализации in vitro не указывает на протективный эффект in vivo и не предсказывает его.
На фигурах 4-6 и фигуре 7(a)-(c) продемонстрировано, что три комбинации двух различных антигенов CT с комплементарными иммунологическими профилями способны предоставлять защиту от заражения CT в модели хламидийной генитальной инфекции на мышах при введении в комбинации с иммуностимуляторным средством.
ПРИМЕР 4. Иммунизация комбинациями из первой группы антигенов
Следующий пример иллюстрирует иммунизацию различными комбинациями антигенов CT из первой антигенной группы экспериментальных мышей. Конкретно в данном примере показана иммунизация комбинацией пяти антигенов из первой антигенной группы (CT045, CT381, CT396, CT398 и CT089).
Пять антигенов из первой антигенной группы ((OmpH-подобный белок, ArtJ, DnaK, CT398 и HrtA) или другие комбинации антигенов CT, которые уже описаны) получали, как описано выше. Антигены экспрессируют и очищают. Затем получали композиции комбинаций антигенов, включающие в себя пять антигенов на композицию (и содержащие 15 мкг каждого антигена на композицию).
Мышей CD1 разделяли на семь групп (5-6 мышей на группу для групп от 1 до 6; 3-4 мыши для групп 5, 6, 7, 8 и 9), и иммунизировали следующим образом.
| Таблица 3. Схема иммунизации для примера 4 |
| Группа |
Композиция для иммунизации |
Путь введения |
| 1 |
Смесь 5 антигенов (15 мкг/каждого) + CFA |
Внутрибрюшинно или интраназально |
| 2 |
Смесь 5 антигенов (15 мкг/каждого) + AlOH (200 мкг) |
Внутрибрюшинно или интраназально |
| 3 |
Смесь 5 антигенов (15 мкг/каждого) + CpG (10 мкг) |
Внутрибрюшинно или интраназально |
| 4 |
Смесь 5 антигенов (15 мкг/каждого) + AlOH (200 мкг) + CpG (10 мкг) |
Внутрибрюшинно или интраназально |
| 5 |
Полный адъювант Фрейнда (CFA) |
Внутрибрюшинно или интраназально |
| 6 |
Смесь 5 антигенов (5 мкг/каждого) + LTK63 (5 мкг) |
Внутрибрюшинно или интраназально |
| 7 |
AlOH (200 мкг) + CpG (10 мкг) |
Внутрибрюшинно или интраназально |
| 8 |
CpG (10 мкг) |
Внутрибрюшинно или интраназально |
| 9 |
LTK63 (5 мкг) |
Внутрибрюшинно или интраназально |
Мышей иммунизировали с двухнедельными интервалами. Через две недели после последней иммунизации всех мышей заражали сероваром D Chlamydia trachomatis путем интравагинального инфицирования. При использовании иммунизации через слизистые оболочки (например, интраназальной (и./н.)) экспериментальных животных также заражали через слизистые оболочки для тестирования протективного эффекта иммуногена для слизистых оболочек.
ПРИМЕР 5. Иммунизация комбинациями из первой группы антигенов
Следующий пример иллюстрирует иммунизацию различными комбинациями антигенов CT из первой группы антигенов в модели на экспериментальных мышах. В частности, в данном примере показана иммунизация комбинацией из пяти антигенов из первой группы антигенов (CT045, CT381, CT396, CT398 и CT089).
Модель на мышах для скрининга in-vivo защитных антигенов CT. Для того чтобы определять in vivo защитное действие антигенов СТ (разрешение первичной инфекции Chlamydia), использовали модель генитальной инфекции Chlamydia trachomatis на мышах. Используемую модель описывают следующим образом: использовали самок мышей Balb/c в возрасте 4-6 недель. Мышей иммунизировали внутрибрюшинно (ip) смесью пяти рекомбинантных антигенов СТ, как указано ниже в таблице 4. Данные антигены СТ определили как FACS-положительные и/или нейтрализующие (см. таблицу 1(a)). Три дозы смеси пяти антигенов СТ давали в концентрации 15 мкг на дозу. Антигены CT, перечисленные в группах 1-3 в таблице 4, представляли собой белки слияния HIS. Мышей подвергали гормональной обработке DepoProvera (медроксипрогестеронацетат) в количестве 2,5 мг за 5 дней до заражения.
| Таблица 4. Схема иммунизации для примера 5 |
| Группа |
Композиция для иммунизации |
Иммунорегуляторное средство |
Путь доставки |
| 1 (тестируемая группа) |
CT045 + CT089 + CT396 + CT398 + CT381 (15 мкг/ каждого антигена СТ) |
CFA |
Внутрибрюшинно (в.б.) |
| 2 (тестируемая группа) |
CT045 + CT089 + CT396 + CT398 + CT381 (15 мкг/ каждого антигена СТ) |
AlOH (200 мкг) и CpG (10 мкг) |
Внутрибрюшинно (в.б.) |
| 3 (тестируемая группа) |
CT045 + CT089 + CT396 + CT398 + CT381 (15 мкг/ каждого антигена СТ) |
только AlOH (200 мкг) |
Внутрибрюшинно (в.б.) |
| 4 (тестируемая группа) |
CT045 + CT089 + CT396 + CT398 + CT381 (15 мкг/ каждого антигена СТ) |
только CpG (10 мкг) |
Внутрибрюшинно (в.б.) |
| 5 (отрицательный контроль) |
только полный адъювант Фрейнда (CFA) |
 |
Внутрибрюшинно (в.б.) |
| 6 (отрицательный контроль) |
AlOH (200 мкг) + CpG (10 мкг) |
 |
Внутрибрюшинно (в.б.) |
| 7 (положительный контроль) (контроль защиты) |
Живые элементарные тельца (EB) из хламидии (два раза - предзаражение и заражение) |
 |
Внутрибрюшинно (в.б.) |
| 8 (контроль инфекции) |
Живые элементарные тельца (EB) из хламидии (один раз - только заражение) |
 |
Внутрибрюшинно (в.б.) |
Провокационные тесты. Мышей интравагинально заражали 105 IFU очищенных EB (серовар D) через 2 недели после последней дозы иммунизации. Данные получали при анализе вагинальных мазков каждые 7 дней до 28 дней после заражения. Также проводили следующие анализы предварительно зараженных сывороток: серологический анализ: FACS, WB, анализ нейтрализации и ELISA. ELISA проводили с использованием планшетов, покрытых каждым рекомбинантным антигеном и посредством анализа реакции предварительной иммунизации иммунных сывороток от единичных мышей, иммунизированных комбинацией пяти антигенов СТ. Данные представлены в виде среднего значения, вычисленного для каждой группы, выраженного в качестве средних единиц ELISA. Специфичный для хламидии тип антитела (IgG, IgA и т.д) и изотип проверяли в сыворотке после иммунизации, но перед предварительным заражением. Цель исследований сыворотки заключалась в определении того, как мыши реагировали на иммунизацию комбинациями антигенов СТ. Цель анализа вагинальных смывов заключалась в определении того, как мыши реагировали на бактериальное заражение хламидией. Также с использованием вагинальных смывов проводили анализы специфичных для хламидии антител в отношении типа антитела (IgG и IgA) и субтипа антитела.
Отрицательные контроли: используемый отрицательный контроль представлял собой одно только иммунорегуляторное средство (например, CFA или AlOH и/или CpG).
Положительные контроли с  живыми живыми ЕВ: используемый положительный контроль представлял собой экстракт из живых хламидийных элементарных телец (ЕВ). В данном случае мышей инфицировали живыми EB хламидии в то же самое время, как вводилась исследуемая комбинация антигенов CT. Животных положительного контроля с ЕВ: используемый положительный контроль представлял собой экстракт из живых хламидийных элементарных телец (ЕВ). В данном случае мышей инфицировали живыми EB хламидии в то же самое время, как вводилась исследуемая комбинация антигенов CT. Животных положительного контроля с  живыми живыми EB инфицировали в течение 1,5 месяцев (то есть 6 недель) (поскольку 3 дозы комбинаций антигенов CT вводили каждые 2 недели (то есть в общей сложности 6 недель). Животные (мыши), инфицированные EB инфицировали в течение 1,5 месяцев (то есть 6 недель) (поскольку 3 дозы комбинаций антигенов CT вводили каждые 2 недели (то есть в общей сложности 6 недель). Животные (мыши), инфицированные  живыми живыми EB, проявляли врожденный иммунитет и устраняли инфекцию (поскольку хламидийная инфекция у мышей является преходящей инфекцией). Когда мышей вакцинировали комбинациями антигенов CT, а затем заражали EB, проявляли врожденный иммунитет и устраняли инфекцию (поскольку хламидийная инфекция у мышей является преходящей инфекцией). Когда мышей вакцинировали комбинациями антигенов CT, а затем заражали  живыми живыми EB, положительных контрольных мышей с EB, положительных контрольных мышей с  живыми живыми EB также повторно заражали (то есть они получали вторую дозу EB также повторно заражали (то есть они получали вторую дозу  живых живых EB). Поскольку положительная контрольная группа с "живами" ЕВ проявляла врожденный иммунитет, они быстро устраняли второе повторное заражение. EB). Поскольку положительная контрольная группа с "живами" ЕВ проявляла врожденный иммунитет, они быстро устраняли второе повторное заражение.
Инфекционный контроль: В данной группе мышей заражали только  живыми живыми ЕВ в то же самое время, как повторно заражали положительные контроли с ЕВ в то же самое время, как повторно заражали положительные контроли с  живыми живыми ЕВ и заражали исследуемую группу СТ. Цель данной контрольной группы заключалась в том, чтобы проверить возможное защитное действие в отрицательной контрольной группе (то есть группы, иммунизированной одним только иммунорегуляторным средством). ЕВ и заражали исследуемую группу СТ. Цель данной контрольной группы заключалась в том, чтобы проверить возможное защитное действие в отрицательной контрольной группе (то есть группы, иммунизированной одним только иммунорегуляторным средством).
Результаты иммунизаций по данному примеру подробно описаны ниже.
Результаты по комбинациям 1 × 5 + CFA/AlOH + CpG. На фигуре 8(a)-8(d) показаны результаты, полученные после введения комбинации пяти различных антигенов СТ (CT045, CT089, CT396, CT398 и CT381) с комплементарными иммунологическими профилями, которые демонстрируют, что данная смесь пяти антигенов способна обеспечить защиту против заражения СТ в модели генитальной хламидийной инфекции на мышах при использовании в комбинации с иммунорегуляторным средством, таким как AlOH и CpG.
Фигура 8(a), 8(b) и 8(c). Более подробно: на представленной фигуре 8(b) на оси х обозначены результаты в течение 14 дней после заражения. На оси у обозначены единицы заражения Chlamydia trachomatis в виде IFU/мазок на 14 день. Результаты представлены в виде среднего значения IFU/мазок, полученного для каждой группы мышей. Представлены результаты как для положительного, так и отрицательного контроля. Отрицательный контроль = мыши, иммунизированные одним только адъювантом. Положительный контроль = мыши, инфицированные EB хламидии в количестве 106 IFU и повторно зараженные (естественная защита). Результаты демонстрируют, что защитное действие комбинации пяти антигенов CT (CT045, CT089, CT396, CT398 и CT381) при использовании в комбинации с AlOH и CpG наблюдали на 14 день после заражения.
На фигуре 8(c) продемонстрировано, что специфичные для антигенов хламидии изотипы антител IgG1 и IgG2 можно измерить в сыворотке мышей, полученной после иммунизации, но перед предварительным заражением. Данные специфичные для антигенов хламидии профили изотипов IgG показательны для защитного иммунного ответа Th2 и Th1 соответственно. Более высокий уровень IgG1 относительно IgG2 (а именно преобладание IgG1 над IgG2) получили как для иммунорегуляторных средств CFA и AlOH, так и CpG, причем самые высокие уровни IgG1 получили после введения смеси 5 антигенов СТ в комбинации с AlOH и CpG. Кроме того, наблюдали большее увеличение уровней IgG2a для группы AlOH + CpG относительно группы CFA. Таким образом, результаты демонстрируют, что наблюдали усиленный ответ Th1 и Th2 у мышей, вакцинированных группой 5 антигенов CT и AlOH и CpG в качестве иммунорегуляторных средств по сравнению с мышами, вакцинированными группой 5 антигенов CT и CFA в качестве иммунорегуляторного средства.
Фигуры 9(a), 9(b) и 9(c): Повторяли протокол вакцинации мышей в группе 1 из таблицы 4 и полученные результаты представили на фигурах 9(a)-(c). Однако на этот раз использовали только адъюванты AlOH и CpG.
На фигурах 9(a) и 9(b) показана статистически значимая защита как на 7 день, так и на 14 день после заражения CT мышей, иммунизированных комбинацией пяти антигенов CT (CT045, CT089, CT396, CT398 и CT381) и адъювантами AlOH и CpG. Из фигуры 9(b) очевидно, что на 7 и на 14 день после заражения вакцинированные мыши устраняли хламидийную инфекцию на уровне только немного более высоком, чем мыши положительного контроля с  живыми живыми ЕВ, указывая на то, что мыши, вакцинированные комбинацией пяти антигенов CT (CT045, CT089, CT396, CT398 и CT381) и адъювантов AlOH и CpG, обладают почти таким же высоким уровнем защитного иммунитета, как и ЕВ, указывая на то, что мыши, вакцинированные комбинацией пяти антигенов CT (CT045, CT089, CT396, CT398 и CT381) и адъювантов AlOH и CpG, обладают почти таким же высоким уровнем защитного иммунитета, как и  врожденный врожденный иммунитет, проявляемый контрольными мышами с иммунитет, проявляемый контрольными мышами с  живыми живыми ЕВ. На фигуре 9(b) также продемонстрировано, что имеет место более быстрое и статистически значимое устранение хламидийной инфекции через 7 дней и через 14 дней после заражения. Статистически значимое защитное действие через 7 дней после заражения представляет собой весьма важный результат, поскольку хламидийная бактериальная инфекция у мышей достигает максимума приблизительно через 7 дней после заражения. Действительно, это продемонстрировано на примере контрольной группы ЕВ, которая не проявляет полного устранения бактерий СТ через 7 дней после заражения. Статистически значимое устранение инфекции через 7 и 14 дней после заражения также является намного более значимым, чем статистически значимое устранение инфекции, наблюдаемое на 21 день после заражения, когда число бактерий, полученных при анализе вагинальных мазков, относительно мало. ЕВ. На фигуре 9(b) также продемонстрировано, что имеет место более быстрое и статистически значимое устранение хламидийной инфекции через 7 дней и через 14 дней после заражения. Статистически значимое защитное действие через 7 дней после заражения представляет собой весьма важный результат, поскольку хламидийная бактериальная инфекция у мышей достигает максимума приблизительно через 7 дней после заражения. Действительно, это продемонстрировано на примере контрольной группы ЕВ, которая не проявляет полного устранения бактерий СТ через 7 дней после заражения. Статистически значимое устранение инфекции через 7 и 14 дней после заражения также является намного более значимым, чем статистически значимое устранение инфекции, наблюдаемое на 21 день после заражения, когда число бактерий, полученных при анализе вагинальных мазков, относительно мало.
На фигуре 9(c) показано, что специфичные для антигенов хламидии изотипы антител IgG1 и IgG2 можно определить в сыворотке мышей, полученной после иммунизации, но перед заражением. Данные профили специфичных для антигенов хламидии изотипов антител IgGl и IgG2 характерны для защитного иммунного ответа Th1 и Th2 соответственно. На фигуре 9(c) также указано, что разведение сыворотки, при котором было получено 50% уменьшение хламидийной инфекционности, составляло 1:120.
Данные по нейтрализации для смеси 5 антигенов: на фигурах 10(a) и 10(b) указано, что уровни нейтрализующих антител, полученные для смеси 5 CT при объединении с AlOH и CpG, были приблизительно такими же, как и уровни нейтрализующих антител, полученные для групп положительного контроля с  живыми живыми ЕВ, тогда как никаких нейтрализующих титров не определили для групп отрицательного контроля. В этом случае разведение сыворотки, при котором было получено 50% уменьшение хламидийной инфекционности, составляло 1:120 и 1:110 соответственно. ЕВ, тогда как никаких нейтрализующих титров не определили для групп отрицательного контроля. В этом случае разведение сыворотки, при котором было получено 50% уменьшение хламидийной инфекционности, составляло 1:120 и 1:110 соответственно.
Результаты иммунизаций по данному примеру дополнительно обсуждаются ниже.
На фигурах 8-10 продемонстрировано, что комбинации пяти различных антигенов CT с комплементарно иммунологическими профилями при использовании в комбинации с иммунорегуляторным средством способны обеспечить защиту против заражения CT в модели хламидийной генитальной инфекции на экспериментальных мышах. Не желая привязываться к теории, оказывается, что комбинация AlOH и CpG вызывает усиленный иммунный ответ IgG1 и IgG2a, который характерен для повышенного иммунного ответа Th2 и Th1, соответственно.
ОБЩАЯ ДИСКУССИЯ
Согласно геномной стратегии, имеющей целью идентификацию новых кандидатов для вакцины, которые давали многообещающие результаты для других бактериальных патогенов, авторы изобретения экспрессировали в E. coli в качестве рекомбинантных белков слияния 158 ORF, отобранных in silico из генома C. trachomatis, и, вероятно, кодирующих периферийно располагающиеся белки. Поликлональные антитела к этим белкам были индуцированы у мышей и проанализированы при параллельном скрининге (i) их способности связывать очищенные хламидии в анализе путем проточной цитометрии (определяющем FACS-положительные сыворотки и соответствующие антигены) и (ii) их способности вызвать >50% ингибирование хламидийной инфекционности для клеточных культур in vitro (нейтрализующий сыворотки и антигены). Специфичность антисывороток, которые частично очищали путем адсорбции на белковых экстрактах E. coli, оценивали посредством анализа путем вестерн-блота сыворотки, разведенной 1:400 (такое же разведение, как обнаружили, является оптимальным для скрининга при FACS-анализе), которая исследовалась против очищенных в градиенте экстрактов белков элементарных телец C. trachomatis. Результаты вестерн-блота показывают, что большинство из 30 FACS-положительных и/или нейтрализующих антисывороток, обнаруживающих либо единичную полосу ожидаемой молекулярной массы, либо полосу, соответствующую ожидаемому хламидийному антигену, так или иначе преобладало в профиле WB с только минорными полосами других масс. Фактически только для 5 антигенов оставалось сомнение относительно действительной специфичности антисыворотки, а именно в случае белка CT547, для которого ожидаемая полоса присутствовала, но не преобладала, и 4 случая, для которых получили WB, были полностью негативными (CT456, CT476-AtoS, и два белка слияния для pmpD (CT812) и pmpE (CT869).
При параллельных скринингах определили FACS-положительные сыворотки и соответствующие антигены и до настоящего времени 9  нейтрализующих нейтрализующих антисывороток и антигенов (таблица 1(a)). Семь их них (рекомбинантные формы PepA (CT045), ArtJ (CT381), DnaK (CT396), енолазы (CT587); 2 гипотетических продукта CT398 и CT547 и хорошо изученный продукт ompA, более известный как основной белок внешней мембраны, MOMP (CT681), C. trachomatis) были как FACS-положительными, так и нейтрализующими in vitro: данные по нейтрализации в связи с этим, по-видимому, подтверждают, что связывание, наблюдаемое в FACS-анализе, происходит с интактными инфекционными EB. Напротив, два рекомбинантных антигена, полученные для OmpH-подобного белка (CT242) и белка AtoS (CT467), вызывали образование антитела со свойствами нейтрализации in vitro, но удивительно, что они не проявляли какого-либо определяемого связывания при FACS-анализе (фиг. 2 и 3). Результаты, полученные для CT242 и CT467, удивительны и неожиданны, поскольку эти антигены, по-видимому, не экспонированы на поверхности и все же оба обладают высокими титрами нейтрализации in-vitro. антисывороток и антигенов (таблица 1(a)). Семь их них (рекомбинантные формы PepA (CT045), ArtJ (CT381), DnaK (CT396), енолазы (CT587); 2 гипотетических продукта CT398 и CT547 и хорошо изученный продукт ompA, более известный как основной белок внешней мембраны, MOMP (CT681), C. trachomatis) были как FACS-положительными, так и нейтрализующими in vitro: данные по нейтрализации в связи с этим, по-видимому, подтверждают, что связывание, наблюдаемое в FACS-анализе, происходит с интактными инфекционными EB. Напротив, два рекомбинантных антигена, полученные для OmpH-подобного белка (CT242) и белка AtoS (CT467), вызывали образование антитела со свойствами нейтрализации in vitro, но удивительно, что они не проявляли какого-либо определяемого связывания при FACS-анализе (фиг. 2 и 3). Результаты, полученные для CT242 и CT467, удивительны и неожиданны, поскольку эти антигены, по-видимому, не экспонированы на поверхности и все же оба обладают высокими титрами нейтрализации in-vitro.
AtoS (CT467): AtoS представляет собой особый случай, в котором антисыворотка не определяла какие-либо варианты белка при анализе путем вестерн-блота и давала отрицательные результаты при FACS-анализе (с оценкой К-С ниже порога отсечения). Тем не менее, данная антисыворотка приводила к появлению одного из лучших титров нейтрализации, уступающая только титрам, вызванным  гипотетическим гипотетическим белком CT398. Интересно, что при предыдущем подобном скрининге антигенов Chlamydia pneumoniae (Cpn) (Montigiani et al. (2002) Infect Immun 70: 368-379), антисыворотка к гомологу, Cpn-AtoS, оказалась снова отрицательной при WB, но в этом случае FACS-положительной (КС=14,61) и способной к нейтрализации in vitro (средний титр=270) инфицирования Cpn в той же самой клеточной линии, используемой в настоящем исследовании. Очевидное несоответствие данных результатов можно объяснить, предполагая, что антиген, присутствующий в очень небольших количествах в образце ЕВ, мог связать слишком немного антител, чтобы его можно было обнаружить при связывании в FACS-анализе, однако он мог стать доступным для обнаружения в анализе нейтрализации in vitro вследствие возможности использования более высокой концентрации антител и амплификации, происходящей при хламидийной репликации в данном типе анализа. Гипотеза, что AtoS так или иначе отсутствует в очищенных ЕВ, например, из-за особой нестабильности, согласуется с тем фактом, что белок AtoS, который, как показано, является сенсорной частью 2-компонентной системы, состоящей из AtoS и AtoC, никогда не обнаруживали до настоящего времени при помощи масс-спектрометрического анализа 2DE-протеомной карты ни в одном из 3 серотипов СТ, тогда как экспрессию, предположительно одинаковых по количеству субъединиц AtoC обнаружили на 2DE-карте СТ серотипа-A посредством анализа MALDI-TOF. белком CT398. Интересно, что при предыдущем подобном скрининге антигенов Chlamydia pneumoniae (Cpn) (Montigiani et al. (2002) Infect Immun 70: 368-379), антисыворотка к гомологу, Cpn-AtoS, оказалась снова отрицательной при WB, но в этом случае FACS-положительной (КС=14,61) и способной к нейтрализации in vitro (средний титр=270) инфицирования Cpn в той же самой клеточной линии, используемой в настоящем исследовании. Очевидное несоответствие данных результатов можно объяснить, предполагая, что антиген, присутствующий в очень небольших количествах в образце ЕВ, мог связать слишком немного антител, чтобы его можно было обнаружить при связывании в FACS-анализе, однако он мог стать доступным для обнаружения в анализе нейтрализации in vitro вследствие возможности использования более высокой концентрации антител и амплификации, происходящей при хламидийной репликации в данном типе анализа. Гипотеза, что AtoS так или иначе отсутствует в очищенных ЕВ, например, из-за особой нестабильности, согласуется с тем фактом, что белок AtoS, который, как показано, является сенсорной частью 2-компонентной системы, состоящей из AtoS и AtoC, никогда не обнаруживали до настоящего времени при помощи масс-спектрометрического анализа 2DE-протеомной карты ни в одном из 3 серотипов СТ, тогда как экспрессию, предположительно одинаковых по количеству субъединиц AtoC обнаружили на 2DE-карте СТ серотипа-A посредством анализа MALDI-TOF.
CT08 (гипотетический белок): CT082 (гипотетический белок) является частью оперона, аннотированного в качестве поздней транскрипционной единицы, и экспрессию данного ORF определили в протеоме EB. Интересно, что данные авторов изобретения теперь указывают вероятное экспонирование белка CT082 на поверхности ЕВ, подтверждаемое относительно высокой оценкой K-С (25,62) в FACS-анализе. Такое расположение совместно с его поздней экспрессией в репликационном цикле предполагает важную роль CT082 для некоторых из множества функций ЕВ. Удивительно, что авторы изобретения не смогли обнаружить достаточную нейтрализацию инфекционности, опосредованную антисывороткой против CT082 согласно изобретению. Однако, как отмечено выше, отрицательные результаты исследования при скрининге не рассматривают как категорические, потому что множество факторов (тип рекомбинантной экспрессии, качество иммунного ответа, обязательно искусственные условия в анализе нейтрализации in vitro) может влиять на результат и изменять чувствительность данных анализов.
CT398 (гипотетической белок): Антисыворотка CT398 проявляла самый лучший титр нейтрализации в данном исследовании. Биологическая функция этого гипотетического белка неизвестна. Однако его присутствие в протеоме ЕВ подтвердили масс-спектрометрическим анализом. Настоящие данные авторов изобретения указывают на его поверхностную локализацию и нейтрализующие свойства, и анализ in silico, несмотря на то что N-концевой сигнальный пептид не обнаружен при помощи алгоритмов, таких как PSORT, указывает на наличие между аминокислотными остатками 11 и 170 предсказанной структуры биспирали, которая часто присутствует в бактериальных поверхностных белках. Поиски гомологии показывают некоторую гомологию к человеческому мышечному белку (MYST_HUMAN) и структурную схожесть с gi|230767|pdb|2TMA|A, цепь A, тропомиозин.
Отрицательные результаты, полученные в данных исследованиях, следует рассматривать отрицательными только в плане конкретных процедур и условий, адаптированных для тестов по скринингу. То есть отрицательный результат может просто являться функцией чувствительности анализа. Типичный пример такой ситуации представлен рекомбинантным белком porB (консервативный специфичный в отношении дикарбоксилата порин, который может участвовать в подпитке хламидийного цикла TCA), который, как доказано авторами изобретения, является экспонированным на поверхность в соответствии с опубликованными данными, но не может индуцировать нейтрализующие антитела. Однако, как показано другими исследователями в данной области porB, фактически также является нейтрализующим антигеном. Данное несоответствие может объясняться с учетом того факта, что в данных исследованиях использован рекомбинантный porB. Для проявления нейтрализующей активности исходно нерастворимый рекомбинантный porB должен был подвергаться рефолдингу экстракцией 1% октилглюкозидом и стадии диализа против PBS. Поэтому нейтрализующая активность porB явно зависит от его фолдинга, и в своих работах по скринингу авторы могли получить рекомбинантный porB с фолдингом, позволяющим выявление поверхностной экспонированности в анализе FACS, но потерявшим нейтрализующий(-ие) эпитоп(-ы). Сходная ситуация может предсказываться из литературных данных для других известных поринов Chlamydia, то есть для продукта гена ompA, MOMP (CT681), наиболее исследованного к настоящему времени вакцинного кандидата, который также был описан как имеющий зависимые от фолдинга свойства нейтрализации. В соответствии с этим следовало ожидать, что в отсутствие специфических стадий рефолдинга результаты по скринингу авторов изобретения могли бы быть отрицательными в плане выявления рекомбинантного MOMP как нейтрализующего антитела. Этого, однако, не произошло, и фактически присутствие MOMP в коротком списке нейтрализующих антигенов придает ему в некотором смысле свойства внутреннего положительного контроля.
Проект, описанный здесь, имеет преимущество над предшествующими работами за счет отбора в качестве первого условия некоторого количества генов C. trachomatis, которые считали ортологами (до 40% идентичности в отношении кодируемого полипептида)  FACS-позитивным FACS-позитивным генам C.pneumoniae, т.е. генам, которые при экспрессии в виде белков слияния с GST или с (6)His индуцировали антитела, связывающиеся с очищенными клетками C. pneumoniae. В таблице 1(a) названия белков CT, которые характеризовались соответствующими положительными результатами скрининга в C. pneumoniae, затенены, и можно отменить, что 70% FACS-позитивных антигенов CT, о которых сообщают авторы, имеют ортолог Cpn, ранее описанный как FACS-позитивный. Для общих комментариев по типам белков, выявленным таким образом как потенциальные составляющие поверхности хламидийных EB и по степени ожидаемого согласования данных экспериментальных находок с современными аннотациями in silico, авторы изобретения, таким образом, отсылают автора к дискуссии предшествующих результатов (Montigiani et al (2002)ibis). Что касается анализа нейтрализации, то опубликованная работа по Cpn не включала в себя данный тип анализа, однако в последующей работе лаборатории авторов изобретения в FACS-позитивном наборе идентифицировано по меньшей мере 10 нейтрализующих антигенов Cpn (Finco et al., подано для публикации). Примечательно, что AtoS, ArtJ, енолаза и OmpH-подобный антигены (4 из 9 нейтрализующих антигенов, идентифицированных в данном исследовании) при экспрессии в виде Cpn-специфичных аллельных вариантов имели данные свойства также в отношении инфекции Cpn in vitro. В отличие от предшествующего иследования C. pneumoniae, когда большинство Pmp Cpn давали растворимые и генам C.pneumoniae, т.е. генам, которые при экспрессии в виде белков слияния с GST или с (6)His индуцировали антитела, связывающиеся с очищенными клетками C. pneumoniae. В таблице 1(a) названия белков CT, которые характеризовались соответствующими положительными результатами скрининга в C. pneumoniae, затенены, и можно отменить, что 70% FACS-позитивных антигенов CT, о которых сообщают авторы, имеют ортолог Cpn, ранее описанный как FACS-позитивный. Для общих комментариев по типам белков, выявленным таким образом как потенциальные составляющие поверхности хламидийных EB и по степени ожидаемого согласования данных экспериментальных находок с современными аннотациями in silico, авторы изобретения, таким образом, отсылают автора к дискуссии предшествующих результатов (Montigiani et al (2002)ibis). Что касается анализа нейтрализации, то опубликованная работа по Cpn не включала в себя данный тип анализа, однако в последующей работе лаборатории авторов изобретения в FACS-позитивном наборе идентифицировано по меньшей мере 10 нейтрализующих антигенов Cpn (Finco et al., подано для публикации). Примечательно, что AtoS, ArtJ, енолаза и OmpH-подобный антигены (4 из 9 нейтрализующих антигенов, идентифицированных в данном исследовании) при экспрессии в виде Cpn-специфичных аллельных вариантов имели данные свойства также в отношении инфекции Cpn in vitro. В отличие от предшествующего иследования C. pneumoniae, когда большинство Pmp Cpn давали растворимые и  FACS-позитивные FACS-позитивные белки слияния, в настоящем исследовании авторы изобретения получали только 4 FACS-позитивных белков слияния Pmp из 9 Pmp, идентифицированных в геноме CT. белки слияния, в настоящем исследовании авторы изобретения получали только 4 FACS-позитивных белков слияния Pmp из 9 Pmp, идентифицированных в геноме CT.
Общий итог
Настоящее изобретение демонстрирует, что комбинации антигенов CT являются протективными в отношении заражения Chlamydia. Данные антигенные комбинации CT способны индуцировать антительный ответ (в плане нейтрализующего антитела) и клеточно-опосредованный иммунный ответ (по меньшей мере, в плане Th1-клеточных профилей), которые могут быстро реагировать на воздействие Chlamydia.
Все публикации, указанные в приведенной выше спецификации, включены сюда в качестве ссылки. Различные модификации и вариации описанных способов и системы согласно изобретению понятны специалистам в данной области без уклонения от объема и сущности изобретения. Хотя изобретение описано в связи с конкретными предпочтительными вариантами осуществления, следует понимать, что изобретение не следует излишне ограничивать такими конкретными вариантами осуществления. Наоборот, различные модификации описанных путем воплощения изобретения, очевидные специалистам в области молекулярной биологии или в связанных областях, как подразумевается, относятся к настоящему изобретению.
Формула изобретения
1. Иммуногенная композиция, включающая в себя комбинацию антигенов Chlamydia trachomatis, состоящую из двух, трех, четырех или пяти антигенов Chlamydia trachomatis из первой группы антигенов, причем указанная первая группа антигенов состоит из РерА, LcrE, ArtJ, DnaK и СТ398.
2. Композиция по п.1, в которой указанная комбинация состоит из РерА, LcrE, ArtJ, DnaK и СТ398.
3. Композиция по п.1, в которой указанная комбинация включает в себя LcrE.
4. Композиция по п.1, дополнительно содержащая одно или несколько иммунорегуляторных средств.
5. Композиция по п.4, в которой одно или несколько иммунорегуляторных средств включают в себя адъювант.
6. Композиция по п.5, в которой указанный адъювант выбран из группы, состоящей из TH1-адъюванта и ТН2-адъюванта.
7. Композиция по п.5, в которой адъювант выбран из группы, состоящей из солей алюминия и олигонуклеотидов, содержащих CpG-мотивы.
8. Иммуногенная композиция, включающая в себя комбинацию антигенов Chlamydia trachomatis, состоящую из двух, трех, четырех, пяти, шести, семи, восьми, девяти, десяти, одиннадцати, двенадцати или тринадцати антигенов Chlamydia trachomatis из второй группы антигенов, причем указанная вторая группа антигенов состоит из РерА, LcrE, ArtJ, DnaK, СТ398, OmpH-подобного антигена, L7/L12, OmcA, AtoS, CT547, Енолазы, HtrA и MurG.
9. Иммуногенная композиция по п.8, в которой указанная комбинация включает в себя один или несколько антигенов из группы, состоящей из РерА, LcrE, ArtJ, DnaK, OmpH-подобного антигена и СТ398.
10. Иммуногенная композиция по п.8, в которой указанная комбинация включает в себя LcrE.
11. Иммуногенная композиция по п.8, в которой указанная комбинация включает в себя OmpH-подобный белок.
12. Композиция по п.8, дополнительно содержащая одно или несколько иммунорегуляторных средств.
13. Композиция по п.12, в которой одно или несколько иммунорегуляторных средств включают в себя адъювант.
14. Композиция по п.13, в которой указанный адъювант выбран из группы, состоящей из TH1-адъюванта и ТН2-адъюванта.
15. Композиция по п.13, в которой адъювант выбран из группы, состоящей из солей алюминия и олигонуклеотидов, содержащих CpG-мотивы.
16. Вакцина, содержащая иммуногенную композицию по любому из предшествующих пунктов, для профилактики или лечения инфекции Chlamydia trachomatis.
17. Применение иммуногенной композиции по любому из пп.1-15 или вакцины по п.16 при получении лекарственного средства для профилактики или лечения инфекции Chlamydia trachomatis.
18. Способ нейтрализации у млекопитающего инфекции Chlamydia trachomatis, включающий в себя стадию введения млекопитающему эффективного количества композиции по любому из пп.1-15 или вакцины по п.16.
19. Способ индукции у млекопитающего иммунного ответа против инфекции Chlamydia trachomatis, включающий в себя введение млекопитающему эффективного количества композиции по любому из пп.1-15 или вакцины по п.16.
20. Способ по п.19, в котором указанная композиция вызывает усиленный иммунный ответ ТН1 и ТН2.
21. Способ индукции специфичных в отношении Chlamydia trachomatis антител, включающий в себя введение млекопитающему эффективного количества композиции по любому из пп.1-15 или вакцины по п.16.
22. Иммуногенная композиция, включающая в себя комбинацию антигенов Chlamydia trachomatis, состоящую из двух, трех, четырех или пяти антигенов Chlamydia trachomatis из первой группы антигенов, состоящей из РерА, LcrE, ArtJ, DnaK и СТ398, и дополнительно содержащую одно или несколько из иммунорегуляторных средств.
23. Иммуногенная композиция, включающая в себя олигонуклеотид, содержащий CpG-мотив, минеральную соль и антиген, ассоциированный с заболеванием, передающимся половым путем.
24. Композиция по п.23, в которой указанная минеральная соль представляет собой соль алюминия.
25. Композиция по п.23, в которой указанный антиген представляет собой антиген Chlamydia trachomatis.
26. Применение иммуногенной композиции по любому из пп.1-15 для получения специфического антитела, используемого для нейтрализации, профилактики или лечения инфекции Chlamydia trachomatis у млекопитающего.
27. Применение иммуногенной композиции по любому из пп.1-15 для индукции у млекопитающего иммунного ответа против инфекции Chlamydia trachomatis.
28. Применение по п.27, где указанная композиция вызывает усиленный иммунный ответ ТН1 и ТН2.
|