
СПИСОК ПАТЕНТОВ С УПОМИНАНИЕМ ГИАЛУРОНОВОЙ КИСЛОТЫ
-
- 2017751 Способ получения гиалурона
- 2192150 БАД для профилактики йодной недостаточности
- 2112542 Препарат для лечения патологий соединительных тканей
- 2225206 Препарат для лечения рака молочной железы
- 2299733 Лечение опорно-двигательного аппарата
- 2299732 Способ лечения глаукомы
- 2299726 Противоинфекционная губная помада
- 2299725 Косметическое средство для ухода за кожей
- 2198878 Ароматическое соединение
- 2198702 Способ подготовки трофических язв к аутодермапластике
- 2198653 Вагинальные суппозитории
- 2197946 Композиция для ухода за волосами
- 2197923 Фармацевтическая композиция для лечения отеков роговицы
- 2298410 Биотрансплантант и способ лечения ревматических и аутоиммунных заболеваний
- 2197501 Фотоотверженный гель на основе сшитой гиалуроновой кислоты
- 2197228 Твердые лекарственные формы
- 2197222 Водная компазиция для ухода за волосами, лица и тела
- 2297425 Полипептиды
- 2297240 Композиция с гиалуроновой кислотой
- 2297230 Фармацевтическая компазиция с ксантоновой смолой
- 2196588 Глазные капли
- 2195955 Применение биологически активных веществ
- 2195926 Дерматологические композиции
- 2295954 Микрочастицы для доставки нуклеиновых кислот
- 2295951 Косметика для ухода за кожей лица и век
- 2195262 Фармакологическое средство на основе гиалуроновой кислоты
- 2194512 Способ профилактики и коррекции процесса старения кожи
- 2194478 Лечение экземы
- 2294716 Расширяемый стент
- 2194055 Сшитые сополимеры
- 2099350 Ассоциаты депротонированной гиалуроновой кислоты
- 2293557 Средство для лечения кожи и слизистых
- 2292878 Приготовление микроцастиц, содержащих метопропол
- 2292746 БАД
- 2192256 Защита кишечника
- 2191782 Получение модифицированной гиалуроновой кислоты
- 2292219 Паратиреоидный гормон человека
- 2291686 Микроцастицы
- 2191000 Косметическая маска
- 2290921 Фармацевтические и косметические средства против старения кожи
- 2290900 Модифицированный биоматериал для использования в офтальмологии
- 2290899 Получение биоматерьяла
- 2290397 Новые инданилиденовые соединения
- 2290186 Лечение сирингомиелии
- 2288702 Иррингационный раствор для офтальмологии
- 2288699 Гель для лечения стоматологических заболеваний
- 2188011 Активирующая остеогенез фармацевтическая композиция
- 2187327 Средство с антисептиком
- 2187325 Средство с радиопротекторным действием
- 2287330 Композиции миноксидила
- 2186786 Способ получения гиалуроновой кислоты
- 2186593 Лечение раненого процесса кожи
- 2286801 Очищение воды
- 2286781 Лечение ожогов пищевода у детей
- 2286764 Средство лечения воспалений полости рта
- 2185840 Лечение инфекционных заболеваний
- 2286151 Альфа-2-Дельта-Лиганда
- 2185149 Ранозаживляющий гель
- 2285527 Лечение ИЛ-6 заболеваний
- 2184448 Раствор хранения роговицы, включающий гиалуроновую кислоту
- 2090179 Крем для кожи
- 2183961 Способ лечения кожи
- 2284331 Соли алифотических аминов
- 2284187 Производные амида
- 2089191 Снизить внутрение давление
- 2283320 Получение гликозаминогликанов
- 2283129 Лечение опухолей
- 2283098 Косметические средства с Q
- 2182574 Ароматические соединения
- 2088257 Средство с гипохолестеролемическим действием
- 2088218 Состав для гигиенических салфеток
- 2088206 Способ получения препарата, создающего исскуственный загар
- 2282462 Противомикробные средства
- 2182008 Интровагинальная компазиция
- 2181999 Препарат с отсроченным высвобождением
- 2181998 Новые композиции липидов
- 2181995 Лечение болевого синдрома
- 2181295 Вирионная вакцина
- 2087144 Витамин Е
- 2379336 Способ стирки
- 2379052 Вакцинация
- 2180855Композиция в виде ионного комплекса
- 2379025 Противоинфекционный гель
- 2180825 Лечение травм роговицы
- 2281082 Способ коррекции эстетических и возрастных проблем кожи
- 2180576 Биоактивная добавка для косметических средств
- 2280459 Средство для изменения скорости роста или репродукции клеток
- 2179981 Соли переходного металла
- 2378010 Жидкие вакцины
- 2378008 Комбинированные вакцины
- 2378007 Анаболическое средство
- 2377973 Растительные экстракты
- 2280041 Способ получения водорастворимых комплексов гиалурил
- 2280038 Биополимеры
- 2323733 Йодный обмен
- 2377260 Гель
- 2178693 Противовирусное средство на основе гиалуроновой кислоты
- 2178692 Облегчающие зуд косметическое средство
- 2377022 Гемостатические спреи
- 2376982 Увлажняющая сыворотка для лица
- 2376974 Трансдермальный гель для лица
- 2362784 Гипо-и гиперацетилированные менингокковые капсульные сахариды
- 2177789 Устройство для доставки лекарства к шейке матки
- 2277954 Крем для лица омолаживающий
- 2376378 Способ получения метионина
- 2177332 Биоматериал для предотвращения послеоперационных спаек, с производной гиалуроновой кислотой
- 2177310 Способ получения таблеток
- 2376011 Средство для позвоночника
- 2277410 Косметическое средство
- 2323748 Медицинская повязка
- 2276998 Гидрогелевые композиции
- 2082416 Способ получения препарата с коллагенном из животного сырья
- 2375081 Адсорбирующее изделие
- 2375049 Охлаждающий пластырь
- 2346049 Способ получения гиалурона
- 2275913 Фармацевтические средства
- 2174985 Полисахарид с антиоксидантом
- 2373957 Носитель для лекарственных средств и биологически активных веществ
- 2373941 Способ коррекции возрастных и патологических изменений кожных покров
- 2174845 Композиции и способы доставки генетического материала
- 2174830 Средство для укрепления волос
- 2373769 Синбиотическая композиция
- 2274472 Лечение апорно-двигательного аппарата и болевых синдромов
- 2372929 Профилактическая композиция на основе веществ фенольной природы в липосомной форме
- 2173563 Способ нанесения на поверхность предметов покрытия на основе гиалуроновой кислоты, её производных и полусинтетических полимеров
- 2079304 фармацевтическая композиция, обладающая иммуносупрессорной и антимикробной активностью
- 2273645 Полипептид ожирения
- 2173154 Фракция кератансульфатолигосахаридов и содержащий ее фармацевтический препарат
- 2173136 Грязная мазь
- 2173128 Способ хирургического лечения центральных разрывов сечатки
- 2078561 Косметическое средство предотвращающее старение кожи
- 2172490 Способ прогнозирования воспалительных заболеваний молочной железы при эндопластике
- 2272645 Способ лечения ЦМВ-Инфекции у детей раннего возроста
- 2272636 Фармацевтическая композиция для местного лечения воспаления
- 2272635 Фармацевтически активная субстанция для офтальмологии
- 2272599 Биоматерьял для стабилизации прогрессирующей миопии "Коллаплант"
- 2172168 Средство для заживления ран на основе гиалуроновой кислоты
- 2371172 Фармацевтическая композиция для лечения нервной системы на основе стефаглабрина
- 2171470 Способ прогнозирования послеоперационной трансформации доброкачественных опухолей нервной системы
- 2077317 Состав для ванн
- 2271213 Комбинированные композиции, содержащие экстракты из растений и морских животных
- 2076872 Способ получения окрашенной гиалуроновой кислоты
- 2076671 Раствор для защиты роговицы
- 2370281 Конъюгаты гидроксиалкилкрахмал
- 2370275 Способ лечения (коррекции) косметических и возрастных дефектов кожи
- 2370258 Фармацевтическая композиция для парентальной доставки в форме лиофилизата
- 2270023 Способ экстракции и очистки протеогликана хрящего типа (варианты)
- 2369408 Гемостатическая композиция, включающая гиалуроновую кислоту
- 2369387 Фармацевтическая композиция для лечения нервной системы
- 2369379 Нетаблитированные жевательные формы для индивидуального введения
- 2169136 Производное коричной кислоты
- 70792 Медицинский аппликатор
- 20741717 Способ стабилизации аскорбиновой кислоты
- 2074712 Способ получения препарата, препятствующего преждевременной эякуляции
- 2367954 Способ прогнозирования развития кожной патологии у женщин с синдромом склерополикистозных яичников (СПКЯ)
- 2268075 Устройство для электрокинетической доставки
- 2268052 Средство для лечения воспалительных и дегенеративных заболеваний суставов
- 2167649 Способ получения твердой дисперсии умеренного водорастворимого лекарственного вещества
- 2167647 Гель для бритья
- 2073520 Лечение урологических инфекций
- 2367476 Биопластический материал
- 2367475 Мембрана для использования при направленной регенерации тканей
- 2367469 Фармацевтическая композиция на основе лизоамидазы
- 2367456 Фармацевтическая композиция обладающая антибактериальным и некролитическим действием
- 2367455 Фармацевтическая композиция обладающая некролитическим и антибактериальным действием
- 2267324 Применение антиадгезивных углеводов, препарат для уменьшения и /или блокирования адгезии патогенных веществ
- 2166934 Композиции включающие биологический агент
- 2166510 Псевдодипептиды
- 2366460 Композиции, имеющие высокую противовирусную и антибактериальную активность
- 2360901 Производные феноксиуксусной кислоты
- 2165749 Способ восстановления эндотелия роговицы
- 2265441 Способ укрепления склеры
- 2365382 Композиции и способы для регуляции развития сосудов
- 2070879 Соли гликозаминогликанов
- 2164914 Циклические и гетероциклические N - замещенные - иминогидроксамовые карбоновые кислоты
- 2264627 Хламидийный конъюктивит
- 2364399 Фармацевтический препарат на основе стефаглабрина
- 2264230 Препарат с замедленным высвобождением активного вещества
- 2363497 Фармацевтические композиции
- 2363496 Способ увеличения объема мягких тканей
- 2363473 Способ антифлогистической активации в эксперементе
- 2363461 Фармацевтический препарат на основе сигетина
- 2363459 Средства для введения в роговицу глаз для предотвращения офтальмологических нарушений
- 2363448 Фармацевтические композиции
- 2163123 Глазные капли
- 2162687 Усовершенствованнная лекарственная форма индуктора интерферана
- 2162343 Биосовместимый полимерный материал и способ его получения
- 2162327 Лечение рака
- 2067841 Способ получения ароматизатора
- 2161478 Способ консервированого лечения гонартроза
- 2361617 Вольфрамовые частицы в качестве рентгеноконтрастных веществ
- 2361552 Способы и устройства для дренирования жидкостей и понижения внутриглазного давления
- 2066996 Способ изготовления пленочного материала для офтальмохирургии
- 2361417 Корм с глюкозамином и экстрактом ивы для профилактики артроза у животных
- 2161002 Пищевой общеукрепляющий лечебно-профилактический продукт из хрящевой ткани акул
- 2360928 Комплексная матрица для медико-биологического применения
- 2160574 Способ лечения глаукомы
- 2360688 Способ лечения повреждений переферических нервов
- 2360670 Фармацевтическая композиция при климактерических расстройствах
- 2360646 Эндолюминальный протез
- 2260445 Способ усовершенствования транспортировки через легко прспосабливаемый полупроницаемый барьер
- 2260007 Производные амида
- 2359975 Способ получения модифицированных арабиногалактанов
- 2359974 Антигенные Пептиды
- 2159775 Псевдопептидный продукт
- 2259833 Фармацевтическая композиция для лечения роговицы глаза
- 2259816 Ранозаживляющее средство
- 2259815 Способ коррекции возрастных изменений, связанных с процессами старения кожи
- 2359706 Способ сохранения офтальмологических растворов
- 2359704 Антисептическое средство
- 2359662 Микрокапсулы
- 2159253 Катионные полимеры
- 2159111 Средство для ухода за кожей лица
- 2159105 Композиция для защиты кожи от опасных химических веществ Получение
- 2158593 Биосовместимый водный раствор
- 2358728 Способ лечения и предупреждения потери костной ткани
- 2258517 Способ хирургического лечения травмотических повреждений селезенки пленкой на основе гиалуроновой кислоты
- 2357968 Кристалические формы производной имидазола
- 2357957 Ингибиторы P38 и их применение
- 2157647 Пищевая добавка и ее получение
- 2357758 Препараты для чрескожной и чересслизистой добавки
- 2063244 Способ стабилизации растворов
- 2063140 Способ получения препарата для консервирования мяса
- 2157381 Способ получения гиалуроновой кислоты
- 2257198 Композиции микроцастиц
- 2356909 Белковый комплекс
- 2356570 Косметическая композиция
- 2256434 Способ закрытия перфорации барабанной перепонки
- 2356520 Способ лечения постконтузионного повреждения сечатки глаза
- 2156133 Гель
- 2255945 Полимерная композиция
- 2355761 Средства повторной дифференцировки
- 2061043 Способ повышения устойчивости урокиназы к нагреванию
- 2061005 Способ получения красителей для гистологических исследований
- 2355420 Зубная паста
- 2355385 Композиции пролонгированного действия с контролируемым высвобождением
- 2355240 Способ получения пищевого препарата хондропротекторного действия
- 2155057 Пихтово репейный бальзам
- 2354409 Способ производства высвобождающих лекарственные средчтва медицинских устройств
- 2254145 Раневое покрытие на основе коллаген-хитозанового комплекса
- 2254133 Лечение и профилактика ВИЧ-инфекции у человека
- 2253439 Фармацевтическая композиция для защиты и улучшения оптических свойств роговици при проведении эндовитреальных вмешательств
- 2253437 Способ омоложения кожи
- 2153352 Фармацевтическая композиция обладающая ранозаживляющим и противовоспалительным действием
- 2353354 Фармацевтический препарат на основе низкомолекулярного индуктора интерферона
- 2252787 Способ получения искусственной матрицы кожи
- 2252767 Способ нормализации иммунобиохимического гомеостаза коров в предродовом и послеродовом периодах
- 2352583 Фармацевтическая композиция содержащая Fc-область иммуноглобулина в качестве носителя
- 2152403 Модифицированные полисахариды
- 2352356 Иммуногенная композиция
- 2352342 Исскусственный физиологический солевый раствор Способ его получения
- 2352330 Фармацевтический препарат на основе низкомолекулярного индуктора интерферона
- 2352323 Фармацевтический препарат с модифицированным высвобождением
- 2152027 Способ подготовки ткани мозга для определения гликозаминогликанов
- 2251842 Интектицидный состав для борьбы с личинками оводов
- 2151580 Способ активации пролиферации эндотелия роговицы
- 2351648 Дифференцировка стромальных клеток, полученных из жировой ткани, в эндокринные клетки поджелудочной железы и их использование
- 2351595 N - гидроксиформамидные соединения в качестве ингибиторов металлопротеина
- 2251411 Косметическое средство в лиофилизированной фармацевтической форме
- 2251405 Косметика...ее композиции для косметических препаратов
- 2251367 Средство со сшитой гиалуроновой кислотой для наращивания тканей
- 2351359 Косметика для профилактики и лечения избыточной массы тела
- 2351322 Препарат на основе низкомолекулярного индуктора интерферона
- 2351153 Диета при остеортрите собак
- 2350958 Способ определения групповой принадлежности синовальной жидкости
- 2350625 Производные гиалуроновой кислоты с пониженной биодеградируемостью
- 2150266 Крем после бритья
- 2350354 Фармацевтическое средство содержащие антагонист и фактор некроза
- 2350340 Способ коррекции процессов регенерации
- 2350309 Способ лечения избыточной массы тела с помощью рефлексотерапии
- 2250047 Профилактический продукт из хрящевой ткани гидробионтов
- 2249467 Медицинский матерьял и изделия на его основе
- 2055079 Способ получения препарата гиалуроновой кислоты
- 2349599 Биоадгезив мидии
- 2054903 Способ лечения коллагеноза у бычков на откорме
- 2249210 Способ прогнозирования предрасположенности к развитию и тяжести течения деформирующего остеоартроза коленного сустава у взрослых
- 2349339 Средство для соединительной ткани
- 2148988 Человеческий интерферона
- 2148399 Лечение атеросклероза
- 2148396 Способ определения активного вещества в дифильных мазевых основах
- 2148375 Способ диагностики близорукости
- 2348415 Способ противоспаечной терапии после хирургического вмешательства
- 2348400 Препарат на основе низкомолекулярного индуктора интерферона
- 2348386 Способ непроникающего хирургического лечения первичной открытоугольной глаукомы
- 2248213 Лечение Галактозидальной А недостаточности
- 2347586 Микрофлюидизированные эмульсии типа "масло в воде" и вакцинные средства
- 2147243 Контрастное средство
- 2146526 Лечебный препарат дисбактериоза и урогенитальных инфекций
- 2146148 Терапевтическое применение фактора роста кератиноцитов (ФРК)
- 2146139 Способ повышения активности макрофагов и комбинации для его осуществления
- 2346277 Способ диагностики специфического синовита
- 2345793 Ультразвуковые контрастные вещества и их получение
- 2345782 Терапевтические комбинации на основе PORIFERA для лечения и предотвращения кожных заболеваний
- 2245131 Способ коррекции косметических недостатков кожи
- 2245130 Способ активации восстановительных процессов в коже
- 2144833 Хондроитиназа
- 2344809 Получение твердых дозированных форм с использованием сшитого нетермопластичного носителя
- 2244540 Косметический гель для ухода за кожей лица
- 2244536 Способ лечения дегенеративно-дистрофических заболеваний тазобедренного сустава
- 2344167 Хмелевый экстракт
- 2143884 Агент регулирования дифференциации клеток кожи, культурная среда для клеток или тканей и способ регулирования дифференциации клеток кожи
- 2343932 Способ получения обладающих пониженной растворимостью в воде пленночных материалов
- 2343903 Устройство доставки лекарств для контролируемого введения препаратов
- 2048817 Способ получения материала для лечения ожогов и гнойно - некронических ран
- 2048803 Гидратантный крем
- 2242974 Средства и способы лечения воспалительных заболнваний
- 2142816 Способ получения антигерпетической вакцины
- 2342923 Средство для обработки рук с увлажняющим эффектом
- 2142781 Косметика для макияжа ресниц и бровей и агент ингирирующий рост микроорганизмов в косметических средствах
- 2242251 Трансплантируемые стенты с биоактивными покрытиями
- 2142257 Способ обработки глазных имплантантов и контакных линз
- 2342389 Мононатриевая соль
- 2342107 Способ устранения западения верхнего века при анофтальме
- 2141828 Средство, пролонгирующее эффективность чесночного порошка
- 2241489 Косметическое средство матриксных протеинов для залечивания ран
- 2241443 Средство для лечения герпеса
- 2241414 Способ получения протезов кровеносных сосудов
- 2341539 Гидрогель
- 2141324 Регулятор скорости воздействия препарата для инъекций
- 2141312 Косметическое средство для ухода за кожей лица
- 2341296 Средства и способы покрытия медицинских имплантантов
- 2341272 Средство для неспецифической иммунотерапии
- 2341266 Стенты с нанесенным покрытием содержащим N - (5-(4-(4-
- 2341257 Иммуномодулирующее средство
- 2341255 Средство для лечения климактерических расстройств
- 2240821 Способ лечения урологических инфекций
- 2140786 Способ лечения лишая
- 2140243 Способ хирургического лечения диабетической ретинопатии и отслоек сечатной оболочки
- 2240140 Медицинская многослойная повязка и изделия на ее основе
- 2240135 Культура клеток, содержащая клетки - предшественники остеонегеза, имплантант на ее основе и его использование для восстановления целостности кости
- 2240123 Экзогенные биологически активные коньюгирующие вещества
- 2139886 Фотоотвержаемое производное гликозаминогликата, сшитое производное гликозаминогликата и способы их получения, способ предотвращения клеточной и тканевой адгезии
- 2139729 Вакцина. Способ стимулирования иммунной системы
- 2339386 Средство обладающее радио - и химиозащитным действием
- 2339369 Лечение офтальмологических нарушений с использованием мочевины и ее производных
- 2139041 Гидратантный регенерирующий крем и способ его получения
- 2139039 Косметический суперкрем для ухода за кожей
- 2139017 Способ получения боисовместимого материала
- 2138503 Производные камптотецина, способы их получения, уникальное средство
- 2338556 Средство содержащие антагонист Р2Х - рецептора и нестероидное противоспалительное лекарственное средство
- 2338514 Косметическое средство для профилактики старения кожи
- 2138297 Медицинские устройства, подверженные вызываемому разложению
- 2138295 Покрытие для ран
- 2337906 Ингибиторы цитозольной фосфолипазы А2 Применение физиологически допустимого корпускулярного ферримагнитного или ферромагнитного материала. Способ формирования магнитометрического изображения
- 2137501 Устройство формирования изображения
- 2137477 Способ лечения заболеваний характеризующихся аутоиммунной агрессией
- 2137467 Крем для кожи лица и тела
- 2137449 Способ коррекции дефектов преломления в глазу млекопитающего
- 2137402 Пищевая Добавка БАД
- 2336899 Способ стимуляции миелопоэза
- 2336862 Способ получения раствора для лечения роговицы
- 2336830 Способ восстановления костных структур челюсти
- 2136696 Новый полипептид и средство против ВИЧ - Инфекции
- 2336092 Биоадгезивное средство, по существу свободное от воды
- 2336089 Средство и способ лечения заболеваний периодонтальных и пульпы
- 2336074 Средства и способы лечения заднего сегмента глаза
- 2235548 Ранозаживляющее средство
- 2135186 Способ лечения рефлекторных синдромов при остеохондрозе
- 2234945 Стабилизатор водного раствора и водосодержащего сырья
- 2334762 Растворимая ассоциативная карбоксиметилцеллюлоза
- 2234514 Макропористые хитозановые гранулы и способ их получения. Способ культивирования клеток
- 2133615 Средство для лечения неврологических заболеваний
- 2233164 Способ профилактики развития послеоперационных спаек брюшной полости
- 2133127 Неткатный материал, способ его получения и способ лечения
- 2333223 Альдегидные производные сиаловой кислоты и средства на их основе
- 2333007 Полипептидные вакцины для широкой защиты против рядов поколений менингококов с повышенной вирулентностью
- 2332985 Дозированные формы анестезирующих средств с длительным высвобождением для обезболивания
- 2132677 Косметическая маска
- 38603 Пленочный аппликатор
- 2232594 Средство содержащие ингибирующие остеокластогенез фактор и полисахарид
- 2332238 Средство для прокладок, раневых повязок и других изделий, контактирующих с кожей
- 2331668 Стромальные клетки, получение из жировой ткани, для заживления дефектов роговицы и внутриглазных дефектов и их использование
- 2331438 Альфа - 2 - Дельта Лигант для лечения симптомов нижних мочевыводящих путей
- 2331411Электропряденые аморфные фармоцевтические средства
- 2331367 Способ профилактики образования спаек и их рецидива
- 2130767 Масло в воде для получения косметических и дерматологических средств, способ косметической обработки
- 2230752 Поперечносшитые гиалуроновые кислоты и их применение в медицине
- 2230558 Способ восстановления и сохранения здоровья скмьи
- 2230550 Средства длительного высвобождения, способ их получения и применения
- 2230458 Поддержания здоровья суставов
- 2330290 Способ определения состояния метаболических процессов в ткани суставного хряща
- 2230073 Способ поперечного сшивания карбоксилированных полисахаридов
- 2329059 Способ лечения полипозного риносинусита
- 2329037 Комбинированная терапия для лечения иммуновоспалительных заболеваний
- 2128666 Гиалуроновая кислота и ее соли, способ очистки гиалуроновой кислоты, способ получения гиалуроновой кислоты. Фармацевтический препарат с гиалуроновой кислотой и средства с гиалуроновой кислотой используемые в офтальмологии
- 2328740 Способ экспресс - оценки действия зубных паст
- 2128502 Косметический гель
- 2328272 Суппозитории индуктора интерферона
- 2328268 Косметика содержащая амфолитный сополимер
- 2128057 Композиционная мембрана, способ ее получения и способ направленной регенерации тканей с ее применением
- 2128055 Средство замедленного освобождения и способ его получения
- 2128049 Свечи
- 2227743 Полипептидные варианты с повышенной гепаринсвязывающей способностью
- 2326893 Ковалентное и нековалентное сшивание гидрофильных полимеров
- 2326697 Новый перевязочный материал для быстрого заживления раневой поверхности кожи
- 2126264 Фармацевтическое средство с гиалуроновой кислотой
- 2326137 Способ получения содержащих альгинат пористых формованных изделий
- 2325902 Способ выделения гликозаминогликанов из минерализованной соединительной ткани
- 2225195 Репелленты против насекомых
- 2325193 Сосудистый стент
- 2325184 Улучшенные везикулы наружной мембраны бактерий
- 2325153 Многокомпонентная фармацевтическая дозированная форма
- 2325152 Удерживаемая в желудке система регулируемой доставки лекарственного средства
- 2029955 Способ предоперационного определения помутнения задней капсулы хрусталика при экстракции катаракты
- 2324688 Производные бисбензизоселеназолонила с противоопухолевым, противовоспалительным и антитромбоническим действием
- 2323017 Устройство и способ контролируемый доставки активных веществ в кожу
- 2323011 Содержащий Коллаген I и Коллаген II способный к рассасыванию внеклеточный матрикс, предназначенный для реконструирования хряща
- 2322955 Способ изготовления имплантанта для пластики дефектов хрящевой ткани
- 2322454 Антитело против CCR5
- 2322263 Система продолжительного высвобождения растворимого лекарственного средства
- 2221561 Витамин Е и его сложные эфиры
- 2321634 Гены участвующие в метаболизме углерода и продуцировании энергии
- 2321597 Биоматерьял, способ его приготовления и его применение, медицинское средство, имплантант и вкладыш
- 2121340 Средство для похудения
- 2220737 Средство для улучшения состояния опорно-двигательного аппарата
- 2220729 Гель используемый в стоматологии
- 2320720 Способ культивирования фибропластов для заместительной терапии
- 2320378 Накожный аппликатор
- 2320369 Средства, содержащие Альфа - 2 - Дельта Лиганды и ингибиторы обратного захвата серотонина/норадреналина
- 2320362 Местные фармацевтические средства, содержащие проантоцианидины, для лечения дерматитов
- 2320322 Биоадгезивная доставка лекарств
- 2320318 Чувствительное к температуре изменяющие состояние средство гидрогеля
- 2025120 Способ получения препарата, содержащего Фактор /G-CSF/, стимулирующий рост колоний гранулоцитов
- 2319490 Средство для введения железа при лечении синдрома беспокойных ног
- 25995 Содержащее адгезив приспособление для фиксации зубных протезов в полости рта
- 2218907 Средство для ухода за кожей лица и веками
- 2318830 Способ получения модифицированного дерматансульфата
- 2118153 Косметика - туш для ресниц
- 2217441 Способ получения полимера
- 2317296 Изетионатная соль селективного ингибитора CDK4
- 2217171 Мембрана для использования при направленной регенерации тканей
- 2317095 Экстракты ECHINACEA ANGUSTIFOLIA
- 2216332 Препарат для лечения астроза
- 2216314 Крем - маска для обезвоженной кожи
- 2316333 Средство оздоровительно-восстановительных косметических панто-магниевых ванн
- 2021304 Способ получения биологически активного средства
- 2115662 Способ получения гиалуроновой кислоты
- 2315627 Впрыскиваемые имплантанты на керамической основе для заполнения морщин, кожных впадин, шрамов
- 2315623 Средство получаемое путем лиофилизации препарата
- 2114862 Способ получения гиалуроновой кислоты
- 2314791 Лечебно-Косметическое средство
- 2314791 Косметический крем-бальзам для ухода за кожей лица и шеи
- 2214600 Способ оценки эффективности лечения неврологических проявлений
- 2114602 Способ косметической обработки
- 2114587 Раствор для защиты роговицы
- 2214283 Имплантант для подкожного или внутрикожного введения
- 2313370 Медицинские протезы, имеющие улучшенную биологическую совместимость
- 2313356 Препарат для лечения демодекоза
- 2313338 Средство на основе этиллинолеата и триэтилцитрата для лечения себореи и угрей
- 2313328 Косметика содержащая тонкодисперный и пористый порошок
- 2212880 Способ получения препарата содержащего антибиотик, с замедленным высвобождением активного вещества
- 2312640 Способ лечения Блефароконьюнктивальной формы синдрома сухого глаза
- 2017751 Способ получения гиалуроновой кислоты
- 2312145 Гены CORYNEBACTERIUM GLUTAMICUM, кодирующие белки, участвующие в синтезе мембран и мембранном транспорте
- 2311458 Белки вызывающие измененную иммуногенную реакцию. Способ их получения и использования
- 2311183 Улучшенное разделение с использованием гталуроновой кислоты
- 2311177 Ингибиторы интегрина для лечения заболевания глаз
- 2300069 Косметическая маска
- 2211024 Уход за сухой кожей
- 2310440 Раствор для защиты роговицы от повреждений
- 2309684 Лечение межфалангового остеоатроза узелковой формы
- 2309406 Способ мониторинга фиброза печени у больных хроническим гепатитом с (ХГС)
- 2209088 Опосредованная рецепторами доставка генов с использованием векторов на основе бактериофагов
- 2308967 Уменьшение объема ткани
- 2308962 Средство для опорно-дигательного аппарата
- 2308957 Способ получения препарата для мезотерапии
- 2308954 Средство для лечения ран, содержащее плазму или сыворотку крови
- 2308951 Комплексный способ профилактики вагинальных дисбактериозов
- 2308937 Косметическая биологически активная добавка и косметический литофитокомплекс на ее основе
- 2208638 ДНК (варианты), способ получения белка
- 2207885 Способ подачи небольшого объема лечебного раствора к целевому месту
- 2207858 Лишенные побочных эффектов производные простагландинов для лечения глаукомы
- 2207845 Твердая лекарственная форма пролонгированного действия
- 2207844 Препарат для местного неинвазивного применения
- 2207841 Средства с антиферментативным действием
- 2306335 Стволовые клетки и решетки полученные из жировой ткани
- 2306140 Новые рецепторы для Helicobacter pylori и их применение
- 2205612 Способ эндотелизации IN VITRO протезов кровеносных сосудов
- 2105540 Депигментирующее средство
- 2304960 Косметическое средство для кожи
- 2304616 Гены участвующие в гомеостазе и адаптации
- 2204550Способ получения длинноцепочечной N-Ацилированной кислотой Аминокислот
- 2204415 Способ получения изображения
- 2204394 Средство для лечения грибковых инфекций, желудочных язв
- 2204366 Способ хирургического лечения глаукомы
- 2104034 Вагинальное увлажняющие средство, способ его получения
- 2303991 Биологически активная добавка
- 2303990 БАД
- 2303973 Адсорбирующее изделие
- 2203676 Средство обладающее иммунокорригирующим действием
- 2203672 Способ предупреждения беременности
- 2303635 Гены кодирующие белки резистентности и толерантности к стрессам
- 2303529 Способ фиксации альгинатного геля на твердой фазе, способ получения клеточного чипа на его основе
- 2203078 Способ лечения гнойных ран
- 2302412 Гидразоно-малонитрилы
- 2102400 Способ получения гиалуроновой кислоты
- 2202356 Способ стимуляции репаративных процессов длительно незаживающих ран и трофических язв
- 2202336 Средство для ухода за кожей
- 2302231 Глазные капли
- 2102082 Способ магнитометрического исследования тела человека или животного
- 2301814 Полиакриламидный гидрогель
- 2201765 Гибридные матричные имплантанты и эксплантанты
- 2301677 Биотрансплантант для лечения дегенеративных и трвматических заболеваний хрящевой ткани и способ его получения
- 2301676 Способ лечения ревматизма
- 2301674 Способ лечения больных с переломами нижней челюсти
- 2301661 Средство с регулируемым освобождением и способ его получения
- 2005488 Средство для лечения болезней соединительной ткани
- 2200001 Крем для кожи
|
РОССИЙСКАЯ ФЕДЕРАЦИЯ

ФЕДЕРАЛЬНАЯ СЛУЖБА
ПО ИНТЕЛЛЕКТУАЛЬНОЙ СОБСТВЕННОСТИ
ПАТЕНТАМ И ТОВАРНЫМ ЗНАКАМ
|
Патент №2378010 |
(54) ЖИДКИЕ ВАКЦИНЫ ДЛЯ МНОЖЕСТВЕННЫХ СЕРОГРУПП МЕНИНГОКОККОВ
(57) Реферат:
Конъюгированные капсульные сахариды серогрупп В, С, W135 и Y N.meningitidis являются безопасными и иммуногенными для человека, когда объединены в однократной дозе. Этот эффект сохраняется при добавлении конъюгированного капсульного сахарида из серогруппы А. Данные конъюгированные антигены можно стабильно объединять в однократной водной дозе без необходимости лиофилизации. Широкого спектра защиты против инфекции серогруппой В можно достичь путем дополнительного применения определенных полипептидных антигенов - белок NadA в олигомерной форме, белки  741 741 , ,  936 936 , ,  955 955 , ,  287 287 , которые можно объединять с сахаридными антигенами нейссерий без потери защитной эффективности любой из пяти серогрупп. Эффективность вакцины сохраняется, например, при добавлении Hib-конъюгата. Эффективность конъюгата серогруппы W135 увеличивается при добавлении белковых антигенов, происходящих из штамма нейссерий серогруппы В. При добавлении Hib-конъюгата к менингококковым конъюгатам увеличивается общая активность против серогруппы W135 менингококка. Полученные на основе капсульных антигенов водные иммуногенные композиции (варианты) предназначены для иммунизации против бактериального менингита, индуцируя специфический иммунный ответ у млекопитающего. При использовании в составе композиции антигена Hib и антигена Str. pneumoniae обеспечивается профилактическая защита млекопитающего пробив заболевания, вызванного H.influenzae типа В и Str. pneumoniae. Полученные водные вакцинные композиции обеспечивают широкий спектр иммунологической защиты против инфекции менингококками серогруппы В. 8 н. и 11 з.п. ф-лы, 9 табл. , которые можно объединять с сахаридными антигенами нейссерий без потери защитной эффективности любой из пяти серогрупп. Эффективность вакцины сохраняется, например, при добавлении Hib-конъюгата. Эффективность конъюгата серогруппы W135 увеличивается при добавлении белковых антигенов, происходящих из штамма нейссерий серогруппы В. При добавлении Hib-конъюгата к менингококковым конъюгатам увеличивается общая активность против серогруппы W135 менингококка. Полученные на основе капсульных антигенов водные иммуногенные композиции (варианты) предназначены для иммунизации против бактериального менингита, индуцируя специфический иммунный ответ у млекопитающего. При использовании в составе композиции антигена Hib и антигена Str. pneumoniae обеспечивается профилактическая защита млекопитающего пробив заболевания, вызванного H.influenzae типа В и Str. pneumoniae. Полученные водные вакцинные композиции обеспечивают широкий спектр иммунологической защиты против инфекции менингококками серогруппы В. 8 н. и 11 з.п. ф-лы, 9 табл.
Все цитируемые документы приведены здесь в качестве ссылки в полном объеме.
Область техники
Настоящее изобретение относится к иммунизации против бактериальных менингитов и конкретно к комбинированной иммунизации против бактериальных менингитов, вызванных множественными патогенами.
Предшествующий уровень техники
N.meningitidis представляет собой неподвижный грамотрицательный патоген человека, заселяющий глотку и вызывающий менингит (и иногда сепсис в отсутствие менингита). Он вызывает как эндемическое, так и эпидемическое заболевание. После введения конъюгированной вакцины против Haemophilus influenzae типа B (Hib), N.meningitidis является основной причиной бактериальных менингитов в США. Третьим патогеном, ответственным за бактериальные менингиты, является Streptococcus pneumoniae, но в настоящее время доступна эффективная вакцина (PrevNar [1]). Как и Hib-вакцина, пневмококковая вакцина основана на конъюгированных капсульных сахаридных антигенах. [1]). Как и Hib-вакцина, пневмококковая вакцина основана на конъюгированных капсульных сахаридных антигенах.
Исходя из капсульного полисахарида организма идентифицировали различные серогруппы N.meningitidis, включая (A, B, C, H, I, K, L, 29E, W135, X, Y и Z). Серогруппа A представляет собой патоген, наиболее часто вовлеченный в эпидемическое заболевание в Африке к югу от Сахары. Серогруппы B и C ответственны за подавляющее большинство случаев в Соединенных Штатах и в наиболее развитых странах. Серогруппы W135 и Y ответственны за остальные случаи в Соединенных Штатах и в развитых странах. Хотя капсульный полисахарид является эффективным защитным иммуногеном, каждая серогруппа нуждается в отдельном сахаридном антигене, и данный подход не подходит для иммунизации против серогруппы B. Таким образом, недавний успех с конъюгированными сахаридными вакцинами против серогруппы C (Menjugate [2], Meningitec [2], Meningitec и NeisVac-C и NeisVac-C ) не повлиял на заболевание, вызванное серогруппами A, B, W135 или Y; напротив, показано селективное давление в пользу проявления данных серогрупп в качестве основных причин менингококкового заболевания. ) не повлиял на заболевание, вызванное серогруппами A, B, W135 или Y; напротив, показано селективное давление в пользу проявления данных серогрупп в качестве основных причин менингококкового заболевания.
В течение многих лет известна и лицензирована для применения на человеке пригодная для инъекций тетравалентная вакцина из капсульных полисахаридов серогрупп A, C, Y и W135 [3, 4]. В данной вакцине полисахариды не конъюгированы и присутствуют в соотношении по весу 1:1:1:1 [5], с 50 мкг каждого очищенного полисахарида. Несмотря на эффективность для подростков и взрослых у детей она индуцирует слабый иммунный ответ и короткую продолжительность защиты, и ее нельзя применять [например, ссылка 6]. Кроме того, вакцины страдают недостатком необходимости восстановления из лиофилизированной формы во время применения.
Доказано, что трудно получить вакцину для серогруппы B. Тестированы вакцины на основе везикул из наружной мембраны [например, ссылка 7], но, как правило, защита ограничена штаммом, применяемым для получения вакцины.
Таким образом, остается необходимость в вакцине для детей, защищающей против менингококковых серогрупп A, C, W135 и Y, и также вакцины, не требующей разбавления перед введением. Кроме того, остается необходимость в вакцине с широким спектром защиты против серогруппы B.
Описание изобретения
Изобретение соответствует всем этим различным требованиям и основано на восьми отдельных результатах. Во-первых, авторы изобретения обнаружили, что конъюгированные капсульные сахариды менингококковых серогрупп C, W135 и Y являются безопасными и иммуногенными для человека, когда объединены в однократной дозе. Во-вторых, авторы обнаружили, что данный эффект сохраняется при добавлении конъюгированного капсульного сахарида серогруппы A. В-третьих, авторы обнаружили, что данные конъюгированные антигены можно стабильно объединять в однократной водной дозе без необходимости лиофилизации. В-четвертых, авторы обнаружили, что широкой защиты против инфицирования серогруппой B можно достичь применением малого числа определенных полипептидных антигенов. В-пятых, авторы обнаружили, что указанные полипептидные антигены можно объединять с сахаридными антигенами без потери защитной эффективности для любой из пяти серогрупп. В-шестых, авторы обнаружили, что эффективность сохраняется даже при добавлении Hib-конъюгата. В-седьмых, авторы обнаружили, что эффективность конъюгата серогруппы W135 увеличивается при добавлении белковых антигенов, происходящих из штамма серогруппы B. Наконец, авторы изобретения обнаружили, что при добавлении Hib-конъюгата к менингококковым конъюгатам увеличивается общая активность против серогруппы W135 менингококка.
Таким образом, изобретение относится к водной иммуногенной композиции, которая после введения субъекту способна индуцировать иммунный ответ, бактерицидный в отношении серогрупп B, C, W135 и Y N.meningitidis, причем композиция состоит из (i) конъюгированного капсульного сахаридного антигена серогруппы C; (ii) конъюгированного капсульного сахаридного антигена серогруппы W135; (iii) конъюгированного капсульного сахаридного антигена серогруппы Y; и (iv) одного или нескольких полипептидных антигенов серогруппы B. Водная композиция может также индуцировать иммунный ответ, бактерицидный в отношении серогруппы A N.meningitidis, и, таким образом, может дополнительно содержать (v) конъюгированный капсульный сахаридный антиген серогруппы A.
Изобретение относится также к водной иммуногенной композиции, которая после введения субъекту способна индуцировать иммунный ответ, который является (a) бактерицидным против по меньшей мере серогруппы W135 N.meningitidis и (b) защитным против заболевания, вызванного H.influenzae типа b, где композиция состоит из (i) конъюгированного капсульного сахаридного антигена серогруппы W135; (ii) конъюгированного капсульного сахаридного антигена H.influenzae типа b. Композиция дополнительно может содержать конъюгированные капсульные сахаридные антигены серогрупп C и Y и, необязательно, A. Она дополнительно может содержать полипептидные антигены серогруппы B N.meningitidis.
Предпочтительными сахаридными антигенами являются олигосахариды.
Серогруппы C, W135 и Y
Технологии получения капсульных полисахаридов из менингококков известны много лет и, как правило, включают в себя способ, предусматривающий стадии осаждения полисахаридов (например, с применением катионного детергента), фракционирования этанолом, холодной фенольной экстракции (для удаления белка) и ультрацентрифугирования (для удаления LPS) [например, см. ссылку 8].
Более предпочтительный способ [9] предусматривает осаждение полисахарида с последующим растворением осажденного полисахарида с применением низшего спирта. Осаждение можно проводить с применением катионного детергента, такого как соли тетрабутиламмония и цетилтриметиламмония (например, бромистые соли) или бромида гексадиметрина и солей миристилтриметиламмония. Особенно предпочтительным является бромид цетилтриметиламмония ('CTAB') [10]. Растворения осажденного вещества можно достичь применением низшего спирта, такого как метанол, пропан-1-ол, пропан-2-ол, бутан-1-ол, бутан-2-ол, 2-метилпропан-1-ол, 2-метилпропан-2-ол, диолы и т.д., но этанол особенно пригоден для растворения CTAB-полисахаридных комплексов. Этанол можно добавлять к осажденному полисахариду для получения конечной концентрации этанола между 50% и 95% (исходя из общего содержания этанола и воды).
После перерастворения полисахариды можно дополнительно обрабатывать для удаления примесей. Это особенно важно в ситуациях, где неприемлемо даже незначительное загрязнение (например, при получении вакцины для человека). Как правило, это предусматривает одну или несколько стадий фильтрации, например можно применять объемную фильтрацию, фильтрацию через активированный уголь, фильтрацию по размеру и/или ультрафильтрацию.
После фильтрации для удаления загрязнений полисахариды можно осадить для дальнейшей обработки и/или переработки. Это легко осуществить обменом катионов (например, добавлением солей кальция или натрия).
После очистки капсульные полисахариды конъюгируют с белками-носителями, как описано ниже.
Дополнительные и альтернативные способы очистки и конъюгации менингококковых сахаридов описаны в ссылках 11 и 12.
В качестве альтернативы очистке капсульные сахариды согласно изобретению можно получить путем полного или частичного синтеза, например, синтез Hib описан в ссылке 13, и синтез MenA в ссылке 14.
Сахарид может быть химически модифицированным, например, O-ацетилирован или де-O-ацетилирован. Любое такое де-O-ацетилирование или гиперацетилирование может присутствовать в конкретных положениях в сахариде. Например, большинство штаммов серогруппы C обладают O-ацетильными группами в положении C-7 и/или C-8 остатков сиаловой кислоты, но приблизительно у 15% клинических изолятов данные O-ацетильные группы отсутствуют [15,16]. По-видимому, ацетилирование не влияет на защитную эффективность (например, в отличие от продукта Menjugate , в продукте NeisVac-C , в продукте NeisVac-C применяют де-O-ацетилированный сахарид, но обе вакцины эффективны). Сахарид серогруппы W135 представляет собой полимер дисахаридных звеньев сиаловой кислоты-галактозы. Сахарид серогруппы Y подобен сахариду серогруппы W135 за исключением того, что повторяющееся дисахаридное звено содержит глюкозу вместо галактозы. Подобно сахаридам серогруппы C сахариды MenW135 и MenY обладают изменяющимся O-ацетилированием, но по сиаловой кислоте в положениях 7 и 9 [17]. Любые такие химические модификации предпочтительнее проводить перед конъюгацией, но альтернативно или дополнительно можно проводить во время конъюгации. применяют де-O-ацетилированный сахарид, но обе вакцины эффективны). Сахарид серогруппы W135 представляет собой полимер дисахаридных звеньев сиаловой кислоты-галактозы. Сахарид серогруппы Y подобен сахариду серогруппы W135 за исключением того, что повторяющееся дисахаридное звено содержит глюкозу вместо галактозы. Подобно сахаридам серогруппы C сахариды MenW135 и MenY обладают изменяющимся O-ацетилированием, но по сиаловой кислоте в положениях 7 и 9 [17]. Любые такие химические модификации предпочтительнее проводить перед конъюгацией, но альтернативно или дополнительно можно проводить во время конъюгации.
Сахариды из различных серогрупп предпочтительнее очищать отдельно, и затем их можно объединить до или после конъюгации.
Серогруппа A
Композиции согласно изобретению могут содержать конъюгированный капсульный сахаридный антиген серогруппы A. Сахарид можно очистить и конъюгировать таким же способом, как для серогрупп C, W135 и Y (см. выше), хотя он структурно отличается, в то время как капсулы серогрупп C, W135 и Y основаны на сиаловой кислоте (N-ацетилнейраминовой кислоте, NeuAc), капсула серогруппы A основана на N-ацетилманнозамине, являющемся природным предшественником сиаловой кислоты. Сахарид серогруппы A особенно чувствителен к гидролизу, и его нестабильность в водной среде означает, что (a) иммуногенность жидких вакцин против серогруппы A со временем уменьшается, и (b) контроль качества более труден из-за высвобождения продуктов гидролиза сахарида в вакцине.
Природный капсульный сахарид MenA представляет собой гомополимер ( 1 1 6)-связанный N-ацетил-D-маннозамино-1-фосфат с частичным O-ацетилированием по C3 и C4. Главной гликозидной связью является 1-6 фосфодиэфирная связь, затрагивающая полуацетальную группу Cl и спиртовую группу C6 D-маннозамина. Средняя длина цепи составляет 93 мономера. Она имеет следующую формулу: 6)-связанный N-ацетил-D-маннозамино-1-фосфат с частичным O-ацетилированием по C3 и C4. Главной гликозидной связью является 1-6 фосфодиэфирная связь, затрагивающая полуацетальную группу Cl и спиртовую группу C6 D-маннозамина. Средняя длина цепи составляет 93 мономера. Она имеет следующую формулу:
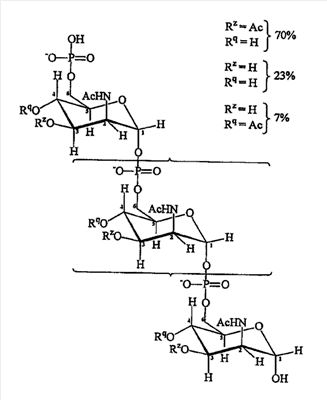
Авторы изобретения получили модифицированный сахаридный антиген, сохраняющий иммуногенную активность природного сахарида серогруппы A, но гораздо более стабильный в воде. Гидроксильные группы, соединенные с атомами углерода 3 и 4 в моносахаридном звене, заменили на защитную группу [ссылка 18].
Число моносахаридных звеньев, имеющих защитные группы вместо гидроксилов, может различаться. Например, защитные группы могут иметь все или в основном все моносахаридные звенья. В качестве альтернативы защитные группы могут иметь по меньшей мере 10%, 20%, 30%, 40%, 50%, 60%, 70%, 80% или 90% моносахаридных звеньев. Защитные группы могут иметь по меньшей мере 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26 ,27, 28, 29 или 30 моносахаридных звеньев.
Подобным образом может изменяться число защитных групп в моносахаридном звене. Например, число защитных групп в любом конкретном моносахаридном звене может составлять 1 или 2.
Концевое моносахаридное звено может иметь или не иметь защитную группу вместо своего природного гидроксила. Предпочтительнее оставлять свободную аномерную гидроксильную группу в концевом моносахаридном звене для предоставления возможности дальнейших реакций (например, конъюгации). Аномерные гидроксильные группы можно перевести в аминогруппы (-NH2 или -NH-E, где E представляет собой защищающую азот группу) путем восстановительного аминирования (например, с применением NaBH3CN/NH4Cl) и затем можно окислить после перевода других гидроксильных групп в защитные группы.
Защитные группы для замещения гидроксильных групп можно вводить напрямую посредством реакции дериватизации гидроксильной группы, т.е. путем замещения атома водорода гидроксильной группы другой группой.
Подходящие производные гидроксильных групп, действующие как защитные группы, представляют собой, например, карбаматы, сульфонаты, карбонаты, сложные эфиры, простые эфиры (например, силиловые эфиры или алкиловые эфиры) и ацетали. Некоторые конкретные примеры таких защитных групп представляют собой аллил, Aloc, бензил, BOM, трет-бутил, тритил, TBS, TBDPS, TES, TMS, TIPS, PMB, MEM, MOM, MTM, THP и др. Другие защитные группы, не вводимые напрямую и полностью замещающие гидроксильную группу, включают в себя C1-12-алкил, C3-12-алкил, C5-12-арил, C5-12-арил-C1-6-алкил, NR1R2 (Rl и R2 определены в следующем абзаце), H, F, Cl, Br, CO2H, CO2(C1-6-алкил), CN, CF3, CCl3 и т.д.
Предпочтительные защитные группы имеют формулу -O-X-Y или -OR3, где X представляет собой C(O), S(O) или SO2; Y представляет собой C1-12-алкил, C1-12-алкокси, C3-12-циклоалкил, C5-12-арил или C5-12-арил-C1-6-алкил, каждый из которых, необязательно можно заменить 1, 2 или 3 группами, независимо выбранными из F, Cl, Br, CO2H, CO2(C1-6-алкила), CN, CF3 или CCl3; или Y представляет собой NRlR2; R1 и R2 независимо выбирают из H, Cl-12-алкила, C3-12-циклоалкила, C5-12-арила, C5-12-арил-C1-6-алкила; или Rl и R2 можно объединить для формирования C3-12-насыщенной гетероциклической группы; R3 представляет собой C1-12-алкил, или C3-12-циклоалкил, каждый из которых, необязательно, можно заменить 1, 2 или 3 группами, независимо выбранными из F, Cl, Br, CO2(C1-6-алкила), CN, CF3 или CCl3; или R3 представляет собой C5-12-арил или C5-12-арил-C1-6-алкил, каждый из которых, необязательно, можно заменить 1, 2, 3, 4 или 5 группами, выбранными из F, Cl, Br, CO2H CO2(C1-6-алкила), CN, CF3 или CCl3. Когда R3 представляет собой C1-12-алкил или C3-12-циклоалкил, он, как правило, замещен 1, 2 или 3 группами, как определено выше. Когда Rl и R2 объединены для формирования C3-12-насыщенной гетероциклической группы, это означает, что Rl и R2 вместе с атомом азота формируют насыщенную гетероциклическую группу, содержащую любое число атомов углерода между 3 и 12 (например, C3, C4, C5, C6, C7, C8, C9, Cl0, CII, C12). Гетероциклическая группа может содержать 1 или 2 гетероатома (таких как N, O или S), отличных от атома азота. Примерами C3-12-насыщенной гетероциклической группы являются пирролидинил, пиперидинил, морфолинил, пиперазинил, имидазолидинил, азетидинил и азиридинил.
Защитные группы -O-X-Y и -OR3 можно получить из групп -OH посредством общепринятых процедур дериватизации, таких как реакция гидроксильной группы с ацилгалогенидом, алкилгалогенидом, сульфонилгалогенидом и т.д. Следовательно, атом кислорода в -O-X-Y предпочтительнее представляет собой атом кислорода гидроксильной группы, в то время как группа -X-Y в -O-X-Y предпочтительно замещает атом водорода гидроксильной группы.
В качестве альтернативы защитные группы можно вводить посредством реакции замещения, такой как замещение по типу Mitsonobu. Эти и другие способы получения защитных групп из гидроксильных групп хорошо известны.
Более предпочтительно защитная группа представляет собой -OC(O)CF3 [19] или карбаматную группу -OC(O)NRlR2, где Rl и R2 выбраны независимо из C1-6-алкила. Более предпочтительно R1 и R2 представляют собой метил, т.е. защитная группа представляет собой -OC(O)NMe2. Карбаматная защитная группа оказывает стабилизирующий эффект на гликозидную связь и может быть получена в мягких условиях.
Предпочтительные модифицированные сахариды MenA содержат n моносахаридных звеньев, где по меньшей мере h% моносахаридных звеньев не имеют -OH-групп в обоих положениях 3 и 4. Величина h составляет 24 или более (например, 25, 26, 27, 28, 29, 30, 35, 40, 45, 50, 55, 60, 65, 70, 75, 80, 85, 90, 95, 98, 99 или 100) и предпочтительнее составляет 50 или более. Отсутствующие -OH-группы предпочтительнее представляют собой защитные группы, как определено выше.
Другие предпочтительные модифицированные сахариды MenA содержат моносахаридные звенья, где по меньшей мере s моносахаридных звеньев не имеют -OH в положении 3 и не имеют -OH в положении 4. Величина s составляет по меньшей мере 1 (например, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 35, 40, 45, 50, 60, 70, 80, 90). Отсутствующие -OH-группы предпочтительнее представляют собой защитные группы, как определено выше.
Модифицированные сахариды MenA, пригодные для применения согласно изобретению, обладают формулой:
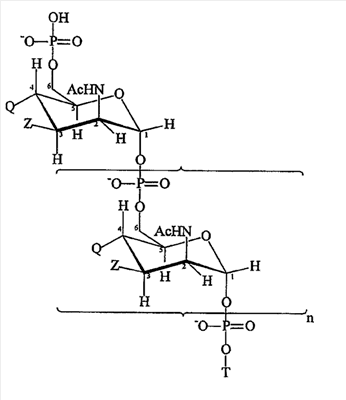
где
n представляет собой целое число от 1 до 100 (предпочтительно целое число от 5 до 25, более предпочтительно 15-25);
T выбран из формулы (A) или (B):
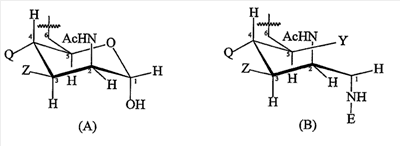
каждая группа Z независимо выбрана из OH или защитной группы, как определено выше; и
каждая группа Q независимо выбрана из OH или защитной группы, как определено выше;
Y выбран из OH или защитной группы, как определено выше;
E представляет собой H или защитную группу азота;
и где более чем приблизительно 7% (например, 8%, 9%, 10% или более) групп Q представляют собой защитные группы.
Каждая из n+2 групп Z может быть одинаковой или отличаться одна от другой. Подобным образом каждая из n+2 групп Q может быть одинаковой или отличаться одна от другой. Все группы Z могут представлять собой OH. Альтернативно по меньшей мере 10%, 20%, 30%, 40%, 50% или 60% групп Z могут являться OAc. Предпочтительнее приблизительно 70% групп Z являются OAc, а остальные группы Z представляют собой OH или защитные группы, как определено выше. По меньшей мере 7% групп Q представляют собой защитные группы. Предпочтительно по меньшей мере 10%, 20%, 30%, 40%, 50%, 60%, 70%, 80%, 90% или даже 100% групп Q представляют собой защитные группы.
Предпочтительными защитными группами являются группы, поглощающие электрон. Не желая связывать себя теорией, авторы считают, что гликозидные связи нестабильны к гидролизу из-за содействия внутримолекулярных нуклеофильных атак гидроксильной группы сахарида на гликозидную связь (т.е. посредством формирования циклического промежуточного соединения). Чем больше нуклеофильность гидроксильной группы, тем больше тенденция к внутримолекулярной нуклеофильной атаке. Поглощающая электрон защитная группа оказывает эффект делокализации отдельной пары кислорода, таким образом уменьшая нуклеофильность кислорода и уменьшая тенденцию к внутримолекулярной нуклеофильной атаке.
Следовательно, для защиты против серогруппы A водные композиции могут содержать модифицированный сахарид MenA, как определено выше.
Предпочтительные композиции согласно изобретению можно хранить 28 суток при 37°C и после этого периода менее чем f% начального общего количества конъюгированного сахарида MenA становится неконъюгированным, где f составляет 20, 19, 18, 17, 16, 15, 14, 13, 12, 11, 10, 9, 8, 7, 6, 5 или ниже.
Ковалентная конъюгация
Капсульные сахариды в композициях согласно изобретению, как правило, конъюгируют с белком-носителем (белками-носителями). Как правило, конъюгация улучшает иммуногенность сахаридов, так как превращает их из T-независимых антигенов в T-зависимые антигены, что позволяет примирование для иммунологической памяти. Конъюгация особенно полезна для педиатрических вакцин и является хорошо известным способом [например, рассматриваемым в ссылках 20-29].
Предпочтительными белками-носителями являются бактериальные токсины или анатоксины, такие как дифтерийный анатоксин или столбнячный анатоксин, или мутант дифтерийного токсина CRM197 [30-32]. Другие пригодные белки-носители включают в себя белок наружной мембраны N.meningitidis [33], синтетические пептиды [34, 35], белки теплового шока [36, 37], белки возбудителя коклюша [38, 39], цитокины [40], лимфокины [40], гормоны [40], факторы роста [40], искусственные белки, содержащие множественные эпитопы CD4+ T-клеток человека для разных полученных из патогенов антигенов [41], таких как белок N19 [42], белок D из H.influenzae [43, 44], пневмолизин [45], поверхностный белок пневмококка PspA [46], железосвязывающие белки [47], токсин A или B из C.difficile [48], мутантные бактериальные токсины (например, холерный токсин 'CT' или термолабильный токсин 'LT' E.coli), такие как CT с заменой Glu-29 [49], и т.д. Предпочтительными носителями являются дифтерийный анатоксин, столбнячный анатоксин, белок D H.influenzae и особенно CRM197.
В композиции согласно изобретению можно применять более одного белка-носителя, например, чтобы уменьшить риск подавления носителем. Так, различные белки-носители можно применять для различных серогрупп, например, сахариды серогруппы A можно конъюгировать с CRM197, в то время как сахариды серогруппы C можно конъюгировать со столбнячным анатоксином. Можно также применять более одного белка-носителя для конкретного сахаридного антигена, например, сахариды серогруппы A могут присутствовать в двух группах, некоторые конъюгированные с CRM197, а другие конъюгированные со столбнячным анатоксином. Однако, как правило, предпочтительнее применять один и тот же белок-носитель для всех серогрупп, и CRM197 является предпочтительным выбором.
Один белок-носитель может нести более одного сахаридного антигена [50]. Например, один белок-носитель можно конъюгировать с сахаридами серогрупп A и C. Для достижения этой цели сахариды можно смешивать перед реакцией конъюгации. Однако, как правило, предпочтительнее получать отдельные конъюгаты для каждой серогруппы.
Предпочтительными являются конъюгаты с соотношением сахарид:белок (мас./мас.) между 1:5 (т.е. избыток белка) и 5:1 (т.е. избыток сахарида). Предпочтительными являются соотношения между 1:2 и 5:1, как наиболее предпочтительными являются соотношения между 1:1,25 и 1:2,5. Избыток белка-носителя может являться предпочтительным для MenA и MenC.
Конъюгаты можно применять совместно со свободным белком-носителем [51]. Когда данный белок-носитель присутствует в композиции согласно изобретению и в свободной, и в конъюгированной форме, неконъюгированная форма предпочтительнее составляет не более 5% общего количества белка-носителя в композиции в целом, и более предпочтительно присутствует менее чем в 2 мас.%.
Можно применять любую подходящую реакцию конъюгации, с любым подходящим линкером, где необходимо.
Как правило, перед конъюгацией сахарид активируют или вводят функциональные группы. Активация может предусматривать, например, цианирующие реагенты, такие как CDAP (т.е. тетрафторборат 1-циано-4-диметиламинопиридина [52, 53 и т.д.]). Другие подходящие способы предусматривают карбодиимиды, гидразиды, активные сложные эфиры, норборнан, p-нитробензойную кислоту, N-гидроксисукцинимид, S-NHS, EDC, TSTU (см. также введение к ссылке 27).
Соединения через линкерную группу можно осуществить с применением любой известной процедуры, например процедур, описанных в ссылках 54 и 55. Один тип соединения привлекает восстановительное аминирование полисахарида, соединяя полученную аминогруппу с одним концом линкерной группы адипиновой кислоты и затем соединяя белок с другим концом линкерной группы адипиновой кислоты [25, 56, 57]. Другие линкеры включают в себя B-пропионамид [58], нитрофенилэтиламин [59], галоидангидриды галоидзамещенных кислот [60], гликозидные соединения [61], 6-аминокапроновую кислоту [62], ADH [63], C4-C12-группы [64] и т.д. В качестве альтернативы применению линкера можно применять прямое связывание. Прямое связывание с белком может предусматривать окисление полисахарида с последующим восстановительным аминированием с белком, как описано, например, в ссылках 65 и 66.
Предпочтительным является процесс, предусматривающий введение аминогрупп в сахарид (например, замещением концевых =O групп на -NH2) с последующей дериватизацией сложным диэфиром адипиновой кислоты (например, сложным диэфиром адипиновой кислоты и N-гидроксисукцинимида) и реакцией с белком-носителем. Другая предпочтительная реакция предусматривает активацию CDAP с белком-носителем D, например, для MenA или MenC.
После конъюгации свободные и конъюгированные сахариды можно разделить. Существует множество подходящих способов, предусматривающих гидрофобную хроматографию, тангенциальную ультрафильтрацию, диафильтрацию и т.д. [см. также ссылки 67 и 68 и т.д.].
Когда композиция согласно изобретению содержит конъюгированный олигосахарид, предпочтительно, чтобы получение олигосахарида предшествовало конъюгации.
После конъюгации способы согласно изобретению могут предусматривать стадию измерения уровня неконъюгированного белка-носителя. Один из способов проведения данного измерения предусматривает капиллярный электрофорез [69] (например, в свободном растворе) или мицеллярную электрокинетическую хроматографию [70].
После конъюгации способы согласно изобретению могут предусматривать стадию измерения уровня неконъюгированного сахарида. Один из способов проведения данного измерения предусматривает HPAEC-PAD [67].
После конъюгации способы согласно изобретению могут предусматривать стадию отделения конъюгированного сахарида от неконъюгированного сахарида. Один из способов разделения этих сахаридов предусматривает применение способа, избирательно осаждающего один из компонентов. Предпочтительным является осаждение конъюгированного сахарида, чтобы оставлять неконъюгированный сахарид в растворе, например, обработка деоксихолатом [67].
После конъюгации способы согласно изобретению могут предусматривать стадию измерения размера молекул и/или молярной массы конъюгата. В частности, можно измерять распределение. Один из способов проведения данных измерений предусматривает эксклюзионную хроматографию с детекцией многоугловой светорассеивающей фотометрией и дифференциальной рефрактометрией (SEC-MALS/RI) [71].
Олигосахариды
Как правило, капсульные сахариды применяют в форме олигосахаридов. Их легко получают фрагментацией очищенного капсульного полисахарида (например, гидролизом), как правило, с последующей очисткой фрагментов желаемого размера.
Предпочтительно проводить фрагментацию полисахаридов для получения конечной средней степени полимеризации (DP) олигосахарида менее 30 (например, между 10 и 20, предпочтительно около 10 для серогруппы A; между 15 и 25 для серогрупп W135 и Y, предпочтительно около 15-20; между 12 и 22 для серогруппы C и т.д.). DP можно легко измерить ионообменной хроматографией или колориметрическими анализами [72].
Если проводят гидролиз, гидролизат, как правило, сортируют по размеру для удаления коротких олигосахаридов [73]. Этого можно достичь различными способами, такими как ультрафильтрация с последующей ионообменной хроматографией. Олигосахариды со степенью полимеризации, меньшей или равной приблизительно 6, предпочтительно удаляют для серогруппы A и со степенью полимеризации, меньшей или равной приблизительно 4, предпочтительно удаляют для серогрупп W135 и Y.
Химический гидролиз сахаридов, как правило, предусматривает обработку кислотой или основанием при условиях, общепринятых в данной области. Условия деполимеризации капсульных сахаридов до составляющих их моносахаридов известны в данной области. Один из способов деполимеризации предусматривает применение перекиси водорода [11]. Перекись водорода добавляют к сахариду (например, для достижения конечной концентрации H2O2 1%) и затем смесь инкубируют (например, приблизительно при 55°C) до достижения желаемого уменьшения длины цепи. Уменьшение можно сопровождать в течение долгого времени отбором образцов из смеси и затем измерением (среднего) размера молекул сахарида в образце. Затем деполимеризацию можно остановить быстрым охлаждением, сразу после достижения желаемой длины цепи.
Серогруппа B
Вакцины против патогенов, таких как вирус гепатита B, дифтерия и столбняк, как правило, содержат один белковый антиген (например, поверхностный антиген HBV или столбнячный анатоксин). Напротив, бесклеточная коклюшная вакцина, как правило, содержит по меньшей мере три белка B.pertussis, а пневмококковая вакцина PrevNar содержит семь отдельных конъюгированных сахаридных антигенов. Другие вакцины, такие как клеточные коклюшные вакцины, вакцина против кори, инактивированная полиовакцина (IPV) и менингококковые вакцины OMV, по самой своей природе представляют собой сложные смеси большого числа антигенов. Таким образом, от интересующего патогена зависит, можно ли обеспечить защиту против него посредством отдельного антигена, небольшого числа определенных антигенов или сложной смеси неопределенных антигенов. содержит семь отдельных конъюгированных сахаридных антигенов. Другие вакцины, такие как клеточные коклюшные вакцины, вакцина против кори, инактивированная полиовакцина (IPV) и менингококковые вакцины OMV, по самой своей природе представляют собой сложные смеси большого числа антигенов. Таким образом, от интересующего патогена зависит, можно ли обеспечить защиту против него посредством отдельного антигена, небольшого числа определенных антигенов или сложной смеси неопределенных антигенов.
Как упомянуто выше, доказано, что трудно получить вакцину для серогруппы B. Вакцины, основанные на OMV, демонстрируют ограниченную эффективность. Кроме того, в OMV присутствует большое число неопределенных антигенов, что в сочетании с их изменчивой природой означает наличие для OMV различных проблем контроля качества.
Авторы изобретения обнаружили, что можно достичь широкого спектра защиты против инфекции серогруппой B и этого можно достичь применением малого числа определенных полипептидных антигенов серогруппы B, и, таким образом, композиции согласно изобретению содержат один или несколько полипептидных антигенов, таких что композиция может индуцировать иммунный ответ, бактерицидный против двух или более (например, 2 или 3) гипервирулентных линий A4, ET-5 и линии 3 N.meningitidis серогруппы B.
Опубликованы последовательности генома менингококков серогрупп A [74] и B [75, 76], и подходящие антигены можно выбрать из кодируемых полипептидов [например, ссылки 77-82]. Кандидатов на роль антигенов модифицировали для улучшения гетерологичной экспрессии [ссылки 83-85].
Одна из предпочтительных композиций содержит белок Tbp и белок Hsf [86]. Hsf представляет собой белок-автотранспортер [87-89], известный также как nhhA [89], GNA0992 [77] или NMB0992 [75]. Tbp представляет собой белок, связывающий трансферрин [90-93], и охватывает TbpA, TbpB и формы TbpA и TbpB с высокой и низкой молекулярной массой. Tbp охватывает отдельные белки, описанные выше, и комплексы данных белков и любых других белков и их комплексов, способных связывать трансферрин. Хотя Tbp может относиться к формам TbpA или TbpB с высокой или низкой молекулярной массой, предпочтительнее, чтобы присутствовали формы TbpA и/или TbpB и с высокой, и с низкой молекулярной массой. Наиболее предпочтительно присутствие TbpA с высокой и с низкой молекулярной массой.
Другая предпочтительная композиция содержит липоолигосахарид серогруппы B (LOS) [94]. LOS можно применять в дополнение к полипептиду (полипептидам) серогруппы B или вместо него/них.
Другая предпочтительная композиция содержит по меньшей мере один антиген, выбранный из каждой по меньшей мере двух различных категорий белков, обладающих различными функциями у Neisseria. Примеры таких категорий белков включают в себя: адгезины, белки-автотранспортеры, токсины, интегральные белки наружной мембраны и железосвязывающие белки. Данные антигены могут быть с применением номенклатуры ссылки 95 выбраны следующим образом: по меньшей мере один адгезин Neisseria, выбранный из группы, включающей в себя FhaB, NspA, PilC, Hsf, Hap, MafA, MafB, Omp26, NMB0315, NMB0995, NMB1119 и NadA; по меньшей мере один автотранспортер Neisseria, выбранный из группы, включающей в себя Hsf, Hap, протеазу IgA, AspA и NadA; по меньшей мере один токсин Neisseria, выбранный из группы, включающей в себя FrpA, FrpC, FrpA/C, VapD, NM-ADPRT(NMB1343) и любой или оба из LPS иммунотипа L2 и LPS иммунотипа L3; по меньшей мере один Fe-связывающий белок Neisseria, выбранный из группы, включающей в себя TbpA, TbpB, LbpA, LbpB, HpuA, HpuB, Lipo28 (GNA2132), Sibp, NMB0964, NMB0293, FbpA, Bcp, BfrA, BfrB и P2086 (XthA); по меньшей мере один мембраносвязанный белок Neisseria, предпочтительно белок наружной мембраны, в частности, интегральный белок наружной мембраны, выбранный из группы, включающей в себя PilQ, OMP85, FhaC, NspA, TbpA, LbpA, TspA, TspB, TdfH, PorB, MItA, HpuB, HimD, HisD, GNA1870, OstA, HlpA (GNA1946), NMB1124, NMB1162, NMB1220, NMB1313, NMB1953, HtrA, и PLDA (OMPLA). Указано, что данные сочетания антигенов Neisseria приводят к неожиданному улучшению эффективности вакцины против инфекции Neisseria [95].
Особенно предпочтительные композиции включают в себя один или несколько из следующих пяти антигенов [96]: (1) белок 'NadA', предпочтительно в олигомерной форме (например, в тримерной форме); (2) белок '741'; (3) белок '936'; (4) белок '953'; и (5) белок '287'.
'NadA' (адгезин A Neisseria) из MenB обозначен как белок '961' в ссылке 80 (SEQ ID 2943 и 2944) и как 'NMB1994' в ссылке 75 (см. также инвентарные номера GenBank: 11352904 и 7227256). Детальное исследование белка можно найти в ссылке 97. При применении согласно изобретению NadA может принимать различные формы. Предпочтительные формы NadA представляют собой усеченные или делетированные варианты, такие как описаны в ссылках 83-85. В частности, предпочтительнее NadA без C-концевого мембранного якоря (например, с делецией остатков 351-405 для штамма 2996 для получения SEQ ID NO: 1 здесь), который иногда обозначен здесь с применением надстрочного индекса 'C', например NadA(C). Экспрессия NadA без его домена мембранного якоря в E.coli приводит к секреции белка в культуральную жидкость, сопровождаемой удалением его 23-мерного лидерного пептида (например, чтобы оставить 327-мер для штамма 2996 [SEQ ID NO: 2 здесь]). Полипептиды без их лидерных пептидов иногда обозначены здесь с применением надстрочного индекса 'NL', например NadA(NL) или NadA(C)(NL). Предпочтительные полипептиды NadA обладают аминокислотной последовательностью, которая (a) на 50% или более идентична (например, на 60%, 70%, 80%, 90%, 95%, 99% или более) SEQ ID NO: 2; и/или (b) содержит фрагмент из по меньшей мере n последовательных аминокислот SEQ ID NO: 1, где n равно 7 или более (например, 8, 10, 12, 14, 16, 18, 20, 25, 30, 35, 40, 50, 60, 70, 80, 90, 100, 150, 200, 250 или более). В предпочтительных фрагментах для (b) отсутствует одна или несколько аминокислот (например, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 15, 20, 25 или более) с C-конца и/или с N-конца SEQ ID NO:1 (например, NadA(C), NadA(NL), NadA(C)(NL)). Другие предпочтительные фрагменты содержат эпитоп из SEQ ID 1, и особенно предпочтительным фрагментом из SEQ ID 1 является SEQ ID 2. Эти различные последовательности включают в себя варианты NadA (например, аллельные варианты, гомологи, ортологи, паралоги, мутанты и т.д.). Различные последовательности NadA показаны на фигуре 9 ссылки 98.
Белок '741' из MenB описан в ссылке 80 (SEQ ID 2535 и 2536) и как 'NMB1870' в ссылке 75 (см. также инвентарный номер GenBank GI:7227128). Соответствующий белок серогруппы A [74] имеет инвентарный номер GenBank 7379322. 741 в природе является липопротеином. При применении согласно изобретению белок 741 может принимать различные формы. Предпочтительные формы 741 представляют собой усеченные или делетированные варианты, такие как описаны в ссылках 83-85. В частности, N-конец 741 может быть делетирован до его полиглициновой последовательности и включая ее (т.е. с делецией остатков 1-72 для штамма MC58 [SEQ ID NO: 3 здесь]), которая иногда обозначена здесь с применением приставки ' G'. Данная делеция может улучшать экспрессию. Делеция удаляет также участок липидизации 741. Предпочтительные последовательности 741 обладают аминокислотной последовательностью, которая: (a) на 50% или более идентична (например, на 60%, 70%, 80%, 90%, 95%, 99% или более) SEQ ID NO: 3; и/или (b) содержит фрагмент по меньшей мере из n последовательных аминокислот из SEQ ID NO: 3, где n равно 7 или более (например, 8, 10, 12, 14, 16, 18, 20, 25, 30, 35, 40, 50, 60, 70, 80, 90, 100, 150, 200, 250 или более). Предпочтительные фрагменты для (b) содержат эпитоп из 741. В других предпочтительных фрагментах отсутствует одна или несколько аминокислот (например, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 15, 20, 25 или более) с C-конца и/или с N-конца SEQ ID NO: 3. Эти последовательности включают в себя варианты 741 (например, аллельные варианты, гомологи, ортологи, паралоги, мутанты и т.д.). Различные последовательности 741 можно найти в SEQ ID 1-22 ссылки 85, в SEQ ID 1-23 ссылки 99, и в SEQ ID 1-299 ссылки 100. G'. Данная делеция может улучшать экспрессию. Делеция удаляет также участок липидизации 741. Предпочтительные последовательности 741 обладают аминокислотной последовательностью, которая: (a) на 50% или более идентична (например, на 60%, 70%, 80%, 90%, 95%, 99% или более) SEQ ID NO: 3; и/или (b) содержит фрагмент по меньшей мере из n последовательных аминокислот из SEQ ID NO: 3, где n равно 7 или более (например, 8, 10, 12, 14, 16, 18, 20, 25, 30, 35, 40, 50, 60, 70, 80, 90, 100, 150, 200, 250 или более). Предпочтительные фрагменты для (b) содержат эпитоп из 741. В других предпочтительных фрагментах отсутствует одна или несколько аминокислот (например, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 15, 20, 25 или более) с C-конца и/или с N-конца SEQ ID NO: 3. Эти последовательности включают в себя варианты 741 (например, аллельные варианты, гомологи, ортологи, паралоги, мутанты и т.д.). Различные последовательности 741 можно найти в SEQ ID 1-22 ссылки 85, в SEQ ID 1-23 ссылки 99, и в SEQ ID 1-299 ссылки 100.
Белок '936' серогруппы B описан в ссылке 80 (SEQ ID 2883 и 2884) и как 'NMB2091' в ссылке 75 (см. также инвентарный номер GenBank GI:7227353). Соответствующий ген для серогруппы A [74] имеет инвентарный номер GenBank 7379093. При применении согласно изобретению белок 936 может принимать различные формы. Предпочтительные формы 936 представляют собой усеченные или делетированные варианты, такие как описаны в ссылках 83-85. В частности, N-концевой лидерный пептид 936 может быть делетирован (например, делеция остатков 1-23 для штамма MC58 для получения 936(NL) [SEQ ID NO: 4 здесь]). Предпочтительные последовательности 936 обладают аминокислотной последовательностью, которая: (a) на 50% или более идентична (например, на 60%, 70%, 80%, 90%, 95%, 99% или более) SEQ ID NO: 4; и/или (b) содержит фрагмент по меньшей мере из n последовательных аминокислот из SEQ ID NO:4, где n равно 7 или более (например, 8, 10, 12, 14, 16, 18, 20, 25, 30, 35, 40, 50, 60, 70, 80, 90, 100, 150, 200, 250 или более). Предпочтительные фрагменты для (b) содержат эпитоп из 936. В других предпочтительных фрагментах отсутствует одна или несколько аминокислот (например, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 15, 20, 25 или более) с C-конца и/или с N-конца SEQ ID NO:4. Эти последовательности включают в себя варианты 936 (например, аллельные варианты, гомологи, ортологи, паралоги, мутанты и т.д.).
Белок '953' из серогруппы B описан в ссылке 80 (SEQ ID 2917 и 2918) и как 'NMB1030' в ссылке 75 (см. также инвентарный номер GenBank GI:7226269). Соответствующий белок серогруппы A [74] имеет инвентарный номер GenBank 7380108. При применении согласно изобретению белок 953 может принимать различные формы. Предпочтительные формы 953 представляют собой усеченные или делетированные варианты, такие как описаны в ссылках 83-85. В частности, N-концевой лидерный пептид 953 может быть делетирован (например, делеция остатков 1-19 для штамма MC58 для получения 953(NL) [SEQ ID NO:5 здесь]. Предпочтительные последовательности 953 обладают аминокислотной последовательностью, которая: (a) на 50% или более идентична (например, на 60%, 70%, 80%, 90%, 95%, 99% или более) SEQ ID NO:5; и/или (b) содержит фрагмент по меньшей мере из n последовательных аминокислот из SEQ ID NO:5, где n равно 7 или более (например, 8, 10, 12, 14, 16, 18, 20, 25, 30, 35, 40, 50, 60, 70, 80, 90, 100, 150, 200, 250 или более). Предпочтительные фрагменты для (b) содержат эпитоп из 953. В других предпочтительных фрагментах отсутствует одна или несколько аминокислот (например, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 15, 20, 25 или более) с C-конца и/или с N-конца SEQ ID NO:5. Эти последовательности включают в себя варианты 953 (например, аллельные варианты, гомологи, ортологи, паралоги, мутанты и т.д.). Аллельные формы 953 представлены на фигуре 19 ссылки 82.
Белок '287' из серогруппы B описан в ссылке 80 (SEQ ID 3103 и 3104), как 'NMB2132' в ссылке 75 и как 'GNA2132' в ссылке 77 (см. также инвентарный номер GenBank GI:7227388). Соответствующий белок серогруппы A [74] имеет инвентарный номер GenBank 7379057. При применении согласно изобретению белок 287 может принимать различные формы. Предпочтительные формы 287 представляют собой усеченные или делетированные варианты, такие как описаны в ссылках 83-85. В частности, N-конец 287 может быть делетирован до его полиглициновой последовательности и включая ее (т.е. с делецией остатков 1-24 для штамма MC58 для получения  G287 [SEQ ID NO:6 здесь]. Данная делеция может улучшать экспрессию. Предпочтительные последовательности 287 обладают аминокислотной последовательностью, которая: (a) на 50% или более идентична (например, на 60%, 70%, 80%, 90%, 95%, 99% или более) SEQ ID NO:6; и/или (b) содержит фрагмент по меньшей мере из n последовательных аминокислот из SEQ ID NO:6, где n равно 7 или более (например, 8, 10, 12, 14, 16, 18, 20, 25, 30, 35, 40, 50, 60, 70, 80, 90, 100, 150, 200, 250 или более). Предпочтительные фрагменты для (b) содержат эпитоп из 287. В других предпочтительных фрагментах отсутствует одна или несколько аминокислот (например, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 15, 20, 25 или более) с C-конца и/или с N-конца SEQ ID NO:6. Эти последовательности включают в себя варианты 287 (например, аллельные варианты, гомологи, ортологи, паралоги, мутанты и т.д.). Аллельные формы 287 представлены на фигурах 5 и 15 ссылки 82, и в примере 13 и на фигуре 21 ссылки 80 (SEQ ID 3179-3184). G287 [SEQ ID NO:6 здесь]. Данная делеция может улучшать экспрессию. Предпочтительные последовательности 287 обладают аминокислотной последовательностью, которая: (a) на 50% или более идентична (например, на 60%, 70%, 80%, 90%, 95%, 99% или более) SEQ ID NO:6; и/или (b) содержит фрагмент по меньшей мере из n последовательных аминокислот из SEQ ID NO:6, где n равно 7 или более (например, 8, 10, 12, 14, 16, 18, 20, 25, 30, 35, 40, 50, 60, 70, 80, 90, 100, 150, 200, 250 или более). Предпочтительные фрагменты для (b) содержат эпитоп из 287. В других предпочтительных фрагментах отсутствует одна или несколько аминокислот (например, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 15, 20, 25 или более) с C-конца и/или с N-конца SEQ ID NO:6. Эти последовательности включают в себя варианты 287 (например, аллельные варианты, гомологи, ортологи, паралоги, мутанты и т.д.). Аллельные формы 287 представлены на фигурах 5 и 15 ссылки 82, и в примере 13 и на фигуре 21 ссылки 80 (SEQ ID 3179-3184).
Предпочтительные антигены MenB содержат аминокислотную последовательность, обнаруженную в одном из штаммов 2996, MC58, 95N477 и 394/98. Предпочтителен белок 287 из штамма 2996 или, более предпочтительно, из штамма 394/98. Предпочтителен белок 741 из штаммов серогруппы B MC58, 2996, 394/98 или 95N477 или из штамма серогруппы C 90/18311. Более предпочтителен штамм MC58. Предпочтительны белки 936, 953 и NadA из штамма 2996. Где композиция содержит конкретный белковый антиген (например, 741 или 287), композиция может содержать более одной вариантной формы данного антигена, например тот же белок, но более чем из одного штамма. Данные белки можно включить сюда как тандем или отдельные белки.
В некоторых вариантах осуществления, однако, композиция согласно изобретению содержит один и тот же белок, но более чем из одного штамма. Обнаружена эффективность данного подхода для белка 741. Данный белок является чрезвычайно эффективным антигеном для индукции ответов анти-менингококковых антител и экспрессирован во всех серогруппах менингококков. Филогенетический анализ показал, что данный белок разделяется на две группы, и одна из этих групп разделяется снова, получая всего три варианта [101], и в то время как сыворотка, полученная против данного варианта, является бактерицидной в пределах той же группы вариантов, она не активна против штаммов, экспрессирующих один из двух других вариантов, т.е. существует перекрестная защита внутри варианта, но не между вариантами [99, 101]. Таким образом, для максимальной перекрестной эффективности между штаммами предпочтительно, чтобы композиция содержала более одного варианта белка 741. Примерная последовательность из каждого варианта дана на SEQ ID NO:10, 11 и 12 здесь начиная с N-концевого остатка цистеина, к которому ковалентно присоединен липид в нативной форме липопротеина. Таким образом предпочтительно, чтобы композиция содержала по меньшей мере два из (1) первого белка, содержащего аминокислотную последовательность, по меньшей мере на a% идентичную последовательности SEQ ID NO:10 и/или содержащую аминокислотную последовательность, состоящую из фрагмента по меньшей мере из x последовательных аминокислот из SEQ ID NO:10; (2) второго белка, содержащего аминокислотную последовательность, по меньшей мере на b% идентичную последовательности SEQ ID NO:11 и/или содержащую аминокислотную последовательность, состоящую из фрагмента по меньшей мере из y последовательных аминокислот из SEQ ID NO:11; и (3) третьего белка, содержащего аминокислотную последовательность, по меньшей мере на c% идентичную последовательности SEQ ID NO:12 и/или содержащую аминокислотную последовательность, состоящую из фрагмента по меньшей мере из z последовательных аминокислот из SEQ ID NO:12. Величина a составляет по меньшей мере 85, например, 86, 87, 88, 89, 90, 91, 92, 93, 94, 95, 96, 97, 98, 99, 99,5 или более. Величина b составляет по меньшей мере 85, например, 86, 87, 88, 89, 90, 91, 92, 93, 94, 95, 96, 97, 98, 99, 99,5 или более. Величина c составляет по меньшей мере 85, например, 86, 87, 88, 89, 90, 91, 92, 93, 94, 95, 96, 97, 98, 99, 99,5 или более. Величины a, b и c по существу не зависят друг от друга. Величина x составляет по меньшей мере 7 (например, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 35, 40, 45, 50, 60, 70, 80, 90, 100, 120, 140, 160, 180, 200, 225, 250). Величина y составляет по меньшей мере 7 (например, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 35, 40, 45, 50, 60, 70, 80, 90, 100, 120, 140, 160, 180, 200, 225, 250). Величина z составляет по меньшей мере 7 (например, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 35, 40, 45, 50, 60, 70, 80, 90, 100, 120, 140, 160, 180, 200, 225, 250). Величины x, y и z по существу не зависят друг от друга. Предпочтительно, чтобы любая данная аминокислотная последовательность 741 не попадала более чем в одну из категорий (1), (2) и (3). Таким образом, любая данная последовательность 741 попадает только в одну из категорий (1), (2) и (3). Таким образом предпочтительно, чтобы белок (1) обладал менее чем i% идентичности последовательности с белком (2); белок (1) обладал менее чем j% идентичности последовательности с белком (3); и белок (2) обладал менее чем k% идентичности последовательности с белком (3). Величина i составляет 60 или более (например, 61, 62, 63, 64, 65, 66, 67, 68, 69, 70, 71, 72, 73, 74, 75, 76, 77, 78, 79, 80, 81, 82, 83, 84, 85, 86, 87, 88, 89, 90 и т.д.) и не превышает a. Величина j составляет 60 или более (например, 61, 62, 63, 64, 65, 66, 67, 68, 69, 70, 71, 72, 73, 74, 75, 76, 77, 78, 79, 80, 81, 82, 83, 84, 85, 86, 87, 88, 89, 90 и т.д.) и не превышает b. Величина k составляет 60 или более (например, 61, 62, 63, 64, 65, 66, 67, 68, 69, 70, 71, 72, 73, 74, 75, 76, 77, 78, 79, 80, 81, 82, 83, 84, 85, 86, 87, 88, 89, 90 и т.д.) и не превышает c. Величины i, j и k по существу не зависят друг от друга.
Композиции согласно изобретению содержат небольшое число очищенных антигенов серогруппы B (например, меньше чем t антигенов, где t равно 10, 9, 8, 7, 6, 5, 4 или 3). Особенно предпочтительно, чтобы композиция не содержала сложных или неопределенных смесей антигенов, например предпочтительно, чтобы композиция не содержала везикул наружной мембраны. Предпочтительно экспрессировать рекомбинантные антигены в гетерологичном хозяине и затем очищать. Для композиции, содержащей t антигенов MenB, может существовать t отдельных полипептидов, однако для дальнейшего уменьшения сложности предпочтительно экспрессировать по меньшей мере два из антигенов как одну полипептидную цепь ('гибридный' белок [ссылки 83-85]), т.е. так, чтобы t антигенов формировали менее чем t полипептидов. Гибридные белки предоставляют два принципиальных преимущества: во-первых, белок, который может быть нестабильным или плохо экспрессироваться самостоятельно, может преодолевать эту проблему с помощью подходящего гибридного партнера; во-вторых, упрощается коммерческое производство, так как для производства двух полезных по отдельности белков требуется только однократная экспрессия и очистка. Гибридный белок, включаемый в состав композиции согласно изобретению, может содержать два или более (например, 2, 3, 4 или 5) из пяти перечисленных выше антигенов. Предпочтительны гибриды, состоящие из двух из пяти антигенов.
В сочетании из пяти основных антигенов (NadA, 741, 953, 936 и 287), антиген может присутствовать в более чем одном гибридном белке и/или как негибридный белок. Однако предпочтительно, чтобы антиген присутствовал как гибрид или не как гибрид, но не как оба, хотя может быть полезно включать в состав белок 741 как гибридный и как негибридный антиген (предпочтительно липопротеин), особенно когда применяют более одного варианта 741.
Гибридные белки можно представить формулой NH2-A-[-X-L-]n-B-COOH, где: X представляет собой аминокислотную последовательность одного из пяти основных антигенов; L представляет собой необязательную линкерную аминокислотную последовательность; A представляет собой необязательную N-концевую аминокислотную последовательность; B представляет собой необязательную C-концевую аминокислотную последовательность и n равно 2, 3, 4 или 5.
Наиболее предпочтительно n равно 2. Гибриды двух антигенов для применения согласно изобретению включают в себя NadA и 741; NadA и 936; NadA и 953; NadA и 287; 741 и 936; 741 и 953; 741 и 287; 936 и 953; 936 и 287; 953 и 287. Два предпочтительных белка представляют собой: X1 является 936 и X2 является 741; Xl является 287 и X2 является 953.
Если компонент -X- в форме дикого типа обладает последовательностью лидерного пептида, ее можно включать или не включать в гибридный белок. В некоторых вариантах осуществления лидерные пептиды можно делетировать за исключением лидерного пептида компонента -X-, локализованного на N-конце гибридного белка, т.е. сохраняют лидерный пептид X1, но исключают лидерные пептиды X2...Xn. Это эквивалентно делеции всех лидерных пептидов и применении лидерного пептида Xl в качестве компонента -A-.
Для каждых n случаев [-X-L-], линкерная аминокислотная последовательность -L- может присутствовать или отсутствовать. Например, когда n=2, гибрид может представлять собой NH2-Xl-L1-X2-L2-COOH, NH2-Xl-X2-COOH, NH2-X1-L1-X2-COOH, NH2-X1-X2-L2-COOH и т.д. Линкерная аминокислотная последовательность(и) -L-, как правило, является короткой (например, 20 или менее аминокислот, т.е. 19, 18, 17, 16, 15, 14, 13, 12, 11, 10, 9, 8, 7, 6, 5, 4, 3, 2, 1). Примеры включают в себя короткие пептидные последовательности, облегчающие клонирование, полигилициновые линкеры (т.е. состоящие из Glyn, где n=2, 3, 4, 5, 6, 7, 8, 9, 10 или более) и гистидиновые метки (т.е. Hisn, где n=3, 4, 5, 6, 7, 8, 9, 10 или более). Другие подходящие линкерные аминокислотные последовательности очевидны специалистам в данной области. Полезным линкером является GSGGGG (SEQ ID 9), дипептид Gly-Ser, образуемый с участка рестрикции BamHI, облегчающего клонирование и манипуляции, и тетрапептид (Gly)4, являющийся типичным полигилициновым линкером. Если Xn+l представляет собой  G-белок и Ln представляет собой глициновый линкер, это эквивалентно тому, что Xn+l не является G-белок и Ln представляет собой глициновый линкер, это эквивалентно тому, что Xn+l не является  G-белком, а Ln отсутствует. G-белком, а Ln отсутствует.
-A- представляет собой необязательную N-концевую аминокислотную последовательность. Как правило, она является короткой (например, 40 или менее аминокислот, т.е. 39, 38, 37, 36, 35, 34, 33, 32, 31, 30, 29, 28, 27, 26, 25, 24, 23, 22, 21, 20, 19, 18, 17, 16, 15, 14, 13, 12, 11, 10, 9, 8, 7, 6, 5, 4, 3, 2, 1). Примеры включают в себя лидерные последовательности для направленного транспорта белка или короткие пептидные последовательности, облегчающие клонирование или очистку (например, гистидиновые метки, т.е. Hisn, где n=3, 4, 5, 6, 7, 8, 9, 10 или более). Другие подходящие N-концевые аминокислотные последовательности очевидны специалистам в данной области. Если собственный N-концевой метионин Xl отсутствует, -A- предпочтительно представляет собой олигопептид (например, из 1, 2, 3, 4, 5, 6, 7 или 8 аминокислот), предоставляющий N-концевой метионин.
-B- представляет собой необязательную C-концевую аминокислотную последовательность. Как правило, она является короткой (например, 40 или менее аминокислот, т.е. 39, 38, 37, 36, 35, 34, 33, 32, 31, 30, 29, 28, 27, 26, 25, 24, 23, 22, 21, 20, 19, 18, 17, 16, 15, 14, 13, 12, 11, 10, 9, 8, 7, 6, 5, 4, 3, 2, 1). Примеры включают в себя последовательности для направленного транспорта белка или короткие пептидные последовательности, облегчающие клонирование или очистку (например, содержащие гистидиновые метки, т.е. Hisn, где n=3, 4, 5, 6, 7, 8, 9, 10 или более), или последовательности, увеличивающие стабильность белка. Другие подходящие C-концевые аминокислотные последовательности очевидны специалистам в данной области.
Два особенно предпочтительных гибридных белка согласно изобретению следующие:
| n |
A |
Xl |
L1 |
X2 |
L2 |
B |
SEQ ID NO: |
| 2 |
MA |
 G287 G287 |
GSGGGG |
953(NL) |
- |
- |
7 |
| 2 |
M |
936(NL) |
GSGGGG |
 G741 G741 |
- |
- |
8 |
Данные два белка можно применять в сочетании с NadA (конкретно с SEQ ID NO:2). Так, предпочтительная композиция антигенов MenB для применения согласно изобретению, таким образом, содержит первый полипептид, содержащий аминокислотную последовательность SEQ ID NO:2, второй полипептид, содержащий аминокислотную последовательность SEQ ID NO:7, и третий полипептид, содержащий аминокислотную последовательность SEQ ID NO:8. Это предпочтительная группа антигенов MenB для применения согласно изобретению.
Как упомянуто выше, композиции согласно изобретению могут индуцировать бактерицидный ответ антител в сыворотке, эффективный против двух из трех гипервирулентных линий MenB A4, ET-5 и линии 3. Они могут дополнительно индуцировать бактерицидный ответ антител против одной или нескольких гипервирулентных линий подгруппы I, подгруппы III, подгруппы IV-1 или комплекса ET-37 и против других линий, например, гиперинвазивных линий. Данные ответы антител легко измерить у мышей, и они являются общепринятым показателем эффективности вакцины [например, см. пояснение 14 ссылки 77]. Сывороточная бактерицидная активность (SBA) измеряет опосредованное комплементом уничтожение бактерий, и ее можно проанализировать с применением комплемента человека или крольчонка. Стандарты ВОЗ требуют вакцины, индуцирующей по меньшей мере 4-кратное увеличение SBA у более 90% реципиентов.
Композиция не должна содержать бактерицидные антитела против каждого штамма MenB из данных гипервирулентных линий; предпочтительнее, чтобы для каждой данной группы из четырех или более штаммов менингококков серогруппы B в конкретной гипервирулентной линии индуцируемые композицией антитела являлись бактерицидными против по меньшей мере 50% (например, 60%, 70%, 80%, 90% или более) из группы. Предпочтительны группы штаммов, включающие штаммы, выделенные по меньшей мере в четырех из следующих стран: GB, AU, CA, NO, IT, US, NZ, NL, BR, и CU. Сыворотка предпочтительно обладает бактерицидным титром по меньшей мере 1024 (например, 210, 211, 212, 213, 214, 215, 216, 217, 218 или выше, предпочтительно по меньшей мере 214), т.е. сыворотка способна уничтожать по меньшей мере 50% тестируемых бактерий конкретного штамма при разведении 1/1024, как описано в ссылке 77.
Предпочтительные композиции могут индуцировать бактерицидные ответы против следующих штаммов менингококков серогруппы B (i) штамма 961-5945 (B:2b:P1,21,16) и/или штамма G2136 (B:-) из кластера A4; (ii) штамма MC58 (B:15:P1,7,16b) и/или штамма 44/76 (B:15:P1,7,16) из комплекса ET-5; (iii) штамма 394/98 (B:4:P1,4) и/или штамма BZ198 (B:NT:-) из линии 3. Более предпочтительные композиции могут индуцировать бактерицидные ответы против штаммов 961-5945, 44/76 и 394/98. Штаммы 961-5945 и G2136, оба, являются контрольными штаммами Neisseria для MLST [идентификаторы 638 и 1002 в ссылке 102]. Штамм MC58 широко доступен (например, BAA-335 в ATCC) и является штаммом, секвенированным в ссылке 75. Штамм 44/76 широко применим и охарактеризован (например, ссылка 103) и является одним из контрольных штаммов Neisseria для MLST [идентификатор 237 в ссылке 102; ряд 32 таблицы 2 в ссылке 104]. Штамм 394/98 первоначально выделен в Новой Зеландии в 1998, и опубликовано несколько исследований с применением данного штамма (например, ссылки 105 и 106). Штамм BZ198 является другим контрольным штаммом Neisseria для MLST [идентификатор 409 в ссылке 102; ряд 41 таблицы 2 в ссылке 104]. Композиция дополнительно может индуцировать бактерицидный ответ против серогруппы W135 штамма LNP17592 (W135:2a:P1,5,2) из комплекса ET-37. Это штамм Haji, выделенный во Франции в 2000.
Другие полипептидные антигены MenB, которые можно включать в композиции согласно изобретению, включают в себя антигены, содержащие одну из следующих аминокислотных последовательностей: SEQ ID NO:650 из ссылки 78; SEQ ID NO:878 из ссылки 78; SEQ ID NO:884 из ссылки 78; SEQ ID NO:4 из ссылки 79; SEQ ID NO:598 из ссылки 80; SEQ ID NO:818 из ссылки 80; SEQ ID NO:864 из ссылки 80; SEQ ID NO:866 из ссылки 80; SEQ ID NO:1196 из ссылки 80; SEQ ID NO:1272 из ссылки 80; SEQ ID NO:1274 из ссылки 80; SEQ ID NO:1640 из ссылки 80; SEQ ID NO:1788 из ссылки 80; SEQ ID NO:2288 из ссылки 80; SEQ ID NO:2466 из ссылки 80; SEQ ID NO:2554 из ссылки 80; SEQ ID NO:2576 из ссылки 80; SEQ ID NO:2606 из ссылки 80; SEQ ID NO:2608 из ссылки 80; SEQ ID NO:2616 из ссылки 80; SEQ ID NO:2668 из ссылки 80; SEQ ID NO:2780 из ссылки 80; SEQ ID NO:2932 из ссылки 80; SEQ ID NO:2958 из ссылки 80; SEQ ID NO:2970 из ссылки 80; SEQ ID NO:2988 из ссылки 80, или полипептид, содержащий аминокислотную последовательность, которая (a) на 50% или более (например, на 60%, 70%, 80%, 90%, 95%, 99% или более) идентична указанным последовательностям; и/или (b) содержит фрагмент по меньшей мере из n последовательных аминокислот из указанных последовательностей, где n равно 7 или более (например, 8, 10, 12, 14, 16, 18, 20, 25, 30, 35, 40, 50, 60, 70, 80, 90, 100, 150, 200, 250 или более). Предпочтительные фрагменты для (b) содержат эпитоп из подходящей последовательности. Можно включать в состав более одного (например, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14 или более) из этих полипептидов.
Дополнительные антигенные компоненты
В композиции согласно изобретению можно также включать неменингококковые и негонококковые антигены, предпочтительно не уменьшающие иммунный ответ против менингококковых компонентов. Например, в ссылке 107 описаны сочетания олигосахаридов из серогрупп B и C N.meningitidis с сахаридом Hib. Особенно предпочтительные не менингококковые антигены включают в себя:
- дифтерийный антиген, такой как дифтерийный анатоксин [например, часть 3 ссылки 108].
- антиген столбняка, такой как столбнячный анатоксин [например, часть 4 ссылки 108].
- голотоксин коклюша (PT) и филаментозный гемагглютинин (FHA) из B.pertussis, необязательно в сочетании с пертактином и/или агглютиногенами 2 и 3 [например, ссылки 109 и 110].
- клеточный антиген коклюша.
- антиген вируса гепатита A, такой как инактивированный вирус [например, 111, 112].
- антиген вируса гепатита B, такой как поверхностный и/или коровый антигены [например, 112, 113], с поверхностным антигеном, предпочтительно адсорбированным на фосфате алюминия [114].
- полио антиген(ы) [например, 115, 116], такие как IPV.
Смесь может содержать один или несколько таких антигенов, которые можно детоксифицировать, если необходимо (например, детоксикация токсина коклюша химическими и/или генетическими способами).
Когда в смесь включен дифтерийный антиген, предпочтительно включать также антиген столбняка и антигены коклюша. Аналогично, где включен антиген столбняка, предпочтительно включать также антигены дифтерии и коклюша. Аналогично, где включен антиген коклюша, предпочтительно включать также антигены дифтерии и столбняка.
Как правило, антигены в смеси присутствуют в концентрации по меньшей мере 1 мкг/мл каждый. В общем, концентрация любого данного антигена достаточна для индукции иммунного ответа против данного антигена. Предпочтительно, чтобы защитная эффективность отдельных сахаридных антигенов не исчезала в результате их объединения, хотя фактическая иммуногенность (например, титры ELISA) могут уменьшаться.
В качестве альтернативы применению белковых антигенов в смеси, можно применять нуклеиновую кислоту, кодирующую антиген. Таким образом, белковые компоненты смеси можно заменить нуклеиновой кислотой (предпочтительно ДНК, например, в форме плазмиды), кодирующей белок. Аналогично композиции согласно изобретению могут содержать белки, мимикрирующие сахаридные антигены, например, мимотопы [117] или антиидиотипические антитела. Они могут заменять отдельные сахаридные компоненты или дополнять их. В качестве примера, вакцина может содержать пептидный миметик капсульного полисахарида MenC [118] или MenA [119] вместо собственно сахарида.
Два предпочтительных не менингококковых антигена для включения в композиции согласно изобретению представляют собой антигены, защищающие против H.influenzae типа B (Hib) и против Streptococcus pneumoniae.
Haemophilus influenzae типа B (Hib)
Когда композиция содержит антиген H.influenzae типа B, он, как правило, представляет собой капсульный сахаридный антиген Hib. Сахаридные антигены H.influenzae b хорошо известны.
Сахарид Hib преимущественно ковалентно конъюгируют с белком-носителем, чтобы усилить его иммуногенность, особенно для детей. Получение полисахаридных конъюгатов в общем и капсульного полисахарида Hib, в частности, хорошо документировано [например, ссылки 21-29, и т.д.]. Согласно изобретению можно применять любой подходящий конъюгат Hib. Подходящие белки-носители описаны выше, и предпочтительными носителями для сахаридов Hib являются CRM197 ('HbOC'), столбнячный анатоксин ('PRP-T') и комплекс наружной мембраны N.meningitidis ('PRP-OMP').
Сахаридный компонент конъюгата может представлять собой полисахарид (например, полноразмерный полирибозилрибитолфосфат (PRP)), но предпочтительно гидролизовать полисахариды для получения олигосахаридов (например, молекулярного веса от приблизительно 1 до приблизительно 5 кДа).
Предпочтительный конъюгат содержит олигосахарид Hib, ковалентно присоединенный к CRM197 посредством линкера адипиновой кислоты [120, 121]. Столбнячный анатоксин также является предпочтительным носителем.
Введение антигена Hib предпочтительно приводит к концентрации анти-PRP антител  0,15 мкг/мл и более предпочтительно 0,15 мкг/мл и более предпочтительно  1 мкг/мл. 1 мкг/мл.
Когда композиция содержит сахаридный антиген Hib, предпочтительно, чтобы она не содержала также гидроксид алюминия в качестве адъюванта. Если композиция содержит в качестве адъюванта фосфат алюминия, антиген Hib может быть адсорбирован адъювантом [122] или может быть не адсорбирован [123]. Предотвращения адсорбции можно достичь выбором корректного pH во время смешивания антиген/адъювант, адъюванта с подходящей точкой нулевого заряда и подходящего порядка смешивания различных отличающихся антигенов в композиции [124].
Композиции согласно изобретению могут содержать более одного антигена Hib. Антигены Hib можно лиофилизировать, например, для разбавления менингококковыми композициями согласно изобретению.
Streptococcus pneumoniae
Когда композиция содержит антиген S.pneumoniae, он, как правило, представляет собой капсульный сахаридный антиген, предпочтительно конъюгированный с белком-носителем [например, ссылки 125-127]. Предпочтительно включать сахариды из более чем одного серотипа S.pneumoniae. Например, широко применяют смеси полисахаридов из 23 различных серотипов, так, существуют конъюгированные вакцины с полисахаридами из между 5 и 11 различных серотипов [128]. Например, PrevNar [1] содержит антигены из семи серотипов (4, 6B, 9V, 14, 18C, 19F и 23F), где каждый сахарид отдельно конъюгирован с CRM197 восстановительным аминированием, по 2 мкг каждого сахарида на дозу 0,5 мл (4 мкг серотипа 6B), и конъюгаты адсорбированы на адъюванте - фосфате алюминия. Композиции согласно изобретению предпочтительно включают по меньшей мере серотипы 6B, 14, 19F и 23F. Конъюгаты могут быть адсорбированы на фосфате алюминия. [1] содержит антигены из семи серотипов (4, 6B, 9V, 14, 18C, 19F и 23F), где каждый сахарид отдельно конъюгирован с CRM197 восстановительным аминированием, по 2 мкг каждого сахарида на дозу 0,5 мл (4 мкг серотипа 6B), и конъюгаты адсорбированы на адъюванте - фосфате алюминия. Композиции согласно изобретению предпочтительно включают по меньшей мере серотипы 6B, 14, 19F и 23F. Конъюгаты могут быть адсорбированы на фосфате алюминия.
В качестве альтернативы применению сахаридных антигенов пневмококка композиция может содержать один или несколько полипептидных антигенов. Последовательности генома для нескольких штаммов пневмококков доступны [129, 130] и подлежат обратной вакцинологии [131-134] для идентификации подходящих полипептидных антигенов [135, 136]. Например, композиция может содержать один или несколько следующих антигенов: PhtA, PhtD, PhtB, PhtE, SpsA, LytB, LytC, LytA, Spl25, Sp101, Spl28, Spl30 и Spl30, как определено в ссылке 137. Композиция может содержать более одного (например, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13 или 14) из данных антигенов.
Согласно некоторым вариантам осуществления композиция может содержать и сахаридные, и полипептидные антигены пневмококка. Их можно применять в простой смеси, или пневмококковый сахаридный антиген можно конъюгировать с пневмококковым белком. Подходящие белки-носители для таких вариантов осуществления включают в себя антигены, перечисленные в предыдущем абзаце [137].
Пневмококковые антигены можно лиофилизировать, например, вместе с антигеном Hib.
Фармацевтические композиции
Композиция согласно изобретению, как правило, кроме упомянутых выше компонентов содержит один или несколько 'фармацевтически пригодных носителей', которые включают в себя любой носитель, самостоятельно не вызывающий продукции антител, вредных для индивидуума, получающего композицию. Подходящими носителями, как правило, являются большие, медленно метаболизирующие макромолекулы, такие как белки, полисахариды, полимолочные кислоты, полигликольные кислоты, полимерные аминокислоты, сополимеры аминокислот, сахароза [138], трегалоза [139], лактоза и липидные агрегаты (такие как масляные капли или липосомы). Такие носители хорошо известны обычным специалистам в данной области. Вакцины могут содержать также разбавители, такие как вода, солевой раствор, глицерин и т.д. Дополнительно могут присутствовать вспомогательные вещества, такие как смачивающие или эмульгирующие вещества, pH-буферные вещества и подобные. Типичным носителем является апирогенный забуференный фосфатом физиологический солевой раствор. Всестороннее обсуждение фармацевтически пригодных наполнителей доступно в ссылке 140.
Композиции согласно изобретению существуют в водной форме, т.е. как растворы или суспензии. Жидкий состав такого типа позволяет введение композиций непосредственно из их расфасованной формы без необходимости разбавления в водной среде и, таким образом, идеален для инъекций. Композиции могут присутствовать в ампулах или могут присутствовать в готовых наполненных шприцах. Шприцы можно поставлять с иглами или без. Шприц содержит однократную дозу композиции, в то время как ампула может содержать однократную дозу или множественные дозы.
Жидкие композиции согласно изобретению пригодны также для восстановления других вакцин из лиофилизированной формы, например для восстановления лиофилизированных антигенов Hib или DTP. Когда композицию согласно изобретению применяют для такого разбавления непосредственно перед введением, изобретение относится к набору, который может содержать две ампулы или может содержать один готовый наполненный шприц и одну ампулу, где содержимое шприца применяют для реактивации содержимого ампулы перед инъекцией.
Композиции согласно изобретению можно расфасовать в форме однократной дозы или в форме множественной дозы. Для форм множественных доз ампулы предпочтительнее, чем готовые наполненные шприцы. Эффективный объем дозы можно определить общепринятым способом, однако объем обычной дозы композиции для инъекции человеку составляет 0,5 мл.
Предпочтительным является pH композиции между 6 и 8, предпочтительно приблизительно 7. Стабильный pH можно поддерживать с применением буфера. Если композиция содержит соль гидроксида алюминия, предпочтительнее применять гистидиновый буфер [141]. Композиция может быть стерильной и/или апирогенной. Композиции согласно изобретению могут быть изотоническими по отношению к людям.
Композиции согласно изобретению являются иммуногенными, и более предпочтительно, являются вакцинными композициями. Вакцины согласно изобретению могут являться профилактическими (т.е. предупреждать инфекцию) или терапевтическими (т.е. лечить инфекцию), но обычно являются профилактическими. Иммуногенные композиции, применяемые в качестве вакцин, содержат иммунологически эффективное количество антигена (антигенов), так же как любые другие компоненты, как необходимо. 'Иммунологически эффективное количество' означает, что введение данного количества индивидууму в однократной дозе или как части серий эффективно для лечения или предупреждения. Данное количество меняется в зависимости от здоровья и физического состояния подлежащего лечению индивидуума, возраста, таксономической группы подлежащего лечению индивидуума (например, не относящийся к человеку примат, примат, и т.д.), способности иммунной системы индивидуума синтезировать антитела, степени желаемой защиты, состава вакцины, оценки медицинского состояния лечащим врачом и других существенных факторов. Ожидают, что количество попадет в относительно широкий диапазон, который можно определить общепринятыми испытаниями.
Количество отдельного сахаридного антигена в каждой дозе, как правило, составляет между 1-50 мкг (измеренных как масса сахарида), например приблизительно 1 мкг, приблизительно 2,5 мкг, приблизительно 4 мкг, приблизительно 5 мкг, или приблизительно 10 мкг.
Каждый сахарид может присутствовать в основном в одинаковом количестве на дозу. Однако соотношение (мас./мас.) сахарид MenY: сахарид MenW135 может быть больше 1 (например, 2:1, 3:1, 4:1, 5:1, 10:1 или выше) и/или соотношение (мас./мас.) сахарид MenY: сахарид MenC может быть меньше 1 (например, 1:2, 1:3, 1:4, 1:5 или ниже).
Предпочтительные соотношения (мас./мас.) для сахаридов серогрупп A:C:W135:Y составляют: 1:1:1:1; 1:1:1:2; 2:1:1:1; 4:2:1:1; 8:4:2:1; 4:2:1:2; 8:4:1:2; 4:2:2:1; 2:2:1:1; 4:4:2:1; 2:2:1:2; 4:4:1:2 и 2:2:2:1. Предпочтительные соотношения (мас./мас.) для сахаридов серогрупп C:W135:Y составляют: 1:1:1; 1:1:2; 1:1:1; 2:1:1; 4:2:1; 2:1:2; 4:1:2; 2:2:1; и 2:1:1. Предпочтительно применение главным образом одинаковой массы каждого сахарида.
Предпочтительные композиции согласно изобретению содержат менее чем 50 мкг менингококкового сахарида на дозу. Другие предпочтительные композиции содержат  40 мкг менингококкового сахарида на дозу. Другие предпочтительные композиции содержат 40 мкг менингококкового сахарида на дозу. Другие предпочтительные композиции содержат  30 мкг менингококкового сахарида на дозу. Другие предпочтительные композиции содержат 30 мкг менингококкового сахарида на дозу. Другие предпочтительные композиции содержат  25 мкг менингококкового сахарида на дозу. Другие предпочтительные композиции содержат 25 мкг менингококкового сахарида на дозу. Другие предпочтительные композиции содержат  20 мкг менингококкового сахарида на дозу. Другие предпочтительные композиции содержат 20 мкг менингококкового сахарида на дозу. Другие предпочтительные композиции содержат  10 мкг менингококкового сахарида на дозу, однако в идеале композиции согласно изобретению содержат по меньшей мере 10 мкг общего менингококкового сахарида на дозу. 10 мкг менингококкового сахарида на дозу, однако в идеале композиции согласно изобретению содержат по меньшей мере 10 мкг общего менингококкового сахарида на дозу.
Композиции согласно изобретению могут содержать противомикробный препарат, особенно при расфасовке в формате множественной дозы.
Композиции согласно изобретению могут содержать детергент, например Tween (полисорбат), такой как Tween 80. Как правило, присутствуют низкие уровни детергентов, например, <0,01%.
Композиции согласно изобретению могут содержать соли натрия (например, хлорид натрия) для получения тоничности. Обычная концентрация NaCl составляет 10±2 мг/мл.
Композиции согласно изобретению, как правило, могут содержать буфер. Обычным является фосфатный буфер.
Композиции согласно изобретению, как правило, можно вводить в сочетании с другими иммунорегуляторными средствами. В частности, композиции обычно содержат один или более адъювантов. Такие адъюванты включают в себя в качестве неограничивающих примеров:
A. Минералсодержащие композиции
Минералсодержащие композиции, пригодные для применения в качестве адъювантов согласно изобретению, включают в себя минеральные соли, такие как соли алюминия и соли кальция. Изобретение относится к минеральным солям, таким как гидроксиды (например, гидроокиси), фосфаты (например, гидроксифосфаты, ортофосфаты), сульфаты и т.д. [например, см. разделы 8 и 9 ссылки 142], или смесям различных минеральных соединений, с соединениями, принимающими любую подходящую форму (например, геля, кристаллическую, аморфную и т.д.), предпочтительно с адсорбцией. Минерал-содержащие композиции можно также составить в виде частицы соли металла [143].
B. Масляные эмульсии
Композиции масляных эмульсий, пригодные для применения в качестве адъювантов согласно изобретению, включают в себя сквален-водные эмульсии, такие как MF59 [часть 10 ссылки 142; см. также ссылку 144] (5% сквален, 0,5% Tween 80 и 0,5% Span 85, составленные в виде субмикронных частиц с применением микрораспылителя). Можно применять также полный адъювант Фрейнда (CFA) и неполный адъювант Фрейнда (IFA).
C. Сапониновые составы [часть 22 ссылки 142]
В качестве адъювантов согласно изобретению можно также применять сапониновые составы. Сапонины представляют собой гетерологичную группу стериновых гликозидов и тритерпеновых гликозидов, обнаруженных в коре, листьях, стеблях и даже цветах широкого ряда видов растений. Сапонин из коры дерева Quillaia saponaria Molina широко изучали как адъювант. Коммерчески доступен также сапонин из Smilax ornata (сарсапарель), Gypsophilla paniculata (фата невесты), и Saponaria officianalis (мыльный корень). Составы сапониновых адъювантов содержат очищенные составы, такие как QS21, так же как липидные составы, такие как ISCOM. QS21 продают как Stimulon . .
Сапониновые композиции очищали с применением HPLC и RP-HPLC. С применением данных способов идентифицировали конкретные очищенные фракции, включая QS7, QS17, QS18, QS21, QH-A, QH-B и QH-C. Предпочтительно сапонин представляет собой QS21. Способ получения QS21 описан в ссылке 145. Сапониновые составы могут также содержать стерин, такой как холестерин [146].
Сочетания сапонинов и холестеринов можно применять для получения уникальных частиц, называемых иммуностимулирующими комплексами (ISCOM) [часть 23 ссылки 142]. ISCOM, как правило, содержат также фосфолипид, такой как фосфатидилэтаноламин или фосфатидилхолин. Любой известный сапонин можно применять в ISCOM. Предпочтительно ISCOM содержит один или несколько из QuilA, QHA и QHC. ISCOM дополнительно описаны в ссылках 146-148. ISCOM, необязательно, могут быть свободны от дополнительного детергента [149].
Обзор разработки основанных на сапонине адъювантов, можно найти в ссылках 150 и 151.
D. Виросомы и вирусоподобные частицы
Виросомы и вирусоподобные частицы (VLP) также можно применять в качестве адъювантов согласно изобретению. Данные структуры, как правило, содержат один или несколько белков вируса, необязательно объединенных или сформулированных с фосфолипидом. Они, как правило, непатогенные, невоспроизводящиеся и, как правило, не содержат никакого нативного вирусного генома. Вирусные белки можно получить рекомбинантным способом или выделить из целых вирусов. Такие вирусные белки, пригодные для применения в виросомах или VLP, включают в себя белки, полученные из вируса гриппа (такие как HA или NA), вируса гепатита B (такие как коровые или капсидные белки), вируса гепатита E, вируса кори, вируса Синдбис, ротавируса, вируса ящура, ретровируса, вируса Норволк, вируса папилломы человека, HIV, РНК-фагов, Q -фага (такие как белки оболочки), GA-фага, fr-фага, фага AP205, и Ty (такой как ретротранспозон Ty белок pl). VLP дополнительно обсуждается в ссылках 152-157. Виросомы дополнительно обсуждают, например, в ссылке 158. -фага (такие как белки оболочки), GA-фага, fr-фага, фага AP205, и Ty (такой как ретротранспозон Ty белок pl). VLP дополнительно обсуждается в ссылках 152-157. Виросомы дополнительно обсуждают, например, в ссылке 158.
E. Бактериальные или микробные производные
Адъюванты, пригодные для применения согласно изобретению, включают в себя бактериальные или микробные производные, такие как нетоксичные производные энтеробактериального липополисахарида (LPS), производные липида A, иммуностимулирующие олигонуклеотиды, АДФ-рибозилирующие токсины и их детоксифицированные производные.
Нетоксичные производные LPS включают в себя монофосфориллипид A (MPL) и 3-O-деацилированный MPL (3dMPL). 3dMPL представляет собой смесь 3 де-O-ацилированных монофосфорил липида A с 4, 5 или 6 ацилированными цепями. Предпочтительная «малая частица» сформирована из 3 де-O-ацилированного монофосфорил липида A, как описано в ссылке 159. Такие «малые частицы» 3dMPL достаточно малы, чтобы стерилизовать их фильтрованием через мембрану 0,22 мкм [159]. Другие нетоксичные производные LPS включают в себя миметики монофосфориллипида A, такие как аминоалкилглюкозаминидфосфатные производные, например, RC-529 [160, 161].
Производные липида A включают в себя производные липида A из Escherichia coli, такие как OM-174. OM-174 описан, например, в ссылках 162 и 163.
Иммуностимулирующие олигонуклеотиды, пригодные для применения в качестве адъювантов согласно изобретению, включают в себя нуклеотидные последовательности, содержащие CpG-мотив (динуклеотидную последовательность, содержащую неметилированный цитозин, связанный фосфатной связью с гуанозином. Показано, что двухцепочечные РНК и олигонуклеотиды, содержащие палиндромные или поли(dG)-последовательности, также являются иммуностимулирующими.
CpG могут включать в себя нуклеотидные модификации/аналоги, такие как фосфоротиоатные модификации, и могут быть двухцепочечными или одноцепочечными. В ссылках 164, 165 и 166 описаны возможные аналогичные замены, например замена гуанозина на 2'-дезокси-7-деазагуанозин. Адъювантный эффект CpG-олигонуклеотидов дополнительно обсуждается в ссылках 167-172.
CpG-последовательность может быть направлена на TLR9, такой как мотив GTCGTT или TTCGTT [173]. CpG-последовательность может быть специфической в отношении индукции Thl-иммунного ответа, такой как CpG-A ODN, или она может быть специфической в отношении индукции B-клеточного ответа, такой как CpG-B ODN. CpG-A и CpG-B ODN обсуждают в ссылках 174-176. CpG предпочтительно представляет собой CpG-A ODN.
CpG-олигонуклеотид предпочтительно конструируют таким образом, что 5'-конец был доступен для узнавания рецептором. Необязательно, две последовательности CpG-олигонуклеотидов можно соединить по их 3'-концам, с получением «иммуномеров». См., например, ссылки 173 и 177-179.
Бактериальные ADP-рибозилирующие токсины и их детоксифицированные производные можно использовать в качестве адъювантов согласно изобретению. Предпочтительно, когда белок получают из E.coli (термолабильный энтеротоксин E.coli "LT"), холеры ("CT"), или коклюша ("PT"). Применение детоксифицированных ADP-рибозилирующих токсинов в качестве адъювантов для слизистой оболочки описано в ссылке 180, а в качестве парентеральных адъювантов - в ссылке 181. Токсин или анатоксин предпочтительно присутствует в форме голотоксина, содержащего и A-, и B-субъединицы. Субъединица A предпочтительно содержит детоксифицирующую мутацию; субъединица B предпочтительно не мутирована. Адъювант предпочтительно представляет собой детоксифицированный мутантный LT, такой как LT-K63, LT-R72 и LT-G192. Применение в качестве адъювантов ADP-рибозилирующих токсинов и их детоксифицированных производных, в частности LT-K63 и LT-R72, можно найти в ссылках 182-189. Нумерационная ссылка на аминокислотные замены предпочтительно основана на выравниваниях A и B субъединиц ADP-рибозилирующих токсинов, представленных в ссылке 190, которая конкретно приведена здесь в качестве ссылки в полном объеме.
F. Иммуномодуляторы человека
Иммуномодуляторы человека, пригодные для применения в качестве адъювантов согласно изобретению, включают в себя цитокины, такие как интерлейкины (например, IL-1, IL-2, IL-4, IL-5, IL-6, IL-7, IL-12 [191] и т.д.) [192], интерфероны (например,  -интерферон), макрофагальный колониестимулирующий фактор и фактор некроза опухолей. -интерферон), макрофагальный колониестимулирующий фактор и фактор некроза опухолей.
G. Биоадгезивы и мукоадгезивы
Биоадгезивы и мукоадгезивы также можно применять в качестве адъювантов согласно изобретению. Подходящие биоадгезивы включают в себя микросферы эстерифицированной гиалуроновой кислоты [193] или мукоадгезивы, такие как производные поли(акриловой кислоты), поливинилового спирта, поливинилпирролидона, полисахаридов и карбоксиметилцеллюлозы с поперечной межмолекулярной связью. Хитозан и его производные также можно применять в качестве адъювантов согласно изобретению [194].
H. Микрочастицы
Микрочастицы также можно применять в качестве адъювантов согласно изобретению. Микрочастицы (т.е. частица от ~l00 нм до ~150 мкм в диаметре, предпочтительнее от ~200 нм до ~30 мкм в диаметре и наиболее предпочтительно от ~500 нм до ~10 мкм в диаметре), сформированные из материалов, поддающихся биологическому разложению и нетоксичных (например, поли( -гидроксикислоты), полигидроксимасляной кислоты, полиортоэфира, полиангидрида, поликапролактона и т.д.), где предпочтительными являются поли(лактидкогликолиды), необязательно, обрабатывают для получения отрицательно заряженной поверхности (например, SDS) или положительно заряженной поверхности (например, катионными детергентами, такими как CTAB). -гидроксикислоты), полигидроксимасляной кислоты, полиортоэфира, полиангидрида, поликапролактона и т.д.), где предпочтительными являются поли(лактидкогликолиды), необязательно, обрабатывают для получения отрицательно заряженной поверхности (например, SDS) или положительно заряженной поверхности (например, катионными детергентами, такими как CTAB).
I. Липосомы (разделы 13 и 14 ссылки l42)
Примеры составов липосом, пригодных для применения в качестве адъювантов, описаны в ссылках 195-197.
J. Полиэтиленоксид и составы с полиэтиленоксидом
Адъюванты, пригодные для применения согласно изобретению, включают в себя простые эфиры полиэтиленоксида и сложные эфиры полиэтиленоксида [198]. Такие композиции дополнительно включают в себя сурфактанты сложных эфиров сорбита и полиэтиленоксида в сочетании с октоксинолом [199], так же как сурфактанты алкиловых простых или сложных эфиров полиэтиленоксида в сочетании по меньшей мере с одним дополнительным неионным сурфактантом, таким как октоксинол [200]. Предпочтительные простые эфиры выбирают из следующей группы: полиэтиленоксид-9-лаурилового эфира (laureth 9), полиэтиленоксид-9-стеарилового эфира, полиэтиленоксид-8-стеарилового эфира, полиэтиленоксид-4-лаурилового эфира, полиэтиленоксид-35-лаурилового эфира и полиэтиленоксид-23-лаурилового эфира.
K. Полифосфазен (PCPP)
Составы с PCPP описаны, например, в ссылках 201 и 202.
L. Мурамилпептиды
Примеры мурамилпептидов, пригодных для применения в качестве адъювантов согласно изобретению, включают в себя N-ацетилмурамил-L-треонил-D-изоглютамин (thr-MDP), N-ацетил-нор-мурамил-L-аланил-D-изоглутамин (nor-MDP) и N-ацетилмурамил-L-аланил-D-изоглутаминил-L-аланил-2-(1'-2'-дипальмитоил-sn-глицеро-3-гидроксифосфорилокси)этиламин (MTP-PE).
M. Имидазоксихинолоновые соединения
Примеры имидазоксихинолоновых соединений, пригодных для применения в качестве адъювантов согласно изобретению, включают в себя имиквимод и его гомологи, например ("резиквимод 3M"), описанные дополнительно в ссылках 203 и 204.
Изобретение может также относится к сочетаниям аспектов одного или нескольких адъювантов, определяемых выше. Например, согласно изобретению, можно использовать следующие композиции адъювантов: (1) сапонин и эмульсию типа "масло в воде" [205]; (2) сапонин (например, QS21) + нетоксичное производное LPS (например, 3dMPL) [206]; (3) сапонин (например, QS21) + нетоксичное производное LPS (например, 3dMPL) + холестерин; (4) сапонин (например, QS21) + 3dMPL + IL-12 (необязательно + стерин) [207]; (5) сочетания 3dMPL, например, с QS21 и/или эмульсиями типа "масло в воде" [208]; (6) SAF, содержащий 10% сквален, 0,4% Tween 80 , 5% плюрониловый блок-сополимер L121 и thr-MDP, или микрораспыляемые до субмикронной эмульсии, или перемешанные встряхиванием для получения эмульсии с частицами большего размера. (7) адъювантную систему Ribi , 5% плюрониловый блок-сополимер L121 и thr-MDP, или микрораспыляемые до субмикронной эмульсии, или перемешанные встряхиванием для получения эмульсии с частицами большего размера. (7) адъювантную систему Ribi (RAS), (Ribi Immunochem), содержащую 2% сквален, 0,2% Tween 80 и один или несколько компонентов бактериальной стенки из группы, состоящей из монофосфориллипида A (MPL), тригалозадимиколата (TDM) и скелета клеточной стенки (CWS), предпочтительно MPL+CWS (DetoxTM) и (8) одну или несколько минеральных солей (такую как соль алюминия) + нетоксичное производное LPS (такое как 3dMPL). (RAS), (Ribi Immunochem), содержащую 2% сквален, 0,2% Tween 80 и один или несколько компонентов бактериальной стенки из группы, состоящей из монофосфориллипида A (MPL), тригалозадимиколата (TDM) и скелета клеточной стенки (CWS), предпочтительно MPL+CWS (DetoxTM) и (8) одну или несколько минеральных солей (такую как соль алюминия) + нетоксичное производное LPS (такое как 3dMPL).
Другие вещества, действующие как иммуностимулирующие средства, описаны в разделе 7 ссылки 142.
Применение солей алюминия в качестве адъювантов особенно предпочтительно, и антигены, как правило, адсорбированы на таких солях. В конъюгатах MenC Menjugate и NeisVac и NeisVac применяют гидроксид как адъювант, в то время как в Meningitec применяют гидроксид как адъювант, в то время как в Meningitec применяют фосфат. В композициях согласно изобретению возможно адсорбировать некоторые антигены на гидроксиде алюминия, но получать другие антигены связанными с фосфатом алюминия. Однако, как правило, предпочтительно использовать только одну соль, например гидроксид или фосфат, но не обе соли. Предпочтительно избегать гидроксида алюминия как адъюванта, особенно если композиция содержит антиген Hib. Таким образом, предпочтительны композиции, не содержащие гидроксида алюминия. Предпочтительнее применение фосфатов алюминия, и типичным адъювантом является аморфный гидроксифосфат алюминия с молярным соотношением PO4/Al между 0,84 и 0,92, содержащий 0,6 мг Al3+/мл. Можно применять адсорбцию низкой дозой фосфата алюминия, например между 50 и 100 мкг A13+ в конъюгате на дозу. Когда применяют фосфат алюминия и желательно не адсорбировать антиген на адъюванте, это поддерживают включением в раствор свободных ионов фосфата (например, применением фосфатного буфера). применяют фосфат. В композициях согласно изобретению возможно адсорбировать некоторые антигены на гидроксиде алюминия, но получать другие антигены связанными с фосфатом алюминия. Однако, как правило, предпочтительно использовать только одну соль, например гидроксид или фосфат, но не обе соли. Предпочтительно избегать гидроксида алюминия как адъюванта, особенно если композиция содержит антиген Hib. Таким образом, предпочтительны композиции, не содержащие гидроксида алюминия. Предпочтительнее применение фосфатов алюминия, и типичным адъювантом является аморфный гидроксифосфат алюминия с молярным соотношением PO4/Al между 0,84 и 0,92, содержащий 0,6 мг Al3+/мл. Можно применять адсорбцию низкой дозой фосфата алюминия, например между 50 и 100 мкг A13+ в конъюгате на дозу. Когда применяют фосфат алюминия и желательно не адсорбировать антиген на адъюванте, это поддерживают включением в раствор свободных ионов фосфата (например, применением фосфатного буфера).
Не все конъюгаты нужно адсорбировать, т.е. некоторые из них или все они могут свободно присутствовать в растворе.
Другим предпочтительным адъювантом является фосфат кальция.
Способы лечения
Изобретение также относится к способам индукции иммунного ответа у млекопитающего, предусматривающим введение млекопитающему фармацевтической композиции согласно изобретению.
Изобретение также относится к способам индукции иммунного ответа у млекопитающего, предусматривающим стадию введения млекопитающему эффективного количества композиции согласно изобретению. Иммунный ответ предпочтительно является протективным и предпочтительно развивается с участием антител. Способ может индуцировать вторичный иммунный ответ.
Млекопитающее предпочтительно является человеком. В тех случаях, когда вакцина предназначена для профилактических целей, человек предпочтительно является ребенком (например, ребенком раннего возраста или грудным ребенком) или подростком; когда вакцина предназначена для терапевтического применения, человек предпочтительно является взрослым. Вакцину, предназначенную для детей, можно также вводить взрослым, например, для оценки безопасности, дозы, иммуногенности и т.д.
Изобретение относится также к композиции согласно изобретению для применения в качестве лекарственного средства. Лекарственное средство предпочтительно способно индуцировать иммунный ответ у млекопитающего (т.е. является иммуногенной композицией) и предпочтительнее является вакциной.
Изобретение также относится к применению (i) конъюгированного капсульного сахаридного антигена серогруппы C; (ii) конъюгированного капсульного сахаридного антигена серогруппы W135; (iii) конъюгированного капсульного сахаридного антигена серогруппы Y; (iv) одного или нескольких полипептидных антигенов серогруппы B и, необязательно, (v) конъюгированного капсульного сахаридного антигена серогруппы A в производстве лекарственного средства, индуцирующего иммунный ответ у млекопитающего.
Данные применения и способы предпочтительны для предупреждения и/или лечения заболевания, вызванного: Neisseria (например, менингиты, сепсис, бактериемия, гонорея и т.д.). Предпочтительным является предупреждение и/или лечение бактериальных и/или менингококковых менингитов.
Один из способов проверки эффективности терапевтического лечения предусматривает мониторинг инфекции Neisseria после введения композиции согласно изобретению. Один из способов проверки эффективности профилактического лечения предусматривает мониторинг иммунных ответов против пяти основных антигенов после введения композиции. Иммуногенность композиций согласно изобретению можно определить введением их контрольным субъектам (например, детям в возрасте 12-16 месяцев или модельным животным [209]) и определением затем стандартных параметров, включающих в себя сывороточные бактерицидные антитела (SBA) и титры в ELISA (GMT) общих и высокоавидных анти-капсульных IgG. Данные иммунные ответы, как правило, определяют около 4 недель после введения композиции и сравнивают с величинами, определенными перед введением композиции. Предпочтительно увеличение SBA по меньшей мере в 4 раза или в 8 раз. Когда вводят более одной дозы композиции, можно проводить более одного определения после введения.
Предпочтительные композиции согласно изобретению для приемлемой части человеческих субъектов могут обеспечивать в организме пациента титр антител, который превосходит критерий серопротекции для каждого антигенного компонента. Антигены со связанными титрами антител, выше которых хозяина считают показавшим сероконверсию против антигена, хорошо известны, и такие титры опубликованы организациями, такими как ВОЗ. Предпочтительно более 80% статистически значимой выборки субъектов показывают сероконверсию, предпочтительно более 90%, еще более предпочтительно более 93% и наиболее предпочтительно 96-100%.
Композиции согласно изобретению, как правило, вводят непосредственно пациенту. Непосредственной доставки можно достичь парентеральной инъекцией (например, подкожно, внутрибрюшинно, внутривенно, внутримышечно или в интерстициальные пространства ткани) или посредством ректального, орального, вагинального, местного, чрескожного, интраназального, глазного, ушного, легочного или другого введения на слизистую оболочку. Предпочтительно внутримышечное введение в бедро или плечо. Инъекцию можно проводить через иглу (например, подкожную иглу), но альтернативно можно применять инъекцию без иглы. Обычная внутримышечная доза составляет 0,5 мл.
Инъекцию можно применять для индукции системного иммунитета и/или иммунитета слизистых оболочек.
Дозирование при лечении можно проводить по схеме применения однократной дозы или по схеме применения множественных доз. Множественные дозы можно применять в схеме первичной иммунизации и/или в схеме вторичной иммунизации. После схемы первичной иммунизации может следовать схема вторичной иммунизации. Подходящие промежутки времени между примирующими дозами (например, между 4-16 неделями), и между примированием и вторичной иммунизацией можно определить общепринятыми способами.
Инфекции Neisseria поражают различные области тела, и таким образом композиции согласно изобретению можно получать в различных формах. Например, композиции можно получить как инъецируемые, в жидких растворах или суспензиях. Можно получить композицию для введения в легкие, например, в качестве ингалятора, с применением тонкого порошка или аэрозоля. Можно получить композицию в качестве суппозитория или пессария. Можно получить композицию для интраназального, ушного или глазного введения, например, в качестве аэрозоля, капель, геля или порошка [например, ссылки 210 и 211]. Опубликовано успешное назальное введение пневмококковых сахаридов [212, 213], пневмококковых полипептидов [214], сахаридов Hib [215], сахаридов MenC [216], и смесей конъюгатов сахаридов Hib и MenC [217].
Стабильность при хранении
Композиции согласно изобретению обеспечивают улучшенную стабильность, особенно для сахаридного компонента серогруппы A. Изобретение относится к способу получения вакцинной композиции, предусматривающему стадии (1) смешивания (i) конъюгированного капсульного сахаридного антигена серогруппы C, (ii) конъюгированного капсульного сахаридного антигена серогруппы W135, (iii) конъюгированного капсульного сахаридного антигена серогруппы Y и (iv) одного или нескольких полипептидных антигенов серогруппы B; (2) хранения композиции, полученной на стадии (1), по меньшей мере, 1 неделю; (3) подготовку шприца, содержащего композицию после хранения со стадии (2), готового для инъекции пациенту, и, необязательно, (4) инъекции композиции пациенту.
Стадия (1) может также предусматривать смешивание (v) конъюгированного капсульного сахаридного антигена серогруппы A. Она может также предусматривать смешивание (vi) конъюгированного антигена Hib. Она может также предусматривать смешивание (vii) пневмококкового антигена. Стадия (2) предпочтительно предусматривает хранение по меньшей мере в течение 2 недель, 4 недель, 6 недель, 8 недель, 10 недель, 12 недель или долее. Стадия хранения (2) необязательно может проводиться при температуре ниже комнатной (например, при 10±10°C).
Изобретение относится также к способу приготовления вакцинной композиции, предусматривающему стадии (1) смешивания (i) конъюгированного капсульного сахаридного антигена серогруппы C, (ii) конъюгированного капсульного сахаридного антигена серогруппы W135, (iii) конъюгированного капсульного сахаридного антигена серогруппы Y и (iv) одного или нескольких полипептидных антигенов серогруппы B; и (2) выделения объема единичной дозы из смешанных антигенов, и (c) упаковки выделенной единичной дозы в герметичный контейнер.
Стадия (1) может также предусматривать смешивание (v) конъюгированного капсульного сахаридного антигена серогруппы A. Она может также предусматривать смешивание (vi) конъюгированного антигена Hib. Она может также предусматривать смешивание (vii) пневмококкового антигена. Герметичный контейнер может представлять собой ампулу или шприц.
Изобретение относится к герметичному контейнеру, содержащему композицию согласно изобретению.
Общие положения
Термин "содержащий" означает "включающий в себя", также как "состоящий", например, композиция, "содержащая" X, может состоять исключительно из X или может включать в себя что-нибудь дополнительное, например X+Y.
Термин "приблизительно" по отношению к числовому значению x означает, например, x±10%.
Слова "в основном" не исключают "полностью", например, композиция, "в основном" свободная от Y может быть полностью свободной от Y. Когда необходимо, слова "в основном" можно исключить из определения изобретения.
Ссылки на процент идентичности последовательности между двумя аминокислотными последовательностями означают, что при выравнивании этот процент аминокислот одинаков в двух сравниваемых последовательностях. Такое выравнивание и процент гомологии или идентичности последовательности можно определить с применением программного обеспечения, известного в данной области, например описанного в разделе 7.7.18 ссылки 218. Предпочтительным выравниванием является определяемое по алгоритму поиска гомологии Смита-Вотермана с применением поиска аффинного пропуска со штрафом на внесение пропуска 12 и штрафом на продолжение пропуска 2, матрица BLOSUM 62. Алгоритм поиска гомологии Смита-Вотермана объяснен в ссылке 219.
Термин "алкил" относится к алкильным группам в неразветвленной и разветвленной формах. Алкильная группа может быть прервана 1, 2 или 3 гетероатомами, выбранными из -O-,-NH-или -S-. Алкильная группа может быть прервана 1, 2 или 3 двойными и/или тройными связями. Однако, как правило, термин "алкил" относится к алкильным группам, не имеющим прерываний гетероатомами или двойными или тройными связями. Когда ссылка дана на Cl-12-алкил, это означает, что алкильная группа может содержать любое число атомов углерода между 1 и 12 (например, Cl, C2, C3, C4, C5, C6, C7, C8, C9, C10, C11, C12). Подобным образом, когда ссылка дана на Cl-6-алкил, это означает, что алкильная группа может содержать любое число атомов углерода между 1 и 6 (например, Cl, C2, C3, C4, C5, C6).
Термин "циклоалкил" относится к циклоалкильным, полиалкильным и циклоалкенильным группам, так же как и к их сочетаниям с алкильными группами, такими как циклоалкильные группы. Циклоалкильная группа может быть прервана 1, 2 или 3 гетероатомами, выбранными из -O-, -NH- или -S-. Однако, как правило, термин "циклоалкил" относится к циклоалкильным группам, не имеющим прерываний гетероатомами. Примеры циклоалкильных групп включают в себя циклопентильную, циклогексильную, циклогексинильную, метилциклогексильную и адамантильную группы. Когда ссылка дана на C3-12-циклоалкил, это означает, что циклоалкильная группа может содержать любое число атомов углерода между 3 и 12 (например, C3, C4, C5, C6, C7, C8, C9, C10, C11, C12).
Термин "арил" относится к ароматической группе, такой как фенил или нафтил. Когда ссылка дана на C5-12-арил, это означает, что арильная группа может содержать любое число атомов углерода между 5 и 12 (например, C5, C6, C7, C8, C9, C10, C11, C12).
Термин «C5-12-арил-Cl-6-алкил» относится к таким группам, как бензил, фенилэтил и нафтилметил.
Защитные для азота группы включают в себя силильные группы (такие как TMS, TES, TBS, TIPS), ацильные производные (такие как фталимиды, трифторацетамиды, метоксикарбонил, этоксикарбонил, трет-бутоксикарбонил (Boc), бензилоксикарбонил (Z или Cbz), 9-флуоренилметоксикарбонил (Fmoc), 2-(триметилсилил)этоксикарбонил, 2,2,2-трихлорэтоксикарбонил (Troc)), сульфонильные производные (такие как  -триметилсилилэтансульфонил (SES)), сульфенильные производные, Cl-12-алкил, бензил, бензгидрил, тритил, 9-фенилфлуоренил и т.д. Предпочтительной защитной группой для азота является Fmoc. -триметилсилилэтансульфонил (SES)), сульфенильные производные, Cl-12-алкил, бензил, бензгидрил, тритил, 9-фенилфлуоренил и т.д. Предпочтительной защитной группой для азота является Fmoc.
Изобретение необязательно относится к последовательностям, включенным для облегчения клонирования или очистки и т.д., и их можно исключить или удалить.
Необходимо иметь в виду, что кольца сахаров могут присутствовать в открытой или замкнутой форме и так, что хотя на структурной формуле здесь показаны замкнутые формы, изобретение относится также и к открытым формам.
Полипептиды согласно изобретению можно получать различными способами (например, рекомбинантной экспрессией, очисткой из культуры клеток), химическим синтезом (по меньшей мере частично), и т.д.) и в различных формах (например, природные, слитные, негликозилированные, с присоединенным липидом и т.д.). Предпочтительно их получают в основном в чистой форме (например, в основном свободными от других белков N.meningitidis или клетки-хозяина). Хотя экспрессия полипептида может иметь место в Neisseria, предпочтительнее гетерологичный хозяин. Гетерологичный хозяин может быть прокариотом (например, бактерией) или эукариотом. Предпочтительно это E.coli, однако другие подходящие хозяева включают в себя Bacillus subtilis, Vibrio cholerae, Salmonella typhi, Salmonella typhimurium, Neisseria lactamica, Neisseria cinerea, Mycobacteria (например, M.tuberculosis), дрожжи и т.д.
Нуклеиновые кислоты согласно изобретению можно получать многими способами (например, химическим синтезом (по меньшей мере частично), из геномных или кДНК-библиотек, собственно из организма и т.д.), они могут принимать различные формы (например, одноцепочечные, двухцепочечные, векторы, зонды и т.д.). Предпочтительно их получают в основном в чистой форме (например, в основном свободными от других нуклеиновых кислот N.meningitidis или клетки-хозяина). Термин "нуклеиновые кислоты" относится к ДНК и РНК, и также их аналогам, таким как содержащие модифицированные остовы (например, фосфоротиоаты и т.д.), и также пептидные нуклеиновые кислоты (PNA) и т.д. Изобретение относится к нуклеиновым кислотам, включая последовательности, комплементарные описанным выше (например, предназначенные в качестве антисмысловых или зондов).
После серогрупп классификация менингококков включает в себя серотип, сероподтип и затем иммунотип, каждый из которых отделен двоеточием, например, B:4:P1,15:L3,7,9. Внутри серогруппы B некоторые линии вызывают заболевание часто (гиперинвазивные), некоторые линии вызывают более тяжелые формы заболевания, чем другие (гипервирулентные), и остальные вообще редко вызывают заболевание. Различают семь гипервирулентных линий, а именно подгруппы I, III и IV-1, комплекс ET-5, комплекс ET-37, кластер A4 и линия 3. Их определили мультилокусным ферментным электрофорезом (MLEE), но для классификации менингококков применяют также мультилокусное секвенирование-типирование (MLST) [ссылка 104].
СПОСОБЫ ОСУЩЕСТВЛЕНИЯ ИЗОБРЕТЕНИЯ
Гибридный белок  G287-953 G287-953
ДНК, кодирующие белок 287 менингококка штамма 394/98 серогруппы B и белок 953 менингококка штамма 2996 серогруппы B, расщепляли и лигировали вместе с короткой линкерной последовательностью с получением плазмиды, кодирующей аминокислотную последовательность SEQ ID 7. Плазмидой трансфицировали E.coli и растили бактерии для экспрессии белка. После достаточного роста бактерии собирали и очищали белок. Бактерии из культуры отделяли центрифугированием и осадок гомогенизировали в присутствии 50 мМ ацетатного буфера (pH 5) с соотношением объемов осадка:буфера 1:8. Проводили лизис с применением гомогенизатора высокого давления (AVESTIN, 4 цикла при 14000 фунт/кв. дюйм). После лизиса добавляли мочевину до конечной концентрации 5M с последующим помешиванием в течение 1 часа при комнатной температуре. pH уменьшали от 6 до 5 с применением 200 мМ ацетатного буфера (pH 4) + 5M мочевина. Смесь центрифугировали при 16800g в течение 60 минут при 2-8°C. Супернатант собирали и фильтровали посредством SARTOBRAN P (0,45-0,22 мкм SARTORIUS). Белок в фильтрованном супернатанте стабилен по меньшей мере в течение 30 суток при -20°C и по меньшей мере в течение 15 суток при 2-8°C.
Белок далее очищали на катионообменной колонке (SPFF, Amersham Biosciences) с элюцией с применением 350 мМ NaCl+50 мМ ацетат+5 M мочевина pH 5,00. Большинство примесей присутствовало в проскоке. Промыванием перед элюцией с применением более низкой концентрации NaCl (180 мМ) преимущественно удаляли два загрязняющих белка E.coli.
В элюированном веществе доводили pH до 8 (с применением 200 мМ Трис/HCl+5 М мочевина pH 9) и очищали дальше на колонке Q Sepharose HP (Amersham) с элюцией с применением 150 мМ NaCl+20 мМ Трис/HCl pH 8,00 в 5 М мочевине. И в этом случае промывание перед элюцией с применением пониженной концентрации соли (90 мМ) было полезно для удаления примесей.
Фильтрованное элюированное вещество после колонки Q HP разводили 1:2 с применением PBS pH 7,00 (150 мМ NaCl+10 мМ фосфат калия, pH 7,00) и затем диафильтровали против 10 объемов PBS pH 7,00 посредством тангенциальной ультрафильтрации. К концу диафильтрации вещество концентрировали в 1,6 раз до приблизительно 1,2 мг/мл общих белков. С применением мембраны, отсекающей 30000 Да (восстановленная целлюлозная мембрана 50 см2, Millipore PLCTK 30), возможно диализовать вещество с выходом приблизительно 90%.
Гибридный белок 936- G741 G741
ДНК, кодирующие белок 936 менингококка штамма 2996 серогруппы B и белок 741 менингококка штамма MC58 серогруппы B, расщепляли и лигировали вместе с короткой линкерной последовательностью c получением плазмиды, кодирующей аминокислотную последовательность SEQ ID 8. Плазмидой трансфицировали E.coli и растили бактерии для экспрессии белка. Рекомбинантный белок не секретировался, но оставался растворимым внутри бактерий.
После достаточного роста бактерии центрифугировали для получения влажной пасты и обрабатывали следующим образом:
- Гомогенизацией в системе высокого давления в присутствии 20 мМ фосфата натрия, pH 7,00.
- Центрифугированием и осветлением путем ортогональной фильтрации.
- Хроматографированием на катионной колонке (SP Sepharose Fast Flow) с элюцией 150 мМ NaCl в 20 мМ фосфате натрия, pH 7,00.
- Хроматографированием на анионной колонке (Q Sepharose XL) со сбором проскока.
- Хроматографированием на гидрофобной колонке (Phenyl Sepharose 6 Fast Flow High Sub) с элюцией 20 мМ фосфатом натрия, pH 7,00.
- Диафильтрацией против PBS, pH 7,4 с отсечкой 10 кДа.
- Конечной стерильной фильтрацией и хранением при -20°C.
Белок в конечном веществе стабилен по меньшей мере в течение 3 месяцев и при -20°C, и при 2-8°C.
Белок NadA(NL)(C)
ДНК, кодирующую белок NadA менингококка штамма 2996 серогруппы B, расщепляли для удаления последовательности, кодирующей C-конец, с получением плазмиды, кодирующей аминокислотную последовательность SEQ ID 1.
Плазмидой трансфицировали E.coli и бактерии растили для экспрессии белка. Рекомбинантный белок секретировался в культуральную среду, и в секретируемом белке отсутствовал лидерный пептид (SEQ ID 2). Супернатант обрабатывали следующим образом:
- 7× концентрированием и диафильтрацией против буфера 20 мМ Трис/HCl, pH 7,6 посредством ультрафильтрации (UF) с перекрестным потоком (отсечка 30 кДа).
- Хроматографированием на анионной колонке (Q Sepharose XL) с элюцией 400 мМ NaCl в 20 мМ Трис/HCl, pH 7,6.
- Стадией хроматографии на гидрофобной колонке (Phenyl Sepharose 6 Fast Flow High Sub) с элюцией 50 мМ NaCl в Трис/HCl, pH 7,6.
- Хроматография на колонке с керамическим гидроксилапатитом (HA Macro. Prep) с элюцией 200 мМ фосфатом натрия, pH 7,4.
- Диафильтрацией (отсечка 30 кДа) против PBS, pH 7,4.
- Конечной стерильной фильтрацией и хранением при -20°C.
Белок в конечном веществе стабилен по меньшей мере в течение 6 месяцев и при -20°C, и при 2-8°C.
Белок NadA подвержен деградации, и укороченные формы NadA можно обнаружить, используя метод вестерн-блоттинга или масс-спектрометрии (например, MALDI-TOF), выявляя потерю молекулярного веса до 10 кДа. Продукты деградации можно отделить от нативного NadA путем гель-фильтрации (например, с использованием колонки TSK300SWXL, предколонки TSKSWXL, TOSOHAAS). При такой фильтрации получают три пика: (i) первый пик со временем удерживания 12,637 мин и кажущимся молекулярным весом 885,036 Да; (ii) со временем удерживания 13,871 мин и кажущимся молекулярным весом 530,388 Да; (iii) со временем удерживания 13,871 мин и кажущимся молекулярным весом 530,388 Да. Анализ светорассеяния трех пиков показал фактические величины молекулярного веса (i) 208500 Да, (ii) 98460 Да, (iii) 78760 Да. Таким образом, первый пик содержит агрегаты NadA, и третий пик содержит продукты деградации. Так как ожидаемый молекулярный вес NadA(NL)(C) составляет 34113 Да, пик (ii) содержит тримерный белок, являющийся желаемым антигеном.
Сочетания антигенов
Мышей иммунизировали композицией, содержащей три белка, и с целью сравнения три белка также тестировали по отдельности. Применяли по десять мышей на группу. Смесь способна индуцировать высокие бактерицидные титры против различных штаммов:
| Штамм менингококка(серогруппа) |
 |
2996(В) |
МC58(В) |
NGH38 |
394/
98(В) |
H44/
76(B) |
F6124(А) |
BZ133(C) |
C11(C) |
| (1) |
32000 |
16000 |
130000 |
16000 |
32000 |
8000 |
16000 |
8000 |
| (2) |
256 |
131000 |
128 |
16000 |
32000 |
8000 |
16000 |
<4 |
| (3) |
32000 |
8000 |
- |
- |
- |
8000 |
- |
32000 |
| Мix |
32000 |
32000 |
65000 |
16000 |
260000 |
65000 |
>65000 |
8000 |
 - - показывает, что данный штамм не содержит гена NadA показывает, что данный штамм не содержит гена NadA |
При проверке у отдельных мышей, тройная смесь индуцировала высокие и постоянные бактерицидные титры против трех штаммов серогруппы B, из которых получены отдельные антигены:
| # |
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
| 2996 |
32768 |
16384 |
65536 |
32768 |
32768 |
65536 |
65536 |
32768 |
65536 |
8192 |
| МС58 |
65536 |
32768 |
65536 |
65536 |
65536 |
8192 |
65536 |
32768 |
32768 |
65536 |
| 394/98 |
65536 |
4096 |
16384 |
4096 |
8192 |
4096 |
32768 |
16384 |
8192 |
16384 |
Сочетание и сравнение с OMV
В дальнейших экспериментах антигены (20 мкг каждого антигена на дозу) вводили в сочетании с 10 мкг OMV, полученных или из штамма H44/76 (Норвегия), или из штамма 394/98 (Новая Зеландия). Положительными контролями являлись антикапсульное МАТ SEAM-3 для серогруппы B или CRM197-конъюгированные капсульные сахариды для других штаммов. Для смеси почти всегда получали лучшие титры, чем просто для OMV, и добавление смеси к OMV почти всегда значительно улучшало эффективность OMV. Во многих случаях ответ для смеси антигенов совпадал с ответом для положительного контроля или превышал его.
Тесты гипервирулентных линий
Следующие антигены тестировали против ряда штаммов серогруппы B из ряда гипервирулентных линий:
(a) NadA(NL)(C)
(b)  G287-953 G287-953
(c) 936- G741 G741
(d) смесь из (a), (b) и (c)
(e) OMV, полученные из штамма H44/76 (Норвегия)
(f) OMV, полученные из штамма 394/98 (Новая Зеландия)
(g) смесь из  G287 и (e) G287 и (e)
(h) смесь из (d) и (e)
(i) смесь из (d) и (f)
SEAM-3 применяли в качестве положительного контроля.
Получены следующие результаты, выраженные как процент штаммов в указанной гипервирулентной линии, где бактерицидный титр в сыворотке превышал 1024:
 |
# штаммов |
(а) |
(b) |
(c) |
(d) |
(e) |
(f) |
(g) |
(h) |
(i) |
S-3 |
| А4 |
4 |
50 |
50 |
0 |
100 |
25 |
25 |
25 |
100 |
100 |
+ |
| ET-5 |
8 |
25 |
75 |
88 |
100 |
71 |
14 |
71 |
100 |
100 |
+ |
| Линия 3 |
13 |
0 |
75 |
15 |
93 |
8 |
85 |
8 |
92 |
93 |
+ |
| ET-37 |
4 |
11 |
22 |
0 |
33 |
0 |
0 |
0 |
22 |
25 |
+ |
Против конкретных контрольных штаммов получены следующие бактерицидные титры:
 |
# штаммов |
(а) |
(b) |
(c) |
(d) |
(e) |
(f) |
(g) |
(h) |
(i) |
S-3 |
| А4 |
961-5945 |
128 |
2048 |
<8 |
2048 |
262144 |
8192 |
262144 |
262144 |
4096 |
8192 |
| ET-5 |
44/76 |
<4 |
2048 |
32768 |
131072 |
524288 |
8192 |
524288 |
524288 |
524288 |
16384 |
| Линия 3 |
394/98 |
<4 |
1024 |
32 |
4096 |
<4 |
16384 |
256 |
16384 |
16384 |
16384 |
| ET-37 |
LPN
17592 |
2048 |
1024 |
256 |
4096 |
<8 |
<8 |
512 |
16384 |
65536 |
1024 |
Таким образом, композиции (d), (h) и (i) индуцируют ответы бактерицидных антител против широкого ряда штаммов менингококка серогруппы B из гипервирулентных линий A4, ET-5 и линии 3. С применением композиций (h) и (i) титры, как правило, выше, чем с (d), однако охват штаммов в гипервирулентных линиях A4, ET-5 и линии 3 не лучше.
Охват нетипированных штаммов для композиций (d), (h) и (i) также высок.
Сочетание с менингококковыми и/или Hib-конъюгатами
Тройную композицию MenB объединяли со смесью олигосахаридных конъюгатов для серогрупп C, W135 и Y для получения вакцины, содержащей следующие антигены:
| Компонент |
Количество на дозу 0,5 мл |
| Конъюгат серогруппы C |
10 мкг сахарида + 12,5-25 мкг CRM197 |
| Конъюгат серогруппы W135 |
10 мкг сахарида + 6,6-20 мкг CRM197 |
| Конъюгат серогруппы Y |
10 мкг сахарида + 6,6-20 мкг CRM197 |
 G287-953 G287-953 |
20 мкг полипептида |
936- G741 G741 |
20 мкг полипептида |
| NadA |
20 мкг полипептида |
Подобную вакцину получали, включая в состав конъюгат MenA (10 мкг сахарида + 12,5-33 мкг CRM197) и/или конъюгат HbOC Hib (10 мкг сахарида + 2-5 мкг CRM197).
В одной серии тестов объединяли конъюгаты серогрупп C, W135 и Y, с присутствием 40 мкг/мл каждого конъюгата (измеренного как сахарида). Для хранения перед применением с антигенами MenB объединенные конъюгаты лиофилизировали [при -45°C в течение 3 часов, при -35°C в течение 20 часов в вакууме 50 мТор, при 30°C в течение 10 часов при 50 мТор, при 30°C в течение 9 часов при 125 мТор] в присутствии 15 мг сахарозы, 10 мМ фосфатного буфера (pH 7,2). Конечный объем перед лиофилизацией составлял 0,3 мл. Следовательно, после ресуспендирования в 0,6 мл водного раствора присутствует 12 мкг сахаридов на серогруппу. Лиофилизацию применяли только для удобства, и в ходе обычного хранения лиофилизация не требуется ни для эффективности, ни для стабильности конечного продукта.
Вторую серию вещества получали таким же образом, но включали в состав также конъюгат серогруппы A с той же дозой сахарида, как для серогрупп C, W135 и Y.
Третью серию вещества получали таким же образом (серогруппы A, C, W135 и Y), но включая также конъюгат Hib-CRM197 в такой же сахаридной дозе, как и для менингококков.
Для сравнения получали лиофилизированные препараты конъюгатов серогрупп A и C. Вещество MenA лиофилизировали с 15 мг сахарозы для получения 12 мкг дозы сахарида после разбавления, как описано выше. Вещество MenC лиофилизировали с 9 мг маннита для получения 12 мкг дозы сахарида после разбавления.
Данные вещества объединяли с 600 мкл смеси серогрупп (d) (или, как контроль, т.е. группы 2 и 3, в такой же композиции, но в отсутствие антигенов) для получения восьми композиций:
| Компоненты |
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
 |
 |
 |
 |
 |
 |
 |
 |
 |
| NadA(NL)(C) мкг/дозу |
20 |
 |
 |
20 |
20 |
20 |
20 |
20 |
| 936-741 мкг/дозу |
20 |
 |
 |
20 |
20 |
20 |
20 |
20 |
| 287-953 мкг/дозу |
20 |
 |
 |
20 |
20 |
20 |
20 |
20 |
| MenA-CRM мкг/дозу* |
 |
2,4 |
2,4 |
2,4 |
 |
 |
2,4 |
2,4 |
| MenC-CRM мкг/дозу* |
 |
2,4 |
2,4 |
 |
2,4 |
2,4 |
2,4 |
2,4 |
| MenW-CRM мкг/дозу* |
 |
2,4 |
2,4 |
 |
 |
2,4 |
2,4 |
2,4 |
| MenY-CRM мкг/дозу* |
 |
2,4 |
2,4 |
 |
 |
2,4 |
2,4 |
2,4 |
| Hib-CRM мкг/дозу* |
 |
 |
2,4 |
 |
 |
 |
 |
2,4 |
| Гидроксид алюминия мг/дозу |
0,15 |
0,15 |
0,15 |
0,15 |
0,15 |
0,15 |
0,15 |
0,15 |
| Гистидин мМ |
10 |
10 |
10 |
10 |
10 |
10 |
10 |
10 |
| Сахароза мг/дозу |
 |
3 |
3 |
3 |
 |
3 |
3 |
3 |
| Маннит мг/дозу |
 |
 |
 |
 |
1,8 |
 |
 |
 |
| Фосфат калия pH 7,2 мМ |
 |
3 |
3 |
3 |
 |
3 |
3 |
3 |
| Фосфат натрия pH 7,2 мМ |
 |
 |
 |
 |
3 |
 |
 |
 |
| Хлорид натрия мг/дозу |
1,8 |
1,8 |
1,8 |
1,8 |
1,8 |
1,8 |
1,8 |
1,8 |
| * Количество указано по сахариду |
Данные композиции вводили внутрибрюшинно в объеме 200 мкл мышам CD/1 (8 на группу) на 0, 21 и 35 сутки с конечным спуском крови на 49 сутки. Сыворотку 49 суток тестировали в анализах SBA против ряда штаммов менингококков в серогруппах A, B, C, W135 и Y. Полученные результаты:
Таким образом, белковые антигены менингококкоков остаются эффективными даже после добавления конъюгированных менингококковых и Hib-сахаридных антигенов. Подобным образом, менингококковые конъюгаты остаются эффективными даже после добавления белковых антигенов. Действительно, данные позволяют предполагать, что добавление белковых антигенов к конъюгатам улучшает эффективность анти-MenW135 (сравни группы 2 и 7). Более того, существует уровень перекрестной реактивности, особенно для серогруппы Y, поскольку для самих по себе белковых антигенов получен хороший титр анти-MenY [ср. ссылку 220], как для групп 4 и 5.
Данные показывают также, что добавление конъюгата Hib к менингококковым конъюгатам (сравни группы 2 и 3) улучшает активность анти-W135.
Применение модифицированного сахарида MenA
Очищали капсульный полисахарид из MenA и гидролизовали для получения олигосахарида MenA. Полисахарид (2 г) гидролизовали при 50°C в 50 мМ буфере с ацетатом натрия pH 4,75, при концентрации полисахарида 10 мг/мл в течение приблизительно 4 часов [73]. После гидролиза раствор высушивали роторным испарением.
Олигосахарид активировали с применением следующей схемы реакции:
Олигосахарид растворяли в DMSO для получения концентрации сахарида 10 мг/мл. Согласно молярному соотношению олигосахарид:CDI 1:20, 21,262 г CDI добавляли затем в реакционную смесь, перемешивая 16 часов при комнатной температуре. Полученное соединение MenA-CDI очищали избирательным осаждением в смеси 80:20 (об./об.) ацетон:DMSO с последующим центрифугированием. Эффективность реакции активации рассчитали как приблизительно 67,9% определением соотношения свободного имидазола к связанному имидазолу.
На второй стадии реакции олигосахарид MenA-CDI растворяли в DMSO при концентрации сахарида приблизительно 10 мг/мл. Согласно молярному соотношению звено MenA-CDI:DMA 1:100 добавляли 36,288 г 99% диметиламингидрохлорида (т.е. Rl и R2=Me)и реакционную смесь перемешивали 16 часов при комнатной температуре. Продукт реакции сушили сублимацией и перерастворяли в водном растворе при 10 мг/мл.
Для удаления из олигосахаридного препарата низкомолекулярного реакционного реагента (в частности, диметиламина (DMA)) проводили стадию диализа через мембрану 3,5 кДа MWCO (Spectra/Por ). Проводили четыре стадии диализа: (i) 16 часов против 2 л 1 М хлорида натрия (коэффициент диализа 1:20), (ii) 16 часов против 2 л 0,5 М хлорида натрия (коэффициент диализа 1:20), (iii) и (iv) 16 часов против 2 л WFI (коэффициент диализа 1:20). Для улучшения очистки также проведена стадия диафильтрации через мембрану 1 кДа MWCO (Centricon ). Проводили четыре стадии диализа: (i) 16 часов против 2 л 1 М хлорида натрия (коэффициент диализа 1:20), (ii) 16 часов против 2 л 0,5 М хлорида натрия (коэффициент диализа 1:20), (iii) и (iv) 16 часов против 2 л WFI (коэффициент диализа 1:20). Для улучшения очистки также проведена стадия диафильтрации через мембрану 1 кДа MWCO (Centricon ). ).
Очищенный продукт MenA-CDI-DMA забуферивали при pH 6,5 в 25 мМ L-гистидине (Fluka ). ).
Для получения конъюгатов модифицированного сахарида MenA (MenA-CDI-DMA) проводили следующий общий процесс:
- гидролиз полисахарида для получения олигосахаридных фрагментов
- сортировка по размерам олигосахаридных фрагментов
- восстановительное аминирование концевых альдегидных групп сортированных по размерам олигосахаридов
- защита концевых -NH2-групп группой Fmoc перед реакцией с CDI
- внутреннее снятие защиты -NH2-групп в ходе реакции с DMA
- активация концевых -NH2-групп SIDEA (N-гидроксисукцинимид адипиновой кислотой)
- ковалентное присоединение к белку CRM197.
Модифицированный олигосахаридный конъюгат MenA намного более устойчив к гидролизу при повышенных температурах, чем его природный аналог. Например, после 28 суток при 37°C, процент высвобождающегося сахарида составляет 6,4% для модифицированного олигосахарида против 23,5% для природного антигена. Вместе с тем, титры, индуцированные модифицированными олигосахаридами, незначительно ниже, чем титры, полученные при применении природных структур сахаров.
Модифицированный конъюгат MenA объединяли с конъюгатами MenC, MenW135 и MenY в качестве замены немодифицированного олигосахарида. Данную тетравалентную смесь смешивали с тремя полипептидами MenB для получения вакцины, эффективной в однократной дозе против серогрупп N.meningitidis A, B, C, W135 и Y.
Пневмококковые сочетания
Три объединенных белка MenB смешивали с пневмококковыми сахаридными конъюгатами для получения конечной концентрации 2 мкг/дозу каждого из пневмококковых серотипов (двойное количество для серотипа 6B). Таким образом, реконструированная вакцина содержит следующие антигены:
| Компонент |
Количество на дозу 0,5 мл |
| Конъюгат серогруппы A |
5 мкг сахарида+6,25-16,5 мкг CRM197 |
| Конъюгат серогруппы C |
5 мкг сахарида+6,25-12,5 мкг CRM197 |
| Конъюгат серогруппы W135 |
5 мкг сахарида+3,3-10 мкг CRM197 |
| Конъюгат серогруппы Y |
5 мкг сахарида+3,3-10 мкг CRM197 |
| Конъюгат серотипа 4 пневмококка |
2 мкг сахарида+2,5 мкг CRM197 |
| Конъюгат серотипа 9V пневмококка |
2 мкг сахарида+2,5 мкг CRM197 |
| Конъюгат серотипа 14 пневмококка |
2 мкг сахарида+2,5 мкг CRM197 |
| Конъюгат серотипа 18C пневмококка |
2 мкг сахарида+2,5 мкг CRM197 |
| Конъюгат серотипа 19F пневмококка |
2 мкг сахарида+2,5 мкг CRM197 |
| Конъюгат серотипа 23F пневмококка |
2 мкг сахарида+2,5 мкг CRM197 |
| Конъюгат серотипа 6B пневмококка |
4 мкг сахарида+5 мкг CRM197 |
Понятно, что изобретение описано только посредством примера и могут быть внесены модификации, оставаясь в пределах объема и сущности изобретения.
Формула изобретения
1. Водная композиция для иммунизации против бактериального менингита, которая после введения субъекту способна индуцировать иммунный ответ, являющийся бактерицидным, по меньшей мере, в отношении серогрупп В, С, W135 и Y N.meningitidis, включающая (i) конъюгированный капсульный сахаридный антиген серогруппы С; (ii) конъюгированный капсульный сахаридный антиген серогруппы W135; (iii) конъюгированный капсульный сахаридный антиген серогруппы Y; и (iv) белок  NadA NadA в олигомерной форме, белок в олигомерной форме, белок  741 741 , белок , белок  936 936 , белок , белок  953 953 и белок и белок  287 287 , где NadA обладает аминокислотной последовательностью, которая (а) на 50% или более идентична SEQ ID NO:2, и/или (б) содержит фрагмент из, по меньшей мере, 7 последовательных аминокислот SEQ ID NO:1, включающий эпитоп из SEQ ID NO:1; 741 обладает аминокислотной последовательностью, которая (а) на 50% или более идентична SEQ ID NO:3, и/или (б) содержит фрагмент из, по меньшей мере, 7 последовательных аминокислот SEQ ID NO:3, включающий эпитоп из SEQ ID NO:3; 936 обладает аминокислотной последовательностью, которая (а) на 50% или более идентична SEQ ID NO:4, и/или (б) содержит фрагмент из, по меньшей мере, 7 последовательных аминокислот SEQ ID NO:4, включающий эпитоп из SEQ ID NO:4; 953 обладает аминокислотной последовательностью, которая (а) на 50% или более идентична SEQ ID NO:5, и/или (б) содержит фрагмент из, по меньшей мере, 7 последовательных аминокислот SEQ ID NO:5, включающий эпитоп из SEQ ID NO:5; 287 обладает аминокислотной последовательностью, которая (а) на 50% или более идентична SEQ ID NO:6, и/или (б) содержит фрагмент из, по меньшей мере, 7 последовательных аминокислот SEQ ID NO:6, включающий эпитоп из SEQ ID NO:6. , где NadA обладает аминокислотной последовательностью, которая (а) на 50% или более идентична SEQ ID NO:2, и/или (б) содержит фрагмент из, по меньшей мере, 7 последовательных аминокислот SEQ ID NO:1, включающий эпитоп из SEQ ID NO:1; 741 обладает аминокислотной последовательностью, которая (а) на 50% или более идентична SEQ ID NO:3, и/или (б) содержит фрагмент из, по меньшей мере, 7 последовательных аминокислот SEQ ID NO:3, включающий эпитоп из SEQ ID NO:3; 936 обладает аминокислотной последовательностью, которая (а) на 50% или более идентична SEQ ID NO:4, и/или (б) содержит фрагмент из, по меньшей мере, 7 последовательных аминокислот SEQ ID NO:4, включающий эпитоп из SEQ ID NO:4; 953 обладает аминокислотной последовательностью, которая (а) на 50% или более идентична SEQ ID NO:5, и/или (б) содержит фрагмент из, по меньшей мере, 7 последовательных аминокислот SEQ ID NO:5, включающий эпитоп из SEQ ID NO:5; 287 обладает аминокислотной последовательностью, которая (а) на 50% или более идентична SEQ ID NO:6, и/или (б) содержит фрагмент из, по меньшей мере, 7 последовательных аминокислот SEQ ID NO:6, включающий эпитоп из SEQ ID NO:6.
2. Композиция по п.1, содержащая первый полипептид, содержащий аминокислотную последовательность SEQ ID NO:2; второй полипептид, содержащий аминокислотную последовательность SEQ ID NO:7; и третий полипептид, содержащий аминокислотную последовательность SEQ ID NO:8.
3. Композиция по п.1, дополнительно содержащая (v) конъюгированный капсульный сахаридный антиген серогруппы А.
4. Композиция по п.3, где капсульный сахаридный антиген серогруппы А модифицирован так, что, по меньшей мере, 20% его моносахаридных звеньев не несут -ОН ни в 3, ни в 4 положениях.
5. Композиция по п.4, которую можно хранить 28 сут при 37°С, и после такого периода менее чем 20% исходного общего количества конъюгированного сахарида MenА станет неконъюгированным.
6. Композиция по п.5, где конъюгированный сахаридный антиген представляет собой олигосахарид.
7. Композиция по п.6, где сахаридный антиген конъюгирован с белком-носителем, выбранным из дифтерийного анатоксина, столбнячного анатоксина, белка D из H.influenzae и CRM197.
8. Композиция по п.1, содержащая фосфат алюминия в качестве адъюванта.
9. Водная иммуногенная композиция для иммунизации против бактериального менингита, которая после введения субъекту способна индуцировать иммунный ответ, являющийся бактерицидным, по меньшей мере, в отношении серогруппы В, С, W135 и Y N.meningitidis, включающая (i) конъюгированный капсульный сахаридный антиген серогруппы С; (ii) конъюгированный капсульный сахаридный антиген серогруппы W135; (iii) конъюгированный капсульный сахаридный антиген серогруппы Y; и (iv) белок  NadA NadA в олигомерной форме, белок в олигомерной форме, белок  741 741 , белок , белок  936 936 , белок , белок  953 953 и белок и белок  287 287 , где NadA обладает аминокислотной последовательностью, которая (а) на 50% или более идентична SEQ ID NO:2, и/или (б) содержит фрагмент из, по меньшей мере, 7 последовательных аминокислот SEQ ID NO:1, включающий эпитоп из SEQ ID NO:1; 741 обладает аминокислотной последовательностью, которая (а) на 50% или более идентична SEQ ID NO:3, и/или (б) содержит фрагмент из, по меньшей мере, 7 последовательных аминокислот SEQ ID NO:3, включающий эпитоп из SEQ ID NO:3; 936 обладает аминокислотной последовательностью, которая (а) на 50% или более идентична SEQ ID NO:4, и/или (б) содержит фрагмент из, по меньшей мере, 7 последовательных аминокислот SEQ ID NO:4, включающий эпитоп из SEQ ID NO:4; 953 обладает аминокислотной последовательностью, которая (а) на 50% или более идентична SEQ ID NO:5, и/или (б) содержит фрагмент из, по меньшей мере, 7 последовательных аминокислот SEQ ID NO:5, включающий эпитоп из SEQ ID NO:5; 287 обладает аминокислотной последовательностью, которая (а) на 50% или более идентична SEQ ID NO:6, и/или (б) содержит фрагмент из, по меньшей мере, 7 последовательных аминокислот SEQ ID NO:6, включающий эпитоп из SEQ ID NO:6, и сахаридный антиген H.influenzae типа В (Hib), который дополнительно делает специфический иммунный ответ профилактическим против заболевания, вызванного H.influenzae типа b. , где NadA обладает аминокислотной последовательностью, которая (а) на 50% или более идентична SEQ ID NO:2, и/или (б) содержит фрагмент из, по меньшей мере, 7 последовательных аминокислот SEQ ID NO:1, включающий эпитоп из SEQ ID NO:1; 741 обладает аминокислотной последовательностью, которая (а) на 50% или более идентична SEQ ID NO:3, и/или (б) содержит фрагмент из, по меньшей мере, 7 последовательных аминокислот SEQ ID NO:3, включающий эпитоп из SEQ ID NO:3; 936 обладает аминокислотной последовательностью, которая (а) на 50% или более идентична SEQ ID NO:4, и/или (б) содержит фрагмент из, по меньшей мере, 7 последовательных аминокислот SEQ ID NO:4, включающий эпитоп из SEQ ID NO:4; 953 обладает аминокислотной последовательностью, которая (а) на 50% или более идентична SEQ ID NO:5, и/или (б) содержит фрагмент из, по меньшей мере, 7 последовательных аминокислот SEQ ID NO:5, включающий эпитоп из SEQ ID NO:5; 287 обладает аминокислотной последовательностью, которая (а) на 50% или более идентична SEQ ID NO:6, и/или (б) содержит фрагмент из, по меньшей мере, 7 последовательных аминокислот SEQ ID NO:6, включающий эпитоп из SEQ ID NO:6, и сахаридный антиген H.influenzae типа В (Hib), который дополнительно делает специфический иммунный ответ профилактическим против заболевания, вызванного H.influenzae типа b.
10. Водная иммуногенная композиция для иммунизации против бактериального менингита, которая после введения субъекту способна индуцировать иммунный ответ, являющийся бактерицидным, по меньшей мере, в отношении серогруппы В, С, W135 и Y N.meningitidis, включающая (i) конъюгированный капсульный сахаридный антиген серогруппы С; (ii) конъюгированный капсульный сахаридный антиген серогруппы W135; (iii) конъюгированный капсульный сахаридный антиген серогруппы Y; и (iv) белок  NadA NadA в олигомерной форме, белок в олигомерной форме, белок  741 741 , белок , белок  936 936 , белок , белок  953 953 и белок и белок  287 287 , где NadA обладает аминокислотной последовательностью, которая (а) на 50% или более идентична SEQ ID NO:2, и/или (б) содержит фрагмент из, по меньшей мере, 7 последовательных аминокислот SEQ ID NO:1, включающий эпитоп из SEQ ID NO:1; 741 обладает аминокислотной последовательностью, которая (а) на 50% или более идентична SEQ ID NO:3, и/или (б) содержит фрагмент из, по меньшей мере, 7 последовательных аминокислот SEQ ID NO:3, включающий эпитоп из SEQ ID NO:3; 936 обладает аминокислотной последовательностью, которая (а) на 50% или более идентична SEQ ID NO:4, и/или (б) содержит фрагмент из, по меньшей мере, 7 последовательных аминокислот SEQ ID NO:4, включающий эпитоп из SEQ ID NO:4; 953 обладает аминокислотной последовательностью, которая (а) на 50% или более идентична SEQ ID NO:5, и/или (б) содержит фрагмент из, по меньшей мере, 7 последовательных аминокислот SEQ ID NO:5, включающий эпитоп из SEQ ID NO:5; 287 обладает аминокислотной последовательностью, которая (а) на 50% или более идентична SEQ ID NO:6, и/или (б) содержит фрагмент из, по меньшей мере, 7 последовательных аминокислот SEQ ID NO:6, включающий эпитоп из SEQ ID NO:6, сахаридный антиген H.influenzae типа В (Hib), который дополнительно делает специфический иммунный ответ профилактическим против заболевания, вызванного H.influenzae типа b; и антиген Streptococcus pneumoniae, который дополнительно делает специфический иммунный ответ профилактическим против заболевания, вызванного Streptococcus pneumoniae. , где NadA обладает аминокислотной последовательностью, которая (а) на 50% или более идентична SEQ ID NO:2, и/или (б) содержит фрагмент из, по меньшей мере, 7 последовательных аминокислот SEQ ID NO:1, включающий эпитоп из SEQ ID NO:1; 741 обладает аминокислотной последовательностью, которая (а) на 50% или более идентична SEQ ID NO:3, и/или (б) содержит фрагмент из, по меньшей мере, 7 последовательных аминокислот SEQ ID NO:3, включающий эпитоп из SEQ ID NO:3; 936 обладает аминокислотной последовательностью, которая (а) на 50% или более идентична SEQ ID NO:4, и/или (б) содержит фрагмент из, по меньшей мере, 7 последовательных аминокислот SEQ ID NO:4, включающий эпитоп из SEQ ID NO:4; 953 обладает аминокислотной последовательностью, которая (а) на 50% или более идентична SEQ ID NO:5, и/или (б) содержит фрагмент из, по меньшей мере, 7 последовательных аминокислот SEQ ID NO:5, включающий эпитоп из SEQ ID NO:5; 287 обладает аминокислотной последовательностью, которая (а) на 50% или более идентична SEQ ID NO:6, и/или (б) содержит фрагмент из, по меньшей мере, 7 последовательных аминокислот SEQ ID NO:6, включающий эпитоп из SEQ ID NO:6, сахаридный антиген H.influenzae типа В (Hib), который дополнительно делает специфический иммунный ответ профилактическим против заболевания, вызванного H.influenzae типа b; и антиген Streptococcus pneumoniae, который дополнительно делает специфический иммунный ответ профилактическим против заболевания, вызванного Streptococcus pneumoniae.
11. Композиция по любому из пп.1-10, упакованная в герметичный контейнер.
12. Композиция по п.13, где контейнер представляет собой ампулу или шприц.
13. Применение композиции по любому из пп.1-12 в качестве лекарственного средства, которое является бактерицидным в отношении менингококковой инфекции.
14. Применение композиции по п.1, включающей: (i) конъюгированный капсульный сахаридный антиген серогруппы С; (ii) конъюгированный капсульный сахаридный антиген серогруппы W135; (iii) конъюгированный капсульный сахаридный антиген серогруппы Y; (iv) один или несколько полипептидных антигенов серогруппы В и необязательно (v) конъюгированный капсульный сахаридный антиген серогруппы А в производстве лекарственного средства для иммунизации млекопитающего против бактериального менингита.
15. Способ индукции специфического иммунного ответа у млекопитающего, предусматривающий введение млекопитающему композиции по любому из пп.1-12.
16. Водная иммуногенная композиция для иммунизации против бактериального менингита, которая после введения субъекту способна индуцировать иммунный ответ, который является (а) бактерицидным, по меньшей мере, в отношении серогруппы W135 N.meningitidis и одновременно (б) профилактическим против заболевания, вызванного H.influenzae типа b, где композиция включает в себя (i) конъюгированный капсульный сахаридный антиген серогруппы W135; (ii) конъюгированный сахаридный антиген H.influenzae типа b.
17. Композиция по п.16, дополнительно содержащая капсульные сахаридные антигены серогрупп С и Y и необязательно А.
18. Композиция по п.16 или 17, дополнительно содержащая один или несколько полипептидных антигенов серогруппы В N.meningitidis.
19. Водная композиция для иммунизации против бактериального менингита, которая после введения субъекту способна индуцировать иммунный ответ, являющийся бактерицидным, по меньшей мере, в отношении серогрупп В, С, W135 и Y N.meningitidis, включающая (i) конъюгированный капсульный сахаридный антиген серогруппы С; (ii) конъюгированный капсульный сахаридный антиген серогруппы W135; (iii) конъюгированный капсульный сахаридный антиген серогруппы Y; и (iv) первый полипептидный антиген из серогруппы В, содержащий аминокислотную последовательность SEQ ID NO:2, второй полипептид, содержащий аминокислотную последовательность SEQ ID NO:7, и третий полипептид, содержащий аминокислотную последовательность SEQ ID NO:8. |
|
|
|