(54) ПРОИЗВОДНЫЕ ГИАЛУРОНОВОЙ КИСЛОТЫ С ПОНИЖЕННОЙ БИОДЕГРАДИРУЕМОСТЬЮ
(57) Реферат:
Изобретение относится к новым производным гиалуроновой кислоты, которые могут быть использованы в медицине и фармакологии. Описываются производные гиалуроновой кислоты общей формулы
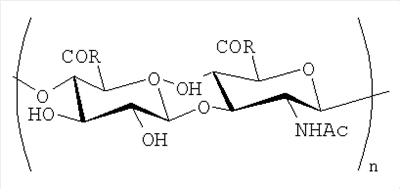 , где R=ОН или R1 и соотношение R1:OH изменяется от 8:92 до 100:0 , где R=ОН или R1 и соотношение R1:OH изменяется от 8:92 до 100:0
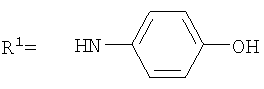 , ,  , ,  , , 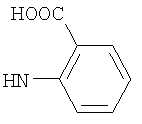 , ,
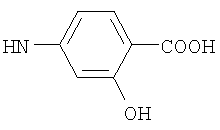 , , 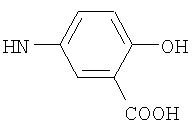 , , 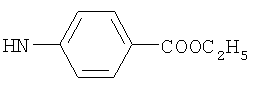 , ,
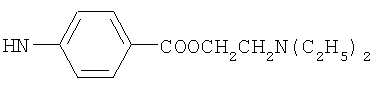 , ,  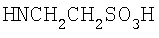 , ,
 , ,  , , 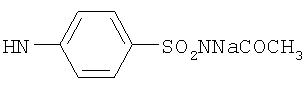 , ,
обладающие пониженной биодеградируемостью по сравнению с природной гиалуроновой кислотой. 3 ил., 1 табл.
Изобретение относится к новым химическим веществам, а именно к производным гиалуроновой кислоты, которые могут быть использованы в медицине, фармакологии.
Гиалуроновая кислота (ГК) относится к классу гликозаминогликанов - гетерополисахаридов линейного строения, является основным веществом внеклеточного матрикса, выполняет важные функции в живых организмах и состоит из повторяющихся звеньев D-глюкуроновой кислоты и N-ацетил-D-глюкозамина:
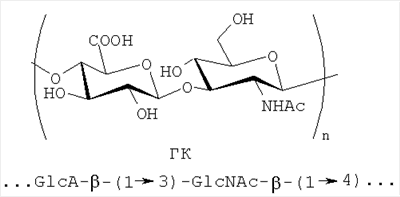
Высокомолекулярная ГК (М˜106 Да) входит в состав вискоэластичных гелей "Provisk" (Швеция) и "Healon" (Канада), применяющихся в офтальмохирургии при операциях экстракции катаракты, является действующим веществом в пленках "Seprafilm" для предупреждения спаечной болезни брюшины. Гидрогель на основе комплексной соли ГК с хлоридом железа (III) (0.5% FeCl3) предложен в качестве барьерного материала (фирма "Этикон") и предназначается для профилактики спаечной болезни в абдоминальной хирургии. Низкомолекулярной ГК пропитывают салфетки "Гиаплюс" (г. Тула), используемые для лечения ожоговой болезни. Лекарственное средство "Куриозин" (Гедеон Рихтер, Венгрия), представляющее собой цинковую соль ГК, используется для лечения трофических язв и угрей, препарат "Цистистат" восстанавливает функции слизистой оболочки мочевого пузыря при интерстициальном цистите, препараты "Sinvisc", "Viscorneal-Ortho" и др. предназначаются для внутрисуставного введения и применяются для лечения артритов различной этиологии. ГК является также компонентом косметических кремов и тоников для стимуляции роста волос.
В последние годы проявляется большой интерес к получению и исследованию биологических свойств химически модифицированной ГК. Химическая модификация может придать ГК дополнительные медикаментозные свойства, можно также ожидать значительного изменения физико-химических и биологических свойств модифицированной ГК (биодоступность, биодеградируемость), существенного расширения областей применения производных ГК как самостоятельных лекарственных препаратов, так и в качестве адъювантов (в качестве систем доставки лекарственных средств).
Пониженная биодеградируемость может быть полезной функцией производных ГК, поскольку целью химической модификации полимеров чаще всего является пролонгирование терапевтического действия ковалентно связанных с полимерной матрицей лекарств. Известны некоторые производные ГК, биодеградируемость которых под действием субстратспецифичного фермента гиалуронидазы является значительно более низкой, чем природной ГК. Низкая биодеградируемость достигалась кросс-сшивкой молекул ГК дигидразидами или тригидразидами различного строения в присутствии 1-этил-3-[3-(диметиламино)пропил]карбодиимида (КДИ) [Vercruysse K.P., Marecak D.M., Marecak J.F., Prestwich G.D. // Bioconj. Chem. 1997. V. 8(5). P. 686-694; Prestwich G.D., Marecak D.M., Marecak J.F., Vercruysse K.P., Ziebell M.R. // J.Controll. Rel. 1998. V.53. P.99]. Реакцией с триметилсилилдиазометаном получена ГК, в которой карбоксильные группы полностью метилированы. Такая этерифицированная ГК не деполимеризуется под действием гиалуронидазы или гиалуронангидролазы, но является субстратом для хондротин-ACI лиазы из Flavobacterium heparinium и хондротин-ACII лиазы из Arthrobacter aurescens [К. Hirano, S. Sakai, T. Ishikawa, F.Y. Avci, R.J. Linhardt, T.Toida // Carbohydr. Res. 2005. V.430 (14), 2297-2304].
Наиболее близкими к предлагаемому изобретению являются структурные аналоги ГК, полученные взаимодействием ГК с фармакозначимыми аминами в присутствии КДИ в качестве конденсирующего реагента [Понеделькина И.Ю., Одиноков В.Н., Вахрушева Е.С. и др. // Биоорг. химия. 2005. Т.31. №1. С.90-95; Лукина Е.С. Автореф. дисс. на соиск. степ. канд. наук. 2007. 110 С. (www.anrb.ru/ink, диссер. совет)]. Практически все полученные этим способом конъюгаты ГК наряду с амидными группами содержат звенья с изоуреидокарбонильными группами, образовавшимися в результате присоединения КДИ к карбоксигруппам ГК, и растворимость конъюгатов в воде сильно зависит от содержания этих звеньев. Ферментативная биодеградируемость конъюгатов ГК под действием гиалуронидазы зависит как от природы, так и от содержания модифицированных звеньев. Биодеградируемость конъюгатов ГК с содержанием остатков фармакозначимых аминов до 30% сохраняется на уровне природной ГК, с дальнейшим увеличением конверсии карбоксигрупп биодеградируемость снижается. Значительное снижение биодеградируемости наблюдается только для конъюгатов, содержащих значительное количество уреидных звеньев и обладающих, вследствие этого, ограниченной растворимостью в воде (например, конъюгаты ГК с таурином, ГК со стрептоцидом).
Задачей предлагаемого изобретения является получение обладающих пониженной биодеградируемостью производных гиалуроновой кислоты (ГК). Это достигается следующим образом. ГК селективно окисляют по первичным гидроксигруппам в системе 2,2,6,6-тетраметилпиперидиний-1-оксил радикал (TEMPO)-NaBr-NaClO-H2O (pH 10.2, 0°С), получая в составе окисленной ГК (ГКох) звенья N-ацетил-D-глюкозаминуроновой кислоты [Jiang В., Drouet E., Milas M., Rinaudo М. // Carbohydr. Res. 2000. V.327. P.455-461]. Затем в присутствии 1-этил-3-[3-(диметиламино)пропил]карбодиимида (КДИ) конъюгацией собственных и введенных в результате окисления карбоксигрупп ГК с фармакозначимыми первичными аминами получают целевые конъюгаты с варьируемым (в зависимости от соотношения реагентов) содержанием соответствующего фармакофора (схема). Следует отметить, что при использовании ГКох удается увеличить фармакологическую нагрузку на молекулу полисахарида - вплоть до ˜100% конверсии карбоксигрупп в амидные (в расчете на моносахаридное звено), причем во всех конъюгатах практически отсутствуют продукты присоединения КДИ по карбоксигруппам ГКох, то есть звенья с уреидокарбонильными группами. Растворимость в воде хорошая.
Схема
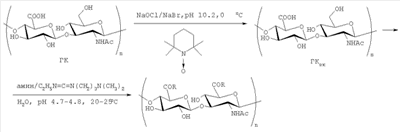 , ,
где R=OH и R1 в конъюгатах, и содержащие R1 сооставляет 8-100% мольн. в расчете на моносахаридное зерно, n=100-150
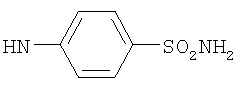
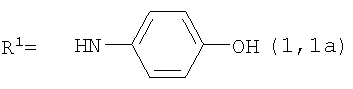 , , 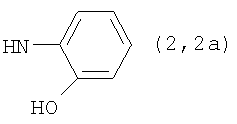 , , 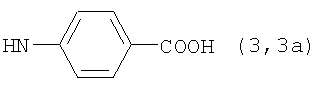 , , 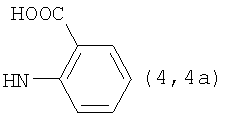 , ,
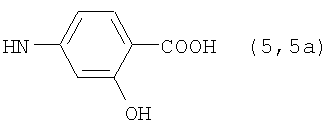 , , 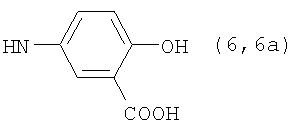 , , 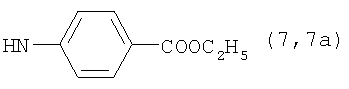 , ,
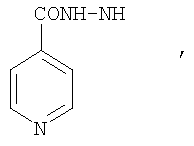
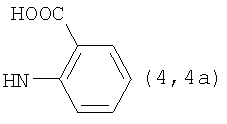
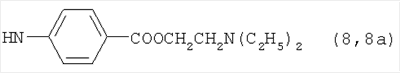 , , 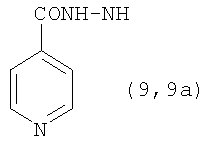 , , 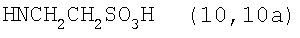 , ,
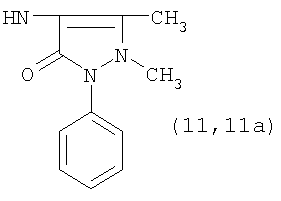 , , 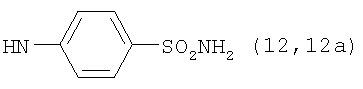 , , 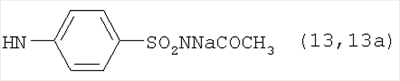 , ,
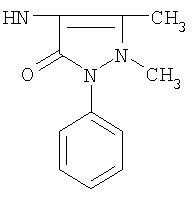
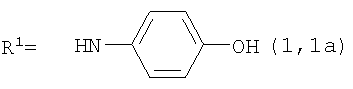
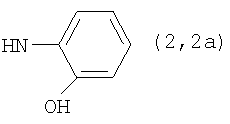
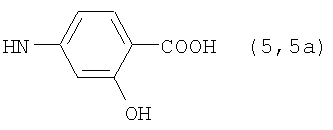
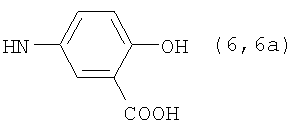
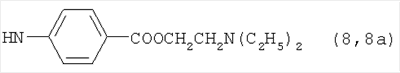
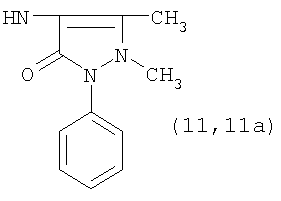
Реакцию ГКох с аминами проводят в присутствии КДИ при различных соотношениях реагентов в водной среде (рН 4.7-4.8) при комнатной температуре в течение 20-30 мин. В качестве соединений, содержащих аминогруппу, используют n- (1) и о-аминофенолы (2), n-аминобензойную (3), антраниловую (4), 4- (5) и 5-аминосалициловые (6) кислоты, этиловый эфир n-аминобензойной кислоты (анестезин) (7),  -диэтиламиноэтиловый эфир n-аминобензойной кислоты (новокаин) (8), гидразид изоникотиновой кислоты (изониазид) (9), 2-аминоэтансульфоновую кислоту (таурин) (10), 1-фенил-2,3-диметил-4-аминопиразолон-5 (4-аминоантипирин) (11), а также сульфаниламидные препараты, содержащие свободную аминогруппу, такие как n-аминобензолсульфамид (стрептоцид) (12), n-аминобензолсульфацетамид-натрий (сульфацил-натрий) (13) и др. Для модификации ГКох можно применять -диэтиламиноэтиловый эфир n-аминобензойной кислоты (новокаин) (8), гидразид изоникотиновой кислоты (изониазид) (9), 2-аминоэтансульфоновую кислоту (таурин) (10), 1-фенил-2,3-диметил-4-аминопиразолон-5 (4-аминоантипирин) (11), а также сульфаниламидные препараты, содержащие свободную аминогруппу, такие как n-аминобензолсульфамид (стрептоцид) (12), n-аминобензолсульфацетамид-натрий (сульфацил-натрий) (13) и др. Для модификации ГКох можно применять  -аминокислоты (глицин, лизин и др.) или их эфиры, различные диамины (гидразин, этилендиамин, гексаметилендиамин) и дигидразиды, например дигидразид адипиновой кислоты. В зависимости от соотношения реагентов (от ГКох:амин:КДИ=1:0.12:0.25 до ГКох:амин:КДИ=1:1.5:1.5, в расчете на моносахаридное звено ГКох) получают конъюгаты с различным содержанием остатков амина R1 - от 8 до ˜100% мольн. в расчете на моносахаридное звено ГКох. -аминокислоты (глицин, лизин и др.) или их эфиры, различные диамины (гидразин, этилендиамин, гексаметилендиамин) и дигидразиды, например дигидразид адипиновой кислоты. В зависимости от соотношения реагентов (от ГКох:амин:КДИ=1:0.12:0.25 до ГКох:амин:КДИ=1:1.5:1.5, в расчете на моносахаридное звено ГКох) получают конъюгаты с различным содержанием остатков амина R1 - от 8 до ˜100% мольн. в расчете на моносахаридное звено ГКох.
Содержание остатков амина R1 (т.е. конверсию карбоксильных групп ГКох в амидные) определяют по данным 1Н-ЯМР-спектроскопии, используя интегральные интенсивности характеристических сигналов протонов остатков конъюгированных с ГКох соответствующих аминов по отношению к интенсивности сигнала метильных протонов ацетамидной группы в области 2 м.д. как внутреннему стандарту.
Спектры 1Н-ЯМР и 13С-ЯМР регистрируют для растворов в D2O на спектрометре Bruker АМХ-300 (рабочая частота для 1Н-ЯМР-300.13 МГц), в качестве внутреннего стандарта используют натриевую соль 3-(триметилсилил)-1-пропансульфоновой кислоты. УФ-спектры получают на спектрофотометре Specord M-40. Контроль рН растворов проводят с помощью рН-метра «рН-340».
ГКох и ее конъюгаты, как определено после инкубации с ферментом гиалуронидазой, проявляют более низкую биодеградируемость по сравнению с немодифицированной ГК.
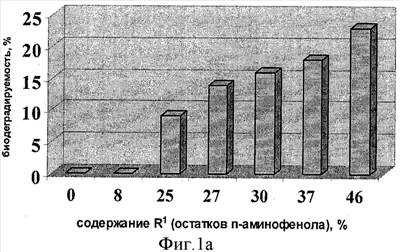
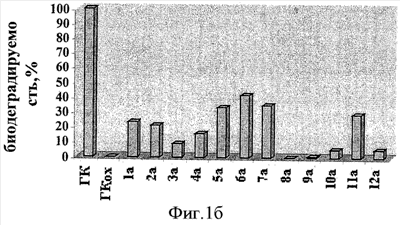
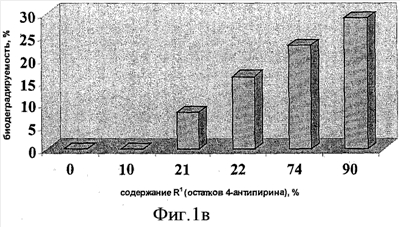
Биодеградируемость ГКох и ее производных (в сравнении с природной ГК) оценивают по разработанной авторами методике, которая заключается в следующем: 0.01 ммоль соответствующего образца помещают в центрифужную пробирку V=10 мл, растворяют в 1 мл буфера (30 мМ лимонная кислота/150 мМ Na2HPO4/150 мМ NaCl; pH 6.3), затем добавляют 3 ед. гиалуронидазы (препарат Лидаза) в 0.1 мл того же буфера, инкубируют при 37°С в течение 20 ч. По окончании ферментативной реакции в каждую пробирку добавляют 4 мл охлажденной до 0°С смеси метанол/диэтиловый эфир (3:1) и выдерживают при 0°С в течение 1 ч для полноты осаждения полимера, не подвергшегося ферментативному расщеплению. Выпавшие осадки отделяют центрифугированием, супернатанты, содержащие не осаждающиеся смесью MeOH/Et2O (3:1) низкомолекулярные продукты ферментативной деградации, помещают в стеклянные стаканы и упаривают досуха. Каждый высушенный образец растворяют в аликвоте воды V=5 мл, отбирают пробу и спектрофотометрически анализируют содержание уроновых кислот карбазоловым методом по Дише,  =530 нм [Методы химии углеводов: Пер. с англ. М.: Мир, 1967. Под редакцией Н.А. Кочеткова]. За показатель биодеградируемости принимают величину оптической плотности раствора хромофора (при =530 нм [Методы химии углеводов: Пер. с англ. М.: Мир, 1967. Под редакцией Н.А. Кочеткова]. За показатель биодеградируемости принимают величину оптической плотности раствора хромофора (при  =530 нм) испытуемого образца, рассчитанную в % от оптической плотности раствора хромофора природной ГК, которую принимают за 100%. Результаты оформляют в виде диаграмм (рис.1а-в), на которых биодеградируемость природной ГК принимают 100%-ной. =530 нм) испытуемого образца, рассчитанную в % от оптической плотности раствора хромофора природной ГК, которую принимают за 100%. Результаты оформляют в виде диаграмм (рис.1а-в), на которых биодеградируемость природной ГК принимают 100%-ной.
Предлагаемое изобретение иллюстрируется следующими примерами.
Пример 1. Конъюгат ГКох с n-аминофенолом, R1=8%.
а) ГК селективно окисляют по первичным гидроксигруппам в системе 2,2,6,6-тетраметилпиперидиний-1 -оксил радикал (TEMPO)-NaBr-NaClO-H2O (рН 10.2) [Jiang В., Drouet E., Milas M., Rinaudo M. // Carbohydr. Res. 2000. V.327. P.455-461]. Условия реакции окисления ГК: рН 10.2, 0°С, TEMPO = 0.027 ммоль, NaBr = 0.5 ммоль, ГК = 2.5 ммоль в 200 мл воды, и 4 мл 13%-го водного раствора гипохлорита натрия (NaClO). Окисленный продукт из водного раствора выделяют осаждением в метанол. Осадок отделяют центрифугированием, промывают метанолом, диэтиловым эфиром и высушивают при пониженном давлении и температуре не выше 60°С. Получают водорастворимый порошок белого цвета. Количественное определение уроновых кислот в ГКох по стандартной методике реакции Дише показывает, что хромофор, поглощающий при 530 нм, образует только D-глюкуроновая кислота. Содержание D-глюкуроновой кислоты составляет 45.2% масс. (теоретически рассчитано - 44.4% масс.),
13С NMR ГКох (D2О):  177.5, 177.2, 176.4 (С=O), 105.3, 102.8, 83.7, 82.8, 78.7, 78.2, 75.9, 74.7, 69.9, 56.6, 24.9 (СН3CONH). Как видно из спектра 13С ЯМР, вместо двух синглетов атомов углерода СООН-группы D-глюкуроновой кислоты и СН3CONH-группы, в области 176-178 м.д. наблюдается третий синглет, отвечающий атому углерода вновь образовавшейся СООН-группы. При этом сигнал атома углерода CH2OH-групп в области 62-63 м.д. отсутствует, что свидетельствует о полной трансформации первичных гидроксигрупп ГК в карбоксильные (схема). Как видно из рис.1.а, при используемых условиях ферментативной обработки ГКох не является субстратом для гиалуронидазы. 177.5, 177.2, 176.4 (С=O), 105.3, 102.8, 83.7, 82.8, 78.7, 78.2, 75.9, 74.7, 69.9, 56.6, 24.9 (СН3CONH). Как видно из спектра 13С ЯМР, вместо двух синглетов атомов углерода СООН-группы D-глюкуроновой кислоты и СН3CONH-группы, в области 176-178 м.д. наблюдается третий синглет, отвечающий атому углерода вновь образовавшейся СООН-группы. При этом сигнал атома углерода CH2OH-групп в области 62-63 м.д. отсутствует, что свидетельствует о полной трансформации первичных гидроксигрупп ГК в карбоксильные (схема). Как видно из рис.1.а, при используемых условиях ферментативной обработки ГКох не является субстратом для гиалуронидазы.
б) К смеси 60 мг (˜0.3 ммоль СООН-групп) ГКох и 3.7 мг (0.036 ммоль) n-аминофенола (1) в 15 мл Н2О добавляют 0.1 н. NaOH до рН 4.7-4.8, затем при интенсивном перемешивании и температуре 20-22°С вносят 10.8 мг (0.056 ммоль) карбодиимида (соотношение реагентов ГКох:n-аминофенол:КДИ=1:0.12:0.25 в расчете на одну карбоксигруппу ГКох), поддерживая рН 4.7-4.8 титрованием 0.1 н. HCl. Через 0.5 ч к охлажденной до 0°С реакционной смеси последовательно добавляют 0.1 н. NaOH (до рН 7-8), 2-3 мл насыщенного раствора NaCl и 45 мл охлажденного метанола. Выпавший осадок отделяют центрифугированием, растворяют в 10 мл 6% NaCl, добавляют 30 мл метанола. Вновь выпавший осадок центрифугируют, промывают метанолом (10×3 мл), затем эфиром (10×3 мл) и сушат при температуре  60°С и пониженном давлении. Получают ˜60 мг конъюгата в виде белого порошка, растворимого в воде. Содержание остатков R1 (или конверсия карбоксигрупп ГКох в амидные) в конъюгате ГКох с n-аминофенолом составляет 8% в расчете на моносахаридное звено ГКох. Аналогично ГКох этот конъюгат не является субстратом для гиалуронидазы. 60°С и пониженном давлении. Получают ˜60 мг конъюгата в виде белого порошка, растворимого в воде. Содержание остатков R1 (или конверсия карбоксигрупп ГКох в амидные) в конъюгате ГКох с n-аминофенолом составляет 8% в расчете на моносахаридное звено ГКох. Аналогично ГКох этот конъюгат не является субстратом для гиалуронидазы.
Пример 2. Конъюгаты ГКох с n-аминофенолом, R1=25-100%.
Конъюгаты ГКох с содержанием остатков n-аминофенола 25% (табл.), 27%, 30%, 37%, 46% и 100% получают аналогично примеру 1, при этом используют другие соотношения реагентов. При соотношении ГКох:n-аминофенол:КДИ=1:0.5:0.38 получают конъюгат с содержанием R1=25%, 1:0.5:0.45 - R1=27%, 1:0.5:0.5 - R1=30%, 1:0.6:0.75 - R1=37%, 1:1:0.75 -Rl=46% и при 1:1.5:1.5 - Rl˜100%.
С увеличением содержания остатков n-аминофенола биодеградируемость конъюгатов возрастает по сравнению с ГКох, но уровня природной ГК не достигает (рис.1а). Биодеградируемость конъюгата с содержанием R1˜100% не приводится, поскольку в цитратном буфере (рН 6.5) он не растворяется.
Пример 3. Конъюгаты ГКох с аминами 2-13 синтезируют аналогично примерам 1 и 2. В таблице приведены характеристики конъюгатов, полученных при соотношении ГКох:2-13:КДИ=1:0.5:0.38. Значения биодеградируемости соответствующих конъюгатов 2а-13а зависят от природы амина и значительно меньше биодеградируемости природной ПС (рис.1б).
| Таблица |
| Конъюгат |
Содержание R1 (% в расчете на моносахаридное звено) в конъюгатах, полученных при соотношении ГКох:1-13:КДИ=1:0.5:0.38 |
Характеристичекие сигналы остатков аминов в 1Н ЯМР-спектрах конъюгатов,  , м.д. , м.д. |
| 1а |
25 |
7.41, 7.39, 7.00, 6.98 |
| 2а |
35 |
7.59, 7.57, 7.28, 7.26, 7.09, 7.06 |
| 3а |
36 |
8.04, 7.70 |
| 4а |
19 |
8.31, 8.02, 8.00, 7.64, 7.58, 7.33 |
| 5а |
30 |
7.89, 7.86, 7.25, 7.16, 7.11, 7.08 |
| 6а |
23 |
7.98, 7.59, 7.56, 7.05, 7.02 |
| 7а |
31 |
8.12, 7.71 |
| 8а |
30 |
8.11, 7.74 |
| 9а |
35 |
8.80, 7.90 |
| 10а |
23* |
- |
| 11а |
35 |
7.68, 7.52, 7.49 |
| 12а |
30 |
8.01, 7.98, 7.84, 7.81 |
| 13а |
20 |
8.01, 7.99, 7.83, 7.81 |
| * Определено элементным анализом на S. |
Для конъюгатов ГКОХ с 4-аминоантипирином с содержанием R1=10-90% также приведена зависимость биодеградируемости от содержания остатков амина (рис. 1в).
Формула изобретения
Производные гиалуроновой кислоты общей формулы:
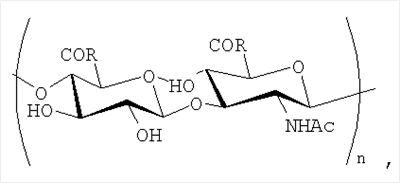
где R=OH и R1 в конъюгатах, n=100-150
 , ,  , , 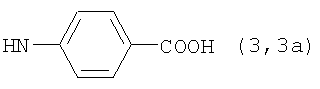 , ,  , ,
 , ,  , , 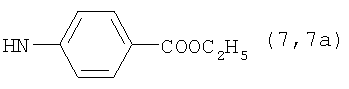 , ,
 , , 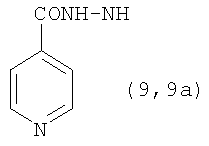 , , 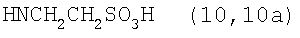 , ,
 , , 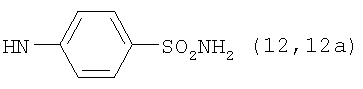 , , 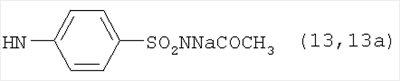 , ,
где содержание R1 составляет 8-100% в расчете на моносахаридное звено, полученные взаимодействием окисленной гиалуроновой кислоты с соответствующим фармакозначимым первичным амином, обладающие пониженной биодеградируемостью. |
|