
СПИСОК ПАТЕНТОВ С УПОМИНАНИЕМ ГИАЛУРОНОВОЙ КИСЛОТЫ
-
- 2017751 Способ получения гиалурона
- 2192150 БАД для профилактики йодной недостаточности
- 2112542 Препарат для лечения патологий соединительных тканей
- 2225206 Препарат для лечения рака молочной железы
- 2299733 Лечение опорно-двигательного аппарата
- 2299732 Способ лечения глаукомы
- 2299726 Противоинфекционная губная помада
- 2299725 Косметическое средство для ухода за кожей
- 2198878 Ароматическое соединение
- 2198702 Способ подготовки трофических язв к аутодермапластике
- 2198653 Вагинальные суппозитории
- 2197946 Композиция для ухода за волосами
- 2197923 Фармацевтическая композиция для лечения отеков роговицы
- 2298410 Биотрансплантант и способ лечения ревматических и аутоиммунных заболеваний
- 2197501 Фотоотверженный гель на основе сшитой гиалуроновой кислоты
- 2197228 Твердые лекарственные формы
- 2197222 Водная компазиция для ухода за волосами, лица и тела
- 2297425 Полипептиды
- 2297240 Композиция с гиалуроновой кислотой
- 2297230 Фармацевтическая компазиция с ксантоновой смолой
- 2196588 Глазные капли
- 2195955 Применение биологически активных веществ
- 2195926 Дерматологические композиции
- 2295954 Микрочастицы для доставки нуклеиновых кислот
- 2295951 Косметика для ухода за кожей лица и век
- 2195262 Фармакологическое средство на основе гиалуроновой кислоты
- 2194512 Способ профилактики и коррекции процесса старения кожи
- 2194478 Лечение экземы
- 2294716 Расширяемый стент
- 2194055 Сшитые сополимеры
- 2099350 Ассоциаты депротонированной гиалуроновой кислоты
- 2293557 Средство для лечения кожи и слизистых
- 2292878 Приготовление микроцастиц, содержащих метопропол
- 2292746 БАД
- 2192256 Защита кишечника
- 2191782 Получение модифицированной гиалуроновой кислоты
- 2292219 Паратиреоидный гормон человека
- 2291686 Микроцастицы
- 2191000 Косметическая маска
- 2290921 Фармацевтические и косметические средства против старения кожи
- 2290900 Модифицированный биоматериал для использования в офтальмологии
- 2290899 Получение биоматерьяла
- 2290397 Новые инданилиденовые соединения
- 2290186 Лечение сирингомиелии
- 2288702 Иррингационный раствор для офтальмологии
- 2288699 Гель для лечения стоматологических заболеваний
- 2188011 Активирующая остеогенез фармацевтическая композиция
- 2187327 Средство с антисептиком
- 2187325 Средство с радиопротекторным действием
- 2287330 Композиции миноксидила
- 2186786 Способ получения гиалуроновой кислоты
- 2186593 Лечение раненого процесса кожи
- 2286801 Очищение воды
- 2286781 Лечение ожогов пищевода у детей
- 2286764 Средство лечения воспалений полости рта
- 2185840 Лечение инфекционных заболеваний
- 2286151 Альфа-2-Дельта-Лиганда
- 2185149 Ранозаживляющий гель
- 2285527 Лечение ИЛ-6 заболеваний
- 2184448 Раствор хранения роговицы, включающий гиалуроновую кислоту
- 2090179 Крем для кожи
- 2183961 Способ лечения кожи
- 2284331 Соли алифотических аминов
- 2284187 Производные амида
- 2089191 Снизить внутрение давление
- 2283320 Получение гликозаминогликанов
- 2283129 Лечение опухолей
- 2283098 Косметические средства с Q
- 2182574 Ароматические соединения
- 2088257 Средство с гипохолестеролемическим действием
- 2088218 Состав для гигиенических салфеток
- 2088206 Способ получения препарата, создающего исскуственный загар
- 2282462 Противомикробные средства
- 2182008 Интровагинальная компазиция
- 2181999 Препарат с отсроченным высвобождением
- 2181998 Новые композиции липидов
- 2181995 Лечение болевого синдрома
- 2181295 Вирионная вакцина
- 2087144 Витамин Е
- 2379336 Способ стирки
- 2379052 Вакцинация
- 2180855Композиция в виде ионного комплекса
- 2379025 Противоинфекционный гель
- 2180825 Лечение травм роговицы
- 2281082 Способ коррекции эстетических и возрастных проблем кожи
- 2180576 Биоактивная добавка для косметических средств
- 2280459 Средство для изменения скорости роста или репродукции клеток
- 2179981 Соли переходного металла
- 2378010 Жидкие вакцины
- 2378008 Комбинированные вакцины
- 2378007 Анаболическое средство
- 2377973 Растительные экстракты
- 2280041 Способ получения водорастворимых комплексов гиалурил
- 2280038 Биополимеры
- 2323733 Йодный обмен
- 2377260 Гель
- 2178693 Противовирусное средство на основе гиалуроновой кислоты
- 2178692 Облегчающие зуд косметическое средство
- 2377022 Гемостатические спреи
- 2376982 Увлажняющая сыворотка для лица
- 2376974 Трансдермальный гель для лица
- 2362784 Гипо-и гиперацетилированные менингокковые капсульные сахариды
- 2177789 Устройство для доставки лекарства к шейке матки
- 2277954 Крем для лица омолаживающий
- 2376378 Способ получения метионина
- 2177332 Биоматериал для предотвращения послеоперационных спаек, с производной гиалуроновой кислотой
- 2177310 Способ получения таблеток
- 2376011 Средство для позвоночника
- 2277410 Косметическое средство
- 2323748 Медицинская повязка
- 2276998 Гидрогелевые композиции
- 2082416 Способ получения препарата с коллагенном из животного сырья
- 2375081 Адсорбирующее изделие
- 2375049 Охлаждающий пластырь
- 2346049 Способ получения гиалурона
- 2275913 Фармацевтические средства
- 2174985 Полисахарид с антиоксидантом
- 2373957 Носитель для лекарственных средств и биологически активных веществ
- 2373941 Способ коррекции возрастных и патологических изменений кожных покров
- 2174845 Композиции и способы доставки генетического материала
- 2174830 Средство для укрепления волос
- 2373769 Синбиотическая композиция
- 2274472 Лечение апорно-двигательного аппарата и болевых синдромов
- 2372929 Профилактическая композиция на основе веществ фенольной природы в липосомной форме
- 2173563 Способ нанесения на поверхность предметов покрытия на основе гиалуроновой кислоты, её производных и полусинтетических полимеров
- 2079304 фармацевтическая композиция, обладающая иммуносупрессорной и антимикробной активностью
- 2273645 Полипептид ожирения
- 2173154 Фракция кератансульфатолигосахаридов и содержащий ее фармацевтический препарат
- 2173136 Грязная мазь
- 2173128 Способ хирургического лечения центральных разрывов сечатки
- 2078561 Косметическое средство предотвращающее старение кожи
- 2172490 Способ прогнозирования воспалительных заболеваний молочной железы при эндопластике
- 2272645 Способ лечения ЦМВ-Инфекции у детей раннего возроста
- 2272636 Фармацевтическая композиция для местного лечения воспаления
- 2272635 Фармацевтически активная субстанция для офтальмологии
- 2272599 Биоматерьял для стабилизации прогрессирующей миопии "Коллаплант"
- 2172168 Средство для заживления ран на основе гиалуроновой кислоты
- 2371172 Фармацевтическая композиция для лечения нервной системы на основе стефаглабрина
- 2171470 Способ прогнозирования послеоперационной трансформации доброкачественных опухолей нервной системы
- 2077317 Состав для ванн
- 2271213 Комбинированные композиции, содержащие экстракты из растений и морских животных
- 2076872 Способ получения окрашенной гиалуроновой кислоты
- 2076671 Раствор для защиты роговицы
- 2370281 Конъюгаты гидроксиалкилкрахмал
- 2370275 Способ лечения (коррекции) косметических и возрастных дефектов кожи
- 2370258 Фармацевтическая композиция для парентальной доставки в форме лиофилизата
- 2270023 Способ экстракции и очистки протеогликана хрящего типа (варианты)
- 2369408 Гемостатическая композиция, включающая гиалуроновую кислоту
- 2369387 Фармацевтическая композиция для лечения нервной системы
- 2369379 Нетаблитированные жевательные формы для индивидуального введения
- 2169136 Производное коричной кислоты
- 70792 Медицинский аппликатор
- 20741717 Способ стабилизации аскорбиновой кислоты
- 2074712 Способ получения препарата, препятствующего преждевременной эякуляции
- 2367954 Способ прогнозирования развития кожной патологии у женщин с синдромом склерополикистозных яичников (СПКЯ)
- 2268075 Устройство для электрокинетической доставки
- 2268052 Средство для лечения воспалительных и дегенеративных заболеваний суставов
- 2167649 Способ получения твердой дисперсии умеренного водорастворимого лекарственного вещества
- 2167647 Гель для бритья
- 2073520 Лечение урологических инфекций
- 2367476 Биопластический материал
- 2367475 Мембрана для использования при направленной регенерации тканей
- 2367469 Фармацевтическая композиция на основе лизоамидазы
- 2367456 Фармацевтическая композиция обладающая антибактериальным и некролитическим действием
- 2367455 Фармацевтическая композиция обладающая некролитическим и антибактериальным действием
- 2267324 Применение антиадгезивных углеводов, препарат для уменьшения и /или блокирования адгезии патогенных веществ
- 2166934 Композиции включающие биологический агент
- 2166510 Псевдодипептиды
- 2366460 Композиции, имеющие высокую противовирусную и антибактериальную активность
- 2360901 Производные феноксиуксусной кислоты
- 2165749 Способ восстановления эндотелия роговицы
- 2265441 Способ укрепления склеры
- 2365382 Композиции и способы для регуляции развития сосудов
- 2070879 Соли гликозаминогликанов
- 2164914 Циклические и гетероциклические N - замещенные - иминогидроксамовые карбоновые кислоты
- 2264627 Хламидийный конъюктивит
- 2364399 Фармацевтический препарат на основе стефаглабрина
- 2264230 Препарат с замедленным высвобождением активного вещества
- 2363497 Фармацевтические композиции
- 2363496 Способ увеличения объема мягких тканей
- 2363473 Способ антифлогистической активации в эксперементе
- 2363461 Фармацевтический препарат на основе сигетина
- 2363459 Средства для введения в роговицу глаз для предотвращения офтальмологических нарушений
- 2363448 Фармацевтические композиции
- 2163123 Глазные капли
- 2162687 Усовершенствованнная лекарственная форма индуктора интерферана
- 2162343 Биосовместимый полимерный материал и способ его получения
- 2162327 Лечение рака
- 2067841 Способ получения ароматизатора
- 2161478 Способ консервированого лечения гонартроза
- 2361617 Вольфрамовые частицы в качестве рентгеноконтрастных веществ
- 2361552 Способы и устройства для дренирования жидкостей и понижения внутриглазного давления
- 2066996 Способ изготовления пленочного материала для офтальмохирургии
- 2361417 Корм с глюкозамином и экстрактом ивы для профилактики артроза у животных
- 2161002 Пищевой общеукрепляющий лечебно-профилактический продукт из хрящевой ткани акул
- 2360928 Комплексная матрица для медико-биологического применения
- 2160574 Способ лечения глаукомы
- 2360688 Способ лечения повреждений переферических нервов
- 2360670 Фармацевтическая композиция при климактерических расстройствах
- 2360646 Эндолюминальный протез
- 2260445 Способ усовершенствования транспортировки через легко прспосабливаемый полупроницаемый барьер
- 2260007 Производные амида
- 2359975 Способ получения модифицированных арабиногалактанов
- 2359974 Антигенные Пептиды
- 2159775 Псевдопептидный продукт
- 2259833 Фармацевтическая композиция для лечения роговицы глаза
- 2259816 Ранозаживляющее средство
- 2259815 Способ коррекции возрастных изменений, связанных с процессами старения кожи
- 2359706 Способ сохранения офтальмологических растворов
- 2359704 Антисептическое средство
- 2359662 Микрокапсулы
- 2159253 Катионные полимеры
- 2159111 Средство для ухода за кожей лица
- 2159105 Композиция для защиты кожи от опасных химических веществ Получение
- 2158593 Биосовместимый водный раствор
- 2358728 Способ лечения и предупреждения потери костной ткани
- 2258517 Способ хирургического лечения травмотических повреждений селезенки пленкой на основе гиалуроновой кислоты
- 2357968 Кристалические формы производной имидазола
- 2357957 Ингибиторы P38 и их применение
- 2157647 Пищевая добавка и ее получение
- 2357758 Препараты для чрескожной и чересслизистой добавки
- 2063244 Способ стабилизации растворов
- 2063140 Способ получения препарата для консервирования мяса
- 2157381 Способ получения гиалуроновой кислоты
- 2257198 Композиции микроцастиц
- 2356909 Белковый комплекс
- 2356570 Косметическая композиция
- 2256434 Способ закрытия перфорации барабанной перепонки
- 2356520 Способ лечения постконтузионного повреждения сечатки глаза
- 2156133 Гель
- 2255945 Полимерная композиция
- 2355761 Средства повторной дифференцировки
- 2061043 Способ повышения устойчивости урокиназы к нагреванию
- 2061005 Способ получения красителей для гистологических исследований
- 2355420 Зубная паста
- 2355385 Композиции пролонгированного действия с контролируемым высвобождением
- 2355240 Способ получения пищевого препарата хондропротекторного действия
- 2155057 Пихтово репейный бальзам
- 2354409 Способ производства высвобождающих лекарственные средчтва медицинских устройств
- 2254145 Раневое покрытие на основе коллаген-хитозанового комплекса
- 2254133 Лечение и профилактика ВИЧ-инфекции у человека
- 2253439 Фармацевтическая композиция для защиты и улучшения оптических свойств роговици при проведении эндовитреальных вмешательств
- 2253437 Способ омоложения кожи
- 2153352 Фармацевтическая композиция обладающая ранозаживляющим и противовоспалительным действием
- 2353354 Фармацевтический препарат на основе низкомолекулярного индуктора интерферона
- 2252787 Способ получения искусственной матрицы кожи
- 2252767 Способ нормализации иммунобиохимического гомеостаза коров в предродовом и послеродовом периодах
- 2352583 Фармацевтическая композиция содержащая Fc-область иммуноглобулина в качестве носителя
- 2152403 Модифицированные полисахариды
- 2352356 Иммуногенная композиция
- 2352342 Исскусственный физиологический солевый раствор Способ его получения
- 2352330 Фармацевтический препарат на основе низкомолекулярного индуктора интерферона
- 2352323 Фармацевтический препарат с модифицированным высвобождением
- 2152027 Способ подготовки ткани мозга для определения гликозаминогликанов
- 2251842 Интектицидный состав для борьбы с личинками оводов
- 2151580 Способ активации пролиферации эндотелия роговицы
- 2351648 Дифференцировка стромальных клеток, полученных из жировой ткани, в эндокринные клетки поджелудочной железы и их использование
- 2351595 N - гидроксиформамидные соединения в качестве ингибиторов металлопротеина
- 2251411 Косметическое средство в лиофилизированной фармацевтической форме
- 2251405 Косметика...ее композиции для косметических препаратов
- 2251367 Средство со сшитой гиалуроновой кислотой для наращивания тканей
- 2351359 Косметика для профилактики и лечения избыточной массы тела
- 2351322 Препарат на основе низкомолекулярного индуктора интерферона
- 2351153 Диета при остеортрите собак
- 2350958 Способ определения групповой принадлежности синовальной жидкости
- 2350625 Производные гиалуроновой кислоты с пониженной биодеградируемостью
- 2150266 Крем после бритья
- 2350354 Фармацевтическое средство содержащие антагонист и фактор некроза
- 2350340 Способ коррекции процессов регенерации
- 2350309 Способ лечения избыточной массы тела с помощью рефлексотерапии
- 2250047 Профилактический продукт из хрящевой ткани гидробионтов
- 2249467 Медицинский матерьял и изделия на его основе
- 2055079 Способ получения препарата гиалуроновой кислоты
- 2349599 Биоадгезив мидии
- 2054903 Способ лечения коллагеноза у бычков на откорме
- 2249210 Способ прогнозирования предрасположенности к развитию и тяжести течения деформирующего остеоартроза коленного сустава у взрослых
- 2349339 Средство для соединительной ткани
- 2148988 Человеческий интерферона
- 2148399 Лечение атеросклероза
- 2148396 Способ определения активного вещества в дифильных мазевых основах
- 2148375 Способ диагностики близорукости
- 2348415 Способ противоспаечной терапии после хирургического вмешательства
- 2348400 Препарат на основе низкомолекулярного индуктора интерферона
- 2348386 Способ непроникающего хирургического лечения первичной открытоугольной глаукомы
- 2248213 Лечение Галактозидальной А недостаточности
- 2347586 Микрофлюидизированные эмульсии типа "масло в воде" и вакцинные средства
- 2147243 Контрастное средство
- 2146526 Лечебный препарат дисбактериоза и урогенитальных инфекций
- 2146148 Терапевтическое применение фактора роста кератиноцитов (ФРК)
- 2146139 Способ повышения активности макрофагов и комбинации для его осуществления
- 2346277 Способ диагностики специфического синовита
- 2345793 Ультразвуковые контрастные вещества и их получение
- 2345782 Терапевтические комбинации на основе PORIFERA для лечения и предотвращения кожных заболеваний
- 2245131 Способ коррекции косметических недостатков кожи
- 2245130 Способ активации восстановительных процессов в коже
- 2144833 Хондроитиназа
- 2344809 Получение твердых дозированных форм с использованием сшитого нетермопластичного носителя
- 2244540 Косметический гель для ухода за кожей лица
- 2244536 Способ лечения дегенеративно-дистрофических заболеваний тазобедренного сустава
- 2344167 Хмелевый экстракт
- 2143884 Агент регулирования дифференциации клеток кожи, культурная среда для клеток или тканей и способ регулирования дифференциации клеток кожи
- 2343932 Способ получения обладающих пониженной растворимостью в воде пленночных материалов
- 2343903 Устройство доставки лекарств для контролируемого введения препаратов
- 2048817 Способ получения материала для лечения ожогов и гнойно - некронических ран
- 2048803 Гидратантный крем
- 2242974 Средства и способы лечения воспалительных заболнваний
- 2142816 Способ получения антигерпетической вакцины
- 2342923 Средство для обработки рук с увлажняющим эффектом
- 2142781 Косметика для макияжа ресниц и бровей и агент ингирирующий рост микроорганизмов в косметических средствах
- 2242251 Трансплантируемые стенты с биоактивными покрытиями
- 2142257 Способ обработки глазных имплантантов и контакных линз
- 2342389 Мононатриевая соль
- 2342107 Способ устранения западения верхнего века при анофтальме
- 2141828 Средство, пролонгирующее эффективность чесночного порошка
- 2241489 Косметическое средство матриксных протеинов для залечивания ран
- 2241443 Средство для лечения герпеса
- 2241414 Способ получения протезов кровеносных сосудов
- 2341539 Гидрогель
- 2141324 Регулятор скорости воздействия препарата для инъекций
- 2141312 Косметическое средство для ухода за кожей лица
- 2341296 Средства и способы покрытия медицинских имплантантов
- 2341272 Средство для неспецифической иммунотерапии
- 2341266 Стенты с нанесенным покрытием содержащим N - (5-(4-(4-
- 2341257 Иммуномодулирующее средство
- 2341255 Средство для лечения климактерических расстройств
- 2240821 Способ лечения урологических инфекций
- 2140786 Способ лечения лишая
- 2140243 Способ хирургического лечения диабетической ретинопатии и отслоек сечатной оболочки
- 2240140 Медицинская многослойная повязка и изделия на ее основе
- 2240135 Культура клеток, содержащая клетки - предшественники остеонегеза, имплантант на ее основе и его использование для восстановления целостности кости
- 2240123 Экзогенные биологически активные коньюгирующие вещества
- 2139886 Фотоотвержаемое производное гликозаминогликата, сшитое производное гликозаминогликата и способы их получения, способ предотвращения клеточной и тканевой адгезии
- 2139729 Вакцина. Способ стимулирования иммунной системы
- 2339386 Средство обладающее радио - и химиозащитным действием
- 2339369 Лечение офтальмологических нарушений с использованием мочевины и ее производных
- 2139041 Гидратантный регенерирующий крем и способ его получения
- 2139039 Косметический суперкрем для ухода за кожей
- 2139017 Способ получения боисовместимого материала
- 2138503 Производные камптотецина, способы их получения, уникальное средство
- 2338556 Средство содержащие антагонист Р2Х - рецептора и нестероидное противоспалительное лекарственное средство
- 2338514 Косметическое средство для профилактики старения кожи
- 2138297 Медицинские устройства, подверженные вызываемому разложению
- 2138295 Покрытие для ран
- 2337906 Ингибиторы цитозольной фосфолипазы А2 Применение физиологически допустимого корпускулярного ферримагнитного или ферромагнитного материала. Способ формирования магнитометрического изображения
- 2137501 Устройство формирования изображения
- 2137477 Способ лечения заболеваний характеризующихся аутоиммунной агрессией
- 2137467 Крем для кожи лица и тела
- 2137449 Способ коррекции дефектов преломления в глазу млекопитающего
- 2137402 Пищевая Добавка БАД
- 2336899 Способ стимуляции миелопоэза
- 2336862 Способ получения раствора для лечения роговицы
- 2336830 Способ восстановления костных структур челюсти
- 2136696 Новый полипептид и средство против ВИЧ - Инфекции
- 2336092 Биоадгезивное средство, по существу свободное от воды
- 2336089 Средство и способ лечения заболеваний периодонтальных и пульпы
- 2336074 Средства и способы лечения заднего сегмента глаза
- 2235548 Ранозаживляющее средство
- 2135186 Способ лечения рефлекторных синдромов при остеохондрозе
- 2234945 Стабилизатор водного раствора и водосодержащего сырья
- 2334762 Растворимая ассоциативная карбоксиметилцеллюлоза
- 2234514 Макропористые хитозановые гранулы и способ их получения. Способ культивирования клеток
- 2133615 Средство для лечения неврологических заболеваний
- 2233164 Способ профилактики развития послеоперационных спаек брюшной полости
- 2133127 Неткатный материал, способ его получения и способ лечения
- 2333223 Альдегидные производные сиаловой кислоты и средства на их основе
- 2333007 Полипептидные вакцины для широкой защиты против рядов поколений менингококов с повышенной вирулентностью
- 2332985 Дозированные формы анестезирующих средств с длительным высвобождением для обезболивания
- 2132677 Косметическая маска
- 38603 Пленочный аппликатор
- 2232594 Средство содержащие ингибирующие остеокластогенез фактор и полисахарид
- 2332238 Средство для прокладок, раневых повязок и других изделий, контактирующих с кожей
- 2331668 Стромальные клетки, получение из жировой ткани, для заживления дефектов роговицы и внутриглазных дефектов и их использование
- 2331438 Альфа - 2 - Дельта Лигант для лечения симптомов нижних мочевыводящих путей
- 2331411Электропряденые аморфные фармоцевтические средства
- 2331367 Способ профилактики образования спаек и их рецидива
- 2130767 Масло в воде для получения косметических и дерматологических средств, способ косметической обработки
- 2230752 Поперечносшитые гиалуроновые кислоты и их применение в медицине
- 2230558 Способ восстановления и сохранения здоровья скмьи
- 2230550 Средства длительного высвобождения, способ их получения и применения
- 2230458 Поддержания здоровья суставов
- 2330290 Способ определения состояния метаболических процессов в ткани суставного хряща
- 2230073 Способ поперечного сшивания карбоксилированных полисахаридов
- 2329059 Способ лечения полипозного риносинусита
- 2329037 Комбинированная терапия для лечения иммуновоспалительных заболеваний
- 2128666 Гиалуроновая кислота и ее соли, способ очистки гиалуроновой кислоты, способ получения гиалуроновой кислоты. Фармацевтический препарат с гиалуроновой кислотой и средства с гиалуроновой кислотой используемые в офтальмологии
- 2328740 Способ экспресс - оценки действия зубных паст
- 2128502 Косметический гель
- 2328272 Суппозитории индуктора интерферона
- 2328268 Косметика содержащая амфолитный сополимер
- 2128057 Композиционная мембрана, способ ее получения и способ направленной регенерации тканей с ее применением
- 2128055 Средство замедленного освобождения и способ его получения
- 2128049 Свечи
- 2227743 Полипептидные варианты с повышенной гепаринсвязывающей способностью
- 2326893 Ковалентное и нековалентное сшивание гидрофильных полимеров
- 2326697 Новый перевязочный материал для быстрого заживления раневой поверхности кожи
- 2126264 Фармацевтическое средство с гиалуроновой кислотой
- 2326137 Способ получения содержащих альгинат пористых формованных изделий
- 2325902 Способ выделения гликозаминогликанов из минерализованной соединительной ткани
- 2225195 Репелленты против насекомых
- 2325193 Сосудистый стент
- 2325184 Улучшенные везикулы наружной мембраны бактерий
- 2325153 Многокомпонентная фармацевтическая дозированная форма
- 2325152 Удерживаемая в желудке система регулируемой доставки лекарственного средства
- 2029955 Способ предоперационного определения помутнения задней капсулы хрусталика при экстракции катаракты
- 2324688 Производные бисбензизоселеназолонила с противоопухолевым, противовоспалительным и антитромбоническим действием
- 2323017 Устройство и способ контролируемый доставки активных веществ в кожу
- 2323011 Содержащий Коллаген I и Коллаген II способный к рассасыванию внеклеточный матрикс, предназначенный для реконструирования хряща
- 2322955 Способ изготовления имплантанта для пластики дефектов хрящевой ткани
- 2322454 Антитело против CCR5
- 2322263 Система продолжительного высвобождения растворимого лекарственного средства
- 2221561 Витамин Е и его сложные эфиры
- 2321634 Гены участвующие в метаболизме углерода и продуцировании энергии
- 2321597 Биоматерьял, способ его приготовления и его применение, медицинское средство, имплантант и вкладыш
- 2121340 Средство для похудения
- 2220737 Средство для улучшения состояния опорно-двигательного аппарата
- 2220729 Гель используемый в стоматологии
- 2320720 Способ культивирования фибропластов для заместительной терапии
- 2320378 Накожный аппликатор
- 2320369 Средства, содержащие Альфа - 2 - Дельта Лиганды и ингибиторы обратного захвата серотонина/норадреналина
- 2320362 Местные фармацевтические средства, содержащие проантоцианидины, для лечения дерматитов
- 2320322 Биоадгезивная доставка лекарств
- 2320318 Чувствительное к температуре изменяющие состояние средство гидрогеля
- 2025120 Способ получения препарата, содержащего Фактор /G-CSF/, стимулирующий рост колоний гранулоцитов
- 2319490 Средство для введения железа при лечении синдрома беспокойных ног
- 25995 Содержащее адгезив приспособление для фиксации зубных протезов в полости рта
- 2218907 Средство для ухода за кожей лица и веками
- 2318830 Способ получения модифицированного дерматансульфата
- 2118153 Косметика - туш для ресниц
- 2217441 Способ получения полимера
- 2317296 Изетионатная соль селективного ингибитора CDK4
- 2217171 Мембрана для использования при направленной регенерации тканей
- 2317095 Экстракты ECHINACEA ANGUSTIFOLIA
- 2216332 Препарат для лечения астроза
- 2216314 Крем - маска для обезвоженной кожи
- 2316333 Средство оздоровительно-восстановительных косметических панто-магниевых ванн
- 2021304 Способ получения биологически активного средства
- 2115662 Способ получения гиалуроновой кислоты
- 2315627 Впрыскиваемые имплантанты на керамической основе для заполнения морщин, кожных впадин, шрамов
- 2315623 Средство получаемое путем лиофилизации препарата
- 2114862 Способ получения гиалуроновой кислоты
- 2314791 Лечебно-Косметическое средство
- 2314791 Косметический крем-бальзам для ухода за кожей лица и шеи
- 2214600 Способ оценки эффективности лечения неврологических проявлений
- 2114602 Способ косметической обработки
- 2114587 Раствор для защиты роговицы
- 2214283 Имплантант для подкожного или внутрикожного введения
- 2313370 Медицинские протезы, имеющие улучшенную биологическую совместимость
- 2313356 Препарат для лечения демодекоза
- 2313338 Средство на основе этиллинолеата и триэтилцитрата для лечения себореи и угрей
- 2313328 Косметика содержащая тонкодисперный и пористый порошок
- 2212880 Способ получения препарата содержащего антибиотик, с замедленным высвобождением активного вещества
- 2312640 Способ лечения Блефароконьюнктивальной формы синдрома сухого глаза
- 2017751 Способ получения гиалуроновой кислоты
- 2312145 Гены CORYNEBACTERIUM GLUTAMICUM, кодирующие белки, участвующие в синтезе мембран и мембранном транспорте
- 2311458 Белки вызывающие измененную иммуногенную реакцию. Способ их получения и использования
- 2311183 Улучшенное разделение с использованием гталуроновой кислоты
- 2311177 Ингибиторы интегрина для лечения заболевания глаз
- 2300069 Косметическая маска
- 2211024 Уход за сухой кожей
- 2310440 Раствор для защиты роговицы от повреждений
- 2309684 Лечение межфалангового остеоатроза узелковой формы
- 2309406 Способ мониторинга фиброза печени у больных хроническим гепатитом с (ХГС)
- 2209088 Опосредованная рецепторами доставка генов с использованием векторов на основе бактериофагов
- 2308967 Уменьшение объема ткани
- 2308962 Средство для опорно-дигательного аппарата
- 2308957 Способ получения препарата для мезотерапии
- 2308954 Средство для лечения ран, содержащее плазму или сыворотку крови
- 2308951 Комплексный способ профилактики вагинальных дисбактериозов
- 2308937 Косметическая биологически активная добавка и косметический литофитокомплекс на ее основе
- 2208638 ДНК (варианты), способ получения белка
- 2207885 Способ подачи небольшого объема лечебного раствора к целевому месту
- 2207858 Лишенные побочных эффектов производные простагландинов для лечения глаукомы
- 2207845 Твердая лекарственная форма пролонгированного действия
- 2207844 Препарат для местного неинвазивного применения
- 2207841 Средства с антиферментативным действием
- 2306335 Стволовые клетки и решетки полученные из жировой ткани
- 2306140 Новые рецепторы для Helicobacter pylori и их применение
- 2205612 Способ эндотелизации IN VITRO протезов кровеносных сосудов
- 2105540 Депигментирующее средство
- 2304960 Косметическое средство для кожи
- 2304616 Гены участвующие в гомеостазе и адаптации
- 2204550Способ получения длинноцепочечной N-Ацилированной кислотой Аминокислот
- 2204415 Способ получения изображения
- 2204394 Средство для лечения грибковых инфекций, желудочных язв
- 2204366 Способ хирургического лечения глаукомы
- 2104034 Вагинальное увлажняющие средство, способ его получения
- 2303991 Биологически активная добавка
- 2303990 БАД
- 2303973 Адсорбирующее изделие
- 2203676 Средство обладающее иммунокорригирующим действием
- 2203672 Способ предупреждения беременности
- 2303635 Гены кодирующие белки резистентности и толерантности к стрессам
- 2303529 Способ фиксации альгинатного геля на твердой фазе, способ получения клеточного чипа на его основе
- 2203078 Способ лечения гнойных ран
- 2302412 Гидразоно-малонитрилы
- 2102400 Способ получения гиалуроновой кислоты
- 2202356 Способ стимуляции репаративных процессов длительно незаживающих ран и трофических язв
- 2202336 Средство для ухода за кожей
- 2302231 Глазные капли
- 2102082 Способ магнитометрического исследования тела человека или животного
- 2301814 Полиакриламидный гидрогель
- 2201765 Гибридные матричные имплантанты и эксплантанты
- 2301677 Биотрансплантант для лечения дегенеративных и трвматических заболеваний хрящевой ткани и способ его получения
- 2301676 Способ лечения ревматизма
- 2301674 Способ лечения больных с переломами нижней челюсти
- 2301661 Средство с регулируемым освобождением и способ его получения
- 2005488 Средство для лечения болезней соединительной ткани
- 2200001 Крем для кожи
|
РОССИЙСКАЯ ФЕДЕРАЦИЯ

ФЕДЕРАЛЬНАЯ СЛУЖБА
ПО ИНТЕЛЛЕКТУАЛЬНОЙ СОБСТВЕННОСТИ
ПАТЕНТАМ И ТОВАРНЫМ ЗНАКАМ
|
Патент №2341257 |
(54) ИММУНОМОДУЛИРУЮЩЕЕ СРЕДСТВО, ПРОТИВОРАКОВОЕ СРЕДСТВО И ЗДОРОВАЯ ПИЩА, СОДЕРЖАЩАЯ ПРОИЗВОДНЫЕ МОНОАЦЕТИЛДИАЦИЛГЛИЦЕРИНА
(57) Реферат:
Изобретение относится к медицине, а именно к диетологии, и раскрывает применение производных моноацетилдиацилглицерина, экстрагированных из оленьего рога, в качестве средства, подавляющего нарушение клеток в результате аутоиммунной реакции. Пероральное применение производных моноацетилдиацилглицерина задерживает развитие индуцированного рака у хомячков путем активации лимфоцитов, моноцитов и дендритных клеток, а также индукции апоптоза раковых клеток вследствие усиления цитотоксичности иммунных клеток по отношению к раковым клеткам. Также при индукции септического шока у мышей продемонстрирован 100%-ный уровень выживаемости даже через 120 часов, достигаемый контролем иммунитета и подавляющим эффектом апоптоза. Производные моноацетилдиацилглицерина в соответствии с настоящим изобретением могут эффективно применяться как средство для лечения сепсиса и рака и как здоровая пища для предотвращения рака или аутоиммунных заболеваний. 4 н. и 7 з.п.ф-лы, 16 ил. 6 табл.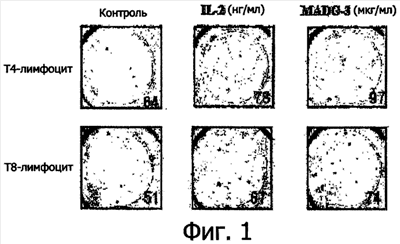
(56) (продолжение):
CLASS="b560m"Suppression of interleukin-2 by the putative endogenous cannabinoid 2-arachidonyl-glycerol is mediated through down-regulation of the nuclear factor of activated Т cells. Mol. Pharmacol. 1998 Apr; 53(4):676-83.
Область техники, к которой относится изобретение
Это изобретение имеет отношение к применению иммуномодулирующего средства, к лечебным ресурсам и здоровой пище, содержащей в качестве эффективного ингредиента производные моноацетилдиацилглицерина, экстрагированные из оленьего рога.
Уровень техники
Олений рог (по латыни Cervi parvu cornu) представляет собой заготовленный и высушенный необызвестленный рог любого животного семейства оленьих. В традиционной восточной медицине Кореи широко используют оленьи рога, а также женьшень из-за их различных заявленных медицинских эффектов. При традиционном применении оленьих рогов ограничиваются только несколькими видами семейств оленьих: Cervus Nippon Temminick var. Mantchuricus Swinhoe (далее C.N.) и Cervus elaphus L.. Полагают, что олений рог обладает целым рядом лечебных эффектов. Известно, что он эффективен в тонизирующих средствах для стимулирования роста и развития, гемопоэза, для лечения нервных расстройств, лечения сердечной недостаточности, и, как правило, он улучшает функцию пяти плотных внутренних органов и шести полых внутренностей (Dong-euibogam, классическая медицинская литература в Корее). Другие книги в традиционной медицине, имеющие отношение к эффектам оленьих рогов, также сообщают о тонизирующих эффектах, питательном эффекте, эффектах на повышение жизнеспособности, включающих улучшение сердечной функции, эффектах снятия усталости, повышении иммунитета. Было предпринято много усилий для открытия полного химического состава оленьего рога. В результате было обнаружено, что он содержит активные ингредиенты, такие как свободные аминокислоты, следовые (металлические) элементы, гексозу, пентозу, гексозамин, уроновую кислоту, сиаловую кислоту, мукополисахариды (например, гиалуроновую кислоту, хондроитин А), различные жирные кислоты, простагландины. Также было сообщено, что в экстрактах из оленьих рогов были обнаружены гликолипид, фосфолипид, холестерин, гипоксантин, холест-5-ен-3 ,7 ,7 -диол, сложный эфир холестерина, полиамин. Другие авторы сообщали о присутствии эстрона и рецептора эстрадиола (report NIH Korea, Vol.22, p. 359, 1985; Korean Biochem. J, Vol.9, No.3, p.153, 1976; Korean Biochem. J, Vol.9, No.4, p. 215, 1976; Korean Biochem. J, Vol.10, No.1. p. 1, 1977; Shoykugaku Zasshi, 43(2), p 173, 1989). -диол, сложный эфир холестерина, полиамин. Другие авторы сообщали о присутствии эстрона и рецептора эстрадиола (report NIH Korea, Vol.22, p. 359, 1985; Korean Biochem. J, Vol.9, No.3, p.153, 1976; Korean Biochem. J, Vol.9, No.4, p. 215, 1976; Korean Biochem. J, Vol.10, No.1. p. 1, 1977; Shoykugaku Zasshi, 43(2), p 173, 1989).
Иммунитет представляет собой защитный механизм, охраняющий живой организм от различных патогенов. Иммунодефицит возникает из-за дефекта в компонентах иммунной системы, указывающего на то, что иммунная система не способна отвечать на различные антигены. Иммунодефицит в значительной степени делится на врожденный или первичный иммунодефицит и приобретенный или вторичный иммунодефицит. В случае врожденного иммунодефицита, как и следовало ожидать, отсутствуют В-клетки или Т-клетки, поэтому его можно лечить только с помощью генной терапии, введением антител или трансплантацией костного мозга. С другой стороны, в случае приобретенного иммунодефицита все факторы, имеющие отношение к иммунитету, естественно существуют, но имеет место нарушение в иммунных реакциях, поэтому иммунодефицит может быть повышен с помощью активации функций иммунных факторов. В последнее время увеличилось количество аутоиммунных заболеваний, таких как артрит, атопия, слабоумие и сепсис. Аутоиммунные заболевания возникают из-за чрезмерного усиления иммунной функции. Для лечения аутоиммунных заболеваний применяли иммунный супрессор, но иммунный супрессор также часто вызывает подавление иммунитета. Основываясь на раскрытии механизма иммунитета, было предпринято много попыток для разработки иммунного регулятора для контроля над иммунитетом. Целью этих попыток является усиление защитной силы живого организма против патогенов и минимизация побочных эффектов с помощью контроля за активацией и супрессией иммунной функции иммунными регуляторами, которые могут неспецифично стимулировать иммунные клетки. Иммунные регуляторы могут лечить едва ли не все заболевания живого организма, такие как рак, сепсис, дегенеративный артрит, инфекция, слабоумие, старение, диабет, анемия, заболевание кожи, астма, атопия, стресс, нервное расстройство, физическая усталость, синдром хронической усталости и остеопороз. На сегодняшний день в качестве иммунного регулятора использовали химические соединения, композиции микроорганизмов, биологические продукты и т.д. Большинство этих иммунных регуляторов ограничены в применении, так как они имеют склонность вызывать только один эффект (или иммунную активацию, или супрессию). Таким образом, они могут вызывать побочные эффекты и быть токсичными сами по себе. Чтобы преодолеть указанные выше проблемы, главными мишенями для разработки иммунных регуляторов являются продукты питания, не обладающие токсичностью, эффективные ингредиенты, экстрагированные из природных источников и традиционные лекарственные травы; а также эксперименты для выяснения их эффектов в качестве лекарственных средств для клинических испытаний. Но эти иммунные регуляторы все еще обладают или активирующим или подавляющим эффектом на иммунитет.
Число случаев рака, главной причины смертности в Корее, каждый год увеличивается. Химиотерапия или радиотерапия при лечении рака не только убивают раковые клетки, но также разрушают нормальные клетки костного мозга, в особенности кроветворные клетки, регулирующие иммунитет и гемопоэз, что приводит к нарушениям в иммунной системе и кроветворных органах (Korean J. BRM., 1, р. 23, 1993; Korean J. BRM., 4, p. 47, 1994; Crit Rev Oncol Hematol. 1, p.227, 1984). Сепсис является серьезным заболеванием, приводящим в более чем к 45% смертельному исходу, он вызывается тяжелой системной инфекцией, ведущей к системному воспалительному ответу. Он возникает, когда инфицированные организмы в избыточной степени отвечают на эндотоксин грамотрицательных бактерий. Несмотря на то что при лечении септического шока применяли антибиотики, стероид или «Ксигрис» (Eli Lilly company), уровень смертности от септического шока остается все еще высоким, так как эти антибиотики, стероид или «Ксигрис» неэффективны против сепсиса.
Авторы настоящего изобретения выделили различные ингредиенты из рога оленя C.N., который, как известно, обладает превосходными фармацевтическими эффектами как народное средство, и затем обнаружили, что один из этих эффективных ингредиентов рога оленя C.N., моноацетилдиацилглицерин, демонстрирует значительную иммунную регуляторную активность in vivo. За счет его иммунных регуляторных эффектов рог оленя C.N. можно применять при лечении септического шока и как противораковое средство, не вызывающее токсичности in vivo. Авторы настоящего изобретения подтвердили, что моноацетилдиацилглицерол настоящего изобретения может быть применен как безопасное средство, усиливающее иммунитет, как иммуномодулирующее средство, как средство для лечения септического шока и как противораковое средство.
Раскрытие изобретения
Таким образом, целью настоящего изобретения является обеспечение иммуномодулирующего средства, средства для лечения септического шока, противоракового средства и здоровой пищи, содержащей производные моноацетилдиацилглицерина в качестве эффективного ингредиента. Здоровые продукты питания предназначены для модулирования иммунитета, предупреждения или лечения септического шока и рака.
Для достижения указанной выше цели настоящее изобретение обеспечивает иммуномодулирующее средство, содержащее в качестве эффективного ингредиента производные моноацетилдиацилглицерола, представленные ниже формулой (1):
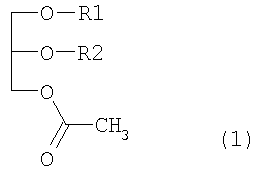
где R1/R2 является 9-октадеценоил(олеоил)/(гексадеканоил(пальмитоил), гексадеканоил(пальмитоил)/(9-октадеценоил(олеоил), гексадеканоил(пальмитоил)/9,12-октадекадиеноил(линолеоил), гексадеканоил(пальмитоил)/9,12,15-октадекатриеноил(линоленоил) или гексадеканоил(пальмитоил)/5,8,11,14-эйкозатетраеноил(арахидоноил).
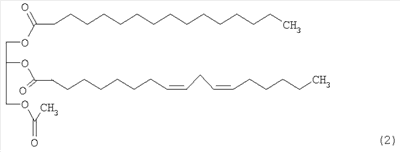
Предпочтительными являются указанные выше производные моноацетилдиацилглицерина, представленные ниже формулой (2):
Настоящее изобретение также обеспечивает средство лечения СПИДа, сепсиса и противораковое средство, содержащее производные моноацетилдиацилглицерина с формулой 1 в качестве эффективного активного ингредиента. Настоящее изобретение, кроме того, обеспечивает продукты здорового питания, содержащие производные моноацетилдиацилглицерина с формулой 1 в качестве эффективного активного ингредиента для модуляции иммунитета или предупреждения рака.
Краткое описание чертежей
Фиг.1 представляет собой набор фотографий, демонстрирующих активность Т-клеток (Т-4 и Т-8) контрольной группы, группы, обработанной IL-2 (20 нг/мл), и группы, обработанной соединением 3 (1 мкг/мл). Каждое число указывает количество пятен, захвативших специфические антитела к IL-2.
Фиг.2 представляет собой график, показывающий высвобождение цитокинов после того, как Т-лимфоциты активируются соединением 3,
Контрольная группа: обработанная анти-CD3 и анти-CD28,
Экспериментальная группа: обработанная анти-CD3, анти-CD28 и соединением 3 (0,1 мкг/мл).
Фиг.3 представляет собой набор фотографий, демонстрирующих морфологию мышиных дендритных клеток, происходящих из мышиных клеток костного мозга, после обработки GM-CSF (20 нг/мл), IL-4 (20 нг/мл) и TNF- (5 нг/мл). (5 нг/мл).
А: микрофотография, сделанная сразу после инокуляции мышиных клеток костного мозга с плотностью 1×106 клеток/мл (×100).
В: микрофотография, демонстрирующая стволовые клетки костного мозга круглых костей через три дня культивирования. Эти клетки формировали кластер, который вырастал на дне лунки клеточного культурального планшета (×400).
С: микрофотография растущих зрелых дендритных клеток, которые формируют кластер на 6-й или 7-й день культивирования (×400), эта небольшая фотография представляет собой увеличенную фотографию индивидуальной клетки (×2).
D: микрофотография дендритных клеток, которые формируют специфические небольшие и длинные выпячивания на 9-й день культивирования (×1000), эта небольшая фотография представляет собой увеличенную фотографию индивидуальной клетки (×2).
Фиг.4 представляет собой набор фотографий, демонстрирующих результаты FACS, анализа экспрессии специфических маркеров дендритных клеток, специфических маркеров моноцитов и специфических маркеров гранулоцитов, на 11-й день культивирования клеток костного мозга, выделенных из мышей Balb/c AnN. (Здесь для установки линии маркеров (прямая линия) применяют окрашивание изомерного контроля с помощью IgG хомячка и IgG2a крысы.
Применяют следующие маркеры:
CD80 и CD86 как специфические маркеры костимуляции,
CD11 и DEC-205 как специфические маркеры дендритных клеток,
CD 14 и F4/80 как специфические маркеры моноцитов/макрофагов,
Gr-1 как специфический маркер гранулоцитов.
Фиг.5 представляет собой фотографию электрофоретического разделения, демонстрирующую эффекты соединения 3 на дендритные клетки и экспрессию адгезивных молекул.
| Дорожка 1: Vcam-1 |
Дорожка 2: Icam-1 |
Дорожка 3: Icam-2 |
| Дорожка 4: VLA-4 |
Дорожка 5: VLA-5 |
Дорожка 6: LFA-1 |
| Дорожка 7: GAPDH |
|
|
| (+): Группа, обработанная соединением 3 |
|
|
| (-): Контрольная группа |
|
|
Фиг.6 представляет собой набор фотографий, демонстрирующих результаты образования опухоли вблизи места инъекции, через 4 недели после внутривенной инъекции опухоли (KIGB-5) и обработки в следующих условиях.
А: Контрольная группа RPMI
В: Группа, обработанная BMSC
С: Группа, обработанная BMSC+Ad/ Е1. Е1.
Фиг.7 представляет собой набор фотографий, демонстрирующих результаты образования опухоли вблизи места инъекции, через 8 недель после внутривенной инъекции опухоли (KIGB-5) и обработки в следующих условиях.
А: Контрольная группа RPMI
В: Группа, обработанная BMSC (2,5×106 клеток/день)
С: Группа, обработанная BMSC (2,5×106 клеток/день)+Ad/ Е1 (50 MOI). Е1 (50 MOI).
D: Группа, обработанная дендритными клетками (5×106 клеток/день) + лизатом опухоли
F: Группа, обработанная соединением 3 (50 мг/кг/день)
Фиг.8 и 9 представляют собой набор фотографий, демонстрирующих значительное и микроскопическое обнаружение метастазных поражений легких в каждой группе, через 8 недель после внутривенной инъекции опухоли (KIGB-5).
На фиг.8
А: Контрольная группа RPMI
В: Группа, обработанная BMSC (2,5×106 клеток/день)
С: Группа, обработанная BMSC (2,5×106 клеток/день)+Ad/ Е1 (50 MOI). Е1 (50 MOI).
D: Группа, обработанная BMSC (2,5×106 клеток/день)+Ad/IL-2 (50 MOI).
На фиг.9
А: Контрольная группа RPMI
В: Группа, обработанная дендритными клетками (5×106 клеток/день) + лизатом опухоли
С: Группа, обработанная соединением 3 (25 мг/кг/день).
Фиг.10 представляет собой набор фотографий, демонстрирующих опухоли легких и их размеры в каждой группе, через 12 недель после внутривенной инъекции опухоли (KIGB-5).
А: Контрольная группа RPMI
В: Группа, обработанная BMSC (2,5×106 клеток/день)+Ad/ Е1 (50 MOI) Е1 (50 MOI)
С: Группа, обработанная BMSC (2,5×106 клеток/день)
D: Группа, обработанная DC (5×106 клеток/день) + лизатом опухоли
Е: Группа, обработанная BMSC (2,5×106 клеток/день)+Ad/IL-2 (50 MOI)
F: Группа, обработанная BMSC (2,5×106 клеток/день)+Ad/IL-2 (50 MOI)+соединением 3 (25 мг/кг/день)
G: Группа, обработанная соединением 3 (25 мг/кг/день).
Фиг.11 представляет собой набор фотографий, демонстрирующих обнаружение крупных метастазных поражений легких в каждой группе сирийских золотых хомячков, получавших различные дозировки соединения 3, через 8 недель после инъекции клеток билиарного рака (5×105 клеток).
А: Контрольная группа PBS
В: Группа, обработанная соединением 3 (10 мг/кг/день)
С: Группа, обработанная соединением 3 (25 мг/кг/день)
D: Группа, обработанная соединением 3 (50 мг/кг/день).
Фиг.12 представляет собой набор фотографий, демонстрирующих обнаружение микроскопических метастазных поражений легких в каждой группе сирийских золотых хомячков, получавших различные дозировки соединения 3, через 8 недель после инъекции клеток билиарного рака (5×105 клеток).
А: Контрольная группа PBS
В: Группа, обработанная соединением 3 (10 мг/кг/день)
С: Группа, обработанная соединением 3 (25 мг/кг/день)
D: Группа, обработанная соединением 3 (50 мг/кг/день).
Фиг.13 представляет собой набор фотографий, демонстрирующих обнаружение крупных метастазных поражений легких в каждой группе мышей С57В 1/6, получавших различное лечение, через 4 недели после внутривенной инъекции клеток меланомы (2×104 клеток).
А: Контрольная группа PBS
В: Группа, обработанная дендритными клетками (4×105 клеток/день) + лизатом опухоли
С: Группа, обработанная соединением 3 (50 мг/кг/день).
Фиг.14 представляет собой набор фотографий, демонстрирующих обнаружение микроскопических метастазных поражений легких в каждой группе мышей С57В 1/6, получавших различное лечение, через 4 недели после внутривенной инъекции клеток меланомы (2×104 клеток).
А: Контрольная группа PBS
В: Группа, обработанная дендритными клетками (4×105 клеток/день) + лизатом опухоли
С: Группа, обработанная соединением 3 (50 мг/кг/день).
Фиг.15 представляет собой график, демонстрирующий степень выживаемости клеток каждой группы, подвергавшейся воздействию в течение 6 недель после внутривенной инъекции клеток меланомы (2×104 клеток).
Контрольная группа RPMI
Группа, обработанная дендритными клетками (5×106 клеток/день) + лизатом опухоли
Группа, обработанная соединением 3 (50 мг/кг/день).
Фиг.16 представляет собой график, демонстрирующий цитотоксичность Т-лимфоцитов, активированных соединением 3, по отношению к клеткам меланомы.
Контроль 1: Группа, обработанная анти-CD3, анти-CD28
Контроль 2: Группа, обработанная анти-CD3, анти-CD28 и IL-2 (20 нг/мл)
Экспериментальная группа: Группа, обработанная анти-CD3, анти-CD28 и соединением 3 (1 мкг/мл).
Осуществление изобретения
Ниже настоящее изобретение описано в деталях.
Настоящее изобретение обеспечивает иммуномодулирующее средство, средство для лечения СПИДа, лечения сепсиса и противораковое средство, содержащее в качестве эффективного активного ингредиента производные моноацетилдиацилглицерина, представленные формулой 1. Соединение, представленное формулой 1, настоящего изобретения является одним из пяти следующих соединений:
1) 1-олеоил-2-2-пальмитоил-3-ацетилглицерин (R1/R2=9-октадеценоил/гексадеканоил, далее по тексту «соединение 1»)
2) 1-пальмитоил-2-олеоил-3-ацетилглицерин (R1/R2=гексадеканоил/9-октадеценоил, далее по тексту «соединение 2»)
3) 1-пальмитоил-2-линолеил-3-ацетилглицерин (R1/R2=гексадеканоил/9,12-октадекадиеноил, далее по тексту «соединение 3»)
4) 1-пальмитоил-2-линоленоил-3-ацетилглицерин (R1/R2=гексадеканоил/9,12,15-октадекатриеноил, далее по тексту «соединение 4»)
5) 1-пальмитоил-2-арахидоноил-3-ацетилглицерин (R1/R2=гексадеканоил/5,8,11,14-эйкозатетраеноил, далее по тексту «соединение 5»).
Любое из производных моноацетилдиацилглицерина, представленное формулой 1, доступно, и, в частности, предпочтительным является соединение 3. Соединение настоящего изобретения было экстрагировано из рогов оленей C.N. или произведено с помощью общепринятого метода органического синтеза. Типичный метод экстракции имеет следующие стадии. Более подробно, хлороформенные экстракты рогов оленя C.N. получают сначала экстракцией рогов оленя C.N. гексаном и затем экстракцией остатка после гексановой экстракции хлороформом. Количества гексана и хлороформа, применяемые в процессе экстракции, достаточно для того, чтобы пропитать олений рог. Обычно гексан и хлороформ применяются в соотношении примерно 4-5 л на 1 кг рогов оленя C.N. Хлороформенный экстракт рогов оленя C.N., полученный в результате такого процесса экстракции, фракционируют и очищают с помощью серии колоночных хроматографий на силикагеле и TLC (тонкослойной хроматографии). Элюент для последовательных стадий экстракции отбирают из смеси хлороформ/метанол, гексан/этилацетат. Чтобы синтезировать производные моноацетилдиацилглицерина химическим путем, например, 1-пальмитоилглицерин отделяют от обоих продуктов реакции, глицерина и пальмитиновой кислоты. Целевой моноацетилдиацилглицерин можно синтезировать путем этерификации 1-пальмитоилглицерина соединениями карбоновой кислоты, такой как уксусная кислота и линолевая кислота, и при необходимости очистить. Другой способ синтеза производных моноацетилдиацилглицерина представляет собой ацетолиз фосфатидилхолина.
Моноацетилдиацилглицериновое соединение в соответствии с настоящим изобретением представляет собой иммуномодулирующее средство. Модуляция иммунитета включает усиление аномально нарушенного иммунитета или поддержание баланса аномально повышенного иммунитета. Следовательно, моноацетилдиацилглицериновые соединения в соответствии с настоящим изобретением обладают эффектами не только на предупреждение и лечение различных заболеваний, но также на подавление, предупреждение и лечение аутоиммунных заболеваний, таких как артрит, атопия, слабоумие и сепсис, возникающие в результате аутоиммунных реакций.
В регулировании иммунной функции важно не увеличение числа Т-клеток, которые отвечают за иммунитет, а продолжительность активации Т-клеток, соотношение Т4- и Т8-клеток. Авторы настоящего изобретения обрабатывали Т4- и Т8-лимфоциты производными моноацетилдиацилглицерина для исследования иммуномодулирующего эффекта производных моноацетилдиацилглицерина изобретения. В результате было подтверждено, что в этих клетках повышалась секреция IL-2, одного из цитокинов (см. фиг.1). После обработки клеток соединением 3 настоящего изобретения с помощью Bio-plex, который способен одновременно измерять огромное количество цитокинов, исследовали секрецию цитокина в Т-клетках. В результате секреция IL-2, IL-4 и IL-5 была значительно выше в группе, обработанной соединением 3, чем в контрольной группе (см. фиг.2). Увеличившийся в наибольшем количестве цитокин IL-4 представляет собой полифункциональный цитокин, называемый противовоспалительным цитокином, который секретируется из Th2, которые дифференцировались из Т4-клеток. Из-за подавления дифференциации Т4 в Th1 IL-4 может подавлять повреждение клеток, возникающее в результате аутоиммунной реакции, выполняя важную роль для противоракового эффекта и регулирования иммунного ответа (Annu. Rev. Immunol. 1999. 17:701-738). Соединения настоящего изобретения влияют как на повышение иммунитета с помощью стимуляции секреции IL-2, так и на модуляцию иммунитета с помощью стимуляции секреции IL-4. Соединения настоящего изобретения также могут поддерживать соотношение Т4 и Т8 в норме с помощью усиления и активации не только Т4, но также и Т8, которые являются цитотоксичными иммунными клетками. Поэтому изобретение эффективно для лечения побочных эффектов и заболеваний, возникающих из-за аномального усиления или подавления иммунной системы. В модели септического шока эти эффекты усиления иммунитета могут работать в направлении стимуляции секреции IL-4 и ингибирования апоптоза. В результате уровень смертности от сепсиса значительно снижается. Следовательно, производные моноацетилдиацилглицерина в соответствии с настоящим изобретением полезны для лечения аутоиммунных заболеваний, например, для предупреждения и лечения сепсиса, так как эти соединения повышают секрецию IL-4.
Было известно, что взаимодействие между клетками стимулирует различные кроветворные клетки и иммунные клетки, и особенно важно для иммунной системы взаимодействие между дендритными клетками. Авторы настоящего изобретения исследовали эффект производных моноацетилдиацилглицерина на взаимодействие между выделенными и индуцированными дендритными клетками и TCR (рецептор Т-клеток). В исследовании проводили ПЦР-анализ в режиме реального времени DC (дендритных клеток), обработанных соединением 3, чтобы измерить экспрессию адгезивных молекул-посредников взаимодействия между DC и TCR. В результате по сравнению с контролем повышалась экспрессия адгезивных молекул, таких как Vcam-1, Icam-1, Icam-2, VLA-4, VLA-5 и LFA-1 (см. фиг.5). Приведенные выше результаты подтвердили, что производные моноацетилдиацилглицерина в соответствии с настоящим изобретением обладают эффектом не только на активацию Т-клеток, но также специфическим противораковым эффектом через активацию дендритных клеток, которые дают возможность Т-клетке узнавать антиген раковых клеток.
Приведенные выше результаты подтвердили, что производные моноацетилдиацилглицерина в соответствии с настоящим изобретением обладают эффектом усиления иммунитета с помощью повышения секреции цитокинов через активацию Т-клеток и с помощью активации пролиферации и стимуляции кроветворных клеток и иммунных клеток через повышение экспрессии внутриклеточных адгезивных молекул. В результате было подтверждено, что эти соединения имеют возможность применения в качестве иммунотерапии при различных заболеваниях. Например, производные моноацетилдиацилглицерина в соответствии с настоящим изобретением могут применяться для лечения или в качестве здоровой пищи для усиления иммунитета у пациентов, больных СПИДом, через пролиферативный эффект Т4- и Т8-клеток. На ранней стадии болезни пациентов со СПИДом снижался уровень Т4, но серьезной вспышки заболевания не происходило. С другой стороны, на последней фазе заболевания СПИДом у пациентов снижался уровень Т8 и происходила вспышка заболевания. Следовательно, соотношение Т4 и Т8 является важным фактором, и абсолютное количество Т4 и Т8 также является важным фактором. Кроме того, авторы настоящего изобретения подтвердили, что при различных аутоиммунных заболеваниях эффективна модуляция иммунной функции с помощью повышения секреции IL-4. Чтобы исследовать возможность применения соединений в соответствии с настоящим изобретением для предупреждения и лечения септического шока, проводили CLP-тест (цекальная лигатура и пункция) на мышах. В результате все протестированные мыши выжили до 120 часов. Следовательно, это подтверждает, что производные моноацетилдиацилглицерина в соответствии с настоящим изобретением были эффективны для предупреждения и лечения сепсиса. Приведенные выше результаты подтвердили, что производные моноацетилдиацилглицерина в соответствии с настоящим изобретением были полезны в качестве идеального иммуномодулирующего средства, вызывающего как повышение иммунитета, так и регулирующего иммунную функцию.
Кроме того, чтобы исследовать возможность применения соединений в соответствии с настоящим изобретением для предупреждения и лечения рака, авторы настоящего изобретения исследовали противораковый эффект соединений против билиарного рака и злокачественной меланомы, которые, как известно, относятся к неизлечимым формам рака. Во-первых, авторы настоящего изобретения индуцировали рак у хомячка внутривенной или подкожной инъекцией KIBG-5, клеточной линии билиарного рака. Затем хомячку вводили RPMI, BMSC, аденовирус/ Е1, дендритные клетки + лизат опухоли, соединение 3, аденорирус/IL-2 и смеси. Наблюдение за результатом проводили через 4 недели. В результате при наблюдении невооруженным глазом или с помощью микроскопа в группах, подвергнутых воздействию дендритных клеток + лизата опухоли, соединения 3 и аденорируса/IL-2, не происходило образование опухоли (см. фиг.6), Кроме того, опухолевые клетки вводили внутривенно и наблюдения проводили через 8 недель. В результате образовывались метастазные поражения легких во всех группах, за исключением группы, которой вводили BMSC + аденовирус/IL-2. По результатам биопсии только незначительное поражение было обнаружено в группе, которой вводили дендритные клетки + лизат опухоли, и в группе, которой вводили соединение 3 (см. фиг.7, фиг.8 и фиг.9). И далее, опухолевые клетки вводили подкожно и наблюдение проводили через 12 недель. В результате опухоль возникала во всех группах, за исключением группы, которой вводили BMSC + аденовирус/hIL-2, и группы, которой вводили BMSC+Ad/hIL-2 + соединение 3 (см. фиг.10). Образование опухоли тормозилось соединением 3 дозо-зависимым способом (см. фиг.11 и 12). Как было объяснено выше, авторы настоящего изобретения индуцировали метастазирующий рак у хомячка с помощью инъекции клеток билиарного рака (KIBG) и затем хомячка подвергали воздействию производных моноацетилдиацилглицерина настоящего изобретения. В результате было подтверждено, что развитие рака значительно ингибировалось в результате воздействия соединений настоящего изобретения. Е1, дендритные клетки + лизат опухоли, соединение 3, аденорирус/IL-2 и смеси. Наблюдение за результатом проводили через 4 недели. В результате при наблюдении невооруженным глазом или с помощью микроскопа в группах, подвергнутых воздействию дендритных клеток + лизата опухоли, соединения 3 и аденорируса/IL-2, не происходило образование опухоли (см. фиг.6), Кроме того, опухолевые клетки вводили внутривенно и наблюдения проводили через 8 недель. В результате образовывались метастазные поражения легких во всех группах, за исключением группы, которой вводили BMSC + аденовирус/IL-2. По результатам биопсии только незначительное поражение было обнаружено в группе, которой вводили дендритные клетки + лизат опухоли, и в группе, которой вводили соединение 3 (см. фиг.7, фиг.8 и фиг.9). И далее, опухолевые клетки вводили подкожно и наблюдение проводили через 12 недель. В результате опухоль возникала во всех группах, за исключением группы, которой вводили BMSC + аденовирус/hIL-2, и группы, которой вводили BMSC+Ad/hIL-2 + соединение 3 (см. фиг.10). Образование опухоли тормозилось соединением 3 дозо-зависимым способом (см. фиг.11 и 12). Как было объяснено выше, авторы настоящего изобретения индуцировали метастазирующий рак у хомячка с помощью инъекции клеток билиарного рака (KIBG) и затем хомячка подвергали воздействию производных моноацетилдиацилглицерина настоящего изобретения. В результате было подтверждено, что развитие рака значительно ингибировалось в результате воздействия соединений настоящего изобретения.
Проводили внутривенную инъекцию клеток злокачественной меланомы в хвост мышей, чтобы вызвать там рак. Затем вводили RPMI, дендритные клетки (DC), лизат опухоли и соединение 3 индивидуально или в виде смеси. В результате в контрольной группе, которой вводили RPMI, образовывались метастазные поражения легких, но в группах, которым вводили соединение 3 и дендритные клетки + лизат опухоли, поражений обнаружено не было (см. фиг.13 и 14). Кроме того, в течение 6 недель после инъекции опухоли проводили наблюдение за группами, которым вводили соединение 3 и дендритные клетки + лизат опухоли, что привело к 90%-ному уровню выживаемости (см. фиг.15). На основании результатов, приведенных выше, авторы настоящего изобретения подтвердили, что соединение 3 активирует Т-клетки (Т4 и 8), что указывает на то, что соединение 3 обладает противораковым эффектом. Поэтому авторы настоящего изобретения провели цитотоксический тест Т-клеток, активированных соединением 3, по отношению к злокачественной меланоме in vitro. В результате цитотоксичность значительно увеличивалась, если Т-клетки обрабатывали соединением 3, по сравнению с Т-клетками, не обработанными соединением 3, и также цитотоксичность увеличивалась с увеличением количества Т-клеток (см. фиг.16). Как объяснялось ранее, было подтверждено, что производные моноацетилдиацилглицерина настоящего изобретения ингибируют развитие рака и демонстрируют цитотоксичность в отношении раковых клеток, возникающую в результате активации Т-клеток, указывающую на то, что соединения настоящего изобретения могут эффективно применяться в качестве противоракового средства.
Лечение с помощью продукта настоящего изобретения в качестве противоракового средства, по-видимому, является многообещающим в случае рака желчных протоков, рака почек и меланомы, но другие формы злокачественных заболеваний также перспективны в качестве мишеней.
Автор настоящего изобретения в настоящий момент получил опытные капсулы и таблетки, содержащие производные моноацетилдиацилглицерина в качестве эффективного активного ингредиента. Иммуномодулирующее средство, средство лечения СПИДа, сепсиса и противораковое средство настоящего изобретения предпочтительно включают производные моноацетилдиацилглицерина в количестве от 20 до 100 вес.% от общего веса средства, более предпочтительно от 30 до 100 вес.%. Если количество моноацетилдиацилглицеринов слишком велико или слишком мало, в действительности трудно принимать лекарственное средство и от этого нет никакой пользы. Также предпочтительно принимать средство для лечения сепсиса, противораковое средство и иммуномодулирующее средство принимать перорально от одного до трех раз в день или от одного до четырех раз в день в дозировке 50 мг/кг. Композиции (средства) в соответствии с настоящим изобретением могут дополнительно включать один или несколько фармацевтически приемлемых носителей, в дополнение к эффективному ингредиенту их вводят в состав фармацевтической формы. Носитель может быть выбран из группы, состоящей из солевого раствора, забуференного солевого раствора, воды, глицерина и этанола, но выбор не ограничен этими соединениями. Пригодна любая фармацевтически приемлемая композиция, известная в этой области техники (Remingtons Pharmaceutical Science (the latest edition). Mack Publishing Company, Easton PA). Композицию настоящего изобретения можно принимать внутрь перорально и применять в общепринятых формах фармацевтических композиций. Композицию настоящего изобретения можно получить для перорального приема путем смешивания с общепринятыми наполнителями, сухими разбавителями, связующими веществами, смачивающими веществами, дезинтегрирующими веществами, разбавителями, такими как поверхностно-активное вещество или эксипиент. Эффективную дозировку композиции настоящего изобретения можно определить в зависимости от возраста, пола, состояния здоровья, поглощения эффективного ингредиента, скорости инактивации, экскреции и совместного применения других лекарственных средств. Например, дозировка для перорального введения может быть от 0,24 до 9,0 г в день, но не ограничиваться только этими значениями. Настоящее изобретение также включает фармацевтические композиции в дозировочных единицах. Это означает, что композиции присутствуют в виде индивидуальных форм, например таблеток, таблеток, покрытых оболочкой, капсул, пилюль, суппозиториев и ампул, содержание активного соединения в которых соответствует части или нескольким индивидуальным дозам. Дозировочные единицы могут содержать, например, 1, 2, 3 или 4 индивидуальные дозировки или 1/2, 1/3 или 1/4 часть индивидуальной дозировки. Индивидуальная дозировка содержит количество активного соединения, которое вводят в один прием и которое обычно соответствует целой, 1/2, 1/3 или 1/4 дневной дозировки. Твердые композиции для перорального введения представляют собой таблетки, пилюли, порошки и капсулы, жидкие композиции для перорального применения представляют собой суспензии, растворы, эмульсии и сиропы, и указанные выше композиции в дополнение к обычно используемым простым растворителям, таким как вода и жидкий парафин, могут содержать различные эксипиенты, такие как увлажняющие средства, подсластители, ароматизаторы и консерванты. Соединения настоящего изобретения могут применяться не только в составе композиций для перорального употребления, но также в виде композиций для инъекций. Например, водную или масляную суспензию для стерильной инъекции можно получить в соответствии с известным методом с помощью диспергирующих средств, увлажняющих средств или эмульсий. Любой фармацевтически приемлемый растворитель включает воду, раствор Рингера или изотонический раствор NaCl. Стерильное усваивающееся масло применяют в качестве растворителя или диспергирующей среды, и может включать нераздражающее усваивающееся масло, включающее моноглицерид, диглицерид и полипропиленгликоль, и жирную кислоту, такую как олеиновую кислоту.
Настоящее изобретение также обеспечивает иммуномодулирующую и противораковую здоровую пищу, содержащую производные моноацетилдиацилглицерина в качестве эффективных ингредиентов. В настоящем изобретении «здоровая пища» включает продукт питания, пищевую и целебную добавку для лечения или предупреждения различных заболеваний и поддержания баланса функций организма. Здоровая пища, полученная по настоящему изобретению, содержит моноацетилдиацилглицерины в количестве от 0,02 до 100 вес.%. В случае применения соединений настоящего изобретения в качестве здоровой пищи с соединением по изобретению можно применять в соответствии с общепринятым методом, например, используя исходные соединения или используя смеси соединений с другими продуктами питания или пищевыми ингредиентами. Эффективное количество смеси соединений зависит от целей их применения (предупреждение, здоровье или терапевтическое лечение). В случае применения для предупреждения нарушения предпочтительное количество производных моноацетилдиацилглицерина составляет от 0,02 до 2 вес.% от общего количества продукта здоровой пищи, предпочтительно от 0,2 до 0,6 вес.%. Если количество моноацетилдиацилглицеринов слишком велико или слишком мало, то получить здоровую пищу затруднительно и она неэффективна. Эффективный ингредиент также является безопасным при долговременном введении, имеющем цель контроля или защиты здоровья, что подтверждено цитотоксическим тестом. Без всяких ограничений можно приготовить любые виды пищи, содержащие композицию настоящего изобретения. Например, мясная колбаса, хлеб, супы, напитки, чай, алкогольные напитки и витаминный комплекс представляют собой продукты питания, которые изготавливают в качестве здоровой пищи, содержащей композицию настоящего изобретения. В случае если здоровую пищу применяют в качестве пищевых или целебных добавок для лечения или предупреждения заболевания, предпочтительное количество производных моноацетилдиацилглицерина составляет от 20 до 100 вес.% от общего количества здоровой пищи, предпочтительно от 30 до 100 вес.%, более предпочтительно от 35 до 95 вес.%. Потребление может составлять от 0,18 до 9,0 г в день, но не ограничивается только этими количествами. Композиции включают таблетки и капсулы.
Как было объяснено ранее, производные моноацетилдиацилглицерина настоящего изобретения активируют Т-клетки, способствуя секреции цитокинов, повышают секрецию адгезивных молекул между клетками для стимуляции кроветворных клеток и иммунных клеток для того, чтобы не только улучшить иммунитет, но также предотвратить и вылечить аутоиммунные заболевания и рак.
Далее для более ясного понимания настоящего изобретения будут представлены предпочтительные экспериментальные примеры. Однако настоящее изобретение не ограничивается экспериментальными примерами, представленными ниже.
ПРИМЕРЫ
Экспериментальный пример 1. Влияние производных моноацетилдиацилглицерина на пролиферацию Т-клеток и моноядерных клеток.
Экспериментальный пример 1-1. Влияние производных моноацетилдиацилглицерина на пролиферацию Т-клеток
Спленоциты получали из селезенки мышей линии C57BL/6 (предоставлены Asan Institute for Life Sciences Animal Lab., Seoul, Korea). Затем суспензии единичных клеток получали с помощью повторной аспирации и промывания. Эритроциты удаляли, используя клорид аммония, и затем пропускали через нейлоновую вату для удаления обломков и агрегатов. Т-клетки очищали с помощью магнитных шариков (MACS bead, Miltenyi Biotec, bergich gladbach, Germany), содержащих антитела к козьим IgG (MACS bead, Miltenyi Biotec, bergich gladbach, Germany) или антитела к мышиному CD8 (MACS bead, Miltenyi Biotec, bergich gladbach, Germany) (Turner and Dockrell (1996) Immunology, 87:339-342).
Суспензию Т-клеток суспендировали в среде Дюльбекко в модификации Искова (IMDM, Gibco, Grand Island, NY) с добавлением 10%-ной фетальной бычьей сыворотки (далее везде "FBS") (Gibco, Grand Island, NY). Жизнеспособные клетки в количестве 5×104 штук на лунку культивировали в 96-луночном планшете с 1 мкг/мл соединения 1, соединения 2, соединения 4 и соединения 5, 0,01, 0,1, 1 мкг/мл соединения 3 (синтезированного и предоставленного Department of Chemistry, Ewha Womans University, Seoul, Korea) или 20 нг/мл IL-2. На 6-й день клетки инкубировали с 1 мкКи 3H-тимидина/лунку в течение 24 час. На 7-й день клетки собирали и рассчитывали индекс включения (далее везде "SI") с помощью математической формулы 1, приведенной ниже.
Математическая формула 1
SI=3H-тимидин, адсорбированный в лунках экспериментальной группы (СРМ в образце)/3H-тимидин, адсорбированный в лунках контрольной группы (СРМ в контроле).
В результате в группе, обработанной производными моноацетилдиацилглицерина, был повышенный SI Т-клеток с поглощением тимидина 2,05, который был сходен с индексом группы, обработанной IL-2 (табл.1).
| Таблица 1 |
| Экспериментальная группа |
SI |
| IL-2 (20 нг/мл)* |
2,05±0,24 |
| соединение 1 (1 мкг/мл)* |
2,01±0,43 |
| соединение 2 (1 мкг/мл)* |
2,03±0,54 |
| соединение 3 (0,01 мкг/мл)** |
1,83±0,32 |
| соединение 3 (0,1 мкг/мл)* |
1,96±0,18 |
| соединение 3 (1 мкг/мл)* |
2,05±0,64 |
| соединение 4 (1 мкг/мл)* |
1,98±0,26 |
| соединение 5 (1 мкг/мл)* |
2,02±0,38 |
| *Р<0,05, **Р<0,005. Каждый тест проводили в трех повторах и повторяли три раза. |
Экспериментальный пример 1-2. Влияние производных моноацетилдиацилглицерина на пролиферацию моноцитов
Моноциты получали из цельной крови человека, используя Histopaque 1077. И затем моноциты в количестве 5×106 клеток/мл оставляли на 3 часа в СО2-инкубаторе (5% CO2) для связывания с флаконом для тканевых культур. Через 3 часа несвязавшиеся клетки удаляли, а связавшиеся клетки помещали в 96-луночные планшеты в среду RPMI 1640 (Gibco, Grand Island, NY) с добавлением 10% FBS. Жизнеспособные клетки в количестве 5×104 штук/лунку культивировали в 96-луночных планшетах с 1 мкг/мл соединений 1-5. На 6-й день клетки инкубировали с 1 мкКи 3H-тимидина/лунку в течение 24 час. На 7-й день клетки собирали и измеряли включение 3H-тимидина. С помощью указанной выше математической формулы 1 рассчитывали SI. В результате группа, обработанная соединениями 1-5, имела повышенный по сравнению с контрольной группой SI моноцитов, равный 10,68 и указывающий на то, что соединения стимулировали пролиферацию моноцитов (табл.2).
| Таблица 2 |
| Группа, подвергнутая обработке |
SI(±S.E.) |
| Контрольная группа, не подвергнутая обработке |
1 |
| соединение 1 (1 мкг/мл)* |
9,97±0,10 |
| соединение 2 (1 мкг/мл)* |
10,42±0,15 |
| соединение 3 (1 мкг/мл)* |
10,68±0,13 |
| соединение 4 (1 мкг/мл)* |
10,21±0,18 |
| соединение 5 (1 мкг/мл)* |
9,75±0,09 |
| *Р<0,001. Каждый тест проводили в трех повторах и повторяли три раза. |
Экспериментальный пример 2. Влияние соединения 3 на активность Т-клеток
Экспериментальный пример 2-1. Измерение цитокина с помощью Elispot
Elispot bioassay (иммуноферментный анализ ESAT-6) является очень чувствительным количественным анализом для измерения цитокина, связанного с мембраной, так как дно каждой лунки планшетов Elispot, используемых в этом анализе, было покрыто специфическими антителами к цитокину. Таким образом, для измерения активности Т-клеток проводили анализ Elispot. Т-клетки в количестве 2×106 клеток на каждую лунку засевали в стерильный 24-луночный планшет для тканевых культур (Nunc, Denmark) с последующей обработкой различными концентрациями соединения 3 (0,01, 0,1, 1 мкг/мл) или IL-2 (20 нг/мл). На 7-й день клетки собирали, затем клетки сеяли в количестве 5×105 штук на мультитестовый планшет (Elispot system kit, AID, Straberg, Germany), покрытый соответствующим первичным антителом (мышиный IL-2). После того как планшет инкубировали в течение 24 час в CO2-инкубаторе (5% СО2), происходила секреция цитокинов клетками, которые захватывались первичными антителами (мышиный IL-2), определяемыми с помощью коммерческих наборов фирмы Elispot "mouse IL-2 Elispot kits" в соответствии с инструкцией фирмы-производителя. Каждый образец анализировали в двойных повторах. Подсчет клеток, продуцирующих IL-2, с помощью набора Elispot проводили на ридере Elispot (AID Elispot Reader System). Результаты показали, что группа, обработанная соединением 3, демонстрировала увеличение активности Т4 в 1,52 раза по сравнению с контрольной группой и увеличение активности Т8 в 1,46 раза (фиг.1).
Экспериментальный пример 2-2. Измерение цитокина с помощью Bio-plex
Bio-plex способен одновременно измерять огромное количество цитокина в лунке. Поэтому, для того чтобы количественно оценить 8 типов цитокинов Th1/Th2-каналов, которые секретируются при активации Т-клеток, применяли набор Bio-plex. Стерильные 24-луночные планшеты для тканевых культур (Nunc, Denmark) обрабатывали анти-CD3 и анти-CD28. Затем планшеты инокулировали Т-клетками в количестве 2×106 клеток/мл. Чтобы активировать Т-клетки, туда же вносили 0,1, 1 мкг/мл соединения 3 и затем культивировали в течение 5 дней. На 5-й день получали культуральные растворы на различных стадиях и затем центрифугировали. Полученные супернатанты и цитокин, секретированный в них, количественно оценивали с помощью набора Bio-plex в соответствии с инструкцией фирмы-производителя (Bio-rad). В результате в группе, получавшей соединением 3, секретировались три типа цитокинов (IL-2, IL-4 и IL-5) из 8 типов цитокинов (IL-2, IL-4, IL-5, IL-10, IL-12, INF- , GM-CSF, TNF- , GM-CSF, TNF- ), и их количество было выше, чем в контрольной группе, не обработанной соединением 3 (фиг.2). ), и их количество было выше, чем в контрольной группе, не обработанной соединением 3 (фиг.2).
Экспериментальный пример 3. Анализ пролиферации Т-клеток
Чтобы подтвердить влияние соединения 3 на иммуноциты пациентов со СПИДом, проводили следующий эксперимент. Сначала с помощью Hisopaque 1077 из периферической крови пациентов со СПИДом получали одноядерные клетки человека. Эритроциты удаляли с помощью хлорида аммония и затем пропускали через нейлоновую вату для удаления обломков и агрегатов. Т-клетки очищали с помощью магнитных шариков (антитело к CD3 человека) (MACS bead, Miltenyi Biotec, bergich gladbach, Germany). Суспензии Т-клеток суспендировали в среде Дюльбекко в модификации Искова (IMDM, Gibco, Grand Island, NY) с добавлением 10%-ной фетальной бычьей сыворотки (далее везде "FBS") (Gibco, Grand Island, NY). Жизнеспособные клетки в количестве 5×104 на лунку (в трех повторах) культивировали в 96-луночном планшете с 0,01, 0,1, 1 мкг/мл соединения 3 или IL-2 (20 нг/мл). На 6-й день клетки инкубировали с 1 мкКи 3H-тимидина/лунку в течение 24 час. На 7-й день клетки собирали и измеряли включение 3H-тимидина. Индекс стимуляции SI (Stimulation Index) рассчитывали с помощью указанной выше математической формулы 1. В результате у пациентов со СПИДом анализ пролиферации Т-клеток показал, что в группе, обработанной соединением 3, индекс стимуляции Т-клеток, измеренный с помощью включения тимидина, увеличился от 1,5 до 3,9 раза у всех пациентов (четыре из четырех) по сравнению с контролем, как видно из табл.3. В целом результат стимуляции соединением 3 был сравним со стимуляцией с помощью IL-2.
| Таблица 3 |
| |
Индекс стимуляции (SI) |
| 1 |
2 |
3 |
4 |
| IL-2 (20 нг/мл) |
1,41 |
4,17 |
1,29 |
6,54 |
| соединение 3 (1 мкг/мл) |
2,23 |
3,87 |
1,48 |
3,49 |
Экспериментальный пример 4. Влияние соединения 3 на экспрессию адгезивных молекул дендритных клеток
Экспериментальный пример 4-1. Культура дендритных клеток
Клетки костного мозга получали из бедра и большой берцовой кости мышей Balb/c AnN (Park, J. Et al. (2003) J. Korean Med. Sci., 18: 372-380). Клетки промывали три раза в RPMI и затем получали одноядерные клетки. Эти одноядерные клетки оставляли для связывания с флаконом для тканевых культур на 3 часа в RPMI и 10%-ной FBS. После инкубации прикрепившиеся клетки (моноциты) удаляли, а неприкрепившиеся клетки помещали в 100 миллиметровые чашки для тканевых культур в концентрации 1×105 клеток/мл в среде RPMI плюс 10%-ная FBS, дополненной 20 нг/мл мышиного rGM-CSF (R&D systems, Minneapolis, MN, USA), 10 нг/мл мышиного IL-4 (R&D systems) и 2,5 нг/мл мышиного TNF- (R&D systems). Культуральные чашки подпитывали каждые 3 дня. На 6-й день культивирования добавляли мышиный TNF- (R&D systems). Культуральные чашки подпитывали каждые 3 дня. На 6-й день культивирования добавляли мышиный TNF- (R&D systems). После этого мышиный TNF- (R&D systems). После этого мышиный TNF- (R&D systems) добавляли каждые 3 дня до 11-го дня. Созревшие дендритные клетки собирали для ПЦР-анализа в режиме реального времени для исследования адгезивных молекул. В результате, если круглые гранулоциты культивировали в течение трех дней, эти клетки формировали кластер, который рос на дне лунки планшета для клеточных культур, а созревшие дендритные клетки росли, образуя группу на 6-й или 7-й день культивирования. А на 9-й день культивирования, в частности, дендритные клетки формировали небольшие, но длинные выпячивания (фиг.3). (R&D systems) добавляли каждые 3 дня до 11-го дня. Созревшие дендритные клетки собирали для ПЦР-анализа в режиме реального времени для исследования адгезивных молекул. В результате, если круглые гранулоциты культивировали в течение трех дней, эти клетки формировали кластер, который рос на дне лунки планшета для клеточных культур, а созревшие дендритные клетки росли, образуя группу на 6-й или 7-й день культивирования. А на 9-й день культивирования, в частности, дендритные клетки формировали небольшие, но длинные выпячивания (фиг.3).
Экспериментальный пример 4-2. Определение фенотипа дендритных клеток
Подсчитывали те клетки, которые имели большие размеры и не окрашивались Трипановым синим, и исследовали морфологию каждой клетки. Клетки в количестве 1×106 клеток/мл культивировали и затем промывали, а затем фиксировали с помощью 1%-ного раствора параформальдегида. Проводили проточный цитометрический анализ фиксированных клеток с помощью FACScan (Beckton Dickinson, Mountain View, CA, U.S.A.), дающий определение фенотипа с помощью антител к следующим маркерам; изотипический контроль к IgG хомячка, крысиный IgG 2a, маркер DC: DEC 205(NLDC-145) и CD11C, молекула костимуляции/адгезии: CD 80(B7-1) и CD 86(B7-2), маркер макрофагов: CD14 и F4/80, маркер гранулоцитов: Gr-1 (Pharmingen, Hamburg, Germany). В результате уровни специфических молекулярных маркеров костимуляции CD80 и С86 и специфических маркеров дендритных клеток CD11С и DEC-205 были высокими. В противоположность этому уровни специфических маркеров моноцитов CD14 и F4/89 и специфического маркера гранулоцитов Gr-1 были понижены. Результат указывает на то, что выделенные в настоящем изобретении дендритные клетки имеют точный фенотип дендритных клеток и их чистота составляет 97-98% (фиг.4).
Экспериментальный пример 4-3. Обработка и экспрессия адгезивных молекул
Общеизвестно, что в стимуляцию различных кроветворных клеток и иммунных клеток вовлечены межклеточные взаимодействия. Поэтому авторы настоящего изобретения попытались подтвердить, влияет или нет соединение 3 на различные адгезивные молекулы указанных клеток. В частности, дендритные клетки, культивированные в примере, упомянутом выше, обрабатывали 1 мкг/мл соединения 3, а затем проводили ПЦР-анализ в режиме реального времени.
Для ПЦР-анализа в режиме реального времени применяли следующие праймеры: Icam-1 (SEQ. ID. No1 и No2), Icam-2 (SEQ. ID. No3 и No4), Vcam-1 (SEQ. ID. No5 и No6), VLA-4 (SEQ. ID. No7 и No8), VLA-5 (SEQ. ID. No9 и No10), LFA-1 (SEQ. ID. No11 и No12) и GAPDH (SEQ. ID. No13 и No14). Реакционные наборы, применяемые здесь, представляли собой смешанный раствор 2 мкл ДНК, 10-кратного буферного раствора, 1,5 мкл MgCl2, 2 мкл dNTPs, 0,5 мкл прямого праймера, 0,5 мл обратного праймера, 0,2 мкл полимеразы и 15,8 мкл дистиллированной воды.
Суммарную РНК, полученную из дендритных клеток и MS-5, клеток низкой плотности, культивированных с олиго(А)-праймером, обратно транскрибировали и проводили ПЦР-анализ при 94°С в течение 30 с, при 65°С в течение 30 с и при 72°С в течение 50 с. ПЦР-анализ проводили в итоге 34 раза, и количество ПЦР-продуктов каждый сеанс удваивалось. Экспрессию адгезивных молекул, таких как Vcam-1, Icam-1, Icam-2, VLA-4, VLA-5 и LFA-1, подтверждали с помощью ПЦР-анализа в режиме реального времени. Для количественной оценки проводили ПЦР-анализ GAPDH для подтверждения соответствующей кДНК. Результаты показали, что экспрессия адгезивных молекул, Icam-2, VLA-5, LFA-1 на дендритных клетках, обработанных соединением 3, значительно увеличивалась по сравнению с контролем (фиг.5).
Экспериментальный пример 5. Изучение противоракового эффекта соединения 3 с помощью подкожной инъекции (местная модель) и внутривенной инъекции (системная модель)
Экспериментальный пример 5-1. Модель билиарного рака у хомячков
Шестинедельные самки сирийского золотого хомячка (Harian, Indianapolis, India, USA) содержались в специальном блоке, свободном от патогена. Клетки KJBG-5 (5×105 штук) (Molecular therapy. Vol.3, No.4, pp431-437), суспендированные в 100 мкл среды RPMI 1640, не содержавшей сыворотки, вводили внутривенно через бедренную вену. И также клетки KJBG-5 (5×105 штук), суспендированные в 100 мкл среды RPMI 1640, не содержавшей сыворотки, вводили подкожно в бок хомячков. Хомячков, инъецированных KIBG-5, делили на следующие 7 групп;
1) Контрольная группа, обработанная средой RPMI,
2) Экспериментальная группа, обработанная немодифицированными клетками BMSC (2,5×106) (Leukemia & Lymphoma, Vol.44, No.11, pp 1973-1978),
3) Экспериментальная группа, обработанная клетками BMSC, модифицированными Ad/ Е1 50 MOI ((Leukemia&Lymphoma, Vol.44, No.11, pp 1973-1978), Е1 50 MOI ((Leukemia&Lymphoma, Vol.44, No.11, pp 1973-1978),
4) Экспериментальная группа, обработанная DC + лизатом опухоли (5×106),
5) Экспериментальная группа, обработанная клетками BMCS, модифицированными Ad/hIL-2 50 MOI (Leukemia&Lymphoma, Vol.44, No.11, pp 1973-1978),
6) Экспериментальная группа, обработанная клетками BMCS, модифицированными Ad/hIL-2 50 MOI + экспериментальная группа, обработанная соединением 3 (25 мг/кг/день),
7) Экспериментальная группа, обработанная соединением 3 (25 мг/кг/день).
Через одну неделю после инъекции раковых клеток (группа, обработанная BMSC), каждому хомячку вновь вводили 2,5×106 клеток BMSC. В группе, обработанной DC + лизатом опухоли, каждому хомячку вводили 5×106 клеток DC и лизат опухоли (с помощью подкожной инъекции или внутривенной инъекции) на первой, второй, третьей, четвертой, шестой, восьмой неделе с последующим наблюдением в течение 12 недель. В группе, обработанной соединением 3, за одну неделю до инъекции KIBG-5-клеток давали соединением 3 (25 мг/кг/день) с помощью перорального введения, которое продолжалось 2 недели с однонедельным перерывом в течение восьми недель.
В результате через 4 недели после инъекции раковых клеток опухоль образовалась в группе, обработанной RPMI, которая была контролем для группы, обработанной BMSC, и в группе, обработанной BMSC Ad/ E1, но опухоли не было обнаружено в группе, обработанной DC + лизатом опухоли, в группе, обработанной соединением 3, и в группе, обработанной BMSC+Ad/IL-2 (фиг.6). Более того, через 8 недель после инъекции раковых клеток множественные метастазные поражения легких были обнаружены в группе, обработанной RPMI, которая является контролем, в группе, обработанной BMSC+Ad/ E1, но опухоли не было обнаружено в группе, обработанной DC + лизатом опухоли, в группе, обработанной соединением 3, и в группе, обработанной BMSC+Ad/IL-2 (фиг.6). Более того, через 8 недель после инъекции раковых клеток множественные метастазные поражения легких были обнаружены в группе, обработанной RPMI, которая является контролем, в группе, обработанной BMSC+Ad/ E1, и только одно небольшое поражение легкого было обнаружено в группе, обработанной DC + лизатом опухоли, и в группе, обработанной соединением 3. Но не было обнаружено поражений в группе, обработанной BMSC+Ad/IL-2 (фиг.7, 8, 9). Кроме того, через 12 недель после подкожной инъекции раковых клеток опухоль образовалась в группе, обработанной RPMI, которая была контролем, в группе, обработанной BMSC, в группе, обработанной BMSC+Ad/ E1, и только одно небольшое поражение легкого было обнаружено в группе, обработанной DC + лизатом опухоли, и в группе, обработанной соединением 3. Но не было обнаружено поражений в группе, обработанной BMSC+Ad/IL-2 (фиг.7, 8, 9). Кроме того, через 12 недель после подкожной инъекции раковых клеток опухоль образовалась в группе, обработанной RPMI, которая была контролем, в группе, обработанной BMSC, в группе, обработанной BMSC+Ad/ Е1, в группе, обработанной BMSC+Ad/ Е1, в группе, обработанной BMSC+Ad/ E1, и в группе, обработанной DC + лизатом опухоли, и опухоль, имеющая размер менее 5 мм, была обнаружена у одной мыши в группе, обработанной BMSC+Ad/hIL-2, но в группе, обработанной BMSC+Ad/IL-2 + соединением 3, опухоли обнаружено не было (фиг.10). E1, и в группе, обработанной DC + лизатом опухоли, и опухоль, имеющая размер менее 5 мм, была обнаружена у одной мыши в группе, обработанной BMSC+Ad/hIL-2, но в группе, обработанной BMSC+Ad/IL-2 + соединением 3, опухоли обнаружено не было (фиг.10).
С другой стороны, шестинедельные самки сирийского золотого хомячка содержались в специальном блоке, свободном от патогена. Клетки KIBG-5 (5×105 штук), суспендированные в 100 мкл среды RPMI 1640, не содержавшей сыворотки, вводили внутривенно через бедренную вену. Хомячков делили на следующие 4 группы: 1) контрольная группа PBS, 2) группа, обработанная соединением 3 (10 мг/кг/день), 3) группа, обработанная соединением 3 (25 мг/кг/день), 4) группа, обработанная соединением 3 (50 мг/кг/день). За одну неделю до инъекции опухолевых клеток давали соединение 3 (10, 25 или 50 мг/кг/день) с помощью перорального введения, которое продолжалось 2 недели с однонедельным перерывом в течение 12 недель. Животных из каждой группы умерщвляли на 4-й, 8-й, 12-й неделе для патологического исследования. Макроскопические данные на 4-й неделе, опухоль развивалась в месте инъекции в контрольной группе. В группах, принимавших соединение 3 (10, 25 или 50 мг/кг/день), присутствия опухолей не наблюдалось. На 8-й неделе в контрольной группе наблюдали множественные метастазные поражения в обоих легких. В группе, принимавшей соединение 3 (25 или 50 мг/кг/день), невооруженным глазом не было обнаружено никаких метастазных поражений легких, но в группе, принимавшей соединение 3 (25 мг/кг/день), с помощью микроскопа было обнаружено одно незначительное поражение. В группе, принимавшей соединение 3 (10 мг/кг/день), в левом легком была обнаружена опухоль (фиг.11 и 12).
Экспериментальный пример 5-2. Меланомная модель на мышах (C57BL/6)
Шестинедельные самки мышей C57BL/6 (предоставлены Asan Institute for Life Sciences Animal La., Seoul, Korea) содержались в специальном блоке, свободном от патогена.
Клетки B16F10 (2×104 штук), суспендированные в 100 мкл среды RPMI 1640, не содержавшей сыворотки, вводили внутривенно через хвостовую вену. За неделю до инъекции опухолевых клеток воздействию были подвергнуты следующие три группы.
1) Контрольная группа, обработанная средой RPMI,
2) Группа, обработанная дендритными клетками (DC) (5×105 клеток/день) + лизатом опухоли,
3) Группа, обработанная соединением 3 (50 мг/кг/день).
В случае группы, обработанной DC + лизатом опухоли, за одну неделю перед инъекцией меланомы 5×105 клеток DC, смешанных с лизатом опухоли, вводили инъекцией в брюшную полость и продолжали вводить каждую неделю. В случае группы, получавшей соединение 3, каждой мыши вводили 50 мг/кг/день соединения 3. За неделю до инъекции меланомы (B16F10) вводили перорально соединение 3 (50 мг/кг/день) и продолжали вводить 2 недели с однонедельным перерывом в течение 6 недель. В результате макроскопические наблюдения контрольной группы на 4-й недели показали множественные метастазные поражения в обоих легких. Группа, обработанная соединением 3, и группа, которой вводили DC + лизат опухоли, демонстрировали отсутствие признаков заболевания в легких (фиг.13, 14) и показали 90%-ный уровень выживаемости при наблюдении в течение 6 недель после инъекции меланомы (B16F10) (фиг.15).
Основываясь на предположении, что противораковые эффекты соединения 3 объясняются активацией Т-клеток соединением 3, изучали цитотоксичность Т-клеток, активированных соединением 3, по отношению к клеткам злокачественной меланомы. В результате, если отношение Т-клеток, активированных соединением 3, к клеткам меланомы составляло 100:1, цитотоксичность повышалась на 42% (фиг.16).
Экспериментальный пример 6. Тест на токсичность соединения 3
Синтезированное соединение 3 растворяли в 5%-ном растворе этанола, который вводили перорально в дозировке 0,1 мл/20 г. Контрольной группе вводили 5%-ный раствор этанола. В качестве тестируемых животных использовали мышей IRC, помещенных в приспособление SPF. Перед введением лекарственного средства мышей не кормили в течение одного дня, обеспечивали им свободный доступ к воде и кормили после введения препаратов. Создавали группы от восьми до десяти мышей ICR весом 25-35 г. Тестируемое вещество вводили перорально однократно в увеличивающихся дозировках от 62,5 мг/кг, 125 мг/кг, 250 мг/кг, 500 мг/кг, 1,0 г/кг до 2,0 г/кг. Со дня введения препаратов невооруженным взглядом наблюдали за количеством выживших животных и фиксировали любые указания на аномалии в течение 14 дней. LD50 рассчитывали с помощью метода Lichfield-Wilcoxon ( - acute toxicity test. Realize Inc., Tokyo, 1988), а изменения веса рассчитывали с помощью математической формулы 2, приведенной ниже. - acute toxicity test. Realize Inc., Tokyo, 1988), а изменения веса рассчитывали с помощью математической формулы 2, приведенной ниже.
Математическая формула 2
Скорость прироста веса (%) = (Вес на 14-й день - Вес в начале исследования)÷(Вес в начале исследования)×100
Результаты приведены в табл.4. Токсичность отсутствовала при введении 62,5 мг/кг-2 г/кг соединения 3. Это наблюдение указывает на то, что LD50 была выше, чем 2 г/кг. При наблюдении невооруженным взглядом в течение 14 дней после введения любые указания на аномалии отсутствовали. Вес животных в группе, которой вводили соединение 3, постоянно увеличивался так же, как у контрольных животных. Как показано в табл.5, не наблюдали изменения веса (повышения или снижения), вызванного введением соединения 3.
Таблица 4
Уровень смертности при введении соединения 3 (%) |
| Дозировка соединения 3 (мг/кг) |
0 |
62,5 |
125 |
250 |
500 |
1000 |
2000 |
| Число погибших мышей/число мышей, принимавших препарат перорально |
0/10 |
1/8 |
0/8 |
1/8 |
2/9 |
0/9 |
0/9 |
| LD50 |
0 |
12,5 |
30 |
12,5 |
22,2 |
0 |
0 |
| Таблица 5 |
| Повышение веса через 14 дней после перорального введения соединения 3 |
| Дозировка соединения 3 (мг/кг) |
0 |
62,5 |
125 |
250 |
500 |
1000 |
2000 |
| Вес через 14 дней после введения препарата (г) |
38,7±1,1 |
34,3±0,1 |
38,1±1,3 |
35,6±1,4 |
36,5±1,9 |
35,5±1,1 |
35,9±2,7 |
| Скорость прироста веса (%) |
16,9 |
11,9 |
17,3 |
11,2 |
10,1 |
9,5 |
14,4 |
Долгосрочный тест на гепатотоксичность проводили на крысах при дозировке соединения 3 100 мг/кг веса тела/день, вводимого перорально в течение 4 недель, и следили за тестом на функции печени, за липидным профилем, активностью цитохрома С-450. В конце 4-й недели проводили гистологические исследования печени. Существенных неблагоприятных эффектов обнаружено не было.
Экспериментальный пример 7. Тест CLP (цекальное лигирование и пункция)
Тест CLP проводили для подтверждения влияния соединения 3 на предупреждение или лечение септического шока. Самцов инбредной линии мышей С3Н/HeN в возрасте 7-10 недель (весом 20-25 г) разделяли на группы. После того как мышам вводили соединение 3 в количестве 50 мг/кг/день в течение 2 недель с перерывом в 1 неделю, мышей анестезировали с помощью кетамина (80 мг/кг) и ромпуна (16 мг/кг). С помощью модели CLP у анестезированных мышей индуцировали септический шок. Через час после индукции септического шока вводили 50 мг/кг соединения 3 и затем такое же воздействие продолжали в течение 3 дней каждые 24 часа. Контрольной группе вводили перорально PBS+5%-ный раствор этанола. Уровень выживаемости группы, получавшей соединение 3, и контрольной группы после различных временных промежутков показан в табл.6. Группы, получавшие соединение 3, демонстрировали уровень выживаемости в 100% даже после 120 часов.
Таблица 6
Уровень выживаемости при септическом шоке |
| Уровень выживаемости после различных временных промежутков |
0 час Уровень выживаемости |
24 час Уровень выживаемости |
48 час Уровень выживаемости |
72 час Уровень выживаемости |
96 час Уровень выживаемости |
120 час Уровень выживаемости |
| Группа, обработанная PBS (контроль) |
100% |
60% |
40% |
40% |
40% |
40% |
| соединение 3 (50 мг/кг) |
100% |
100% |
100% |
100% |
100% |
100% |
Производственный пример 1. Получение лекарственных ресурсов, содержащих в качестве эффективного ингредиента соединение 3
После того как в экспериментах, указанных выше, было подтверждено, что соединение 3 обладает превосходной иммуномодулирующей и противораковой активностью, авторы настоящего изобретения получили лекарственное средство, содержащее соединение 3 в качестве эффективного ингредиента. Кроме того, следующий производственный пример лекарственного средства, содержащего соединение 3 в качестве эффективного ингредиента, может быть применен не только для получения лекарственного средства, но также для получения здоровой пищи. Если специально не указано, в производственном примере символ % означает вес.%.
Производственный пример 1-1. Изготовление мягких желатиновых капсул
Производственный пример 1-1-1
| Соединение 3 |
30% |
| Витамин С |
4,5% |
| Витамин D3 |
0,001% |
| Сульфат магния |
0,1% |
| Воск |
10% |
| Пальмовое масло |
25% |
| Сафлоровое масло (Carthamus tinctorius) |
30,399% |
Производственный пример 1-1-2
| Соединение 3 |
31,25% |
| Масло семян энотеры |
59,75% |
| Соевое масло |
6,7% |
Уксусный эфир витамина Е (DL- -токоферолацетат) -токоферолацетат) |
2,1% |
| Соевый лецитин |
0,2% |
Производственный пример 1-1-3
Уксусный эфир витамина Е (DL- -токоферолацетат) 2,0% -токоферолацетат) 2,0%
Производственный пример 1-2. Изготовление таблеток
| Соединение 3 |
30% |
| Витамин С |
10% |
| Витамин D3 |
0,001% |
| Сульфат магния |
0,1% |
| Кристаллическая целлюлоза |
25,0% |
| Лактоза |
32,999% |
| Стеарат магния |
2% |
Производственный пример 1-3. Изготовление композиции для инъекций
| Соединение 3 |
2% |
| Пропиленгликоль |
35% |
| Моноглицерид |
8% |
| Этанол |
5% |
| Вода |
50% |
Композицию для инъекций получали общепринятым методом с применением указанных выше композиций и их состава.
Производственный пример 2. Получение лекарственных ресурсов, содержащих соединения 1, 2, 4 и 5 в качестве эффективных ингредиентов
Мягкие желатиновые капсулы, таблетки и суспензии для инъекций изготавливали тем же способом и в том же составе, как описано в указанном выше производственном примере 1, за исключением того, что соединение 3 заменяли на соединение 1, 2, 4 и 5 в том же соотношении.
Производственный пример 3. Изготовление здоровой пищи, содержащей соединение 3 в качестве эффективного ингредиента
После того как в Примерах, указанных выше, было подтверждено, что соединение 3 обладает превосходной иммуномодулирующей активностью, активностью против септического шока и противораковой активностью, авторы настоящего изобретения получили здоровую пищу, содержащую соединение 3 в качестве эффективного ингредиента.
Производственный пример 3-1. Изготовление напитков
| Мед |
522 мг |
| Амид липоевой кислоты |
5 мг |
| Никотинамид |
10 мг |
| Натриевая соль рибофлавина гидрохлорида |
3 мг |
| Пиридоксин гидрохлорид |
2 мг |
| Инозитол |
30 мг |
| Ортокислота |
50 мг |
| Соединение 3 |
0,48-1,28 мг |
| Вода |
200 мл |
Напиток получали на основе указанных выше композиций и их состава общепринятым методом.
Производственный пример 3-2. Изготовление жевательной резинки
| Основа резинки |
20% |
| Сахар |
76,36% |
| Соединение 3 |
0,24-0,64% |
| Фруктовый ароматизатор |
1% |
| Вода |
2% |
Жевательную резинку изготавливали на основе указанных выше композиций и их состава общепринятым методом.
Производственный пример 3-3. Изготовление конфет
| Сахар |
50-60% |
| Крахмальный сироп |
39,26-49,66% |
| Соединение 3 |
0,24-0,64% |
| Апельсиновый ароматизатор |
0,1% |
Конфеты изготавливали на основе указанных выше композиций и их состава общепринятым методом.
Производственный пример 3-4. Изготовление бисквита
| Мука твердых сортов 1-го класса |
88 кг |
| Мука для кексов 1-го класса |
76,4 кг |
| Рафинированный сахар |
16,5 кг |
| Соль |
2,5 кг |
| Глюкоза |
2,7 кг |
| Пальмовый жир |
40,5 кг |
| Аммоний |
5,3 кг |
| Пищевая сода |
0,6 кг |
| Гидросульфат натрия |
0,55 кг |
| Рисовая мука |
5,0 кг |
| Витамин В1 |
0,003 кг |
| Витамин В2 |
0,003 кг |
| Молочный ароматизатор |
0,16 кг |
| Вода |
71,1 кг |
| Сухое цельное молоко |
4 кг |
| Заменитель сухого молока |
1 кг |
| Фосфат кальция одноосновный |
0,1 кг |
| Аэрозольная соль |
1 кг |
| Аэрозольное молоко |
25 кг |
| Соединение 3 |
0,2-0,5 кг |
Бисквит изготавливали на основе указанных выше композиций и их состава общепринятым методом.
Производственный пример 3-5. Изготовление мороженого
| Молочный жир |
10,0% |
| Сухое вещество молока, не содержащее жира |
10,8% |
| Сахар |
12,0% |
| Крахмальный сироп |
3,0% |
| Эмульгирующий стабилизатор (взбитый) |
0,5% |
| Ароматизатор (клубника) |
0,15% |
| Вода |
63,31-62,91% |
| Соединение 3 |
0,24-0,64% |
Мороженое изготавливали на основе указанных выше композиций и их состава общепринятым методом.
Производственный пример 3-6. Изготовление шоколада
| Сахар |
34,36-34,76% |
| Масло какао |
34% |
| Кокосовое волокно |
15% |
| Кокосовый порошок |
15% |
| Лецитин |
0,5% |
| Ванильный ароматизатор |
0,5% |
| Соединение 3 |
0,24-0,64% |
Шоколад изготавливали на основе указанных выше композиций и их состава общепринятым методом.
Производственный пример 4. Изготовление здоровой пищи, содержащей соединения 1, 2, 4 и 5 в качестве эффективного ингредиента
Напиток, жевательную резинку, конфеты, бисквит, мороженое и шоколад изготавливали тем же способом и в том же составе, как описано в указанном выше производственном примере 1, за исключением того, что соединение 3 заменяли на соединение 1, 2, 4 и 5 в том же соотношении.
Преимущества заявленного изобретения
Как было объяснено ранее, производные моноацетилдиацилглицерина, содержащие соединение 3, демонстрируют значительный эффект на иммуномодуляцию, включая повышение иммунитета. При индукции рака у хомячков с помощью инъекции раковой клеточной линии развитие рака задерживалось через активацию лимфоцитов, моноцитов и дендритных клеток, которые являются важными факторами для активизации иммунитета, и апоптоз раковой клетки индуцировался усилением цитотоксичности иммунной клетки по отношению к раковой клетке. Также при индукции септического шока у мышей продемонстрирован 100%-ный уровень выживаемости даже через 120 часов, достигаемый контролем иммунитета и подавляющим эффектом апоптоза. Следовательно, производные моноацетилдиацилглицерина в соответствии с настоящим изобретением могут эффективно применяться как иммуномодулирующее средство, средство для лечения сепсиса и рака и как здоровая пища для иммуномодуляции или предупреждения рака.
Формула изобретения
1. Средство для лечения аутоиммунного заболевания, подавляющее нарушение клеток в результате аутоиммунной реакции, содержащее производное моноацетилдиацилглицерина, представленное формулой 1, в качестве эффективного активного ингредиента
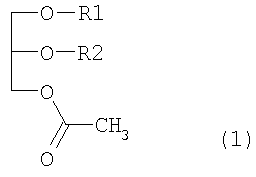
где R1/R2 является 9-октадеценоил(олеоил)/(гексадеканоил(пальмитоил), гексадеканоил(пальмитоил)/(9-октадеценоил(олеоил), гексадеканоил(пальмитоил)/9,12-октадекадиеноил(линолеоил), гексадеканоил(пальмитоил)/9,12,15-октадекатриеноил(линоленоил) или гексадеканоил(пальмитоил)/5,8,11,14-эйкозатетраеноил(арахидоноил).
2. Средство по п.1, в котором производные моноацетилдиацилглицерина, представленные формулой 1, являются моноацетилдиацилглицерином, представленным формулой 2, приведенной ниже
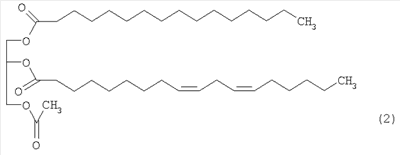
3. Средство по п.1, в котором производные моноацетилдиацилглицерина стимулируют в Т-клетках секрецию цитокинов, выбранных из группы, включающей IL-2, IL-4 и IL-5.
4. Средство по п.1, в котором производные моноацетилдиацилглицерина стимулируют секрецию IL-4 и пролиферацию и активацию как Т4-, так и Т8-клеток.
5. Средство по п.1, в котором производные моноацетилдиацилглицерина составляют от 20 до 100 вес.% от общего веса иммуномодулирующего средства.
6. Лекарственное средство от сепсиса, содержащее в качестве эффективного активного ингредиента производные моноацетилдиацилглицерина, представленные формулой 1

в которой, R1/R2 является октадеценоил(олеоил)/(гексадеканоил(пальмитоил), гексадеканоил(пальмитоил)/(9-октадеценоил(олеоил), гексадеканоил(пальмитоил)/9,12-октадекадиеноил(линолеоил), гексадеканоил(пальмитоил)/9,12,15-октадекатриеноил(линоленоил) или гексадеканоил(пальмитоил)/5,8,11,14-эйкозатетраеноил(арахидоноил).
7. Противораковое средство, содержащее в качестве эффективного активного ингредиента производные моноацетилдиацилглицерина, представленные формулой 1

в которой, R1/R2 является 9-октадеценоил(олеоил)/(гексадеканоил(пальмитоил), гексадеканоил(пальмитоил)/(9-октадеценоил(олеоил), гексадеканоил(пальмитоил)/9,12-октадекадиеноил(линолеоил), гексадеканоил(пальмитоил)/9,12,15-октадекатриеноил(линоленоил) или гексадеканоил(пальмитоил)/5,8,11,14-эйкозатетраеноил(арахидоноил).
8. Противораковое средство по п.7, которое применяют для лечения рака желчных протоков, рака почек или злокачественной меланомы.
9. Противораковое средство по п.7, которое активирует дендритные клетки, которые дают возможность Т-клеткам узнавать антиген раковых клеток.
10. Здоровая пища для предотвращения рака или аутоиммунного заболевания, содержащая в качестве эффективного активного ингредиента производные моноацетилдиацилглицерина, представленные формулой 1

в которой, R1/R2 является 9-октадеценоил(олеоил)/(гексадеканоил(пальмитоил), гексадеканоил(пальмитоил)/(9-октадеценоил(олеоил), гексадеканоил(пальмитоил)/9,12-октадекадиеноил(линолеоил), гексадеканоил(пальмитоил)/9,12,15-октадекатриеноил(линоленоил) или гексадеканоил(пальмитоил)/5,8,11,14-эйкозатетраеноил(арахидоноил).
11. Здоровая пища по п.10, в которой производные моноацетилдиацилглицерина составляют от 0,02 до 100 вес.% от общего веса этой пищи.
Приоритет по пунктам:
21.12.2004 - пп.1-6, 10-11;
24.04.2004 - пп.7-9.
|