
СПИСОК ПАТЕНТОВ С УПОМИНАНИЕМ ГИАЛУРОНОВОЙ КИСЛОТЫ
-
- 2017751 Способ получения гиалурона
- 2192150 БАД для профилактики йодной недостаточности
- 2112542 Препарат для лечения патологий соединительных тканей
- 2225206 Препарат для лечения рака молочной железы
- 2299733 Лечение опорно-двигательного аппарата
- 2299732 Способ лечения глаукомы
- 2299726 Противоинфекционная губная помада
- 2299725 Косметическое средство для ухода за кожей
- 2198878 Ароматическое соединение
- 2198702 Способ подготовки трофических язв к аутодермапластике
- 2198653 Вагинальные суппозитории
- 2197946 Композиция для ухода за волосами
- 2197923 Фармацевтическая композиция для лечения отеков роговицы
- 2298410 Биотрансплантант и способ лечения ревматических и аутоиммунных заболеваний
- 2197501 Фотоотверженный гель на основе сшитой гиалуроновой кислоты
- 2197228 Твердые лекарственные формы
- 2197222 Водная компазиция для ухода за волосами, лица и тела
- 2297425 Полипептиды
- 2297240 Композиция с гиалуроновой кислотой
- 2297230 Фармацевтическая компазиция с ксантоновой смолой
- 2196588 Глазные капли
- 2195955 Применение биологически активных веществ
- 2195926 Дерматологические композиции
- 2295954 Микрочастицы для доставки нуклеиновых кислот
- 2295951 Косметика для ухода за кожей лица и век
- 2195262 Фармакологическое средство на основе гиалуроновой кислоты
- 2194512 Способ профилактики и коррекции процесса старения кожи
- 2194478 Лечение экземы
- 2294716 Расширяемый стент
- 2194055 Сшитые сополимеры
- 2099350 Ассоциаты депротонированной гиалуроновой кислоты
- 2293557 Средство для лечения кожи и слизистых
- 2292878 Приготовление микроцастиц, содержащих метопропол
- 2292746 БАД
- 2192256 Защита кишечника
- 2191782 Получение модифицированной гиалуроновой кислоты
- 2292219 Паратиреоидный гормон человека
- 2291686 Микроцастицы
- 2191000 Косметическая маска
- 2290921 Фармацевтические и косметические средства против старения кожи
- 2290900 Модифицированный биоматериал для использования в офтальмологии
- 2290899 Получение биоматерьяла
- 2290397 Новые инданилиденовые соединения
- 2290186 Лечение сирингомиелии
- 2288702 Иррингационный раствор для офтальмологии
- 2288699 Гель для лечения стоматологических заболеваний
- 2188011 Активирующая остеогенез фармацевтическая композиция
- 2187327 Средство с антисептиком
- 2187325 Средство с радиопротекторным действием
- 2287330 Композиции миноксидила
- 2186786 Способ получения гиалуроновой кислоты
- 2186593 Лечение раненого процесса кожи
- 2286801 Очищение воды
- 2286781 Лечение ожогов пищевода у детей
- 2286764 Средство лечения воспалений полости рта
- 2185840 Лечение инфекционных заболеваний
- 2286151 Альфа-2-Дельта-Лиганда
- 2185149 Ранозаживляющий гель
- 2285527 Лечение ИЛ-6 заболеваний
- 2184448 Раствор хранения роговицы, включающий гиалуроновую кислоту
- 2090179 Крем для кожи
- 2183961 Способ лечения кожи
- 2284331 Соли алифотических аминов
- 2284187 Производные амида
- 2089191 Снизить внутрение давление
- 2283320 Получение гликозаминогликанов
- 2283129 Лечение опухолей
- 2283098 Косметические средства с Q
- 2182574 Ароматические соединения
- 2088257 Средство с гипохолестеролемическим действием
- 2088218 Состав для гигиенических салфеток
- 2088206 Способ получения препарата, создающего исскуственный загар
- 2282462 Противомикробные средства
- 2182008 Интровагинальная компазиция
- 2181999 Препарат с отсроченным высвобождением
- 2181998 Новые композиции липидов
- 2181995 Лечение болевого синдрома
- 2181295 Вирионная вакцина
- 2087144 Витамин Е
- 2379336 Способ стирки
- 2379052 Вакцинация
- 2180855Композиция в виде ионного комплекса
- 2379025 Противоинфекционный гель
- 2180825 Лечение травм роговицы
- 2281082 Способ коррекции эстетических и возрастных проблем кожи
- 2180576 Биоактивная добавка для косметических средств
- 2280459 Средство для изменения скорости роста или репродукции клеток
- 2179981 Соли переходного металла
- 2378010 Жидкие вакцины
- 2378008 Комбинированные вакцины
- 2378007 Анаболическое средство
- 2377973 Растительные экстракты
- 2280041 Способ получения водорастворимых комплексов гиалурил
- 2280038 Биополимеры
- 2323733 Йодный обмен
- 2377260 Гель
- 2178693 Противовирусное средство на основе гиалуроновой кислоты
- 2178692 Облегчающие зуд косметическое средство
- 2377022 Гемостатические спреи
- 2376982 Увлажняющая сыворотка для лица
- 2376974 Трансдермальный гель для лица
- 2362784 Гипо-и гиперацетилированные менингокковые капсульные сахариды
- 2177789 Устройство для доставки лекарства к шейке матки
- 2277954 Крем для лица омолаживающий
- 2376378 Способ получения метионина
- 2177332 Биоматериал для предотвращения послеоперационных спаек, с производной гиалуроновой кислотой
- 2177310 Способ получения таблеток
- 2376011 Средство для позвоночника
- 2277410 Косметическое средство
- 2323748 Медицинская повязка
- 2276998 Гидрогелевые композиции
- 2082416 Способ получения препарата с коллагенном из животного сырья
- 2375081 Адсорбирующее изделие
- 2375049 Охлаждающий пластырь
- 2346049 Способ получения гиалурона
- 2275913 Фармацевтические средства
- 2174985 Полисахарид с антиоксидантом
- 2373957 Носитель для лекарственных средств и биологически активных веществ
- 2373941 Способ коррекции возрастных и патологических изменений кожных покров
- 2174845 Композиции и способы доставки генетического материала
- 2174830 Средство для укрепления волос
- 2373769 Синбиотическая композиция
- 2274472 Лечение апорно-двигательного аппарата и болевых синдромов
- 2372929 Профилактическая композиция на основе веществ фенольной природы в липосомной форме
- 2173563 Способ нанесения на поверхность предметов покрытия на основе гиалуроновой кислоты, её производных и полусинтетических полимеров
- 2079304 фармацевтическая композиция, обладающая иммуносупрессорной и антимикробной активностью
- 2273645 Полипептид ожирения
- 2173154 Фракция кератансульфатолигосахаридов и содержащий ее фармацевтический препарат
- 2173136 Грязная мазь
- 2173128 Способ хирургического лечения центральных разрывов сечатки
- 2078561 Косметическое средство предотвращающее старение кожи
- 2172490 Способ прогнозирования воспалительных заболеваний молочной железы при эндопластике
- 2272645 Способ лечения ЦМВ-Инфекции у детей раннего возроста
- 2272636 Фармацевтическая композиция для местного лечения воспаления
- 2272635 Фармацевтически активная субстанция для офтальмологии
- 2272599 Биоматерьял для стабилизации прогрессирующей миопии "Коллаплант"
- 2172168 Средство для заживления ран на основе гиалуроновой кислоты
- 2371172 Фармацевтическая композиция для лечения нервной системы на основе стефаглабрина
- 2171470 Способ прогнозирования послеоперационной трансформации доброкачественных опухолей нервной системы
- 2077317 Состав для ванн
- 2271213 Комбинированные композиции, содержащие экстракты из растений и морских животных
- 2076872 Способ получения окрашенной гиалуроновой кислоты
- 2076671 Раствор для защиты роговицы
- 2370281 Конъюгаты гидроксиалкилкрахмал
- 2370275 Способ лечения (коррекции) косметических и возрастных дефектов кожи
- 2370258 Фармацевтическая композиция для парентальной доставки в форме лиофилизата
- 2270023 Способ экстракции и очистки протеогликана хрящего типа (варианты)
- 2369408 Гемостатическая композиция, включающая гиалуроновую кислоту
- 2369387 Фармацевтическая композиция для лечения нервной системы
- 2369379 Нетаблитированные жевательные формы для индивидуального введения
- 2169136 Производное коричной кислоты
- 70792 Медицинский аппликатор
- 20741717 Способ стабилизации аскорбиновой кислоты
- 2074712 Способ получения препарата, препятствующего преждевременной эякуляции
- 2367954 Способ прогнозирования развития кожной патологии у женщин с синдромом склерополикистозных яичников (СПКЯ)
- 2268075 Устройство для электрокинетической доставки
- 2268052 Средство для лечения воспалительных и дегенеративных заболеваний суставов
- 2167649 Способ получения твердой дисперсии умеренного водорастворимого лекарственного вещества
- 2167647 Гель для бритья
- 2073520 Лечение урологических инфекций
- 2367476 Биопластический материал
- 2367475 Мембрана для использования при направленной регенерации тканей
- 2367469 Фармацевтическая композиция на основе лизоамидазы
- 2367456 Фармацевтическая композиция обладающая антибактериальным и некролитическим действием
- 2367455 Фармацевтическая композиция обладающая некролитическим и антибактериальным действием
- 2267324 Применение антиадгезивных углеводов, препарат для уменьшения и /или блокирования адгезии патогенных веществ
- 2166934 Композиции включающие биологический агент
- 2166510 Псевдодипептиды
- 2366460 Композиции, имеющие высокую противовирусную и антибактериальную активность
- 2360901 Производные феноксиуксусной кислоты
- 2165749 Способ восстановления эндотелия роговицы
- 2265441 Способ укрепления склеры
- 2365382 Композиции и способы для регуляции развития сосудов
- 2070879 Соли гликозаминогликанов
- 2164914 Циклические и гетероциклические N - замещенные - иминогидроксамовые карбоновые кислоты
- 2264627 Хламидийный конъюктивит
- 2364399 Фармацевтический препарат на основе стефаглабрина
- 2264230 Препарат с замедленным высвобождением активного вещества
- 2363497 Фармацевтические композиции
- 2363496 Способ увеличения объема мягких тканей
- 2363473 Способ антифлогистической активации в эксперементе
- 2363461 Фармацевтический препарат на основе сигетина
- 2363459 Средства для введения в роговицу глаз для предотвращения офтальмологических нарушений
- 2363448 Фармацевтические композиции
- 2163123 Глазные капли
- 2162687 Усовершенствованнная лекарственная форма индуктора интерферана
- 2162343 Биосовместимый полимерный материал и способ его получения
- 2162327 Лечение рака
- 2067841 Способ получения ароматизатора
- 2161478 Способ консервированого лечения гонартроза
- 2361617 Вольфрамовые частицы в качестве рентгеноконтрастных веществ
- 2361552 Способы и устройства для дренирования жидкостей и понижения внутриглазного давления
- 2066996 Способ изготовления пленочного материала для офтальмохирургии
- 2361417 Корм с глюкозамином и экстрактом ивы для профилактики артроза у животных
- 2161002 Пищевой общеукрепляющий лечебно-профилактический продукт из хрящевой ткани акул
- 2360928 Комплексная матрица для медико-биологического применения
- 2160574 Способ лечения глаукомы
- 2360688 Способ лечения повреждений переферических нервов
- 2360670 Фармацевтическая композиция при климактерических расстройствах
- 2360646 Эндолюминальный протез
- 2260445 Способ усовершенствования транспортировки через легко прспосабливаемый полупроницаемый барьер
- 2260007 Производные амида
- 2359975 Способ получения модифицированных арабиногалактанов
- 2359974 Антигенные Пептиды
- 2159775 Псевдопептидный продукт
- 2259833 Фармацевтическая композиция для лечения роговицы глаза
- 2259816 Ранозаживляющее средство
- 2259815 Способ коррекции возрастных изменений, связанных с процессами старения кожи
- 2359706 Способ сохранения офтальмологических растворов
- 2359704 Антисептическое средство
- 2359662 Микрокапсулы
- 2159253 Катионные полимеры
- 2159111 Средство для ухода за кожей лица
- 2159105 Композиция для защиты кожи от опасных химических веществ Получение
- 2158593 Биосовместимый водный раствор
- 2358728 Способ лечения и предупреждения потери костной ткани
- 2258517 Способ хирургического лечения травмотических повреждений селезенки пленкой на основе гиалуроновой кислоты
- 2357968 Кристалические формы производной имидазола
- 2357957 Ингибиторы P38 и их применение
- 2157647 Пищевая добавка и ее получение
- 2357758 Препараты для чрескожной и чересслизистой добавки
- 2063244 Способ стабилизации растворов
- 2063140 Способ получения препарата для консервирования мяса
- 2157381 Способ получения гиалуроновой кислоты
- 2257198 Композиции микроцастиц
- 2356909 Белковый комплекс
- 2356570 Косметическая композиция
- 2256434 Способ закрытия перфорации барабанной перепонки
- 2356520 Способ лечения постконтузионного повреждения сечатки глаза
- 2156133 Гель
- 2255945 Полимерная композиция
- 2355761 Средства повторной дифференцировки
- 2061043 Способ повышения устойчивости урокиназы к нагреванию
- 2061005 Способ получения красителей для гистологических исследований
- 2355420 Зубная паста
- 2355385 Композиции пролонгированного действия с контролируемым высвобождением
- 2355240 Способ получения пищевого препарата хондропротекторного действия
- 2155057 Пихтово репейный бальзам
- 2354409 Способ производства высвобождающих лекарственные средчтва медицинских устройств
- 2254145 Раневое покрытие на основе коллаген-хитозанового комплекса
- 2254133 Лечение и профилактика ВИЧ-инфекции у человека
- 2253439 Фармацевтическая композиция для защиты и улучшения оптических свойств роговици при проведении эндовитреальных вмешательств
- 2253437 Способ омоложения кожи
- 2153352 Фармацевтическая композиция обладающая ранозаживляющим и противовоспалительным действием
- 2353354 Фармацевтический препарат на основе низкомолекулярного индуктора интерферона
- 2252787 Способ получения искусственной матрицы кожи
- 2252767 Способ нормализации иммунобиохимического гомеостаза коров в предродовом и послеродовом периодах
- 2352583 Фармацевтическая композиция содержащая Fc-область иммуноглобулина в качестве носителя
- 2152403 Модифицированные полисахариды
- 2352356 Иммуногенная композиция
- 2352342 Исскусственный физиологический солевый раствор Способ его получения
- 2352330 Фармацевтический препарат на основе низкомолекулярного индуктора интерферона
- 2352323 Фармацевтический препарат с модифицированным высвобождением
- 2152027 Способ подготовки ткани мозга для определения гликозаминогликанов
- 2251842 Интектицидный состав для борьбы с личинками оводов
- 2151580 Способ активации пролиферации эндотелия роговицы
- 2351648 Дифференцировка стромальных клеток, полученных из жировой ткани, в эндокринные клетки поджелудочной железы и их использование
- 2351595 N - гидроксиформамидные соединения в качестве ингибиторов металлопротеина
- 2251411 Косметическое средство в лиофилизированной фармацевтической форме
- 2251405 Косметика...ее композиции для косметических препаратов
- 2251367 Средство со сшитой гиалуроновой кислотой для наращивания тканей
- 2351359 Косметика для профилактики и лечения избыточной массы тела
- 2351322 Препарат на основе низкомолекулярного индуктора интерферона
- 2351153 Диета при остеортрите собак
- 2350958 Способ определения групповой принадлежности синовальной жидкости
- 2350625 Производные гиалуроновой кислоты с пониженной биодеградируемостью
- 2150266 Крем после бритья
- 2350354 Фармацевтическое средство содержащие антагонист и фактор некроза
- 2350340 Способ коррекции процессов регенерации
- 2350309 Способ лечения избыточной массы тела с помощью рефлексотерапии
- 2250047 Профилактический продукт из хрящевой ткани гидробионтов
- 2249467 Медицинский матерьял и изделия на его основе
- 2055079 Способ получения препарата гиалуроновой кислоты
- 2349599 Биоадгезив мидии
- 2054903 Способ лечения коллагеноза у бычков на откорме
- 2249210 Способ прогнозирования предрасположенности к развитию и тяжести течения деформирующего остеоартроза коленного сустава у взрослых
- 2349339 Средство для соединительной ткани
- 2148988 Человеческий интерферона
- 2148399 Лечение атеросклероза
- 2148396 Способ определения активного вещества в дифильных мазевых основах
- 2148375 Способ диагностики близорукости
- 2348415 Способ противоспаечной терапии после хирургического вмешательства
- 2348400 Препарат на основе низкомолекулярного индуктора интерферона
- 2348386 Способ непроникающего хирургического лечения первичной открытоугольной глаукомы
- 2248213 Лечение Галактозидальной А недостаточности
- 2347586 Микрофлюидизированные эмульсии типа "масло в воде" и вакцинные средства
- 2147243 Контрастное средство
- 2146526 Лечебный препарат дисбактериоза и урогенитальных инфекций
- 2146148 Терапевтическое применение фактора роста кератиноцитов (ФРК)
- 2146139 Способ повышения активности макрофагов и комбинации для его осуществления
- 2346277 Способ диагностики специфического синовита
- 2345793 Ультразвуковые контрастные вещества и их получение
- 2345782 Терапевтические комбинации на основе PORIFERA для лечения и предотвращения кожных заболеваний
- 2245131 Способ коррекции косметических недостатков кожи
- 2245130 Способ активации восстановительных процессов в коже
- 2144833 Хондроитиназа
- 2344809 Получение твердых дозированных форм с использованием сшитого нетермопластичного носителя
- 2244540 Косметический гель для ухода за кожей лица
- 2244536 Способ лечения дегенеративно-дистрофических заболеваний тазобедренного сустава
- 2344167 Хмелевый экстракт
- 2143884 Агент регулирования дифференциации клеток кожи, культурная среда для клеток или тканей и способ регулирования дифференциации клеток кожи
- 2343932 Способ получения обладающих пониженной растворимостью в воде пленночных материалов
- 2343903 Устройство доставки лекарств для контролируемого введения препаратов
- 2048817 Способ получения материала для лечения ожогов и гнойно - некронических ран
- 2048803 Гидратантный крем
- 2242974 Средства и способы лечения воспалительных заболнваний
- 2142816 Способ получения антигерпетической вакцины
- 2342923 Средство для обработки рук с увлажняющим эффектом
- 2142781 Косметика для макияжа ресниц и бровей и агент ингирирующий рост микроорганизмов в косметических средствах
- 2242251 Трансплантируемые стенты с биоактивными покрытиями
- 2142257 Способ обработки глазных имплантантов и контакных линз
- 2342389 Мононатриевая соль
- 2342107 Способ устранения западения верхнего века при анофтальме
- 2141828 Средство, пролонгирующее эффективность чесночного порошка
- 2241489 Косметическое средство матриксных протеинов для залечивания ран
- 2241443 Средство для лечения герпеса
- 2241414 Способ получения протезов кровеносных сосудов
- 2341539 Гидрогель
- 2141324 Регулятор скорости воздействия препарата для инъекций
- 2141312 Косметическое средство для ухода за кожей лица
- 2341296 Средства и способы покрытия медицинских имплантантов
- 2341272 Средство для неспецифической иммунотерапии
- 2341266 Стенты с нанесенным покрытием содержащим N - (5-(4-(4-
- 2341257 Иммуномодулирующее средство
- 2341255 Средство для лечения климактерических расстройств
- 2240821 Способ лечения урологических инфекций
- 2140786 Способ лечения лишая
- 2140243 Способ хирургического лечения диабетической ретинопатии и отслоек сечатной оболочки
- 2240140 Медицинская многослойная повязка и изделия на ее основе
- 2240135 Культура клеток, содержащая клетки - предшественники остеонегеза, имплантант на ее основе и его использование для восстановления целостности кости
- 2240123 Экзогенные биологически активные коньюгирующие вещества
- 2139886 Фотоотвержаемое производное гликозаминогликата, сшитое производное гликозаминогликата и способы их получения, способ предотвращения клеточной и тканевой адгезии
- 2139729 Вакцина. Способ стимулирования иммунной системы
- 2339386 Средство обладающее радио - и химиозащитным действием
- 2339369 Лечение офтальмологических нарушений с использованием мочевины и ее производных
- 2139041 Гидратантный регенерирующий крем и способ его получения
- 2139039 Косметический суперкрем для ухода за кожей
- 2139017 Способ получения боисовместимого материала
- 2138503 Производные камптотецина, способы их получения, уникальное средство
- 2338556 Средство содержащие антагонист Р2Х - рецептора и нестероидное противоспалительное лекарственное средство
- 2338514 Косметическое средство для профилактики старения кожи
- 2138297 Медицинские устройства, подверженные вызываемому разложению
- 2138295 Покрытие для ран
- 2337906 Ингибиторы цитозольной фосфолипазы А2 Применение физиологически допустимого корпускулярного ферримагнитного или ферромагнитного материала. Способ формирования магнитометрического изображения
- 2137501 Устройство формирования изображения
- 2137477 Способ лечения заболеваний характеризующихся аутоиммунной агрессией
- 2137467 Крем для кожи лица и тела
- 2137449 Способ коррекции дефектов преломления в глазу млекопитающего
- 2137402 Пищевая Добавка БАД
- 2336899 Способ стимуляции миелопоэза
- 2336862 Способ получения раствора для лечения роговицы
- 2336830 Способ восстановления костных структур челюсти
- 2136696 Новый полипептид и средство против ВИЧ - Инфекции
- 2336092 Биоадгезивное средство, по существу свободное от воды
- 2336089 Средство и способ лечения заболеваний периодонтальных и пульпы
- 2336074 Средства и способы лечения заднего сегмента глаза
- 2235548 Ранозаживляющее средство
- 2135186 Способ лечения рефлекторных синдромов при остеохондрозе
- 2234945 Стабилизатор водного раствора и водосодержащего сырья
- 2334762 Растворимая ассоциативная карбоксиметилцеллюлоза
- 2234514 Макропористые хитозановые гранулы и способ их получения. Способ культивирования клеток
- 2133615 Средство для лечения неврологических заболеваний
- 2233164 Способ профилактики развития послеоперационных спаек брюшной полости
- 2133127 Неткатный материал, способ его получения и способ лечения
- 2333223 Альдегидные производные сиаловой кислоты и средства на их основе
- 2333007 Полипептидные вакцины для широкой защиты против рядов поколений менингококов с повышенной вирулентностью
- 2332985 Дозированные формы анестезирующих средств с длительным высвобождением для обезболивания
- 2132677 Косметическая маска
- 38603 Пленочный аппликатор
- 2232594 Средство содержащие ингибирующие остеокластогенез фактор и полисахарид
- 2332238 Средство для прокладок, раневых повязок и других изделий, контактирующих с кожей
- 2331668 Стромальные клетки, получение из жировой ткани, для заживления дефектов роговицы и внутриглазных дефектов и их использование
- 2331438 Альфа - 2 - Дельта Лигант для лечения симптомов нижних мочевыводящих путей
- 2331411Электропряденые аморфные фармоцевтические средства
- 2331367 Способ профилактики образования спаек и их рецидива
- 2130767 Масло в воде для получения косметических и дерматологических средств, способ косметической обработки
- 2230752 Поперечносшитые гиалуроновые кислоты и их применение в медицине
- 2230558 Способ восстановления и сохранения здоровья скмьи
- 2230550 Средства длительного высвобождения, способ их получения и применения
- 2230458 Поддержания здоровья суставов
- 2330290 Способ определения состояния метаболических процессов в ткани суставного хряща
- 2230073 Способ поперечного сшивания карбоксилированных полисахаридов
- 2329059 Способ лечения полипозного риносинусита
- 2329037 Комбинированная терапия для лечения иммуновоспалительных заболеваний
- 2128666 Гиалуроновая кислота и ее соли, способ очистки гиалуроновой кислоты, способ получения гиалуроновой кислоты. Фармацевтический препарат с гиалуроновой кислотой и средства с гиалуроновой кислотой используемые в офтальмологии
- 2328740 Способ экспресс - оценки действия зубных паст
- 2128502 Косметический гель
- 2328272 Суппозитории индуктора интерферона
- 2328268 Косметика содержащая амфолитный сополимер
- 2128057 Композиционная мембрана, способ ее получения и способ направленной регенерации тканей с ее применением
- 2128055 Средство замедленного освобождения и способ его получения
- 2128049 Свечи
- 2227743 Полипептидные варианты с повышенной гепаринсвязывающей способностью
- 2326893 Ковалентное и нековалентное сшивание гидрофильных полимеров
- 2326697 Новый перевязочный материал для быстрого заживления раневой поверхности кожи
- 2126264 Фармацевтическое средство с гиалуроновой кислотой
- 2326137 Способ получения содержащих альгинат пористых формованных изделий
- 2325902 Способ выделения гликозаминогликанов из минерализованной соединительной ткани
- 2225195 Репелленты против насекомых
- 2325193 Сосудистый стент
- 2325184 Улучшенные везикулы наружной мембраны бактерий
- 2325153 Многокомпонентная фармацевтическая дозированная форма
- 2325152 Удерживаемая в желудке система регулируемой доставки лекарственного средства
- 2029955 Способ предоперационного определения помутнения задней капсулы хрусталика при экстракции катаракты
- 2324688 Производные бисбензизоселеназолонила с противоопухолевым, противовоспалительным и антитромбоническим действием
- 2323017 Устройство и способ контролируемый доставки активных веществ в кожу
- 2323011 Содержащий Коллаген I и Коллаген II способный к рассасыванию внеклеточный матрикс, предназначенный для реконструирования хряща
- 2322955 Способ изготовления имплантанта для пластики дефектов хрящевой ткани
- 2322454 Антитело против CCR5
- 2322263 Система продолжительного высвобождения растворимого лекарственного средства
- 2221561 Витамин Е и его сложные эфиры
- 2321634 Гены участвующие в метаболизме углерода и продуцировании энергии
- 2321597 Биоматерьял, способ его приготовления и его применение, медицинское средство, имплантант и вкладыш
- 2121340 Средство для похудения
- 2220737 Средство для улучшения состояния опорно-двигательного аппарата
- 2220729 Гель используемый в стоматологии
- 2320720 Способ культивирования фибропластов для заместительной терапии
- 2320378 Накожный аппликатор
- 2320369 Средства, содержащие Альфа - 2 - Дельта Лиганды и ингибиторы обратного захвата серотонина/норадреналина
- 2320362 Местные фармацевтические средства, содержащие проантоцианидины, для лечения дерматитов
- 2320322 Биоадгезивная доставка лекарств
- 2320318 Чувствительное к температуре изменяющие состояние средство гидрогеля
- 2025120 Способ получения препарата, содержащего Фактор /G-CSF/, стимулирующий рост колоний гранулоцитов
- 2319490 Средство для введения железа при лечении синдрома беспокойных ног
- 25995 Содержащее адгезив приспособление для фиксации зубных протезов в полости рта
- 2218907 Средство для ухода за кожей лица и веками
- 2318830 Способ получения модифицированного дерматансульфата
- 2118153 Косметика - туш для ресниц
- 2217441 Способ получения полимера
- 2317296 Изетионатная соль селективного ингибитора CDK4
- 2217171 Мембрана для использования при направленной регенерации тканей
- 2317095 Экстракты ECHINACEA ANGUSTIFOLIA
- 2216332 Препарат для лечения астроза
- 2216314 Крем - маска для обезвоженной кожи
- 2316333 Средство оздоровительно-восстановительных косметических панто-магниевых ванн
- 2021304 Способ получения биологически активного средства
- 2115662 Способ получения гиалуроновой кислоты
- 2315627 Впрыскиваемые имплантанты на керамической основе для заполнения морщин, кожных впадин, шрамов
- 2315623 Средство получаемое путем лиофилизации препарата
- 2114862 Способ получения гиалуроновой кислоты
- 2314791 Лечебно-Косметическое средство
- 2314791 Косметический крем-бальзам для ухода за кожей лица и шеи
- 2214600 Способ оценки эффективности лечения неврологических проявлений
- 2114602 Способ косметической обработки
- 2114587 Раствор для защиты роговицы
- 2214283 Имплантант для подкожного или внутрикожного введения
- 2313370 Медицинские протезы, имеющие улучшенную биологическую совместимость
- 2313356 Препарат для лечения демодекоза
- 2313338 Средство на основе этиллинолеата и триэтилцитрата для лечения себореи и угрей
- 2313328 Косметика содержащая тонкодисперный и пористый порошок
- 2212880 Способ получения препарата содержащего антибиотик, с замедленным высвобождением активного вещества
- 2312640 Способ лечения Блефароконьюнктивальной формы синдрома сухого глаза
- 2017751 Способ получения гиалуроновой кислоты
- 2312145 Гены CORYNEBACTERIUM GLUTAMICUM, кодирующие белки, участвующие в синтезе мембран и мембранном транспорте
- 2311458 Белки вызывающие измененную иммуногенную реакцию. Способ их получения и использования
- 2311183 Улучшенное разделение с использованием гталуроновой кислоты
- 2311177 Ингибиторы интегрина для лечения заболевания глаз
- 2300069 Косметическая маска
- 2211024 Уход за сухой кожей
- 2310440 Раствор для защиты роговицы от повреждений
- 2309684 Лечение межфалангового остеоатроза узелковой формы
- 2309406 Способ мониторинга фиброза печени у больных хроническим гепатитом с (ХГС)
- 2209088 Опосредованная рецепторами доставка генов с использованием векторов на основе бактериофагов
- 2308967 Уменьшение объема ткани
- 2308962 Средство для опорно-дигательного аппарата
- 2308957 Способ получения препарата для мезотерапии
- 2308954 Средство для лечения ран, содержащее плазму или сыворотку крови
- 2308951 Комплексный способ профилактики вагинальных дисбактериозов
- 2308937 Косметическая биологически активная добавка и косметический литофитокомплекс на ее основе
- 2208638 ДНК (варианты), способ получения белка
- 2207885 Способ подачи небольшого объема лечебного раствора к целевому месту
- 2207858 Лишенные побочных эффектов производные простагландинов для лечения глаукомы
- 2207845 Твердая лекарственная форма пролонгированного действия
- 2207844 Препарат для местного неинвазивного применения
- 2207841 Средства с антиферментативным действием
- 2306335 Стволовые клетки и решетки полученные из жировой ткани
- 2306140 Новые рецепторы для Helicobacter pylori и их применение
- 2205612 Способ эндотелизации IN VITRO протезов кровеносных сосудов
- 2105540 Депигментирующее средство
- 2304960 Косметическое средство для кожи
- 2304616 Гены участвующие в гомеостазе и адаптации
- 2204550Способ получения длинноцепочечной N-Ацилированной кислотой Аминокислот
- 2204415 Способ получения изображения
- 2204394 Средство для лечения грибковых инфекций, желудочных язв
- 2204366 Способ хирургического лечения глаукомы
- 2104034 Вагинальное увлажняющие средство, способ его получения
- 2303991 Биологически активная добавка
- 2303990 БАД
- 2303973 Адсорбирующее изделие
- 2203676 Средство обладающее иммунокорригирующим действием
- 2203672 Способ предупреждения беременности
- 2303635 Гены кодирующие белки резистентности и толерантности к стрессам
- 2303529 Способ фиксации альгинатного геля на твердой фазе, способ получения клеточного чипа на его основе
- 2203078 Способ лечения гнойных ран
- 2302412 Гидразоно-малонитрилы
- 2102400 Способ получения гиалуроновой кислоты
- 2202356 Способ стимуляции репаративных процессов длительно незаживающих ран и трофических язв
- 2202336 Средство для ухода за кожей
- 2302231 Глазные капли
- 2102082 Способ магнитометрического исследования тела человека или животного
- 2301814 Полиакриламидный гидрогель
- 2201765 Гибридные матричные имплантанты и эксплантанты
- 2301677 Биотрансплантант для лечения дегенеративных и трвматических заболеваний хрящевой ткани и способ его получения
- 2301676 Способ лечения ревматизма
- 2301674 Способ лечения больных с переломами нижней челюсти
- 2301661 Средство с регулируемым освобождением и способ его получения
- 2005488 Средство для лечения болезней соединительной ткани
- 2200001 Крем для кожи
|
РОССИЙСКАЯ ФЕДЕРАЦИЯ

ФЕДЕРАЛЬНАЯ СЛУЖБА
ПО ИНТЕЛЛЕКТУАЛЬНОЙ СОБСТВЕННОСТИ
ПАТЕНТАМ И ТОВАРНЫМ ЗНАКАМ
|
Патент №2331438 |
(54) АЛЬФА-2-ДЕЛЬТА ЛИГАНД ДЛЯ ЛЕЧЕНИЯ СИМПТОМОВ НИЖНИХ МОЧЕВЫВОДЯЩИХ ПУТЕЙ
(57) Реферат:
Изобретение относится к области фармакологии и медицины и касается применения альфа-2-дельта лиганда для получения лекарственного средства для лечения симптомов нижних мочевыводящих путей, отличных от недержания мочи, связанного с ГМП и/или ДГПЖ. Средство обладает повышенной эффективностью 11 з.п. ф-лы, 4 ил.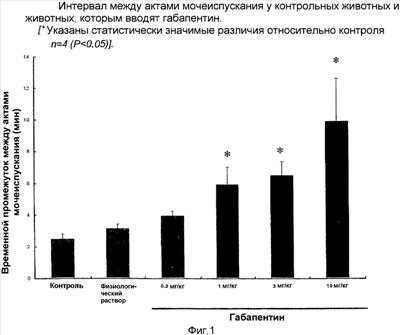
Настоящее изобретение относится к новому применению альфа-2-дельта лигандов и их фармацевтически приемлемых производных. В частности, оно относится к новому использованию габапентина и прегабалина.
Симптомы нижних мочевыводящих путей (СНМП) включают три группы симптомов, а именно ирритативные, обструктивные симптомы и симптомы неудобства после мочеиспускания. К обструктивным симпомам относятся безотлагательное, учащенное мочеиспускание и никтурия, которые могут быть связаны с: гиперактивным мочевым пузырем (ГМП) и доброкачественной гиперплазией предстательной железы (ДГПЖ).
Гиперактивный мочевой пузырь (ГМП) диагностируют по безотлагательному мочеиспусканием в сочетании с недержанием мочи или без нее, обычно с учащенным мочеиспусканием и никтурией [Abrams et al., Neurourology and Urodynamics 21:167-178 (2002)]. Симптом ГМП одинаково распространен как у мужчин, так и у женщин, и приблизительно 16% населения США страдают этим заболеванием [Stewart et al., Prevalence of Overactive Bladder in the United State: Result from the NOBLE Program; Abstract Presented at the 2nd International Consultation on Incontinence, July 2001, Paris, France].
Термины ГМП в сочетании с недержанием мочи и ГМП без недержания относятся к больным, у которых при ГМП наблюдается недержание мочи или оно отсутствует, соответственно. До недавнего времени основным симптомом ГМП считался симптом недержания мочи. Однако появление новых данных означает, что у большого количества больных отсутствует недержание мочи (то есть больные с ГПМ без недержания). Таким образом, Liberman et al [Health Related Quality of Life Among Adults with Symptoms of Overactive Bladder: Results From A US Community-Based Survey; Urology 57 (6), 1044-1050, 2001] недавно исследовали влияние всех симптомов ГМП на качество жизни пациента в США. Это исследование показало, что у пациентов, страдающих ГМП без очевидного недержания мочи, снижается качество жизни по сравнению с контрольными группами.
ДГПЖ представляет собой хроническое прогрессирующее заболевание, которое может быть причиной таких осложнений, как острая задержка мочи, повторяющиеся инфекции мочевыводящих путей, камни мочевого пузыря и почечная дисфункция. Частота заболеваемости и средняя тяжесть СНМП, связанных с ДГПЖ, увеличивается у мужчин с возрастом.
ДГПЖ приводит к увеличению размера предстательной железы, что приводит к синдрому обструкции пузырно-уретрального отдела, а также к вторичным изменениям функции мочевого пузыря. Такое увеличение предстательной железы и изменение функций мочевого пузыря проявляются в виде симптомов накопления (ирритативные симтпомы) и опорожнения (обструктивные симптомы).
Было описано, что альфа-2-дельта лиганды имеют большое количество показаний. Самый известный альфа-2-дельта лиганд, габапентин (I), известный как Neurontin®, 1-(аминометил)-циклогексилуксусная кислота, впервые был описан в патентной литературе в семействе патентов, к которым относится патент США № 4024175.
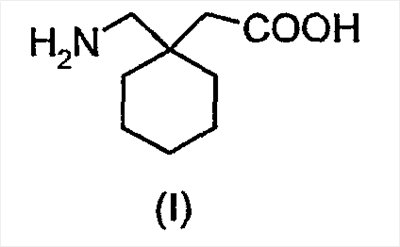
Соединение было одобрено для лечения эпилепсии и нейропатической боли.
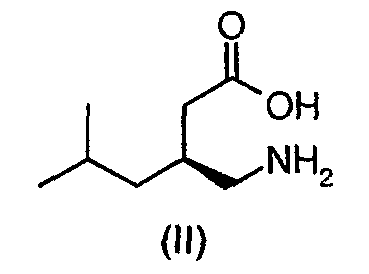
Второй альфа-2-дельта лиганд, прегабалин (II), (S)-(+)-4-амино-3-(2-метилпропил)бутановая кислота, был описан в европейской патентной заявке номер EP641330 для противосудорожной терапии, применяемой при лечении эпилепсии, и в EP0934061 для лечения боли.
Совсем недавно, в международной патентной публикации №WO02/085839, были описаны альфа-2-дельта лиганды нижеприведенной формулы, которые могут использоваться при большом количестве заболеваний, включая боль:
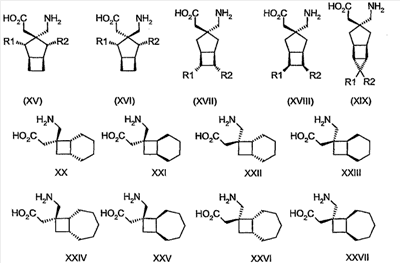
где каждый R1 и R2 независимо выбран из H, прямого или разветвленного алкила из 1-6 атомов углерода, циклоалкила из 3-6 атомов углерода, фенила и бензила, при условии, за исключением трициклооктанового соединения формулы (XVIII), что R1 и R2 одновременно не могут быть водородом.
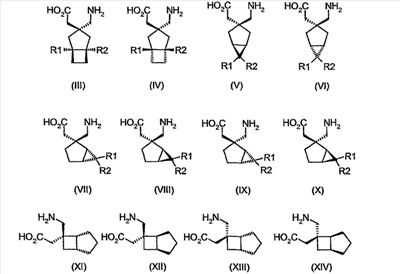
Другие примеры альфа-2-дельта лигандов представлены ниже:
Циклические альфа-2-дельта лиганды, которые могут использоваться по настоящему изобретению, проиллюстрированы следующей формулой (I):
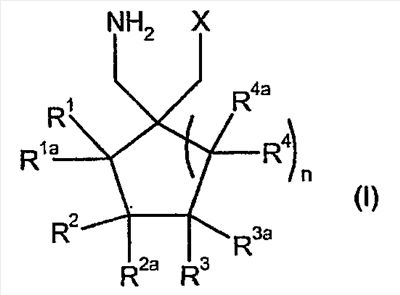
где X представляет собой карбоновую кислоту или биоизостер карбоновой кислоты;
n равно 0, 1 или 2; и
R1, R1a, R2, R2а, R3, R3а, R4 и R4а независимо выбраны из H и C1-C6 алкила, или
R1 и R2 или R2 и R3 вместе образуют С3-С7 циклоалкильное кольцо, которое необязательно замещено одним или двумя заместителями, выбранными из C1-C6 алкила,
или его фармацевтически приемлемая соль.
В формуле (I), соответственно, R1, R1a, R2a, R3а, R4 и R4a представляют собой H, а R2 и R3 независимо выбраны из H и метила, или R1a, R2а, R3a и R4a представляют собой H, и R1 и R2 или R2 и R3 вместе образуют С3-С7 циклоалкильное кольцо, которое необязательно замещено одним или двумя метильными заместителями. Соответствующий биоизостер карбоновой кислоты выбран из тетразолила и оксадиазолонила. X предпочтительно представляет карбоновую кислоту.
В формуле (I), предпочтительно, R1, R1a, R2а, R3a, R4 и R4a представляют собой H, а R2 и R3 независимо выбраны из H и метила, или R1a, R2а, R3a и R4a представляют собой H, и R1 и R2 или R2 и R3 вместе образуют С4-C5 циклоалкильное кольцо, или, если n равно 0, то R1, R1a, R2а, R3a, R4 и R4а представляют собой H, а R2 и R3 образуют циклопентильное кольцо, или, если n равно 1, то R1, R1a, R2a, R3a, R4 и R4a представляют собой H, а R2 и R3 оба являются метилом, или R1, R1a, R2а, R3a, R4 и R4a представляют собой H, а R2 и R3 образуют циклобутильное кольцо или, если n равно 2, то R1, R1a, R2, R2a, R3, R3a, R4 и R4а представляют собой H, или, если n равно 0, R1, R1a, R2a, R3a, R4 и R4а представляют собой H, а R2 и R3 образуют циклопентильное кольцо. Ациклические альфа-2-дельта лиганды, которые используются по настоящему изобретению, проиллюстрированы следующей формулой (II):
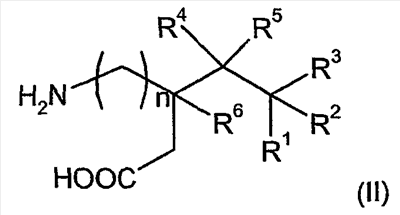
где:
n равно 0 или 1, R1 представляет собой водород или (С1-С6)алкил; R2 представляет собой водород или (С1-С6)алкил; R3 представляет собой водород или (С1-С6)алкил; R4 представляет собой водород или (С1-С6)алкил; R5 представляет собой водород или (С1-С6)алкил, и R2 представляет собой водород или (С1-С6)алкил,
или их фармацевтически приемлемая соль.
В соответствии с формулой (II), предпочтительно, R1 представляет собой С1-С6 алкил, R2 представляет собой метил, R3-R6 представляют собой водород, а n равно 0 или 1. Более предпочтительно, R1 представляет собой метил, этил, н-пропил или н-бутил, R2 представляет собой метил, R3-R6 представляют собой водород, и n равно 0 или 1. Если R2 представляет собой метил, R3-R6 представляют собой водород, а n равно 0, то R1, предпочтительно, представляет собой этил, н-пропил или н-бутил. Если R2 представляет собой метил, R3-R6 представляют собой водород, а n равно 1, то R1, предпочтительно представляет собой метил или н-пропил. Предпочтительно, соединения формулы (II) находятся в 3S,5R конфигурации.
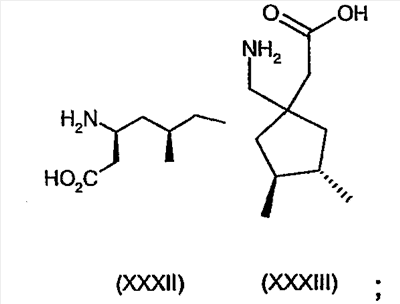
Примеры альфа-2-дельта лигандов, которые используются по настоящему изобретению, являются соединения, описанные, в целом или конкретно, в патенте США №4024175, в частности габапентин, в EP641330, в частности прегабалин, в патенте США №5563175, WO9733858, WO9733859, WO9931057, W09931074, W09729101, WO02085839, в частности [(1R,5R,6S)-6-(аминометил)бицикло[3.2.0]гепт-6-ил]уксусная кислота, в WO9931075, в частности, 3-(1-аминометил-циклогексилметил)-4H-[1,2,4]оксадиазол-5-он и C-[1-(1H-тетразол-5-илметил)циклогептил]метиламин, в WO9921824, в частности, (3S,4S)-(1-аминометил-3,4-диметилциклопентил)уксусная кислота, в WO0190052, WO0128978, в частности, (1 ,3 ,3 ,5 ,5 )(3-амино-метил-бицикло[3.2.0]гепт-3-ил)уксусная кислота, в EP0641330, W09817627, WO0076958, в частности, (3S,5R)-3-аминометил-5-метилоктановая кислота, в PCT/IB03/00976, в частности, (3S,5R)-3-амино-5-метилгептановая кислота, (3S,5R)-3-амино-5-метилнонановая кислота и (3S,5R)-3-амино-5-метилоктановая кислота, в EP1178034, EP1201240, WO9931074, WO03000642, WO0222568, WO0230871, WO0230881, WO02100392, WO02100347, WO0242414, WO0232736 и WO0228881 или их фармацевтически приемлемые соли, каждый из которых приведен здесь в качестве ссылки. )(3-амино-метил-бицикло[3.2.0]гепт-3-ил)уксусная кислота, в EP0641330, W09817627, WO0076958, в частности, (3S,5R)-3-аминометил-5-метилоктановая кислота, в PCT/IB03/00976, в частности, (3S,5R)-3-амино-5-метилгептановая кислота, (3S,5R)-3-амино-5-метилнонановая кислота и (3S,5R)-3-амино-5-метилоктановая кислота, в EP1178034, EP1201240, WO9931074, WO03000642, WO0222568, WO0230871, WO0230881, WO02100392, WO02100347, WO0242414, WO0232736 и WO0228881 или их фармацевтически приемлемые соли, каждый из которых приведен здесь в качестве ссылки.
Предпочтительные альфа-2-дельта лиганды по настоящему изобретению включают: габапентин, прегабалин, [(1R,5R,6S)-6-(аминометил)бицикло[3.2.0]гепт-6-ил]уксусную кислоту, 3-(1-аминометилциклогексилметил)-4H-[1,2,4]оксадиазол-5-он, C-[1-(1H-тетразол-5-илметил)циклогептил]метиламин, (3S,4S)-(1-аминометил-3,4-диметилциклопентил)уксусную кислоту, (1 ,3 ,3 ,5 ,5 )(3-амино-метил-бицикло[3.2.0]гепт-3-ил)уксусную кислоту, (3S, 5R)-3-аминометил-5-метилоктановую кислоту, (3S,5R)-3-амино-5-метилгептановую кислоту, (3S,5R)-3-амино-5-метилнонановую кислоту и (3S,5R)-3-амино-5-метилоктановую кислоту, или их фармацевтически приемлемые соли. В частности, предпочтительные альфа-2-дельта лиганды по настоящему изобретению выбраны из габапентина, прегабалина и (1 )(3-амино-метил-бицикло[3.2.0]гепт-3-ил)уксусную кислоту, (3S, 5R)-3-аминометил-5-метилоктановую кислоту, (3S,5R)-3-амино-5-метилгептановую кислоту, (3S,5R)-3-амино-5-метилнонановую кислоту и (3S,5R)-3-амино-5-метилоктановую кислоту, или их фармацевтически приемлемые соли. В частности, предпочтительные альфа-2-дельта лиганды по настоящему изобретению выбраны из габапентина, прегабалина и (1 ,3 ,3 ,5 ,5 )(3-аминометилбицикло[3.2.0]гепт-3-ил)уксусной кислоты, или их фармацевтически приемлемых солей. )(3-аминометилбицикло[3.2.0]гепт-3-ил)уксусной кислоты, или их фармацевтически приемлемых солей.
В WO 00/01135 описано использование аналогов глутаминовой кислоты и гамма-аминомасляной кислоты для лечения недержания мочи.
Неожиданно было обнаружено, что альфа-2-дельта лиганды, такие как описано выше, могут использоваться при лечении СНМП, кроме использования для лечения недержания мочи, связанных с ГМП и/или ДГПЖ. Более конкретно, было обнаружено, что альфа-2-дельта лиганды могут использоваться при лечении частых позывов при СНМП, связанного с ГМП и/или ДГПЖ. Это обнаружение было неожиданным, так как предполагалось, что соединение, которое, как известно, используется для лечение недержания мочи (то есть нежелательное и часто неосознанное упускание мочи вследствие нарушения мышечного контроля) может снижать симптомы частых позывов, которые наблюдаются у больных с ГМП и ДГПЖ.
Таким образом, в настоящем изобретении предлагается применение альфа-2-дельта лиганда, или его фармацевтически приемлемой соли или сольвата, для лечения СНМП, кроме применения для лечения недержания мочи, связанных с ГМП и/или ДГПЖ.
Предпочтительно, СНМП представляет частые позывы к мочеиспусканию. Предпочтительно, СНМП связаны с ДГПЖ. Предпочтительно, если СНМП связаны с ДГПЖ, то ГМП представляет собой ГМП без недержания мочи.
Предпочтительно, альфа-2-дельта-1-лиганд выбран из:
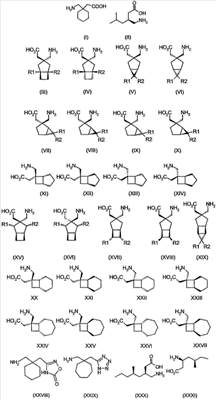 
или его фармацевтически приемлемой соли или сольвата,
где каждый R1 и R2 независимо выбран из H, прямого или разветвленного алкила из 1-6 атомов углерода, циклоалкила из 3-6 атомов углерода, фенила и бензила, при условии, за исключением трициклооктанового соединения формулы (XVIII), что R1 и R2 одновременно не могут быть водородом; или выбран из
или его фармацевтически приемлемой соли или сольвата.
Более предпочтительно, альфа-2-дельта лиганд представляет собой габапентин (I), прегабалин (II) или (1 , 3 , 3 , 5 , 5 )(3-амино-метил-бицикло[3.2.0]гепт-3-ил)уксусную кислоту (III') )(3-амино-метил-бицикло[3.2.0]гепт-3-ил)уксусную кислоту (III')
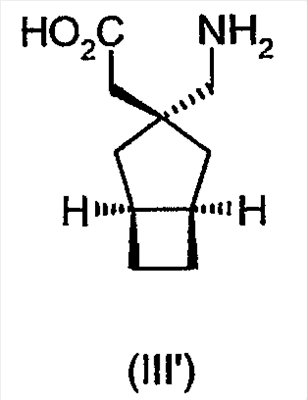
или его фармацевтически приемлемую соль или сольват.
Альфа-2-дельта лиганд, или его фармацевтически приемлемое производное, может вводиться самостоятельно или в любой удобной фармацевтической форме. Пероральное введение является предпочтительным. В этом случае соответствующая дозировка альфа-2-дельта лиганда, или активной группы его фармацевтически приемлемого производного, составляет от около 5 до около 50 мг/кг массы тела и, предпочтительно, от около 0,1 до около 200 мг/кг.
Изобретение также относится к способу лечения СНМП, исключая способ лечения недержания мочи, связанных с ГМП и/или ДГПЖ, который заключается во введении альфа-2-дельта лиганда, или его фармацевтически приемлемой соли или сольвата, больному при необходимости такого лечения.
Альфа-2-дельта лиганды, в частности, соединения, описанные выше, могут использоваться в сочетании с другими соединениями. Например, они могут использоваться в сочетании с антагонистами  1-адренергического рецептора. 1-адренергического рецептора.
Таким образом, еще одним аспектом настоящего изобретения является применение сочетания альфа-2-дельта лиганда и антагониста  1-адренергического рецептора, или его фармацевтически приемлемых солей или сольватов, для получения лекарственного средства для лечения СНМП, связанных с ГМП и/или ДГПЖ. 1-адренергического рецептора, или его фармацевтически приемлемых солей или сольватов, для получения лекарственного средства для лечения СНМП, связанных с ГМП и/или ДГПЖ.
Кроме того, настоящее изобретение относится к продукту, содержащему альфа-2-дельта лиганд и антагонист  1-адренергического рецептора, или его фармацевтически приемлемые соли или сольваты, в виде объединенного препарата для одновременного, отдельного или последовательного введения при лечение СНМП, связанных с ГМП и/или ДГПЖ. 1-адренергического рецептора, или его фармацевтически приемлемые соли или сольваты, в виде объединенного препарата для одновременного, отдельного или последовательного введения при лечение СНМП, связанных с ГМП и/или ДГПЖ.
Предпочтительно, СНМП не является симптомом недержания мочи. Более предпочтительно, СНМП являются частыми позывами к мочеиспусканию. Предпочтительно, СНМП связаны с ДГПЖ. Предпочтительно, если СНМП связаны с ДГПЖ, то ГМП представляет собой ГМП без недержания мочи.
Антагонисты  1-адренергического рецептора, которые могут использоваться в сочетании с альфа-2-дельта лигандами, включают, но ими не ограничиваются, 1-адренергического рецептора, которые могут использоваться в сочетании с альфа-2-дельта лигандами, включают, но ими не ограничиваются,
(i) теразозин (патент США №4026894);
(ii) доксазозин (патент США №4188390);
(iii) празозин (патент США №3511836);
(iv) буназозин (патент США №3920636);
(v) альфузозин (патент США №4315007);
(vi) нафтопидил (патент США №3997666);
(vii) тамсулозин (патент США №4703063);
(viii) силодозин (патент США №5387603) или
(ix) соединения, описанные в опубликованной международной патентной заявке No. WO 98/30560 (в частности, в примере 19 и их мезилатная соль).
Содержание патентных заявок и, в частности, общие формулы терапевтически активных соединений по пунктам формулы изобретения и примеры этих соединений приведены здесь в качестве ссылки в полном объеме.
Альтернативно, альфа-2-дельта лиганды могут использоваться в сочетании с соединением, которое демонстрирует NRI и/или SRI активность. Таким образом, дополнительным аспектом настоящего изобретения является применение сочетания альфа-2-дельта лиганда и соединения, демонстрирующего NRI и/или SRI активность, или его фармацевтически приемлемых солей или сольватов, для получения лекарственного средства для лечения СНМП, связанных с ГМП и/или ДГПЖ.
Кроме того, изобретение относится к продукту, содержащему альфа-2-дельта лиганд и соединение, демонстрирующее NRI и/или SRI активность, или его фармацевтически приемлемые соли или сольваты, в виде объединенного препарата для одновременного, отдельного или последовательного применения при лечении СНМП, связанных с ГМП и/или ДГПЖ.
Предпочтительно, СНМП не является симптомом недержания мочи. Более предпочтительно, СНМП являются частыми позывами к мочеиспусканию. Предпочтительно, СНМП связаны с ДГПЖ. Предпочтительно, если СНМП связаны с ДГПЖ, то ГМП представляет собой ГМП без недержания мочи.
Соединения, обладающие NRI и/или SRI активностью, которые могут быть эффективны для применения по настоящему изобретению, включают, но ими не ограничиваются, ниже представленные соединения:
(i) Флуоксетин, флувоксамин, пароксетин, сертралин, циталопрам, ванлафаксин, нефазодон, тразодон, дулоксетин и ребоксетин (и в рацемически и энантиомерно чистых формах, например, S,S-ребоксетин) и
(ii) Соединения, описанные в европейской патентной публикации № 1220831 и 1154984, в патенте США №4018830, международной патентной публикации WO 97/17325, в патенте США №5190965, 5430063, 4161529 и временной заявке США № 60/121313.
Содержание патентных заявок и, в частности, общие формулы терапевтически активных соединений пунктов формулы изобретения и иллюстрируемых соединений, приведены здесь в качестве ссылки в полном объеме.
Альтернативно, альфа-2-дельта лиганды могут использоваться в сочетании с ингибитором HMG-CoA редуктазы. Таким образом, дополнительным аспектом настоящего изобретения является использование сочетания альфа-2-дельта лиганда и ингибитора HMG-СоА редуктазы, или его фармацевтически приемлемой соли или сольвата, для получения лекарственного средства для лечения СНМП, связанного с ГМП и/или ДГПЖ.
Кроме того, изобретение относится к продукту, содержащему альфа-2-дельта лиганд и ингибитор HMG-СоА редуктазы, или его фармацевтически приемлемую соль или сольват, в виде объединенного препарата для одновременного, отдельного или последовательного применения при лечении СНМП, связанного с ГМП и/или ДГПЖ.
Предпочтительно, СНМП не является симптомом недержания мочи. Более предпочтительно, СНМП являются частыми позывами к мочеиспусканию. Предпочтительно, СНМП связаны с ДГПЖ. Предпочтительно, если СНМП связаны с ДГПЖ, то ГМП представляет собой ГМП без недержания мочи.
Ингибиторы HMG-СоА редуктазы, эффективные для применения по настоящему изобретению, включают, но ими не ограничиваются, соединения представленные ниже:
(i) Флувастатин натрий, [R*,S*,-(E)]-(±)-7-[3-(4-фторфенил)-1-(1-метилэтил)-H-индол-2-ил]-3,5-дигидрокси-6-гептеновая кислота, мононатриевая соль;
(ii) Церивастатин натрий, [S-[R*,S*-(E)]-7-[4-(4-фторфенил)-5-метоксиметил)-2,6-бис(1-метилэтил)-3-пиридинил]-3,5-дигидрокси-6-гептеноат;
(iii) Аторвастатин кальций, тригидрат кальциевой соли (2:1) [R-(R*,R*)]-2-(4-фторфенил)-бета, дельта-гидрокси-5-(1-метилэтил)-3-фенил-4-[(фениламино)карбонил]-1H-пиррол-1-гептановой кислоты;
(iv) Ловастатин, {S-[1-альфа(R*), 3-альфа, 7-бета, 8-бета (2S*, 4S*), 8a бета]}-1,2,3,7,8,8a-гексагидро-3,7-диметил-8-[2-(тетрагидро-4-гидрокси-6-оксо-2H-пиран-2-ил)этил]-1-нафталенил-2-метилбутаноат;
(v) Правастатин натрия, 1-нафтален-гептановая кислота, 1,2,6,7,8,8a-гексагидро-бета, дельта, 6-тригидрокси-2-метил-8-(2-метил-1-оксобутокси)-, мононатриевая соль, {1S-[1альфа(бета*, дельта*), 2 альфа, 6 альфа, 8 бета (R*), 8a альфа]} и
(vi) Симвастатин, бутановая кислота, 2,2-диметил-1,2,3,7,8,8a-гексагидро-3,7-диметил-8-[2-(тетрагидро-4-гидрокси-6-оксо-2H-пиран-2-ил)-этил]-1-нафталениловый эфир, {1S-[1 альфа, 3 альфа, 7 бета, 8 бета (2S*, 4S*), -8а бета]}.
Альтернативно, альфа-2-дельта лиганды могут использоваться в сочетании с ингибиторами PDEV. Таким образом, дополнительным аспектом настоящего изобретения является применение сочетания альфа-2-дельта лиганда и ингибитора PDEV, или его фармацевтически приемлемых солей или сольватов, для получения лекарственного средства для лечения СНМП, связанного с ГМП и/или ДГПЖ.
Кроме того, настоящее изобретение относится к продукту, содержащему альфа-2-дельта лиганд и ингибитор PDEV, или его фармацевтически приемлемые соли или сольваты, в виде объединенного препарата для одновременного, отдельного или последовательного применения при лечении СНМП, связанных с ГМП и/или ДГПЖ.
Предпочтительно, СНМП не является симптомом недержания мочи. Более предпочтительно, СНМП являются частыми позывами к мочеиспусканию. Предпочтительно, СНМП связаны с ДГПЖ. Предпочтительно, если СНМП связаны с ДГПЖ, то ГМП представляет собой ГМП без недержания мочи.
Ингибиторы PDEV, которые могут использоваться для объединения с альфа-2-дельта лигандами, включают, но ими не ограниваются:
(i) ингибиторы PDE5, указанные в международных публикациях патентных заявок №№ WO03/000691; WO02/64590; WO02/28865; WO02/28859; WO02/38563; WO02/36593; WO02/28858; WO02/00657; WO02/00656; WO02/10166; W002/00658; WO01/94347; WO01/94345; WOOO/15639 и WOOO/15228;
(ii) ингибиторы PDE5, указанные в патентах США №6143746; 6143747 и 6043252;
(iii) пиразоло[4,3-d]пиримидин-7-оны, описанные в EP-А-0463756; пиразоло[4,3-d] пиримидин-7-оны в EP 0526004; пиразоло[4,3-d]пиримидин-7-оны, описанные в опубликованной международной патентной заявке WO 93/06104; изомеры пиразоло[3,4-d]пиримидин-4-онов, описанные в опубликованной международной патентной заявке WO 93/07149; хиназолин-4-оны, описанные в опубликованной международной патентной заявке WO 93/12095; пиридо[3,2-d]пиримидин-4-оны, описанные в опубликованной международной патентной заявке WO 94/05661; пурин-6-оны, описанные в опубликованной международной патентной заявке WO 94/00453; пиразоло[4,3-d]пиримидин-7-оны, описанные в опубликованной международной патентной заявке WO 98/49166; пиразоло[4,3-d]пиримидин-7-оны, описанные в опубликованной международной патентной заявке WO 99/54333; пиразоло [4,3-d] пиримидин-4-оны, описанные в EP 0995751; пиразоло[4,3-d]пиримидин-7-оны, описанные в опубликованной международной патентной заявке WO 00/24745; пиразоло[4,3-d]пиримидин-4-оны, описанные в EP 0995750; гексагидропиразино[2'1':6,1]пиридо[3,4-b]индол-1,4-дионы, описанные в опубликованной международной заявке WO95/19978; пиразоло[4,3-d]пиримидин-4-оны, описанные в WO00/27848; имидазо[5,1-f] [1,2,4]триазин-оны, описанные в EP 1092719 и в опубликованной международной заявке WO, 99/24433 и бициклические соединения, описанные в опубликованной международной заявке WO 93/07124; пиразоло[4,3-d]пиримидин-7-оны, описанные в опубликованной международной заявке WO 01/27112; пиразоло[4,3-d]пиримидин-7-оны, описанные в опубликованной международной заявке WO 01/27113; соединения описанные в EP-А-1092718 и соединения, описанные в EP-А-1092719; трициклические соединения, описанные в EP-А-1241170; алкилсульфоновые соединения, описанные в опубликованной международной заявке WO 02/074774; соединения, описанные в опубликованной международной заявке WO 02/072586; соединения, описанные в опубликованной международной заявке WO, 02/079203 и соединения, описанные в WO 02/074312.
(iv) предпочтительно, 5-[2-этокси-5-(4-метил-1-пиперазинилсульфонил)фенил]-1-метил-3-н-пропил-1,6-дигидро-7H-пиразоло[4,3-d]пиримидин-7-он (силденафил, например, продаваемый как Viagra®), также известный как 1-[[3-(6,7-дигидро-1-метил-7-оксо-3-пропил-1H-пиразоло[4,3-d]пиримидин-5-ил)-4-этоксифенил]сульфонил]-4-метилпиперазин (см. EP-A-0463756); 5-(2-этокси-5-морфолиноацетилфенил)-1-метил-3-н-пропил-1,6-дигидро-7H-пиразоло[4,3-d]пиримидин-7-он (см. EP-A-0526004); 3-этил-5-[5-(4-этилпиперазин-1-илсульфонил)-2-н-пропоксифенил]-2-(пиридин-2-ил)метил-2,6-дигидро-7H-пиразоло[4,3-d]пиримидин-7-он (см. WO98/49166); 3-этил-5-[5-(4-этилпиперазин-1-илсульфонил)-2-(2-метоксиэтокси)пиридин-3-ил]-2-(пиридин-2-ил)метил-2,6-дигидро-7H-пиразоло[4,3-d]пиримидин-7-он (см. WO99/54333); (+)-3-этил-5-[5-(4-этилпиперазин-1-илсульфонил)-2-(2-метокси-1(R)-метилэтокси)пиридин-3-ил]-2-метил-2,6-дигидро-7H-пиразоло[4,3-d]пиримидин-7-он, также известный как 3-этил-5-{5-[4-этилпиперазин-1-илсульфонил]-2-([(1R)-2-метокси-1-метилэтил]окси)пиридин-3-ил}-метил-2,6-дигидро-7H-пиразоло[4,3-d]пиримидин-7-он (см. WO99/54333); 5-[2-этокси-5-(4-этилпиперазин-1-илсульфонил)пиридин-3-ил]-3-этил-2-[2-метоксиэтил]-2,6-дигидро-7H-пиразоло[4,3-d]пиримидин-7-он, также известный как 1-{6-этокси-5-[3-этил-6,7-дигидро-2-(2-метоксиэтил)-7-оксо-2H-пиразоло[4,3-d]пиримидин-5-ил]-3-пиридилсульфонил}-4-этилпиперазин (см., WO 01/27113, пример 8); 5-[2-изобутокси-5-(4-этилпиперазин-1-илсульфонил)пиридин-3-ил]-3-этил-2-(1-метилпиперидин-4-ил)-2,6-дигидро-7H-пиразоло [4,3-d] пиримидин-7-он (см., WO 01/27113, пример 15); 5-[2-этокси-5-(4-этилпиперазин-1-илсульфонил)пиридин-3-ил]-3-этил-2-фенил-2,6-дигидро-7H-пиразоло[4,3-d]пиримидин-7-он (см., WO 01/27113, пример 66); 5-(5-ацетил-2-пропокси-3-пиридинил)-3-этил-2-(1-изопропил-3-азетидинил)-2,6-дигидро-7H-пиразоло[4,3-d|пиримидин-7-он (см., WO 01/27112, пример 124); 5-(5-ацетил-2-бутокси-3-пиридинил)-3-этил-2-(1-этил-3-азетидинил)-2,6-дигидро-7H-пиразоло[4,3-d]пиримидин-7-он (см., WO 01/27112, пример 132); (6R,12aR)-2,3,6,7,12,12a-гексагидро-2-метил-6-(3,4-метилендиоксифенил)пиразино[2',1':6,1]пиридо[3,4-b]индол-1,4-дион (тадалафил, IC-351, Cialis ®), то есть соединение примеров 78 и 95 из опубликованной международной заявки WO95/19978, так же, как соединение примеров 1, 3, 7 и 8; 2-[2-этокси-5-(4-этил-пиперазин-1-ил-1-сульфонил)-фенил]-5-метил-7-пропил-3H-имидазо [5,1-f] [1,2,4] триазин-4-он (варденафил, LEVITRA®) также известный как 1-[[3-(3,4-дигидро-5-метил-4-оксо-7-пропилимидазо[5,1-f]-аз-триазин-2-ил)-4-этоксифенил]сульфонил]-4-этилпиперазин, то есть соединение примеров 20, 19, 337 и 336 из опубликованной международной заявки WO99/24433; соединение примера 11 из опубликованной международной заявки WO93/07124 (EISAI); соединения 3 и 14 от Rotella D P, J. Med. Chem., 2000, 43, 1257; 4-(4-хлорбензил)амино-6,7,8-триметоксихиназолин; N-[[3-(4,7-дигидро-1-метил-7-оксо-3-пропил-1H-пиразоло[4,3-d]-пиримидин-5-ил)-4-пропоксифенил]сульфонил]-1-метил-2-пирролидинпропанамид ["DA-8159" (пример 68 из WO00/27848)]; и 7,8-дигидро-8-оксо-6-[2-пропоксифенил]-1H-имидазо [4,5-g] хиназолин и 1-[3-[1-[(4-фторфенил)метил]-7,8-дигидро-8-оксо-1H-имидазо[4,5-g]хиназолин-6-ил]-4-пропоксифенил]карбоксамид.
(v) 4-бром-5-(пиридилметиламино)-6-[3-(4-хлорфенил)-пропокси]-3(2H)пиридазинон; 1-[4-[(1,3-бензодиоксол-5-илметил)амино]-6-хлор-2-хинозолинил]-4-пиперидин-карбоновая кислота, мононатриевая соль; (+)-цис-5,6а,7,8,9,9а-гексагидро-2-[4-(трифторметил)-фенилметил-5-метил-циклопент-4,5]имидазо[2,1-b]пурин-4(3H)-он; фуразлоциллин; цис-2-гексил-5-метил-3,4,5,6a,7,8,9,9a-октагидроциклопент[4,5]-имидазо[2,1-b]пурин-4-он; 3-ацетил-1-(2-хлорбензил)-2-пропилиндол-6-карбоксилат; 3-ацетил-1-(2-хлорбензил)-2-пропилиндол-6-карбоксилат; 4-бром-5-(3-пиридилметиламино)-6-(3-(4-хлорфенил)пропокси)-3-(2H)пиридазинон; 1-метил-5(5-морфолиноацетил-2-н-пропоксифенил)-3-н-пропил-1,6-дигидро-7H-пиразоло(4,3-d]пиримидин-7-он; мононатриевая соль 1-[4-[(1,3-бензодиоксол-5-илметил)амино]-6-хлор-2-хиназолинил]-4-пиперидинкарбоновой кислоты; Pharmaprojects № 4516 (Glaxo Wellcome); Pharmaprojects № 5051 (Bayer); Pharmaprojects №5064 (Kyowa Hakko; см. WO 96/26940); Pharmaprojects № 5069 (Schering Plough); GF-196960 (Glaxo Wellcome); E-8010 и E-4010 (Eisai); Bay-38-3045 и 38-9456 (Bayer); FR229934 и FR226807 (Fujisawa); и Sch-51866.
Содержание патентных заявок и журнальных статей и, в частности, общие формулы терапевтически активных соединений по пунктам формулы изобретения и примеры этих соединений приведены здесь в качестве ссылки в полном объеме.
Предпочтительно, ингибитор PDEV выбран из синденафила, тадалафила, варденафила, DA-8159 и 5-[2-этокси-5-(4-этилпиперазин-1-илсульфонил)пиридин-3-ил]-3-этил-2-[2-метоксиэтил]-2,6-дигидро-7H-пиразоло[4,3-d]пиримидин-7-она.
Наиболее предпочтительно, ингибитор PDE5 представляет собой силденафил и его фармацевтически приемлемые соли. Силденафил цитрат предпочтительно находится в виде соли.
Альтернативно, альфа-2-дельта лиганды могут быть объединены с мускариновыми антагонистами. Таким образом, дополнительным аспектом настоящего изобретения является применение сочетания альфа-2-дельта лиганда и мускариновых антагонистов, или их фармацевтически приемлемых солей или сольватов, для получения лекарственного средства для лечения СНМП, связанного с ГМП и/или ДГПЖ.
Кроме того, изобретение относится к продукту, содержащему альфа-2-дельта лиганд и мускариновый антагонист, или его фармацевтически приемлемые соли или сольваты, в виде объединенного препарата для одновременного, отдельного или последовательного применения при лечении СНМП, связанного с ГМП и/или ДГПЖ.
Предпочтительно, СНМП не является симптомом недержания мочи. Более предпочтительно, СНМП являются частыми позывами к мочеиспусканию. Предпочтительно, СНМП связаны с ДГПЖ. Предпочтительно, если СНМП связаны с ДГПЖ, то ГМП представляет собой ГМП без недержания мочи.
Мускариновый антагонист может быть селективным в отношении рецепторов М3, или он может быть неселективным антагонистом в отношении М1, М2 и М3. Антагонисты, селективные в отношении рецептора М3, являются предпочтительными.
Мускариновые антагонисты, которые могут использоваться для объединения с альфа-2-дельта лигандами включают, но ими не ограничиваются:
(i) Атропин, флувоксат, гиосцин, оксибутинин, толтеродин и соединения, описанные в международной патентной публикации № WO 89/06644, пропантелин, пропиверин, троспиум и соединения, описанные в международной патентной публикации № WO 98/05641, а также их фармацевтически приемлемые соли.
(ii) Особенно предпочтительными являются дарифенацин, оксибутинин, толтеродин и соединения, описанные в международной патентной публикации № WO 89/06644, и соединения, описанные в международной патентной публикации № WO 98/05641, а также их фармацевтически приемлемые соли.
Интерес, в частности, представляет толтеродин.
Содержание патентных заявок и журнальных статей и, в частности, общие формулы терапевтически активных соединений по пунктам изобретения, и примеры этих соединений приведены здесь в качестве ссылки в полном объеме.
Альтернативно, альфа-2-дельта лиганды могут быть объединены с ингибиторами циклооксигеназы. Таким образом, дополнительным аспектом настоящего изобретения является применение сочетания альфа-2-дельта лиганда и ингибитора COX, или его фармацевтически приемлемых солей или сольватов, для получения медикамента для лечения СНМП, связанного с ГМП и/или ДГПЖ.
Кроме того, настоящее изобретение относится к продукту, содержащему альфа-2-дельта лиганд и ингибитор COX в виде объединенного препарата для одновременного, отдельного или последовательного применения при лечении СНМП, связанного с ГМП и/или ДГПЖ.
Предпочтительно, СНМП не является симптомом недержания мочи. Более предпочтительно, СНМП являются частыми позывами к мочеиспусканию. Предпочтительно, СНМП связаны с ДГПЖ. Предпочтительно, если СНМП связаны с ДГПЖ, то ГМП представляет собой ГМП без недержания мочи. Предпочтительно ингибитор COX представляет собой ингибитор COX2.
Ингибиторы COX, которые могут использоваться для объединения с альфа-2-дельта лигандами, включают, но ими не ограниваются:
(i) ибупрофен, напроксен, беноксапрофен, флурбипрофен, фенопрофен, фенбуфен, кетопрофен, индопрофен, пирпрофен, карпрофен, оксапрозин, прапопрофен, миропрофен, тиоксапрофен, супрофен, альминопрофен, тиапрофеновая кислота, флупрофен, буклоксиновую кислоту, индометацин, сулиндак, толметин, зомепирак, диклофенак, фенклофенек, алклофенак, ибуфенак, изоксепак, фурофенак, тиопинак, зидометацин, ацетилсалициловую кислоту, индометацин, пироксикам, теноксикам, набуметон, кеторолак, азапропазон, мефенамовую кислоту, толфенамовую кислоту, дифлунисал, производные подофиллотоксина, ацеметацин, дроксикам, флоктафенин, оксифенбутазон, фенилбутазон, проглуметацин, ацеметацин, фентиазак, клиданак, оксипинак, мефенамовую кислоту, меклофенамовую кислоту, флуфенамовую кислоту, нифлумовую кислоту, флуфенизал, судоксикам, этодолак, пипрофен, салициловую кислоту, трисалицилат магний холина, салицилат, бенорилат, фентиазак, клопинак, фепразон, изоксикам и 2-фтор-a-метил[1,1'-дифенила]-4-уксусная кислота, 4-(нитроокси)бутиловый эфир (см. Wenk, et al., Europ. J. Pharmacol. 453:319-324 (2002));
(ii) мелоксикам, (CAS регистрационный номер 71125-38-7; описанный в патенте США № 4233299), или его фармацевтически приемлемая соль или пролекарство;
(iii) замещенные производные бензопирана, которые описаны в патенте США № 6271253. Также производные бензопирана, описанные в патенте США № 6034256 и 6077850, а также в международных публикациях WO 98/47890 и WO 00/23433;
(iv) селективные ингибиторы хромена COX2, описанные в патенте США № 6077850 и в патенте США № 6034256;
(v) соединения, описанные в международных публикациях патентных заявок WO 95/30656, WO 95/30652, WO 96/38418 и WO 96/38442, и соединения, описанные в европейской публикации патентной заявки № 799823, а также их фармацевтически приемлемые производные;
(vi) целекоксиб (патент США № 5466823), валдекоксиб (патент США № 5633272), деракоксиб (патент США № 5521207), рофекоксиб (патент США № 5474995), эторикоксиб (международная публикация патентной заявки № WO 98/03484), JTE-522 (японская публикация патентной заявки № 9052882), или его фармацевтически приемлемая соль или пролекарство;
(vii) парекоксиб (описанный в патенте США № 5932598), который является терапевтически эффективным пролекарством трициклического селективного ингибитора COX2 валдекоксиба (описан в патенте США № 5633272), в частности, парекоксиб натрия;
(viii) ABT-963 (описанный в международной публикации патентной заявки № WO 00/24719)
(ix) нимесулид (описанный в патенте США № 3840597), флосулид (описанный в J. Carter. Exp. Qpin. Ther. Patents, 8(1), 21-29 (1997)), NS-398 (описанный в патенте США № 4885367), SD 8381 (описанный в патенте США № 6034256), BMS 347070 (описанный в патенте США № 6180651), S-2474 (описанный в европейской патентной публикации № 595546) и MK-966 (описанный в патенте США № 5968974);
(x) соединения и фармацевтически приемлемые производные, описанные в патенте США № 6395724, патенте США № 6077868, патенте США № 5994381, патенте США № 6362209, патенте США № 6080876, патенте США № 6133292, патенте США № 6369275, патенте США № 6127545, патенте США № 6130334, патенте США № 6204387, патенте США № 6071936, патенте США № 6001843, патенте США № 6040450, международной публикации патентной заявки No WO 96/03392, международной публикации патентной заявки No WO 96/24585, патенте США № 6340694, патенте США № 6376519, патенте США № 6153787, патенте США № 6046217, патенте США № 6329421, патенте США № 6239137, патенте США № 6136831, патенте США № 6297282, патенте США № 6239173, патенте США № 6303628, патенте США № 6310079, патенте США № 6300363, патенте США № 6077869, США, патенте № 6140515, патенте США № 5994379, патенте США № 6028202, патенте США № 6040320, патенте США № 6083969, патенте США № 6306890, патенте США № 6307047, патенте США № 6004948, патенте США № 6169188, патенте США № 6020343, патенте США № 5981576, патенте США № 6222048, патенте США № 6057319, патенте США № 6046236, патенте США № 6002014, патенте США № 5945539, патенте США № 6359182, международной публикации патентной заявки № WO 97/13755, международной публикации патентной заявки № WO 96/25928, международной публикации патентной заявки № WO 96/374679, международной публикации патентной заявки № WO 95/15316, международной публикации патентной заявки № WO 95/15315, международной публикации патентной заявки, № WO, 96/03385, международной патентной заявки № WO 95/00501, международной патентной заявке № WO 94/15932, международной публикации патентной заявке, № WO 95/00501, международной публикации патентной заявки, № WO 94/27980, международной публикации патентной заявки, № WO 96/25405, международной публикации патентной заявки, № WO 96/03388, международной публикации патентной заявки, № WO 96/03387, патенте США № 5344991, международной публикации патентной заявки № WO 95/00501, международной публикации патентной заявки № WO 96/16934, международной публикации патентной заявки № WO 96/03392, международной публикации патентной заявки № WO 96/09304, международной публикации патентной заявки № WO 98/47890, и международной публикации патентной заявки № WO 00/24719.
Содержание любой патентной заявки и, в частности, общие формулы терапевтически активных соединений по пунктам формулы изобретения, и примеры этих соединений приведены здесь в качестве ссылки в полном объеме.
При лечении ДГПЖ альфа-2-дельта лиганды могут быть объединены с соединением, которое замедляет рост предстательной железы. Например, в композиции могут быть объединены альфа-2-дельта лиганд и ингибитор человеческой 5- редуктазы [смотри международную патентную заявку WO 95/28397]. редуктазы [смотри международную патентную заявку WO 95/28397].
Таким образом, дополнительным аспектом настоящего изобретения является применение сочетания альфа-2-дельта лиганда и ингибитора человеческой 5- редуктазы или его фармацевтически приемлемой соли или сольватов для получения лекарственного средства для лечения СНМП, который не является недержанием мочи, связанных с ДГПЖ. редуктазы или его фармацевтически приемлемой соли или сольватов для получения лекарственного средства для лечения СНМП, который не является недержанием мочи, связанных с ДГПЖ.
Настоящее изобретение также относится к продукту, содержащему альфа-2-дельта лиганд и ингибитор человеческой 5- редуктазы, или его фармацевтически приемлемые соли или сольваты, в качестве объединенного препарата для одновременного, отдельного или последовательного применения при лечении СНМП, который не является недержанием мочи, связанных с ДГПЖ. редуктазы, или его фармацевтически приемлемые соли или сольваты, в качестве объединенного препарата для одновременного, отдельного или последовательного применения при лечении СНМП, который не является недержанием мочи, связанных с ДГПЖ.
Предпочтительно СНМП представляет собой частые позывы к мочеиспусканию.
Содержание любой из опубликованных патентных заявок и, в частности, общие формулы терапевтически активных соединений по пунктам формулы изобретения и примеры этих соединений приведены здесь в качестве ссылки в полном объеме.
Применение описанных здесь соединений и сочетаний может иметь преимущество, заключающееся в более высокой эффективности, более длительной продолжительности действия, меньшем количестве побочных эффектов, улучшенной избирательности или других полезных свойств, достигаемых при таком применении, по сравнению с предшествующим уровнем техники при лечении СНМП, связанных с ГМП и/или ДГПЖ, в частности, когда СНМП представляет частые позывы к мочеиспусканию.
Соединения по настоящему изобретению получают способами, хорошо известными специалистам в данной области. В частности, в патентах, патентных заявках и публикациях, указанных выше, каждая из которых приведена здесь в качестве ссылки, проиллюстрированы соединения, которые могут использоваться в сочетании, в фармацевтических композициях, в способах и наборах в соответствии с настоящими изобретениями, и способы получения указанных соединений.
Фармацевтически приемлемые соли соединений, подходящие для использования по изобретению, включают соли добавления кислот и оснований.
Соответствующие соли добавления кислот получают из кислот, которые образуют нетоксические соли. Примеры включают ацетат, аспартат, бензоат, безилат, бикарбонат/карбонат, бисульфат/сульфат, борат, камзилат, цитрат, эдисилат, эсилат, формиат, фумарат, глюцептат, глюконат, глюкуронат, гексафторфосфат, хибензат, гидрохлорид/хлорид, гидробромид/бромид, гидройодид/йодид, изетионат, лактат, малат, малеат, малонат, мезилат, метилсульфат, нафтилат, 2-напзилат, пикотинат, нитрат, оротат, оксалат, пальмитат, памоат, фосфат/гидрофосфат/дигидрофосфат, сахарат, стеарат, сукцинат, тартрат, тозилат и соль трифторуксусной кислоты.
Соответствующие соли основания получают из оснований, которые образуют нетоксические соли. Примеры включают соли алюминия, аргинина, бензатина, кальция, холина, диэтиламина, диоламина, глицина, лизина, магния, меглюмина, оламина, калия, натрия, трометамина и цинка.
Обзор подходящих солей представлен в «Handbook of Pharmaceutical Salts: Properties, Selection, and Use» Stahl Wermuth (Wiley-VCH, Weinheim, Germany, 2002).
Фармацевтически приемлемая соль соединения, которая может использоваться в соответствии с настоящим изобретением может быть легко получена путем смешения раствора соединений и соответствующей желаемой кислоты или основания. Соль, которая может выпасть в осадок из раствора, можно собрать фильтрацией или восстанавлением упариванием растворителя. Степень ионизации этой соли может изменяться от полностью ионизированной до практически неионизированной.
Соединения, подходящие для применения по настоящему изобретению, могут существовать как в нерастворимой, так и в растворимой форме. Термин «сольват» используется здесь для описания молекулярного комплекса, содержащего соединение по изобретению в одной или нескольких молекулах фармацевтически приемлемого растворителя, например этанола. Термин «гидрат» используется, если растворителем является вода.
В рамках изобретения находятся комплексы, такие как хлатраты, комплексы включения препарат-хозяин, где, в противоположность вышеуказанным сольватам, препарат и хозяин находятся в стехиометрическом или нестехиометрическом количествах. Изобретение также включает комплексы препарата, содержащие два или несколько органических и/или неорганических компонента, которые могут быть в стехиометрических или нестехиометрических количествах. Полученные комплексы могут быть ионизированными, частично ионизированными или неионизированными. Обзор таких комплексов представлен в J Pharm Sci, 64 (8), 1269-1288, Haleblian (август 1975).
Все приведенные здесь ссылки соединений, подходящих для применения по настоящему изобретению, включают ссылки на их соли, сольваты и комплексы и сольваты и комплексы их солей.
Соединения, подходящие для применения по настоящему изобретению, включают соединения, определенные выше, их полиморфы, пролекарства и изомеры (включая оптические, геометрические и таутомерные изомеры), как определено здесь и соединения, меченные изотопами.
Как указано, изобретение включает все полиморфы соединений, подходящих для применения по настоящему изобретению, как определено здесь выше.
Также в рамках настоящего изобретения находятся так называемые «пролекарства» соединений, подходящих для применения по настоящему изобретению. Такие определенные производные соединений, подходящих для применения по настоящему изобретению, которые сами могут обладать небольшой или не обладать фармакологической активностью, при введении в или при нанесении на организм могут преобразовываться в соединения с желательной активностью, например, путем гидролиза. Такие производные называются «пролекарствами». Дополнительную информацию по использованию пролекарств можно найти в «Pro-drugs as Novel Delivery Systems, Vol. 14, ACS Symposium Series (T Higuchi and W Stella) and Bioreversible Carriers in Drug Design», Pergamon Press, 1987 (ed. E B Roche, American Pharmaceutical Association).
Пролекарства в соответствии с настоящим изобретением могут, например, быть получены путем замены соответствующих функциональных групп соединений, подходящих для применения по настоящему изобретению, определенными группами, известными специалисту в данной области как «предгруппы», как описано, например, в «Design of Prodrugs», H Bundgaard (Elsevier, 1985).
Некоторые примеры пролекарств в соответствии с изобретением включают:
(i) соединение содержит функциональную группу карбоновой кислоты (-COOH), ее сложного эфира, например, замену водорода на (C1-C8)алкил;
(ii) соединение содержит спиртовую функциональную группу (-OH), его простой эфир, например, замену водорода на (C1-С6)алканоилоксиметил; и
(iii) соединение содержит первичную или вторичную функциональную аминогруппу (-NH2 или -NHR, где R не является H), ее амид, например, замену одного или обоих водородов (C1-C10)алканоилом.
Другие примеры замещающих групп в соответствии с вышеуказанными примерами и примеры других пролекарств могут быть найдены в вышеуказанным ссылках.
Наконец, определенные соединения, подходящие для применения по настоящему изобретению могут сами действовать как пролекарства других соединений, подходящих для применения по настоящему изобретению.
Соединения, подходящие для применения по настоящему изобретению, содержащие один или несколько ассиметричных атомов углерода, могут существовать в виде двух или более стереоизомеров. Если соединение содержит алкенильную или алкениленовую группу, то возможны геометрические изомеры цис/транс (или Z/E). Если соединения содержат, например, кето или оксим группу или ароматическую группу, то может возникать таутомерный изомеризм («таутомеризм»). Отсюда следует, что единичное соединение может обладать более чем одним типом изомеризма.
В рамках настоящего изобретения находятся все стереоизомеры, геометрические изомеры и таутомерные формы соединений, подходящих для применения по настоящему изобретению, как описано выше, включая соединения, обладающие более чем одним типом изомеризма и смеси одного или нескольких из них. Настоящее изобретение также включает все соли добавления кислот или оснований, в которых каунтер-ион является оптически активным, например, D-лактат или L-лизин, или рацемические смеси, например, DL-тартрат или DL-аргинин.
Настоящее изобретение включает все фармацевтически приемлемые соединения, меченные изотопами, подходящие для применения по настоящему изобретению, как описано выше, если один или несколько атомов заменены атомами с одинаковыми атомными номерами, но атомная масса или массовое число отличается от атомной массы или массового числа, обычно существующего в природе.
Примеры изотопов, подходящих для введения в соединения по изобретению, включают изотопы водорода, такие как 2H и 3H, углерода, такие как 11C, 13C и 14C, хлора, такие как 36Cl, фтора, такие как 18F, йода, такие как 123I и 125I, азота, такие как 13N и 15N, кислорода, такие как 15О, 17O и 18O, фосфора, такие как 32P, и серы, такие как 35S.
Фармацевтически приемлемые сольваты в соответствии с изобретением включают сольваты, где растворитель кристаллизации может быть изотопно замещен, например, D2O, d6-ацетон, d6-DMSO.
Соединения по изобретению, предназначенные для фармацевтического применения, могут вводиться как кристаллические или аморфные продукты. Они могут вводиться самостоятельно или в сочетании с одним или несколькими другими соединениями по изобретению или в сочетании с одним или несколькими другими лекарственными препаратами (или с любым их сочетанием). Обычно их вводят в виде композиции в сочетании с одной или несколькими фармацевтически приемлемыми наполнителями. Термин «наполнитель» используется здесь для описания любого ингредиента, отличного от соединения(й) по изобретению. Выбор наполнителя зачастую зависит от факторов, таких как конкретный способ введения, действие наполнителя на растворимость и стабильность, и природу лекарственной формы.
Фармацевтические композиции, подходящие для доставки соединений по настоящему изобретению, и способы их получения хорошо известны специалисту в данной области. Такие композиции и способы их получения могут быть найдены, например, в «Remington's Pharmaceutical Sciences», 19th Edition (Mack Publishing Company, 1995).
Соединения по изобретению могут вводиться перорально. Пероральное введение может включать в себя глотание, так чтобы соединение достигло желудочно-кишечного тракта, или может использоваться защечное или подъязычное введение, при котором соединение попадает в кровоток непосредственно из ротовой полости.
Композиции, подходящие для перорального применения, включают твердые композиции, такие как таблетки, капсулы, содержащие частицы, жидкости или порошки, лепешки (включая лепешки с жидким наполнением), жевательные конфеты, мульти- и наночастицы, гели, твердые растворы, липосомы, пленки (включая мукоадгезивные пленки), вагинальные свечи, спреи и жидкие композиции.
Жидкие композиции включают суспензии, растворы, сиропы и эликсиры. Такие композиции могут использоваться в качестве наполнителей в мягких или твердых капсулах и обычно включают носитель, например воду, этанол, полиэтиленгликоль, пропиленгликоль, метилцеллюлозу или подходящее масло, и один или несколько эмульгирующих агентов и/или суспендирующих агентов. Жидкие композиции могут также быть получены восстановлением твердого продукта, например саше.
Соединения по изобретению могут также использоваться в быстрорастворимой, быстрораспадающейся формах, таких как описаны в Expert Opinion in Therapeutic Patents, 11 (6), 981-986 by Liang and Chen (2001).
В случае лекарственной формы в виде таблетки, в зависимости от дозы, лекарственный препарат может составлять от 1 мас.% до 80 мас.% лекарственной формы, обычно от 5 мас.% до 60 мас.% лекарственной формы. Кроме лекарственного препарата, таблетки обычно содержат дезинтегратор. Примеры дезинтеграторов включают натрий крахмал гликолат, натрий карбоксиметилцеллюлозу, кальций карбоксиметилцеллюлозу, кроскармеллозу натрия, кросповидон, поливинилпирролидон, метилцеллюлозу, микрокристаллическую целлюлозу, гидроксипропилцеллюлозу, замещенную низшим алкилом, крахмал, предварительно клейстеризованный крахмал и натрий альгинат. Обычно дезинтегратор содержит от 1 мас.% до 25 мас.%, предпочтительно, от 5 мас.% до 20 мас.% лекарственной формы.
Связывающие агенты обычно используются для придания свойств склеивания композиции в таблетке. Подходящие связывающие агенты включают микрокристаллическую целлюлозу, желатин, сахара, полиэтиленгликоль, природные и синтетические смолы, поливинилпирролидон, предварительно клейстеризованный крахмал, гидроксипропилцеллюлозу и гидроксипропилметилцеллюлозу. Таблетки могут также содержать разбавители, такие как лактоза (моногидрат, моногидрат, высушенный распылением, безводную лактозу и тому подобное), маннит, ксилит, декстроза, сахароза, сорбит, микрокристаллическая целлюлоза, крахмал и двухосновной кальций фосфат дигидрат.
Таблетки также могут необязательно содержать поверхностно-активные вещества, такие как натрий лаурилсульфат и полисорбат 80, и агенты скольжения, такие как диоксид силикона и тальк. В случае их присутствия, поверхностно-активные вещества могут содержать от 0,2 мас.% до 5 мас.% таблетки, и агенты скольжения могут содержать от 0,2 мас.% до 1 мас.% таблетки.
Таблетки также обычно содержат смачивающие агенты, такие как стеарат магния, стеарат кальция, стеарат цинка, натрий стеарил фумарат и смеси магния стеарата и натрия лаурил сульфата. Смачивающие агенты содержат от 0,25 мас.% до 10 мас.%, предпочтительно, от 0,5 мас.% до 3 мас.% таблетки.
Другими возможными ингредиентами являются антиоксиданты, красители, ароматизаторы, консерванты и исправляющее вкус лекарственного средства вещество.
Примеры таблеток содержат около 80% лекарственного препарата, от около 10 мас.% до около 90 мас.% связывающего агента, от около 0 мас.% до около 85 мас.% разбавителя, от около 2 мас.% до около 10 мас.% дезинтегратора, и от около 0,25 мас.% до около 10 мас.% смачивающего агента.
Таблеточные смеси могут быть спрессованы непосредственно или с помощью барабана с образованием таблетки. Таблеточные смеси или части смесей могут, альтернативно, подвергаться сухому, влажному гранулированию и гранулированию плавлением, плавлению-застыванию и экструдированию перед таблетированием. Окончательная композиция может содержать один или несколько слоев и может быть покрыта или не покрыта; она даже может быть инкапсулирована.
Композиция для таблеток описана в «Pharmaceutical Dosage Forms: Tablets, Vol. 1», H. Lieberman and L. Lachman, Marcel Dekker, N.Y., N.Y., 1980 (ISBN 0-8247-6918-X).
Твердые композиции для перорального введения могут быть получены для немедленного и/или отсроченного высвобождения. Композиции с измененным высвобождением включают композиции с отсроченным, длительным, импульсным, контролируемым, направленным и программируемым высвобождением.
Подходящим образом модифицированные композиции для целей изобретения описаны в патенте США № 6106864. Подробное описание других подходящих способов получения таких композиций, например высокоэнергетичных дисперсий и осмотических и покрытых частиц, могут быть найдены в Verma et al., Pharmaceutical Technology On-line, 25(2), 1-14 (2001). Применение жевательных резинок для обеспечения контролируемого высвобождения описано в WO 00/35298.
Соединения по изобретению могут также вводиться непосредственно в кровоток, в мышцы или во внутренние органы. Подходящие способы для парентерального введения включают внутривенное, внутриартериальное, внутрибрюшинное, интретекальное, внутрижелудочковое, интрауретальное, интрастернальное, внутричерепное, внутримышечное и подкожное. Подходящие устройства для парентерального введения включают игольчатые (включая микроигольчатые) шприцы, безыгольчатые шприцы и способы инфузии.
Парентеральные композиции обычно представляют собой водные растворы, которые могут содержать наполнители, такие как соли, углеводороды и буферные агенты (предпочтительно до pH 3-9), но, в некоторых случаях применения, они могут быть получены с более подходящим рецептурным составом, например, в виде стерильного безводного раствора или в виде сухой формы для применения для соединения с подходящим носителем, таким как стерильная, апирогенная вода.
Получение парентеральных композиций в стерильных условиях, например путем лиофилизации, может быть легко осуществлено, используя стандартные фармацевтические свойства, хорошо известные специалисту в данной области.
Растворимость соединений по настоящему изобретению, используемых при получении парентеральных растворов, может повышаться путем применения соответствующих подходов получения композиций, таких как введение агентов, повышающих растворимость.
Композиции для парентерального введения могут быть получены для немедленного и/или модифицированного высвобождения. Композиции с модифицированным высвобождением включают композиции с отсроченным, длительным, импульсным, контролируемым, направленным и программируемым высвобождением. С такими соединениями по изобретению могут быть получены твердые, полутвердые композиции или тиксотропные жидкие композиции для введения в виде имплантируемого депо, обеспечивающего модифицированное высвобождение активного соединения. Примеры таких композиций включают стенты, покрытые лекарственным препаратом, и микросферы PGLA.
Соединения по изобретению могут также применяться местно на коже или слизистой, то есть кожно или чрескожно. Обычные композиции для этой цели включают гели, гидрогели, лосьоны, растворы, кремы, мази, опудривающее средство, повязки, пены, пленки, кожные пластыри, облатки, имплантанты, губки, волокна, бандажи и микроэмульсии. Также могут использоваться липосомы. Обычные носители включают спирт, воду, минеральное масло, жидкий вазелин, белый вазелин, глицерин, полиэтиленгликоль и пропиленгликоль. В композицию могут вводиться вещества, способствующие проникновению, см., например, J Pharm Sci, 88 (10), 955-958, Finnin and Morgan (October 1999).
Другие способы местного применения включают доставку электропорацией, ионофорезом, фонофорезом, сонофорезом и шприцами с микроиголками или безигольными шприцами (например Powderject , Bioject , Bioject и тому подобное). и тому подобное).
Композиции для местного введения могут быть получены для немедленного и/или модифицированного высвобождения. Композиции для модифицированного высвобождения включают композиции с отсроченным, длительным, импульсным, контролируемым, направленным и программируемым высвобождением.
Соединения по изобретению могут также вводиться интраназально или ингаляционно, обычно в форме сухого порошка (либо самостоятельно, либо в смеси, например, в сухой смеси с лактозой, или в виде смеси частиц компонентов, например, в смеси с фосфолипидами, например, фосфатидилхолином) из ингалятора для сухого порошка или в виде аэрозольного спрея из контейнера, в котором он находится под давлением, насоса, срея, пульверизатора (предпочтительно, пульверизатора с использованием электрогидродинамической аппаратуры с получением мелкой пыли), или распылителя, с или без применения подходящего пропеллента, такого как 1,1,1,2-тетрафторэтана или 1,1,1,2,3,3,3-гептафторпропана.
Для интраназального применения порошок может содержать биоадгезивный агент, например хитозан или циклодекстрин.
Контейнер, в котором смесь находится под давлением, насос, спрей, распылитель или пульверизатор содержит раствор или суспензию соединения(й) по изобретению, содержащий, например, этанол, водный этанол или подходящий альтернативный агент для диспергирования, растворения или увеличения высвобождения активного вещества, пропеллента(ов) в качестве растворителя и, необязательно, поверхностно-активного вещества, такого как триолеат сорбита, олеиновая кислота или олигомолочная кислота.
Перед использованием в композиции сухого порошка или суспензии лекарственное средство тонкоизмельчают до размера, подходящего для доставки ингалятором (обычно менее 5 микрон). Это может быть достигнуто любым соответствующим способом измельчения, таким как спиральное измельчение, измельчение в псевдосжиженном слое, обработка сверхкритической жидкости с получением наночастиц, гомогенизация в высоком давлении или сушка распылением.
Рецептурная смесь для капсул (получение, например, из желатина или HPMC), блистеров и картриджей для использования в ингаляторах или инсуффляторе может содержать порошковую смесь соединения по изобретению, подходящее порошковое основание, такое как лактоза или крахмал и модификатор свойств, такой как l-лейцин, маннит или стеарат магния. Лактоза может быть безводной или образовывать моногидрат, последний является предпочтительным. Другие подходящие наполнители включают дестран, глюкозу, мальтозу, сорбит, ксилит, фруктозу, сахарозу и трегалозу.
Рецептурный состав подходящего раствора для применения в пульверизаторе с электрогидродинамическими аппаратами для получения мелкой пыли может содержать от 1 мкг до 20 мг соединения по изобретению на пшик, и объем пшика может изменяться от 1 мкл до 100 мкл. Обычная композиция может содержать соединение по изобретению пропиленгликоль, стерильную воду, этанол и хлорид натрия. Другие варианты растворителей, которые могут использоваться вместо пропиленгликоля, включают глицерин и полиэтиленгликоль.
В композиции по изобретению, предназначенные для ингаляционного/интраназального введения, могут быть добавлены подходящие вкусовые добавки, такие как ментол и левоментол или подсластители, такие как сахарин или сахарин натрия.
Композиции для ингаляционного/интраназального введения могут быть получены для незамедлительного и/или модифицированного высвобождения, используя, например, поли(DL)-молочную-когликолевую кислоту (PGLA).
Композиции с измененным высвобождением включают композиции с отсроченным, длительным, импульсным, контролируемым, направленным и программируемым высвобождением.
Соединения по изобретению могут быть введены ректально или вагинально, например, в виде свечей, пессарий или клизмой. Масло какао является обычной основой для свечей, однако могут использоваться различные подходящие альтернативы.
Композиции для ректального/вагинального введения могут быть получены для незамедлительного и/или модифицированного высвобождения. Композиции с измененным высвобождением включают композиции с отсроченным, длительным, импульсным, контролируемым, направленным и программируемым высвобождением.
Соединения по изобретению могут также вводиться непосредственно в глаз или ухо, обычно в виде капель тонкодисперстной суспензии или раствора в изотоническом, pH-установленном, стерильном физиологическом растворе. Другие композиции, подходящие для глазного и ушного введения, включают мази, биодеградируюмые (например, рассасывающиеся гелевые тампоны, коллагеновые) и небиодеградируемые (например, силиконовые) имплантаты, облатки, линзы и системы, состоящие из частиц или везикул, такие как ниосомы или липосомы. Полимер, такой как поперечносвязанная полиакриловая кислота, поливиниловый спирт, гиалуроновая кислота, целлюлозный полимер, например гидроксипропилметилцеллюлоза, гидроксиэтилцеллюлоза, или метилцеллюлоза, или гетерополисахаридный полимер, например гелановая смола, может быть включен вместе с консервантом, таким как бензалконий хлорид. Такие композиции могут также быть доставлены с помощью ионофореза.
Композиции для глазного/ушного введения могут быть получены для незамедлительного и/или модифицированного высвобождения. Композиции с измененным высвобождением включают композиции с отсроченным, длительным, импульсным, контролируемым, направленным и программируемым высвобождением.
Соединения по изобретению могут быть объединены с растворимыми макромолекулярными веществами, такими как циклодекстрин и его подходящие производные или полимеры, содержащие полиэтиленгликоль, для улучшения их растворимости, скорости растворения, улучшения вкуса, биодоступности и/или стабильности для использования в любом вышеуказанном пути введения.
Было обнаружено, что комплексы, например содержащие лекарственный препарат и циклодекстрин, обычно используются в большинстве лекарственных форм и путях введения. Могут использоваться оба типа комплексов включения и не включения. В качестве варианта непосредственного комплекса образования с лекарственным препаратом в качестве дополнительной добавки, то есть в качестве носителя, растворителя или солюбилизирующего агента может использоваться циклодекстрин. Для этих целей наиболее часто используется альфа-, бета-, и гамма-циклодекстрины, примеры которых можно найти в международных патентных заявках WO 91/11172, WO 94/02518 и WO 98/55148.
Поскольку, например, для лечения определенных заболеваний или состояний может быть желательным введение сочетания активных соединений, то в рамках настоящего изобретения две или более фармацевтических композиций, по крайней мере, одно из которых содержит соединение по изобретению, могут быть подходящим образом объединены с образованием набора для одновременного введения композиций.
Таким образом, набор по изобретению содержит две или несколько отдельных композиций, по крайней мере одна из которых содержит соединение, описанное в настоящем изобретении, и приспособление для раздельного хранения указанных композиций, таких как контейнер, разделенная бутылочка или разделенный пакет из фольги. Примером такого набора является широко используемая блистерная упаковка, используемая для упаковки таблеток, капсул и тому подобное.
Набор по изобретению обычно подходит для введения различных лекарственных форм, например пероральных или парентеральных, для введения отдельных композиций с различными интервалами введения или для титрования отдельных композиций друг против друга. Для удобства, набор обычно включает руководства для введения и может включать так называемую памятку.
Во избежание неопределенности, при указании «лечения» оно включает лечебное, паллиативное и профилактическое лечение.
Химические примеры:
Пример 1:
1-Трет-бутиловый эфир 2-метиловый эфир (2S,4S)-4-(3-хлорфенокси)пирролидин-1,2-дикарбоновой кислоты
К перемешиваемому раствору 1-трет-бутилового эфира 2-метилового эфира (2S,4R)-4-гидроксипирролидин-1,2-дикарбоновой кислоты (CAS Reg 74844-91-0) (6,1 кг, 24,87 моль), 3-хлорфенола (3,52 кг, 27,39 моль) и трифенилфосфина (7,18 кг, 27,37 моль) в трет-бутил метиловом эфире (30,5 л) при 0°C по каплям добавляли диизопропилазодикарбоксилат (5,53 кг, 27,35 моль) в трет-бутилметиловом эфире (15 л). Смесь перемешивали в течение ночи при 20°C. Реакционную смесь фильтровали и жидкость промывали 0,5M гидроксидом натрия (вод.) (2x12,5 л) и водой (12,2 л). Растворитель трет-бутилметиловый эфир заменяли на н-гептан (42,7 л) с помощью дистилляции при атмосферном давлении и охлаждали для кристаллизации сырого продукта, который собирали фильтрацией (11,1 кг, 125% объединенные с 35% восстановленным диизопроилдикарбоксилатом и оксидом трифенилфосфина - уточненный выход = 86%).
1H ЯМР (400 МГц, CDCl3):  = 1,46, 1,49 (2 x с, 9H), 2,47 (2H, м), 3,71 (5H, м), 4,42 (1H, м), 4,42, 4,54 (1H, 2 x м), 4,87 (1H, м), 6,68 (1H, м), 6,79 (1H, с), 6,92 (1H, м), 7,18 (1H, м). = 1,46, 1,49 (2 x с, 9H), 2,47 (2H, м), 3,71 (5H, м), 4,42 (1H, м), 4,42, 4,54 (1H, 2 x м), 4,87 (1H, м), 6,68 (1H, м), 6,79 (1H, с), 6,92 (1H, м), 7,18 (1H, м).
LRMS (Электрораспыление): m/z 378 (MNa+).
1-Трет-бутиловый эфир (2S,4S)-4-(3-хлорфенокси)пирролидин-1,2-дикарбоновой кислоты
К 1-трет-бутиловому эфиру 2-метиловому эфиру (2S,4S)-4-(3-хлорфенокси)пирролидин-1,2-дикарбоновой кислоты (11,1 кг, 20,28 моль) в ТГФ (26,6 л) добавляли раствор LiOH·H2O (4,86 кг, 115,4 моль) в воде (55,5 л). Смесь перемешивали в течение ночи при 25°C. ТГФ удаляли дистилляцией и полученный водный раствор экстрагировали дихлорметаном (33,3 л и 16,7 л). Объединенные слои дихлорметана экстрагировали водой (33 л и 16,7 л). Объединенную водную фазу доводили до pH 3-3,5 с помощью 1M соляной кислоты (водный раствор) и экстрагировали дихлорметаном (2x22,2 л). Объединенные фазы дихлорметана заменяли на толуол (33,3 л), который охлаждали для кристаллизации продукта, который собирали фильтрацией (6,1 кг, 98%).
1H ЯМР (400 МГц, CDCl3):  1,42, 1,48 (2 x с, 9H), 2,30-2,70 (м, 2H), 3,60-3,80 (м, 2H), 4,40-4,60 (м, 1H), 4,86 (м, 1H), 6,71 (м, 1H), 6,82 (м, 1H), 6,94 (м, 1H), 7,16 (м, 1H). 1,42, 1,48 (2 x с, 9H), 2,30-2,70 (м, 2H), 3,60-3,80 (м, 2H), 4,40-4,60 (м, 1H), 4,86 (м, 1H), 6,71 (м, 1H), 6,82 (м, 1H), 6,94 (м, 1H), 7,16 (м, 1H).
LRMS (Электрораспыление): m/z [MNa+] 364, 340 [M-1] 340.
(2S,4S)-4-(3-Хлорфенокси)пирролидин-2-карбоновая кислота (XXVIII)
Раствор 1-трет-бутилового эфира (2S,4S)-4-(3-хлорфенокси)пирролидин-1,2-дикарбоновой кислоты (29,25 моль) растворяли в ТГФ (20 л) и фильтровали. К этому раствору добавляли 4M HCl в диоксане (30 л) и перемешивали в течение ночи. К полученной суспензии добавляли трет-бутил метиловый эфир (70 л) и продукт собирали фильтрацией (7,06 кг, 86,7%).
1H ЯМР (400 МГц, CD3OD):  = 2,65 (м, 2H), 3,60 (дд, 1H), 3,70 (д, 1H), 4,60 (дд, 1H), 5,02 (м, 1H), 6,88 (м, 1H), 6,97 (с, 1H), 7,03 (д, 1H), 7,29 (дд, 1H). = 2,65 (м, 2H), 3,60 (дд, 1H), 3,70 (д, 1H), 4,60 (дд, 1H), 5,02 (м, 1H), 6,88 (м, 1H), 6,97 (с, 1H), 7,03 (д, 1H), 7,29 (дд, 1H).
LRMS (Электрораспыление) [MH+] 242, [M-1] 240.
Микроанализ для С11Н12ClNO3·HCl 0,1 H2O:
Найдено: C 46,97; H 4,70; N 4,90.
Вычислено: C 47,20; H 4,75; N 5,00.
Пример 2:
1-Трет-бутиловый эфир 2-(2-изопропил-5-метилциклогексил)эфир 4-(3-фторбензил)пирролидин-1,2-дикарбоновой кислоты
1-Трет-бутиловый эфир 2-(2-изопропил-5-метилциклогексил)эфир 4-(3-фторбензилиден)пирролидин-1,2-дикарбоновой кислоты (1,20 г, 2,61 ммоль) растворяли в смеси этилацетат:толуол (1:1, 12 мл). Раствор подвергали гидрированию на оксиде платины (120 мг, 10% по массе) при 25°C и 15 фунт/кв.дюйм в течение 1 часа. Реакционную смесь фильтровали через волокна целлюлозы «Arbocel» и фильтрат восстанавливали под давлением. Осадок очищали флэш-хроматографией («Flashmaster»), элюируя гептаном:этилацетатом (15:1) с выходом соединения, указанного в заголовке в виде бесцветного масла (1,11 г, 91%).
1H ЯМР (400 МГц, CD3OD):  = 0,72-1,37 (м, 13 H), 1,44 (д, 9H), 1,43-1,75 (м, 4H), 1,87-2,01 (м, 2H), 2,31-2,58 (м, 2H), 2,83 (д, 2H), 3,07 (т, 1H), 3,50-3,65 (м, 1H), 4,13-4,30 (дт, 1H), 4,71 (тд, 1H), 6,90 (д, 2H), 7,00 (д, 1H), 7,30 (кв, 1H). = 0,72-1,37 (м, 13 H), 1,44 (д, 9H), 1,43-1,75 (м, 4H), 1,87-2,01 (м, 2H), 2,31-2,58 (м, 2H), 2,83 (д, 2H), 3,07 (т, 1H), 3,50-3,65 (м, 1H), 4,13-4,30 (дт, 1H), 4,71 (тд, 1H), 6,90 (д, 2H), 7,00 (д, 1H), 7,30 (кв, 1H).
LRMS (APCI): m/z [MH-BOC]+ 362.
Моногидрохлоридная соль (2S,4S)-4-(3-фторбензил)пирролидин-2-карбоновой кислоты (XXIX)
1-Трет-бутиловый эфир 2-(2-изопропил-5-метилциклогексил)эфир 4-(3-фторбензил)пирролидин-1,2-дикарбоновой кислоты (0,91 г, 1,96 ммоль) растворяли в толуоле (2 мл). Добавляли 6 н. хлористоводородную кислоту (50 мл) и перемешивали при кипячении с обратным холодильником в течение 18 часов. Реакционную смесь охлаждали до комнатной температуры и экстрагировали этилацетатом (3x20 мл). Водный слой концентрировали, упаривая при пониженном давлении с получением соединения, указанного в заголовке (417 мг, 81 %), в виде белого твердого вещества. С помощью 1H-ЯМР было показано, что соотношение цис:транс диастереоизомеров составляет 7:1, поэтому продукт перекристаллизовывали из изопропилового спирта с получением соединения, указанного в заголовке (170 мг, 65%) с соотношением цис:транс, равным 14:1, определенным с помощью ЯМР.
1H-ЯМР (400 МГц, CD3OD): (смесь диастереомеров 2S,4S:2S,4R (14:1)): 1,85 (кв, 1H), 2,51 (квин, 1H), 2,69-2,85 (м, 3H), 3,07 (т, 1H), 3,41 (дд, 1H), 4,38 и 4,48 (т, 1H), 6,90-7,04 (м, 3H), 7,32 (кв, 1H).
LRMS (APCI): m/z [MH]+ 224.
[a]D 25-1,27° (c=9,00 в метаноле).
Микроанализ для C12H14FNO2·HCl:
Найдено: C 55,56; H 5,81; N 5,34%.
Вычислено: C 55,50; H 5,82; N 5,39%.
Пример 3:
1-Трет-бутиловый эфир 2-(2-изопропил-5-метилциклогексил)эфир 4-(3-фторбензил)пирролидин-1,2-дикарбоновой кислоты
1-Трет-бутиловый эфир 2-(2-изопропил-5-метилциклогексил)эфир 4-(3-фторбензил)пирролидин-1,2-дикарбоновой кислоты получали способом, аналогичным способу получения 1-трет-третбутилового эфира 2-(2-изопропил-5-метилциклогексил)эфира 4-(3-фторбензил)пирролидин-1,2-дикарбоновой кислоты, используя соответствующий исходный продукт, алкениловый ментоловый эфир; [MH]480
Микроанализ C27H39·F2NO4 (смесь диастереомеров цис (основной) и транс):
Найдено: C 67,74; H 8,30; N 2,90%.
Вычислено: C 67,62; H 8,20; N 2,92%;
[ ]D 25 -71,92° (c = 3,26 в метаноле) ]D 25 -71,92° (c = 3,26 в метаноле)
Моногидрохлоридная соль (2S,4S)-4-(2,3-дифторбензил)пирролидин-2-карбоновой кислоты (XXX)
Соединение, указанное в заголовке, получали способом, описанным в примере 2, используя в качестве исходного продукта 1-трет-бутиловый эфир 2-(2-изопропил-5-метилциклогексил)эфир 4-(3-фторбензил)пирролидин-1,2-дикарбоновой кислоты, и очищали перекристаллизацией с ацетоном/простым эфиром с получением соединения, указанного в заголовке в виде смеси диастереоизомеров (2S,4S:2S,4R (12:1)), как было определено с помощью 1H-ЯМР (500 мг, 60 %), в виде белого твердого продукта.
1H-ЯМР (400 МГц, CD3OD) (смесь диастереоизомеров цис/транс (12:1)): 0,80-1,90 (м, 0,92H), 2,12-2,20 (м, 0,08H), 2,28-2,36 (м, 0,08H), 2,49-2,58 (кв, 0,92H), 2,66-2,81 (м, 1H), 2,83-2,95 (м, 2H), 3,02-3,13 (т, 1H), 3,46 (дд, 1H), 4,40 (дд, 0,92H), 4,48-4,54 (м, 0,08H), 7,03-7,20 (м, 3H). 0,80-1,90 (м, 0,92H), 2,12-2,20 (м, 0,08H), 2,28-2,36 (м, 0,08H), 2,49-2,58 (кв, 0,92H), 2,66-2,81 (м, 1H), 2,83-2,95 (м, 2H), 3,02-3,13 (т, 1H), 3,46 (дд, 1H), 4,40 (дд, 0,92H), 4,48-4,54 (м, 0,08H), 7,03-7,20 (м, 3H).
LRMS (Электрораспыление): m/z [M + H]+ 242.
Микроанализ для С12H13NO2F2·HCl:
Найдено: C 51,42; H 5,08; N 5,01%.
Вычислено: C 51,90; H 5,08; N 5,04%.
Пример 4:
1,2-Ди-трет-бутиловый эфир (2S,4S)-пирролидин-1,2,4-трикарбоновой кислоты
К смеси ди-трет-бутилового эфира 4-фенилпирролидин-1,2-дикарбоновой кислоты (CAS Reg. No. 344 286-69-7; J. Org. Chem., 2001, 3593-3596) (0,78 г, 2,24 ммоль) и периодата натрия (5,77 г, 27 ммоль), перемешиваемой при 0°C в атмосфере азота в этилацетате (5,5 мл), ацетонитриле (5,5 мл) и воды (8,5 мл) добавляли трихлорид рутения (10 мг, 0,05 ммоль) и перемешивали при комнатной температуре в течение 18 часов. Добавляли диэтиловый эфир (20 мл) и перемешивали еще 1 час. Добавляли 1M хлористоводородную кислоту (5 мл) и смесь экстрагировали этилацетатом (3x30 мл). Органические экстракты объединяли, сушили (MgSO4), фильтровали и упаривали при пониженном давлении. Осадок очищали хроматографией на силикагеле, элюируя смесью 50:50:1 этилацетата:гептана:ледяной уксусной кислоты с получением соединения, указанного в заголовке, в виде бесцветной смолы (501 мг, 78%).
1H-ЯМР (400 МГц, CDCl3):  = 1,40-1,49 (м, 18H); 2,26-2,40 (м, 1H); 2,42-2,56 (м, 1H); 3,02-3,12 (м, 1H); 3,65-3,80 (м, 1,4H) и 3,80-3,88 (м, 0,6H) [ротамеры]; 4,09-4,20 (м, 0,7H) и 4,20-4,26 (м, 0,3H) [ротамеры]. = 1,40-1,49 (м, 18H); 2,26-2,40 (м, 1H); 2,42-2,56 (м, 1H); 3,02-3,12 (м, 1H); 3,65-3,80 (м, 1,4H) и 3,80-3,88 (м, 0,6H) [ротамеры]; 4,09-4,20 (м, 0,7H) и 4,20-4,26 (м, 0,3H) [ротамеры].
LRMS (электрораспыление): [M-1] 314.
(2S,4S)-4-(3-Фторфеноксиметил)пирролидин-2-карбоновой кислоты (XXI)
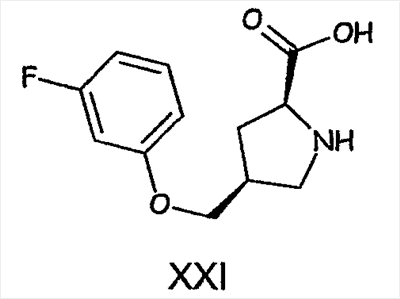
Ди-трет-бутиловый эфир 4-(3-фторфеноксиметил)пирролин-1,2-дикарбоновой кислоты (475 мг, 1,2 ммоль) растворяли в растворе безводного хлористого водорода в диоксане (4M, 15 мл) и перемешивали при 50°C в атмосфере азота в течение 1 часа. Растворитель удаляли при пониженном давлении и полученный полутвердый продукт растирали в порошок с этилацетатом с получением твердого белого продукта, который перекристаллизовывали из этилацетата/изопропилового спирта с получением соединения, указанного в заголовке, в виде смеси диастереомеров (˜5:1 2S,4S:2S,4R) в виде белого гидрохлорида (90 мг, 35%).
1H-ЯМР (400 МГц, CD3OD):  =2,04-2,09 (м, 0,8H); 2,33-2,47 (м, 0,4H); 2,65-2,75 (м, 0,8H); 2,88-3,00 (м, 1H); 3,33-3,40 (м, 1H); 3,52-3,60 (м, 0,8H); 3,60-3,68 (0,2H); 3,96-4,04 (м, 1H); 4,04-4,12 (м, 1H); 4,42-4,51 (м, 0,8H); 4,40-4,56 (м, 0,2H); 6,65-6,80 (м, 3H), 7,21-7,30 (м, 1H). =2,04-2,09 (м, 0,8H); 2,33-2,47 (м, 0,4H); 2,65-2,75 (м, 0,8H); 2,88-3,00 (м, 1H); 3,33-3,40 (м, 1H); 3,52-3,60 (м, 0,8H); 3,60-3,68 (0,2H); 3,96-4,04 (м, 1H); 4,04-4,12 (м, 1H); 4,42-4,51 (м, 0,8H); 4,40-4,56 (м, 0,2H); 6,65-6,80 (м, 3H), 7,21-7,30 (м, 1H).
LRMS (электрораспыление): [M+1] 240; [M+23] 262; [M-1] 238.
Пример 5:
Гидрохлорид (R)-2,6-диметилнон-2-ена (3S,5R)-3-амино-5-метилоктановой кислоты
К (S)-цитронеллил бромиду (50 г, 0,228 моль) в ТГФ (800 мл) при 0°C добавляли LiCl (4,3 г), а затем CuCl2 (6,8 г). Через 30 минут добавляли хлорид метилмагния (152 мл 3M раствора в ТГФ, Aldrich) и раствор нагревали до комнатной температуры. Через 10 часов раствор охлаждали до 0°C и осторожно добавляли насыщенный водный раствор хлорида аммония. Полученные два слоя разделяли и водную фазу экстрагировали простым эфиром. Объединенные органические фазы сушили (MgSO4) и концентрировали с получением (R)-2,6-диметилнон-2-ена, 32,6 г; 93%. Использовали без дополнительной очистки.
1H-ЯМР (400 МГц, CDCl3):  5,1 (м, 1H), 1,95 (м, 2H), 1,62 (с, 3H), 1,6 (с, 3H), 1,3 (м, 4H), 1,2 (м, 2H), 0,8 (с, 6H). 5,1 (м, 1H), 1,95 (м, 2H), 1,62 (с, 3H), 1,6 (с, 3H), 1,3 (м, 4H), 1,2 (м, 2H), 0,8 (с, 6H).
(R)-4-Метилгептановая кислота
К (R)-2,6-диметилнон-2-ену (20 г, 0,13 моль) в ацетоне (433 мл) добавляли раствор CrO3 (39 г, 0,39 моль) в H2SO4 (33 мл)/H2O (146 мл) в течение 50 минут. Через 6 часов добавляли дополнительное количество CrO3 (26 г, 0,26 моль) в H2SO4 (22 мл)/H2O (100 мл). Через 12 часов раствор разбавляли насыщенным солевым раствором и раствор экстрагировали простым эфиром. Объединенные органические фазы сушили (MgSO4) и концентрировали. Флэш-хроматография (градиент от 6:1 до 2:1 гексан/EtOAc) давала (R)-4-метилгептановую кислоту в виде масла, 12,1 г; 65%. MS, m/z (относительная интенсивность): 143 [M-H, 100%].
(4R,5S)-4-Метил-3-((R)-4-метилгептаноил)-5-фенилоксазолидин-2-он
К (R)-4-метилгептановой кислоте (19 г, 0,132 моль) и триэтиламину (49,9 г, 0,494 моль) в ТГФ (500 мл) при 0°C добавляли триметилацетилхлорид (20 г, 0,17 моль). Через 1 час LiCl (7,1 г, 0,17 моль) добавляли после (4R,5S)-(+)-4-метил-5-фенил-2-оксазолидининон) 3 (30 г, 0,17 моль). Смесь нагревали до комнатной температуры и через 16 часов фильтрат удаляли фильтрацией и раствор концентрировали при пониженном давлении. Флэш-хроматография (7:1 гексан/EtOAc) давала (4R,5S)-4-метил-3-((R)-4-метилгептаноил)-5-фенилоксазолидин-2-он в виде масла, 31,5 г; 79%. [ ]D=+5,5 (c 1 в CHCl3). MS, m/z (относительная интенсивность): 304 [M+H, 100%]. ]D=+5,5 (c 1 в CHCl3). MS, m/z (относительная интенсивность): 304 [M+H, 100%].
Трет-бутиловый эфир (3S,5R)-5-метил-3-((4R,5S)-4-метил-2-оксо-5-фенилоксазолидин-3-карбонил)октановой кислоты
К (4R,5S)-4-метил-3-((R)-4-метилгептаноил)-5-фенилоксазолидин-2-ону (12,1 г, 0,04 моль) в ТГФ (200 мл) при -50°C добавляли бис(триметилсилил)амид натрия (48 мл 1M раствора в ТГФ). Через 30 минут добавляли трет-бутилбромацетат (15,6 г, 0,08 моль). Раствор перемешивали в течение 4 часов при -50°C и затем нагревали до комнатной температуры. Через 16 часов добавляли насыщенный водный раствор хлорида аммония и два слоя разделяли. Водную фазу экстрагировали простым эфиром и объединенные органические фазы сушили (MgSO4) и концентрировали. Флэш-хроматография (9:1 гексан/EtOAc) давала трет-бутиловый эфир (3S,5R)-5-метил-3-((4R,5S)-4-метил-2-оксо-5-фенилоксазолидин-3-карбонил)октановой кислоты в виде белого твердого продукта 12 г; 72%. [ ]D=+30,2 (c 1 в CHCl3). ]D=+30,2 (c 1 в CHCl3).
13C ЯМР (100 МГц; CDCl3)  176,47, 171,24, 152,72, 133,63, 128,87, 125,86, 80,85, 78,88, 55,34, 39,98, 38,77, 38,15, 37,58, 30,60, 28,23, 20,38, 20,13, 14,50, 14,28. 176,47, 171,24, 152,72, 133,63, 128,87, 125,86, 80,85, 78,88, 55,34, 39,98, 38,77, 38,15, 37,58, 30,60, 28,23, 20,38, 20,13, 14,50, 14,28.
4-Трет-бутиловый эфир (S)-2-((R)-2-метилпентил)янтарной кислоты
К трет-бутиловому эфиру (3S,5R)-5-метил-3-((4R,5S)-4-метил-2-оксо-5-фенилоксазолидин-3-карбонил)октановой кислоты (10,8 г, 0,025 моль) в H2O (73 мл) и ТГФ (244 мл) при 0°C добавляли заранее перемешанный раствор LiOH (51,2 мл 0,8 M раствора) и H2О2 (14,6 мл 30% раствора). Через 4 часа добавляли дополнительные 12,8 мл LiOH (0,8 M раствор) и 3,65 мл Н2О2 (30% раствор). Через 30 минут добавляли бисульфит натрия (7 г), сульфит натрия (13 г) и воду (60 мл), а затем добавляли гексан (100 мл) и простой эфир (100 мл). Два слоя разделяли и водный слой экстрагировали простым эфиром. Объединенные органические фазы концентрировали до масла, затем растворяли в гептане (300 мл). Полученный твердый продукт отфильтровали и фильтрат сушили (MgSO4) и концентрировали с получением 4-трет-бутилового эфира (S)-2-((R)-2-метилпентил)янтарной кислоты (6 г, 93%), которую использовали сразу, без дополнительной очистки. MS, m/z (относительная интенсивность): 257 [M+H, 100%].
Трет-бутиловый эфир (3S,5R)-3-бензиоксикарбониламино-5-метилоктановой кислоты
Раствор 4-трет-бутилового эфира (S)-2-((R)-2-метил-пентил)янтарной кислоты (6,0 г, 23,22 ммоль) и триэтиламина (3,64 мл, 26,19 ммоль) в толуоле (200 мл) обрабатывали азидом дифенилфосфорила (5,0 мл, 23,22 мл) и перемешивали при комнатной температуре в течение 0,5 часов. После кипячения реакционной смеси с обратным холодильником в течение 3 часов и быстрого охлаждения, добавляли бензиловый спирт (7,2 мл, 69,7 ммоль) и раствор нагревали еще 3 часа. После того как реакционную смесь охлаждали, ее разбавляли этиловым эфиром (200 мл) и объединенный органический слой последовательно промывали насыщенным NaHCO3 и насыщенным солевым раствором и сушили (Na2SO4). Концентрированный органический компонент очищали хроматографией (MPLC), элюируя смесью 8:1 гексана:этилацетата с получением трет-бутилового эфира (3S,5R)-3-бензиоксикарбониламино-5-метилоктановой кислоты (6,4 г, 75,8%). MS: M+1: 364,2, 308,2.
Трет-бутиловый эфир (3S,5R)-3-амино-5-метилоктановой кислоты
Раствор трет-бутилового эфира (3S,5R)-3-бензиоксикарбониламино-5-метилоктановой кислоты (2,14 г, 5,88 ммоль) в ТГФ (50 мл) обрабатывали Pd/C (0,2 г) и H2 при 50 фунт/кв.дюйм в течение 2 часов. Реакционную смесь затем фильтровали и концентрировали до масла в вакууме с получением трет-бутилового эфира (3S,5R)-3-амино-5-метилоктановой кислоты с количественным выходом. MS: M+1: 230,2, 174,1.
Гидрохлорид (3S,5R)-3-амино-5-метилоктановой кислоты
Взвесь трет-бутилового эфира (3S,5R)-амино-5-метилоктановой кислоты (2,59 г, 11,3 ммоль) в 6н HCl (100 мл) кипятили с обратным холодильником в течение 18 часов, охлаждали и фильтровали через целит. Фильтрат концентрировали в вакууме до 25 мл и полученные кристаллы собирали и сушили с получением гидрохлорида (3S,5R)-3-амино-5-метилоктановой кислоты, т.пл. 142,5-142,7°C (1,2 г, 50,56%). Второй выход (0,91 г) получали из фильтрата.
Для C9H19NO2·HCl:
Вычислено: C 51,55, H 9,61, N 6,68, Cl 16,91.
Найдено: C 51,69, H 9,72, N 6,56, Cl 16,63.
Гидрохлорид (3S,5R)-3-амино-5-метилоктановой кислоты
4-Трет-бутиловый эфир 2S-(2R-метилпентил)янтарной кислоты (5,3 г), содержащийся в 30 мл метил трет-бутилового эфира взаимодействовал при комнатной температуре с 3,5 мл триэтиламином, а затем с дифенилфосфорилазидом (6,4 г). После достижения реакционной смеси экзотермической точки при 45°C и перемешивания в течение по меньшей мере 4 часов, реакционную смесь оставляли охлаждаться до комнатной температуры и оставляли разделяться на фазы. Нижний слой удаляли, а верхний слой промывали водой, а затем разбавленным водным раствором HCl. Самый нижний слой затем объединяли с 10 мл 6 н. водным раствором HCl, и перемешивали при 45-65°C. Реакционную смесь концентрировали дистилляцией в вакууме до около 10-14 мл и оставляли кристаллизоваться при охлаждении до около 5°C. После получения продукта фильтрации, продукт промывали толуолом и ресуспенидровали в толуоле. Продукт сушили нагреванием в вакуум с получением 2,9 г (67%) белого кристаллического продукта. Продукт может быть перекристаллизован из водной HCl. Т.пл. 137°C.
Пример 6:
(S)-3,7-диметил-окт-6-ениловый эфир метансульфоновой кислоты
К S-(-)-цитронеллолу (42,8 г, 0,274 моль) и триэтиламину (91 мл, 0,657 моль) в CH2Cl2 (800 мл) при 0°C добавляли хлорид метансульфонила (26 мл, 0,329 моль) в CH2Cl2 (200 мл). Через 2 часа при 0°C раствор промывали 1 н. HCl, затем насыщенным солевым раствором. Органическую фазу сушили (MgSO4) и концентрировали с получением соединения, указанного в заголовке в виде масла (60,5 г, 94%), которое затем использовали без дополнительной очистки. MS, m/z (относительная интенсивность): 139 [100%], 143 [100%].
(R)-2,6-Диметил-окт-2-ен
К (S)-3,7-диметил-окт-6-ениловому эфиру метансульфоновой кислоты (60 г, 0,256 моль) в ТГФ (1 л) при 0°C добавляли алюмогидрид лития (3,8 г, 0,128 моль). Через 7 часов, добавляли еще 3,8 г алюмогидрида лития и раствор нагревали до комнатной температуры. Через 18 часов добавляли еще 3,8 г алюмогидрида лития. Еще через 21 час реакционную смесь аккуратно гасили 1 н. лимонной кислотой и раствор еще раз разбавляли насыщенным солевым раствором. Две полученные фазы разделяли и органическую фазу сушили (MgSO4) и концентрировали с получением соединения, указанного в заголовке в виде масла, которое затем использовали без дополнительной очистки. MS, m/z (относительная интенсивность): 139 [M+H, 100%].
(R)-4-Метилгексановая кислота
Использовали способ, аналогичный способу синтеза (R)-4-метилгептановой кислоты, с получением кислоты, указанной в заголовке, в виде масла (9,3 г, 56%). MS, m/z (относительная интенсивность): 129 [M-H, 100%].
(4R,5S)-4-Метил-3-((R)-4-метилгексаноил)-5-фенилоксазолидин-2-он
Использовали способ, аналогичный способу синтеза (4R,5S)-4-метил-3-((R)-4-метилгептаноил)-5-фенилоксазолидин-2-она, с получением соединения, указанного в заголовке, в виде масла (35,7 г, 95%). MS, m/z (относительная интенсивность): 290 [M+H, 100%].
Трет-бутиловый эфир (3S,5R)-5-метил-3-[1-((4R,5S)-4-метил-2-оксо-5-фенилоксазолидин-3-ил)метаноил]гептановой кислоты
Использовали способ, аналогичный способу синтеза трет-бутилового эфира (3S,5R)-5-метил-3-((4R,5S)-4-метил-2-оксо-5-фенилоксазолидин-3-карбонил)октановой кислоты, с получением соединения, указанного в заголовке, в виде масла (7,48 г; 31%). MS, m/z (относительная интенсивность): 178 [100%], 169 [100%]; [ ]D=+21,6 (c 1 в CHCl3). ]D=+21,6 (c 1 в CHCl3).
4-Трет-бутиловый эфир (S)-2-((R)-2-метилбутил)янтарной кислоты
Трет-бутиловый эфир (3S,5R)-5-метил-3-[1-((4R,5S)-4-метил-2-оксо-5-фенилоксазолидин-3-ил)метаноил]гептановой кислоты (7,26 г, 0,018 моль) в H2O (53 мл) и ТГФ (176 мл) при 0°C добавляли заранее перемешанный раствор LiOH (37 мл 0,8 M раствора) и H2O2 (10,57 мл 30% раствора), и раствор нагревали до комнатной температуры. Через 2 часа добавляли бисульфит натрия (7 г), сульфит натрия (13 г) и воду (60 мл), и два слоя разделяли и водный слой экстрагировали простым эфиром. Объединенные органические фазы концентрировали до масла, которое растворяли в гептане (200 мл). Полученный твердый продукт отфильтровывали, и фильтрат сушили (MgSO4) и концентрировали с получением соединения, указанного в заголовке в виде масла (4,4 г), которое использовали без дополнительной очистки. MS, m/z (относительная интенсивность): 243 [100%].
Трет-бутиловый эфир (3S,5R)-3-бензиоксикарбониламино-5-метилгептановой кислоты
Это соединение получали как описано выше, используя в качестве исходного продукта 4-трет-бутиловый эфир (S)-2-((R)-2-метилбутил)янтарной кислоты с получением трет-бутилового эфира (3S,5R)-3-бензиоксикарбониламино-5-метилгептановой кислоты в виде масла (выход 73,3%).
1H-ЯМР (400 МГц, CDCl3):  0,84 (т, 3H, J=7,33 Гц), 0,89 (д, 3H, J=6,60 Гц), 1,12-1,38 (м, 4H), 1,41 (с, 9H), 1,43-1,59 (м, 2H), 2,42 (м, 2H), 4,05 (м, 1H), 5,07 (т, 2H J=12,95 Гц), и 7,28-7,34 (м, 5H). 0,84 (т, 3H, J=7,33 Гц), 0,89 (д, 3H, J=6,60 Гц), 1,12-1,38 (м, 4H), 1,41 (с, 9H), 1,43-1,59 (м, 2H), 2,42 (м, 2H), 4,05 (м, 1H), 5,07 (т, 2H J=12,95 Гц), и 7,28-7,34 (м, 5H).
Трет-бутиловый эфир (3S, 5R)-амино-5-метилгептановой кислоты
Это соединение получали, как описано выше, используя в качестве исходного продукта трет-бутиловый эфир (3S,5R)-3-бензиоксикарбониламино-5-метилгептановой кислоты вместо трет-бутилового эфира (3S,5R)-3-бензиоксикарбониламино-5-метилоктановой кислоты с получением соединения, указанного в заголовке.
1H ЯМР (400 МГц; CDCl3)  0,84 (перекрывающий т и д, 6H), 1,08-1,16 (м, 2H), 1,27-1,30 (м, 2H), 1,42 (с, 9H), 1,62 (ушир.с, 2H), 2,15 (дд, 1H, J=8,54 и 15,62 Гц), 2,29(дд, 1H, J=4,15 и 15,37 Гц) и 3,20(ушир.с, 2H). 0,84 (перекрывающий т и д, 6H), 1,08-1,16 (м, 2H), 1,27-1,30 (м, 2H), 1,42 (с, 9H), 1,62 (ушир.с, 2H), 2,15 (дд, 1H, J=8,54 и 15,62 Гц), 2,29(дд, 1H, J=4,15 и 15,37 Гц) и 3,20(ушир.с, 2H).
Гидрохлорид (3S,5R)-амино-5-метилгептановой кислоты
Взвесь трет-бутилового эфира (3S,5R)-амино-5-метилгептановой кислоты (1,44 г, 6,69 ммоль) в 3 н. HCl кипятили с обратным холодильником в течение 3 часов, фильтровали горячим через целит и досуха концентрировали. После растирания полученного твердого продукта с этиловым эфиром получали гидрохлорид (3S,5R)-3-амино-5-метилгептановой кислоты (0,95 г, 85%). Т.пл. 126,3-128,3°C.
Пример 7:
(3S, 5R)-3-Амино-5-метилнонановая кислота
(R)-4-Метилоктановая кислота. Хлорид лития (0,39 г, 9,12 ммоль) и хлорид меди (I) (0,61 г, 4,56 ммоль) объединяли в 45 мл ТГФ при температуре окружающей среды и перемешивали 15 минут, затем охлаждали до 0°C и в это время добавляли бромид этилмагния (1M раствор в ТГФ, 45 мл, 45 ммоль). По каплям добавляли бромид (S)-цитронеллила (5,0 г, 22,8 ммоль), и раствор оставляли нагреваться до температуры окружающей среды при перемешивании в течение ночи. Реакционную смесь гасили, осторожно добавляя насыщенный NH4Cl (вод.), и перемешивали с Et2O и насыщенным NH4Cl (водный раствор) в течение 30 минут. Фазы разделяли и органическую фазу сушили (MgSO4) и концентрировали. Сырой (R)-2,6-диметил-дец-2-ен использовали без очистки. К раствору (R)-2,6-диметил-дец-2-ена (3,8 г, 22,8 ммоль) в 50 мл ацетона при 0°C добавляли реагент Джонса (2,7 M в H2SO4 (водный раствор), 40 мл 108 ммоль) и раствор оставляли медленно нагреваться до температуры окружающей среды, перемешивая в течение ночи. Смесь разделяли между Et2O и H2O, фазы разделяли и органическую фазу промывали насыщенным солевым раствором, сушили (MgSO4) и концентрировали. Остаток очищали флэш-хроматографией (8:1 гексан:EtOAc) с получением 2,14 г (59%) соединения, указанного в заголовке в виде бесцветного масла: LRMS: m/z 156,9 (M+). Реагент Джонса получали как 2,7M раствор, объединяя 26,7 г CrO3, 23 мл H2SO4, и разбавляли до 100 мл с помощью H2O.
(4R,5S)-4-Метил-3-((R)-4-метилоктаноил)-5-фенилоксазолидин-2-он
К (R)-4-метилоктановой кислоте (2,14 г, 13,5 ммоль) в 25 мл CH2Cl2 при 0°C добавляли 3 капли ДМФ, а затем оксалил хлорид (1,42 мл, 16,2 ммоль), что приводило к активному выделению газа. Раствор непосредственно нагревали до температуры окружающей среды, перемешивали 30 минут и концентрировали. В это время в раствор оксазолидинона (2,64 г, 14,9 ммоль) в 40 мл ТГФ по каплям добавляли н-бутиллитий (1,6 M раствор в гексане, 9,3 мл, 14,9 ммоль) при -78°C. Смесь перемешивали в течение 10 минут, в это время по каплям добавляли хлорангидрид в 10 мл ТГФ. Реакционную смесь перемешивали в течение 30 минут при -78°C, затем непосредственно нагревали до температуры окружающей среды и гасили насыщенным NH4Cl. Смесь разделяли между Et2О и насыщ. NH4Cl (водный раствор), фазы разделяли, и органическую фазу сушили (MgSO4), и концентрировали с получением 3,2 г соединения, указанного в заголовке, в виде бесцветного масла. LRMS: m/z 318,2 (M+).
Трет-бутиловый эфир (3S,5R)-5-метил-3-((4R,5S)-4-метил-2-оксо-5-фенилоксазолидин-3-карбонил)нонановой кислоты
К раствору диизопропиламина (1,8 мл, 12,6 ммоль) в 30 мл ТГФ при -78°C добавляли н-бутиллитий (1,6M раствор в гексане, 7,6 мл, 12,1 ммоль), и смесь перемешивали 10 минут при этом по каплям добавляли (4R,5S)-4-метил-3-((R)-4-метилоктаноил)-5-фенилоксазолидин-2-он (3,2 г, 10,1 ммоль) в 10 мл ТГФ. Раствор перемешивали в течение 30 минут, быстро добавляли по каплям трет-бутил бромацетат (1,8 мл, 12,1 ммоль) при -50°C, и смесь оставляли медленно нагреваться до 10°C в течение 3 часов. Смесь разделяли между Et2О и насыщ. NH4Cl (водный раствор), фазы разделяли и органическую фазу сушили (MgSO4) и концентрировали. Осадок очищали флэш-хроматографией (начиная с 16:1 и заканчивая 8:1 гексан:EtOAc) с получением 2,65 г (61%) соединения, указанного в заголовке, в виде бесцветного кристаллического твердого продукта, т.пл.=84-86°C. [ ]D 23+17,1 (c=1,00, CHCl3). ]D 23+17,1 (c=1,00, CHCl3).
4-Трет-бутиловый эфир (S)-2-((R)-2-метилгексил)янтарной кислоты 4-трет-бутиловый эфир
К раствору трет-бутилового эфира (3S,5R)-5-метил-3-((4R,5S)-4-метил-2-оксо-5-фенилоксазолидин-3-карбонил)нонановой кислоты (2,65 г, 6,14 ммоль) в 20 мл ТГФ при 0°C добавляли заранее охлажденный (0°C) раствор моногидрата LiOH (1,0 г, 23,8 ммоль) и перекись водорода (30 мас.% водный раствор, 5,0 мл) в 10 мл H2O. Смесь энергично перемешивали в течение 90 минут, затем нагревали до температуры окружающей среды и перемешивали в течение 90 минут. Реакционную смесь гасили при 0°C, добавляя 100 мл 10% NaHSO3 (водный раствор), затем экстрагировали Et2O. Фазы разделяли, и органическую фазу промывали насыщенным солевым раствором, сушили (MgSO4) и концентрировали. Соединение, указанное в заголовке использовали без дополнительной очистки.
Трет-бутиловый эфир (3S,5R)-3-бензиоксикарбониламино-5-метилнонановой кислоты
Это соединение получали аналогичным образом, используя в качестве исходного продукта 4-трет-бутиловый эфир (S)-2-((R)-2-метилгексил)янтарной кислоты вместо 4-трет-бутилового эфира (S)-2-((R)-2-метилпентил)янтарной кислоты, с получением соединения, указанного в заголовке в виде масла (выход 71,6%).
1H ЯМР (400 МГц; CDCl3)  0,81 (т, 3H, J=4,40 Гц), 0,85 (д, 3H, J=6,55 Гц), 1,06-1,20 (м, 7H), 1,36 (с, 9H), 1,38-1,50 (м, 2H), 2,36 (м, 2H), 3,99 (м, 1H), 5,02 (м+с, 3H) и 7,28-7,28 (м, 5H). 0,81 (т, 3H, J=4,40 Гц), 0,85 (д, 3H, J=6,55 Гц), 1,06-1,20 (м, 7H), 1,36 (с, 9H), 1,38-1,50 (м, 2H), 2,36 (м, 2H), 3,99 (м, 1H), 5,02 (м+с, 3H) и 7,28-7,28 (м, 5H).
Трет-бутиловый эфир (3S,5R)-3-амино-5-метилнонановой кислоты
Это соединение получали, как описано выше, используя в качестве исходного продукта трет-бутиловый эфир (3S,5R)-бензиоксикарбониламино-5-метилнонановой кислоты вместо трет-бутилового эфира (3S,5R)-3-бензиоксикарбониламино-5-метилоктановой кислоты. Выход = 97%.
1H ЯМР (400 МГц; CDCl3)  0,82 (перекрывающий д и т, 6H), 1,02-1,08 (м, 1H), 1,09-1,36 (м, 6H), 1,39 (с, 9H), 1,47 (ушир.с, 1H), 1,80 (с, 2H), 2,13 (дд, 1H, J=8,54 и 15,61 Гц), и 2,27 (дд, 1H, J=4,15 и 15,38 Гц). 0,82 (перекрывающий д и т, 6H), 1,02-1,08 (м, 1H), 1,09-1,36 (м, 6H), 1,39 (с, 9H), 1,47 (ушир.с, 1H), 1,80 (с, 2H), 2,13 (дд, 1H, J=8,54 и 15,61 Гц), и 2,27 (дд, 1H, J=4,15 и 15,38 Гц).
Гидрохлорид (3S,5R)-3-амино-5-метилнонановой кислоты
Смесь трет-бутилового эфира (3S,5R)-3-амино-5-метилнонановой кислоты (1,50 г, 6,16 ммоль) в 3н HCl (100 мл) кипятили с обратным холодильником в течение 3 часов, фильтровали горячим через целит и концентрировали до 30 мл в вакууме. Полученные кристаллы собирали, промывали дополнительным количеством 3 н. HCl, и сушили с получением соединения, указанного в заголовке, т.пл. 142,5-143,3°C. Дополнительные выходы получали из фильтрата и они составляли 1,03 г (70,4%).
Для C10H21NO2·HCI:
Вычислено: C 53,68, H 9,91, N 6,26, Cl 15,85.
Найдено: C 53,89, H 10,11, N 6,13.
MS: M+1: 188,1.
Биологические примеры:
Биологическая активность соединений, подходящих для использования в соответствии с изобретением в качестве альфа-2-дельта лигандов может быть измерена в анализах связывания радиолиганда, используя [3H]габапентин и  -2- -2- субъедицу, полученную из ткани мозга свиней (Gee N.S., Brown J.P., Dissanayake V.U.K., Offord J., Thurlow R., Woodruff G.N., J. Biol. Chem., 1996; 271:5879-5776). субъедицу, полученную из ткани мозга свиней (Gee N.S., Brown J.P., Dissanayake V.U.K., Offord J., Thurlow R., Woodruff G.N., J. Biol. Chem., 1996; 271:5879-5776).
Пример 1: Исследование эффектов альфа-2-дельта лиганда на рефлекс мочеиспускания у анестезированных крыс
1.0 Материалы и методы:
Животные
Четырех крыс, рожденных путем кесарева сечения (CD), весом приблизительно 225 г, анастезировали, используя уретан, и осуществляли продолжительную цистометрию.
Животных анастезировали, используя уретан (1,2 г/кг, в.в.). Глубину анастезии оценивали по стабильности давления крови и частоте сердечных ударов, и по отсутствию одергивания задней лапы в ответ на ее сжатие. При необходимости давали дополнительные дозы уретана (0,1 г кг-1, в.в.).
Трахею интубировали для поддержания свободного доступа воздуха, в наружную яремную вену вводили канюлю для введения препарата, и в общую сонную артерию вводили гепаринизированную канюлю (20 единиц/мл гепарина в 0,9% мас./об. раствора) для измерения артериального давления крови.
Давление крови измеряли, используя датчик давления и сердечный ритм (HR), получали на электронном табло в оперативном режиме на основании давления крови, используя PoneMah (Linton Pty Ltd UK). За температурой тела следили с помощью ректального температурного зонда и поддерживали между 36-38°C, используя гомеотермическое одеяло (Harvard, UK). На протяжении эксперимента животные самопроизвольно дышали воздухом.
На мочевом пузыре делали поперечный абдоминальный разрез. В верхушку мочевого пузыря вводили канюлю (0,52 мм внутренний и 1,2 мм внешний диаметр) для вливания раствора в мочевой пузырь, одновременно записывая внутрипузырное давление мочевого пузыря. В мочевой пузырь вливали физиологический раствор (0,9%) со скоростью 0,046 мл/мин, стимулируя максимальную скорость часового диуреза крыс (Klevmark B [1974] - Motility of the urinary bladder in cats during filling at physiological rates. I. Intravesical pressure patterns studied by a new method of cystometry. Acta Physiol Scand 90(3): 565-77). После хирургической операции животных оставляли стабилизироваться на приблизительно 30 минут. После периода стабилизации проводили цистометрию и наблюдали за функцией мочевого пузыря (интервал между мочеиспусканием) в ответ на габапентин-HCl (0,3, 1,3 и 10 мг/кг, вводимые внутривенно).
Статистический анализ
Различия между обрабатываемыми группами оценивали, используя ANOVA.
Соединение
Габапентин-HCl (Tocris, UK) растворяли в физиологическом растворе.
2.0 Результаты:
Интервалы времени между актами опорожнения
Интервалы между актами опорожнения увеличивались в ответ на габапентин (см. фиг. 1) относительно соответствующих периодов в контроле. Исследование показало, что габапентин значительно расширяет интвервал между актами опорожнения в зависимости от дозы. Действительно, 10 мг/кг габапентина, вводимого внутривенно, значительно продливал интервалы мочеиспускания по сравнению с соответствующими контрольными животными (3,1±0,29 против 9,89±2,72 мин P<0,05). В результате увеличения интервалов между актами мочеиспускания емкость мочевого пузыря значительно увеличилась, на 200% в ответ на габапентин. Интересно отметить, что габапентин, при введении в количестве 10 мг/кг, не имел каких-либо побочных эффектов на эффективность мочеиспускания, удержание мочи или сокращение мочевого пузыря при опорожнении.
Таким образом, было показано, что введение альфа-2-дельта лиганда повышало емкость мочевого пузыря и снижало СНМП у самок крыс, что указывает на эффективность такого подхода для лечения СНМП, связанного с ГМП.
Пример 2: Эффект альфа-2-дельта лиганда на частоту мочеиспускания и давление мочевого пузыря у самцов крыс co спонтанной гипертонией (SHR)
1.0 Материалы и методы:
Восемь (8) самцов крыс со спонтанной гипертонией получали хирургическим путем с помощью Data Sciences International (DSI) телеметрического транспондера (TL11M2-C50-PXT). За давлением мочевого пузыря постоянно следили с помощью катетера для измерения давления, введенного через верхушку мочевого пузыря.
Характеристики мочевого пузыря (давление мочевого пузыря, давление при опорожнении и число актов опорожнения) записывали в ответ на введение плацебо или лечение 60 мг/кг габапентина, вводимого подкожно (п/к) (см. фиг.2).
2.0 Результаты:
Как показано на фигуре, габапентин в количество 60 мг/кг п/к значительно снижал (P<0,05) интервалы между мочеиспусканиями и поэтому повышал емкость мочевого пузыря. Более того, и это важно для симптомов нижних мочевых путей (СНМП), среднее давление мочевого пузыря во время стадии наполнения цикла мочеиспускания было значительно ниже (P<0,05) в ответ на габапентин по сравнению с соответствующими периодами в контрольной группе (см. фиг.3).
Таким образом, было показано, что введение альфа-2-дельта лиганда увеличивает емкость мочевого пузыря и снижает СНМП у самцов животных, что указывает на эффективность такого подхода для лечения СНМП, связанного с ГМП.
Пример 3: Эффект прегабалина на модели определения функции мочевого пузыря с телеметрией
1.0 Материалы и методы
Животные:
В исследовании использовали крыс с самопроизвольной гипертензией (SHR), которым имплантировали зонды для телеметрии. Животные весом 200-250 г были получены от Charles River и содержались при цикле свет/тьма, 12:12, с доступом к пище и воде ab libitum.
Экспериментальные процедуры:
В каждый день эксперимента животным вводили подкожную инъекцию единичной дозы тестируемого соединения или носителя. Обычно оценку проводили через четыре дозы тестируемого соединения, разделяя каждый день исследования двумя, тремя днями промывки, то есть все животные получали полное лечение. На последнем этапе исследования из хвостовой вены брали 0,4 мл образца крови для РК анализа.
После введения дозы соединения животных размещали по отдельности в Metaboles для записи количества мочеиспусканий и измерения объема на акт мочеиспускания и общий объем мочеиспусканий. Давление мочевого пузыря постоянно регистрировали посредством телеметрии. Все параметры измеряли в течение 120 минут через 60 минут после введения дозы соединения.
В отдельном РК анализе 3-м животным вводили дозу тестируемого соединения. У животных на 15, 30 минуте и через 1 и 3 часа брали 4 образца пробы по 0,25 мл. По этим образцами, а также с образцами крови, полученными у животных на последнем этапе исследования, определяли РК соединений в SHR.
2.0 Результаты:
Эффект прегабалина на функцию мочевого пузыря исследовали на модели определения функции мочевого пузыря с телеметрией у крыс. В этой модели прегабалин продемонстрировал зависимое от дозы повышение среднего объема на акт мочеиспускания в течение двух часов (фиг.4) и соответствующее снижение частоты мочеиспускания. Общий объем при мочеиспускании в течение двух часов оставался неизменным для всех доз. Давление мочевого пузыря при мочеиспускании также оставалось неизменным по сравнению с контролем для всех доз. Таким образом, какой-либо эффект на давление в мочевом пузыре не был подвержен.
Вывод:
Результаты эксперимента показали, что прегабалин повышает средний объем на акт мочеиспускания и снижает частоту мочеиспускания не влияя на давление в мочевом пузыре.
Фиг.4 показывает эффект прегабалина на объем при акте мочеиспускания на модели определения функции мочевого пузыря с телеметрией.
Формула изобретения
1. Применение альфа-2-дельта лиганда или его фармацевтически приемлемой соли или сольвата для получения лекарственного средства для лечения СНМП, отличного от недержания мочи, связанного с ГМП и/или ДГПЖ.
2. Применение по п.1, где СНМП связан с ДГПЖ.
3. Применение по п.1, где СНМП связан с ГМП.
4. Применение по п.3, где при ГМП отсутствует недержание мочи.
5. Применение по любому из пп.1-4, где СНМП является частыми позывами к мочеиспусканию.
6. Применение по любому из пп.1-4, где СНМП представляет собой никтурию.
7. Применение по любому из пп.1-4, где альфа-2-дельта лиганд выбран из:
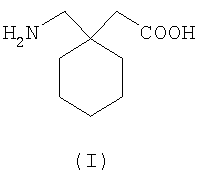 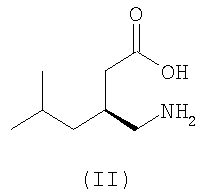
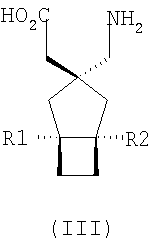 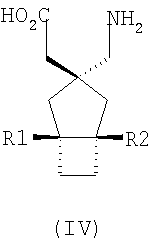 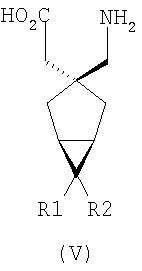 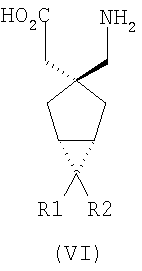
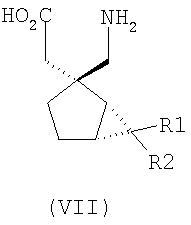 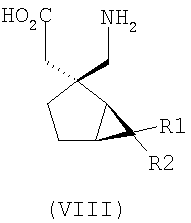 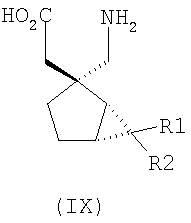 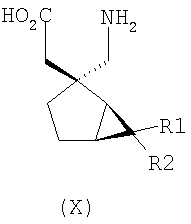
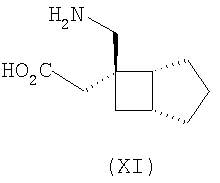 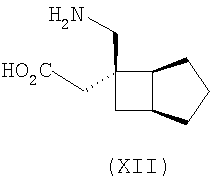 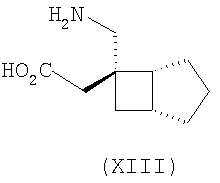 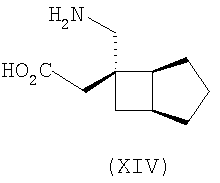
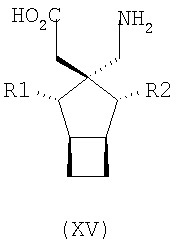 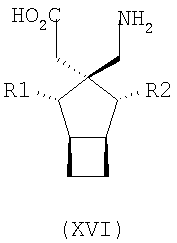 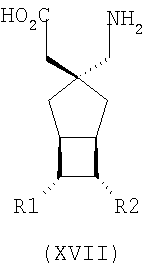 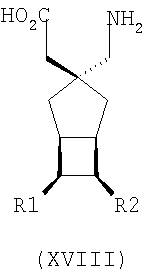 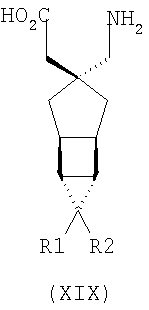
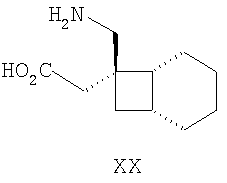 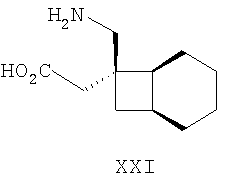 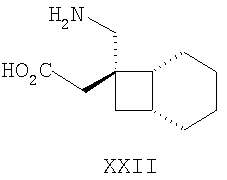 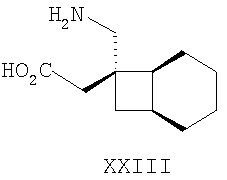
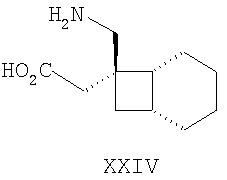 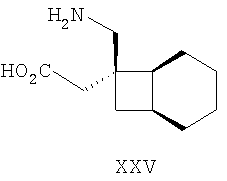 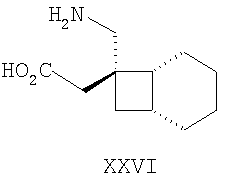 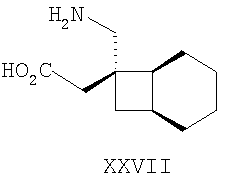
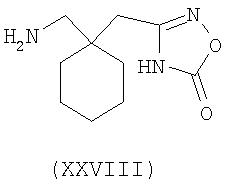 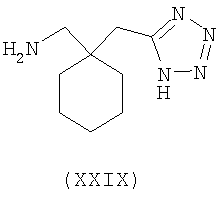 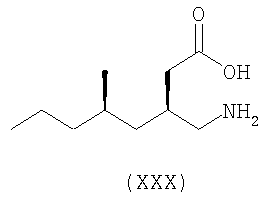
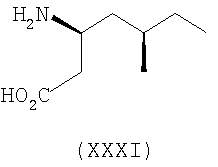
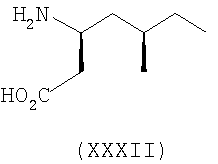 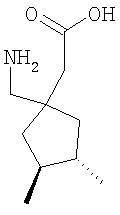 ; или его фармацевтически приемлемой соли или сольвата; ; или его фармацевтически приемлемой соли или сольвата;
где каждый R1 и R2 независимо выбран из Н, прямого или разветвленного алкила из 1-6 атомов углерода, циклоалкила из 3-6 атомов углерода, фенила и бензила, при условии, кроме трициклооктанового соединения формулы (XVIII), что R1 и R2 одновременно не могут быть водородом; или выбран из
  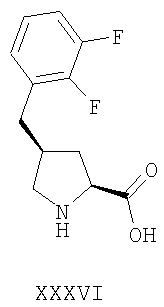 
или его фармацевтически приемлемой соли или сольвата.
8. Применение по п.7, где альфа-2-дельта лиганд представляет собой габапентин (I)

или его фармацевтически приемлемой соли или сольвата.
9. Применение по п.7, где альфа-2-дельта лигандом является прегабалин (II)

или его фармацевтически приемлемой соли или сольвата.
10. Применение по п.7, где альфа-2-дельта лигандом является (1 , 3 , 3 , 5 , 5 )(3-аминометилбицикло[3.2.0]гепт-3-ил) уксусная кислота (III )(3-аминометилбицикло[3.2.0]гепт-3-ил) уксусная кислота (III ) )
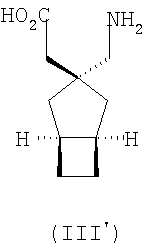
или его фармацевтически приемлемой соли или сольвата.
11. Применение по п.7, где альфа-2-дельта лигандом является 4-(3-фторбензил)пирролидин-2-карбоновая кислота (XXXV)

или ее фармацевтически приемлемая соль или сольват.
12. Применение по п.1, где альфа-2-дельта лигандом является соединение формулы (XXX), как определено в п.7, или его фармацевтически приемлемой соли или сольвата.
|