
СПИСОК ПАТЕНТОВ С УПОМИНАНИЕМ ГИАЛУРОНОВОЙ КИСЛОТЫ
-
- 2017751 Способ получения гиалурона
- 2192150 БАД для профилактики йодной недостаточности
- 2112542 Препарат для лечения патологий соединительных тканей
- 2225206 Препарат для лечения рака молочной железы
- 2299733 Лечение опорно-двигательного аппарата
- 2299732 Способ лечения глаукомы
- 2299726 Противоинфекционная губная помада
- 2299725 Косметическое средство для ухода за кожей
- 2198878 Ароматическое соединение
- 2198702 Способ подготовки трофических язв к аутодермапластике
- 2198653 Вагинальные суппозитории
- 2197946 Композиция для ухода за волосами
- 2197923 Фармацевтическая композиция для лечения отеков роговицы
- 2298410 Биотрансплантант и способ лечения ревматических и аутоиммунных заболеваний
- 2197501 Фотоотверженный гель на основе сшитой гиалуроновой кислоты
- 2197228 Твердые лекарственные формы
- 2197222 Водная компазиция для ухода за волосами, лица и тела
- 2297425 Полипептиды
- 2297240 Композиция с гиалуроновой кислотой
- 2297230 Фармацевтическая компазиция с ксантоновой смолой
- 2196588 Глазные капли
- 2195955 Применение биологически активных веществ
- 2195926 Дерматологические композиции
- 2295954 Микрочастицы для доставки нуклеиновых кислот
- 2295951 Косметика для ухода за кожей лица и век
- 2195262 Фармакологическое средство на основе гиалуроновой кислоты
- 2194512 Способ профилактики и коррекции процесса старения кожи
- 2194478 Лечение экземы
- 2294716 Расширяемый стент
- 2194055 Сшитые сополимеры
- 2099350 Ассоциаты депротонированной гиалуроновой кислоты
- 2293557 Средство для лечения кожи и слизистых
- 2292878 Приготовление микроцастиц, содержащих метопропол
- 2292746 БАД
- 2192256 Защита кишечника
- 2191782 Получение модифицированной гиалуроновой кислоты
- 2292219 Паратиреоидный гормон человека
- 2291686 Микроцастицы
- 2191000 Косметическая маска
- 2290921 Фармацевтические и косметические средства против старения кожи
- 2290900 Модифицированный биоматериал для использования в офтальмологии
- 2290899 Получение биоматерьяла
- 2290397 Новые инданилиденовые соединения
- 2290186 Лечение сирингомиелии
- 2288702 Иррингационный раствор для офтальмологии
- 2288699 Гель для лечения стоматологических заболеваний
- 2188011 Активирующая остеогенез фармацевтическая композиция
- 2187327 Средство с антисептиком
- 2187325 Средство с радиопротекторным действием
- 2287330 Композиции миноксидила
- 2186786 Способ получения гиалуроновой кислоты
- 2186593 Лечение раненого процесса кожи
- 2286801 Очищение воды
- 2286781 Лечение ожогов пищевода у детей
- 2286764 Средство лечения воспалений полости рта
- 2185840 Лечение инфекционных заболеваний
- 2286151 Альфа-2-Дельта-Лиганда
- 2185149 Ранозаживляющий гель
- 2285527 Лечение ИЛ-6 заболеваний
- 2184448 Раствор хранения роговицы, включающий гиалуроновую кислоту
- 2090179 Крем для кожи
- 2183961 Способ лечения кожи
- 2284331 Соли алифотических аминов
- 2284187 Производные амида
- 2089191 Снизить внутрение давление
- 2283320 Получение гликозаминогликанов
- 2283129 Лечение опухолей
- 2283098 Косметические средства с Q
- 2182574 Ароматические соединения
- 2088257 Средство с гипохолестеролемическим действием
- 2088218 Состав для гигиенических салфеток
- 2088206 Способ получения препарата, создающего исскуственный загар
- 2282462 Противомикробные средства
- 2182008 Интровагинальная компазиция
- 2181999 Препарат с отсроченным высвобождением
- 2181998 Новые композиции липидов
- 2181995 Лечение болевого синдрома
- 2181295 Вирионная вакцина
- 2087144 Витамин Е
- 2379336 Способ стирки
- 2379052 Вакцинация
- 2180855Композиция в виде ионного комплекса
- 2379025 Противоинфекционный гель
- 2180825 Лечение травм роговицы
- 2281082 Способ коррекции эстетических и возрастных проблем кожи
- 2180576 Биоактивная добавка для косметических средств
- 2280459 Средство для изменения скорости роста или репродукции клеток
- 2179981 Соли переходного металла
- 2378010 Жидкие вакцины
- 2378008 Комбинированные вакцины
- 2378007 Анаболическое средство
- 2377973 Растительные экстракты
- 2280041 Способ получения водорастворимых комплексов гиалурил
- 2280038 Биополимеры
- 2323733 Йодный обмен
- 2377260 Гель
- 2178693 Противовирусное средство на основе гиалуроновой кислоты
- 2178692 Облегчающие зуд косметическое средство
- 2377022 Гемостатические спреи
- 2376982 Увлажняющая сыворотка для лица
- 2376974 Трансдермальный гель для лица
- 2362784 Гипо-и гиперацетилированные менингокковые капсульные сахариды
- 2177789 Устройство для доставки лекарства к шейке матки
- 2277954 Крем для лица омолаживающий
- 2376378 Способ получения метионина
- 2177332 Биоматериал для предотвращения послеоперационных спаек, с производной гиалуроновой кислотой
- 2177310 Способ получения таблеток
- 2376011 Средство для позвоночника
- 2277410 Косметическое средство
- 2323748 Медицинская повязка
- 2276998 Гидрогелевые композиции
- 2082416 Способ получения препарата с коллагенном из животного сырья
- 2375081 Адсорбирующее изделие
- 2375049 Охлаждающий пластырь
- 2346049 Способ получения гиалурона
- 2275913 Фармацевтические средства
- 2174985 Полисахарид с антиоксидантом
- 2373957 Носитель для лекарственных средств и биологически активных веществ
- 2373941 Способ коррекции возрастных и патологических изменений кожных покров
- 2174845 Композиции и способы доставки генетического материала
- 2174830 Средство для укрепления волос
- 2373769 Синбиотическая композиция
- 2274472 Лечение апорно-двигательного аппарата и болевых синдромов
- 2372929 Профилактическая композиция на основе веществ фенольной природы в липосомной форме
- 2173563 Способ нанесения на поверхность предметов покрытия на основе гиалуроновой кислоты, её производных и полусинтетических полимеров
- 2079304 фармацевтическая композиция, обладающая иммуносупрессорной и антимикробной активностью
- 2273645 Полипептид ожирения
- 2173154 Фракция кератансульфатолигосахаридов и содержащий ее фармацевтический препарат
- 2173136 Грязная мазь
- 2173128 Способ хирургического лечения центральных разрывов сечатки
- 2078561 Косметическое средство предотвращающее старение кожи
- 2172490 Способ прогнозирования воспалительных заболеваний молочной железы при эндопластике
- 2272645 Способ лечения ЦМВ-Инфекции у детей раннего возроста
- 2272636 Фармацевтическая композиция для местного лечения воспаления
- 2272635 Фармацевтически активная субстанция для офтальмологии
- 2272599 Биоматерьял для стабилизации прогрессирующей миопии "Коллаплант"
- 2172168 Средство для заживления ран на основе гиалуроновой кислоты
- 2371172 Фармацевтическая композиция для лечения нервной системы на основе стефаглабрина
- 2171470 Способ прогнозирования послеоперационной трансформации доброкачественных опухолей нервной системы
- 2077317 Состав для ванн
- 2271213 Комбинированные композиции, содержащие экстракты из растений и морских животных
- 2076872 Способ получения окрашенной гиалуроновой кислоты
- 2076671 Раствор для защиты роговицы
- 2370281 Конъюгаты гидроксиалкилкрахмал
- 2370275 Способ лечения (коррекции) косметических и возрастных дефектов кожи
- 2370258 Фармацевтическая композиция для парентальной доставки в форме лиофилизата
- 2270023 Способ экстракции и очистки протеогликана хрящего типа (варианты)
- 2369408 Гемостатическая композиция, включающая гиалуроновую кислоту
- 2369387 Фармацевтическая композиция для лечения нервной системы
- 2369379 Нетаблитированные жевательные формы для индивидуального введения
- 2169136 Производное коричной кислоты
- 70792 Медицинский аппликатор
- 20741717 Способ стабилизации аскорбиновой кислоты
- 2074712 Способ получения препарата, препятствующего преждевременной эякуляции
- 2367954 Способ прогнозирования развития кожной патологии у женщин с синдромом склерополикистозных яичников (СПКЯ)
- 2268075 Устройство для электрокинетической доставки
- 2268052 Средство для лечения воспалительных и дегенеративных заболеваний суставов
- 2167649 Способ получения твердой дисперсии умеренного водорастворимого лекарственного вещества
- 2167647 Гель для бритья
- 2073520 Лечение урологических инфекций
- 2367476 Биопластический материал
- 2367475 Мембрана для использования при направленной регенерации тканей
- 2367469 Фармацевтическая композиция на основе лизоамидазы
- 2367456 Фармацевтическая композиция обладающая антибактериальным и некролитическим действием
- 2367455 Фармацевтическая композиция обладающая некролитическим и антибактериальным действием
- 2267324 Применение антиадгезивных углеводов, препарат для уменьшения и /или блокирования адгезии патогенных веществ
- 2166934 Композиции включающие биологический агент
- 2166510 Псевдодипептиды
- 2366460 Композиции, имеющие высокую противовирусную и антибактериальную активность
- 2360901 Производные феноксиуксусной кислоты
- 2165749 Способ восстановления эндотелия роговицы
- 2265441 Способ укрепления склеры
- 2365382 Композиции и способы для регуляции развития сосудов
- 2070879 Соли гликозаминогликанов
- 2164914 Циклические и гетероциклические N - замещенные - иминогидроксамовые карбоновые кислоты
- 2264627 Хламидийный конъюктивит
- 2364399 Фармацевтический препарат на основе стефаглабрина
- 2264230 Препарат с замедленным высвобождением активного вещества
- 2363497 Фармацевтические композиции
- 2363496 Способ увеличения объема мягких тканей
- 2363473 Способ антифлогистической активации в эксперементе
- 2363461 Фармацевтический препарат на основе сигетина
- 2363459 Средства для введения в роговицу глаз для предотвращения офтальмологических нарушений
- 2363448 Фармацевтические композиции
- 2163123 Глазные капли
- 2162687 Усовершенствованнная лекарственная форма индуктора интерферана
- 2162343 Биосовместимый полимерный материал и способ его получения
- 2162327 Лечение рака
- 2067841 Способ получения ароматизатора
- 2161478 Способ консервированого лечения гонартроза
- 2361617 Вольфрамовые частицы в качестве рентгеноконтрастных веществ
- 2361552 Способы и устройства для дренирования жидкостей и понижения внутриглазного давления
- 2066996 Способ изготовления пленочного материала для офтальмохирургии
- 2361417 Корм с глюкозамином и экстрактом ивы для профилактики артроза у животных
- 2161002 Пищевой общеукрепляющий лечебно-профилактический продукт из хрящевой ткани акул
- 2360928 Комплексная матрица для медико-биологического применения
- 2160574 Способ лечения глаукомы
- 2360688 Способ лечения повреждений переферических нервов
- 2360670 Фармацевтическая композиция при климактерических расстройствах
- 2360646 Эндолюминальный протез
- 2260445 Способ усовершенствования транспортировки через легко прспосабливаемый полупроницаемый барьер
- 2260007 Производные амида
- 2359975 Способ получения модифицированных арабиногалактанов
- 2359974 Антигенные Пептиды
- 2159775 Псевдопептидный продукт
- 2259833 Фармацевтическая композиция для лечения роговицы глаза
- 2259816 Ранозаживляющее средство
- 2259815 Способ коррекции возрастных изменений, связанных с процессами старения кожи
- 2359706 Способ сохранения офтальмологических растворов
- 2359704 Антисептическое средство
- 2359662 Микрокапсулы
- 2159253 Катионные полимеры
- 2159111 Средство для ухода за кожей лица
- 2159105 Композиция для защиты кожи от опасных химических веществ Получение
- 2158593 Биосовместимый водный раствор
- 2358728 Способ лечения и предупреждения потери костной ткани
- 2258517 Способ хирургического лечения травмотических повреждений селезенки пленкой на основе гиалуроновой кислоты
- 2357968 Кристалические формы производной имидазола
- 2357957 Ингибиторы P38 и их применение
- 2157647 Пищевая добавка и ее получение
- 2357758 Препараты для чрескожной и чересслизистой добавки
- 2063244 Способ стабилизации растворов
- 2063140 Способ получения препарата для консервирования мяса
- 2157381 Способ получения гиалуроновой кислоты
- 2257198 Композиции микроцастиц
- 2356909 Белковый комплекс
- 2356570 Косметическая композиция
- 2256434 Способ закрытия перфорации барабанной перепонки
- 2356520 Способ лечения постконтузионного повреждения сечатки глаза
- 2156133 Гель
- 2255945 Полимерная композиция
- 2355761 Средства повторной дифференцировки
- 2061043 Способ повышения устойчивости урокиназы к нагреванию
- 2061005 Способ получения красителей для гистологических исследований
- 2355420 Зубная паста
- 2355385 Композиции пролонгированного действия с контролируемым высвобождением
- 2355240 Способ получения пищевого препарата хондропротекторного действия
- 2155057 Пихтово репейный бальзам
- 2354409 Способ производства высвобождающих лекарственные средчтва медицинских устройств
- 2254145 Раневое покрытие на основе коллаген-хитозанового комплекса
- 2254133 Лечение и профилактика ВИЧ-инфекции у человека
- 2253439 Фармацевтическая композиция для защиты и улучшения оптических свойств роговици при проведении эндовитреальных вмешательств
- 2253437 Способ омоложения кожи
- 2153352 Фармацевтическая композиция обладающая ранозаживляющим и противовоспалительным действием
- 2353354 Фармацевтический препарат на основе низкомолекулярного индуктора интерферона
- 2252787 Способ получения искусственной матрицы кожи
- 2252767 Способ нормализации иммунобиохимического гомеостаза коров в предродовом и послеродовом периодах
- 2352583 Фармацевтическая композиция содержащая Fc-область иммуноглобулина в качестве носителя
- 2152403 Модифицированные полисахариды
- 2352356 Иммуногенная композиция
- 2352342 Исскусственный физиологический солевый раствор Способ его получения
- 2352330 Фармацевтический препарат на основе низкомолекулярного индуктора интерферона
- 2352323 Фармацевтический препарат с модифицированным высвобождением
- 2152027 Способ подготовки ткани мозга для определения гликозаминогликанов
- 2251842 Интектицидный состав для борьбы с личинками оводов
- 2151580 Способ активации пролиферации эндотелия роговицы
- 2351648 Дифференцировка стромальных клеток, полученных из жировой ткани, в эндокринные клетки поджелудочной железы и их использование
- 2351595 N - гидроксиформамидные соединения в качестве ингибиторов металлопротеина
- 2251411 Косметическое средство в лиофилизированной фармацевтической форме
- 2251405 Косметика...ее композиции для косметических препаратов
- 2251367 Средство со сшитой гиалуроновой кислотой для наращивания тканей
- 2351359 Косметика для профилактики и лечения избыточной массы тела
- 2351322 Препарат на основе низкомолекулярного индуктора интерферона
- 2351153 Диета при остеортрите собак
- 2350958 Способ определения групповой принадлежности синовальной жидкости
- 2350625 Производные гиалуроновой кислоты с пониженной биодеградируемостью
- 2150266 Крем после бритья
- 2350354 Фармацевтическое средство содержащие антагонист и фактор некроза
- 2350340 Способ коррекции процессов регенерации
- 2350309 Способ лечения избыточной массы тела с помощью рефлексотерапии
- 2250047 Профилактический продукт из хрящевой ткани гидробионтов
- 2249467 Медицинский матерьял и изделия на его основе
- 2055079 Способ получения препарата гиалуроновой кислоты
- 2349599 Биоадгезив мидии
- 2054903 Способ лечения коллагеноза у бычков на откорме
- 2249210 Способ прогнозирования предрасположенности к развитию и тяжести течения деформирующего остеоартроза коленного сустава у взрослых
- 2349339 Средство для соединительной ткани
- 2148988 Человеческий интерферона
- 2148399 Лечение атеросклероза
- 2148396 Способ определения активного вещества в дифильных мазевых основах
- 2148375 Способ диагностики близорукости
- 2348415 Способ противоспаечной терапии после хирургического вмешательства
- 2348400 Препарат на основе низкомолекулярного индуктора интерферона
- 2348386 Способ непроникающего хирургического лечения первичной открытоугольной глаукомы
- 2248213 Лечение Галактозидальной А недостаточности
- 2347586 Микрофлюидизированные эмульсии типа "масло в воде" и вакцинные средства
- 2147243 Контрастное средство
- 2146526 Лечебный препарат дисбактериоза и урогенитальных инфекций
- 2146148 Терапевтическое применение фактора роста кератиноцитов (ФРК)
- 2146139 Способ повышения активности макрофагов и комбинации для его осуществления
- 2346277 Способ диагностики специфического синовита
- 2345793 Ультразвуковые контрастные вещества и их получение
- 2345782 Терапевтические комбинации на основе PORIFERA для лечения и предотвращения кожных заболеваний
- 2245131 Способ коррекции косметических недостатков кожи
- 2245130 Способ активации восстановительных процессов в коже
- 2144833 Хондроитиназа
- 2344809 Получение твердых дозированных форм с использованием сшитого нетермопластичного носителя
- 2244540 Косметический гель для ухода за кожей лица
- 2244536 Способ лечения дегенеративно-дистрофических заболеваний тазобедренного сустава
- 2344167 Хмелевый экстракт
- 2143884 Агент регулирования дифференциации клеток кожи, культурная среда для клеток или тканей и способ регулирования дифференциации клеток кожи
- 2343932 Способ получения обладающих пониженной растворимостью в воде пленночных материалов
- 2343903 Устройство доставки лекарств для контролируемого введения препаратов
- 2048817 Способ получения материала для лечения ожогов и гнойно - некронических ран
- 2048803 Гидратантный крем
- 2242974 Средства и способы лечения воспалительных заболнваний
- 2142816 Способ получения антигерпетической вакцины
- 2342923 Средство для обработки рук с увлажняющим эффектом
- 2142781 Косметика для макияжа ресниц и бровей и агент ингирирующий рост микроорганизмов в косметических средствах
- 2242251 Трансплантируемые стенты с биоактивными покрытиями
- 2142257 Способ обработки глазных имплантантов и контакных линз
- 2342389 Мононатриевая соль
- 2342107 Способ устранения западения верхнего века при анофтальме
- 2141828 Средство, пролонгирующее эффективность чесночного порошка
- 2241489 Косметическое средство матриксных протеинов для залечивания ран
- 2241443 Средство для лечения герпеса
- 2241414 Способ получения протезов кровеносных сосудов
- 2341539 Гидрогель
- 2141324 Регулятор скорости воздействия препарата для инъекций
- 2141312 Косметическое средство для ухода за кожей лица
- 2341296 Средства и способы покрытия медицинских имплантантов
- 2341272 Средство для неспецифической иммунотерапии
- 2341266 Стенты с нанесенным покрытием содержащим N - (5-(4-(4-
- 2341257 Иммуномодулирующее средство
- 2341255 Средство для лечения климактерических расстройств
- 2240821 Способ лечения урологических инфекций
- 2140786 Способ лечения лишая
- 2140243 Способ хирургического лечения диабетической ретинопатии и отслоек сечатной оболочки
- 2240140 Медицинская многослойная повязка и изделия на ее основе
- 2240135 Культура клеток, содержащая клетки - предшественники остеонегеза, имплантант на ее основе и его использование для восстановления целостности кости
- 2240123 Экзогенные биологически активные коньюгирующие вещества
- 2139886 Фотоотвержаемое производное гликозаминогликата, сшитое производное гликозаминогликата и способы их получения, способ предотвращения клеточной и тканевой адгезии
- 2139729 Вакцина. Способ стимулирования иммунной системы
- 2339386 Средство обладающее радио - и химиозащитным действием
- 2339369 Лечение офтальмологических нарушений с использованием мочевины и ее производных
- 2139041 Гидратантный регенерирующий крем и способ его получения
- 2139039 Косметический суперкрем для ухода за кожей
- 2139017 Способ получения боисовместимого материала
- 2138503 Производные камптотецина, способы их получения, уникальное средство
- 2338556 Средство содержащие антагонист Р2Х - рецептора и нестероидное противоспалительное лекарственное средство
- 2338514 Косметическое средство для профилактики старения кожи
- 2138297 Медицинские устройства, подверженные вызываемому разложению
- 2138295 Покрытие для ран
- 2337906 Ингибиторы цитозольной фосфолипазы А2 Применение физиологически допустимого корпускулярного ферримагнитного или ферромагнитного материала. Способ формирования магнитометрического изображения
- 2137501 Устройство формирования изображения
- 2137477 Способ лечения заболеваний характеризующихся аутоиммунной агрессией
- 2137467 Крем для кожи лица и тела
- 2137449 Способ коррекции дефектов преломления в глазу млекопитающего
- 2137402 Пищевая Добавка БАД
- 2336899 Способ стимуляции миелопоэза
- 2336862 Способ получения раствора для лечения роговицы
- 2336830 Способ восстановления костных структур челюсти
- 2136696 Новый полипептид и средство против ВИЧ - Инфекции
- 2336092 Биоадгезивное средство, по существу свободное от воды
- 2336089 Средство и способ лечения заболеваний периодонтальных и пульпы
- 2336074 Средства и способы лечения заднего сегмента глаза
- 2235548 Ранозаживляющее средство
- 2135186 Способ лечения рефлекторных синдромов при остеохондрозе
- 2234945 Стабилизатор водного раствора и водосодержащего сырья
- 2334762 Растворимая ассоциативная карбоксиметилцеллюлоза
- 2234514 Макропористые хитозановые гранулы и способ их получения. Способ культивирования клеток
- 2133615 Средство для лечения неврологических заболеваний
- 2233164 Способ профилактики развития послеоперационных спаек брюшной полости
- 2133127 Неткатный материал, способ его получения и способ лечения
- 2333223 Альдегидные производные сиаловой кислоты и средства на их основе
- 2333007 Полипептидные вакцины для широкой защиты против рядов поколений менингококов с повышенной вирулентностью
- 2332985 Дозированные формы анестезирующих средств с длительным высвобождением для обезболивания
- 2132677 Косметическая маска
- 38603 Пленочный аппликатор
- 2232594 Средство содержащие ингибирующие остеокластогенез фактор и полисахарид
- 2332238 Средство для прокладок, раневых повязок и других изделий, контактирующих с кожей
- 2331668 Стромальные клетки, получение из жировой ткани, для заживления дефектов роговицы и внутриглазных дефектов и их использование
- 2331438 Альфа - 2 - Дельта Лигант для лечения симптомов нижних мочевыводящих путей
- 2331411Электропряденые аморфные фармоцевтические средства
- 2331367 Способ профилактики образования спаек и их рецидива
- 2130767 Масло в воде для получения косметических и дерматологических средств, способ косметической обработки
- 2230752 Поперечносшитые гиалуроновые кислоты и их применение в медицине
- 2230558 Способ восстановления и сохранения здоровья скмьи
- 2230550 Средства длительного высвобождения, способ их получения и применения
- 2230458 Поддержания здоровья суставов
- 2330290 Способ определения состояния метаболических процессов в ткани суставного хряща
- 2230073 Способ поперечного сшивания карбоксилированных полисахаридов
- 2329059 Способ лечения полипозного риносинусита
- 2329037 Комбинированная терапия для лечения иммуновоспалительных заболеваний
- 2128666 Гиалуроновая кислота и ее соли, способ очистки гиалуроновой кислоты, способ получения гиалуроновой кислоты. Фармацевтический препарат с гиалуроновой кислотой и средства с гиалуроновой кислотой используемые в офтальмологии
- 2328740 Способ экспресс - оценки действия зубных паст
- 2128502 Косметический гель
- 2328272 Суппозитории индуктора интерферона
- 2328268 Косметика содержащая амфолитный сополимер
- 2128057 Композиционная мембрана, способ ее получения и способ направленной регенерации тканей с ее применением
- 2128055 Средство замедленного освобождения и способ его получения
- 2128049 Свечи
- 2227743 Полипептидные варианты с повышенной гепаринсвязывающей способностью
- 2326893 Ковалентное и нековалентное сшивание гидрофильных полимеров
- 2326697 Новый перевязочный материал для быстрого заживления раневой поверхности кожи
- 2126264 Фармацевтическое средство с гиалуроновой кислотой
- 2326137 Способ получения содержащих альгинат пористых формованных изделий
- 2325902 Способ выделения гликозаминогликанов из минерализованной соединительной ткани
- 2225195 Репелленты против насекомых
- 2325193 Сосудистый стент
- 2325184 Улучшенные везикулы наружной мембраны бактерий
- 2325153 Многокомпонентная фармацевтическая дозированная форма
- 2325152 Удерживаемая в желудке система регулируемой доставки лекарственного средства
- 2029955 Способ предоперационного определения помутнения задней капсулы хрусталика при экстракции катаракты
- 2324688 Производные бисбензизоселеназолонила с противоопухолевым, противовоспалительным и антитромбоническим действием
- 2323017 Устройство и способ контролируемый доставки активных веществ в кожу
- 2323011 Содержащий Коллаген I и Коллаген II способный к рассасыванию внеклеточный матрикс, предназначенный для реконструирования хряща
- 2322955 Способ изготовления имплантанта для пластики дефектов хрящевой ткани
- 2322454 Антитело против CCR5
- 2322263 Система продолжительного высвобождения растворимого лекарственного средства
- 2221561 Витамин Е и его сложные эфиры
- 2321634 Гены участвующие в метаболизме углерода и продуцировании энергии
- 2321597 Биоматерьял, способ его приготовления и его применение, медицинское средство, имплантант и вкладыш
- 2121340 Средство для похудения
- 2220737 Средство для улучшения состояния опорно-двигательного аппарата
- 2220729 Гель используемый в стоматологии
- 2320720 Способ культивирования фибропластов для заместительной терапии
- 2320378 Накожный аппликатор
- 2320369 Средства, содержащие Альфа - 2 - Дельта Лиганды и ингибиторы обратного захвата серотонина/норадреналина
- 2320362 Местные фармацевтические средства, содержащие проантоцианидины, для лечения дерматитов
- 2320322 Биоадгезивная доставка лекарств
- 2320318 Чувствительное к температуре изменяющие состояние средство гидрогеля
- 2025120 Способ получения препарата, содержащего Фактор /G-CSF/, стимулирующий рост колоний гранулоцитов
- 2319490 Средство для введения железа при лечении синдрома беспокойных ног
- 25995 Содержащее адгезив приспособление для фиксации зубных протезов в полости рта
- 2218907 Средство для ухода за кожей лица и веками
- 2318830 Способ получения модифицированного дерматансульфата
- 2118153 Косметика - туш для ресниц
- 2217441 Способ получения полимера
- 2317296 Изетионатная соль селективного ингибитора CDK4
- 2217171 Мембрана для использования при направленной регенерации тканей
- 2317095 Экстракты ECHINACEA ANGUSTIFOLIA
- 2216332 Препарат для лечения астроза
- 2216314 Крем - маска для обезвоженной кожи
- 2316333 Средство оздоровительно-восстановительных косметических панто-магниевых ванн
- 2021304 Способ получения биологически активного средства
- 2115662 Способ получения гиалуроновой кислоты
- 2315627 Впрыскиваемые имплантанты на керамической основе для заполнения морщин, кожных впадин, шрамов
- 2315623 Средство получаемое путем лиофилизации препарата
- 2114862 Способ получения гиалуроновой кислоты
- 2314791 Лечебно-Косметическое средство
- 2314791 Косметический крем-бальзам для ухода за кожей лица и шеи
- 2214600 Способ оценки эффективности лечения неврологических проявлений
- 2114602 Способ косметической обработки
- 2114587 Раствор для защиты роговицы
- 2214283 Имплантант для подкожного или внутрикожного введения
- 2313370 Медицинские протезы, имеющие улучшенную биологическую совместимость
- 2313356 Препарат для лечения демодекоза
- 2313338 Средство на основе этиллинолеата и триэтилцитрата для лечения себореи и угрей
- 2313328 Косметика содержащая тонкодисперный и пористый порошок
- 2212880 Способ получения препарата содержащего антибиотик, с замедленным высвобождением активного вещества
- 2312640 Способ лечения Блефароконьюнктивальной формы синдрома сухого глаза
- 2017751 Способ получения гиалуроновой кислоты
- 2312145 Гены CORYNEBACTERIUM GLUTAMICUM, кодирующие белки, участвующие в синтезе мембран и мембранном транспорте
- 2311458 Белки вызывающие измененную иммуногенную реакцию. Способ их получения и использования
- 2311183 Улучшенное разделение с использованием гталуроновой кислоты
- 2311177 Ингибиторы интегрина для лечения заболевания глаз
- 2300069 Косметическая маска
- 2211024 Уход за сухой кожей
- 2310440 Раствор для защиты роговицы от повреждений
- 2309684 Лечение межфалангового остеоатроза узелковой формы
- 2309406 Способ мониторинга фиброза печени у больных хроническим гепатитом с (ХГС)
- 2209088 Опосредованная рецепторами доставка генов с использованием векторов на основе бактериофагов
- 2308967 Уменьшение объема ткани
- 2308962 Средство для опорно-дигательного аппарата
- 2308957 Способ получения препарата для мезотерапии
- 2308954 Средство для лечения ран, содержащее плазму или сыворотку крови
- 2308951 Комплексный способ профилактики вагинальных дисбактериозов
- 2308937 Косметическая биологически активная добавка и косметический литофитокомплекс на ее основе
- 2208638 ДНК (варианты), способ получения белка
- 2207885 Способ подачи небольшого объема лечебного раствора к целевому месту
- 2207858 Лишенные побочных эффектов производные простагландинов для лечения глаукомы
- 2207845 Твердая лекарственная форма пролонгированного действия
- 2207844 Препарат для местного неинвазивного применения
- 2207841 Средства с антиферментативным действием
- 2306335 Стволовые клетки и решетки полученные из жировой ткани
- 2306140 Новые рецепторы для Helicobacter pylori и их применение
- 2205612 Способ эндотелизации IN VITRO протезов кровеносных сосудов
- 2105540 Депигментирующее средство
- 2304960 Косметическое средство для кожи
- 2304616 Гены участвующие в гомеостазе и адаптации
- 2204550Способ получения длинноцепочечной N-Ацилированной кислотой Аминокислот
- 2204415 Способ получения изображения
- 2204394 Средство для лечения грибковых инфекций, желудочных язв
- 2204366 Способ хирургического лечения глаукомы
- 2104034 Вагинальное увлажняющие средство, способ его получения
- 2303991 Биологически активная добавка
- 2303990 БАД
- 2303973 Адсорбирующее изделие
- 2203676 Средство обладающее иммунокорригирующим действием
- 2203672 Способ предупреждения беременности
- 2303635 Гены кодирующие белки резистентности и толерантности к стрессам
- 2303529 Способ фиксации альгинатного геля на твердой фазе, способ получения клеточного чипа на его основе
- 2203078 Способ лечения гнойных ран
- 2302412 Гидразоно-малонитрилы
- 2102400 Способ получения гиалуроновой кислоты
- 2202356 Способ стимуляции репаративных процессов длительно незаживающих ран и трофических язв
- 2202336 Средство для ухода за кожей
- 2302231 Глазные капли
- 2102082 Способ магнитометрического исследования тела человека или животного
- 2301814 Полиакриламидный гидрогель
- 2201765 Гибридные матричные имплантанты и эксплантанты
- 2301677 Биотрансплантант для лечения дегенеративных и трвматических заболеваний хрящевой ткани и способ его получения
- 2301676 Способ лечения ревматизма
- 2301674 Способ лечения больных с переломами нижней челюсти
- 2301661 Средство с регулируемым освобождением и способ его получения
- 2005488 Средство для лечения болезней соединительной ткани
- 2200001 Крем для кожи
|
РОССИЙСКАЯ ФЕДЕРАЦИЯ

ФЕДЕРАЛЬНАЯ СЛУЖБА
ПО ИНТЕЛЛЕКТУАЛЬНОЙ СОБСТВЕННОСТИ
ПАТЕНТАМ И ТОВАРНЫМ ЗНАКАМ
|
Патент №2363497 |
(54) ФАРМАЦЕВТИЧЕСКИЕ КОМПОЗИЦИИ
(57) Реферат:
Изобретение относится к медицине. Описано устройство, имплантируемое в организм человека или животного, содержащее биоразрушаемый полимер, включающий единицы карбоната этилена формулы (А): -(-С(O)-O-CH2-CH2-O-)- (A), в количестве 70-100 мольных %, который обладает внутренней вязкостью 0,4-4,0 дл/г при определении в хлороформе при 20°С в концентрации 1 г/дл и температурой стеклования 5-50°С, разрушаемый за счет поверхностной эрозии, которая контролируется по механизму негидролитического расщепления. Устройство позволяет восстановить нормальный ток крови и сохраняет артерию открытой после установки баллонного катетера. 7 н. и 6 з.п. ф-лы, 1 ил.
Настоящее изобретение относится к устройству, имплантируемому в организм человека или животного, а также к применению такого устройства для контролируемого высвобождения фармацевтического действующего агента для лечения или предупреждения неоинтимальной пролиферации и утолщения, повторного стеноза и/или окклюзии сосуда с последующим повреждением сосуда, или для активации заживления ткани.
Многие люди подвержены заболеваниям кровеносной системы, вызываемым прогрессирующей блокадой кровеносных сосудов, которые снабжают кровью сердце и другие крупные органы. Тяжелая форма блокады кровеносных сосудов у многих людей часто приводит к ишемическому повреждению, гипертонии, инсульту или инфаркту миокарда. Атеросклеротические повреждения, которые ограничивают или закупоривают коронарный или периферический поток крови, являются основной причиной ишемического заболевания, связанного с заболеваемостью и смертностью, в том числе с коронарной болезнью и инсультом. Для прекращения прогрессирования заболевания и предупреждения развития более продвинутых стадий заболевания, при которых затрагивается сердечная мышца и другие органы, применяются медицинские способы замены кровеносных сосудов, например чрескожная транслюминальная коронарная ангиопластика (РСТА), чрескожная транслюминальная ангиопластика (РТА), атерэктомия, шунтовая трансплантация или другие способы сосудистой трансплантации.
Повторное сужение (например, рестеноз) атеросклеротической коронарной артерии после различных способов реваскуляризации (восстановления кровообращения) присутствует у 10-80% пациентов, подвергаемых этому лечению, в зависимости от применяемого способа и места артерии. Помимо вскрытия закупоренной атеросклерозом артерии при реваскуляризации также повреждаются эндотелиальные клетки и клетки гладкой мускулатуры в стенке сосуда, что приводит к инициации тромбоза и воспалительной реакции. Образуемые клетками ростовые факторы, например фактор роста тромбоцитов, инфильтрующиеся макрофаги, лейкоциты или клетки гладкой мускулатуры сами по себе провоцируют пролиферацию и реакции миграции в клетках гладкой мускулатуры. Одновременно с локальной пролиферацией и миграцией клетки воспалительного очага также прорастают в месте сосудистого повреждения и могут мигрировать в более глубокие слои стенки сосуда. Пролиферация/миграция обычно начинается через 1-2 суток после повреждения и в зависимости от применяемого способа реваскуляризации продолжается на протяжении суток или недель.
И клетки внутри атеросклеротического повреждения, и клетки, находящиеся в средах, мигрируют, пролиферируют и/или секретируют значительные количества внеклеточных матричных белков. Пролиферация, миграция и синтез внеклеточного матрикса продолжаются до репарации разрушенного эндотелиального слоя, к этому времени внутри интимы пролиферация снижается. Вновь сформированная ткань называется неоинтимой, интимальным утолщением или рестенозным повреждением и обычно приводит к сужению просвета сосуда. Сужение сосуда также может происходить из-за конструктивной коррекции, например коррекции сосуда, приводящей к дальнейшему интимальному утолщению или гиперплазии.
Также образуются атеросклеротические повреждения, которые не ограничивают ток крови или не закупоривают кровеносный сосуд, но которые образуют так называемые «уязвимые бляшки». Такие атеросклеротические повреждения или уязвимые бляшки подвержены разрыву или изъязвлению, которые приводят к тромбозу и таким образом вызывают нестабильную стенокардию, инфаркт миокарда и внезапную смерть. Воспалительные атеросклеротические бляшки могут быть обнаружены с помощью термографии.
Осложнения, связанные с устройствами сосудистого доступа, являются основной причиной заболеваемости, например, у пациентов с гемодиализом, например, отток при стенозах при циркуляции в венозной системе. Венозная неоинтимальная гиперплазия характеризуется стенозами и последующим у подавляющего большинства патологий, возникающих при отказе диализных трансплантатов. Обнаружено, что связанная с сосудистым доступом заболеваемость занимает примерно 23% времени пребывания в клинике пациентов с прогрессирующим заболеванием почек и составляют половину стоимости госпитализации таких пациентов. Кроме того, дисфункция сосудистого доступа у пациентов, подвергаемых химиотерапии, обычно вызывается оттоком крови при стенозах при циркуляции в венозной системе и выражается в ограниченной возможности вводить лекарственные средства больным раком. Часто отток крови при стенозах является очень тяжелым состоянием и требует вмешательства. Кроме того, дисфункция сосудистого доступа в общем парентеральном питании пациентов (TPN) обычно вызывается оттоком крови при стенозах при циркуляции в венозной системе и приводит к снижению возможности оказания помощи этим пациентам.
До настоящего времени не было известно какого-либо эффективного лечения с целью предупреждения или снижения дисфункции сосудистого доступа, которая сопровождает включение или восстановление хирургическим путем постоянного шунта, фистулы или катетера, например крупного внутреннего катетера, в вену млекопитающего, в частности человека.
Было обнаружено, что стенты (эндопротезы сосудов) применимы вместо ангиопластики или наряду с ней для уменьшения сужения артерии, которое происходит после ангиопластики баллона или других процедур, в которых применяются катетеры. Стенты позволяют восстановить нормальный ток крови и сохраняют артерию открытой после установки баллонного катетера, однако повторный стеноз (повторная закупорка) также представляет проблему, связанную с установкой стента. Повторная закупорка после установки стента может быть либо из-за формирования связанного с рестенозом разрушения в границах стента, либо из-за сдавливающей коррекции и с проксимального, и с дистального конца местного высвобождающего устройства или системы, например, стента.
Ранее разработанные стенты снабжены покрытием из лекарственных средств, которые медленно высвобождаются и помогают предотвратить сосуд от повторной закупорки. Однако серьезные недостатки стентов с покрытием из лекарственных средств касаются биодеградации полимера, в который может быть включено лекарственное средство, и биосовместимости поверхностей медицинских устройств. Также важными для долгосрочного применения являются механические свойства полимера.
Таким образом, существует потребность в эффективном лечении и в системах доставки лекарственного средства для осуществления замены кровеносных сосудов, например, для предупреждения или лечения интимального утолщения или повторного стеноза, наступающего после сосудистого повреждения, например хирургического повреждения, например, вызванного заменой кровеносных сосудов повреждения, например, в том числе в сердечном или ином трансплантате, для процедуры стабилизации уязвимых бляшек или для предупреждения или лечения дисфункций сосудистого доступа.
В соответствии с настоящим изобретением неожиданно было обнаружено, что вставляемое сверху медицинское устройство, имплантируемое в организм человека или животного, может быть получено путем нанесения покрытия на устройство, состоящее из биоразрушаемого полимера, включающего единицы этиленкарбоната формулы -(-C(O)-O-CH2-CH2-O-)- в количестве 70-100 мольных %, обладающего внутренней вязкостью 0,4-4,0 дл/г при определении в хлороформе при 20°С в концентрации 1 г/дл и температурой стеклования 5-50°С, например 15-50°С, разрушаемого за счет поверхностной эрозии, которая управляется по механизму негидролитического расщепления. Полимер, применяемый для нанесения покрытия на устройство настоящего изобретения, называется в настоящем изобретении «полимером настоящего изобретения». Он показывает лучшую биосовместимость, биодеградацию и механические свойства, например жесткие эластичные свойства, например вязкоупругость, а также улучшенные свойства высвобождения инкорпорированного фармацевтического действующего агента, например, растворенного, диспергированного или суспендированного в полимере. В настоящем изобретении было обнаружено, что эта уникальная комбинация свойств может применяться для длительных процедур, например для установки стента или других процедур по трансплантации, описанных выше.
В контексте настоящего изобретения понятия «полимер настоящего изобретения», «полимерная матрица настоящего изобретения», «полимер, применяемый в настоящем изобретении», «поли(карбонат этилена), (РЭК)», «сополимер», или в некоторых случаях «сополимер, применяемый в настоящем изобретении» или «сополимер, применяемый в устройстве настоящего изобретения» следует рассматривать в качестве равноценных.
Понятие «биосовместимый» означает материал, который не вызывает реакции ткани, или это минимально негативная реакция ткани, включая, например, формирование тромба и/или воспаления.
В соответствии с конкретным открытием настоящего изобретения предусмотрено устройство, включающее биоразрушаемый полимер, содержащий единицы этиленкарбоната формулы А

в количестве 70-100 мольных %, обладающий внутренней вязкостью 0,4-4,0 дл/г при определении в хлороформе при 20°С в концентрации 1 г/дл и температурой стеклования 5-50°С, например 15-50°С, разрушаемый за счет поверхностной эрозии, которая контролируется по механизму негидролитического расщепления, это устройство в настоящем изобретении называется «устройством настоящего изобретения».
В другом варианте осуществления настоящего изобретения предусмотрено применение биоразрушаемого полимера, включающего единицы этиленкарбоната формулы А

в количестве 70-100 мольных %, обладающего внутренней вязкостью 0,4-4,0 дл/г при определении в хлороформе при 20°С в концентрации 1 г/дл и температурой стеклования 5-50°С, например 15-50°С, разрушаемый за счет поверхностной эрозии, которая контролируется по механизму негидролитического расщепления, для покрытия устройства, например медицинского устройства, имплантируемого в организм человека или животного, это применение в настоящем изобретении называется «применением настоящего изобретения».
Медицинское устройство может быть выбрано из катетеров, проволочных проводников катетеров, баллонов, фильтров, сосудистых трансплантатов, привитых коннекторов, трубок, имплантатов, нитей, хирургических скобок, эндопротезов сосудов из трансплантата и стентов. Предпочтительно медицинским устройством является стент.
Стентом согласно настоящему изобретению может быть любой стент, включая саморасширяющийся стент, или стент, который расширяется в результате применения частоты радиоволны, которая обеспечивает нагрев, в результате которого стент изменяет свой размер.
Стент обычно может применяться в качестве трубчатой структуры, вставленной в просвет протока или сосуда для преодоления сужения. Стенты могут быть вставлены в просвет протока в сложенной форме и затем они автономно расширяются (саморасширяющиеся стенты), или их используют с применением второго устройства in situ, например поддерживающего катетер баллона для ангиопластики, который расширяется внутри стенозированного сосуда или пассажа в организме с целью прерывания закупорок, связанных с компонентами стенки сосуда, и для получения расширенного просвета. В другом варианте могут применяться стенты, которые легко деформируются при низкой температуре, их вставляют в спавшиеся трубки: после развертывания на месте такие стенты восстанавливают свою исходную форму и оказывают сильное и осторожное воздействие на внутреннюю стенку спавшихся трубок, например, пищевода или трахеи.
Могут применяться любые доступные коммерческие стенты, например JOSTENT® Flex, JOMED, JOSTENT® SelfX, JOSTENT® периферийный, JOSTENT® почечный, Biodivysion (фирма Biocompatibles Ltd., Великобритания), ВХ из нержавеющей стали высокой вязкости L316 (фирма Biocompatibles Ltd., Великобритания), ВХ из нержавеющей стали высокой вязкости L316 (фирма Cordis, Johnson & Johnson Co., США), NIR Primo из нержавеющей стали 316L (фирма Cordis, Johnson & Johnson Co., США), NIR Primo из нержавеющей стали 316L , NIRoyal из нержавеющей стали 316L , NIRoyal из нержавеющей стали 316L (с покрытием толщиной 7 мкм из золота), саморасширяющийся стент Nitinol (с покрытием толщиной 7 мкм из золота), саморасширяющийся стент Nitinol (фирма Medinol, Scimed, Boston Scientific Co., США), S6 (фирма Medinol, Scimed, Boston Scientific Co., США), S6 и S7 и S7 (AVE, Metronic, США), Multilink Duett (AVE, Metronic, США), Multilink Duett и Ultra и Ultra (фирма ACS, Guidant S.A., Бельгия). (фирма ACS, Guidant S.A., Бельгия).
Внешняя поверхность устройства может быть из металла, например золота, серебра, платины, нержавеющей стали, никеля, титана и их биосовместимых сплавов, или биоразрушаемого и/или из биосовместимого органического или неорганического полимера, например фибрина, политетрафторэтилена (ПТФЭ), поли-р-ксилилена (РРХ), силикона, силиконовой резины, нейлона и/или перфталата полиэтилена (фирмы Dacron), или из металла, на который предварительно наносят один или несколько биодеградируемых и/или из биосовместимых органических или неорганических полимеров, например из металла, на который предварительно нанесен РРХ.
Полимер, применяемый в устройстве настоящего изобретения, и способ его получения описаны в WO 95/06077, сущность которого, в частности касающаяся полимера и способа его получения, включена в настоящее описание изобретения в виде ссылки на данную публикацию.
Содержание этиленкарбоната в полимере, применяемом согласно настоящему изобретению, составляет 70-100 мольных %, предпочтительно 80-100%, более предпочтительно 90-99,9%, например 94-99,9%. Внутренняя вязкость сополимера составляет 0,4-4,0 дл/г при определении в хлороформе при 20°С в концентрации 1 г/дл в хлороформе 0,4-3,0 дл/г. Температура стеклования сополимера составляет 5-50°С, например от 15° или 18° до 50°С.
В зависимости от способа получения сополимеры содержат в большинстве случаев в качестве сопутствующей единицы единицу оксида этилена формулы Б
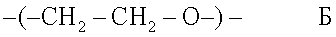
В сополимеры, применяемые в настоящем изобретении, под воздействием водной среды, например фосфатно-буферного раствора рН 7,4, среда практически не поступает к их объемной части. Поэтому не будет возникать объемной эрозии и остающаяся масса полимера будет сохраняться постоянной (100%). Включенное в него лекарственное средство, в случае его чувствительности к влаге, сохраняется стабильным.
Сополимер, применяемый в настоящем изобретении, образуется сополимеризацией оксида этилена и CO2 в молярном соотношении от 1:4 до 1:5 под воздействием катализатора. В рамках этой реакции возможно внедрение единиц оксида этилена в цепь сополимера, если две эпоксидные молекулы взаимодействуют друг с другом без встраивания молекулы CO2, т.е. если анион кислорода в качестве посредника атакует другую молекулу оксида этилена до карбоксилирования CO2. Таким образом, возможно, что сополимер включает несколько единиц оксида этилена.
Применяемый в настоящем изобретении сополимер, если в его состав входят единицы оксида этилена, имеет произвольное распределение единиц этиленкарбоната и оксида этилена согласно общей формуле
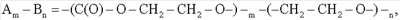
в которой
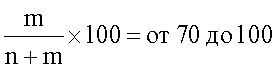
В ходе этого процесса содержание единиц оксида этилена и, таким образом, степень проявления функции простого эфира, способной замедлять или ингибировать скорость биоразрушения сополимера, существенно понижается за счет точной установки условий реакции, например описанного молярного соотношения компонентов реакции, температуры реакции и других, путем выбора определенного катализатора, например, приготовленного из Zn (C2H5)2 и воды, или ацетона, или ди- или трифенола, например флороглюцина, в молярном соотношении от 0,9:1 до 1:0,9, или от 2:1 до 1:2 соответственно, или предпочтительно приготовленного из Zn (C2H5)2 и диола, особенно этиленгликоля, в мольном соотношении от 0,9:1 до 1:0,9.
Способ предпочтительно осуществляют в растворяющей или диспергирующей агент системе органического растворителя, например, диоксана и CO2. CO2 предпочтительно применяют в жидкой форме и в избытке. Давление предпочтительно составляет от 20 до 70 бар, температура предпочтительно составляет от 10 до 80°С, особенно от 20 до 70°С.
Полученные таким образом полимеры обычно обладают функцией простого эфира менее чем на 15%, предпочтительно менее чем на 10%, особенно менее чем на 5%, например менее чем на 3%. Полиэтиленкарбонаты, если они приготовлены с применением катализатора из этиленгликоля или ацетона и диэтилцинка, проявляют низкую полидисперсность (Mw/Mn), обычно менее 5, например менее 2,5.
Согласно описанному выше процессу катализатор или его часть рассматриваются в качестве инициатора цепи для сополимеризации. После окончания реакции и завершения сборки цепи ее последняя концевая группа является гидроксильной группой. Другой конец цепи, с которого начиналась реакция роста цепи, может быть занят каталитической группой или ее фрагментом. Если катализатор приготовлен из этиленгликоля и диэтилцинка или из воды и диэтилцинка, оба конца полимерной цепи предположительно являются идентичными. Однако если катализатор приготовлен из ди- или трифенола и диэтилцинка, ароматическая группа оказывается включенной в конец цепи, с которого начался синтез цпи, а с другого конца цепи находится гидроксильная группа. Было показано, что поли(этиленкарбонат), в случае блокирования одной из его концевых групп, например, ароматическим инициатором, например флороглюцином, подвергается биоразрушению более медленно. В другом варианте дальнейшее изменение концевой гидроксильной группы также может быть рассмотрено, например, в результате реакции эстерификации с целью блокирования концевых гидроксильных групп и контроля биоразрушения поли(этиленкарбонатов), применяемых в настоящем изобретении. Подходящие концевые группы сложного эфира являются биосовместимыми группами сложного эфира, например группами сложного эфира (C1-C48) жирной кислоты, предпочтительно группами сложного эфира (C1-C18) жирной кислоты, например группами сложного эфира уксусной и стеариновой кислот, или группой сложного эфира углекислоты, например группой карбоната этилена, или группой сложного эфира памовой кислоты, или молочной, или гликолевой, или полимолочной, или полигликолевой, или группой сложного эфира полимолочной и полигликолевой кислот.
Поли(этиленкарбонаты), применяемые в настоящем изобретении, стабильны на протяжении нескольких часов в горячей дистиллированной или деминерализованной воде (90-100°С). Значительное увеличение температуры стеклования наблюдают после обработки кипяченой бидистиллированной водой на протяжении 5 ч, например до 18°С, например 28°С. С помощью выполнения этой стадии очистки достигаются повышенная чистота полимера и его лучшая подверженность обработке.
Часть поли(карбоната этилена) сополимеров, используемых в настоящем изобретении, не гидролизуется, т.е. на протяжении по меньшей мере 1 месяца под воздействием гидролитических ферментов в физиологических условиях или под воздействием воды при рН 12 и 37°С.
Однако было обнаружено, что применяемые в настоящем изобретении сополимеры разрушаются in vivo и in vitro за счет поверхностной эрозии под воздействием супероксид радикального аниона О2 -. Супероксид радикальные анионы О2 -. Супероксид радикальные анионы О2 - образуются в воспалительных клетках, например, таких, которые могут присутствовать во время процесса рестеноза. Соответственно, когда лекарственное средство инкорпорировано в полимер настоящего изобретения, скорость высвобождения лекарственного вещества может возрасти в случае процессов рестеноза и может медленно понизиться в случае пониженных скоростей возникновения рестеноза. Полимер настоящего изобретения может служить в качестве высвобождающего лекарственное средства покрытия «до востребования», например, которое высвобождает инкорпорированное лекарственное средство в месте воспаления имплантата, например, путем контакта с макрофагами. Скорость разрушения сополимеров настоящего изобретения может быть изменена в широких пределах в зависимости от их молекулярной массы, содержания оксида этилена, природы концевых групп, например биосовместимых групп сложного эфира, и присутствия поглотителей радикалов О2 - образуются в воспалительных клетках, например, таких, которые могут присутствовать во время процесса рестеноза. Соответственно, когда лекарственное средство инкорпорировано в полимер настоящего изобретения, скорость высвобождения лекарственного вещества может возрасти в случае процессов рестеноза и может медленно понизиться в случае пониженных скоростей возникновения рестеноза. Полимер настоящего изобретения может служить в качестве высвобождающего лекарственное средства покрытия «до востребования», например, которое высвобождает инкорпорированное лекарственное средство в месте воспаления имплантата, например, путем контакта с макрофагами. Скорость разрушения сополимеров настоящего изобретения может быть изменена в широких пределах в зависимости от их молекулярной массы, содержания оксида этилена, природы концевых групп, например биосовместимых групп сложного эфира, и присутствия поглотителей радикалов О2 -, например витамина C, и может длиться от 5 суток до 6 месяцев или дольше, например до 1 года. Поглотитель радикалов может быть погружен в сополимер как во вспомогательное вещество. -, например витамина C, и может длиться от 5 суток до 6 месяцев или дольше, например до 1 года. Поглотитель радикалов может быть погружен в сополимер как во вспомогательное вещество.
Поскольку применяемый в настоящем изобретении полимер разрушается в результате поверхностной эрозии, разрушение всей полимерной массы может быть урегулировано количеством имплантируемого полимера и соотношением определенной поверхности к объему у трансплантата.
Молекулярная масса (Мм) сополимеров настоящего изобретения составляет от 80000, предпочтительно от 100000, особенно от 200000 до 2000000 Да, что было определено гель-проникающей хроматографией с применением хлорида метилена в качестве элюата и полистирола в качестве стандарта.
Сополимер, применяемый в устройстве настоящего изобретения, может быть один или в комбинации с другим полимером, подходящим для нанесения покрытия на медицинский прибор, например стент, имплантируемый в организм человека или животного. Подходящими полимерами для применения в комбинации с полимером, применяемым в устройстве настоящего изобретения, может быть один или несколько из следующих полимеров: гидрофильные, гидрофобные или биосовместимые биодеградируемые материалы, например поликарбоновые кислоты; полимеры на основе целлюлозы; крахмал; коллаген; гиалуроновая кислота; желатин; полиэфиры или сополиэфиры на основе лактона, например полилактид; полигликолид; полилактидгликолид; поликапролактон; поликапролактонгликолид; поли(гидроксибутират); поли(гидроксивалерат); полигидрокси(бутират-ко-валерат); карбонат полигликолид-ко-триметилен; поли(диаксанон); сложные полиортоэфиры; полиангидриды; полиаминокислоты; полисахариды; сложные полифосфоэфиры; сложный полифосфоэфир-уретан; полицианоакрилаты; полифосфацены; сополимеры простых-сложных полиэфиров, например PEO-PLLA, фибрин; фибриноген; или их смеси; и биосовместимые неразрушаемые материалы, например поли-p-ксилилен (ППК), полиуретан; полиолефины; полиэфиры; полиамиды; поликапролактам; полиимид; поливинилхлорид; поливинилметиловый простой эфир; сополимеры поливинилового спирта или винилового спирта/олефина, например сополимеры винилового спирта/этилена; полиакрилонитрил; полистироловые сополимеры виниловых мономеров с олефинами, например сополимеры стирола и акрилонитрила, сополимеры этилена и метилметакрилата; полидиметилсилоксан; поли(этилен-винилацетат); полимеры или сополимеры на основе акрилата, например полибутилметакрилат, поли(гидроксиэтилметилметакрилат); поливинилпирролидон; фторированные полимеры, например политетрафторэтилен; сложные эфиры целлюлозы, например ацетата целлюлозы, нитрата целлюлозы или пропионата целлюлозы. Например, согласно одному из вариантов осуществления настоящего изобретения на металлический стент предварительно может быть нанесен биосовместимый небиоразрушаемый полимер, например, РРХ и затем полимер поли(этиленкарбонат) настоящего изобретения.
Применяемые в настоящем изобретении сополимеры преимущественно комбинируются с фармацевтическими действующими агентами. Например, фармацевтические действующие агенты могут быть инкорпорированы в матрицу полимера. Поскольку в условиях in vitro и in vivo не происходит основного по объему разрушения и действующее соединение защищено полимером, высвобождение действующего соединения происходит по мере эрозии поверхности матрицы. Преимущественно размер молекул фармакологического действующего соединения не влияет на скорость его высвобождения. Однако согласно настоящему изобретению было обнаружено, что разные размеры частиц могут, например, применяться для воздействия в определенной степени на скорость высвобождения.
В сериях дальнейших определенных или различных вариантов осуществления настоящего изобретения также предусмотрено устройство, описанное выше, дополнительно включающее инкорпорированный фармакологический действующий агент, например, растворимый, дигпергированный или суспендированный в полимере.
Согласно одному из объектов настоящего изобретения в настоящем изобретении предусмотрено применение устройства настоящего изобретения для контролируемого, например, устойчивого, высвобождения фармацевтического действующего агента, например адекватного фармацевтического действия, на поверхностях с покрытием устройства или около них.
В настоящем изобретении также в качестве объекта настоящего изобретения предусмотрено устройство, описанное выше, в форме вымывающего лекарственное средство стента.
Понятие «устойчивое высвобождение» или «контролируемое высвобождение» в контексте настоящего изобретения означает, что применяемый сополимер высвобождает не более 10, 20, 30, 40 или от 50% до 60, 70, 80 или 90 мас.% фармацевтического действующего агента, растворенного или диспергированного в нем, на протяжении 3-10 суток, например 7 суток, после имплантации устройства в организм человека или животного.
В настоящем изобретении также предусмотрено применение сополимера, описанного в настоящем изобретении в качестве матрицы для контролируемого высвобождения фармацевтического действующего агента из устройства, например медицинского устройства, имплантируемого в организм человека, например стента.
В контексте настоящего изобретения понятие «фармацевтический действующий агент» означает любое вещество, которое может вызвать физиологическую реакцию при введении в живой организм. Такое вещество следует вводить в «терапевтически эффективном количестве».
Понятие «терапевтически эффективное количество» в контексте настоящего изобретения относится к количеству или концентрации, эффективной для снижения проявления, элиминации, лечения, предупреждения или контролирования над симптомами заболевания или состояния млекопитающего. Понятие «контролирование» обозначает все процессы, в ходе которых может быть снижение, прерывание, прекращение или завершение прогрессирования заболеваний и состояний млекопитающего. Однако «контролирование» необязательно показывает общую элиминация всех симптомов состояния или заболевания, но также подразумевает профилактическое лечение.
Назначаемое терапевтически эффективное количество, известное специалистам в данной области, изменяется в зависимости от используемого терапевтического соединения и показания для его назначения.
В контексте настоящего изобретения понятия «фармацевтический действующий агент», «действующий ингредиент», «фармацевтическое действующее соединение», «действующее вещество» или «лекарственное вещество» следует понимать в качестве равноценных понятий.
Согласно настоящему изобретению в качестве фармацевтического действующего агента может быть выбран, по меньшей мере, один агент из следующих агентов:
(а) иммунодепрессивный агент, например ингибитор кальциневрина, например циклоспорин, например циклоспорин A, ISA tx 247 или FK506;
(б) агонист EDG-рецептора, обладающий свойствами индуцировать лимфопению, например FTY720 (2-амино-2-[2-(4-октилфенил)этил]пропан-1,3-диол в свободной форме или в форме фармацевтически приемлемой соли, например, гидрохлорида) или его аналог, например, описанный в WO 96/06068 или WO 98/45249, например 2-амино-2-{2-[4-(1-оксо-5-фенилпентл)фенил] этил} пропан-1,3-диол или 2-амино-4-(4-гептилоксифенил)-2-метилбутанол в свободной форме или в форме фармацевтически приемлемой соли;
в) противовоспалительный агент, например, стероид, например кортикостероид, например дексаметазон или преднизон, NSAID, например ингибитор циклооксигеназы, например ингибитор сох-2, например селекоксиб, рофекоксиб, эторикоксиб или альдекоксиб, аскомицин, например ASM981 (или пимекролимус), ингибитор цитокина, например ингбитор лимфокина, например ингибиторы ИЛ-1, ИЛ-2 или ИЛ-6, например пралнаказан или анакинра, или ингибитор TNF, например этанерсепт, или ингибитор хемокина;
г) антитромбический или антикоагулирующий агент, например, гепарин или ингибитор гликопротеина IIb/IIIa, например абциксимаб, эптифибатиб или тирофибран;
д) антипролиферативный агент, например агент стабилизации или дестабилизации микротрубочек, включая, но, не ограничиваясь ими, таксаны, например таксол, паклитаксел или доцетаксел, алкалоиды Vinca (барвинка), например винбластин, а именно сульфат винбластина, винкристин, а именно сульфат винкристина, и винорелбин, дискодермолиды, или эпотилоны, или их производные, например, эпотилон В или его производное;
ингибитор протеинтирозинкиназы, например протеинкиназа С или ингибитор киназы РI(3), например стауроспорин и родственные низкомолекулярные соединения, например, UCN-01, BAY 43-9006, бриостатин 1, перифозин, лимофозин, мидостаурин, CGP52421, RO318220, RO320432, GO6976, изис 3521, LY333531, LY379196, SU5416, SU6668, AG1296 и т.п. Мидостаурин является производным природного алкалоида стауроспорина, имеющего химическое обозначение (N-[(9S,10R,11R,13R)-2,3,10,11,12,13-гексагидро-10-метокси-9-метил-1-оксo-9,13-эпокси- 1H,9H-дииндоло[1,2,3-gh:3',2',1'-lm]пиppoлo[3,4-j][1,7]бензодиазонин-11-ил]-N-метилбензамид), и описан в EP 0296110, а также в патенте US 5093330 и японском патенте 2708047. Мидостаурин первоначально был идентифицирован в качестве ингибитора протеинкиназы С (РКС) (Meyer Т, Regenass U, Fabbro D и др. в Int J Cancer 43, 1989, сс.851-856);
соединение или антитело, которое ингибирует PDGF-рецептор тирозинкиназы, или соединение, которое связывается с PDGF, или понижает экспрессию PDGF-рецептора, например производное N-фенил-2-пиримидинамин, СТ52923, RP-1776, GFB-111, пирроло[3,4-с]-бета-карболин-дион и т.п.;
соединение или антитело, которое ингибирует EGF-рецепторную тирозинкиназу, или соединение, которое связывается с EGF или понижает экспрессию EGF-рецептора, например EGF-рецептора, ErbB2, ErbB3 и ErbВ4, или связывается с EGF или EGF-родственными лигандами, и, в частности, теми соединениями, белками или моноклональными антителами, в общем и конкретно описанными в WO 97/02266, например соединение из примера 39, или в ЕР 0564409, WO 99/03854, ЕР 0520722, ЕР 0566226, ЕР 0787722, ЕР 0837063, US 5747498, WO 98/10767, WO 97/30034, WO 97/49688, WO 97/38983 и особенно WO 96/30347 (например, соединение, известное как СР 358774), WO 96/33980 (например, соединение ZD 1839, иресса) и WO 95/03283 (например, соединение ZM 105180); например, трастузумаб (продукт HerpetinR), цетуксимаб, OSI-774, CI-1033, ЕКВ-569, GW-2016, Е1.1, Е2.4, Е2.5, Е6.2, Е6.4, Е2.11, Е6.3 или Е7.6.3, ретиноевая кислота, альфа-, гамма- или дельта-токоферол, или альфа-, гамма- или дельта-токотриенол, или соединения, воздействующие на GRB2, IMC-C225; или
соединение или антитело, которое ингибирует VEGF-рецепторную тирозинкиназу, или VEGF-рецептор, или соединение, которое связывается с VEGF, например, белками, низкомолекулярными соединениями или антителами, в общем и конкретно описанными в WO 98/35958, например, 1-(4-хлороанилино)-4-(4-пиридилметил)фталазин или его фармацевтически приемлемая соль, например сукцинат, или в WO 00/09495, WO 00/27820, WO 00/59509, WO 98/11223, WO 00/27819, WO 00/37502, WO 94/10202 и ЕР 0769947, которые описаны М. Prewett и др. в Cancer Research 59, 1999, сс.5209-5218; F. Yuan и др. в Proc.Natl. Acad. Sci. USA, 93, 1996, сс.14765-14770; Z. Zhu и др. в Cancer Res. 58, 1998, сс.3209-3214; J. Mordenti и др. в Toxicologic Pathology, 27, 1999, сс.14-21; продукт Angiostatin , описанный М.S.O'Reillyn др. в Cell 79, 1994, сс.315-328; продукт Endostatin , описанный М.S.O'Reillyn др. в Cell 79, 1994, сс.315-328; продукт Endostatin , описанный M. S. O'Reilly и др. в Cell 88, 1997, сс.277-285, амиды антраниловой кислоты, ZD4190; ZD6474, SU5416, SU6668 или анти-VEGF антитела или анти-УЕСР-рецептора антитела, например продукт RhuMab; , описанный M. S. O'Reilly и др. в Cell 88, 1997, сс.277-285, амиды антраниловой кислоты, ZD4190; ZD6474, SU5416, SU6668 или анти-VEGF антитела или анти-УЕСР-рецептора антитела, например продукт RhuMab;
е) статин, например, обладающей активностью по ингибированию HMG-СоА-редуктазы, например флувастатин, ловастатин, симвастатин, правастатин, аторвастатин, церивастатин, пативастатин, розувастатин или нивастатин;
ж) соединение, белок, фактор роста или соединение, стимулирующее выработку фактора роста, который может повысить вторичный рост эндотелия просвета, например, FGF, IGF;
з) ингибитор матричной металлопротеиназы, например батимистат, маримистат, трокад, CGS 27023, RS 130830 или AG3340;
и) модулятор (например, антагонисты или агонисты) киназ, например, JNK, ERK1/2, МАРК или STAT;
к) соединение, стимулирующее высвобождение NO или донор NO, например, диазениумдиолаты, S-нитрозотиолы, мезоионные оксатриазолы, изосорбит или их комбинация, например, мононитрат и/или динитрат;
л) аналог соматостатина, например, октреотид, лантреотид, вапреотид или циклогексапептид, обладающий свойствами агониста соматостатина, например цикло [4-(NH2-C2H4-NH-CO-O)Pro-Phg-DTrp-Lys-Tyr(Bzl)-Phe]; или модифицированный аналог гормона роста, химически связанный с PEG, например пегвисомант;
м) ингибитор альдостеронсинтетазы или блокатор рецептора альдостерона, например эплеренон, или соединение, ингибирующее ренин-ангиотензивной системы, например ингибитор ренина, например, SPP100, ингибитор АСЕ, например каптоприл, эналаприл, лизиноприл, фозиноприл, беназеприл, квинаприл, рамиприл, имидаприл, эрбумин периндоприла, трандолаприл или моэксиприл, или блокатор АСЕ-рецептора, например лосартан, ирбесартан, кандесартан силексетил, вальсартан или олмесартан медоксомил;
н) микофенольная кислота или ее соль, например микофенолят натрия, или его пролекарство, например микофенолят мофетила;
о) производное рапамицина. Рапамицин является известным макролидным антибиотиком, образуемым микроорганизмом Streptomyces hygroscopicus, который ингибирует mTOR. Под производным рапамицина, обладающим свойствами ингибитора mTOR, подразумевается замещенный рапамицин, например 40-замещенный рапамицин или 16-замещенный рапамицин, или 32-гидрированный рапамицин. Представителями производных рапамицина являются, например, 32-дезоксорапамицин, 16-пент-2-инилокси-32-дезоксорапамицин, 16-пент-2-инилокси-32(S или R)-дигидро-рапамицин, 16-пент-2-инилокси-32(S или R)-дигидро-40-O-(2-гидроксиэтил)рапамицин, 40-[3-гидрокси-2-(гидроксиметил)-2-метилпропаноат]рапамицин (также называемый CCI779) или 40-эпи-(тетразолил)рапамицин (также называемый АВТ578). Предпочтительным соединением является, например, 40-0-(2-гидроксиэтил)рапамицин, описанный в примере 8 в патенте WO 94/09010, или 32-дезоксорапамицин или 16-пент-2-инилокси-32(S)-дигидрорапамицин согласно описанному в WO 96/41807. Производные рапамицина также могут включать так называемые рапалоги, например, описанные в WO 98/02441 и WO 01/14387, например AP 23573;
п) антибиотик.
К перечисленным выше соединениям также относятся фармацетически приемлемые соли, соответствующие рацематы, дистериоизомеры, энантиомеры, таутомеры, а также соответствующие кристаллические модификации описанных выше соединений, где присутствуют, например, сольваты, гидраты и полиморфы. Также сюда относятся метаболиты и конъюгаты лекарственных средств.
Под понятием «антитело» подразумеваются моноклональные антитела, поликлональные антитела, поливалентные антитела, сочетающие, по меньшей мере, 2 итактных антитела, и фрагменты антител такой длины, которая обеспечивает желаемую биологическую активность.
Предпочтительными фармакологического действия агентами согласно настоящему изобретению являются, по меньшей мере, одно производное рапамицина, обладающее mTOR ингибирующими свойствами, или рапамицин, агонист EDG-рецептора, обладающий свойством индуцировать лимфопению, ингибитор cox-2, пимекролимус, ингибитор цитокина, ингибитор хемокина, антипролифративный агент, статин, белок, фактор роста или соединение, стимулирующее выработку фактора роста, что выражается в повышенном эндотелиальном возобновлении роста эндотелия в просветах сосудов, ингибитор матричной металлопротеиназы, анаьлог солматостатина, ингибитор синтетазы альдостерона или блокатор рецептора альдостерона и соединение, ингибирующее ренин-ангиотензивную систему. Могут применяться наиболее предпочтительные фармакологические действующие агенты, выбранные из ингибитора кальциневрина, микофенольной кислоты, рапамицина и мидостаурина или их солей, или их пролекарств.
Согласно настоящему изобретению какое-либо из перечисленных выше соединений, одно или в комбинации, или какие-либо другое соединение, применимое для лечения или предупреждения неоинтимальной пролиферации и утолщения, повторного стеноза и/или закупорки сосуда с последующим повреждением сосуда, дисфункции сосудистого доступа, или для лечения стимулирующей ткани, может применяться путем инкорпорации в полимер, применяемый в устройстве настоящего изобретения.
Согласно другому объекту настоящего изобретения предусмотрено устройство с покрытием из сополимера, представленного в настоящем изобретении и включающего фармакологический действующий агент, описанный выше, демонстрирующего негидролитическую поверхностную эрозию, особенно с линейной корреляцией, особенно линейной корреляцией в отношении 1:1 высвобождаемой массы действующего соединения и разрушаемой массы негидролитического сополимера, а также защита действующего соединения в матрице сополимера.
Особенность настоящего изобретения также состоит в том, что композиция, включающая сополимер и фармакологический действующий агент, может также включать фармацевтически приемлемые эксципиенты, например ионные и неионные поверхностно-активные вещества, связующие агенты, стабилизаторы, антиоксиданты, скользящие агенты и/или регуляторы значения рН. Следует учитывать, что такие дополнительные ингредиенты хорошо известны в данной области техники.
Фармакологический действующий агент может быть представлен в концентрации 0,01-99 мас.%. Обычная доза фармакологического действующего агента варьирует в широком диапазоне и зависит от различных факторов, например особых потребностей каждого получающего дозу индивидуума, обстоятельств, при которых он был назначен, и применяемого специального медицинского устройства. Доза обычно находится в диапазоне 0,001-100 мг/кг, например 0,001-10 мг/кг, относительно массы тела, однако при определенных обстоятельствах могут потребоваться другие диапазоны.
Местная доставка согласно настоящему изобретению позволяет применять высокую концентрацию лекарственного средства (средств) в месте развития заболевания при низкой концентрации соединения в кровеносной системе. Количество лекарственного средства (средств), применяемого для местной доставки, может варьировать в зависимости от применяемого соединения, подвергаемого лечению состояния и желаемого эффекта. Для целей настоящего изобретения может вводиться терапевтически эффективное количество; например, устройству или системе для высвобождения лекарственного средства придается такая форма, чтобы происходило высвобождение действующего агента и/или действующего сопутствующего агента со скоростью 0,001-800 мкг/сутки, предпочтительно 0,001-200 мкг/сутки. Терапевтически эффективным считается количество, достаточное для ингибирования клеточной пролиферации и приводящее к предупреждению и лечению болезненного состояния. Особенно важно, что для предупреждения или лечения связанных с сосудами осложнений, например после замены кровеносных сосудов или противоопухолевого лечения, для местной доставки может потребоваться меньше соединения, чем при системном введении.
Назначенный период лечения для применения согласно настоящему изобретению может составлять примерно от 14 до примерно 85 суток, например примерно 28, 50 или 70 суток, в связи с установкой или заменой стента, постоянного шунта, фистулы или катетера. Стент может сохраняться на месте установки пожизненно. Полимер может разрушиться и исчезнуть.
Слой полимерного покрытия, нанесенный на устройство, может быть толщиной в диапазоне примерно от 0,1 до 1000 мкг, например, по меньшей мере, примерно 0,5 мкг, например до 20, например примерно от 1 до 1000.
Согласно одной из задач настоящего изобретения толщина полимерного слоя может преимущественно применяться для воздействия на длительность высвобождения фармакологического действующего агента. В целом количество высвобождаемого лекарственного средства в единицу времени может зависеть от нагрузки лекарственного средства и от поверхности полимера.
В другом варианте осуществления настоящего изобретения также предусмотрено применение устройства, описанного в настоящем изобретении, для лечения или предупреждения неоинтимальной пролиферции и утолщения, повторного стеноза и/или закупорки сосуда с последующим повреждением сосуда, или для активирования исцеления ткани.
Еще одна задача настоящего изобретения заключалась в разработке способа для лечения или предупреждения неоинтимальной пролиферции и утолщения, повторного стеноза и/или закупорки сосуда с последующим повреждением сосуда, или для активирования исцеления ткани в организме человека или животного, заключающегося в имплантации устройства, описанного в настоящем изобретении, в то место, которое нуждается в таком лечении, профилактике или излечении.
В соответствии с определенными находками настоящего изобретения также предусмотрен способ предупреждения, лечения, уменьшения или стабилизации
(i) пролиферации и миграции клеток гладкой мускулатуры в полые трубки, например устройство на основе катетера, или повышенной клеточной пролиферации, или пониженного апоптоза, или повышенного напластования матрицы;
(ii) интимального утолщения в стенках сосуда, например коррекции, гипертрофической коррекции, отложения матрицы, отложения фибрна, неоинтимального роста, стеноза, повторного стеноза, например последующей реваскуляризации или неоваскуляризации и/или воспаления и/или тромбоза;
(iii) воспалительные расстройства, например индуцированное Т-клетками воспаление, в полых трубках;
(iv) стабилизирование уязвимых бляшек в кровеносных сосудах;
(v) повторный стеноз, например, у пациентов с диабетом или гипертонией;
(vi) дисфункция сосудистого доступа, например, у пациентов с гемодиализом;
(vii) артериальные или венозные аневризмы;
(viii) анастамозная гиперплазия;
(ix) артериальный, например аорты, обходной анастомоз;
(x) инфекционные заболевания;
у субъекта, нуждающегося в этом; способ включает применение, например вставку или замену, устройства, например какого-либо устройства на основе катетера, например постоянного шунта, фистулы или катетера, например крупного внутреннего катетера, внутрипросветного медицинского устройства, или адвентициального медицинского устройства, вставленного, например, в вену или артерию, согласно данному способу устройство покрыто полимером, описанным выше, например, в сочетании с одним или несколькими фармакологическими действующими ингредиентами, например, согласно описанным выше.
Согласно другой задаче настоящего изобретения предусмотрено высвобождающее лекарственное средство - устройство или система, включающие медицинское устройство, адаптированное для местного применения или введения в полые трубки, например устройство для высвобождения лекарственного средства на основе катетера, например постоянный шунт, фистула или катетер, или медицинское устройство для установки внутри просвета или снаружи полых трубок, например имплантат или оболочка, помещенные внутрь адвентиции, покрытые полимером, согласно описанному в настоящем изобретении, и терапевтическую дозу фармакологического действующего агента, инкорпорированного в полимер.
Такие устройства или системы местной доставки могут применяться для уменьшения упомянутых сосудистых повреждений, например стеноза, повторного стеноза или повторного стеноза в стенте, в качестве вспомогательного вещества для реваскуляризации, процедур обхода или трансплантации, выполняемых при любой сосудистой локализации, включая коронарные артерии, сонные артерии, почечные артерии, периферические артерии, артерии большого мозга или какой-либо другой локализации артерии или вены, для снижения анастомического стеноза или гиперплазии, включая случай артериально-венозного диализного оттока, или в связи с какими-либо другими связанными с сердцем или с трансплантацией процедурами, или с врожденными сосудистыми воздействиями.
Согласно еще одной задаче настоящего изобретения предусмотрено устройство, покрытое полимером, описанным выше, для применения в одном из способов, описанных в пунктах от (i) до (x).
В настоящем изобретении также предусмотрено применение биодеградируемого полимера, содержащего единицы карбоната этилена формулы -(-C(O)-O-CH2-CH2-O-)- в количестве 70-100 мольных %, обладающего внутренней вязкостью 0,4-4,0 дл/г при определении в хлороформе при 20°С в концентрации 1 г/дл и температурой стеклования 5-50°С, например 15-50°С, например 15-50°С, деградируемого за счет поверхностной эрозии, которая управляется по механизму негидролитического расщепления необязательно вместе с фармакологическим действующим агентом, для нанесения покрытия на устройство, например медицинское устройство, например стент, например, для применения в одном из способов, описанных в пунктах от (i) до (x).
Другой задачей настоящего изобретения было предусмотрено разработать способ для получения устройства, содержащего покрытие с полимером карбоната этилена, описанного в настоящем изобретении.
Например, фармакологический действующий агент (агенты) могут быть инкорпорированы в полимер или полимерную матрицу настоящего изобретения, например растворены, диспергированы или суспендированы в растворе полимера и распылены по внешней поверхности стента. Смесь лекарственного средства (средств) и полимерного материала может быть приготовлена в растворителе или смеси растворителей и нанесена на поверхности стентов путем погружения, нанесения устройством, например, напыляющим, печатью и/или погружением/вращением, выпаривая растворитель (растворители) и оставляя пленку с содержащимся в ней лекарственным средством (средствами). В качестве растворителей, например, может применяться дихлорметан или хлорид метилена.
В качестве другого варианта осуществления настоящего изобретения предусмотрен способ получения устройства настоящего изобретения, в котором на устройство предварительно наносится полимер, например биосовместимый и/или небиодеградируемый полимер, и затем оно покрывается полимером настоящего изобретения, содержащим лекарственное средство, растворенное, диспергированное или суспендированное в нем.
Толщина покрытия может зависеть, например, от вязкости, например концентрации полимера, природы растворителя, уровня напыления, например, известных специалисту в данной области. Для повышения толщины покрытия и связанной с этим длительности высвобождения дополнительные слои могут напыляться на стент с уже нанесенным покрытием. Согласно другому варианту уровень напыления и темпы высушивания могут быть откорректированы таким образом, что возникает непрерывный процесс нанесения покрытия.
Применение устройства настоящего изобретения для лечения, предупреждения, активирования или стабилизации описанных выше состояний может быть показано на экспериментальных животных или с помощью стандартных клинических исследований, например, применяя дозы фармакологических действующих агентов в диапазоне 0,001-100 мг/кг, например 0,001-10 мг/кг массы тела. Мониторинг воздействия устройства настоящего изобретения при лечении или предупреждении неоинтимальной пролиферации или утолщения, повторного стеноза и/или закупорки сосуда с последующим повреждением сосуда или для активации излечения ткани, может быть осуществлен одним из способов, известных специалистам в данной области, например фиксированием уменьшения степени формирования поражений при вторичном стенозе по сравнению с обработкой плацебо, например уменьшения средней неоинтимальной толщины, уменьшения неоинтимальной области и уменьшения процентной степени проявления артериального стеноза, (нео)интимального и эндотелиального излечения, супрессии ноинтимального роста внутри стента и коррекции, например гипертрофической коррекции, снижения отложения фибрина.
Пример исследования, проведенного на животных.
Комбинированная ангиопластика и установка стента проводятся на подвздошных артериях новозеландских белых кроликов. Установку баллона в артерию проводят путем закачки баллона для ангиопластики размером 3,0×9,0 мм в срединную часть артерии с последующим «протаскиванием» катера на длину 1 баллона. Повреждение баллона повторяют дважды и стент размером 3,0×12 мм развертывают при 6 атм за 30 сек в подвздошную артерию. Повреждение баллона и замену стента затем проводят на контралатеральной подвздошной артерии таким же образом. После замены стента получают ангиограмму. Все животные получают перорально аспирин в количестве 40 мг/сутки в качестве антитромбоцитарной терапии и стандартный с низким содержанием холестерина корм для кроликов. Через 28 суток после установки стента животных анестезируют и подвергают эвтаназии, после чего артериальное древо подвергают перфузии при 100 ммHg раствором Рингера с лактатом на протяжении нескольких минут, затем подвергают перфузии 10% формалином при давлении 100 ммHg на протяжении 15 мин. Сосудистый разрез между дистальной частью аорты и бедренной артерией надсекают и освобождают от окружающей ткани. Стендированный срез артерии погружают в пластик и получают срезы проксимальной, средней и дистальной частей каждого стента. Все разрезы окрашивают гматоксилин-иозином и пентахромом Movat. Проводят компьютеризированную планиметрию для определения области внутреннего тонкого эластичного слоя (IEL), внешнего тонкого эластичного слоя (EEL) и просвета. Замеряют толщину неоинтимы и неоинтимального утолщения в местах подпорок стента и между ними. Область сосуда измеряют как область внутри EEL. Данные выражают средним значением ± SEM. Статистический анализ гистологических данных проводят с применением анализа вариантов (ANOVA), поскольку у каждого животного измеряют две артерии со стентами. А Р<0,05 рассматривают в качестве статистически значимого.
Предпочтительными фармакологическими действующими агентами или комбинациями фармакологических действующих агентов для применения в опытах на животных или в стандартных клинических исследованиях являются те, которые имеют антипролиферативные свойства, например таксол, паклитаксел, доцетаксел, эпотилон, ингибитор тирозинкиназы, ингибитор VEGF-рецепторной тирозинкиназы, ингибитор VEGF-рецептора, соединение, связанное с VEGF, ингибитор mTOR, например производные рапамицина, например 40-O-(2-гидроксиэтил)рапамицин, противовоспалительные соединения, например стероид, ингибитор циклооксигеназы.
Применяемый в настоящем изобретении полимер является биоразрушаемым и демонстрирует повышенные свойства по высвобождению, переносимости, биосовместимости и механические свойства. Например, применяемый в настоящем изобретении полимер на основе карбоната этилена является чрезвычайно вязкоэластичным, например может растягиваться до 1000%, например 500-1000%, без разрыва, также в зависимости от молекулярной массы полимера. Высвобождение лекарства из устройства, например из стента, может контролироваться покровным составом, например способом получения полимера, количеством и/или размером частиц лекарственного средства, а также количеством супероксидрадикалов, присутствующих во время рестеноза. Из-за разрушения полимера за счет поверхностной эрозии, которая контролируется по негидролитическому механизму, действующее соединение защищено полимером. Действующее соединение высвобождается по мере разрушения и полностью защищено от воздействия среды крови до тех пор, пока полимер не разрушается. Из-за биосовместимости полимера отсутствуют воспалительные реакции или их число минимально. Таким образом, устройство настоящего изобретения показывает улучшенное более длительное применение, например, при установке стенда. Предпочтительно миграция или пролиферация клеток гладкой мускулатуры подавляется или снижается согласно настоящему изобретению непосредственно проксимально или дистально по отношению к месту локального лечения или зоне установки стента.
Без специального обучения специалисты в данной области могут, используя описанную процедуру, использовать настоящее изобретение во всей его полноте. Приводимый ниже пример предназначен для иллюстрации настоящего изобретения и никоим образом его не ограничивает.
В приводимых ниже примерах 40-O-(2-гидроксиэтил)рапамицин (RAD), например в концентрации 0,05-25 мг/мл, применяют в качестве лекарственного средства (называемого в настоящем изобретении «соединением I») для инкорпорирования в полимер настоящего изобретения. Другие лекарственные средства, например, упоминаемые в настоящем изобретении, могут быть суспендированы в растворе полимера.
Пример 1: Стент получают из медицинской нержавеющей стали 316LS и составляют из серии цилиндрически ориентированных колец, расположенных вдоль общей продольной оси. Каждое кольцо состоит из 3 соприкасающихся дуг и 6 расширяющихся элементов. Стент устанавливают на систему высвобождения. Соединение I, необязательно вместе с 2,6-ди-трет-бутил-4-метилфенолом (0,001 мг/мл), инкорпорировано в полимерную матрицу, основу которой составляет полимер, включающий единицы карбоната этилена формулы -(-C(O)-O-CH2-CH2-O-)- в количестве 70-100 мольных %, обладающий внутренней вязкостью 0,4-4,0 дл/г при определении в хлороформе при 20°С в концентрации 1 г/дл и температурой стеклования 15-50°С, разрушаемый за счет поверхностной эрозии, которая контролируется по механизму негидролитического расщепления (полимер настоящего изобретения, РЕС). Стент покрывают этой матрицей.
1.2. 1 г РЕС и 50 мг соединения I растворяют в 10 мл хлорида метилена. Этот раствор напыляют на стент. После высушивания с применением определенного тока газа или вакуума на стенте остается пленка полимера/лекарственного средства.
Могут применяться другие способы нанесения покрытия на стент, например методом погружения, нанесения кистью, печатью или вращением.
Пример 2А:
РЕС синтезируют согласно описанному выше способу. На стенты напылением наносят покрытие в виде раствора РЕС или сополимера D,L-молочной и гликолевой кислот (продукт PLGA, RG502H Resomer 50:50) фирмы Boehringer Ingelheim (Ingelheim, Грмния) в дихлорметане, формируя полимерную матрицу, покрывающую наружную, направленную к стенке сосуда поверхность стента.
Стенты с покрытием РЕС и PLGA расширяют, используя вложенный балонный катетер, и после расширения состояние покрытия проверяют с помощью сканирующей электронной микроскопии (SEM), используя микроскоп Hitachi S-4100 (фирма Hitachi, Германия). Гибкость стента с покрытием РЕС подтверждается отсутствием каких-либо признаков разрушения (см. чертеж, А, Б), а на стенте с покрытием PLGA видны разрывы и трещины на частях стента, подвергаемых высокой нагрузке (см. чертеж, В-Е).
Эти разрывы и трещины могут индуцировать повторный рестеноз.
Пример 2Б:
Стенты полностью предварительно покрывают поли-р-ксилиленом (PPX), используя способ химического выпаривания, описанный, например, Gorham WF в J. Polym. Sci. Polym. Chem. 4, 1966, сс.3027-3039, с последующим нанесением покрытия раствором РЕС или PLGA.
Пример 2В:
Соединение I инкорпорируют в раствор PEC или PLGA перед формированием полимерной матрицы, покрывающей внешнюю поверхность стентов.
На чертеже показаны микрофотографии, полученные с применением сканирующей электронной мсикроскопии, стентов с нанесенным способом напыления покрытием после расширения баллона.
Гладкая поверхность покрытия PEC без каких-либо признаков нарушения целостности при увеличении ×1000 (А) и ×4000 (Б) (при фокусировании нацеливались на частицы порошка). На поверхностном покрытии из продукта RG502H (PLGA) видны разрывы при увеличении ×900 (В) и трещины на частях стента, подвергаемых высокой нагрузке, при увеличении ×800 (Г), ×6000 (Д) и ×7500 (Е).
Формула изобретения
1. Устройство с покрытием, имплантируемое в организм человека или животного, которое содержит биоразрушаемый полимер, включающий единицы этиленкарбоната формулы A

в количестве 70-100 мол.%, обладающий внутренней вязкостью 0,4-4,0 дл/г при определении в хлороформе при 20°С в концентрации 1 г/дл и температурой стеклования 5-50°С, разрушаемый за счет поверхностной эрозии, которая контролируется по механизму негидролитического расщепления.
2. Устройство по п.1, поверхность которого покрыта полимером.
3. Устройство по п.1, дополнительно включающее фармацевтический действующий агент.
4. Устройство по п.3, в котором фармацевтический действующий агент растворен или диспергирован в полимере.
5. Устройство по п.3, содержащее иммунодепрессант или антипролиферативный агент в качестве фармацевтического действующего агента.
6. Устройство по п.1 в форме стента или катетера.
7. Устройство по п.6 в форме стента с вымываемым лекарственным средством.
8. Применение устройства по одному из предшествующих пунктов для контролируемого высвобождения фармакологического действующего агента.
9. Применение устройства по одному из предшествующих пп.1-7 для лечения или предупреждения неоинтимальной пролиферации и утолщения, повторного стеноза, окклюзии сосуда с последующим сосудистым повреждением, и/или для активирования тканевого заживления.
10. Способ лечения или предупреждения неоинтимальной пролиферации и утолщения, повторного стеноза, окклюзии сосуда с последующим сосудистым повреждением, и/или активирования тканевого заживления в организме человека или животного, включающий имплантацию устройства по одному из пп.1-7 в то место, в котором такое лечение, профилактика или заживление ткани необходимо.
11. Способ получения устройства по одному из пп.1-7, включающий нанесение на устройство покрытия, содержащего полимер на основе этиленкарбоната.
12. Применение биоразрушаемого полимера, включающего единицы этиленкарбоната формулы A

в количестве 70-100 мол.%, обладающего внутренней вязкостью 0,4-4,0 дл/г при определении в хлороформе при 20°С в концентрации 1 г/дл, и температурой стеклования 5-50°С, разрушаемый за счет поверхностной эрозии, которая контролируется по механизму негидролитического расщепления, для нанесения покрытия на устройство.
13. Применение биоразрушаемого полимера, включающего единицы этиленкарбоната формулы A

в количестве 70-100 мол.%, обладающего внутренней вязкостью 0,4-4,0 дл/г при определении в хлороформе при 20°С в концентрации 1 г/дл, и температурой стеклования 5-50°С, разрушаемый за счет поверхностной эрозии, которая контролируется по механизму негидролитического расщепления, для получения устройства, предназначенного для лечения или предупреждения неоинтимальной пролиферации и утолщения, повторного стеноза, окклюзии сосуда с последующим сосудистым повреждением, и/или активирования тканевого заживления.
|