
СПИСОК ПАТЕНТОВ С УПОМИНАНИЕМ ГИАЛУРОНОВОЙ КИСЛОТЫ
-
- 2017751 Способ получения гиалурона
- 2192150 БАД для профилактики йодной недостаточности
- 2112542 Препарат для лечения патологий соединительных тканей
- 2225206 Препарат для лечения рака молочной железы
- 2299733 Лечение опорно-двигательного аппарата
- 2299732 Способ лечения глаукомы
- 2299726 Противоинфекционная губная помада
- 2299725 Косметическое средство для ухода за кожей
- 2198878 Ароматическое соединение
- 2198702 Способ подготовки трофических язв к аутодермапластике
- 2198653 Вагинальные суппозитории
- 2197946 Композиция для ухода за волосами
- 2197923 Фармацевтическая композиция для лечения отеков роговицы
- 2298410 Биотрансплантант и способ лечения ревматических и аутоиммунных заболеваний
- 2197501 Фотоотверженный гель на основе сшитой гиалуроновой кислоты
- 2197228 Твердые лекарственные формы
- 2197222 Водная компазиция для ухода за волосами, лица и тела
- 2297425 Полипептиды
- 2297240 Композиция с гиалуроновой кислотой
- 2297230 Фармацевтическая компазиция с ксантоновой смолой
- 2196588 Глазные капли
- 2195955 Применение биологически активных веществ
- 2195926 Дерматологические композиции
- 2295954 Микрочастицы для доставки нуклеиновых кислот
- 2295951 Косметика для ухода за кожей лица и век
- 2195262 Фармакологическое средство на основе гиалуроновой кислоты
- 2194512 Способ профилактики и коррекции процесса старения кожи
- 2194478 Лечение экземы
- 2294716 Расширяемый стент
- 2194055 Сшитые сополимеры
- 2099350 Ассоциаты депротонированной гиалуроновой кислоты
- 2293557 Средство для лечения кожи и слизистых
- 2292878 Приготовление микроцастиц, содержащих метопропол
- 2292746 БАД
- 2192256 Защита кишечника
- 2191782 Получение модифицированной гиалуроновой кислоты
- 2292219 Паратиреоидный гормон человека
- 2291686 Микроцастицы
- 2191000 Косметическая маска
- 2290921 Фармацевтические и косметические средства против старения кожи
- 2290900 Модифицированный биоматериал для использования в офтальмологии
- 2290899 Получение биоматерьяла
- 2290397 Новые инданилиденовые соединения
- 2290186 Лечение сирингомиелии
- 2288702 Иррингационный раствор для офтальмологии
- 2288699 Гель для лечения стоматологических заболеваний
- 2188011 Активирующая остеогенез фармацевтическая композиция
- 2187327 Средство с антисептиком
- 2187325 Средство с радиопротекторным действием
- 2287330 Композиции миноксидила
- 2186786 Способ получения гиалуроновой кислоты
- 2186593 Лечение раненого процесса кожи
- 2286801 Очищение воды
- 2286781 Лечение ожогов пищевода у детей
- 2286764 Средство лечения воспалений полости рта
- 2185840 Лечение инфекционных заболеваний
- 2286151 Альфа-2-Дельта-Лиганда
- 2185149 Ранозаживляющий гель
- 2285527 Лечение ИЛ-6 заболеваний
- 2184448 Раствор хранения роговицы, включающий гиалуроновую кислоту
- 2090179 Крем для кожи
- 2183961 Способ лечения кожи
- 2284331 Соли алифотических аминов
- 2284187 Производные амида
- 2089191 Снизить внутрение давление
- 2283320 Получение гликозаминогликанов
- 2283129 Лечение опухолей
- 2283098 Косметические средства с Q
- 2182574 Ароматические соединения
- 2088257 Средство с гипохолестеролемическим действием
- 2088218 Состав для гигиенических салфеток
- 2088206 Способ получения препарата, создающего исскуственный загар
- 2282462 Противомикробные средства
- 2182008 Интровагинальная компазиция
- 2181999 Препарат с отсроченным высвобождением
- 2181998 Новые композиции липидов
- 2181995 Лечение болевого синдрома
- 2181295 Вирионная вакцина
- 2087144 Витамин Е
- 2379336 Способ стирки
- 2379052 Вакцинация
- 2180855Композиция в виде ионного комплекса
- 2379025 Противоинфекционный гель
- 2180825 Лечение травм роговицы
- 2281082 Способ коррекции эстетических и возрастных проблем кожи
- 2180576 Биоактивная добавка для косметических средств
- 2280459 Средство для изменения скорости роста или репродукции клеток
- 2179981 Соли переходного металла
- 2378010 Жидкие вакцины
- 2378008 Комбинированные вакцины
- 2378007 Анаболическое средство
- 2377973 Растительные экстракты
- 2280041 Способ получения водорастворимых комплексов гиалурил
- 2280038 Биополимеры
- 2323733 Йодный обмен
- 2377260 Гель
- 2178693 Противовирусное средство на основе гиалуроновой кислоты
- 2178692 Облегчающие зуд косметическое средство
- 2377022 Гемостатические спреи
- 2376982 Увлажняющая сыворотка для лица
- 2376974 Трансдермальный гель для лица
- 2362784 Гипо-и гиперацетилированные менингокковые капсульные сахариды
- 2177789 Устройство для доставки лекарства к шейке матки
- 2277954 Крем для лица омолаживающий
- 2376378 Способ получения метионина
- 2177332 Биоматериал для предотвращения послеоперационных спаек, с производной гиалуроновой кислотой
- 2177310 Способ получения таблеток
- 2376011 Средство для позвоночника
- 2277410 Косметическое средство
- 2323748 Медицинская повязка
- 2276998 Гидрогелевые композиции
- 2082416 Способ получения препарата с коллагенном из животного сырья
- 2375081 Адсорбирующее изделие
- 2375049 Охлаждающий пластырь
- 2346049 Способ получения гиалурона
- 2275913 Фармацевтические средства
- 2174985 Полисахарид с антиоксидантом
- 2373957 Носитель для лекарственных средств и биологически активных веществ
- 2373941 Способ коррекции возрастных и патологических изменений кожных покров
- 2174845 Композиции и способы доставки генетического материала
- 2174830 Средство для укрепления волос
- 2373769 Синбиотическая композиция
- 2274472 Лечение апорно-двигательного аппарата и болевых синдромов
- 2372929 Профилактическая композиция на основе веществ фенольной природы в липосомной форме
- 2173563 Способ нанесения на поверхность предметов покрытия на основе гиалуроновой кислоты, её производных и полусинтетических полимеров
- 2079304 фармацевтическая композиция, обладающая иммуносупрессорной и антимикробной активностью
- 2273645 Полипептид ожирения
- 2173154 Фракция кератансульфатолигосахаридов и содержащий ее фармацевтический препарат
- 2173136 Грязная мазь
- 2173128 Способ хирургического лечения центральных разрывов сечатки
- 2078561 Косметическое средство предотвращающее старение кожи
- 2172490 Способ прогнозирования воспалительных заболеваний молочной железы при эндопластике
- 2272645 Способ лечения ЦМВ-Инфекции у детей раннего возроста
- 2272636 Фармацевтическая композиция для местного лечения воспаления
- 2272635 Фармацевтически активная субстанция для офтальмологии
- 2272599 Биоматерьял для стабилизации прогрессирующей миопии "Коллаплант"
- 2172168 Средство для заживления ран на основе гиалуроновой кислоты
- 2371172 Фармацевтическая композиция для лечения нервной системы на основе стефаглабрина
- 2171470 Способ прогнозирования послеоперационной трансформации доброкачественных опухолей нервной системы
- 2077317 Состав для ванн
- 2271213 Комбинированные композиции, содержащие экстракты из растений и морских животных
- 2076872 Способ получения окрашенной гиалуроновой кислоты
- 2076671 Раствор для защиты роговицы
- 2370281 Конъюгаты гидроксиалкилкрахмал
- 2370275 Способ лечения (коррекции) косметических и возрастных дефектов кожи
- 2370258 Фармацевтическая композиция для парентальной доставки в форме лиофилизата
- 2270023 Способ экстракции и очистки протеогликана хрящего типа (варианты)
- 2369408 Гемостатическая композиция, включающая гиалуроновую кислоту
- 2369387 Фармацевтическая композиция для лечения нервной системы
- 2369379 Нетаблитированные жевательные формы для индивидуального введения
- 2169136 Производное коричной кислоты
- 70792 Медицинский аппликатор
- 20741717 Способ стабилизации аскорбиновой кислоты
- 2074712 Способ получения препарата, препятствующего преждевременной эякуляции
- 2367954 Способ прогнозирования развития кожной патологии у женщин с синдромом склерополикистозных яичников (СПКЯ)
- 2268075 Устройство для электрокинетической доставки
- 2268052 Средство для лечения воспалительных и дегенеративных заболеваний суставов
- 2167649 Способ получения твердой дисперсии умеренного водорастворимого лекарственного вещества
- 2167647 Гель для бритья
- 2073520 Лечение урологических инфекций
- 2367476 Биопластический материал
- 2367475 Мембрана для использования при направленной регенерации тканей
- 2367469 Фармацевтическая композиция на основе лизоамидазы
- 2367456 Фармацевтическая композиция обладающая антибактериальным и некролитическим действием
- 2367455 Фармацевтическая композиция обладающая некролитическим и антибактериальным действием
- 2267324 Применение антиадгезивных углеводов, препарат для уменьшения и /или блокирования адгезии патогенных веществ
- 2166934 Композиции включающие биологический агент
- 2166510 Псевдодипептиды
- 2366460 Композиции, имеющие высокую противовирусную и антибактериальную активность
- 2360901 Производные феноксиуксусной кислоты
- 2165749 Способ восстановления эндотелия роговицы
- 2265441 Способ укрепления склеры
- 2365382 Композиции и способы для регуляции развития сосудов
- 2070879 Соли гликозаминогликанов
- 2164914 Циклические и гетероциклические N - замещенные - иминогидроксамовые карбоновые кислоты
- 2264627 Хламидийный конъюктивит
- 2364399 Фармацевтический препарат на основе стефаглабрина
- 2264230 Препарат с замедленным высвобождением активного вещества
- 2363497 Фармацевтические композиции
- 2363496 Способ увеличения объема мягких тканей
- 2363473 Способ антифлогистической активации в эксперементе
- 2363461 Фармацевтический препарат на основе сигетина
- 2363459 Средства для введения в роговицу глаз для предотвращения офтальмологических нарушений
- 2363448 Фармацевтические композиции
- 2163123 Глазные капли
- 2162687 Усовершенствованнная лекарственная форма индуктора интерферана
- 2162343 Биосовместимый полимерный материал и способ его получения
- 2162327 Лечение рака
- 2067841 Способ получения ароматизатора
- 2161478 Способ консервированого лечения гонартроза
- 2361617 Вольфрамовые частицы в качестве рентгеноконтрастных веществ
- 2361552 Способы и устройства для дренирования жидкостей и понижения внутриглазного давления
- 2066996 Способ изготовления пленочного материала для офтальмохирургии
- 2361417 Корм с глюкозамином и экстрактом ивы для профилактики артроза у животных
- 2161002 Пищевой общеукрепляющий лечебно-профилактический продукт из хрящевой ткани акул
- 2360928 Комплексная матрица для медико-биологического применения
- 2160574 Способ лечения глаукомы
- 2360688 Способ лечения повреждений переферических нервов
- 2360670 Фармацевтическая композиция при климактерических расстройствах
- 2360646 Эндолюминальный протез
- 2260445 Способ усовершенствования транспортировки через легко прспосабливаемый полупроницаемый барьер
- 2260007 Производные амида
- 2359975 Способ получения модифицированных арабиногалактанов
- 2359974 Антигенные Пептиды
- 2159775 Псевдопептидный продукт
- 2259833 Фармацевтическая композиция для лечения роговицы глаза
- 2259816 Ранозаживляющее средство
- 2259815 Способ коррекции возрастных изменений, связанных с процессами старения кожи
- 2359706 Способ сохранения офтальмологических растворов
- 2359704 Антисептическое средство
- 2359662 Микрокапсулы
- 2159253 Катионные полимеры
- 2159111 Средство для ухода за кожей лица
- 2159105 Композиция для защиты кожи от опасных химических веществ Получение
- 2158593 Биосовместимый водный раствор
- 2358728 Способ лечения и предупреждения потери костной ткани
- 2258517 Способ хирургического лечения травмотических повреждений селезенки пленкой на основе гиалуроновой кислоты
- 2357968 Кристалические формы производной имидазола
- 2357957 Ингибиторы P38 и их применение
- 2157647 Пищевая добавка и ее получение
- 2357758 Препараты для чрескожной и чересслизистой добавки
- 2063244 Способ стабилизации растворов
- 2063140 Способ получения препарата для консервирования мяса
- 2157381 Способ получения гиалуроновой кислоты
- 2257198 Композиции микроцастиц
- 2356909 Белковый комплекс
- 2356570 Косметическая композиция
- 2256434 Способ закрытия перфорации барабанной перепонки
- 2356520 Способ лечения постконтузионного повреждения сечатки глаза
- 2156133 Гель
- 2255945 Полимерная композиция
- 2355761 Средства повторной дифференцировки
- 2061043 Способ повышения устойчивости урокиназы к нагреванию
- 2061005 Способ получения красителей для гистологических исследований
- 2355420 Зубная паста
- 2355385 Композиции пролонгированного действия с контролируемым высвобождением
- 2355240 Способ получения пищевого препарата хондропротекторного действия
- 2155057 Пихтово репейный бальзам
- 2354409 Способ производства высвобождающих лекарственные средчтва медицинских устройств
- 2254145 Раневое покрытие на основе коллаген-хитозанового комплекса
- 2254133 Лечение и профилактика ВИЧ-инфекции у человека
- 2253439 Фармацевтическая композиция для защиты и улучшения оптических свойств роговици при проведении эндовитреальных вмешательств
- 2253437 Способ омоложения кожи
- 2153352 Фармацевтическая композиция обладающая ранозаживляющим и противовоспалительным действием
- 2353354 Фармацевтический препарат на основе низкомолекулярного индуктора интерферона
- 2252787 Способ получения искусственной матрицы кожи
- 2252767 Способ нормализации иммунобиохимического гомеостаза коров в предродовом и послеродовом периодах
- 2352583 Фармацевтическая композиция содержащая Fc-область иммуноглобулина в качестве носителя
- 2152403 Модифицированные полисахариды
- 2352356 Иммуногенная композиция
- 2352342 Исскусственный физиологический солевый раствор Способ его получения
- 2352330 Фармацевтический препарат на основе низкомолекулярного индуктора интерферона
- 2352323 Фармацевтический препарат с модифицированным высвобождением
- 2152027 Способ подготовки ткани мозга для определения гликозаминогликанов
- 2251842 Интектицидный состав для борьбы с личинками оводов
- 2151580 Способ активации пролиферации эндотелия роговицы
- 2351648 Дифференцировка стромальных клеток, полученных из жировой ткани, в эндокринные клетки поджелудочной железы и их использование
- 2351595 N - гидроксиформамидные соединения в качестве ингибиторов металлопротеина
- 2251411 Косметическое средство в лиофилизированной фармацевтической форме
- 2251405 Косметика...ее композиции для косметических препаратов
- 2251367 Средство со сшитой гиалуроновой кислотой для наращивания тканей
- 2351359 Косметика для профилактики и лечения избыточной массы тела
- 2351322 Препарат на основе низкомолекулярного индуктора интерферона
- 2351153 Диета при остеортрите собак
- 2350958 Способ определения групповой принадлежности синовальной жидкости
- 2350625 Производные гиалуроновой кислоты с пониженной биодеградируемостью
- 2150266 Крем после бритья
- 2350354 Фармацевтическое средство содержащие антагонист и фактор некроза
- 2350340 Способ коррекции процессов регенерации
- 2350309 Способ лечения избыточной массы тела с помощью рефлексотерапии
- 2250047 Профилактический продукт из хрящевой ткани гидробионтов
- 2249467 Медицинский матерьял и изделия на его основе
- 2055079 Способ получения препарата гиалуроновой кислоты
- 2349599 Биоадгезив мидии
- 2054903 Способ лечения коллагеноза у бычков на откорме
- 2249210 Способ прогнозирования предрасположенности к развитию и тяжести течения деформирующего остеоартроза коленного сустава у взрослых
- 2349339 Средство для соединительной ткани
- 2148988 Человеческий интерферона
- 2148399 Лечение атеросклероза
- 2148396 Способ определения активного вещества в дифильных мазевых основах
- 2148375 Способ диагностики близорукости
- 2348415 Способ противоспаечной терапии после хирургического вмешательства
- 2348400 Препарат на основе низкомолекулярного индуктора интерферона
- 2348386 Способ непроникающего хирургического лечения первичной открытоугольной глаукомы
- 2248213 Лечение Галактозидальной А недостаточности
- 2347586 Микрофлюидизированные эмульсии типа "масло в воде" и вакцинные средства
- 2147243 Контрастное средство
- 2146526 Лечебный препарат дисбактериоза и урогенитальных инфекций
- 2146148 Терапевтическое применение фактора роста кератиноцитов (ФРК)
- 2146139 Способ повышения активности макрофагов и комбинации для его осуществления
- 2346277 Способ диагностики специфического синовита
- 2345793 Ультразвуковые контрастные вещества и их получение
- 2345782 Терапевтические комбинации на основе PORIFERA для лечения и предотвращения кожных заболеваний
- 2245131 Способ коррекции косметических недостатков кожи
- 2245130 Способ активации восстановительных процессов в коже
- 2144833 Хондроитиназа
- 2344809 Получение твердых дозированных форм с использованием сшитого нетермопластичного носителя
- 2244540 Косметический гель для ухода за кожей лица
- 2244536 Способ лечения дегенеративно-дистрофических заболеваний тазобедренного сустава
- 2344167 Хмелевый экстракт
- 2143884 Агент регулирования дифференциации клеток кожи, культурная среда для клеток или тканей и способ регулирования дифференциации клеток кожи
- 2343932 Способ получения обладающих пониженной растворимостью в воде пленночных материалов
- 2343903 Устройство доставки лекарств для контролируемого введения препаратов
- 2048817 Способ получения материала для лечения ожогов и гнойно - некронических ран
- 2048803 Гидратантный крем
- 2242974 Средства и способы лечения воспалительных заболнваний
- 2142816 Способ получения антигерпетической вакцины
- 2342923 Средство для обработки рук с увлажняющим эффектом
- 2142781 Косметика для макияжа ресниц и бровей и агент ингирирующий рост микроорганизмов в косметических средствах
- 2242251 Трансплантируемые стенты с биоактивными покрытиями
- 2142257 Способ обработки глазных имплантантов и контакных линз
- 2342389 Мононатриевая соль
- 2342107 Способ устранения западения верхнего века при анофтальме
- 2141828 Средство, пролонгирующее эффективность чесночного порошка
- 2241489 Косметическое средство матриксных протеинов для залечивания ран
- 2241443 Средство для лечения герпеса
- 2241414 Способ получения протезов кровеносных сосудов
- 2341539 Гидрогель
- 2141324 Регулятор скорости воздействия препарата для инъекций
- 2141312 Косметическое средство для ухода за кожей лица
- 2341296 Средства и способы покрытия медицинских имплантантов
- 2341272 Средство для неспецифической иммунотерапии
- 2341266 Стенты с нанесенным покрытием содержащим N - (5-(4-(4-
- 2341257 Иммуномодулирующее средство
- 2341255 Средство для лечения климактерических расстройств
- 2240821 Способ лечения урологических инфекций
- 2140786 Способ лечения лишая
- 2140243 Способ хирургического лечения диабетической ретинопатии и отслоек сечатной оболочки
- 2240140 Медицинская многослойная повязка и изделия на ее основе
- 2240135 Культура клеток, содержащая клетки - предшественники остеонегеза, имплантант на ее основе и его использование для восстановления целостности кости
- 2240123 Экзогенные биологически активные коньюгирующие вещества
- 2139886 Фотоотвержаемое производное гликозаминогликата, сшитое производное гликозаминогликата и способы их получения, способ предотвращения клеточной и тканевой адгезии
- 2139729 Вакцина. Способ стимулирования иммунной системы
- 2339386 Средство обладающее радио - и химиозащитным действием
- 2339369 Лечение офтальмологических нарушений с использованием мочевины и ее производных
- 2139041 Гидратантный регенерирующий крем и способ его получения
- 2139039 Косметический суперкрем для ухода за кожей
- 2139017 Способ получения боисовместимого материала
- 2138503 Производные камптотецина, способы их получения, уникальное средство
- 2338556 Средство содержащие антагонист Р2Х - рецептора и нестероидное противоспалительное лекарственное средство
- 2338514 Косметическое средство для профилактики старения кожи
- 2138297 Медицинские устройства, подверженные вызываемому разложению
- 2138295 Покрытие для ран
- 2337906 Ингибиторы цитозольной фосфолипазы А2 Применение физиологически допустимого корпускулярного ферримагнитного или ферромагнитного материала. Способ формирования магнитометрического изображения
- 2137501 Устройство формирования изображения
- 2137477 Способ лечения заболеваний характеризующихся аутоиммунной агрессией
- 2137467 Крем для кожи лица и тела
- 2137449 Способ коррекции дефектов преломления в глазу млекопитающего
- 2137402 Пищевая Добавка БАД
- 2336899 Способ стимуляции миелопоэза
- 2336862 Способ получения раствора для лечения роговицы
- 2336830 Способ восстановления костных структур челюсти
- 2136696 Новый полипептид и средство против ВИЧ - Инфекции
- 2336092 Биоадгезивное средство, по существу свободное от воды
- 2336089 Средство и способ лечения заболеваний периодонтальных и пульпы
- 2336074 Средства и способы лечения заднего сегмента глаза
- 2235548 Ранозаживляющее средство
- 2135186 Способ лечения рефлекторных синдромов при остеохондрозе
- 2234945 Стабилизатор водного раствора и водосодержащего сырья
- 2334762 Растворимая ассоциативная карбоксиметилцеллюлоза
- 2234514 Макропористые хитозановые гранулы и способ их получения. Способ культивирования клеток
- 2133615 Средство для лечения неврологических заболеваний
- 2233164 Способ профилактики развития послеоперационных спаек брюшной полости
- 2133127 Неткатный материал, способ его получения и способ лечения
- 2333223 Альдегидные производные сиаловой кислоты и средства на их основе
- 2333007 Полипептидные вакцины для широкой защиты против рядов поколений менингококов с повышенной вирулентностью
- 2332985 Дозированные формы анестезирующих средств с длительным высвобождением для обезболивания
- 2132677 Косметическая маска
- 38603 Пленочный аппликатор
- 2232594 Средство содержащие ингибирующие остеокластогенез фактор и полисахарид
- 2332238 Средство для прокладок, раневых повязок и других изделий, контактирующих с кожей
- 2331668 Стромальные клетки, получение из жировой ткани, для заживления дефектов роговицы и внутриглазных дефектов и их использование
- 2331438 Альфа - 2 - Дельта Лигант для лечения симптомов нижних мочевыводящих путей
- 2331411Электропряденые аморфные фармоцевтические средства
- 2331367 Способ профилактики образования спаек и их рецидива
- 2130767 Масло в воде для получения косметических и дерматологических средств, способ косметической обработки
- 2230752 Поперечносшитые гиалуроновые кислоты и их применение в медицине
- 2230558 Способ восстановления и сохранения здоровья скмьи
- 2230550 Средства длительного высвобождения, способ их получения и применения
- 2230458 Поддержания здоровья суставов
- 2330290 Способ определения состояния метаболических процессов в ткани суставного хряща
- 2230073 Способ поперечного сшивания карбоксилированных полисахаридов
- 2329059 Способ лечения полипозного риносинусита
- 2329037 Комбинированная терапия для лечения иммуновоспалительных заболеваний
- 2128666 Гиалуроновая кислота и ее соли, способ очистки гиалуроновой кислоты, способ получения гиалуроновой кислоты. Фармацевтический препарат с гиалуроновой кислотой и средства с гиалуроновой кислотой используемые в офтальмологии
- 2328740 Способ экспресс - оценки действия зубных паст
- 2128502 Косметический гель
- 2328272 Суппозитории индуктора интерферона
- 2328268 Косметика содержащая амфолитный сополимер
- 2128057 Композиционная мембрана, способ ее получения и способ направленной регенерации тканей с ее применением
- 2128055 Средство замедленного освобождения и способ его получения
- 2128049 Свечи
- 2227743 Полипептидные варианты с повышенной гепаринсвязывающей способностью
- 2326893 Ковалентное и нековалентное сшивание гидрофильных полимеров
- 2326697 Новый перевязочный материал для быстрого заживления раневой поверхности кожи
- 2126264 Фармацевтическое средство с гиалуроновой кислотой
- 2326137 Способ получения содержащих альгинат пористых формованных изделий
- 2325902 Способ выделения гликозаминогликанов из минерализованной соединительной ткани
- 2225195 Репелленты против насекомых
- 2325193 Сосудистый стент
- 2325184 Улучшенные везикулы наружной мембраны бактерий
- 2325153 Многокомпонентная фармацевтическая дозированная форма
- 2325152 Удерживаемая в желудке система регулируемой доставки лекарственного средства
- 2029955 Способ предоперационного определения помутнения задней капсулы хрусталика при экстракции катаракты
- 2324688 Производные бисбензизоселеназолонила с противоопухолевым, противовоспалительным и антитромбоническим действием
- 2323017 Устройство и способ контролируемый доставки активных веществ в кожу
- 2323011 Содержащий Коллаген I и Коллаген II способный к рассасыванию внеклеточный матрикс, предназначенный для реконструирования хряща
- 2322955 Способ изготовления имплантанта для пластики дефектов хрящевой ткани
- 2322454 Антитело против CCR5
- 2322263 Система продолжительного высвобождения растворимого лекарственного средства
- 2221561 Витамин Е и его сложные эфиры
- 2321634 Гены участвующие в метаболизме углерода и продуцировании энергии
- 2321597 Биоматерьял, способ его приготовления и его применение, медицинское средство, имплантант и вкладыш
- 2121340 Средство для похудения
- 2220737 Средство для улучшения состояния опорно-двигательного аппарата
- 2220729 Гель используемый в стоматологии
- 2320720 Способ культивирования фибропластов для заместительной терапии
- 2320378 Накожный аппликатор
- 2320369 Средства, содержащие Альфа - 2 - Дельта Лиганды и ингибиторы обратного захвата серотонина/норадреналина
- 2320362 Местные фармацевтические средства, содержащие проантоцианидины, для лечения дерматитов
- 2320322 Биоадгезивная доставка лекарств
- 2320318 Чувствительное к температуре изменяющие состояние средство гидрогеля
- 2025120 Способ получения препарата, содержащего Фактор /G-CSF/, стимулирующий рост колоний гранулоцитов
- 2319490 Средство для введения железа при лечении синдрома беспокойных ног
- 25995 Содержащее адгезив приспособление для фиксации зубных протезов в полости рта
- 2218907 Средство для ухода за кожей лица и веками
- 2318830 Способ получения модифицированного дерматансульфата
- 2118153 Косметика - туш для ресниц
- 2217441 Способ получения полимера
- 2317296 Изетионатная соль селективного ингибитора CDK4
- 2217171 Мембрана для использования при направленной регенерации тканей
- 2317095 Экстракты ECHINACEA ANGUSTIFOLIA
- 2216332 Препарат для лечения астроза
- 2216314 Крем - маска для обезвоженной кожи
- 2316333 Средство оздоровительно-восстановительных косметических панто-магниевых ванн
- 2021304 Способ получения биологически активного средства
- 2115662 Способ получения гиалуроновой кислоты
- 2315627 Впрыскиваемые имплантанты на керамической основе для заполнения морщин, кожных впадин, шрамов
- 2315623 Средство получаемое путем лиофилизации препарата
- 2114862 Способ получения гиалуроновой кислоты
- 2314791 Лечебно-Косметическое средство
- 2314791 Косметический крем-бальзам для ухода за кожей лица и шеи
- 2214600 Способ оценки эффективности лечения неврологических проявлений
- 2114602 Способ косметической обработки
- 2114587 Раствор для защиты роговицы
- 2214283 Имплантант для подкожного или внутрикожного введения
- 2313370 Медицинские протезы, имеющие улучшенную биологическую совместимость
- 2313356 Препарат для лечения демодекоза
- 2313338 Средство на основе этиллинолеата и триэтилцитрата для лечения себореи и угрей
- 2313328 Косметика содержащая тонкодисперный и пористый порошок
- 2212880 Способ получения препарата содержащего антибиотик, с замедленным высвобождением активного вещества
- 2312640 Способ лечения Блефароконьюнктивальной формы синдрома сухого глаза
- 2017751 Способ получения гиалуроновой кислоты
- 2312145 Гены CORYNEBACTERIUM GLUTAMICUM, кодирующие белки, участвующие в синтезе мембран и мембранном транспорте
- 2311458 Белки вызывающие измененную иммуногенную реакцию. Способ их получения и использования
- 2311183 Улучшенное разделение с использованием гталуроновой кислоты
- 2311177 Ингибиторы интегрина для лечения заболевания глаз
- 2300069 Косметическая маска
- 2211024 Уход за сухой кожей
- 2310440 Раствор для защиты роговицы от повреждений
- 2309684 Лечение межфалангового остеоатроза узелковой формы
- 2309406 Способ мониторинга фиброза печени у больных хроническим гепатитом с (ХГС)
- 2209088 Опосредованная рецепторами доставка генов с использованием векторов на основе бактериофагов
- 2308967 Уменьшение объема ткани
- 2308962 Средство для опорно-дигательного аппарата
- 2308957 Способ получения препарата для мезотерапии
- 2308954 Средство для лечения ран, содержащее плазму или сыворотку крови
- 2308951 Комплексный способ профилактики вагинальных дисбактериозов
- 2308937 Косметическая биологически активная добавка и косметический литофитокомплекс на ее основе
- 2208638 ДНК (варианты), способ получения белка
- 2207885 Способ подачи небольшого объема лечебного раствора к целевому месту
- 2207858 Лишенные побочных эффектов производные простагландинов для лечения глаукомы
- 2207845 Твердая лекарственная форма пролонгированного действия
- 2207844 Препарат для местного неинвазивного применения
- 2207841 Средства с антиферментативным действием
- 2306335 Стволовые клетки и решетки полученные из жировой ткани
- 2306140 Новые рецепторы для Helicobacter pylori и их применение
- 2205612 Способ эндотелизации IN VITRO протезов кровеносных сосудов
- 2105540 Депигментирующее средство
- 2304960 Косметическое средство для кожи
- 2304616 Гены участвующие в гомеостазе и адаптации
- 2204550Способ получения длинноцепочечной N-Ацилированной кислотой Аминокислот
- 2204415 Способ получения изображения
- 2204394 Средство для лечения грибковых инфекций, желудочных язв
- 2204366 Способ хирургического лечения глаукомы
- 2104034 Вагинальное увлажняющие средство, способ его получения
- 2303991 Биологически активная добавка
- 2303990 БАД
- 2303973 Адсорбирующее изделие
- 2203676 Средство обладающее иммунокорригирующим действием
- 2203672 Способ предупреждения беременности
- 2303635 Гены кодирующие белки резистентности и толерантности к стрессам
- 2303529 Способ фиксации альгинатного геля на твердой фазе, способ получения клеточного чипа на его основе
- 2203078 Способ лечения гнойных ран
- 2302412 Гидразоно-малонитрилы
- 2102400 Способ получения гиалуроновой кислоты
- 2202356 Способ стимуляции репаративных процессов длительно незаживающих ран и трофических язв
- 2202336 Средство для ухода за кожей
- 2302231 Глазные капли
- 2102082 Способ магнитометрического исследования тела человека или животного
- 2301814 Полиакриламидный гидрогель
- 2201765 Гибридные матричные имплантанты и эксплантанты
- 2301677 Биотрансплантант для лечения дегенеративных и трвматических заболеваний хрящевой ткани и способ его получения
- 2301676 Способ лечения ревматизма
- 2301674 Способ лечения больных с переломами нижней челюсти
- 2301661 Средство с регулируемым освобождением и способ его получения
- 2005488 Средство для лечения болезней соединительной ткани
- 2200001 Крем для кожи
|
РОССИЙСКАЯ ФЕДЕРАЦИЯ

ФЕДЕРАЛЬНАЯ СЛУЖБА
ПО ИНТЕЛЛЕКТУАЛЬНОЙ СОБСТВЕННОСТИ
ПАТЕНТАМ И ТОВАРНЫМ ЗНАКАМ
|
Патент №2260445 |
54) СПОСОБ УСОВЕРШЕНСТВОВАНИЯ ТРАНСПОРТИРОВКИ ЧЕРЕЗ ЛЕГКО ПРИСПОСАБЛИВАЕМЫЙ ПОЛУПРОНИЦАЕМЫЙ БАРЬЕР
(57) Реферат:
Изобретение относится к химико-фармацевтической промышленности и касается способа контролирования потока пенетрантов через легко приспосабливаемый полупроницаемый пористый барьер; а также изобретение относится к пластырю, содержащему суспендированные в полярной жидкости пенетранты в форме жидких капелек, набора, содержащего состав, включающий диспергированные в полярной жидкости пенетранты, а также способ ведения состава, содержащего диспергированные в полярной жидкости пенетранты в тело млекопитающего или растения. Изобретение позволяет получить лекарственную форму с контролируемым высвобождением активного начала и ее применение в виде пластыря для введения лекарственного средства. 4 н.п. и 89 з.п. ф-лы, 4 табл., 14 ил. 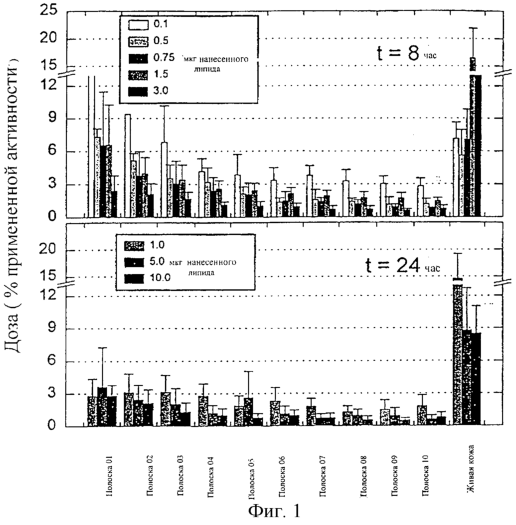
Настоящее изобретение относится к области введения лекарственных средств и особенно доставки лекарственных средств через легко приспосабливаемые барьеры. Это особенно касается способа контроля за потоком проникающей жидкости (пенетранта) через легко приспосабливаемый полупроницаемый пористый барьер. Изобретение, кроме того, касается наборов и пластырей, которые вместе делают возможньм контролируемое применение лекарственного средства.
Пористый барьер, как его используют в соответствии с изобретением, представляет собой любое препятствие, содержащее поры, которые являются слишком узкими, чтобы позволить пенетрантам проход за счет диффузии. Это обязательно подразумевает, что пенетранты больше, чем средний диаметр такой поры.
Некоторые барьеры, типа искусственных пористых мембран, например ионопроницаемые поликарбонатные мембраны, могут иметь постоянные свойства, в то время как другие характеризуются возможным изменением своих свойств. Наиболее заметно изменение размера пор и реже изменение плотности пор в зависимости от среды и/или потока проникающей жидкости через поры в барьере. Последний случай может быть найден в живых тканях, которые имеют границы с такими свойствами, например клетки и клеточные органеллы.
Кожа представляет собой дальнейшую иллюстрацию основного принципа такого барьера.
Максимальные барьерные свойства кожи находятся в наиболее удаленной внешней области кожи, то есть в ее наружном слое (роговой слой). Это происходит вследствие специфических химических и анатомических характеристик наружного слоя, который предотвращает наиболее эффективно проход по существу любого материала через кожу.
В роговом слое 20-30 последовательных слоев клеток кожи (в основном гомеоциты) организованы в колонны. Эти колонны ориентированы перпендикулярно к поверхности кожи, позволяя клеткам от смежных колонн наложиться латерально (со стороны) и вынуждая клетки одного слоя проникать друг в друга, так чтобы они были плотно упакованы. Межклеточные переходы в наружном слое, кроме того, являются сильно изолированными с помощью специализированных липидов, в основном церамидов, которые изобилуют в коже. Липиды кожи также хорошо упакованы: обычно они образуют мультиламелярные липиды, которые соединены ковалентно с соседней клеточной мембраной (типа-конверт). Индивидуальные мультиламелярные стопки, которые находятся параллельно поверхности клеток, объединяются вместе с менее определенными липидными областями. В таких областях преобладают нецерамидные липиды (жирные кислоты, холестерилсульфат, и т.д.).
Тенденция липидов кожи к самосборке в плотно упакованные мультиламелярные структуры усиливается или даже управляется гидратированием или градиентами концентрации некоторых ионов (например, Са++) в коже. Это может объяснить, почему некоторые подобные организации липидов не наблюдаются в других местах тела, кроме полости рта, где это происходит в несколько меньшем количестве.
Химические усилители проникновения в кожу, например диметилсульфоксид, усиливают диффузию лекарственных средств через кожу за счет сольюбилизирования или экстракции некоторых межклеточных липидов из барьера. Чрескожный транспорт, поэтому наиболее эффективен в некоторых не сильно упакованных областях липидов, где гидрофобные поры в барьере создаются наиболее легко. Такие поры достаточно малы и липофильные агенты могут диффундировать по чрескожному градиенту(ам) концентрации. Полученная проницаемость кожи является независимой от концентрации агента, если агент не действует в качестве усилителя, но при этом проходимость зависит от концентрации и выбора химического усилителя проникновения кожи. Однако гидрофобные поры в коже не достаточно велики, чтобы позволить заметный проход больших лекарственных средств любого вида. Вследствие тенденции липидов кожи к самосборке в плотно упакованные мультиламелярные структуры межклеточных липидных областей, такие поры живут довольно мало. Липофильность типичных пор в коже также препятствует проходу гидрофильных, то есть высоко полярных молекул через орган. Таким образом, обычное повышение проникновения кожи полезно только для доставки гидрофобных продуктов, которые не раздражают кожу слишком сильно, при этом усиленный проход и раздражение плохо воспринимаются потребителями в большинстве случаев.
Таким образом, до настоящего времени, проникновение, в основе которого лежит доставка лекарственного средства через кожу, действительно успешно осуществляется только для лекарственных средств небольшого размера с молекулярной массой ниже 400 Da (дальтон). Такие лекарства могут проникать в межклеточную матрицу липидов в коже и затем рассеиваться через маленькие гидрофобные поры в роговом слое, сначала в основание кожи, а затем далее вниз к глубоким тканям тела. Полученному устойчивому проходу предшествует короткая задержка, в течение которой лекарственное средство пересекает барьер. Однако чрескожный проход не страдает от первого эффекта при прохождении молекул.
Биодоступность лекарств, доставляемых через кожу такими обычными средствами, обычно ниже 50% и часто не достигает даже 25% (Hadgraft, 1996; Cevc, 1997).
Большие гидрофобные молекулы обычно пересекают кожу только в незначительном количестве. Как уже упомянуто выше, это происходит из-за недостатка подходящих проходов в коже. Чрескожный транспорт макромолекул поэтому в основном полагается на молекулярную диффузию через шунты (сбросы), типа волосообразующих луковиц (pilosebaceous). Чтобы доставить большую и сильно полярную молекулу через кожу требуются другие методы, чем те, которые традиционно используют. Например, используют различные варианты кожных порообразовании, чтобы создать гидрофильные поры в коже, подходящие для этих целей (для того, чтобы избежать путаницы, такие гидрофильные поры названы каналами):
Самое простое и обычное решение для создания широкого канала через кожу, заключается в механическом устранении кожного барьера. Например, чтобы доставить большой, гидрофильный антидиуретический пептид 1-деамино-8-D-аргинин вазопрессин через человеческую кожу из герметичного пластыря, используют удаление маленькой части эпидермиса вакуумным всасыванием (Svedman и другие, 1996).
Другой, наиболее общий метод для открытия широкого канала через кожу, состоит в том, чтобы использовать иглу для инъекции или механическое воздействие(я) (впрыскивание; введение порошка). Ограниченное разрушение кожи также возможно в местном масштабе. Это может быть сделано местным подводом тепла (термопорация); используя высокий импульс напряжения (>150 В; электропорация); или акустической энергией, типа ультразвука (несколько ватт на см2; зонопорация). Полученный размер канала зависит от природы и интенсивности обработки кожи, но не от характера или общего количества молекул, которые нужно транспортировать.
Отверстия или даже кратеры в коже, созданные вышеупомянутыми методами, заживают довольно медленно при нормальных условиях; чем более широкий проход, тем дольше он заживает. Кожа, таким образом, может вести себя как приспосабливаемый, но медленно восстанавливаемый барьер.
Даже наиболее используемые методы для создания пор в коже полагаются на используемую технику и плюс опыт для основной операции; они также включают дезинфекцию кожи для того, чтобы защитить пациента. Это допускается, несмотря на приносимый вред и неудобство, в тех случаях, когда достигают терапевтический эффект.
Среди последних достижений для создания гидрофильных проходов в таких барьерах, как кожа, является использование микроскопических барьерных проникающих жидкостей (пенетрантов), которые прямо и обратимо открывают указанные гидрофильные каналы. Указанные пенетранты являются независимыми от внешнего источника энергии и, кроме того, не полагаются ни на какую технику. Они также хорошо воспринимаются кожей.
Такие пенетранты, известные до настоящего времени, все принадлежат к классу высокодеформируемых сложных капелек (Transfersomes®). Такие капельки легко приспосабливаются, адаптируются к порам барьера, который они затем эффективно пересекают - при условии, что компоненты капельки и приготовление основательно выбраны и/или оптимизированы. Достаточно отобранные и гидрофильные капельки могут поэтому спонтанно пересечь барьер, такой как кожа. Такие гидрофильные каналы открываются скоротечно при движении пенетрантов после того, как последние приспособили свою форму, чтобы выполнить свое назначение. Это позволяет приспосабливаемым капелькам действовать в виде носителя для доставки различных гидрофильных или гидрофобных веществ через барьер.
Наиболее полезные капельки включают водное ядро, окруженное гибким и смешанным бислоем липидов, который делает агрегат ультрадеформируемым и, в поверхностном слое, крайне гидрофильным. Оба качества требуются для эффективного чрескожного транспорта (Cevc, 1997). Было продемонстрировано, как указанные капельки довольно эффективно транспортируют свою массу через кожу при оптимальных условиях применения (Cevc, 1997).
Другие типы агрегатов (липосомы, ниосомы, наночастички, микроэмульсии и так далее) также определялись как способные эффективно пересекать кожу, но очень редко, если это было когда-либо доказано, доставляли связанные лекарства через кожу в практически заметных количествах. Было показано, что в отличие от высокодеформируемых капелек (Transfersomes®), используемые агрегаты являются или недостаточно деформируемыми и/или слишком неустойчивыми, чтобы достичь цели.
Вместо этого обычные агрегаты действуют просто в качестве резервуаров лекарственного средства на коже: агрегаты, не способные к преодолению барьера, остаются на коже, в то время как лекарственное средство освобождается постепенно от "транспортного средства" и затем вероятно диффундирует через кожный барьер в его собственном виде. Главное действие загруженных обычным лекарственным средством суспензий заключается в повышении гидратации кожного барьера и/или выделения молекул с повышенной способностью проникновения через кожу в ткани.
Напротив, сложные, ультрадеформируемые липидные капельки (Transfersomes ®) изменяются и затем проникают через кожу быстрее, чем слипаются в месте применения. Такое движение агрегатов через кожу, кажется, проходит по естественному градиенту(ам) влажности между клетками кожи, который проводит агрегаты в гидрофильные(виртуальные) каналы в органе.
Предшественники указанных каналов, которые способствуют высокоадаптируемому проходу капелек через кожу, первоначально настолько узки, что они только дают возможность молекулам воды испаряться через кожу. Эти первоначальные крошечные поры (диаметр <0,5 нм), представляются обратимо открытыми, как бы то ни было, когда напряжение от частичной дегидратации капельки, которая, по-видимому, выталкивается в устье канала, при не герметичных условиях, становится черезмерным. Сильная гидрофильность и большая масса капельки являются факторами, которые делают максимальной тенденцию капелек двигаться через кожу; однако адаптируемость капельки является необходимым условием для успеха в указанном движении.
Движение капелек через кожу вероятно проходит по пути, который используют молекулы воды во время прохода через кожу в противоположном направлении. Капельки, таким образом, направляются в межклеточные области, в те точки, где контакты между вышеназванными изолирующими липидами кожи являются самыми слабыми и наименее напряженными. Соответствующую область кожи, охваченную каналами, оценивают как составляющую около 4% от общей поверхности кожи или даже меньше.
Имеется возможность связать маленькие и большие, гидрофобные и гидрофильные молекулы с ультрадеформируемыми и легко приспосабливаемыми каплеподобными агрегатами. При использовании таких сложных агрегированных капелек все типы молекул могут быть доставлены через барьер, такой как роговой слой (stratum comeum).
Обычно достигают высоких возможностей переноса лекарственного средства. Относительная эффективность переноса через кожу превышает в большинстве случаев 50% (Cevc и другие, 1996). Устойчивое состояние достигается в течение нескольких часов и более (CevcetaL, 1998).
Уже доказано, что кожный барьер полностью восстанавливается после того, как эти капельки устраняют с поверхности кожи. Напротив, каналы, созданные другими средствами, например ультразвуком, остаются открытыми, по крайней мере, 20 часов. Фактически, они не закрываются полностью в течение 2 дней, даже когда используют относительно слабый терапевтический ультразвук. Более сильное разрушение приводит к постоянным повреждениям кожи (Mitragotri и другие, 1995). (В чрезвычайном случае, когда барьер устранен вакуум-всасыванием, кожа не восстанавливается полностью в течение 8 недель.)
Точное распределение по размерам в коже каналов, через которые высокодеформируемые капельки спонтанно мигрируют через роговой слой (stratum comeum) является пока еще неизвестным. Однако вероятно, что они являются асимметричными. Средняя ширина, то есть максимум распределения, как оценивают, составляет 20-30 нм, при обычно используемых условиях применения. Искаженное распределение может следовать из-за существования двух количественно различных, но качественно подобных межклеточных транспортных путей через кожу (Schatzlein и Cevc, 1998), которые вместе формируют семейство чрескожных проходов.
Во-первых, межкластерный путь, который проходит между группами корнеоцитов. Он представляет собой распределение каналов по размерам с тянущимся длинным хвостом и обычно начинается на дне узкого межкластерного прохода. Отсюда он проходит плотный материал, наполняющий такой узкий проход, и обеспечивает самую низкую устойчивость к транспорту в переходах, где встречаются несколько кластеров.
Во-вторых, внутрикластерный путь, который проходит между индивидуальными корнеоцитами в каждом кластере корнеоцитов. Этот маршрут обычно проходит по поверхности липидных слоев. В проекции, по внешней трети рогового слоя, межкорнеоцитный путь имеет сходство с переплетенной меж собой трехмерной сетью, включающей все клетки в органе (Schatzlein и Cevc, 1998).
Вышеупомянутые различия являются количественными в природе. Без сомнения существует мнение о том, что чрескожные каналы, за исключением волосяных луковиц, являются устойчивыми к проходу недеформированых, больших агрегатов.
Свойства канала также являются по существу постоянными по отношению к обнаруживаемой изменяемости небольшого межрасположения, межиндивидуальности, межвидов или межносителя. Согласно предшествующему уровню техники относительная биопригодность различных лекарств в крови после того, как используют подкожное введение в виде легко приспосабливаемых капелек (Transfersomes ®), является довольно постоянной (Cevc, 1997). Распределение пор мало зависит от природы пенетранта или от лекарственного средства. Это же касается зависимости от дозы, которая предназначена для оказания влияния просто на глубину пенетранта и распределения лекарственного средства. Маленькая доза в районе действия, как найдено, благоприятствует локальному (поверхностному) удерживанию, в то время как большая доза гарантирует относительно большую системную пригодность.
Удивительно и вопреки вышеупомянутому заключению было выяснено, что изменение нанесенной дозы выше некоторого порога и в достаточно широком диапазоне не только воздействует на распределение лекарственного средства пенетранта, но также и определяет степень прохода пенетранта через барьер.
Новая и неожиданная находка обеспечивает средства для контролирования скорости чрескожного прохождения лекарственного средства всякий раз, когда используют легкодеформируемые носители при проходе через барьер; это также обеспечивает основание для лучшего, то есть более рационального, проекта устройства прохождения. Это особенно выгодно для развития кожных пластырей, подходящих для использования в комбинации с высокоприспосабливаемыми носителями (Transfersomes ®). Улучшенная терапия и высокая коммерческая ценность изделий впоследствии должна иметь место.
Видно, что наблюдаемый новый эффект отражает расширение каналов в барьере, но это только одна из гипотез. Недавно обнаруженное расширение дозозависимых пор вероятно различно для всевозможных чрескожных каналов: первоначально более узкая пора вероятно заменяется на относительно более широкую (например, межкластерные) каналы. Эффект относительного размера канала, то есть канала, соответствующего размеру пенетранта, дает возможность предположить, что будет требоваться намного большее время, чтобы перенести некоторое количество пенетрантов через узкие, чем через широкие каналы.
Если каналы действуют как транспортные массовые дискриминаторы и регулируют свою ширину по требованию потока, узкие каналы остаются намного дольше в своей первоначальной, высокой устойчивости к пенетрантам, чем широкие каналы. Однако отвечая многочисленным проходам пенетрантов увеличением ширины, такие каналы начнут вести себя, как первоначально более широкие каналы. Многократные регулирования возможны, но только с некоторым верхним пределом.
Другим потенциально важным фактором, действующим в том же направлении, является гидратация поверхности кожи, которая склонна к увеличению в зависимости от применяемой дозы. В любом случае средняя ширина и распределение по размерам каналов в коже будут сдвинуты с увеличением вводимой дозы к большим значениям ширины. Это, таким образом, приведет к более сильному, окончательному чрескожному потоку.
Уже описаны наборы и более сложные устройства для проведения лекарственных средств через барьер, такой как кожа или слизистые оболочки. Эти устройства могут быть, как правило, разделены на матричные системы и жидкие резервуарные системы.
Контейнерный тип резервуаров часто формируется как карман между поддерживающим или тыльным слоем и контролирующей скорость мембраной, через которую лекарственное средство проходит к коже. Чувствительный к давлению липкий (адгезивный) слой обычно располагается под мембраной и лекарственное средство также проходит через него по пути к коже.
Как упомянуто выше, является общепринятым готовить пластырь резервуарного типа для черезкожного прохождения лекарственного средства из поддерживающей мембраны и мембраны, контролирующей скорость (Ogiso, Т., Y. Ito, et al. (1989). "Membrane-controlled transdermal therapeutic system containing clonazepam and anticonvulsant activity after its application." Chem Pharm Bull (Tokyo) 37, 446-9; Ito, Y., Т. Ogiso, et al. (1993). "Percutaneous absorption of acemetacin from a membrane controlled transdermal system and prediction of the disposition of the drug in rats" Biol. Pharm. Bull 16, 583-8).
Было описано множество резервуарных систем.
Патент США №829224, Chang и другие, например, раскрывает устройство с резервуаром, который определен поддерживающим слоем и слоем проницаемой мембраны, через которую проходит лекарственное средство. Кольцевидный клеевой слой является периферийным по отношению к резервуару. Легкоотслаивающийся слой прокладки находится под мембраной. Второй легкоотслаивающийся слой, прокладка высвобождения, лежит в основе всего устройства. Первая теплоизолирующая прокладка соединяет поддерживающий слой и мембрану и окружает резервуар. Вторая теплоизолирующая, концентрическая относительно первой теплоизолирующей прокладки, соединяет поддерживающий слой и прокладку высвобождения. Вторая теплоизоляционная прокладка оказывается разрушенной, когда прокладку высвобождения удаляют. Устройство может включать внутреннюю прокладку, которая лежит в основе мембраны и частей поддерживающего слоя. Эта внутренняя прокладка может быть удалена после удаления прокладки высвобождения так, чтобы мембрана была выставлена наружу.
Патент США №4983395, Chang и другие, касается другого устройства с поддерживающим слоем и мембранным слоем, которые представляют собой резервуар.
Легкоотслаиваемая внутренняя прокладка лежит в основе резервуара и поддерживающего слоя и мембранных слоев вне периферии резервуара. Липкий слой лежит в основе внутренней прокладки и остающихся частей поддержки и мембранных слоев. Легкоотслаивающая прокладка высвобождения лежит в основе липкого слоя. Первая теплоизолирующая прокладка соединяет поддерживающий и мембранный слои на периферии резервуара. Вторая теплоизолирующая прокладка лежит в основе первой теплоизолирующей прокладки и соединяет мембрану и внутреннюю прокладку. При использовании прокладка высвобождения и внутренняя прокладка легко удаляются, чтобы выставить снизу мембранные и липкие слои до помещения устройства на кожу или слизистую оболочку.
Международная заявка WO 96-19205, Theratech, Inc., раскрывает устройство для нанесения активного агента на кожу или слизистую оболочку индивидуума, включающее многослойное соединение липкого верхнего слоя, поддерживающего слоя, лежащего в основе центральной части липкого верхнего слоя, проницаемую для активного агента мембрану, поддерживающий слой и мембрана образуют резервуар, который содержит состав активного агента, отслаивающегося изолирующего диска, лежащего в основе проницаемой для активного агента мембраны, теплоизолирующей прокладки, находящейся на периферии отслаивающегося изолирующего диска, при этом проницаемая для активного агента мембрана и поддерживающий слой, а также удаляемая прокладка высвобождения, лежат под удаляемым верхним слоем и отслаивающимся изолирующим диском. Липкий слой находится наверху и является периферийным на пути активного агента к коже или слизистой оболочке и защищен от разложения компонентами резервуара, разнообразными теплоизолирующими прокладками. Отслаивающийся изолирующий диск защищает от выпуска активного содержимого агента из резервуара, и прокладка высвобождения защищает клей от выделения до использования в окружающей среде.
Патент США №5202125, Theratech, Inc., описывает трансдермальную систему прохождения для доставки нитроглицерина, которая поставляет лекарственное средство в увеличенных трансдермальных потоках. Системы включают, в дополнение к нитроглицерину, усилитель проникновения, который является или сложным эфиром сорбитола, или C8-C22 алифатическим спиртом, или их смесью. Способы введения нитроглицерина, использующие такие усилители проникновения, также раскрыты.
Международная заявка WO 90-11065, Theratech, Inc. раскрывает трансдермальное устройство доставки лекарственного средства, включающее резервуар, сделанный из поддерживающего слоя и слоя проницаемой мембраны, через которую проходит лекарственное средство, легкоотслаивающуюся внутреннюю прокладку, которая лежит в основе резервуара и части поддерживающей прокладки /мембраны внешней периферии резервуара, липкий слой, который лежит в основе внутренней прокладки и внешних простирающихся частей мембраны/ поддерживающего слоев, и слоя легкоотслаивающейся прокладки высвобождения, которая лежит в основе липкого слоя с первой постоянной теплоизолирующей прокладкой между поддерживающим слоем и мембраной по периметру резервуара и другой легкоотслаивающейся (непроницаемой) теплоизолирующей прокладкой между мембраной и внутренней прокладкой, лежащей в основе первой постоянной теплоизолирующей прокладки, теплоизолирующих прокладок и легкоотслаивающего барьерного слоя, обеспечивающего барьеры, которые изолируют состав лекарственного средства от клея.
В зависимости от особенностей, которые будут достигнуты, поддерживающие пленки являются или герметичными, или проницаемыми и обычно их получают из синтетических полимеров, таких как полиэфиры, полиэтилен, поливинилиден хлорид (PVDC), полиуретан или природных полимеров, типа ваты, шерсти, и т.д. Возможно использовать в качестве поддерживающего слоя в трансдермальных пластырях также непористую или микропористую полипропиленовую или полиэтиленовую пленку, а также макропористые ткущиеся и неткущиеся материалы, такие как вата, шерсть и так далее. Поддерживающие слои вообще выбираются из этих материалов в зависимости от активного агента, который будет использован.
Герметичные поддерживающие слои в классических TTS (транстедмальных транспортных системах) имеют тенденцию промотировать более высокое осаждение и более высокую скорость проникновения активных или не активных компонентов в кожу по сравнению с негерметичным поддерживающим слоем. Герметичные поддерживающие слои, например, пригодны для увеличения степени доставки стероидов к более низким слоям эпидермиса при лечении воспалений и дерматозов. Примерами являются Actiderm ® (дерматологический пластырь) или Cordran ® (лента и пластырь).
Полугерметичные пленки, такие как полиуретаны и полиолефиновые сополимеры, и негерметичные ткущиеся и не ткущиеся волоконные материалы, такие как вата и полиэфиры, позволяют переход водяного пара от поверхности кожи и от пластыря. Эти полугерметичные или негерметичные материалы редко используются в виде поддерживающих материалов в TTS. Более толстые негерметичные поддерживающие пленки были весьма желательны в изделиях для удаления мозолей, так как активный агент должен быть подан только к внешним слоям рогового слоя. Негерметичные ткущиеся и неткущиеся материалы, используемые во многих из этих изделий, главным образом служат в виде защитной прокладки.
Мембраны, контролирующие интенсивность прохождения, которые обычно используют в коммерческом TTS, являются тонкими (26 - 78 мкм) непористыми этиленвинилацетатными пленками, такими как Transderm-Nitro® (Ciba-Geigy and ZAFFARONI) Duragesic®, Estraderm®, и EstraGest®. Кроме того, тонкие (26-78 мкм) микропористые пленки из полиэтилена, такие как Transderm-Scop®, Catapres®, используют как контролирующие интенсивность прохождения мембраны в мультислоистых пластырях с твердым резервуаром или в жидких резервуарах TTS.
Дальнейшими примерами таких микропористых полиэтиленовых мембран являются мембраны  -Estro® и Androderm®. Эти мембраны обычно служат для ограничения степени диффузии лекарственного средства на или через кожу. -Estro® и Androderm®. Эти мембраны обычно служат для ограничения степени диффузии лекарственного средства на или через кожу.
Как уже описано выше, Transfersomes® способны осуществить проход лекарственного средства или агента через кожу вследствие существования градиента гидратации вдоль биологического барьера. Вопреки общепринятым трансдермальным транспортным системам, где передвижение агента обычно зависит от классического закона (Fick's) диффузии Фика, терапевтические системы, подходящие для Transfersomes® и полезные для способа по настоящему изобретению, должны удовлетворять различньм требованиям.
Является проблемой то, что Transfersome® - осуществляемый проход лекарственного средства через кожу из пластыря, затруднен, если используют герметичный поддерживающий материал. Использование герметичной мембраны в виде поддерживающего слоя приводит к увеличенной гидратации Transfersomes®, так как пары не могут просачиваться из пластыря. Соответственно, градиент гидратации и поэтому движущая сила для Transfersome® транспорта заметно снижается.
Другая проблема состоит в том, что многие из негерметичных ткущихся и неткущихся поддерживающих материалов, которые обычно служат в виде защитных прокладок, удерживают Transfersomes®, из-за адсорбции и поглощения липидов и белков в структуре волокна.
Кроме того, любые классические микропористые и не пористые контролирующие скорость мембраны, имеющие размер пор меньше чем приблизительно 20 нм, могут мешать проходу через поры Transfersomes® из-за своего размера.
Очевидно, что для специалиста в данной области известные трансдермальные пластыри, имеющие обычный поддерживающий материал и полупроницаемую мембрану не подходят для использования Transfersomes® согласно настоящему изобретению. Это же касается пластырей, выполненных по матричному типу.
Матричным типом трансдермального пластыря являются те пластыри, в которых лекарственное средство содержится в и выделяется из полимерной матрицы. Матрица обычно сделана из чувствительного к давлению адгезива и занимает основную поверхность пластыря (то есть поверхность, прикрепленную к коже).
Было описано множество матричных систем.
Патент США №5460820, Theratech, Inc., раскрывает метод обеспечения заместительной терапии тестостерона у женщин, имеющих потребность в такой терапии, включающий применение поставляющего тестостерон пластыря, расположенного на коже женщины, при этом пластырь трансдермально поставляет женщине от 50 до 500 мг/день тестостерона. Накожный пластырь включает многослойную композицию из поддерживающего слоя и матричного слоя, включающего раствор тестостерона в полимерном носителе, причем матричный слой обеспечивает достаточную суточную дозу тестостерона, чтобы обеспечить указанную терапию.
Патент США №5783208, Theratech, Inc., раскрывает матричный тип трансдермального пластыря для двойного введения эстрадиола и другого стероида, где матрицу получают из N-винил-2-пирролидона, содержащего чувствительный к давлению акриловый сополимерный клей, эстрадиол, другой стероид, и, необязательно, усилитель проникновения, при этом соответствующий поток эстрадиола и другого стероида от матрицы является независимым от соответствующих концентраций другого стероида и эстрадиола в матрице.
Как было упомянуто выше, обычно готовят пластырь для трансдермального прохождения лекарственного средства с резервуаром из поддерживающей мембраны и контролирующей интенсивность прохода мембраны. Эти мембраны формируют обычно один слой, которой содержит соответствующий состав. Этот состав может быть, главным образом, спиртовым или водным раствором, водной суспензией или гелем, и который содержит гельформирующие полимеры. Параметры, такие как химическая и физическая стабильность, вязкость, концентрация активного компонента(ов) и наполнителей, не являются критическими относительно коммерческого однослойного резервуарного типа пластырей, так как большинство наиболее активных компонентов (лекарств), являются устойчивыми низкомолекулярными веществами (никотин, фентанил, эстрадиол, скополимин и другие), которые обычно не препятствуют, например, дополнительным компонентам, таким как антиоксиданты, стабилизаторы, дополнительные растворители или усилители проникновения.
Как было уже упомянуто, Transfersome®, осуществляющие доставку лекарственных средств через барьеры, явно отличаются от общепринятого транспорта лекарственного средства через кожу. Поскольку является невозможным введение высокомолекулярных лекарств с помощью трансдермальных пластырей, известных в этой области, Transfersomes® в принципе оказываются подходящими переносчиками для высокомолекулярного лекарственного средства, такого как пептид (например, инсулин) и белка (сывороточный альбумин). Для специалиста в данной области ясно, что проблемы могут возникать при хранении, если, например, лабильные белки смешивают с несмешивающимися или дестабилизирующими компонентами в обычных однослойных пластырях.
Во многих случаях достаточная стабильность всех компонентов не достижима в пределах одного слоя пластыря. Например, Transfersome® -формирующие фосфолипиды являются наиболее устойчивыми при рН 6,5, в то время как белки могут иметь другие значения рН для оптимальной стабильности (например, интерферрон- -2b при рН 7,4 или рН 3). Поэтому было бы необходимо держать указанные вещества в различной среде, если хранение является достаточно долгим. Например, Transfersomes типа-Т созданы и хранятся в фосфорнокислом буфере, в то время как фактор роста гепатоцита (HGF) является устойчивым в лимоннокислом буфере. Более того, обычно органические растворители (дополнительные растворители) используют, чтобы ввести антиоксиданты, такие как ВНТ, в липидные агрегаты. Эти дополнительные органические растворители могут вносить вклад в уменьшение растворимости белков, так как они понижают диэлектрическую константу, таким образом уменьшая электростатическое отталкивание. Это может вести к неконтролируемой, крайне нежелательной, агрегации и денатурации белков. -2b при рН 7,4 или рН 3). Поэтому было бы необходимо держать указанные вещества в различной среде, если хранение является достаточно долгим. Например, Transfersomes типа-Т созданы и хранятся в фосфорнокислом буфере, в то время как фактор роста гепатоцита (HGF) является устойчивым в лимоннокислом буфере. Более того, обычно органические растворители (дополнительные растворители) используют, чтобы ввести антиоксиданты, такие как ВНТ, в липидные агрегаты. Эти дополнительные органические растворители могут вносить вклад в уменьшение растворимости белков, так как они понижают диэлектрическую константу, таким образом уменьшая электростатическое отталкивание. Это может вести к неконтролируемой, крайне нежелательной, агрегации и денатурации белков.
Важной задачей настоящего изобретения является обеспечение управления потоком высокодеформируемых пенетрантов (Transfersomes®) через легко приспосабливаемый полупроницаемый пористый барьер, такой как кожа человека, или тела животного, или растения. Другим объектом настоящего изобретения является обеспечение контроля за потоком пенетрантов с высокодеформируемой формой (Transfersomes®) через легко приспосабливаемый полунепроницаемый пористый барьер при использовании набора или трансдермальной транспортной системы, который дает возможность применения состава с выбранной дозой на площадь поверхности. Кроме того, объектом изобретения является трансдермальный пластырь резервуарного типа, пригодный для доставки с помощью Transfersome® - агента или лекарственного средства через интактную кожу. Другим объектом настоящего изобретения является стабильный в течение длительного срока многослойный трансдермальный пластырь резервуарного типа, который содержит отделенные друг от друга слои и является пригодным для доставки Transfersome® - промежуточного агента или лекарственного средства через интактную кожу.
Согласно настоящему изобретению этого достигают за счет способа контролирования потока пенетрантов через легко приспосабливаемый полупроницаемый пористый барьер, содержащий следующие стадии:
- приготовление состава путем суспендирования или диспергирования указанных пенетрантов в полярной жидкости в форме жидких капелек, окруженных подобным мембране покрытием из одного или нескольких слоев, указанное покрытие, содержащее по крайней мере две разновидности или формы амфифильных соединений с тенденцией к агрегации, при условии что
- указанные по крайней мере два вещества отличаются по крайней мере коэффициентом растворимости, равным 10, в указанной полярной жидкости,
- и/или указанные вещества, когда они находятся в форме гомоагрегатов (для более растворимого вещества) или гетероагрегатов (для любой комбинации обоих указанных веществ) имеют предпочтительный средний диаметр меньший, чем диаметр гомоагрегатов, содержащих только менее растворимые вещества,
- и/или более растворимое вещество имеет тенденцию солюбилизировать капельку и содержание такого соединения составляет вплоть до 99% мол. от концентрации солюбилизации или по другому соответствует вплоть до 99% мол. от концентрации насыщения в несолюбилизированной капельке, которая всегда выше,
- и/или присутствие более растворимого вещества снижает среднюю энергию упругости подобного мембране покрытия на величину по крайней мере в 5 раз ниже, более предпочтительно по крайней мере в 10 раз ниже и наиболее предпочтительно более чем в 10 раз ниже, чем средняя энергия упругости эритроцитов или фосфолипидных бислоев с жидкими алифатическими цепями,
- указанные пенетранты способны переносить агенты через поры указанного барьера или способны облегчать проникновение агента через поры указанного барьера, после того как пенетранты вошли в поры,
- выбора дозированного количества указанных пенетрантов, которые должны быть применены на заранее определенной площади указанного барьера для контролирования потока указанных пенетрантов через указанный барьер,
- нанесения выбранного дозированного количества указанного состава, содержащего указанные пенетранты на указанную площадь указанного пористого барьера.
Предпочтительно если поток пенетрантов через указанный барьер возрастает при увеличении количества применяемой дозы указанных пенетратов.
Значение рН состава предпочтительно выбирают из интервала между 3 и 10, более предпочтительно между 4 и 9 и наиболее предпочтительно между 5 и 8.
Согласно другой предпочтительной особенности настоящего изобретения состав, включающий пенетранты, содержит:
- по крайней мере один загуститель, взятый в таком количестве, чтобы повысить вязкость состава максимально до 5 нм/с, более предпочтительно вплоть до 1 нм/с и наиболее предпочтительно вплоть до 0,2 нм/с, так что состав намазывают сверху, и на площади нанесения создается возможность задержать лекарственное средство,
- и/или по крайней мере один антиоксидант, взятый в таком количестве, которое снижает увеличение индекса окисления до значения, ниже 100% на период в 6 месяцев, более предпочтительно менее чем на 100% на период 12 месяцев и более предпочтительно менее чем на 50% на период 12 месяцев,
- и/или по крайней мере одно бактерицидное средство, взятое в количестве, которое снижает количество бактерий с 1 миллиона зародышей, добавленных на г общей массы состава до менее чем 100 в случае аэробных бактерий, до менее чем 10 в случае энтеробактерий и менее чем 1 в случае Pseudomonas aeruginosa или Staphilococcus aureus, после периода в 4 дня.
Кроме того, является предпочтительным, если указанное по крайней мере одно бактерицидное средство добавляют в таком количестве, которое снижает количество бактерий с 1 миллиона зародышей, добавленных на 1 г общей массы состава, до менее чем 100 в случае аэробных бактерий, и менее чем 10 в случае энтеробактерий, и менее чем 1 в случае Pseudomonas aeruginosa или Staphilococcus aureus, после периода в 3 дня и более предпочтительно после периода в 1 день.
Кроме того, является предпочтительным, если указанный загуститель выбирают из класса фармацевтически приемлемых гидрофильных полимеров, таких как частично этерифицированные производные целлюлозы, такие как карбоксиметил-, гидроксиэтил-, гидроксипропил-, гидроксипропилметил- или метилцеллюлоза; полностью синтетических гидрофильных полимеров, таких как полиакрилаты, полиметакрилаты, поли(гидроксиэтил)-, поли(гидроксипропил)-, поли(гидроксипропилметил)метакрилаты, полиакрилонитрилы, металлилсульфонаты, полиэтилены, полиоксиэтилены, полиэтиленгликоли, полиэтиленгликольлактиды, полиэтиленгликольдиакрилаты, поливинилпирролидоны, поливиниловые спирты, поли(пропилметакриламиды), поли(пропиленфумарат -со-этиленгликоли), полоксамеры, полиаспартамиды, (поперечно-сшитый гидразин) гиалуроновые кислоты, силиконы; природные смолы содержащие альгинаты, каррагенаны, гуаровые смолы, желатины, трагаканты, (амидированные) пектины, ксантаны, хитозановые коллагены, агарозы; смеси и другие производные или их со-полимеры и/или другие фармацевтически или, по крайней мере, биологически приемлемые полимеры.
Концентрацию указанного полимера предпочтительно выбирают такой, которая лежит в интервале между 0.01 мас.% и 10 мас.%, более предпочтительно в интервале между 0.1 мас.% и 5 мас.%, даже более предпочтительно в интервале между 0.25 мас.% и 3.5 мас.% и наиболее предпочтительно в интервале между 0.5 мас.% и 2 мас.%.
Кроме того, является предпочтительным, что указанный антиоксидант выбирают из синтетических фенольных антиоксидантов, таких как бутилированный гидроксианизол (ВНА), бутилированный гидрокситолуол (ВНТ ) и ди-трет.-бутилфенол (LY178002, LY256548, HWA-131, BF-389, CI-98.6, PD-127443, E-5119, BI-L-239XX, и т.д.), третичный бутилгидрохинон (TBHQ), пропилгаллат (PG), 1-О-гексил-2,3,5-триметилгидрохинон (HTHQ); ароматических аминов (таких как дифениламин, п-алкилтио-о-анизидин, производные этилендиамина, карбазол, тетрагидроинденоиндол); фенолов и феноловых кислот (таких как гваякол, гидрохинон, ванилин, галловые кислоты и их сложные эфиры, протокатехатовые кислоты, хиновая кислота, сиреневая кислота, элаговая кислота, салициловая кислота, нордигидрогуаретовая кислота (NDGA), эвгенол); токоферолов (включая токоферолы (альфа, бэта, гамма, дельта) и их производных, таких как токоферилацелат (например, -ацетат, -лаурат, миристат, -пальмитат, -олеат, -линолеат, и т.д. или любые другие пригодные токоферил-липоаты), токоферил-РОЕ-сукцинатов; тролокса и соответствующих амид- и тиокарбоксамидных аналогов; аскорбиновой кислоты и ее соли, изоаскорбатов (2 или 3 или 6)-о-алкиласкорбиновых кислот, аскорбиловых эфиров (например, 6-о-лауроил, миристоил, пальмитоил-, олелоил или линолеоил-L-аскорбиновая кислота, и т.п.); нестероидных противовоспалительных агентов (NSAIDs), таких как индометацин, диклофенак, мефенамовая кислота, флуфенамовая кислота, фенилбутазон, оксифенбутазон ацетилсалициловая кислота, напроксен, дифлунизал, ибупрофен, кетопрофен, пироксикам, пеницилламин, пеницилламин дисульфид, примахин, хинакрин, хлорохин, гидроксихлорохин, азатиоприн, фенобарбитал, ацетаминефен); аминосалициловых кислот и производных; метотрексата, пробукола; противоаритмических агентов (например, таких как амидарон, априндин, азоканоил), амброксола, тамоксифена, b-гидрокситамоксифена; кальциевых антогонистов (таких как нифедипин, низолдипин, нимодипин, никардипин, нилвадипин), блокираторов бэта-рецептора (например, атенолол, пропранолол, небиволол); бисульфита натрия, метабисульфита натрия, тиомочевины; хелатирующих агентов, таких как EDTA, GDTA, десферрала; эндогенных защитных систем, таких как трансферрин, лактоферрин, ферритин, керулоплазмин, хаптоглобион, хамопексин, альбумин, глюкоза, убихинол-10; ферментных антиоксидантов, таких как супероксидная дисмутаза и металлические комплексы с аналогичной активностью, включая каталазу, глутатион пероксидазу, и менее комплексные молекулы, такие как бэта-каратин, билирубин, мочевая кислота; флавоноиды (например, флавоны, флавонолы, флавононы, флаваноналы, хаконы, антоцианин), N-ацетилцистеин, мезна, глутатион, производные тиогистидина, триазолы; таннины, коричную кислоту, гидроксикоричные кислоты и их сложные эфиры (например, кумариновые кислоты и эфиры, кофеиновая кислота ее сложные эфиры, феруловая кислота, (изо-) хоргениновая кислота, синапиновая кислота); экстракты из специй (например, из чеснока, корицы, шалфея, розмарина, муската, орегано, гвоздики, мускатного ореха); карносовую кислоту, карносол, карсолевую кислоту; розмариновую кислоту, розмариндифенол, гентизиновую кислоту, феруловую кислоту; экстракты из овсяной крупы, такие как авенантрамид 1 и 2; тиоэфиры, дитиоэфиры, сульфоксиды, тетраалкилтиурамдисульфиды; фитиновую кислоту, стероидные производные (например, U74006F); метаболиты триптофана (например, 3-гидроксикинуренин, 3-гидроксиантраниловая кислота) и органохалкогениды или тому подобное, представляющее собой фермент, подавляющий окисление.
Кроме того, концентрацию ВНА или ВНТ часто выбирают между 0.001 и 2 мас.%, более предпочтительно она находится между 0.0025 и 0.2 мас.%, и наиболее предпочтительно между 0.005 и 0.02 мас.%, концентрации TBHQ и PG находятся между 0.001 и 2 мас.%, более предпочтительно между 0.005 и 0.2 мас.%, и наиболее предпочтительно между 0.01 и 0.02 мас.%, концентрация токоферолов находится между 0.005 и 5 мас.%, более предпочтительно между 0.01 и 0.5 мас.%, и наиболее предпочтительно между 0.05 и 0.075 мас.%, концентрация сложных эфиров аскорбиновой кислоты находится между 0.001 и 5, более предпочтительно между 0.005 и 0.5, и наиболее предпочтительно находится между 0.01 и 0.15 мас.%, концентрация аскорбиновой кислоты находится между 0.001 и 5, более предпочтительно между 0.005 и 0.5 мас.%, и наиболее предпочтительно находится между 0.01 и 0.1 мас.%, концентрация бисульфита натрия или метабисульфита натрия между 0.001 и 5, более предпочтительно между 0.005 и 0.5 мас.%, и наиболее предпочтительно между 0.01-0.15 мас.%, концентрация тиомочевины находится между 0.0001 и 2 мас.%, более предпочтительно между 0.0005 и 0.2, и наиболее предпочтительно находится между 0.001-0.01 мас.%, наиболее часто 0.005 мас.%, концентрация цистеина находится между 0.01 и 5, более предпочтительно находится между 0.05 и 2 мас.%, и наиболее предпочтительно находится между 0.1 и 1.0 мас.%, наиболее часто 0.5 мас.%, концентрация монотиоглицерина находится между 0.01 и 5 мас.%, более предпочтительно находится между 0.05 и 2 мас.%, и наиболее предпочтительно находится между 0.1-1.0 мас.%, наиболее часто 0.5 мас.%, концентрация NDGA находится между 0.0005-2 мас.%, более предпочтительно находится между 0.001-0.2 мас.%, и наиболее предпочтительно находится между 0.005-0.02 мас.%, наиболее часто 0.01 мас.%, концентрация глутатиона находится между 0.005 и 5 мас.%, более предпочтительно между 0.01 и 0.5 мас.%, и наиболее предпочтительно между 0.05 и 0.2 мас.%, наиболее часто 0.1 мас.%, концентрация EDTA находится между 0.001 и 5 мас.%, даже более предпочтительно между 0.005 и 0.5 мас.%, и наиболее предпочтительно между 0.01 и 0.2 мас.%, наиболее часто между 0.05 и 0.975 мас.%, концентрация лимонной кислоты находится между 0.001 и 5 мас.%, даже более предпочтительно находится между 0.005 и 3 мас.%, и наиболее предпочтительно между 0.01-0.2, наиболее часто между 0.3 и 2 мас.%.
Далее, предпочтительно, что указанное бактерицидное средство выбирают из спиртов с короткой цепью, таких как этиловый и изопропиловый спирт, хлорбутанол, бензиловый спирт, хлорбензиловый спирт, дихлорбензиловый спирт; гексахлорофен; из фенольных соединений, таких как крезол, 4-хлор-м-крезол, п-хлор-м-ксиленол, дихлорофен, гексахлорофен, повидон-иодид; из парабенов, особенно алкилпарабенов, таких как метил-, этил, пропил-, бутилпарабен, бензилпарабен; из кислот, таких как сорбиновая кислота, бензойная кислота и его соли; из четвертичных аммонийных соединений, таких как алкониевые соли, например, бензалкониевая соль, в особенности хлориды или бромиды, цетрониевые соли, например бромиды; феноалкециниевые соли, такая как фенододециний бромид, цетилпиридиний хлорид или другие такие соли; из соединений ртути, таких как фенилацетат ртути, борат или нитрат тиомерсал; хлоргексидин или его глюконат; из активных соединений антибиотиков биологического происхождения или их смесей.
Кроме того, предпочтительным является то, чтобы объемная концентрация спиртов с короткими цепями, в случае этилового, пропилового, бутилового или бензилового спирта составляет вплоть до 10 мас.%, более предпочтительно вплоть до 5 мас.%, и наиболее предпочтительно находится в интервале между 0.5-3 мас.%, и в случае хлорбутанола находится в интервале между 0.3-0.6 мас.%; объемная концентрация парабенов, особенно в случае метилпарабена, находится в интервале между 0.05-0.2 мас.%, и в случае пропилпарабена находится в интервале между 0.002-0.02 мас.%; объемная концентрация сорбиновой кислоты находится в интервале между 0.05-0.2 мас.%, и в случае бензойной кислоты находится в интервале между 0.1-0.5 мас.%; объемная концентрация фенолов, триклозана находится в интервале между 0.1-0.3 мас.% и объемная концентрация хлоргексидина находится в интервале между 0.01-0.05 мас.%.
Также является предпочтительным то, что наименее растворимым среди наполнителей (агрегирующих веществ) является липид или подобный липиду материал, предпочтительно полярный липид, в то время как вещество, которое более растворимо в суспендирующей жидкости и которое снижает среднее значение эластичного растяжения капельки, представляет собой поверхностно-активное вещество или другое ваещество, обладающее свойствами, подобными поверхностно-активным и/или представляет собой форму указанного липида или подобного липиду материала, который сравнительно растворим, как и указанное поверхностно-активное вещество или материал, подобный поверхностно-активному веществу.
Предпочтительно липид или липидоподобный материал представляет собой липид или липоид, источником которого является биологический материал или соответствующий синтетический липид или любые его модификации, предпочтительно указанный липид является принадлежащим к классу чистых фосфолипидов, соответствующих общей формуле
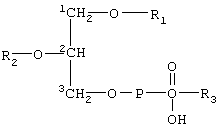
где R1 и R2 представляют собой алифатическую цепь, обычно С10-20-ацил, или -алкил или частично ненасыщенный остаток жирной кислоты, в особенности олеоил-, пальмитоелоил-, элаидоил-, линолеил-, линоленил-, линоленоил-, арахидоил-, вассинил-, лауроил-, миристоил-, пальмитоил- или стеароиловая цепь; и где R3 представляет собой водород, 2-триметиламино-1-этил, 2-амино-1-этил, C1-4-алкил, C1-5-алкил, замещенный карбоксигруппой, С2-5-алкил, замещенный гидрокси, С2-5-алкил, замещенный карбокси и гидроксигруппой или С2-5-алкил, замещенный карбокси и аминогруппой, инозитол, - сфингозин или соли указанных соединений, указанные липиды, содержащие также глицериды, изопреноидные липиды, стероиды, стерины или стеролы, сульфо- или углеводородсодержащие липиды или любые другие образующие два слоя липиды, в частности наполовину протонированные жидкие жирные кислоты, указанный липид выбирают из группы, включающей фосфатидилхолины, фосфатидилэтаноламины, фосфатидилглицерины, фосфатидилинозитолы, фосфатидиловые кислоты, фосфатидилсерины, сфингомиелины или другие сфингофосфолипиды, гликосфинголипиды (включая цереброзиды, керамидполигексозиды, сульфатиды, сфингоплазмалогены), ганглиозиды и другие гликолипиды или синтетические липиды, в частности с соответствующими сфингозиновыми производными, или любые другие гликолипиды, при этом две одинаковые или различные цепи могут быть присоединены через сложные эфирные группы к скелету (как диацильное или диалкеноильное соединение) или они могут быть присоединены к скелету с помощью простых эфирных связей, как диалкил-липиды.
Поверхностно-активное вещество или поверхностно-активный материал предпочтительно представляет собой неионное, цвиттерионное, анионное или катионное поверхностно-активное вещество, особенно такое как жирная кислота или спирт, алкил-три/ди/метиламмонийная соль, алкилсульфатная соль, моновалентная соль холата, деоксихолат, гликохолат, гликодеоксихолат, тауродеоксихолат, таурохолат, и т.д., ацил- или алканоилдиметиламиноксид, особенно додецилдиметиламиноксид, алкил- или алканоил-N-метилглюкамид, N-алкил-N,N-диметилглицин, 3-(ацилдиметиламмоний)-алкансульфонат, N-ацилсульфобетаин, полиэтиленгликольоктилфенильный простой эфир, особенно нонаэтиленгликольоктилфенильный эфир, полиэтиленацильный эфир, в особенности нонаэтилендодециловый эфир, полиэтиленгликольизоациловый эфир, особенно октаэтиленгликольизотридециловый эфир, полиэтиленациловый эфир, особенно октаэтилендодециловый эфир, полиэтиленгликольсорбитанациловый эфир, такой как полиэтиленгликоль-20-монолаурат (Tween 20) или полиэтиленгликоль-20-сорбитанмоноолеат (Tween 80), полигидроксиэтиленациловый эфир, особенно полигидроксиэтиленлаурил, -миристоил, -цетилстеарил или -олеоиловый простой эфир, как полигидроксиэтилен-4 или 6 или 8 или 10 или 12, и т.д., -лауриловый простой эфир (в Brij сериях) или в соответствующих сложных эфирах, например, полигидроксиэтилен-8-стеарат (Myrj 45), -лауратного или олеатного типа или в полиэтоксилированном касторовом масле 40, сорбитанмоноалкилат( например, в Arlacel или Span), в особенности сорбитанмонолаурат, ацил- или алканоил-N-метилглюкамиде, особенно в или деканоил- или додеканоил-N-метилглюкамиде, алкилсульфат (соль), например, в лаурил- или олеоилсульфате, деоксихолате натрия, гликодеоксихолате натрия, олеате натрия, таурате натрия, соль жирной кислоты, такая как элаидат натрия, линолеат натрия, лаурат натрия, лизофосфолипид, такой как н-октадецилен(=олеоил)глицерофосфатидная кислота, -фосфорилглицерин или -фосфорилсерин, н-ацил-, например, лаурил- или олеоилглицерофосфатидная кислота, -фосфорилглицерин или -фосфорилсерин, н-тетрадецилглицерофосфатидная кислота, -фосфорилглицерин или -фосфорилсерин, соответствующий пальмитоелоил-, еладоил-, вассениллизофосфолипид или соответствующий фосфолипид с короткой цепью или другой поверхностно-активный полипептид.
Согласно предпочтительному воплощению настоящего изобретения средний диаметр пенетранта предпочтительно находится между 30 нм и 500 нм, более предпочтительно между 40 нм и 250 нм, даже более предпочтительно между 50 нм и 200 нм и особенно предпочтительно между 60 нм и 150 нм.
Еще одной предпочтительной чертой настоящего изобретения является то, что общую сухую массу капелек в составе предпочтительно выбирают из интервала от 0.01 (мас.%) до 40 мас.% от общей сухой массы состава, более предпочтительно она находится между 0.1 мас.% и 30 мас.%, и наиболее предпочтительно находится между 0,5 мас.% и 20 мас.%.
Предпочтительно общая сухая масса капелек в составе выбирается так, чтобы повысить вязкость состава до максимальных 200 мПа·с, более предпочтительно вплоть до 40 мПа·с, и наиболее предпочтительно вплоть до 8 мПа·с.
Согласно настоящему изобретению предпочтительно, чтобы, по крайней мере, одно крайне-активное вещество или поверхностно-активное вещество и/или, по крайней мере, одно амфифильное соединение и/или, по крайней мере, одну гидрофильную жидкость и агент смешивают, если требуется отдельно, с образованием раствора, полученные (частичные) смеси или растворы затем последовательно объединяют для того, чтобы вызвать, предпочтительно путем воздействия механической энергии, такой как встряхивание, перемешивание, вибрация, гомогенизация, воздействие ультразвуком, сдвиг, замораживание и распарка или фильтрование с использованием приемлемого направленного давления, образование пенетрантов, которые ассоциируются с и/или включают агент.
Также является предпочтительным, если указанные амфифильные вещества растворяют в летучих растворителях, таких как спирты, особенно этанол или в других фармацевтически приемлемых органических растворителях, таких как этанол, 1- и 2-пропанол, бензиловый спирт, пропиленгликоль, полиэтиленгликоль (молекулярная масса: 200-400 D) или глицерин, другие фармацевтически приемлемые органические растворители, такие как переохлажденный газ, в особенности суперкритический газ СО2, которые затем удаляют, особенно упариванием или разбавлением, перед проведением последней стадии.
Кроме того, согласно настоящему изобретению образование указанных пенетрантов предпочтительно активизируют путем добавления требуемых веществ в жидкую фазу, упаривания из обращенной фазы, впрыскиванием или диализом, при необходимости под влиянием механического воздействия, такого как встряхивание, перемешивание, вибрация, гомогенизация, воздействие ультразвуком, сдвиг, замораживание и распарка или фильтрование с использованием пригодного, в особенности низкого (1 МПа) или среднего (вплоть дл 10 МПа), направленного давления.
Кроме того, также предпочтительно, если образование указанных пенетрантов активизируется путем фильтрования через фильтрующий материал, имеющий размеры пор между 0.01 мкм и 0.8 мкм, более предпочтительно между 0.02 мкм и 0.3 мкм, и наиболее предпочтительно между 0.05 мкм и 0.15 мкм, при этом могут быть использованы последовательно или параллельно несколько фильтров.
Согласно настоящему изобретению указанные агенты и пенетранты готовят для связывания, по крайней мере, частичного,
- после образования указанных пенетрантов, например после впрыскивания раствора лекарственного препарата в фармацевтически приемлемую жидкость, такую как этанол, 1- и 2-пропанол, бензиловый спирт, пропилен гликоль, полиэтиленгликоль (молекулярная масса: 200-400 D) или глицерин в суспендирующую среду;
- одновременно с образованием пенетранта, если требуется с использованием сорастворения лекарственного препарата, с, по крайней мере, несколькими пенетрантными ингредиентами.
Является предпочтительным, если указанные пенетранты, с которыми ассоциируется (связывается) агент, готовят непосредственно перед применением состава, если возможно, из пригодного концетранта или лиофилизата.
Составы согласно изобретению предпочтительно наносят путем распыления, намазывания, накатывания или натирания на площадь поверхности нанесения, в частности используя дозированный пульверизатор, спендер, валик или губку или негерметичный пластырь, если возможно.
Является предпочтительным, если барьером является часть тела млекопитающего и/или растения и, предпочтительно, кожа и/или, по крайней мере, частично кератинизированный эндотелий, и/или назальная, или любая другая слизистая оболочка.
Доза указанного пенетранта на площадь поверхности при этом предпочтительно находится между 0.1 мг на квадратный сантиметр (мг см-2) и 40 мг см-2, более предпочтительно находится между 0.25 мг см-2 и 30 мг см-2 и даже более предпочтительно находится между 0.5 мг см-2 и 15 мг см-2, в случае, если пенетрант наносят на указанную кожу и/или по крайней мере на указанный частично кератинизированный эндотелий.
Кроме того, доза на площадь поверхности указанного пенетранта предпочтительно находится между 0.0001 мг на квадратный сантиметр (мг см-2) и 0.1 мг см-2, более предпочтительно находится между 0.0005 мг см-2 и 0.05 мг см-2 и даже более предпочтительно находится между 0.001 мг см-2 и 0.01 мг см-2, в случае, если пенетрант наносят на само растение, на листья растения, на иглы растения.
Доза на площадь поверхности указанного пенетранта предпочтительно находится между 0.05 мг на квадратный сантиметр (мг см-2) и 20 мг см-2, более предпочтительно находится между 0.1 мг см-2 и 15 мг см-2 и даже более предпочтительно находится между 0.5 мг см-2 и 10 мг см-2, в случае если пенетрант наносят на указанную назальную или другую слизистую оболочку.
В соответствии с другим аспектом настоящего изобретения предлагается набор, содержащий указанный состав, взятый в количестве, которое позволяет составу быть нанесенным при выбранной дозе на площадь поверхности, как это указывалось выше.
Кроме того, является предпочтительным, если состав упакован в бутылочку или в любой другой сосуд.
Согласно другому аспекту настоящего изобретения предлагается набор из бутолочек, которые предпочтительно содержат устройство для введения состава.
Согласно другому аспекту настоящего изобретения предлагается пластырь, содержащий состав в таком количестве, которое обеспечивает ту дозу на площадь поверхности, как указано выше. Пластырь или трансдермальный пластырь согласно настоящему изобретению предназначен для нанесения на барьеры, включая кожу или, слизистую оболочку. Термин «трансдермальный ( или чрескожный)» должен включать все указанные барьеры.
Предпочтительно пластырь содержит
- негерметичную поддерживающую (тыльную) прокладку;
- внутреннюю прокладку, при этом тыльная прокладка и внутренняя прокладка образуют резервуар;
и/или матричный слой.
Является предпочтительным, что указанная негерметичная тыльная прокладка позволяет достигнуть значения интенсивности трансмиссии (MVTR) более чем 1000 г/м2 день, предпочтительно более чем 5.000 г/м2 день и наиболее предпочтительно более чем 10.000 г/м2 день. Является предпочтительным, если негерметичная тыльная прокладка имеет поры, размером меньше чем 100 нм, предпочтительно меньше чем 70 нм, более предпочтительно меньше чем 30 нм и наиболее предпочтительно столь большого, как межмолекулярные расстояния в материале тыльной прокладки. Еще в одном воплощении изобретения предпочтительным является негерметичная тыльная прокладка, содержащая полиуретановую мембрану, предпочтительно полиэфирную ультрафильтрационную пористую мембрану, более предпочтительно поликарбонатную ультрафильтрационную пористую мембрану и наиболее предпочтительно полиэтиленовую микропористую мембрану.
Внутренняя прокладка и/или матричный слой, согласно настоящему изобретнию осуществляет контакт с кожей. Внутренняя прокладка предпочтительно предотвращает нежелательное выделение состава из пластыря во время хранения и обеспечивает быстрое смачивание кожи, когда происходит контакт. Согласно настоящему изобреетнию также предпочтительным является то, что внутренняя прокладка содержит гомогенную мембрану, предпочтительно, полиэфирную ультрафильтрационную пористую мембрану или поликарбонатную ультрафильтрационную пористую мембрану. Более того, эти внутренние прокладки предпочтительно имеют плотность пор, которая составляет вплоть до 5%, предпочтительно вплоть до 15%, более предпочтительно вплоть до 25% и наиболее предпочтительно более чем 25% и/или размер пор, лежащий в интервале между 20 нм и 200 нм, предпочтительно между 50 нм и 140 нм и наиболее предпочтительно между 80 нм и 120 нм.
Кроме того, предпочтительно, если материалы для внутренней прокладки, содержат гидрофобные сетчатые мембраны и/или неткущуюся шерсть с ячеистыми отверстиями, образованными гидрофобными нитями. В другом предпочтительном воплощении изобретения внутренняя прокладка представляет собой микропористую полиэтиленовую мембрану, имеющую средние размеры пор, лежащие в интервале между 50 нм и 3000 нм, предпочтительно между 500 нм и 2000 нм и наиболее предпочтительно примерно 1500 нм.
Согласно другому предпочтительному воплощению настоящего изобретния пластырь содержит чувствительный к давлению адгезивный (липкий) слой, предпочтительно адгезивный слой, содержащий полиацилат, полиизобутилен, силикон, сополимер этиленвинилацетата, поливинилпирролидон или гидрогель полиэтиленоксида.
Согласно другой предпочтительной особенности настоящего изобретения состав содержит пенетранты, имеющие средний диаметр меньше чем 150 нм, предпочтительно меньше чем 100 нм. Также является предпочтительным, что общая сухая масса капелек в составе составляет, по крайней мере, 5% (мас.%), предпочтительно между 7.5 мас.% и 30 мас.%, и более предпочтительно между 10 мас.% и 20 мас.%.
Пластырь согласно настоящему изобретению предпочтительно содержит состав, в котором вязкость составляет максимально вплоть до 200 мПа·с, более предпочтительно вплоть до 40 мПа·с, и наиболее предпочтительно вплоть до 8 мПа·с.
Площадь мембраны, через которую выделяется лекарственное средство, составляет от 0.5 см2 до 250 см2, более предпочтительно составляет от 1 см2 до 100 см2, даже более предпочтительно составляет от 2 см2 до 50 см2 и наиболее предпочтительно находится между 4 см2 и 25 см2.
В особенно предпочтительном воплощении изобретения пластырь содержит один или более дополнительных слоев, включающих обезвоживающие слои, матричные слои, ленты губки и/или защитные слои.
Было найдено, что является выгодным использование поддерживающих или тыльных прокладок, обладающих способностью поддерживать выпаривание Transfersomes суспендирующей среды. Согласно настоящему изобретению они предпочтительно демонстрируют значение интенсивности трансмиссиии пара (MVTR), которая составляет более чем 1000 г/м2 день или лучше, более чем 10 000 г/м2 день. Удаление растворителя через такой барьер при существенно высокой интенсивности помогает создать и выдержать активный градиент, который движет поток Transfersome® - агрегатов через барьер.
Пригодные поддерживающие прокладки в соответствии с настоящим изобретением представляют собой полиуретановые мембраны, такие как CoTran 9701 (3М Medica, Borken Германия), Tegaderm (3M Medica, Borken Германия), Arcare 8311 (Adhesive Research, Limerick, Ирландия), IV3000 (Smith и Nephew). Даже более пригодными являются полиэфирные ультрафильтрационные пористые мембраны (размер поры 10 нм) (Osmonics, Minnetonka, США) и поликарбонатные ультрафильтрационные пористые мембраны (размер поры 10 нм) (Osmonics, Minnetonka, США). Наиболее пригодными являются полиэтиленовые микропористые мембраны, такие как Cotran 9711 (ЗМ Medica, Borken Германия), 14Р01А, 10Р05А, 8Р07А, Е011 D (DSM Solutech, Heerlen, Нидерланды). В классических TTS, известных в этой области, последние материалами обычно используют для мембран, контролирующих интенсивность прохода.
Требуется, чтобы указанные поддерживающие прокладки должны быть непроницаемыми для жидкости для того, чтобы предотвратить потерю активного вещества, которое должно доставляться, например, чрескожно. Для того чтобы убедиться или определить, являются ли мембраны непроницаемыми для жидкости, измеряют проницаемость Transfersomes® через мембраны в случае наложения низких гидростатических давлений. Полиэтиленовые мембраны Cotran 9711 (3М Medica, Borken Германия) и 14Р01А являются непроницаемыми для жидкости вплоть до прикладываемого давления 1 МПа. Кроме того, непроницаемыми для жидкости являются все перечисленные полиуретановые мембраны.
Другой важной чертой пластыря согласно настоящему изобретению является использование внутренней мембранной прокладки вместо соответствующих контролирующих скорость мембран, которые облегчают быстрое смачивание кожи с помощью Transfersome®-состава, при этом блокируя (нежелательное) выделение состава во время хранения или во время применения устройства, приложенного к коже. Поскольку настоящее изобретение в особенности направлено на пластырь, содержащий Transfersome®, термин "мембрана, контролирующая скорость" является вводящим в заблуждение, поскольку скорость осуществляемого Transfersome® транспорта идеально контролируется активностью воды в и на биологическом барьере. Таким образом, в данном описании используют термин "внутренняя прокладка" вместо "мембрана, контролирующая скорость".
Одна внутренняя мембранная прокладка, которая пригодна для целей настоящего, изобретения, представляет собой гомогенную мембрану, имеющую высокую плотность пор. Проход через поры зависит от давления по Лапласу/поверхностного натяжения суспензии липидов в порах Pmin=2 cos6/r, где Pmin обозначает минимальное давление, требуемое для преодоления давления Лапласа, cos6/r, где Pmin обозначает минимальное давление, требуемое для преодоления давления Лапласа,  представляет собой поверхностное натяжение суспензии на границе с воздухом (˜30 мН/м), представляет собой поверхностное натяжение суспензии на границе с воздухом (˜30 мН/м),  это угол соприкосновения состава с материалом мембраны и r это радиус поры (˜100 нм). Соответственно, удерживание состава в порах требует cos это угол соприкосновения состава с материалом мембраны и r это радиус поры (˜100 нм). Соответственно, удерживание состава в порах требует cos <0, это означает то, что мембрана должна быть гидрофобной. Согласно этой возможной теории давление Лапласа 0.6 Мпа требуется для того, чтобы продвинуть поверхность раздела воздух-суспензия через поры, что дает возможность суспензии пересечь барьер. <0, это означает то, что мембрана должна быть гидрофобной. Согласно этой возможной теории давление Лапласа 0.6 Мпа требуется для того, чтобы продвинуть поверхность раздела воздух-суспензия через поры, что дает возможность суспензии пересечь барьер.
Хорошо подходящим материалом для внутренней мембранной прокладки согласно настоящему изобретению являются полиэфирные ультрафильтрационные пористые мембраны (размер поры 100 нм) (Infiltec, Speyer, Германия) и поликарбонатные ультрафильтрационные пористые мембраны (размер пор 100 нм) (Infiltec, Speyer, Германия).
Более того, есть намерение использовать гидрофобные сетчатые мембраны, например, Fluortex 09/70/22, Fluortex 09/85/27 (INFILTEC, Speyer) и неткущиеся типы шерсти, например, Parafil R20, Parafil RK 20, Parafil R 30 Natur, Parafil RK 30, Paratherm PR 220/18, Paratherm PR 220/20 (LTS, Andemach, Германия). Эти сетчатые материалы хорошо подходят для работы в качестве внутренней прокладки в пластырях согласно изобретению.
Указанные прокладки представляют собой структуру, составленную из открытых ячеек, построенных из гидрофобных нитей. Они предотвращают проход Transfersomes®, когда прокладка не находится в контакте с кожей. Высокий угол контактирования  воздух/вода или воздух/внутренняя поверхность Transfersome®-суспензии, по отношению к гидрофобной поверхности нити, обеспечивает это. Отверстия в ячейках позволяют проход Transfersomes® через прокладку при контактировании с кожей. Это вызывается энергией, приобретенной за счет смачивания более гидрофильной или менее гидрофобной поверхности (например, кожи), превышающей поверхностную энергию, требуемую для полного смачивания нитей. воздух/вода или воздух/внутренняя поверхность Transfersome®-суспензии, по отношению к гидрофобной поверхности нити, обеспечивает это. Отверстия в ячейках позволяют проход Transfersomes® через прокладку при контактировании с кожей. Это вызывается энергией, приобретенной за счет смачивания более гидрофильной или менее гидрофобной поверхности (например, кожи), превышающей поверхностную энергию, требуемую для полного смачивания нитей.
В более конкретных выражениях такой термин как "эффект-переключения" может быть объяснен следующим образом. Пусть d будет расстоянием между двумя нитями от середины до середины. Пусть r будет радиусом нити:
2 rz rz wt wt zd zd ws ws
Поверхностное натяжение воды на коже составляет  ws = 40 м н/м согласно "Transdermal и Drug Delivery Systems", Buffalo Grove, Interpharm Press, Ghosh, Pfister et al. 1997. Поверхностное натяжение воды на гидрофобной ните составляет ws = 40 м н/м согласно "Transdermal и Drug Delivery Systems", Buffalo Grove, Interpharm Press, Ghosh, Pfister et al. 1997. Поверхностное натяжение воды на гидрофобной ните составляет  wt=70 м н/м (поверхностное натяжение суспензии на коже вновь составляет wt=70 м н/м (поверхностное натяжение суспензии на коже вновь составляет  ws=40 м N/м, поверхностное натяжение суспензии на гидрофобной нити составляет ws=40 м N/м, поверхностное натяжение суспензии на гидрофобной нити составляет  wt=35 м н/м, благодаря присутствию монослоя детергента). Переворачивание приведенной выше формулы приводит к следующему: wt=35 м н/м, благодаря присутствию монослоя детергента). Переворачивание приведенной выше формулы приводит к следующему:
2 r/d r/d   ws/ ws/ wt wt
для случая суспензии ( ws˜ ws˜ wt). Это предполагает, что соотношение радиуса нити к размеру ячейки должно быть предпочтительно в интервале около 0.3. wt). Это предполагает, что соотношение радиуса нити к размеру ячейки должно быть предпочтительно в интервале около 0.3.
Согласно настоящему изобретению в особенности предпочтительно использовать в качестве внутренней прокладки микропористые полиэтиленовые мембраны. Термин "микропористый" для целей настоящего изобретения означает, что размер поры составляет по крайней мере 20 нм, предпочтительно находится в интервале между 50 нм до 3000 нм. Примерами являются Solupor - Е011 D (значение размера поры 1500 нм), Solupor - 8Р07А (значение размера поры 700 нм) и Solupor - 10Р05А (значение размера поры 500 нм) (DSM Solutech, Heerlen, Нидерланды), которые демонстрируют высокую проницаемость при низких давлениях, таким образом, позволяя Transfersomes смачивать кожу при контакте.
Для всех типов перечисленных выше внутренних мембранных прокладок поверхностное натяжение  и угол контактирования и угол контактирования  изменяются при контактировании с кожей. Существует ряд факторов, которые могут вызывать такие изменения поверхностного натяжения, изменяются при контактировании с кожей. Существует ряд факторов, которые могут вызывать такие изменения поверхностного натяжения,  и угла контакта и угла контакта  . Одним из факторов может быть повышение влажности и капиллярной конденсации трансдермально выделяющейся воды. Гидрофильная перемычка благодаря взаимодействию между корнеоцитами / волосяными фолликулами и внутренней мембраной могут также внести вклад в быстрое смачивание, кожи. Наконец, гидрофилизация полости поры за счет загрязнения, например, микроскопическими кусочками кожи, может изменить поверхностное натяжение . Одним из факторов может быть повышение влажности и капиллярной конденсации трансдермально выделяющейся воды. Гидрофильная перемычка благодаря взаимодействию между корнеоцитами / волосяными фолликулами и внутренней мембраной могут также внести вклад в быстрое смачивание, кожи. Наконец, гидрофилизация полости поры за счет загрязнения, например, микроскопическими кусочками кожи, может изменить поверхностное натяжение  и угол контакта и угол контакта  . Как следствие, минимальное давление Pmin, которое требуется для пренодоления давления Лапласа, понижается и состав может проходить чрез внутреннюю прокладку и смачивать поверхность кожи. . Как следствие, минимальное давление Pmin, которое требуется для пренодоления давления Лапласа, понижается и состав может проходить чрез внутреннюю прокладку и смачивать поверхность кожи.
Пластыри согласно настоящему изобретению могут быть изготовлены различными способами, известными из уровня техники. Главное, наслоение поддерживающей и внутренней прокладками может быть достигнуто путем теплового ламинирования, или адгезивного ламинирования, или любого другого известного способа наслоения.
Во время процесса ламинирования при нагревании прокладки прилипают за счет плавления, по крайней мере, одного материала при повышенных температурах и повышенных давлениях в короткий период времени. Слияние при плавке (ах) и вставка при охлаждении и объединение. Температуру и давление прикладывают с помощью металлических ламинаторов либо пульсирующего нагревания, например, микроволновой радиации или непрерывного нагревания. Обычно полиэтиленовые и полиуретановые мембраны наслаивают при нагревании до температур 120-200°С, предпочтительно 140-160°С и давлении 1-6 бар, предпочтительно 3-4 бар. Хорошие ламинирующие свойства достигают для Tranfersom®, содержащих пластырей, применяя давление 4 бар в течение периода около 0.1-5 секунд, предпочтительно около 1-2 секунд.
Адгезивное ламинирование прокладок достигают за счет слоя адгезива, чувствительного к давлению, такого как полиацилат, полиизобутилен, силикон, этилен винилацетатные сополимеры или поливинилпирролидон и полиэтиленоксидный гидрогельный адгезив (PVP/PEO). Адгезивной прокладке придают соответствующую форму, например, концентрического круга шириной 1 см. Поддерживающую и внутреннюю прокладки ламинируют по кругу и пластырь выбивают из ткани. Пригодными пленками являются, например, чувствительные к давлению переносные пленки (Arcare 7396), гибкая пластичная пленка, покрытая с обеих сторон медицинским адгезивом (липким связующим), чувствительным к градиенту давления (Arcare 8570 чистый полиэфир) или лентами из губки (Полиолефин 3М 1777; 3М 1779; 3М 9751, поливинилхлорид 3М 9772L), покрытыми с обеих сторон с помощью чувствительного к давлению акрилатного связующего. В последнем примере увеличивают резервуар определенного объема благодаря ограниченной толщине ленты из губки, в то время как в остальных двух примерах растягивают их Transfersome®, содержащий объем за счет эластичности и/или скрытой площади поверхности прокладок.
Наполнение одного из слоев пластыря резервуарного типа согласно настоящему изобретению может быть достигнуто с помощью нескольких способов, известных из уровня техники.
Один из возможных способов заполнения основан на двухступенчатом процессе ламинирования. На первой ступени основной слой ламинируют, при этом сохраняют небольшой проход. Через это отверстие внедряют пробку или систему трубок, после чего в образовавшийся резервуар впрыскивают Transfersome® состав. После вытягивания пробки или системы трубок ламинирование прохода завершается. В указанном процессе могут быть использованы ламинирование при нагревании, так же как и адгезивное ламинирование. В случае теплового наслоения нагревательный ламинатор ламинирует кольцо С-формы. После заполнения внутренней части С нагревательный ламинатор сменяют при 45° и тепловое ламинирование повторяют во второй раз, теперь закрывая открытую часть С. В случае адгезивного ламинирования высвобождающая прокладка трансферной ленты полностью не удаляется, таким образом, позволяя образоваться заполняющему проходу. После заполнения остальную часть прокладки выделения удаляют и проход закрывают. Загиб назад поддерживающей и/или внутренней прокладки приводит к тому же результату: образуется подобный проход, подобный воротнику, который закрывается загибом мембран после процесса заполнения.
Техника формирования, заполнения и герметизации хорошо разработаны и могут быть использованы для производства пластырей согласно настоящему изобретению. На первой ступени пленку для поддерживающей прокладки двигают над углублением (желобом)требуемых размеров. Прокладка воспроизводит эту форму под вакуумом и растягивается в желобе. Затем из крана заполняют желоб Transfersome® составом. После того как кран перекрывают, внутреннюю мембранную прокладку накладывают на мембрану (ткань). Концентрический замкнутый круг ламинирует обе пленки либо путем теплового ламинирования, либо адгезивного ламинирования, как описано выше.
Еще в одном пригодном процессе получения TTS, Transfersome®-состав впрыскивают через предварительно установленную систему трубок после процесса наслоения. Систему трубок подводят горизонтально в губку аналогично тому, как венозный катетер устанавливают в случае непрерывной инъекции. Систему трубок соединяют со шприцом, заполненным Transfersome®-составом с помощью луеровского, крепления. Желаемое количество состава впрыскивают в резервуар и систему трубок отсоединяют и/или при необходимости герметично закрывают.
Другим важным аспектом настоящего изобретения является создание пластыря, который, кроме того, характеризуется тем, что он содержит, по крайней мере, два слоя, которые отделены друг от друга во время хранения. Согласно другому аспекту настоящего изобретения предлагается пластырь, содержащий состав, взятый в количестве, составляющий дозу на площадь поверхности, как указано выше, при этом пластырь содержит несколько, предпочтительно менее чем 5, более предпочтительно 3 и наиболее предпочтительно два внутренних слоя, которые соединяют перед или в момент применения состава. Предпочтительно, по крайней мере, что один из слоев находится внутри и/или снаружи пластыря.
Является предпочтительным то, когда состав и/или отдельные компоненты состава и/или агент и/или суспензию /дисперсию пенетрантов без агента содержат во время хранения в нескольких, предпочтительно менее чем 5, более предпочтительно в трех и наиболее предпочтительно в двух отдельных слоях пластыря, которые при случае соединяют перед или во время его применения или после применения пластыря.
В другом предпочтительном воплощении изобретения внешние слои содержат системы инъекции, предпочтительно шприцы, которые присоединяют к резервуару в пластыре. Предпочтительным является то, что слои вертикально складываются и/или располагаются рядом, бок о бок и/или один слой включает второй слой, предпочтительно без фиксации со вторым слоем.
Предпочтительно слои находятся внутри резервуара, границы которого определяют поддерживающая и внутренняя прокладки. Кроме того, предпочтительно чтобы слои были отделены друг от друга с помощью контролируемо открывающегося барьера, предпочтительно мембраны и/или пробки и/или путем образованного слоями расслоения.
Согласно настоящему изобретению объединение и смешение ингредиентов слоев достигают путем непосредственного механического воздействия, такого как сжатие, растирание, замешивание, скручивание, разрывание и/или опосредованного воздействия, т.е. путем изменения температуры, осмотического давления или электрического потенциала, что вызывает удаление или разрушение отделяющего(их) барьера(ов).
В другом предпочтительном воплощении настоящего изобретения пластырь содержит:
- негерметичную поддерживающую прокладку в соответствии с изобретением;
- мембрану, определяющую границы резервуара, который разделен по крайней мере на два слоя,
при этом состав непосредственно контактирует с кожей, когда он высвобождается из резервуара или из слоев.
Предлагаемый в соответствии с изобретением многослойный резервуарного типа пластырь, содержащий, по крайней мере, два отделенных друг от друга слоя и смешивающий слой, где указанный смешивающий слой может быть накопительным слоем, содержащим один ингредиент состава, или весь состав ингредиентов, или может быть слоем, который не заполнен в период хранения.
Согласно настоящему изобретению накопительные слои, накопители, содержащие критические ингредиенты, могут быть отделены от смешивающего слоя. Накопительные слои содержат некоторые, если не все, ингредиенты во время периода хранения после приготовления и перед употреблением. Смешивающий слой служит для смешивания отдельных ингредиентов после периода хранения. После смешивания состав попадает на кожу из смешивающего слоя. Смешивающий слой должен иметь достаточную площадь контакта с кожей для установления контроля за дозой на площадь поверхности.
Смешивающий слой должен быть в контакте с кожей. Это может быть достигнуто либо путем
1. непосредственного контакта с кожей (отсутствует внутренняя мембранная прокладка)
или
2. через внутреннюю мембранную прокладку согласно настоящему изобретению. Делается отсылка к однослойному пластырю, описанному выше. Одинаковые внутренние мембранные прокладки могут быть использованы для многослойных TTS.
Число накопительных слоев может быть, по крайней мере, два и оно зависит от соответствующих продолжительных несовместимостей ингредиентов.
Накопительные слои могут составлять часть пластыря и могут быть из того же материала (ов). Накопительные слои могут быть - в простейшей форме - двумя шприцами, содержащими жидкие ингредиенты, которые впрыскивают одновременно или последовательно в смешивающую полость через одну или более трубки. Спаренный шприц, в котором соединены два поршня, способствует одновременному впрыскиванию ингредиентов при их постоянном соотношении. Дополнительная система трубок идеально с микроизгибами, как используют в приготовлении образцов для ВЭЖХ (высокоэффективной жидкостной хроматографии) может вызвать бурление сливаемой жидкости. Т-образный соединитель идеально вместе с турбулентной полостью действует так же. Таким образом, оптимальное смешивание компонентов достигают даже при высоких скоростях и высоких концентрациях липидов.
Смешивающий слой согласно настоящему изобретению может быть одним отделенным слоем, который является пустым во время хранения, но заполняется почти одновременно с тем моментом, когда пластырь накладывают на кожу или он может быть одним из существующих слоев накопителей, в который остальные ингредиенты добавляют из других слоев накопителей или он может быть создан путем сляния двух или более накопительных слоев.
Объединение или смешивание ингредиентов может быть достигнуто путем перфорирования или разрушения мембран, разделяющих слои. Это может быть осуществлено, например, путем нажатия или растирания пластыря таким образом, что разделяющие слои мембраны разрываются под механическим воздействием или под внешним или внутренним воздействием острым приспособлением, таким как игла, которая перфорирует мембрану, разделяющую слои.
Другой способ объединения или смешивания ингредиентов основывается на вскрытии системы трубок между слоями. Указанное вскрытие может быть осуществлено, например, путем нажатия или растирания пластыря таким образом, что пробка или патрон, которые закрывают систему трубок, расположенную между отделенными друг от друга слоями во время периода хранения, выталкиваются из этой системы благодаря приложенному давлению.
Также возможно согласно настоящему изобретению объединить или смешать ингредиенты путем разрыва ламинирования, которое образует отдельные накопительные слои. Это может быть осуществлено, например, путем применения небольшого, но устойчивого давления на заполненные полости для хранения, а также путем нагревательного или адгезивного ламинирования. Ламинирование слоеобразующих мембран разрушается и жидкости продавливают через самообразующиеся каналы в смешивающий слой.
Накопительные и смешивающие слои могут быть сложены вертикально или помещены бок о бок, рядом. Например, три мембраны могут быть ламинированы таким, образом, что половина средней мембраны будет герметично прижата к нижней мембране (т.е. внутренней прокладке), а другая половина будет герметично прижата к верхней мембране (поддерживающей прокладке). Верхняя и нижняя мембраны герметично скрепляются друг к другу по концам правой крайней, левой крайней, повернутой вперед и повернутой назад сторонам, образуя, таким образом, двухслойный карман. Средняя мембрана может быть непроницаемой для жидкостей, но легко доступной для разрушения. Пригодными материалами для средних мембран могут быть, например, тонкослойные полиуретаны. Согласно одному из возможных воплощений изобретения контейнером для хранения Transfersomes®-состава может быть левый слой, непроницаемый для жидкости, в то время как высвобождение Transfersome® осуществляют из правой полости через внутреннюю мембранную прокладку в соответствии с изобретением при контаке с кожей. Правая полость может служить, например, в качестве слоя накопителя (для лиофилизованных) (лекарственн(ых)(ого) средств(а). Для специалиста ясно, что также и комбинации перечисленных выше воплощений изобретения, например комбинации вертикального сложения и выпрямления до положения рядом, бок-о-бок пригодно для выполнения целей настоящего изобретения.
После осуществления смешивания в смешивающем слое опустошенные слои - накопители становятся необязательными. Они могут быть отсоединены (в случае наружного слоя, такого как шприцы) или отрезаны. Например, система трубок может быть отсоединена и отверстия перекрыты с помощью крана, или патрона, или пробок. Открытое отверстие может быть вновь ламинировано путем приложения давления.
В другом важном аспекте настоящего изобретения обеспечивается способ введения агента млекопитающему или растению путем транспортировки указанного агента через барьер, где указанньм барьером является интактная кожа, слизистая оболочка и/или эпидермис указанного млекопитающего или растения, указанный агент, будучи связанным с пенетрантом, способен транспортировать указанный агент через поры кожи или через протоки в слизистой оболочке или в эпидермисе или способен облегчать проникновение агента через поры кожи после того, как указанный пенетрант открыл и/или вошел в указанные поры, включающий следующие стадии:
- приготовление состава путем суспендирования или диспергирования указанных пенетрантов в полярной жидкости в форме жидких капелек, окруженных подобным мембране покрытием из одного или нескольких слоев, указанное покрытие, содержащее, по крайней мере, две разновидности или формы амфифильных соединений с тенденцией к агрегации, при условии что
- указанные, по крайней мере два вещества отличаются, по крайней мере, коэффициентом растворимости равном 10 в указанной полярной жидкости,
- и/или указанные вещества, когда они находятся в форме гомоагрегатов (для более растворимого вещества) или гетероагрегатов (для любой комбинации обоих указанных веществ) имеют предпочтительный средний диаметр меньший, чем диаметр гомоагрегатов, содержащих только менее растворимые вещества,
- и/или более растворимое вещество имеет тенденцию солюбилизировать капельки и содержание такого соединения составляет вплоть до 99 мол.% от концентрации солюбилизации или по другому соответствует вплоть до 99 мол.% от концентрации насыщения в несолюбилизированной капельке, которая всегда выше,
- и/или присутствие более растворимого вещества снижает среднюю энергию упругости подобного мембране покрытия на величину по крайней мере в 5 раз ниже, более предпочтительно, по крайней мере, в 10 раз ниже и наиболее предпочтительно более чем в 10 раз ниже, чем средняя энергия упругости эритроцитов или фосфолипидных бислоев с жидкими алифатическими цепями,
- указанные пенетранты, способны транспортировать агенты через поры указанного барьера или способны промотировать проникновение агента через поры указанной кожи после того как пенетранты вошли в поры,
- выбора дозированного количества указанных пенетрантов, которые должны быть применены на заранее определенной площади поверхности указанного барьера для контролирования потока указанных пенетрантов через указанный барьер, и
- нанесения выбранного дозированного количества указанного состава, содержащего указанные пенетранты на указанную площадь указанного пористого барьера.
Кроме того, предпочтительно, если избыточное выделение через указанный барьер возрастает путем увеличения количества применяемой дозы указанных пенетратов в расчете на площадь поверхности барьера.
Значение рН состава предпочтительно выбирают из значений между 3 и 10, более предпочтительно между 4 и 9 и наиболее предпочтительно между 5 и 8.
В этом аспекте изобретения, кроме того, предпочтительно, если состав содержит:
- по крайней мере, один загуститель, взятый в таком количестве, чтобы повысить вязкость состава максимально до 5 нм/с, более предпочтительно вплоть до 1 нм/с и наиболее предпочтительно вплоть до 0.2 нм/с, так что состав намазывают сверху, и на площади нанесения происходит задержка лекарства,
- и/или, по крайней мере, один антиоксидант, взятый в таком количестве, которое снижает увеличение индекса окисления до значения ниже 100% на период в 6 месяцев, более предпочтительно менее чем на 100% на период 12 месяцев и более предпочтительно менее чем на 50% на период 12 месяцев,
- и/или, по крайней мере, одно бактерицидное средство, взятое в количестве, которое снижает количество бактерий с 1 миллиона зародышей, добавленных на г общей массы состава до менее чем 100 в случае аэробных бактерий, до менее чем 10 в случае энтеробактерий и менее чем 1 в случае Pseudomonas aeruginosa или Staphilococcus aureus, после периода в 4 дня.
Указанное, по крайней мере, одно бактерицидное средство предпочтительно добавляют в таком количестве, которое снижает количество бактерий с 1 миллиона зародышей, добавленных на 1 г общей массы состава до менее чем 100 в случае аэробных бактерий и менее чем 10 в случае энтеробактерий и менее чем 1 в случае Pseudomonas aeruginosa или Staphilococcus aureus после периода в 3 дня и более предпочтительно после периода в 1 день.
Указанный загуститель предпочтительно выбирают из класса фармацевтически приемлемых гидрофильных полимеров, таких как частично этерифицированные производные целлюлозы, как карбоксиметил-, гидроксиэтил-, гидроксипропил-, гидроксипропилметил- или метилцеллюлоза; полностью синтетические гидрофильные полимеры, такие как полиакрилаты, полиметакрилаты, поли(гидроксиэтил)-, поли(гидроксипропил)-, поли(гидроксипропилметил)метакрилаты, полиакрилонитрилы, металлилсульфонаты, полиэтилены, полиоксиэтилены, полиэтиленгликоли, полиэтиленгликольлактиды, полиэтиленгликольдиакрилаты, поливинилпирролидоны, поливиниловые спирты, поли(пропилметакриламиды), поли(пропиленфумарат -со-этиленгликоли), полоксамеры, полиаспартамиды, (поперечно-сшитый гидразин) гиалуроновые кислоты, силиконы; природные смолы, содержащие альгинаты, каррагенаны, гуаровые смолы, желатины, трагаканты, (амидированные) пектины, ксантаны, хитозановые коллагены, агарозы; смеси и другие производные или их сополимеры и/или другие фармацевтически или, по крайней мере, биологически приемлемые полимеры.
Концентрацию указаного полимера затем предпочтительно выбирают такой, которая лежит в интервале между 0.01 мас.% и 10 мас.%, более предпочтительно в интервале между 0.1 мас.% и 5 мас.%, даже более предпочтительно в интервале между 0.25 мас.% и 3.5 мас.% и наиболее предпочтительно в интервале между 0.5 мас.% и 2 мас.%.
Согласно настоящему изобретению указанный антиоксидант затем предпочтительно выбирают из синтетических фенольных антиоксидантов, таких как бутилированный гидроксианизол (ВНА), бутилированный гидрокситолуол (ВНТ ) и ди-трет.-бутилфенол (LY178002, LY256548, HWA-131, BF-389, CI-986, PD-127443, Е-5119, BI-L-239XX, и т.д.), третичный бутилгидрохинон (TBHQ), пропилгаллат (PG), 1-О-гексил-2,3,5-триметилгидрохинон (HTHQ); ароматические амины (такие как дифениламин, п-алкилтио-о-анизидин, производные этилендиамина, карбазол, тетрагидроинденоиндол); фенолы и феноловые кислоты (такие как гваякол, гидрохинон, ванилин, галловые кислоты и их сложные эфиры, протокатехатовые кислоты, хиновая кислота, сиреневая кислота, элаговая кислота, салициловая кислота, нордигидрогуаретовая кислота (NDGA), эвгенол); токоферолы (включая токоферолы (альфа, бэта, гамма, дельта) и их производные, такие как токоферилацелат (например, -ацетат, -лаурат, миристат, - пальмитат, -олеат, -линолеат, и т.д, или любые другие пригодные токоферил-липоаты), токоферил-РОЕ-сукцинаты; тролокс и соответствующие амид- и тиокарбоксамидные аналоги; аскорбиновая кислота и ее соли, изоаскорбаты (2 или 3 или 6)-о-алкиласкорбиновые кислоты, аскорбиловые эфиры (например, 6-о-лауроил, миристоил, пальмитоил-, олелоил или линолеоил-L-аскорбиновая кислота, и т.п.); нестероидные противовоспалительные агенты (NSAIDs), такие как индометацин, диклофенак, мефенамовая кислота, флуфенамовая кислота, фенилбутазон, оксифенбутазон ацетилсалициловая кислота, напроксен, дифлунизал, ибупрофен, кетопрофен, пироксикам, пеницилламин, пеницилламин дисульфид, примахин, ханакрин, хлорохин, гидроксихлорохин, азатиоприн, фенобарбитал, ацетаминефен); аминосалициловые кислоты и производные; метотрексат, пробукол; противоаритмические агенты (например, амидарон, априндин, азоканоил), амброксол, тамоксифен, b-гидрокситамоксифен; кальциевые антогонисты (такие как нифедипин, низолдипин, нимодипин, никардипин, нилвадипин), блокираторы бэта-рецептора (например, атенолол, пропранолол, небиволол); бисульфит натрия, метабисульфит натрия, тиомочевина; хелатирующие агенты, такие как EDTA, GDTA, десферрал; эндогенные защитные системы, такие как трансферрин, лактоферрин, ферритин, керулоплазмин, хаптоглобион, хамопексин, альбумин, глюкоза, убихинол-10; ферментные антиоксиданты, такие как супероксидная дисмутаза и металлические комплексы с аналогичной активностью, включая каталазу, глутатион пероксидазу и менее комплексные молекулы, такие как бэта-каратин, билирубин, мочевая кислота; флавоноиды (например, флавоны, флавонолы, флавононы, флаваноналы, хаконы, антоцианин), N-ацетилцистеин, мезна, глутатион, производные тиогистидина, триазоды; таннины, коричная кислота, гидроксикоричные кислоты и их сложные эфиры (например, кумариновые кислоты и эфиры, кофеиновая кислота ее сложные эфиры, феруловая кислота, (изо-) хоргениновая кислота, синапиновая кислота); экстракты из специй (например, из чеснока, корицы, шалфея, розмарина, муската, орегано, гвоздики, мускатного ореха ); камосовая кислота, камосол, карсолевая кислота; розмариновая кислота, розмариндифенол, гентизиновая кислота, феруловая кислота; экстракты из овсяной крупы, такие как авенантрамид 1 и 2; тиоэфиры, дитиоэфиры, сульфоксиды, тетраалкилтиурамдисульфиды; фитиновая кислота, стероидные производные (например, U74006F); метаболиты триптофана (например, 3-гидроксикинуренин, 3-гидроксиантраниловая кислота) и органохалкогениды или тому подобное представляет собой фермент, подавляющий окисление.
Кроме того, является предпочтительным, если концентрация ВНА или ВНТ находится между 0.001 и 2 мас.%, более предпочтительно находится между 0.0025 и 0.2 мас.%, и наиболее предпочтительно между 0.005 и 0.02 мас.%, концентрации TBHQ и PG находится между 0.001 и 2 мас.%, более предпочтительно между 0.005 и 0.2 мас.%, и наиболее предпочтительно между 0.01 и 0.02 мас.%, концентрация токоферолов находится между 0.005 и 5 мас.%, более предпочтительно между 0.01 и 0.5 мас.%, и наиболее предпочтительно между 0.05 и 0.075 мас.%, концентрация сложных эфиров аскорбиновой кислоты находится между 0.001 и 5, более предпочтительно между 0.005 и 0.5 и наиболее предпочтительно находится между 0.01 и 0.15 мас.%, концентрация аскорбиновой кислоты находится между 0.001 и 5, более предпочтительно между 0.005 и 0.5 мас.%, и наиболее предпочтительно находится между 0.01 и 0.1 мас.%, концентрация бисульфита натрия или метабисульфита натрия между 0.001 и 5, более предпочтительно между 0.005 и 0.5 мас.%, и наиболее предпочтительно между 0.01-0.15 мас.%, концентрация тиомочевины находится между 0.0001 и 2 мас.%, более предпочтительно между 0.0005 и 0.2 и наиболее предпочтительно находится между 0.001-0.01 мас.%, наиболее часто 0.005 мас.%, концентрация цистеина находится между 0.01 и 5, более предпочтительно находится между 0.05 и 2 мас.% и наиболее предпочтительно находится между 0.1 и 1.0 мас.%, наиболее часто 0.5 мас.%, концентрация монотиоглицерина находится между 0.01 и 5 мас.%, более предпочтительно находится между 0.05 и 2 мас.%, и наиболее предпочтительно находится между 0.1-1.0 мас.%, наиболее часто 0.5 мас.%, концентрация NDGA находится между 0.0005-2 мас.%, более предпочтительно находится между 0.001-0.2 мас.%, и наиболее предпочтительно находится между 0.005-0.02 мас.%, наиболее часто 0.01 мас.%, концентрация глутатиона находится между 0.005 и 5 мас.%, более предпочтительно между 0.01 и 0.5 мас.%, и наиболее предпочтительно между 0.05 и 0.2 мас.%, наиболее часто 0.1 мас.%, концентрация EDTA находится между 0.001 и 5 мас.%, даже более предпочтительно между 0.005 и 0.5 мас.%, и наиболее предпочтительно между 0.01 и 0.2 мас.%, наиболее часто между 0.05 и 0.975 мас.%, концентрация лимонной кислоты находится между 0.001 и 5 мас.%, даже более предпочтительно находится между 0.005 и 3 мас.%, и наиболее предпочтительно между 0.01-0.2, наиболее часто между 0.3 и 2 мас.%.
Предпочтительно, что указанное бактерицидное средство затем выбирают из спиртов с короткой цепью, таких как этиловый и изопропиловый спирт, хлорбутанол, бензиловый спирт, хлорбензиловый спирт, дихлорбензиловый спирт; гексахлорофен; из фенольных соединений, таких как крезол, 4-хлор-м-крезол, п-хлор-м-ксиленол, дихлорфен, гексахлорфен, повидон-иодид; из парабенов, особенно алкилпарабенов, таких как метил-, этил, пропил-, бутилпарабен, бензилпарабен; из кислот, таких как сорбиновая кислота, бензойная кислота и его соли; из четвертичных аммонийных соединений, таких как алкониевые соли, например бензалкониевая соль, в особенности хлориды или бромиды, цетрониевые соли, например бромиды; феноалкециниевые соли, такая как фенододециний бромид, цетилпиридиний хлорид или другие такие соли; из соединений ртути, таких как фенилацетат ртути, борат или нитрат тиомерсал; хлоргексидин или его глюконат; из активных соединений антибиотиков биологического происхождения или их смесей.
Кроме того, предпочтительным является то, чтобы объемная концентрация спиртов с короткими цепями, в случае этилового, пропилового, бутилового или бензилового спирта, составляет вплоть до 10 мас.%, более предпочтительно вплоть до 5 мас.% и наиболее предпочтительно находилтся в интервале между 0.5-3 мас.%, и в случае хлорбутанола находится в интервале между 0.3-0.6 мас.%; объемная концентрация парабенов, особенно в случае метилпарабена находится в интервале между 0.05-0.2 мас.% и в случае пропилпарабена находится в интервале между 0.002-0.02 мас.%; объемная концентрация сорбиновой кислоты находится в интервале между 0.05-0.2 мас.% и в случае бензойной кислоты находится в интервале между 0.1-0.5 мас.%; объемная концентрация фенолов, триклозана находится в интервале между 0.1-0.3 мас.% и объемная концентрация хлоргексидина находится в интервале между 0.01-0.05 мас.%.
Также является предпочтительным то, что наименее растворимым среди наполнителей является липид или подобный липиду материал, предпочтительно полярный липид, в то время как вещество, которое более растворимо в суспендирующей жидкости и которое снижает среднее значение эластичного растяжения капельки, представляет собой поверхностно-активное вещество или другое вещество, обладающее свойствами, подобными поверхностно-активным и/или представляет собой форму указанного липида или подобного липиду материала, который сравнительно растворим как и указанное поверхностно-активное вещество или материал, подобный поверхностно-активному веществу.
Предпочтительно липид или липидоподобный материал представляет собой липид или липоид, источником которого является биологический материал или соответствующий синтетический липид или любые его модификации, предпочтительно указанный липид является принадлежащим к классу чистых фосфолипидов, соответствующих общей формуле

где R1 и R2 представляют собой алифатическую цепь, обычно С10-20-ацил, или -алкил или частично ненасыщенный остаток жирной кислоты, в особенности олеоил-, пальмитоелоил-, элаидоил-, линолеил-, линоленил-, линоленоил-, арахидоил-, вассинил-, лауроил-, миристоил-, пальмитоил- или стеароиловая цепь; и где R3 представляет собой водород, 2-триметиламино-1-этил, 2-амино-1-этил, C1-4-алкил, C1-5-алкил, замещенный карбокси, С2-5-алкил, замещенный гидрокси, С2-5-алкил, замещенный карбокси и гидроксигруппой или С2-5-алкил, замещенный карбокси и аминогруппой, инозитол, сфингозин или соли указанных соединений, указанные липиды, содержащие также глицериды, изопреноидные липиды, стероиды, стерины или стеролы, сульфо- или углеводородсодержащие липиды или любые другие образующие два слоя липиды, в частности наполовину протонированные жидкие жирные кислоты, указанный липид выбирают из группы, включающей фосфатидилхолины, фосфатидилэтаноламины, фосфатидилглицерины, фосфатидилинозитолы, фосфатидиловые кислоты, фосфатидилсерины, сфингомиелины или другие сфингофосфолипиды, гликосфинголипиды (включая цереброзиды, керамидполигексозиды, сульфатиды, сфингоплазмалогены), ганглиозиды и другие гликолипиды или синтетические липиды, в частности с соответствующими сфингозиновыми производными, или любые другие гликолипиды, при этом две одинаковые или различные цепи могут быть присоединены через сложные эфирные группы к скелету (как диацильное или диалкеноильное соединение) или они могут быть присоединены к скелету с помощью простых эфирных связей, как диалкиллипиды.
Поверхностно-активное вещество или поверхностно-активный материал предпочтительно представляет собой неионное, цвиттерионное, анионное или катионное поверхностно-активное вещество, особенно жирная кислота или спирт, алкил-три/ди/метиламмонийная соль, алкилсульфатная соль, моновалентная соль холата, деоксихолат, гликохолат, гликодеоксихолат, тауродеоксихолат, таурохолат, и т.д., ацилалканоилдиметиламиноксид, особенно додецилдиметиламиноксид, алкил- или алканоил-N-метилглюкамид, N-алкил-N,N-диметилглицин, 3 -(ацилдиметиламмоний)-алкансульфонат, N-ацилсульфобетаин, полиэтиленгликольоктилфенильный простой эфир, особенно нонаэтиленгликольоктилфенильный эфир, полиэтиленацильный эфир, в особенности нонаэтилендодециловый эфир, полиэтиленгликольизоациловый эфир, особенно октаэтиленгликольизотридециловый эфир, полиэтиленациловый эфир, особенно октаэтилендодециловый эфир, полиэтиленгликольсорбитанациловый эфир, такой как полиэтиленгликоль-20-монолаурат (Tween 20) или полиэтиленгликоль-20-сорбитанмоноолеат (Tween 80), полигидроксиэтиленациловый эфир, особенно полигидроксиэтиленлаурил, -миристоил, -цетилстеарил или -олеоиловый простой эфир, как полигидроксиэтилен-4 или 6 или 8 или 10 или 12, и т.д., -лауриловый простой эфир (в Brij сериях) или в соответствующих сложных эфирах, например, полигидроксиэтилен-8-стеарат (Myrj 45), -лауратного или олеатного типа или в полиэтоксилированном, касторовом масле 40, сорбитанмоноалкилат( например, в Arlacel или Span), в особенности сорбитанмонолаурат, ацил- или алканоил-N-метилглюкамиде, особенно в или деканоил- или додеканоил-N-метилглюкамиде, алкилсульфат (соль), например, в лаурил- или олеоилсульфате, деоксихолате натрия, гликодеоксихолате натрия, олеате натрия, таурате натрия, соль жирной кислоты, такая как элаидат натрия, линолеат натрия, лаурат натрия, лизофосфолипид, такой как н-октадецилен(=олеоил)-глицерофосфатидная кислота, -фосфорилглицерин или -фосфорилсерин, н-ацил-, например, лаурил- или олеоилглицерофосфатидная кислота, -фосфорилглицерин или -фосфорилсерин, н-тетрадецилглицерофосфатидная кислота, -фосфорилглицерин или - фосфорилсерин, соответствующий пальмитоелоил-, еладоил-, вассениллизофосфолипид или соответствующий фосфолипид с короткой цепью или другой поверхностно-активный полипептид.
Средний диаметр пенетранта предпочтительно находится между 30 нм и 500 нм, более предпочтительно между 40 нм и 250 нм, даже более предпочтительно между 50 нм и 200 нм и особенно предпочтительно между 60 нм и 150 нм.
Общую сухую массу капелек в составе предпочтительно выбирают затем из интервала от 0.01 (мас.%) до 40 мас.% от общей сухой массы состава, более предпочтительно она находится между 0.1 мас.% и 30 мас.%, и наиболее предпочтительно находится между 0,5 мас.% и 20 мас.%.
Предпочтительно общая сухая масса капелек в составе выбирается так, чтобы повысить вязкость состава до максимальных 200 мПа·с, более предпочтительно вплоть до 40 мПа·с, и наиболее предпочтительно вплоть до 8 мПа·с.
Предпочтительно, когда по крайней мере одно крайне-активное вещество или поверхностно-активное вещество и/или по крайней мере одно амфифильное соединение и/или по крайней мере одну гидрофильную жидкость и агент смешивают, если требуется отдельно, с образованием раствора, полученные (частичные) смеси или растворы затем последовательно объединяют для того, чтобы вызвать, предпочтительно путем воздействия механической энергии, такой как встряхивание, перемешивание, вибрация, гомогенизация, воздействие ультразвуком, сдвиг, замораживание и распарка или фильтрование с использованием приемлемого направленного давления, образование пенетрантов, которые связываются с агентом и/или включают агент.
Также является предпочтительным, если указанные амфифильные вещества затем растворяют в летучих растворителях, таких как спирты, особенно этанол, или в других, фармацевтически приемлемых органических растворителях, таких как этанол, 1- и 2-пропанол, бензиловый спирт, пропиленгликоль, полиэтиленгликоль (молекулярная масса: 200-400 D) или глицерин, другие фармацевтически приемлемые органические растворители, такие как переохлаждающий газ, в особенности суперкритический газ CO2, которые затем удаляют, особенно упариванием или разбавлением, перед проведением последней стадии.
Кроме того, образование указанных пенетрантов предпочтительно активизируют путем добавления требуемых веществ в жидкую фазу, упаривания из обращенной фазы, впрыскиванием или диализом, при необходимости под влиянием механического воздействия, такого как встряхивание, перемешивание, вибрация, гомогенизация, воздействие ультразвуком, сдвиг, замораживание и распарка или фильтрование с использованием пригодного, в особенности низкого (1 МПа) или среднего (вплоть дл 10 МПа), направленного давления.
Кроме того, предпочтительно, если образование указанных пенетрантов активизируется путем фильтрования через фильтрующий материал, имеющий размеры пор между 0.01 мкм и 0.8 мкм, более предпочтительно между 0.02 мкм и 0.3 мкм и наиболее предпочтительно между 0.05 мкм и 0.15 мкм, при этом могут быть использованы последовательно или параллельно несколько фильтров.
Указанные агенты и пенетранты готовят для связывания, по крайней мере, частичного
- после образования указанных пенетрантов, например, после впрыскивания раствора лекарственного препарата в фармацевтически приемлемой жидкости, такой как этанол, 1- и 2-пропанол, бензиловый спирт, пропилен гликоль, полиэтиленгликоль (молекулярная масса: 200-400 D) или глицерина в суспендирующую среду;
- одновременно с образованием пенетранта, если требуется с использованием сорастворения лекарственного препарата, с по крайней мере, несколькими пенетрантными ингредиентами.
Кроме того, является предпочтительным, если указанные пенетранты, с которыми связывается агент, готовят непосредственно перед применением состава, если возможно, из пригодного концетранта или лиофилизата.
Соответственно составы применяют путем распыления, намазывания, накатывания или натирания на площадь поверхности нанесения, в частности используя дозированный пульверизатор, спендер, валик или губку или негерметичный пластырь, если возможно.
Кроме того, является предпочтительным, если барьером является кожа или, по крайней мере, частично кератинизированный эндотелий и/ или назальная или любая другая слизистая оболочка.
Кроме того, доза на площадь поверхности указанного пенетранта при этом предпочтительно находится между 0.1 мг на квадратный сантиметр (мг см-2) и 40 мг см-2, более предпочтительно находится между 0.25 мг см-2 и 30 мг см-2 и даже более предпочтительно находится между 0.5 мг см-2 и 15 мг см-2, в случае, если пенетрант наносят на указанную кожу и/или по крайней мере на указанный частично кератинизированный эндотелий.
Кроме того, доза на площадь поверхности указанного пенетранта предпочтительно находится между 0.05 мг на квадратный сантиметр (мг см-2) и 20 мг см-2, более предпочтительно находится между 0.1 мг см-2 и 15 мг см-2 и даже более предпочтительно находится между 0.5 мг см-2 и 10 мг см-2, в случае, если пенетрант наносят на указанную назальную или другую слизистую оболочку.
Кроме того, доза на площадь поверхности указанного пенетранта предпочтительно находится между 0.0001 мг на квадратный сантиметр (мг см-2) и 0.1 мг см-2, более предпочтительно находится между 0.0005 мг см-2 и 0.05 мг см-2 и даже более предпочтительно находится между 0.001 мг см-2 и 0.01 мг см-2, в случае, если пенетрант наносят на само растение, на листья растения, на иглы растения.
Предпочтительным является, если используют способ распространения иммунного ответа у человека или другого млекопитающего путем вакцинации указанного млекопитающего.
Предпочтительным является, если используют способ распространения терапевтического эффекта у человека или другого млекопитающего.
Согласно настоящему изобретению перечисленные выше способы предпочтительно используют для лечения воспалительных заболеваний, дерматоза, заболеваний почки или печени, почечной недостаточности, аспирационного синдрома, синдрома Бекета, укусов и ожогов, заболеваний крови, плазмоглютининовых простудных заболеваний, плазмолитической анемии, гиперосинофилии, гипопластической анемии, макроглобулиновой анемии, тромбоцитопении пурпура, кроме того, для лечения заболеваний кости, церебрального паралича, синдрома Когана, врожденной надпочечной гиперплазии, заболеваний соединительных тканей типа лишайника, красной волчанки, полимиалгии ревматической, полимиозита и дерматомиозита, эпилепсии, заболеваний глаз, типа катаракт, офтальмологии Грайва, плазмодии, инфекционных заболеваний герпеса, невропатии, сетчаточного васкулита, склерита, некоторых желудочно-кишечных заболеваний типа воспалительной болезни кишки, тошноты, и повреждения глотки, пяточной кости, заразных заболеваний, например глаз (как в инфекционном мононуклеазе), болезни Кавасаки, миастении грейвис, различных синдромов боли типа постгерпетической невралгии, полинефропатита, панкреатита, заболеваний дыхательных путей типа астмы, для управления ревматоидной болезнью и остеоартритом, ринитом, саркоидозом, болезнями кожи типа алопеции, экземы, эритемы многоочаговой, лишайника, пузырчатки и пемфигоида, псориаза, пиодермии гангренозной, крапивницы, в случае щитовидной железы и сосудистых заболеваний.
Не ограничивая область настоящего изобретения, которое определено в прилагаемых пунктах формулы изобретения, изобретение далее будет описано более детально с помощью следующих примеров и чертежей, которые только иллюстрируют без ограничения, конкретные воплощения настоящего изобретения.
Общая подготовка эксперимента и подготовка пробы
Тестируемый состав. Высоко приспосабливаемые агрегированные капельки, используемые в рамках этой работы, имеют форму (олиго)бислойных везикул. Как правило, тестируемый состав содержит биологически совместимые (фосфо)липиды, типа фосфотидилхолина, (био)поверхностно-активные вещества типа холата натрия или полисорбата (Tween 80). Выбирают различные соотношения фосфолипида/поверхностно-активного вещества, чтобы поддержать или выбрать самую высокую возможную деформируемость агрегата.
Производство осуществляют как описано в предыдущих описаниях. Короче, раствор фосфотидилхолина (SPC; Natterman Фосфолипиды, Кельн, Германия) в хлороформе метят тритированным SPC (Amersham, XXX) и смешивают с холатом натрия (Merck, Darmstadt, Германия), чтобы получить соотношение фосфолипида/поверхностно-активного вещества 3,75/1 (моль/моль). Смесь диспергируют в фосфатном буфере (рН 7,2), так чтобы получить 10% общего количества липидов в суспензии.
Трижды везикулы в суспензии замораживают и оттаивают. Затем состав пропускают под давлением через несколько микропористых фильтров (сначала 200 нм; затем 100 нм, и окончательно 50 нм или 80 нм; Poretics, CA). Чтобы проверить воспроизводимость производства везикул, средний размер везикул измеряют с помощью динамической процедуры светорассеяния и обнаруживают, что они находятся в диапазоне от 80 нм до 150 нм.
Подопытные животные. Исследуют в течение эксперимента мышей NMRI породы, возрастом от 8 до 12 недель. Они имеют свободный доступ к стандартной пище и воде и содержатся в подвесных клетках в группах от 4 до 6 особей. Перед испытательным введением состава область наложения на каждом животном тщательно выбривают. Приготовление к тестированию проходит под общей анестезией (0,3 мл в мышь, изотонического раствора NaCl, содержащего 0,0071% Rompun (Bayer, Leverkusen, Германия) и 14,3 мг/мл Ketavet (Parke-Davis, Rochester, N.Y.). Для нанесения на кожу, которую оставляют негерметичной, используют пипетку, сделанную с высокой точностью. Каждое животное затем перемещают в индивидуальную клетку, где его содержат в течение дня. Раздельные клетки используют для каждого животного, по крайней мере, 24 часа. В испытательную группу включают четверых животных.
Испытательные измерения. Пробы крови собирают из конца хвоста после завершения эксперимента. В одном наборе экспериментов ранний забор крови осуществляют каждые 2 часа. Образцы органов включают: печень, селезенку, почку и кожу. Последнюю также осматривают поверхностно при взятии 10 полосок (использование Tesa-пленки).
Обработку образцов органа делают согласно стандартным процедурам: для измерения содержания 3Н, используют маленькую часть каждого органа и 100 мкл лизата трупа, чтобы получить желаемые и указанные экспериментальные данные. Их анализируют согласно стандартньм процедурам.
Чтобы определить общее восстановление метки, труп подопытных животных растворяют и затем выделяют добавлением 50 мл перхлорной кислоты.
Определяют восстановление (% нанесенной активности) и подсчитывают восстановленные дозы (% нанесенной активности на орган), также как и общее доставленное количество (мкг липида/г органа).
Примеры 1-5:
Быстрое введение
Высокоприспосабливаемые сложные капельки (ультрадеформируемые везикулы;
Transfersomes)
87,4 мг фосфатидилхолина из бобов сои (SPC)
12,6 мг холата натрия (NaChol)
следовое количество 3H-DPPC с определенной активностью: 750
микроКюри/500 мкл
0,9 мл фосфатного буфера, рН 7,3
Продолжительность эксперимента: 8 часов. Область нанесения: 1 см2 на верхней тыльной поверхности. Различные дозы, применяемые на контрольной поверхности, приводятся в таблице 1.
Таблица 1
|
Группа 1 |
Группа 2 |
Группа 3 |
Группа 4 |
Группа 5 |
| Нанесенный объем [мкл] |
1.0 |
5.0 |
7.0 |
15.0 |
30.0 |
| Нан. кол-во липидов [мг] |
1,0 |
0.50 |
0.75 |
1.50 |
3.00 |
| Нанесенная активность |
108998 |
544991 |
817486 |
1634972 |
3269943 |
| [импульсов в мин] |
|
|
|
|
|
Результаты тестируемых измерений даются в числах от 1 до 6.
Примеры 6-8:
Длительное нанесение
Высокоприспосабливаемые сложные капельки (ультрадеформируемые везикулы; Transfersomes)
87,4 мг фосфатидилхолина из бобов сои (SPC)
12,6 мг холата натрия (NaChol)
0,9 мл фосфатного буфера, рН 7.3
следовое количество 3H-DPPC с определенной активностью: 250 микрокюри/мл
Продолжительность эксперимента: 24 часа. Область нанесения: 1 см2; доза в каждой области дается в таблице 2.
Таблица 2
|
Группа 6 |
Группа 7 |
Группа 8 |
| Нанесенный объем [мкл] |
10,0 |
50,0 |
100,0 |
| Нанес. кол-во липидов [мг] |
1,00- |
5,00 |
10,00 |
| Нанес. активность [импусов в мин] |
145599 |
727997 |
1Е+06 |
Чтобы проверить эффект от изменения нанесенной дозы на область применения в течение более длинного периода времени, применяют даже большие объемы суспензии на верхнюю заднюю часть подопытных мышей.
Результаты анализируют и представляют вместе с теми, которые получены от предыдущего экспериментального ряда на фигурах от 1 до 7.
Фигура 1 показывает восстановление относительной активности (количество пенетранта) в различных слоях кожи как функцию нанесенной активности (доза).
Фигура 2 показывает количество внесенной радиоактивности (3H-DPPC) в крови как функцию времени и количество введенного пенетранта, как накожное применение, выраженное как процент от нанесенной дозы. Как может быть замечено на этом чертеже, относительное количество неинвазивно введенного липида, найденного в крови, достигает значительного уровня после заметной выдержки из приблизительно 4 часов, но при этом почти не зависит от используемой дозы.
Фигура 3 указывает на относительное накопление носителя с определенной радиоактивностью в различных органах в двух различных точках времени, после того как повышающаяся масса ультрадеформируемых носителей нанесена на кожу. Очевидно, что принимая во внимание то, что относительное количество носителя с определенной радиоактивностью уменьшается с примененной дозой при двух временных исследованиях, количество фосфолипида в крови, жизнеспособность кожи и печени в параллели возрастает при t = 8 часов, но остается практически неизменным при t = 24 часа.
Фигура 4 показывает абсолютный профиль разрушения пенетранта (в случайных частицах) в различных слоях кожи как функция нанесенной активности (доза). Зависимость небольшой дозы заметна в роговом слое для дозы на площадь поверхности между 0.5 мг см-2 и вплоть до 1.5 мг см-2, но большие количества пенетранта откладываются более существенно в барьере. Это действительно через 8 часов, так же как через 24 часа после введения суспензии. Жизнеспособная кожа аккумулирует движущийся пенетрантный материал в форме зависимости от дозы, во всем исследуемом интервале.
Фигура 5 показывает, что общее количество пенетранта, восстановленного в различных тканях (коже, крови, печени) при различных временных периодах после введения увеличивающегося количества ультрадеформированных пенетрантов на кожу растет с примененной дозой на площадь поверхности. Однако в то время как t = 8 часов, тенденция видимого насыщения наблюдается для доз больших, чем 1.5 мг см-2, при t = 24 часа зависимость дозы является линейной.
Фигура 6 показывает временную зависимость внесенной радиоактивности пенетранта в крови как функцию подкожно введенного объема суспензии (количество липида). Как можно увидеть из этого чертежа, временные характеристики проникновения по существу не зависят от применяемой дозы: через отмеренный период времени 4-6 часов наблюдается практически постоянная стабильная ситуация.
Фигура 7 показывает внесенную радиоактивность пенетранта в крови как функцию подкожного введения дозы, замеренную через 8 часов или 24 часов после применения. Линейная экстрополяция предполагает, что барьер начинает приспосабливаться к пенетрантному переносу приблизительно в 0.75 мг см-2.
Негерметичные одно- и многокомпонентный пластыри
Фигура 8 показывает результаты, полученные путем измерения значения интенсивности трансмиссиии пара (MVTR) пяти полиэтиленовых мембран, четырех полиуретановых мембран и одной поликарбонатной ультрафильтрационной мембраны.
Используют следующие сокращения:
Первый блок:
| DSM |
DSM Solutech, Heerlen, The Netherlands |
| 3М |
3М Medica, Borken, Germany |
| ARCare |
Adhesives Research, Limerick, Ireland |
| SM |
Smith и Nephew |
| Infiltec |
Infiltec, Speyer, Germany |
Второй блок:
| РЕ |
микропористый полиэтилен |
| PU |
полиуретан |
| РСТЕ |
поликарбонат ультрафильтрационный |
Третий блок сокращений относится к номерам статей.
Фигура 9 представляет собой диаграмму, показывающую принцип "эффект-выключение", который, например, наблюдается в связи с предлагаемыми гидрофобными сетчатыми мембранами. Дано поперечное сечение двух нитей сетчатого материала. В части 1 нити покрывают Transfersom®-составом или липидной суспензией без какого-либо контакта с кожей, например, во время хранения. Контакт с кожей устанавливает жидкие мостики к поверхности кожи (часть 2), который в конце концов ведет к полной смачиваемости кожи и высвобождает Transfersomes® через "решето" (часть 3).
Фигура 10 показывает проницаемость трех различных микропористых полиэтиленовых мембран для Transfersomes®, названных Тип-С; Solupor - Е011 D, Solupor - 8P07A и Solupor - 10Р05А (DSM Solutech, Heerlen, The Netherlands). Они демонстрируют высокую проницаемость при низких давлениях, таким образом позволяя Transfersomes смачивать кожу при контакте. Более того, на этой фигуре можно увидеть, что проницаемость Transfersomes® через мембраны отсутствует, если давление равно 0.
Фигура 11 показывает схематическую диаграмму многокомпонентного пластыря, имеющего наружные слои согласно настоящему изобретению в форме спаренного шприца, служащего как накопители со смешивающей системой трубок или Т-образным переходником, присоединенным к пластырю.
Фигура 12 показывает схематическую диаграмму многослойного пластыря согласно настоящему изобретению, имеющему вертикально сложенные слои.
Фигура 13 показывает схематическую диаграмму многокомпонентного пластыря согласно настоящему изобретению с расположением слоев бок-о-бок или рядом с вертикально встроенной перегородкой.
Фигура 14 показывает схематическую диаграмму многослойного пластыря согласно настоящему изобретению, имеющему расположение слоев рядом, бок-о-бок, разделением ламинированием.
Пример пластыря, который пригоден для применения Transfersome®-состава (V= 0.6 мл), согласно настоящему изобретению приведен ниже. Указанный трансдермальный (чрескожный) пластырь может быть использован как однослойный пластырь согласно настоящему изобретению и также может быть снабжен внешними слоями, чтобы затем образовать многослойный пластырь согласно настоящему изобретению (см.таблицу 3).
Таблица 3
| Тип |
Материал |
Размеры |
| Поддерживающая (тыльная) прокладка |
COTRAN 9701/3М 2 mil Полиуретан 70-0000-3993-6 SLPP261450106 |
Внутренний диаметр 3.6 см; внешний периметр 4.4 см×4.5 см |
| Слой |
3М лента губки 1779 полиолефиновая лента двойное расслоение
#70-0000-6467-8 |
|
| Внутренняя прокладка |
РСТЕ 100 нм Poratics; Cat 19410 LOTAE84AG11С024 |
|
| Защита/ периферия |
Лейкопласт |
|
| Система трубок для инъекции |
Пробка Venflon 1.2 мм/18GL45 мм
Art. №4253-1 LOT 931208 |
Предварительная установка системы трубок; удаление после TFS инъекции; герметизация лейкопластом |
| Площадь |
10 см2 |
| Применяемый периметр |
3.6 см |
| Концентрич. герметизирующая ширина |
> 0.8 см |
| Общая площадь |
20.25 см2 |
Пример другого пластыря, который пригоден для применения Transfersome®-состава согласно настоящему изобретению дан ниже. Указанный пластырь не имеет внутренней мембранной прокладки и предназначен для непосредственного нанесения на кожу. Заполнение смешивающего слоя (образованного поддерживающей прокладкой и кожей) может быть сделан, например, из наружных шприцов, соединенных со смешивающим слоем (см.таблицу 4).
Таблица 4
| Тип |
Материал |
Размеры |
| Поддерживающая прокладка |
Микропористый
Полиэтилен 9711;
3Mmedica #KG-90054 |
6 см * 8.6 см периметр |
| Слой |
3М лента губки 1779 полиолефиновая лента двойное расслоение # 70-0000-6467-8 |
Внешний периметр
6 см * 8.6 см
Внутренний
периметр 4.4 см * 7
см |
| Покрытие для |
| Выделения I |
Из губки, лента |
| Защитная периферия |
Лейкопласт |
|
| Система трубок для инъекции |
Пробка Venflon
1.2 мм/18GL45 мм
Art. №4253-1 LOT 931208 |
Предварительная установка трубок; удаление после инъекции TFS; герметизация прохода лейкопластом |
| Площадь нанесения |
25 см2 |
| Применяемый периметр |
4.4 см * 7 см |
| Концентрическая герметизирующая ширина |
> 0.8 см |
| Общая площадь |
51.6 см2 |
Формула изобретения
1. Способ контролирования потока пенетрантов через легко приспосабливаемый полупроницаемый пористый барьер, сформированный кожей, по меньшей мере частично кератинизированным эндотелием или слизистой оболочкой тела млекопитающего или растения, включающий в себя:
- приготовление состава путем суспендирования или диспергирования указанных пенетрантов в полярной жидкости в форме жидких капелек, окруженных подобным мембране покрытием из одного или нескольких слоев, при этом покрытие содержит по крайней мере два амфифильных вещества с тенденцией к агрегации, отличающиеся коэффициентом растворимости, по крайней мере равном 10 в указанной полярной жидкости, и где указанные пенетранты способны переносить агенты через поры указанного барьера или облегчать проникновение агентов через поры указанного барьера после того, как пенетранты вошли в поры,
- выбор дозированного количества указанных пенетрантов, которые должны быть нанесены на заранее определенной площади поверхности указанного барьера для контролирования потока указанных пенетрантов через указанный барьер, и
- нанесение выбранного дозированного количества указанного состава, содержащего указанные пенетранты на указанную площадь поверхности указанного пористого барьера,
при этом доза указанного пенетранта на площадь поверхности находится между 0,1 мг см-2 и 40 мг см-2, если пенетрант наносят на кожу млекопитающего и/или частично кератинизированный эндотелий, находится между 0,05 мг см-2 и 20 мг см-2, если пенетрант наносят на слизистую носа или иную слизистую оболочку, находится между 0,0001 мг см-2 и 0,1 мг см-2 в случае, если пенетрант наносят на тело, листья или иглы растения, и состав включает по крайней мере один загуститель, взятый в таком количестве, чтобы повысить вязкость состава максимально до 5 кН с/м2, так что облегчается намазывание состава и удержание лекарственного средства на площади нанесения, и/или по крайней мере один антиоксидант, взятый в таком количестве, которое снижает увеличение индекса окисления до значения ниже 100% на период в 6 месяцев, и/или по крайней мере одно бактерицидное средство, взятое в количестве, которое снижает количество бактерий с 1 миллиона зародышей, добавленных на грамм общей массы состава до менее чем 100 в случае аэробных бактерий, до менее чем 10 в случае энтеробактерий и менее чем 1 в случае Pseudomonas aeruginosa или Staphilococcus aureus, после периода в 4 дня.
2. Способ по п.1, отличающийся тем, что поток через указанный барьер повышается при увеличении нанесенной дозы указанных пенетрантов на площадь поверхности.
3. Способ по п.1 или 2, отличающийся тем, что значение рН состава находится между 3 и 10, более предпочтительно между 4 и 9 и наиболее предпочтительно между 5 и 8.
4. Способ по любому из предыдущих пунктов, отличающийся тем, что загуститель взят в таком количестве, чтобы повысить вязкость состава максимально до 1 кН·см2, и наиболее предпочтительно до 0,2 кН·с/м2, а антиоксидант взят в таком количестве, которое снижает увеличение индекса окисления до значения ниже 100% на период в 12 месяцев и более предпочтительно менее чем на 50% на период 12 месяцев.
5. Способ по п.4, отличающийся тем, что указанное по крайней мере одно бактерицидное средство добавляют в таком количестве, которое понижает количество бактерий с 1 миллиона зародышей, добавленных на грамм общей массы состава до менее чем 100 в случае аэробных бактерий и менее чем 10 в случае энтеробактерий и менее чем 1 в случае Pseudomonas aeruginosa или Staphilococcus aureus, после периода в 3 дня и более предпочтительно после периода в 1 день.
6. Способ по п.4, отличающийся тем, что указанный загуститель выбирают из класса фармацевтически приемлемых гидрофильных полимеров, таких как частично этерифицированные производные целлюлозы, как карбоксиметил-, гидроксиэтил-, гидроксипропил-, гидроксипропилметил- или метилцеллюлоза; полностью синтетических гидрофильных полимеров, таких как полиакрилаты, полиметакрилаты, поли(гидроксиэтил)-, поли(гидроксипропил)-, поли(гидроксипропилметил) метакрилаты, полиакрилонитрилы, металлилсульфонаты, полиэтилены, полиоксиэтилены, полиэтиленгликоли, полиэтиленгликольлактиды, полиэтиленгликольдиакрилаты, поливинилпирролидоны, поливиниловые спирты, поли(пропилметакриламиды), поли(пропиленфумарат -со-этиленгликоли), полоксамеры, полиаспартамиды, (поперечно-сшитый гидразин гиалуроновые кислоты, силиконы: природные смолы, содержащие альгинаты, каррагенаны, гуаровые смолы, желатины, трагаканты, (амидированные) пектины, ксантаны, хитозановые коллагены, агарозы; смеси и другие производные или их сополимеры и/или другие фармацевтически или по крайней мере биологически приемлемые полимеры.
7. Способ по п.6, отличающийся тем, что концентрация указанного полимера находится в интервале между 0,01 мас.% и 10 мас.%, более предпочтительно в интервале между 0,1 и 5 мол.%, еще более предпочтительно в интервале между 0,25 и 3.5 мас.% и наиболее предпочтительно в интервале между 0,5 и 2 мас.%.
8. Способ по п.4, отличающийся тем, что указанный антиоксидант выбирают из синтетических фенольных антиоксидантов, таких как бутилированный гидроксианизол (ВНА), бутилированный гидрокситолуол (ВНТ ) и ди-трет-бутилфенол (LY178002, LY256548, HWA-131, BF-389, CI-986, PD-127443, E-5119, BI-L-239XX, и т.д.), третичный бутилгидрохинон (TBHQ), пропилгаллат (PG), 1-О-гексил-2,3,5-триметилгидрохинон (HTHQ); ароматические амины (такие как дифениламин, п-алкилтио-о-анизидин, производные этилендиамина, карбазол, тетрагидроинденоиндол); фенолы и феноловые кислоты (такие как гваякол, гидрохинон, ванилин, галловые кислоты и их сложные эфиры, протокатехутовые кислоты, хининовая кислота, сиреневая кислота, элаговая кислота, салициловая кислота, нордигидрогуаретовая кислота (NDGA), эвгенол); токоферолы (включая токоферолы (альфа, бэта, гамма, дельта) и их производные, такие как токоферилацелат (например, -ацетат, -лаурат, миристат, -пальмитат, -олеат, -линолеат, и т.д, или любые другие пригодные токоферил-липоаты), токоферил-РОЕ-сукцинаты; тролокс и соответствующие амид- и тиокарбоксамидные аналоги; аскорбиновая кислота и ее соли, изоаскорбаты (2 или 3 или 6)-о-алкиласкорбиновые кислоты, аскорбиловые эфиры (например, 6-о-лауроил, миристоил, пальмитоил-, олеоил или линолеоил-L-аскорбиновая кислота, и т.п.); нестероидные противовоспалительные агенты (NSAIDs), такие как индометацин, диклофенак, мефенамовая кислота, флуфенамовая кислота, фенилбутазон, оксифенбутазон ацетилсалициловая кислота, напроксен, дифлунизал, ибупрофен, кетопрофен, пироксикам, пеницилламин, пеницилламин дисульфид, примахин, хинакрин, хлорохин, гидроксихлорохин, азатиоприн, фенобарбитал, ацетаминефен); аминосалициловые кислоты и производные; метабисульфит натрия, тиомочевина; хелатирующие агенты, такие как EDTA, GDTA, десферрал; глюкоза, убихинол-10; ферментные антиоксиданты, такие как супероксидная дисмутаза и металлические комплексы с аналогичной активностью, включая каталазу, глутатион пероксидазу, и менее комплексные молекулы, такие как бэта-каратин, билирубин, мочевую кислоту; флавоноиды (например, флавоны, флавонолы, флавононы, флаваноналы, хаконы, антоцианин), N-ацетилцистеин, мезна, глутатион, производные тиогистидина, триазолы; таннины, коричная кислота, гидроксикоричные кислоты и их сложные эфиры (например, кумариновые кислоты и сложные эфиры, кофеиновая кислота ее сложные эфиры, феруловая кислота, (изо-) хоргениновая кислота, синапиновая кислота); экстракты из специй (например, из чеснока, корицы, шалфея, розмарина, муската, орегано, гвоздики, мускатного ореха); карносовая кислота, карносол, карсолевая кислота; розмариновая кислота, розмариндифенол, гентизиновая кислота, феруловая кислота; экстракты из овсяной крупы, такие как авенантрамид 1 и 2; тиоэфиры, дитиоэфиры, сульфоксиды, тетраалкилтиурамдисульфиды; фитиновая кислота, стероидные производные (например, U74006F); метаболиты триптофана (например, 3-гидроксикинуренин, 3-гидроксиантраниловая кислота) и органохалкогениды или тому подобное представляющие собой фермент, подавляющий окисление.
9. Способ по п.8, отличающийся тем, что концентрация ВНА или ВНТ находится между 0,001 и 2 мас.%, более предпочтительно находится между 0,0025 и 0,2 мас.%, и наиболее предпочтительно находится между 0,005 и 0,02 мас.%, концентрация TBHQ и PG находится между 0,001 и 2 мас.%, более предпочтительно находится между 0,005 и 0,2 мас.%, и наиболее предпочтительно находится между 0,01 и 0,02 мас.%, концентрация токоферолов находится между 0,005 и 5 мас.%, более предпочтительно находится между 0,01 и 0,5 мас.% и наиболее предпочтительно находится между 0,05 и 0,075 мас.%, концентрация эфиров аскорбиновой кислоты находится между 0,001 и 5, более предпочтительно находится между 0,005 и 0,5 и наиболее предпочтительно находится между 0,01 и 0,15 мас.%, аскорбиновой кислоты находится между 0,001 и 5, более предпочтительно находится между 0,005 и 0,5 мас.% и наиболее предпочтительно находится между 0,01 и 0,1 мас.%, концентрация бисульфита натрия и метабисульфита натрия находится между 0,001 и 5, более предпочтительно находится между 0,005 и 0,5 мас.% и наиболее предпочтительно находится между 0,01-0,15 мас.%, концентрация тиомочевины находится между 0,0001 и 2 мас.%, более предпочтительно находится между 0,0005 и 0,2 и наиболее предпочтительно находится между 0,001-0,01 мас.%, наиболее часто 0,005 мас.%, концентрация цистеина находится между 0,01 и 5, более предпочтительно находится между 0,05 и 2 мас.% и наиболее предпочтительно находится между 0,1 и 1,0 мас.%, наиболее часто 0,5 мас.%, концентрация монотиоглицерина находится между 0,01 и 5 мас.%, более предпочтительно находится между 0,05 и 2 мас.% и наиболее предпочтительно находится между 0,1-1,0 мас.%, наиболее часто 0,5 мас.%, концентрация NDGA находится между 0,0005-2 мас.%, более предпочтительно находится между 0,001-0,2 мас.% и наиболее предпочтительно находится между 0,005-0,02 мас.%, наиболее часто 0,01 мас.%, концентрация глутатиона находится между 0,005 и 5 мас.%, более предпочтительно находится между 0,01 и 0,5 мас.% и наиболее предпочтительно находится между 0,05 и 0,2 мас.%, наиболее часто 0,1 мас.%, концентрация EDTA находится между 0,001 и 5 мас.%, даже более предпочтительно находится между 0,005 и 0,5 мас.% и наиболее предпочтительно находится между 0,01 и 0,2 мас.%, наиболее часто между 0,05 и 0,975 мас.%, концентрация лимонной кислоты находится между 0,001 и 5 мас.%, даже более предпочтительно находится между 0,005 и 3 мас.% и наиболее предпочтительно находится между 0,01-0,2, наиболее часто между 0,3 и 2 мас.%.
10. Способ по п.4, отличающийся тем, что указанное бактерицидное средство выбирают из спиртов с короткой цепью, таких как этиловый и изопропиловый спирт, хлорбутанол, бензиловый спирт, хлорбензиловый спирт, дихлорбензиловый спирт; гексахлорофен; из фенольных соединений, таких как крезол, 4-хлор-м-крезол, п-хлор-м-ксиленол, дихлорофен, гексахлорофен, повидон-иодид; из парабенов, особенно алкилпарабенов, таких как метил-, этил, пропил-, бутилпарабен, бензилпарабен; из кислот, таких как сорбиновая кислота, бензойная кислота и их солей; из четвертичных аммонийных соединений, таких как алкониевые соли, например, бензалкониевая соль, в особенности хлориды или бромиды, цетримониевые соли, например, бромиды; феноалкециниевая соль, такая как фенододециний бромид, цетилпиридиний хлорид или другие такие соли; из соединений ртути, таких как фенилацетат ртути, борат или нитрат тиомерсал; хлоргексидин или его глюконат; из активных соединений антибиотиков биологического происхождения или их смесей.
11. Способ по п.10, отличающийся тем, что объемная концентрация спиртов с короткими цепями, в случае этилового, пропилового, бутилового или бензилового спирта составляет вплоть до 10 мас.%, более предпочтительно вплоть до 5 мас.% и наиболее предпочтительно находится в интервале между 0,5-3 мас.%, и в случае хлорбутанола находится в интервале между 0,3-0,6 мас.%; объемная концентрация парабенов, особенно в случае метилпарабена находится в интервале между 0,05-0,2 мас.%, и в случае пропилпарабена находится в интервале между 0,002-0,02 мас.%; объемная концентрация сорбиновой кислоты находится в интервале между 0,05-0,2 мас.%, и в случае бензойной кислоты находится в интервале между 0,1-0,5 мас.%; объемная концентрация фенолов, триклозана находится в интервале между 0,1-0,3 мас.% и объемная концентрация хлоргексидина находится в интервале между 0,01-0,05 мас.%
12. Способ по любому из предыдущих пунктов, отличающийся тем, что менее растворимым среди агрегирующих веществ представляет собой липид или подобный липиду материал, в особенности полярный липид, в то время как вещество, которое более растворимо в суспендирующей жидкости и которое снижает среднее значение энергии упругости капельки, представляет собой поверхностно-активное вещество или другое вещество, обладающее свойствами, подобными поверхностно-активным и/или представляет собой форму указанного липида или подобного липиду материала, который относительно растворим, как и указанное поверхностно-активное вещество или материал, подобный поверхностно-активному веществу.
13. Способ по п.12, отличающийся тем, что липид или липидоподобный материал представляет собой липид или липоид, источником которого является биологический материал, или соответствующий синтетический липид, или любые его модификации, предпочтительно указанный липид является принадлежащим к классу фосфолипидов, соответствующих общей формуле:
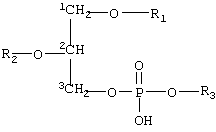
где R1 и R2 представляют собой алифатическую цепь, обычно С10-20-ацил, или -алкил или частично ненасыщенный остаток жирной кислоты, в особенности олеоил-, пальмитолеоил-, элаидоил-, линолеил-, линоленил-, линоленоил-, арахидоил-, вассинил-, лауроил-, миристоил-, пальмитоил- или стеароиловую цепь; и где R3 представляет собой водород, 2-триметиламино-1-этил, 2-амино-1-этил, С1-4-алкил, C1-5-алкил, замещенный карбоксигруппой, С2-5-алкил, замещенный гидрокси, С2-5-алкил, замещенный карбокси и гидроксигруппой или С2-5-алкил, замещенный карбокси и аминогруппой, инозитол, сфингозин или соли указанных соединений, указанные липиды, содержащие также глицериды, изопреноидные липиды, стероиды, стерины или стеролы, сульфо- или углеводородсодержащие липиды или любые другие образующие два слоя липиды, в частности, наполовину протонированные жидкие жирные кислоты, при этом указанный липид выбирают из группы, включающей фосфатидилхолины, фосфатидилэтаноламины, фосфатидилглицерины, фосфатидилинозитолы, фосфатидиловые кислоты, фосфатидилсерины, сфингомиелины или другие сфингофосфолипиды, гликосфинголипиды (включая цереброзиды, керамидполигексозиды, сульфатиды, сфингоплазмалогены), ганглиозиды и другие гликолипиды или синтетические липиды, в частности с соответствующими сфингозиновыми производными, или любые другие гликолипиды, при этом две одинаковые или различные цепи могут быть присоединены через сложные эфирные группы к скелету (как диацильное или диалкеноильное соединение) или они могут быть присоединены к скелету с помощью простых эфирных связей, как диалкил-липиды.
14. Способ по п.12, отличающийся тем, что поверхностно-активное вещество или поверхностно-активный материал представляет собой неионное, цвиттерионное, анионное или катионное поверхностно-активное вещество, особенно такая как жирная кислота или спирт, алкил-три/ди/метиламмонийная соль, алкилсульфатная соль, моновалентная соль холата, деоксихолат, гликохолат, гликодеоксихолат, тауродеоксихолат, таурохолат, и т.д., ацил- или алканоилдиметиламиноксид, особенно додецилдиметиламиноксид, алкил- или алканоил-N-метилглюкамид, N-алкил-N,N-диметилглицин, 3-(ацилдиметиламмоний)-алкансульфонат, N-ацилсульфобетаин, полиэтиленгликольоктилфениловый простой эфир, особенно нонаэтиленгликольоктилфениловый эфир, полиэтиленацильный эфир, в особенности, нонаэтилендодециловый эфир, полиэтиленгликольизоациловый эфир, особенно октаэтиленгликольизотридециловый эфир, полиэтиленациловый эфир, особенно октаэтилендодециловый эфир, полиэтиленгликольсорбитанациловый эфир, такой как полиэтиленгликоль-20-монолаурат (Tween 20) или полиэтиленгликоль-20-сорбитанмоноолеат (Tween 80), полигидроксиэтиленациловый эфир, особенно полигидроксиэтиленлаурил, -миристоил, -цетилстеарил или -олеоиловый простой эфир, как полигидроксиэтилен-4 или 6 или 8 или 10 или 12, и т.д., -лауриловый простой эфир (в Brij сериях) или в соответствующих сложных эфирах, например, полигидроксиэтилен-8-стеарат (Myrj 45), -лауратного или олеатного типа или в полиэтоксилированном касторовом масле 40, сорбитанмоноалкилат (например, в Arlacel или Span), в особенности сорбитанмонолаурат, ацил- или алканоил-N-метилглюкамиде, особенно в или деканоил- или додеканоил-N-метилглюкамиде, алкилсульфат (соль), например, в лаурил- или олеоилсульфате, деоксихолате натрия, гликодеоксихолате натрия, олеате натрия, таурате натрия, соль жирной кислоты, такая как элаидат натрия, линолеат натрия, лаурат натрия, лизофосфолипид, такой как н-октадецилен(=олеоил)-глицерофосфатидиновая кислота, -фосфорилглицерин или -фосфорилсерин, н-ацил-, например, лаурил- или олеоилглицерофосфатидиновая кислота, -фосфорилглицерин или -фосфорилсерин, н-тетрадецилглицерофосфатидная кислота, -фосфорилглицерин или -фосфорилсерин, соответствующий пальмитоелоил-, елаидоил-, вассениллизофосфолипид или соответствующий фосфолипид с короткой цепью или другой поверхностно-активный полипептид.
15. Способ по любому из предыдущих пунктов, отличающийся тем, что средний диаметр пенетранта находится между 30 и 500 нм, более предпочтительно между 40 и 250 нм, даже более предпочтительно между 50 и 200 нм и особенно предпочтительно между 60 и 150 нм.
16. Способ по любому из предыдущих пунктов, отличающийся тем, что общая сухая масса капелек в составе находится в интервале от 0,01 мас.% до 40 мас.% от общей сухой массы состава, более предпочтительно она находится между 0,1 мас.% и 30 мас.% и наиболее предпочтительно находится между 0,5 мас.% и 20 мас.%
17. Способ по любому из предыдущих пунктов, отличающийся тем, что по крайней мере одно амфифильное соединение и/или по крайней мере одно крайне-активное соединение, и поверхностно-активное соединение и/или по крайней мере одну гидрофильную жидкость и агент смешивают, если требуется отдельно, с образованием раствора, полученные частичные смеси или растворы затем последовательно объединяют для того, чтобы вызвать, предпочтительно, путем воздействия механической энергии, такой как встряхивание, перемешивание, вибрация, гомогенизация, воздействие ультразвуком, сдвиг, замораживание и распарка или фильтрование с использованием приемлемого направленного давления, образование пенетрантов, которые ассоциируются с и/или включают агент.
18. Способ по п.17, отличающийся тем, что указанные амфифильные вещества растворяют в летучих растворителях, таких как спирты, особенно этанол, или в других фармацевтически приемлемых органических растворителях, таких как этанол, 1-и 2-пропанол, бензиловый спирт, пропиленгликоль, полиэтиленгликоль (молекулярная масса: 200-400 D) или глицерин, другие фармацевтически приемлемые органические растворители, такие как переохлаждающий газ, в особенности суперкритический газ СО2, которые затем удаляют, особенно упариванием или разбавлением, перед проведением последней стадии.
19. Способ по любому из п.17 или 18, отличающийся тем, что образование указанных пенетрантов активизируют путем добавления требуемых веществ в жидкую фазу, упаривания из обращенной фазы, впрыскиванием или диализом, при необходимости под влиянием механического воздействия, такого как встряхивание, перемешивание, вибрация, гомогенизация, воздействие ультразвуком, сдвиг, замораживание и распарка или фильтрование с использованием пригодного, в особенности низкого до 1 МПа или среднего до 10 МПа, направленного давления.
20. Способ по п.19, отличающийся тем, что образование указанных пенетрантов активизируют путем фильтрования через фильтрующий материал, имеющий размеры пор между 0,01 и 0,8 мкм, более предпочтительно между 0,02 и 0,3 мкм, и наиболее предпочтительно между 0,05 и 0,15 мкм, при этом могут быть использованы последовательно или параллельно несколько фильтров.
21. Способ по любому из пп.17-20, отличающийся тем, что указанные агенты и пенетранты готовят для связывания, по крайней мере частичного, после образования указанных пенетрантов, например, после впрыскивания раствора лекарственного препарата в фармацевтически приемлемой жидкости, такой как этанол, 1- и 2-пропанол, бензиловый спирт, пропиленгликоль, полиэтиленгликоль (молекулярная масса: 200-400 дальтон) или глицерин в суспендирующую среду, или одновременно с образованием пенетранта, если требуется с использованием сорастворения лекарственного препарата, с по крайней мере несколькими пенетрантными ингредиентами.
22. Способ по любому из пп.17-21, отличающийся тем, что указанные пенетранты, с которыми связывается агент, готовят непосредственно перед применением состава из пригодного концетранта или лиофилизата.
23. Способ по любому из предшествующих пунктов, отличающийся тем, что состав наносят путем распыления, намазывания, накатывания или натирания на площадь поверхности нанесения, в частности, используя дозированный пульверизатор, спендер, валик или губку или негерметичный пластырь.
24. Способ по любому из предшествующих пунктов, отличающийся тем, что доза указанного пенетранта на площадь поверхности находится между 0,25 и 30 мг см-2 и наиболее предпочтительно между 0,5 и 15 мг см-2, и пенетрант наносят на указанную кожу и/или на указанный частично кератинизированный эндотелий.
25. Способ по любому из пп.1-23, отличающийся тем, что доза указанного пенетранта на площадь поверхности находится между 0,1 и 15 мг см-2, более предпочтительно между 0,5 и 10 мг см-2, и пенетрант наносят на указанную назальную или другую слизистую оболочку.
26. Способ по любому из пп.1-23, отличающийся тем, что доза указанного пенетранта на площадь поверхности находится между 0,0005 и 0,05 мг см-2, более предпочтительно между 0,001 и 0,01 мг см-2, и пенетрант наносят на тело растения, листья растения или иглы растения.
27. Пластырь, содержащий состав, включающий в себе суспендированные или диспергированные в полярной жидкости пенетранты, окруженные подобным мембране покрытием из одного или нескольких слоев, при этом покрытие содержит по крайней мере два амфифильных вещества с тенденцией к агрегации, отличающиеся коэффициентом растворимости, по крайней мере равном 10 в указанной полярной жидкости, по крайней мере один загуститель, взятый в таком количестве, чтобы повысить вязкость состава максимально до 5 кН с/м2, так что облегчается намазывание состава и удержание лекарственного средства на площади нанесения, и/или по крайней мере один антиоксидант, взятый в таком количестве, которое снижает увеличение индекса окисления до значения ниже 100% на период в 6 месяцев, и/или по крайней мере одно бактерицидное средство, взятое в количестве, которое снижает количество бактерий с 1 миллиона зародышей, добавленных на грамм общей массы состава до менее чем 100 в случае аэробных бактерий, до менее чем 10 в случае энтеробактерий и менее чем 1 в случае Pseudomonas aeruginosa или Staphilococcus aureus после периода в 4 дня.
28. Пластырь по п.27, отличающийся тем, что значение рН состава находится между 3 и 10, более предпочтительно между 4 и 9 и наиболее предпочтительно между 5 и 8.
29. Пластырь по п.27, отличающийся тем, что загуститель взят в таком количестве, чтобы повысить вязкость состава максимально до 1 кН·с/м2 и наиболее предпочтительно до 0,2 кН·с/м2, а антиоксидант взят в таком количестве, которое снижает увеличение индекса окисления до значения ниже 100% на период в 12 месяцев и более предпочтительно менее чем на 50% на период 12 месяцев.
30. Пластырь по п.27, отличающийся тем, что бактерицидное средство взято в таком количестве, которое понижает количество бактерий с 1 миллиона зародышей, добавленных на грамм общей массы состава до менее чем 100 в случае аэробных бактерий и менее чем 10 в случае энтеробактерий, и менее чем 1 в случае Pseudomonas aeruginosa или Staphilococcus aureus после периода в 3 дня и более предпочтительно после периода в 1 день.
31. Пластырь по п.27, отличающийся тем, что загуститель выбирают из класса фармацевтически приемлемых гидрофильных полимеров, таких как частично этерифицированные производные целлюлозы, как карбоксиметил-, гидроксиэтил-, гидроксипропил-, гидроксипропилметил- или метилцеллюлоза; полностью синтетических гидрофильных полимеров, таких как полиакрилаты, полиметакрилаты, поли(гидроксиэтил)-, поли(гидроксипропил)-, поли(гидроксипропилметил)метакрилаты, полиакрилонитрилы, металлилсульфонаты, полиэтилены, полиоксиэтилены, полиэтиленгликоли, полиэтиленгликольлактиды, полиэтиленгликольдиакрилаты, поливинилпирролидоны, поливиниловые спирты, поли(пропилметакриламиды), поли(пропиленфумарат -со-этиленгликоли), полоксамеры, полиаспартамиды, (поперечно-сшитый гидразин) гиалуроновые кислоты, силиконы; природные смолы, содержащие альгинаты, каргагенаны, гуаровые смолы, желатины,- трагаканты, (амидированные) пектины, ксантаны, хитозановые коллагены, агарозы; смеси и другие производные или их сополимеры и/или другие фармацевтически или по крайней мере биологически приемлемые полимеры.
32. Пластырь по п.31, отличающийся тем, что концентрация указанного полимера находится в интервале между 0,01 и 10 мас.%, более предпочтительно в интервале между 0,1 и 5 мас.%, еще более предпочтительно в интервале между 0,25 и 3,5 мас.% и наиболее предпочтительно в интервале между 0,5 и 2 мас.%.
33. Пластырь по п.27, отличающийся тем, что антиоксидант выбирают из синтетических фенольных антиоксидантов, таких как бутилированный гидроксианизол (ВНА), бутилированный гидрокситолуол (ВНТ ) и ди-трет-бутилфенол (LY178002, LY256548, HWA-131, BF-389, CI-986, PD-127443, E-5119, BI-L-239XX, и т.д.), третичный бутилгидрохинон (TBHQ), пропилгаллат (PG), 1-О-гексил-2,3,5-триметилгидрохинон (HTHQ); ароматические амины (такие как дифениламин, п-алкилтио-о-анизидин, производные этилендиамина, карбазол, тетрагидроинденоиндол); фенолы и феноловые кислоты (такие как гваякол, гидрохинон, ванилин, галловые кислоты и их сложные эфиры, протокатехутовые кислоты, хининовая кислота, сиреневая кислота, элаговая кислота, салициловая кислота, нордигидрогуаретовая кислота (NDGA), эвгенол); токоферолы (включая токоферолы (альфа, бэта, гамма, дельта) и их производные, такие как токоферилацелат (например, -ацетат, -лаурат, миристат, -пальмитат, -олеат, -линолеат, и т.д. или любые другие пригодные токоферил-липоаты), токоферил-РОЕ-сукцинаты; тролокс и соответствующие амид- и тиокарбоксамидные аналоги; аскорбиновая кислота и ее соли, изоаскорбаты (2 или 3 или 6)-о-алкиласкорбиновые кислоты, аскорбиловые эфиры (например, 6-о-лауроил, миристоил, пальмитоил-, олеоил или линолеоил-L-аскорбиновая кислота, и т.п.); нестероидные противовоспалительные агенты (NSAIDs), такие как индометацин, диклофенак, мефенамовая кислота, флуфенамовая кислота, фенилбутазон, оксифенбутазон ацетилсалициловая кислота, напроксен, дифлунизал, ибупрофен, кетопрофен, пироксикам, пеницилламин, пеницилламин дисульфид, примахин, хинакрин, хлорохин, гидроксихлорохин, азатиоприн, фенобарбитал, ацетаминефен); аминосалициловые кислоты и производные; метабисульфит натрия, тиомочевина; хелатирующие агенты, такие как EDTA, GDTA, десферрал; глюкоза, убихинол-10; ферментные антиоксиданты, такие как супероксидная дисмутаза и металлические комплексы с аналогичной активностью, включая каталазу, глутатион пероксидазу, и менее комплексные молекулы, такие как бэта-каратин, билирубик, мочевую кислоту; флавоноиды (например, флавоны, флавонолы, флавононы, флаваноналы, хаконы, антоцианин; N-ацетилцистеин, мезна, глутатион, производные тиогистидина, триазолы; таннины, коричная кислота, гидроксикоричные кислоты и их сложные эфиры (например, кумариновые кислоты и сложные эфиры, кофеиновая кислота ее сложные эфиры, феруловая кислота, (изо-) хоргениновая кислота, синапиновая кислота); экстракты из специй (например, из чеснока, корицы, шалфея, розмарина, муската, орегано, гвоздики, мускатного ореха); карносовая кислота, карносол, карсолевая кислота; розмариновая кислота, розмариндифенол, гентизиновая кислота, феруловая кислота; экстракты из овсяной крупы, такие как авенантрамид 1 и 2; тиоэфиры, дитиоэфиры, сульфоксиды, тетраалкилтиурамдисульфиды; фитиновая кислота, стероидные производные (например, U74006F); метаболиты триптофана (например, 3-гидроксикинуренин, 3-гидроксиантраниловая кислота) и органохалкогениды или тому подобное представляющие собой фермент, подавляющий окисление.
34. Пластырь по п.33, отличающийся тем, что концентрация ВНА или ВНТ находится между 0,001 и 2 мас.%, более предпочтительно находится между 0,0025 и 0,2 мас.% и наиболее предпочтительно находится между 0,005 и 0,02 мас.%, концентрация TBHQ и PG находится между 0,001 и 2 мас.%, более предпочтительно находится между 0,005 и 0,2 мас.%, и наиболее предпочтительно находится между. 0,01 и 0,02 мас.%, концентрация токоферолов находится между 0,005 и 5 мас.%, более предпочтительно находится между 0,01 и 0,5 мас.% и наиболее предпочтительно находится между 0,05 и 0,075 мас.%, концентрация эфиров аскорбиновой кислоты находится между 0,001 и 5, более предпочтительно находится между 0,005 и 0,5 и наиболее предпочтительно находится между 0,01 и 0,15 мас.%, аскорбиновой кислоты находится между 0,001 и 5, более предпочтительно находится между 0,005 и 0,5 мас.% и наиболее предпочтительно находится между 0,01 и 0,1 мас.%, концентрация бисульфита натрия и метабисульфита натрия находится между 0,001 и 5, более предпочтительно находится между 0,005 и 0,5 мас.% и наиболее предпочтительно находится между 0,01-0,15 мас.%, концентрация тиомочевины находится между 0,0001 и 2 мас.%, более предпочтительно находится между 0,0005 и 0,2 и наиболее предпочтительно находится между 0,001-0,01 мас.%, наиболее часто 0,005 мас.%, концентрация цистеина находится между 0,01 и 5, более предпочтительно находится между 0,05 и 2 мас.% и наиболее предпочтительно находится между 0,1 и 1,0 мас.%, наиболее часто 0,5 мас.%, концентрация монотиоглицерина находится между 0,01 и 5 мас.%, более предпочтительно находится между 0,05 и 2 мас.% и наиболее предпочтительно находится между 0,1-1,0 мас.% наиболее часто 0,5 мас.%, концентрация NDGA находится между 0,0005-2 мас.% более предпочтительно находится между 0,001-0,2 мас.%, и наиболее предпочтительно находится между 0,005-0,02 мас.%, наиболее часто 0,01 мас.%, концентрация глутатиона находится между 0,005 и 5 мас.%, более предпочтительно находится между 0,01 и 0,5 мас.% и наиболее предпочтительно находится между 0,05 и 0,2 мас.%, наиболее часто 0,1 мас.%, концентрация EDTA находится между 0,001 и 5 мас.%, даже более предпочтительно находится между 0,005 и 0,5 мас.% и наиболее предпочтительно находится между 0,01 и 0,2 мас.%, наиболее часто между 0,05 и 0,975 мас.%, концентрация лимонной кислоты находится между 0,001 и 5 мас.%, даже более предпочтительно находится между 0,005 и 3 мас.% и наиболее предпочтительно находится между 0,01- 0,2, наиболее часто между 0,3 и 2 мас.%.
35. Пластырь по п.27, отличающийся тем, что бактерицидное средство выбирают из спиртов с короткой цепью, таких как этиловый и изопропиловый спирт, хлорбутанол, бензиловый спирт, хлорбензиловый спирт, дихлорбензиловый спирт; гексахлорофен; из фенольных соединений, таких как крезол, 4-хлор-м-крезол, п-хлор-м-ксиленол, дихлорофен, гексахлорофен, повидон-иодид; из парабенов, особенно алкилпарабенов, таких как метил-, этил, пропил-, бутилпарабен, бензилпарабен; из кислот, таких как сорбиновая кислота, бензойная кислота и их солей; из четвертичных аммонийных соединений, таких как алкониевые соли, например, бензалкониевая соль, в особенности хлориды или бромиды, цетримониевые соли, например, бромиды; феноалкециниевая соль, такая как фенододециний бромид, цетилпиридиний хлорид или другие такие соли; из соединений ртути, таких как фенилацетат ртути, борат или нитрат тиомерсал; хлоргексидин или его глюконат; из активных соединений антибиотиков биологического происхождения или их смесей.
36. Пластырь по п.35, отличающийся тем, что объемная концентрация спиртов с короткими цепями в случае этилового, пропилового, бутилового или бензилового спирта составляет вплоть до 10 мас.%, более предпочтительно вплоть до 5 мас.%, и наиболее предпочтительно находится в интервале между 0,5-3 мас.%, и в случае хлорбутанола находится в интервале между 0,3-0,6 мас.%; объемная концентрация парабенов, особенно в случае метилпарабена находится в интервале между 0,05-0,2 мас.% и в случае пропилпарабена находится в интервале между 0,002-0,02 мас.%; объемная концентрация сорбиновой кислоты находится в интервале между 0,05-0,2 мас.%, и в случае бензойной кислоты находится в интервале между 0,1-,5 мас.%; объемная концентрация фенолов, триклозана находится в интервале между 0,1-0,3 мас.% и объемная концентрация хлоргексидина находится в интервале между 0,01-0,05 мас.%.
37. Пластырь по любому из пп.27-36, отличающийся тем, что менее растворимое среди агрегирующих веществ представляет собой липид или подобный липиду материал, в особенности полярный липид, в то время как вещество, которое более растворимо в суспендирующей жидкости и которое снижает среднее значение энергии упругости капельки, представляет собой поверхностно-активное вещество или другое вещество, обладающее свойствами, подобными поверхностно-активным, и/или представляет собой форму указанного липида или подобного липиду материала, который относительно растворим, как и указанное поверхностно-активное вещество или материал, подобный поверхностно-активному веществу.
38. Пластырь по п.37, отличающийся тем, что липид или липидоподобный материал представляет собой липид или липоид, источником которого является биологический материал или соответствующий синтетический липид или любые его модификации, предпочтительно указанный липид является принадлежащим к классу фосфолипидов, соответствующих общей формуле
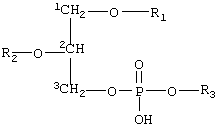
где R1 и R2 представляют собой алифатическую цепь, обычно С10-20-ацил, или -алкил или частично ненасыщенный остаток жирной кислоты, в особенности олеоил-, пальмитолеоил-, элаидоил-, линолеил-, линоленил-, линоленоил-, арахидоил-, вассинил-, лауроил-, миристоил-, пальмитоил- или стеароиловую цепь; и где R3, представляет собой водород, 2-триметиламино-1-этил, 2-амино-1-этил, С1-4-алкил, C1-5-алкил, замещенный карбоксигруппой, С2-5-алкил, замещенный гидрокси, С2-5-алкил, замещенный карбокси и гидроксигруппой или С2-5-алкил, замещенный карбокси и аминогруппой, инозитол, сфингозин или соли указанных соединений, указанные липиды, содержащие также глицериды, изопреноидные липиды, стероиды, стерины или стеролы, сульфо- или углеводородсодержащие липиды или любые другие образующие два слоя липиды, в частности наполовину протонированные жидкие жирные кислоты, при этом указанный липид выбирают из группы, включающей фосфатидилхолины, фосфатидилэтаноламины, фосфатидилглицерины, фосфатидилинозитолы, фосфатидиловые кислоты, фосфатидилсерины, сфингомиелины или другие сфингофосфолипиды, гликосфинголипиды (включая цереброзиды, керамидполигексозиды, сульфатиды, сфингоплазмалогены), ганглиозиды и другие гликолипиды или синтетические липиды, в частности с соответствующими сфингозиновыми производными, или любые другие гликолипиды, при этом две одинаковые или различные цепи могут быть присоединены через сложные эфирные группы к скелету (как диацильное или диалкеноильное соединение) или они могут быть присоединены к скелету с помощью простых эфирных связей, как диалкил-липиды.
39. Пластырь по п.37, отличающийся тем, что поверхностно-активное вещество или поверхностно-активный материал представляет собой неионное, цвиттерионное, анионное или катионное поверхностно-активное вещество, особенно такая, как жирная кислота или спирт, алкил-три/ди/метиламмонийная соль; алкилсульфатная соль, моновалентная соль холата, деоксихолат, гликохолат, гликодеоксихолат, тауродеоксихолат, таурохолат и т.д., ацил- или алканоилдиметиламиноксид, особенно додецилдиметиламиноксид, алкил- или алканоил-N-метилглюкамид, N-алкил-N,N-диметилглицин, 3-(ацилдиметиламмоний)-алкансульфонат, N-ацилсульфобетаин, полиэтиленгликольоктилфениловый простой эфир, особенно нонаэтиленгликольоктилфениловый эфир, полиэтиленацильный эфир, в особенности нонаэтилендодециловый эфир, полиэтиленгликольизоациловый эфир, особенно октаэтиленгликольизотридециловый эфир, полиэтиленациловый эфир, особенно октаэтилендодециловый эфир, полиэтиленгликольсорбитанациловый эфир, такой как полиэтиленгликоль-20-монолаурат (Tween 20) или полиэтиленгликоль-20-сорбитанмоноолеат (Tween 80), полигидроксиэтиленациловый эфир, особенно полигидроксиэтиленлаурил, -миристоил, -цетилстеарил или -олеоиловый простой эфир, как полигидроксиэтилен-4, или 6, или 8, или 10 или 12 и т.д., -лауриловый простой эфир (в Brij сериях) или в соответствующих сложных эфирах, например полигидроксиэтилен-8-стеарат (Myrj 45), -лауратного или олеатного типа или в полиэтоксилированном касторовом масле 40, сорбитанмоноалкилат( например, в Arlacel или Span), в особенности сорбитанмонолаурат, ацил- или алканоил-N-метилглюкамиде, особенно в или деканоил-, или додеканоил-N-метилглюкамиде, алкилсульфат (соль), например в лаурил- или олеоилсульфате, деоксихолате натрия, гликодеоксихолате натрия, олеате натрия, таурате натрия, соль жирной кислоты, такая как элаидат натрия, линолеат натрия, лаурат натрия, лизофосфолипид, такой как н-октадецилен(=олеоил)-глицерофосфатидиновая кислота, -фосфорилглицерин или -фосфорилсерин, н-ацил-, например, лаурил- или олеоилглицерофосфатидиновая кислота, -фосфорилглицерин или -фосфорилсерин, н-тетрадецилглицерофосфатидная кислота, -фосфорилглицерин или -фосфорилсерин, соответствующий пальмитоелоил-, елаидоил-, вассениллизофосфолипид или соответствующий фосфолипид с короткой цепью или другой поверхностно-активный полипептид.
40. Пластырь по п.27, отличающийся тем, что средний диаметр пенетранта находится между 30 и 500 нм, более предпочтительно между 40 и 250 нм, даже более предпочтительно между 50 и 200 нм и особенно предпочтительно между 60 и 150 нм.
41. Пластырь по п.27, отличающийся тем, что общая сухая масса капелек в составе находится в интервале от 0,01 до 40 мас.% от общей сухой массы состава, более предпочтительно она находится между 0,1 и 30 мас.% и наиболее предпочтительно находится между 0,5 и 20 мас.%.
42. Пластырь по п.27, отличающийся тем, что по крайней мере одно амфифильное соединение и/или по крайней мере одно крайне-активное соединение и поверхностно-активное соединение и/или по крайней мере одну гидрофильную жидкость и агент смешивают, если требуется отдельно, с образованием раствора, полученные частичные смеси или растворы затем последовательно объединяют для того, чтобы вызвать предпочтительно путем воздействия механической энергии, такой как встряхивание, перемешивание, вибрация, гомогенизация, воздействие ультразвуком, сдвиг, замораживание и распарка или фильтрование с использованием приемлемого направленного давления, образование пенетрантов, которые ассоциируются с и/или включают агент.
43. Пластырь по п.42, отличающийся тем, что указанные амфифильные вещества растворяют в летучих растворителях, таких как спирты, особенно этанол, или в других фармацевтически приемлемых органических растворителях, таких как этанол, 1- и 2-пропанол, бензиловый спирт, пропиленгликоль, полиэтиленгликоль (молекулярная масса: 200-400 D) или глицерин, другие фармацевтически приемлемые органические растворители, такие как переохлаждающий газ, в особенности суперкритический газ СО2, которые затем удаляют, особенно упариванием или разбавлением, перед проведением последней стадии.
44. Пластырь по п.27, содержащий негерметичную тыльную прокладку, внутреннюю прокладку, предотвращающую нежелательное выделение состава из пластыря во время хранения, при этом тыльная прокладка и внутренняя прокладка образуют резервуар.
45. Пластырь по п. 27, содержащий негерметичную тыльную прокладку; и матричный слой.
46. Пластырь по п.44 или 45, отличающийся тем, что негерметичная тыльная прокладка имеет значение интенсивности трансмиссии пара (MVTR) более чем 1000 г/м2 день, предпочтительно более чем 5,000 г/м2 день и наиболее предпочтительно более чем 10,000 г/м2 день.
47. Пластырь по п.46, отличающийся тем, что негерметичная тыльная прокладка имеет поры размером меньше, чем 100 нм, предпочтительно меньше, чем 70 нм, более предпочтительно меньше, чем 30 нм.
48. Пластырь по п.47, отличающийся тем, что негерметичная тыльная прокладка содержит мембрану, предпочтительно выбранную из группы, содержащей полиуретановую мембрану, полиэфирную ультрафильтрационную пористую мембрану, поликарбонатную ультрафильтрационную пористую мембрану и полиэтиленовую микропористую мембрану.
49. Пластырь по п.47, отличающийся тем, что внутренняя прокладка содержит гомогенную мембрану, предпочтительно полиэфирную ультрафильтрационную пористую мембрану или поликарбонатную ультрафильтрационную пористую мембрану.
50. Пластырь по п.49, отличающийся тем, что мембраны имеют плотность пор, которая составляет до 5%, предпочтительно до 15%, более предпочтительно до 25% и наиболее предпочтительно более чем 25%, и/или размер пор, лежащий в интервале между 20 и 200 нм, предпочтительно между 50 и 140 нм и наиболее предпочтительно между 80 и 120 нм.
51. Пластырь по п.44, отличающийся тем, что внутренняя прокладка содержит гидрофобные ячеистые мембраны и/или нетканную шерсть с ячеистыми отверстиями, образованными гидрофобными нитями.
52. Пластырь по п.51, отличающийся тем, что внутренняя прокладка содержит микропористую полиэтиленовую мембрану, имеющую средние размеры пор, лежащие в интервале между 50 и 3000 нм, предпочтительно между 500 и 2000 нм и наиболее предпочтительно примерно 1500 нм.
53. Пластырь по п.27, отличающийся тем, что он содержит чувствительный к давлению адгезивный слой, предпочтительно адгезивный слой, содержащий полиацилат, полиизобутилен, силикон, сополимер этилен винилацетата, поливинилпирролидон или гидрогель полиэтиленоксида.
54. Пластырь по любому из пп.43-45, отличающийся тем, что он содержит один или более дополнительный слой, включая слои, содержащие сиккатив, матричные слои, слои, содержащие ленты из губки и/или защитные слои.
55. Пластырь по любому из пп.43-45, отличающийся тем, что площадь поверхности мембраны, в которой выделяется лекарственное средство находится между 0,5 и 250 см2, предпочтительно между 1 и 100 см2, предпочтительно между 2 и 50 см2 и более предпочтительно между 4 и 25 см2.
56. Пластырь по п.27, отличающийся тем, что он включает по крайней мере две ячейки, которые отделены друг от друга во время хранения.
57. Пластырь по п.56, отличающийся тем, что состав и/или индивидуальные компоненты состава, и/или агента, или суспензии/дисперсии пенетрантов без агентов содержат во время хранения в нескольких, предпочтительно менее чем 5, более предпочтительно в 3 и наиболее предпочтительно в 2 разделенных ячейках пластыря, которые при необходимости объединяют до или во время применения пластыря путем непосредственного механического действия, такого как давление, трение, растирание, кручение, разрывание, и/или опосредованно путем изменения температуры, осмотического давления или электрического потенциала.
58. Пластырь по любому из пп.56 и 57, отличающийся тем, что внешняя ячейка содержит системы инъекции, которые соединены с резервуаром.
59. Пластырь по любому из пп.56 и 57, отличающийся тем, что ячейки находятся внутри резервуара, который образуется с помощью тыльной прокладки и внутренней прокладки.
60. Пластырь по любому из пп.56 и 57, отличающийся тем, что ячейки расположены вертикально или рядом, бок о бок и/или одна ячейка включается во вторую ячейку, предпочтительно без скрепления с ней.
61. Пластырь по п.56 или 57, отличающийся тем, что ячейки отделены друг от друга с помощью контролируемо открытого барьера, предпочтительно мембраны и/или пробки и/или путем образующего слои ламинирования.
62. Пластырь по п.27, содержащий негерметичную тыльную прокладку, мембрану, создающую резервуар, который разделен по крайней мере на две ячейки, причем состав непосредственно контактирует с кожей, когда происходит его высвобождение из резервуара.
63. Набор, содержащий состав, включающий в себя суспендированные или диспергированные в полярной жидкости гиретранты, окруженные подобным мембране покрытием из одного или нескольких слоев, при этом покрытие содержит по крайней мере два амфифильных вещества с тенденцией к агрегации, отличающиеся коэффициентом растворимости, по крайней мере равном 10 в указанной полярной жидкости, по крайней мере один загуститель, взятый в таком количестве, чтобы повысить вязкость состава максимально до 5 кН с/м2, так что облегчается намазывание состава и удержание лекарственного средства на площади нанесения, и/или по крайней мере один антиоксидант, взятый в таком количестве, которое снижает увеличение индекса окисления до значения ниже 100% на период в 6 месяцев, и/или по крайней мере одно бактерицидное средство, взятое в количестве, которое снижает количество бактерий с 1 миллиона зародышей, добавленных на грамм общей массы состава до менее чем 100 в случае аэробных бактерий, до менее чем 10 в случае энтеробактерий и менее чем 1 в случае Pseudomonas aeruginosa или Staphilococcus aureus, после периода в 4 дня, и устройство для введения указанного состава.
64. Набор по п.63, отличающийся тем, что состав содержится в бутылке или в любом другом упаковочном сосуде.
65. Набор по п.63, отличающийся тем, что устройство для введения состава представляет собой пластырь по любому из пп.27-62.
66. Набор по п.65, отличающийся тем, что устройство для введения состава содержит систему инъекции, предпочтительно шприц, который связан с резервуаром пластыря.
67. Набор по п.63, отличающийся тем, что устройство для введения состава содержит мерный пульверизатор, спендер, каток или губку.
68. Способ введения агента в тело млекопитающего или в растение, заключающийся в том, что вводимый агент объединяют с составом пенетрантов, включающим в себя суспендированные или диспергированные в полярной жидкости пенетранты, окруженные подобным мембране покрытием из одного или нескольких слоев, при этом покрытие содержит по крайней мере два амфифильных вещества с тенденцией к агрегации, отличающиеся коэффициентом растворимости, по крайней мере равном 10 в указанной полярной жидкости, по крайней мере один загуститель, взятый в таком количестве, чтобы повысить вязкость состава максимально до 5 кН с/м2, так что облегчается намазывание состава и удержание лекарственного средства на площади нанесения, и/или по крайней мере один антиоксидант, взятый в таком количестве, которое снижает увеличение индекса окисления до значения ниже 100% на период в 6 месяцев, и/или по крайней мере одно бактерицидное средство, взятое в количестве, которое снижает количество бактерий с 1 миллиона зародышей, добавленных на грамм общей массы состава до менее чем 100 в случае аэробных бактерий, до менее чем 10 в случае энтеробактерий и менее чем 1 в случае Pseudomonas aeruginosa или Staphilococcus aureus после периода в 4 дня, и наносят указанный состав на кожу, слизистую оболочку и/или эпидермис тела млекопитающего или растения.
69. Способ по п.68, отличающийся тем, что значение рН состава находится между 3 и 10, более предпочтительно между 4 и 9 и наиболее предпочтительно между 5 и 8.
70. Способ по п.68, отличающийся тем, что загуститель взят в таком количестве, чтобы повысить вязкость состава максимально до 1 кН·с/м2 и наиболее предпочтительно до 0,2 кН·с/м2, а антиоксидант взят в таком количестве, которое снижает увеличение индекса окисления до значения ниже 100% на период в 12 месяцев и более предпочтительно менее чем на 50% на период 12 месяцев.
71. Способ по п.68, отличающийся тем, что по крайней мере одно бактерицидное средство добавляют в таком количестве, которое понижает количество бактерий с 1 миллиона зародышей, добавленных на грамм общей массы состава до менее чем 100 в случае аэробных бактерий и менее чем 10 в случае энтеробактерий и менее чем 1 в случае Pseudomonas aeruginosa или Staphilococcus aureus после периода в 3 дня и более предпочтительно после периода в 1 день.
72. Способ по п.68, отличающийся тем, что указанный загуститель выбирают из класса фармацевтически приемлемых гидрофильных полимеров, таких как частично этерифицированные производные целлюлозы, как карбоксиметил-, гидроксиэтил-, гидроксипропил-, гидроксипропилметил- или метилцеллюлоза; полностью синтетических гидрофильных полимеров, таких как полиакрилаты, полиметакрилаты, поли(гидроксиэтил)-, поли(гидроксипропил)-, поли(гидроксипропилметил) метакрилаты, полиакрилонитрилы, металлилсульфонаты, полиэтилены, полиоксиэтилены, полиэтиленгликоли, полиэтиленгликольлактиды, полиэтиленгликольдиакрилаты, поливинилпирролидоны, поливиниловые спирты, поли(пропилметакриламиды), поли(пропиленфумарат -со-этиленгликоли), полоксамеры, полиаспартамиды, (поперечно-сшитый гидразин) гиалуроновые кислоты, силиконы; природные смолы, содержащие альгинаты, каррагенаны, гуаровые смолы, желатины, трагаканты, (амидированные) пектины, ксантаны, хитозановые коллагены, агарозы: смеси и другие производные или их сополимеры и/или другие фармацевтически или по крайней мере биологически приемлемые полимеры.
73. Способ по п.72, отличающийся тем, что концентрация указанного полимера находится в интервале между 0,01 и 10 мас.%, более предпочтительно в интервале между 0,1 и 5 мас.%, еще более предпочтительно в интервале между 0,25 и 3,5 мас.% и наиболее предпочтительно в интервале между 0,5 и 2 мас.%.
74. Способ по п.68, отличающийся тем, что указанный антиоксидант выбирают из синтетических фенольных антиоксидантов, таких как бутилированный гидроксианизол (ВНА), бутилированный гидрокситолуол (ВНТ) и ди-трет.-бутилфенол (LY178002, LY256548, HWA-131, BF-389, CI-986, PD-127443, E-5119, BI-L-239XX, и т.д.), третичный бутилгидрохинон (TBHQ), пропилгаллат (PG), 1-О-гексил-2,3,5-триметилгидрохинон (HTHQ); ароматические амины (такие как дифениламин, п-алкилтио-о-анизидин, производные этилендиамина, карбазол, тетрагидроинденоиндол); фенолы и феноловые кислоты (такие как гваякол, гидрохинон, ванилин, галловые кислоты и их сложные эфиры, протокатехутовые кислоты, хининовая кислота, сиреневая кислота, элаговая кислота, салициловая кислота, нордигидрогуаретовая кислота (NDGA), эвгенол); токоферолы (включая токоферолы (альфа, бэта, гамма, дельта) и их производные, такие как токоферилацелат (например, -ацетат, -лаурат, миристат, -пальмитат, -олеат, -линолеат, и т.д. или любые другие пригодные токоферил-липоаты), токоферил-РОЕ-сукцинаты; тролокс и соответствующие амид- и тиокарбоксамидные аналоги; аскорбиновая кислота и ее соли, изоаскорбаты (2 или 3 или 6)-о-алкиласкорбиновые кислоты, аскорбиловые эфиры (например, 6-о-лауроил, миристоил, пальмитоил-, олеоил или линолеоил-L-аскорбиновая кислота, и т.п.); нестероидные противовоспалительные агенты (NSAIDs), такие как индометацин, диклофенак, мефенамовая кислота, флуфенамовая кислота, фенилбутазон, оксифенбутазон ацетилсалициловая кислота, напроксен, дифлунизал, ибупрофен, кетопрофен, пироксикам, пеницилламин, пеницилламин дисульфид, примахин, хинакрин, хлорохин, гидроксихлорохин, азатиоприн, фенобарбитал, адетаминефен); аминосалициловые кислоты и производные; метабисульфит натрия, тиомочевина; хелатирующие агенты, такие как EDTA, GDTA, десферрал; глюкоза, убихинол-10; ферментные антиоксиданты, такие как супероксидная дисмутаза и металлические комплексы с аналогичной активностью, включая каталазу, глутатион пероксидазу, и менее комплексные молекулы, такие как бэта-каратин, билирубин. мочевую кислоту; флавоноиды (например, флавоны, флавонолы, флавононы, флаваноналы, хаконы, антоцианин), N-ацетилцистеин, мезна, глутатион, производные тиогистидина, триазолы; таннины, коричная кислота, гидроксикоричные кислоты и их сложные эфиры (например, кумариновые кислоты и сложные эфиры, кофеиновая кислота ее сложные эфиры, феруловая кислота, (изо-) хоргениновая кислота, синапиновая кислота); экстракты из специй (например, из чеснока, корицы, шалфея, розмарина, муската, орегано, гвоздики, мускатного ореха); карносовая кислота, карносол, карсолевая кислота; розмариновая кислота, розмариндифенол, гентизиновая кислота, феруловая кислота; экстракты из овсяной крупы, такие как авенантрамид 1 и 2; тиоэфиры, дитиоэфиры, сульфоксиды, тетраалкилтиурамдисульфиды; фитиновая кислота, стероидные производные (например, U74006F); метаболиты триптофана (например, 3-гидроксикинуренин, 3-гидроксиантраниловая кислота) и органохалкогениды или тому подобное представляющие собой фермент, подавляющий окисление.
75. Способ по п.74, отличающийся тем, что концентрация ВНА или ВНТ находится между 0,001 и 2 мас.%, более предпочтительно находится между 0,0025 и 0,2 мас.% и наиболее предпочтительно находится между 0,005 и 0,02 мас.%, концентрация TBHQ и PG находится между 0,001 и 2 мас.%, более предпочтительно находится между 0,005 и 0,2 мас.% и наиболее предпочтительно находится между 0,01 и 0,02 мас.%, концентрация токоферолов находится между 0,005 и 5 мас.%, более предпочтительно находится между 0,01 и 0,5 мас.% и наиболее предпочтительно находится между 0,05 и 0,075 мас.%, концентрация эфиров аскорбиновой кислоты находится между 0,001 и 5, более предпочтительно находится между 0,005 и 0,5 и наиболее предпочтительно находится между 0,01 и 0,15 мас.%, аскорбиновой кислоты находится между 0,001 и 5, более предпочтительно находится между 0,005 и 0,5 мас.% и наиболее предпочтительно находится между 0,01 и 0,1 мас.%, концентрация бисульфита натрия и метабисульфита натрия находится между 0,001 и 5, более предпочтительно находится между 0,005 и 0,5 мас.% и наиболее предпочтительно находится между 0,01-0,15 мас.%, концентрация тиомочевины находится между 0,0001 и 2 мас.%, более предпочтительно находится между 0,0005 и 0,2 и наиболее предпочтительно находится между 0,001-0,01 мас.%, наиболее часто 0,005 мас.%, концентрация цистеина находится между 0,01 и 5, более предпочтительно находится между 0,05 и 2 мас.% и наиболее предпочтительно находится между 0,1 и 1,0 мас.%, наиболее часто 0,5 мас.%, концентрация монотиоглицерина находится между 0,01 и 5 мас.%, более предпочтительно находится между 0,05 и 2 мас.% и наиболее предпочтительно находится между 0,1-1,0 мас.%, наиболее часто 0,5 мас.%, концентрация NDGA находится между 0,0005-2 мас.% более предпочтительно находится между 0,001- 0,2 мас.% и наиболее предпочтительно находится между 0,005-0,02 мас.%, наиболее часто 0,01 мас.%, концентрация глутатиона находится между 0,005 и 5 мас.%, более предпочтительно находится между 0,01 и 0,5 мас.% и наиболее предпочтительно находится между 0,05 и 0,2 мас.%, наиболее часто 0,1 мас.%, концентрация EDTA находится между 0,001 и 5 мас.%, даже более предпочтительно находится между 0,005 и 0,5 мас.%, и наиболее предпочтительно находится между 0,01 и 0,2 мас.%, наиболее часто между 0,05 и 0,975 мас.%, концентрация лимонной кислоты находится между 0,001 и 5 мас.%, даже более предпочтительно находится между 0,005 и 3 мас.% и наиболее предпочтительно находится между 0,01-0,2, наиболее часто между 0,3 и 2 мас.%.
76. Способ по п.68, отличающийся тем, что указанное бактерицидное средство выбирают из спиртов с короткой цепью, таких как этиловый и изопропиловый спирт, хлорбутанол, бензиловый спирт, хлорбензиловый спирт, дихлорбензиловый спирт; гексахлорофен; из фенольных соединений, таких как крезол, 4-хлор-м-крезол, п-хлор-м-ксиленол, дихлорофен, гексахлорофен, повидон-иодид; из парабенов, особенно алкилпарабенов, таких как метил-, этил, пропил-, бутилпарабен, бензилпарабен; из кислот, таких как сорбиновая кислота, бензойная кислота и их солей; из четвертичных аммонийных соединений, таких как алкониевые соли, например бензалкониевая соль, в особенности хлориды или бромиды, цетримониевые соли, например бромиды; феноалкециниевая соль, такая как фенододециний бромид, цетилпиридиний хлорид или другие такие соли; из соединений ртути, таких как фенилацетат ртути, борат или нитрат тиомерсал; хлоргексидин или его глюконат; из активных соединений антибиотиков биологического происхождения или их смесей.
77. Способ по п.76, отличающийся тем, что объемная концентрация спиртов с короткими цепями в случае этилового, пропилового, бутилового или бензилового спирта составляет вплоть до 10 мас.%, более предпочтительно вплоть до 5 мас.% и наиболее предпочтительно находится в интервале между 0,5-3 мас.%, и в случае хлорбутанола находится в интервале между 0,3-0,6 мас.%; объемная концентрация парабенов, особенно в случае метилпарабена, находится в интервале между 0,05-0,2 мас.%; и в случае пропилпарабена находится в интервале между 0,002-0,02 мас.%; объемная концентрация сорбиновой кислоты находится в интервале между 0,05-0,2 мас.%, и в случае бензойной кислоты находится в интервале между 0,1-0,5 мас.%; объемная концентрация фенолов, триклозана находится в интервале между 0,1-0,3 мас.% и объемная концентрация хлоргексидина находится в интервале между 0,01-0,05 мас.%.
78. Способ по п.68, отличающийся тем, что менее растворимое среди агрегирующих веществ представляет собой липид или подобный липиду материал, в особенности полярный липид, в то время как вещество, которое более растворимо в суспендирующей жидкости и которое снижает среднее значение энергии упругости капельки, представляет собой поверхностно-активное вещество или другое вещество, обладающее свойствами, подобными поверхностно-активным, и/или представляет собой форму указанного липида или подобного липиду материала, который относительно растворим, как и указанное поверхностно-активное вещество или материал, подобный поверхностно-активному веществу.
79. Способ по п.78, отличающийся тем, что липид или липидоподобный материал представляет собой липид или липоид, источником которого является биологический материал, или соответствующий синтетический липид, или любые его модификации, предпочтительно указанный липид является принадлежащим к классу фосфолипидов, соответствующих общей формуле
где R1 и R2 представляют собой алифатическую цепь, обычно С10-20-ацил, или -алкил или частично ненасыщенный остаток жирной кислоты, в особенности, олеоил-, пальмитолеоил-, элаидоил-, линолеил-, линоленил-, линоленоил-, арахидоил-, вассинил-, лауроил-, миристоил-, пальмитоил- или стеароиловую цепь; и где R3 представляет собой водород, 2-триметиламино-1-этил, 2-амино-1-этил, С1-4-алкил, C1-5-алкил, замещенный карбоксигруппой, C2-5-алкил, замещенный гидрокси, С2-5-алкил, замещенный карбокси и гидроксигруппой или С2-5-алкил, замещенный карбокси и аминогруппой, инозитол, сфингозин или соли указанных соединений, указанные липиды, содержащие также глицериды, изопреноидные липиды, стероиды, стерины или стеролы, сульфо- или углеводородсодержащие липиды или любые другие образующие два слоя липиды, в частности, наполовину протонированные жидкие жирные кислоты, при этом указанный липид выбирают из группы, включающей фосфатидилхолины, фосфатидилэтаноламины, фосфатидилглицерины, фосфатидилинозитолы, фосфатидиловые кислоты, фосфатидилсерины, сфингомиелины или другие сфингофосфолипиды, гликосфинголипиды (включая цереброзиды, керамидполигексозиды, сульфатиды, сфингоплазмалогены), ганглиозиды и другие гликолипиды или синтетические липиды, в частности с соответствующими сфингозиновыми производными, или любые другие гликолипиды, при этом две одинаковые или различные цепи могут быть присоединены через сложные эфирные группы к скелету (как диацильное пли диалкеноильное соединения или они могут быть присоединены к скелету с помощью простых эфирных связей, как диалкил-липиды.
80. Способ по п.78, отличающийся тем, что поверхностно-активное вещество или поверхностно-активный материал представляет собой неионное, цвиттерионное, анионное или катионное поверхностно-активное вещество, особенно такая, как жирная кислота или спирт, алкил-три/ди/метиламмонийная соль, алкилсульфатная соль, моновалентная соль холата, деоксихолат, гликохолат, гликодеоксихолат, тауродеоксихолат, таурохолат, и т.д., ацил- или алканоилдиметиламиноксид, особенно додецилдиметиламиноксид, алкил- или алканоил-N-метилглюкамид, N-алкил-N,N-диметилглицин, 3-(ацилдиметиламмоний)-алкансульфонат, N-ацилсульфобетаин, полиэтиленгликольоктилфениловый простой эфир, особенно нонаэтиленгликольоктилфениловый эфир, полиэтиленацильный эфир, в особенности нонаэтилендодециловый эфир, полиэтиленгликольизоациловый эфир, особенно октаэтиленгликольизотридециловый эфир, полиэтиленациловый эфир, особенно октаэтилендодециловый эфир, полиэтиленгликольсорбитанациловый эфир, такой как полиэтиленгликоль-20-монолаурат (Tween 20) или полиэтиленгликоль-20-сорбитанмоноолеат (Tween 80), полигидроксиэтиленациловый эфир, особенно полигидроксиэтиленлаурил, -миристоил, -цетилстеарил или -олеоиловый простой эфир, как полигидроксиэтилен-4, или 6, или 8, или 10 или 12 и т.д.; -лауриловый простой эфир (в Brij сериях) или в соответствующих сложных эфирах, например полигидроксиэтилен-8-стеарат (Myrj 45), -лауратного или олеатного типа или в полиэтоксилированном касторовом масле 40, сорбитанмоноалкилат( например, в Arlacel или Span), в особенности сорбитанмонолаурат, ацил- или алканоил-N-метилглюкамиде, особенно в или деканоил- или додеканоил-N-метилглюкамиде, алкилсульфат (соль), например в лаурил- или олеоилсульфате, деоксихолате натрия, гликодеоксихолате натрия, олеате натрия, таурате натрия, соль жирной кислоты, такая как элаидат натрия, линолеат натрия, лаурат натрия, лизофосфолипид, такой как н-октадецилен(=олеоил)-глицерофосфатидиновая кислота, -фосфорилглицерин или -фосфорилсерин, н-ацил-, например, лаурил- или олеоилглицерофосфатидиновая кислота, -фосфорилглицерин или -фосфорилсерин, н-тетрадецилглицерофосфатидная кислота, -фосфорилглицерин или -фосфорилсерин, соответствующий пальмитоелоил-, елаидоил-, вассениллизофосфолипид или соответствующий фосфолипид с короткой цепью или другой поверхностно-активный полипептид.
81. Способ по п.68, отличающийся тем, что средний диаметр пенетранта находится между 30 и 500 нм, более предпочтительно между 40 и 250 нм, даже более предпочтительно между 50 и 200 нм и особенно предпочтительно между 60 и 150 нм.
82. Способ по п.68, отличающийся тем, что общая сухая масса капелек в составе находится в интервале от 0,01 до 40 мас.% от общей сухой массы состава, более предпочтительно она находится между 0,1 и 30 мас.% и наиболее предпочтительно находится между 0,5 и 20 мас.%.
83. Способ по п.68, отличающийся тем, что по крайней мере одно амфифильное соединение и/или по крайней мере одно крайне-активное соединение и поверхностно-активное соединение и/или по крайней мере одну гидрофильную жидкость и агент смешивают, если требуется отдельно, с образованием раствора, полученные частичные смеси или растворы затем последовательно объединяют для того, чтобы вызвать предпочтительно путем воздействия механической энергии, такой как встряхивание, перемешивание, вибрация, гомогенизация, воздействие ультразвуком, сдвиг, замораживание и распарка или фильтрование с использованием приемлемого направленного давления, образование пенетрантов, которые ассоциируются с и/или включают агент.
84. Способ по п.83, отличающийся тем, что указанные амфифильные вещества растворяют в летучих растворителях, таких как спирты, особенно этанол, или в других фармацевтически приемлемых органических растворителях, таких как этанол, 1- и 2-пропанол, бензиловый спирт, пропиленгликоль, полиэтиленгликоль или глицерин, другие фармацевтически приемлемые органические растворители, такие как переохлаждающий газ, в особенности суперкритический газ СО2, которые затем удаляют, особенно упариванием или разбавлением, перед проведением последней стадии.
85. Способ по п.68, отличающийся тем, что указанные агенты и пенетранты готовят для связывания, по крайней мере частично, после образования указанных пенетрантов, например после впрыскивания раствора лекарственного препарата в фармацевтически приемлемой жидкости, такой как этанол, 1- и 2-пропанол, бензиловый спирт, пропилен гликоль, полиэтиленгликоль) или глицерин, в суспендирующую среду одновременно с образованием пенетранта, возможно с использованием сорастворения лекарственного препарата с по крайней мере несколькими пенегрантными ингредиентами.
86. Способ по п.68, отличающийся тем, что пенетранты, с которыми связывается агент, готовят непосредственно перед применением состава из пригодного концетранта или лиофилизата.
87. Способ по п.68, отличающийся тем, что состав наносят путем распыления, намазывания, накатывания или натирания на площадь поверхности нанесения, в частности, используя дозированный пульверизатор, спендер, валик, или губку, или негерметичный пластырь.
88. Способ по п.68, отличающийся тем, что барьером является часть тела животного или человека, предпочтительно кожа или по крайней мере частично кератинизированный эндотелий и/или назальная или любая другая слизистая оболочка.
89. Способ по п.68, отличающийся тем, что доза, наносимая на площадь поверхности находится между 0,1 и 40 мг см-2, более предпочтительно находится между 0,25 и 30 мг см-2 и более предпочтительно находится между 0,5 и 15 мг см-2 в случае, если пенетрант наносят на кожу или по крайней мере на частично кератинизированный эндотелий.
90. Способ по п.68, отличающийся тем, что доза, наносимая на площадь поверхности, находится между 0,05 и 20 мг см-2, более предпочтительно находится между 0,1 и 15 мг см-2 и наиболее предпочтительно находится между 0,5 и 10 мг см-2, в случае, если пенетрант наносят на назальную или другую слизистую оболочку.
91. Способ по п.68, отличающийся тем, что доза, наносимая на площадь поверхности, находится между 0,0001 и 0,1 мг см-2, более предпочтительно находится между 0,0005 и 0,05 мг см-2 и наиболее предпочтительно находится между 0,001 и 0,01 мг см-2, в случае, если пенетрант наносят на тело растения, листья растения или иглы растения.
92. Способ по п.68, отличающийся тем, что его используют для вызова иммунного ответа у человека или других млекопитающих путем вакцинации указанных млекопитающих.
93. Способ по п.68, отличающийся тем, что его используют для вызова терапевтического воздействия у человека или других млекопитающих.
|