(54) МОНОНАТРИЕВАЯ СОЛЬ 5-[[(2,3-ДИФТОРФЕНИЛ)МЕТИЛ]ТИО]-7-[[2-ГИДРОКСИ-1-(ГИДРОКСИМЕТИЛ)-1-МЕТИЛЭТИЛ]-АМИНО]-ТИАЗОЛО[4,5-d]ПИРИМИДИН-2(3Н)-ОНА В КАЧЕСТВЕ МОДУЛЯТОРА АКТИВНОСТИ ХЕМОКИНОВЫХ РЕЦЕПТОРОВ, ЕЕ ПРИМЕНЕНИЕ И ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ
(57) Реферат:
Изобретение относится к мононатриевой соли 5-[[(2,3-дифторфенил)метил]тио]-7-[[2-гидрокси-1-(гидроксиметил)-1-метилэтил]амино]-тиазоло[4,5-d]пиримидин-2(3H)-она в качестве модулятора активности хемокиновых рецепторов, способу его получения и фармацевтической композиции на его основе, а также к его применению для производства лекарственного средства. Соединения могут найти применение для лечения заболеваний, опосредованных хемокиновыми рецепторами, таких как астма, аллергический ринит, ХОЗЛ (хроническое обструктивное заболевание легких), воспалительная болезнь кишечника, остеоартрит, ревматоидный артрит. 5 н. и 5 з.п. ф-лы.
Настоящее изобретение относится к тиазолопиримидиноновому соединению, способам и промежуточным соединениям, используемым для его получения, фармацевтическим композициям, содержащим его, и к его применению в терапии.
Хемокины играют важную роль в иммунных и воспалительных ответах при различных заболеваниях и расстройствах, в том числе при астме и аллергических заболеваниях, а также аутоиммунных патологиях, таких как ревматоидный артрит и атеросклероз. Эти небольшие секретируемые молекулы представляют собой растущее суперсемейство белков с молекулярной массой 8-14 кДа, характеризующихся консервативным мотивом из четырех цистеиновых остатков. В настоящее время суперсемейство хемокинов включает три группы, демонстрирующие характерные структурные мотивы, а именно семейства Cys-X-Cys (C-X-C), Cys-Cys (С-С) и Cys-Х3-Cys (С-Х3-С). Семейства C-X-C и С-С имеют сходные последовательности и отличаются друг от друга вставкой одной аминокислоты между NH-проксимальной парой цистеиновых остатков. Семейство С-Х3-С отличается от других двух семейств тем, что содержит вставку из трех аминокислот между NH-проксимальной парой цистеиновых остатков.
Хемокины C-X-C включают некоторые мощные хемоаттрактанты и активаторы нейтрофилов, такие как интерлейкин-8 (IL-8) и нейтрофил-активирующий пептид 2 (NAP-2).
Хемокины С-С включают мощные хемоаттрактанты моноцитов и лимфоцитов, но не нейтрофилов. Примеры включают человеческие моноцитарные хемотаксические белки 1-3 (МСР-1, МСР-2 и МСР-3), RANTES (Regulated on Activation, Normal T Expressed and Secreted; регулируемый при активации, нормально экспрессируемый и секретируемый Т-клетками), эотаксин и макрофагальные воспалительные белки 1 и 1 и 1 (MIP-1 (MIP-1 и MIP-1 и MIP-1 ). ).
Хемокин С-Х3-С (также известный как фракталкин) является мощным хемоаттрактантом и активатором микроглии в центральной нервной системе (ЦНС), а также моноцитов, Т-клеток, NK-клеток и тучных клеток.
Исследования продемонстрировали, что действия хемокинов опосредованы подсемействами сопряженных с G-белком рецепторов, в числе которых находятся рецепторы, обозначаемые как CCR1, CCR2, CCR2A, CCR2B, CCR3, CCR4, CCR5, CCR6, CCR7, CCR8, CCR9, CCR10 и CCR11 (для семейства С-С); CXCR1, CXCR2, CXCR3, CXCR4 и CXCR5 (для семейства С-Х-С) и СХ3СR1 для семейства С-Х3-С. Эти рецепторы представляют собой подходящие мишени для разработки лекарственных средств, так как агенты, которые модулируют эти рецепторы, могут быть полезными в лечении расстройств и заболеваний, таких как заболевания, упомянутые выше.
В WO-01/25242 раскрыт ряд тиазолопиримидиноновых соединений, полезных в качестве антагонистов CXCR2. В настоящее время неожиданно обнаружено, что соединение, лежащее в пределах объема WO-01/25242, но конкретно не раскрытое там, имеет улучшенный фармакологический профиль по сравнению с наиболее сходными по структуре соединениями из WO-01/25242, то есть Примерами 4 и 7.
Следовательно, согласно настоящему изобретению предложено соединение формулы (I) и его фармацевтически приемлемые соли, или их сольваты:
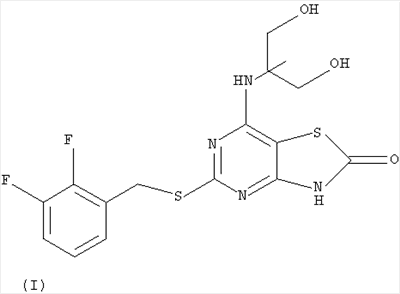
Соединение формулы (I) способно к существованию в таутомерной форме. Таутомеры и их смеси также являются аспектом настоящего изобретения.
Согласно изобретению также предложен способ получения соединения (I), который включает взаимодействие соединения формулы (II):
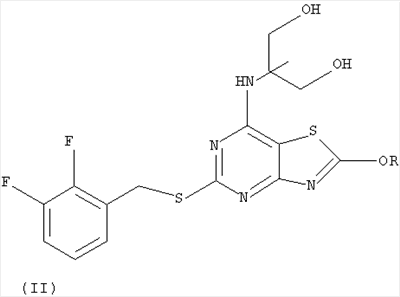
где R представляет собой C1-6алкил, с кислотой
и возможное после этого образование фармацевтически приемлемой соли.
Предпочтительно R представляет собой этил или метил, более предпочтительно метил. Предпочтительно реакцию проводят с использованием диоксана и HCl. Предпочтительно соединения по изобретению получают согласно методикам, приведенным в данном описании в качестве примеров.
Соединение формулы (II) может быть получено из соответствующего соединения формулы (III):
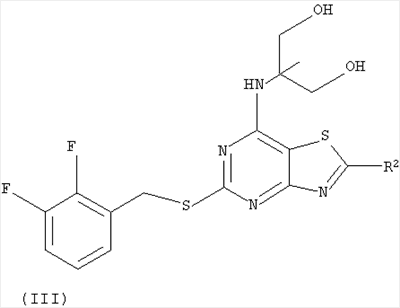
где R2 представляет собой галоген, путем обработки соединением ROH в присутствии основания. Предпочтительно соединение формулы (III) обрабатывают метилатом натрия. Предпочтительно R2 представляет собой хлоро.
Соединения формулы (III) могут быть получены с использованием представленной ниже последовательности:
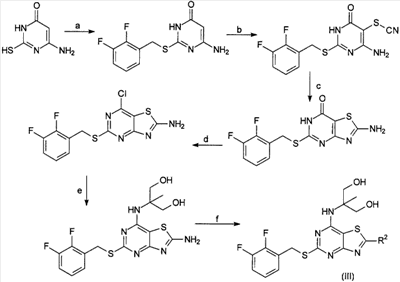
Подходящие реагенты для стадий a-f известны специалистам в данной области техники. Предпочтительно стадии a-f осуществляют так, как приведено в данном описании в качестве примеров.
Полагают, что само соединение формулы (II) является новым и образует дополнительный аспект изобретения.
Специалисты в данной области техники должны будут принять во внимание, что в способах по настоящему изобретению некоторые функциональные группы, такие как гидроксильные или аминогруппы в исходных реагентах или промежуточном соединении, могут нуждаться в защите посредством защитных групп. Таким образом, получение соединения формулы (I) может включать на соответствующей стадии удаление одной или более чем одной защитной группы. Полное описание постановки и снятия защиты с функциональных групп приведено в "Protective Groups in Organic Chemistry", edited by J. W. F. McOmie, Plenum Press (1973) и "Protective Groups in Organic Synthesis", 2nd edition, T.W. Greene & P.G.M. Wuts, Wiley-lnterscience (1991).
Упомянутое выше соединение формулы (I) может быть превращено в свою фармацевтически приемлемую соль, или их сольват, предпочтительно в полученную присоединением основания соль, такую как соль натрия, калия, кальция, алюминия, лития, магния, цинка, бензатина, хлорпрокаина, холина, диэтаноламина, этаноламина, этилдиамина, меглумина, трометамина или прокаина, либо в полученную присоединением кислоты соль, такую как гидрохлорид, гидробромид, фосфат, ацетат, фумарат, малеат, тартрат, цитрат, оксалат, метансульфонат или п-толуолсульфонат.
Соединение формулы (I) обладает активностью как фармацевтическое средство, в частности как модулятор активности хемокиновых рецепторов (в особенности CXCR2), и может быть использовано в лечении (терапевтическом или профилактическом) состояний/заболеваний у человека и животных, причиной обострения или возникновения которых является повышенная или нерегулируемая продукция хемокинов. Примеры таких состояний/заболеваний включают (состояния/заболевания):
(1) (дыхательных путей) обструктивные заболевания дыхательных путей, включая хроническое обструктивное заболевание легких (ХОЗЛ); астму, такую как бронхиальная, аллергическая, наследственная, приобретенная бронхиальная астма и пылевая астма, особенно хроническая или запущенная астма (например, поздняя астма и гиперчувствительность дыхательных путей); бронхит; острый, аллергический, атрофический ринит и хронический ринит, в том числе казеозный ринит, гипертрофический ринит, гнойный ринит, сухой ринит и медикаментозный ринит; пленчатый ринит, в том числе крупозный, фибринозный и псевдопленчатый ринит и скрофулезный ринит; сезонный ринит, в том числе нервный ринит (поллиноз) и вазомоторный ринит; саркоидоз, "легкое фермера" и родственные заболевания, пневмофиброз и идиопатическую интерстициальную пневмонию;
(2) (костей и суставов) ревматоидный артрит, серонегативные спондилоартропатии (такие как анкилозирующий спондилит, псориатический артрит и болезнь Рейтера), болезнь Бехчета, синдром Шегрена и системный склероз;
(3) (кожи) псориаз, атопический дерматит, контактный дерматит и другие экзематозные дерматиты, себорейный дерматит, красный плоский лишай, пузырчатку, буллезную пузырчатку, буллезный эпидермолиз, крапивницу, ангионевротические отеки, васкулиты, эритемы, кожные эозинофилии, увеит, гнездную алопецию и весенний конъюнктивит;
(4) (желудочно-кишечного тракта) целиакию, проктит, эозинофильный гастроэнтерит, мастоцитоз, болезнь Крона, неспецифический язвенный колит, неопределенный колит, микроскопический колит, воспалительную болезнь кишечника, синдром раздраженной кишки, невоспалительную диарею, пищевые аллергии, которые проявляются в удалении от кишечника, например, такие как мигрень, ринит и экзема;
(5) (центральной и периферической нервной системы) нейродегенеративные заболевания и приводящие к слабоумию расстройства, например болезнь Альцгеймера, амиотрофический боковой склероз и другие заболевания двигательных нейронов, болезнь Крейтцфельда-Якоба и другие прионные заболевания, ВИЧ-энцефалопатию (комплекс СПИД-деменция), болезнь Гентингтона, лобно-височную деменцию, деменцию с тельцами Леви и сосудистую деменцию; полиневропатии, например синдром Гийена-Барре, хроническую воспалительную демиелинизирующую полирадикулоневропатию, многоочаговую двигательную невропатию, плексопатии; демиелинизацию ЦНС, например рассеянный склероз, острый рассеянный/геморрагический энцефаломиелит и подострый склерозирующий панэнцефалит; нервно-мышечные расстройства, например миастению тяжелую и синдром Ламберта-Итона; спинномозговые нарушения, например тропический спастический парапарез и синдром мышечной скованности (stiff-man syndrome); паранеопластические синдромы, например церебральную дегенерацию и энцефаломиелит; травму ЦНС; мигрень; и удар;
(6) (других тканей и системное заболевание) атеросклероз, синдром приобретенного иммунодефицита (СПИД), красную волчанку, системную красную волчанку, тиреоидит Хашимото, диабет I типа, нефротический синдром, эозинофильный фасциит, гипер-IgE-синдром, лепроматозную проказу и идиопатическую тромбоцитопеническую пурпуру; послеоперационные спайки и сепсис;
(7) удар, субарахноидальное кровоизлияние, реперфузионное повреждение сердца, мозга, конечностей и других периферических органов;
(8) (отторжение трансплантатов) острое или хроническое, после, например, трансплантации почки, сердца, печени, легкого, костного мозга, кожи и роговицы; и хроническая болезнь "трансплантат против хозяина";
(9) раки, в особенности немелкоклеточный рак легкого (НМРЛ), злокачественную меланому, рак предстательной железы и сквамозный рак, и опухолевый метастаз;
(10) заболевания, при которых ангиогенез связан с повышенными хемокиновыми уровнями CXCR2 (например, НМРЛ, диабетическая ретинопатия);
(11) муковисцидоз;
(12) ожоговые раны и хронические кожные язвы;
(13) заболевания репродуктивной системы (например, расстройства овуляции, менструации и имплантации, преждевременные роды, эндометриоз).
Таким образом, в настоящем изобретении предложено соединение формулы (I), или его фармацевтически приемлемая соль, или их сольват, как они определены в данном описании выше, для использования в терапии.
Предпочтительно соединение по изобретению используют для лечения заболеваний, при которых хемокиновый рецептор принадлежит подсемейству хемокиновых рецепторов СХС, более предпочтительно хемокиновым рецептором-мишенью является рецептор CXCR2.
Особыми состояниями, которые могут быть подвергнуты лечению соединением по изобретению, являются ревматоидный артрит, заболевания, ангиогенез при которых связан с повышенными хемокиновыми уровнями CXCR2 и ХО3Л. Предпочтительно использование соединения по изобретению для лечения ревматоидного артрита и респираторного заболевания.
В качестве следующего аспекта настоящего изобретения соединение формулы (I) может находить применение как антагонист рецептора CX3CR1. Ожидается, что такое соединение будет особенно полезно в лечении расстройств центральной и периферической нервной системы и других состояний, характеризующихся активацией микроглии и/или инфильтрацией лейкоцитов (например, удар/ишемия и травма головы). В следующем аспекте согласно настоящему изобретению предложено применение соединения формулы (I), или его фармацевтически приемлемой соли, или их сольвата, как они определены в данном описании ранее, в производстве лекарственного средства для применения в терапии.
В еще одном аспекте согласно настоящему изобретению предложено применение соединения формулы (I), или его фармацевтически приемлемой соли, или их сольвата, как они определены в данном описании ранее, в производстве лекарственного средства для лечения заболеваний или состояний у людей, при которых модуляция активности хемокиновых рецепторов оказывает благотворное влияние.
В контексте настоящего описания, при условии отсутствия особых указаний на обратное, термин "терапия" также включает "профилактику". Термины "терапевтический" и "терапевтически" следует истолковывать соответственно.
Далее согласно изобретению предложен способ лечения хемокин-опосредованного заболевания, при котором хемокин связывается с хемокиновым рецептором (в частности, CXCR2), включающий введение пациенту терапевтически эффективного количества соединения формулы (I), или его фармацевтически приемлемой соли, или их сольвата, как они определены в данном описании ранее.
Согласно изобретению также предложен способ лечения воспалительного заболевания, в частности ревматоидного артрита, ХОЗЛ, респираторного заболевания или псориаза, у пациента, страдающего от указанного заболевания или с риском его развития, который включает введение пациенту терапевтически эффективного количества соединения формулы (I), или его фармацевтически приемлемой соли, или их сольвата, как они определены в данном описании ранее.
Для вышеупомянутых терапевтических применений вводимая дозировка будет, несомненно, изменяться в зависимости от используемого соединения, способа введения, требующегося лечения и выявленного расстройства.
Соединение формулы (I) и его фармацевтически приемлемые соли и их сольваты могут быть использованы как таковые, но в общем случае будут введены в форме фармацевтической композиции, в которой соединение/соль/сольват (активный ингредиент) формулы (I) находится в ассоциации с фармацевтически приемлемым адъювантом, разбавителем или носителем. В зависимости от способа введения фармацевтическая композиция будет предпочтительно содержать от 0,05 до 99 мас.% (массовых процентов), более предпочтительно от 0,05 до 80 мас.%, еще более предпочтительно от 0,10 до 70 мас.% и даже еще более предпочтительно от 0,10 до 50 мас.% активного ингредиента, где массовые проценты даны в расчете на общую массу композиции.
Согласно настоящему изобретению также предложена фармацевтическая композиция, содержащая соединение формулы (I), или его фармацевтически приемлемую соль, или их сольват, как они определены в данном описании ранее, в ассоциации с фармацевтически приемлемым адъювантом, разбавителем или носителем.
Кроме того, согласно настоящему изобретению предложен способ приготовления фармацевтической композиции по изобретению, который включает смешивание соединения формулы (I), или его фармацевтически приемлемой соли, или их сольвата, как они определены в данном описании ранее, с фармацевтически приемлемым адъювантом, разбавителем или носителем.
Фармацевтические композиции могут быть введены местно (например, в легкое и/или в дыхательные пути, или на кожу) в форме растворов, суспензий, гептафторалкановых аэрозолей и сухих порошковых препаратов; или системно, например, путем перорального введения в форме таблеток, капсул, сиропов, порошков или гранул, либо парентерального введения в форме растворов или суспензий, либо подкожного введения, либо ректального введения в форме суппозиториев, либо трансдермально. Соединение по изобретению предпочтительно вводят перорально.
Кроме того, изобретение относится к комбинированным видам терапии, где соединение формулы (I), или его фармацевтически приемлемые соли, их сольват или гидролизуемый in vivo сложный эфир, либо фармацевтическую композицию или препарат, содержащие соединение формулы (I), вводят одновременно или последовательно с терапией и/или агентом для лечения любого из следующих заболеваний: астма, аллергический ринит, рак, ХО3Л, ревматоидный артрит, псориаз, воспалительное заболевание кишечника, синдром раздраженной кишки, остеоартрит или остеопороз.
В особенности, для лечения воспалительных заболеваний, ревматоидного артрита, псориаза, воспалительного заболевания кишечника, синдрома раздраженной кишки, ХОЗЛ, астмы и аллергического ринита соединения по изобретению можно комбинировать с такими агентами, как ингибиторы TNF- , например анти- TNF-моноклональные антитела (такие как ремикад, CDP-870 и D2E7) и TNF-рецепторные иммуноглобулиновые молекулы (такие как Enbrel), неселективные ингибиторы СОХ-1/СОХ-2 (такие как пироксикам, диклофенак, пропионовые кислоты, как, например, напроксен, флубипрофен, фенопрофен, кетопрофен и ибупрофен, фенаматы, как, например, мефенамовая кислота, индометацин, сулиндак, апазон, пиразолоны, как, например, фенилбутазон, салицилаты, как, например, аспирин), ингибиторы СОХ-2 (такие как мелоксикам, целекоксиб, рофекоксиб, валдекоксиб и эторикоксиб), метотрексат в низкой дозе, лефуномид (lefunomide); циклезонид; гидроксихлороквин, d-пенициламин, ауранофин или парентерально либо перорально вводимое золото. Кроме того, при воспалительном заболевании кишечника и синдроме раздраженной кишки подходящие агенты включают сульфасалазин и препараты группы 5-АСА, стероиды местного и системного действия, иммуномодуляторы и иммунодепрессанты, антибиотики, пробиотики и антиинтегрины. , например анти- TNF-моноклональные антитела (такие как ремикад, CDP-870 и D2E7) и TNF-рецепторные иммуноглобулиновые молекулы (такие как Enbrel), неселективные ингибиторы СОХ-1/СОХ-2 (такие как пироксикам, диклофенак, пропионовые кислоты, как, например, напроксен, флубипрофен, фенопрофен, кетопрофен и ибупрофен, фенаматы, как, например, мефенамовая кислота, индометацин, сулиндак, апазон, пиразолоны, как, например, фенилбутазон, салицилаты, как, например, аспирин), ингибиторы СОХ-2 (такие как мелоксикам, целекоксиб, рофекоксиб, валдекоксиб и эторикоксиб), метотрексат в низкой дозе, лефуномид (lefunomide); циклезонид; гидроксихлороквин, d-пенициламин, ауранофин или парентерально либо перорально вводимое золото. Кроме того, при воспалительном заболевании кишечника и синдроме раздраженной кишки подходящие агенты включают сульфасалазин и препараты группы 5-АСА, стероиды местного и системного действия, иммуномодуляторы и иммунодепрессанты, антибиотики, пробиотики и антиинтегрины.
Кроме того, настоящее изобретение еще относится к комбинации соединения по изобретению с ингибитором биосинтеза лейкотриенов, ингибитором 5-липоксигеназы (5-LO) или антагонистом белка, активирующего 5-липоксигеназу (FLAP), таким как зилейтон; АВТ-761; фенлейтоном (fenleuton); тепоксалином; Abbott-79175; Abbott-85761; N-(5-замещенными)-тиофен-2-алкилсульфонамидами; 2,6-ди-трет-бутилфенол-гидразонами; метокситетрагидропиранами, такими как Zeneca ZD-2138; соединением SB-210661; пиридинил-замещенными 2-цианонафталиновыми соединениями, такими как L-739010; 2-цианохинолиновыми соединениями, такими как L-746530; индоловыми и хинолиновыми соединениями, такими как МК-591, МК-886 и BAY x 1005.
Кроме того, настоящее изобретение еще относится к комбинации соединения по изобретению с антагонистом рецепторов лейкотриенов LTB4, LTC4, LTD4 и LTE4, выбранным из группы, состоящей из фенотиазин-3-онов, таких как L-651392; амидиновыми соединениями, такими как CGS-25019c; бензоксаламинами, такими как онтазоласт; бензолкарбоксимидамидами, такими как BIIL 284/260; и такими соединениями, как зафирлукаст, аблукаст, монтелукаст, пранлукаст, верлукаст (МК-679), RG-12525, Ro-245913, иралукаст (CGP 45715A) и BAY×7195.
Кроме того, настоящее изобретение еще относится к комбинации соединения по изобретению с ингибитором PDE4, включая ингибиторы изоформы PDE4D.
Кроме того, настоящее изобретение еще относится к комбинации соединения по изобретению с антигистаминными антагонистами рецепторов H1, такими как цетиризин, лоратадин, дезлоратадин, фексофенадин, астемизол, азеластин и хлорфенирамин.
Кроме того, настоящее изобретение еще относится к комбинации соединения по изобретению с гастропротекторным антагонистом рецептора Н2.
Кроме того, настоящее изобретение еще относится к комбинации соединения по изобретению с сосудосуживающим симпатомиметическим агентом, являющимся  1- и 1- и  2-адреномиметиком, таким как пропилгекседрин, фенилэфрин, фенилпропаноламин, псевдоэфедрин, нафтазолина гидрохлорид, оксиметазолина гидрохлорид, тетрагидрозолина гидрохлорид, ксилометазолина гидрохлорид и этилнорэпинефрина гидрохлорид. 2-адреномиметиком, таким как пропилгекседрин, фенилэфрин, фенилпропаноламин, псевдоэфедрин, нафтазолина гидрохлорид, оксиметазолина гидрохлорид, тетрагидрозолина гидрохлорид, ксилометазолина гидрохлорид и этилнорэпинефрина гидрохлорид.
Кроме того, настоящее изобретение еще относится к комбинации соединения по изобретению с антихолинергическими агентами, такими как ипратропия бромид; тиотропия бромид; окситропия бромид; пирензепин; и телензепин.
Кроме того, настоящее изобретение еще относится к комбинации соединения по изобретению с от  1- 1- 4-адреномиметиками, такими как метапротеренол, изопротеренол, изопреналин, албутерол, салбутамол, формотерол, салметерол, тербуталин, орципреналин, битолтерола мезилат и пирбутерол; или метилксантанинами, включая теофиллин и аминофиллин; хромогликатом натрия; или антагонистом мускариновых рецепторов (М1, М2 и М3). 4-адреномиметиками, такими как метапротеренол, изопротеренол, изопреналин, албутерол, салбутамол, формотерол, салметерол, тербуталин, орципреналин, битолтерола мезилат и пирбутерол; или метилксантанинами, включая теофиллин и аминофиллин; хромогликатом натрия; или антагонистом мускариновых рецепторов (М1, М2 и М3).
Кроме того, настоящее изобретение еще относится к комбинации соединения по изобретению с миметиком инсулиноподобного фактора роста I типа (IGF-1).
Кроме того, настоящее изобретение еще относится к комбинации соединения по изобретению с вводимым ингаляцией глюкокортикоидом со сниженными системными побочными действиями, таким как преднизон, преднизолон, флунизолид, триамцинолона ацетонид, беклометазона дипропионат, будесонид, флутиказона пропионат и мометазона фуроат.
Кроме того, настоящее изобретение еще относится к комбинации соединения по изобретению с ингибитором матриксных металлопротеаз (MMPs), то есть стромелизинов, коллагеназ и желатиназ, а также агриканазы; в частности, коллагеназы-1 (ММР-1), коллагеназы-2 (ММР-8), коллагеназы-3 (ММР-13), стромелизина-1 (ММР-3), стромелизина-2 (ММР-10) и стромелизина-3 (ММР-11) и ММР-12.
Кроме того, настоящее изобретение еще относится к комбинации соединения по изобретению с другими модуляторами функционирования хемокиновых рецепторов, такими как CCR1, CCR2, CCR2A, CCR2B, CCR3, CCR4, CCR5, CCR6, CCR7, CCR8, CCR9, CCR10 и CCR11 (для семейства С-С); CXCR1, CXCR3, CXCR4 и CXCR5 (для семейства С-Х-С) и СХ3СR1 для семейства С-Х3-С.
Кроме того, настоящее изобретение еще относится к комбинации соединения по изобретению с противовирусными агентами, такими как вирасепт, АЗТ, ацикловир и фамцикловир, и антисептическими соединениями, такими как валант (valant).
Кроме того, настоящее изобретение еще относится к комбинации соединения по изобретению с сердечно-сосудистыми агентами, такими как блокаторы кальциевых каналов, агенты, снижающие содержание липидов, например статины, фибраты, бета-блокаторы, ингибиторы АСЕ (ангиотензин-превращающий фермент), антагонисты рецепторов ангиотензина-2 и ингибиторы агрегации тромбоцитов.
Кроме того, настоящее изобретение еще относится к комбинации соединения по изобретению с агентами ЦНС, такими как антидепрессанты (например, сертралин), лекарства против болезни Паркинсона (например, депренил, L-допа, реквип, мирапекс, ингибиторы МАОВ (моноамин-оксидаза В), такие как селегин и разагилин, ингибиторы СОМТ (катехол-о-метилтрансфераза), такие как тасмар, А-2 ингибиторы, ингибиторы обратного захвата дофамина, антагонисты NMDA (М-метил-D-аспартат), агонисты никотина, агонисты дофамина и ингибиторы нейронной синтазы оксида азота) и лекарства против болезни Альцгеймера, например донепезил, такрин, ингибиторы СОХ-2, пропентофиллин или метрифонат.
Кроме того, настоящее изобретение еще относится к комбинации соединения по изобретению с (1) ингибиторами триптазы; (2) антагонистами фактора активации тромбоцитов (PAF); (3) ингибиторами интерлейкин-превращающего фермента (ICE); (4) ингибиторами IMPDH (инозинмонофосфат-дегидрогеназа); (5) ингибиторами молекул адгезии, в том числе антагонистами VLA-4; (6) катепсинами; (7) ингибиторами МАР-киназ; (8) ингибиторами глюкозо-6-фосфат-дегидрогеназы; (9) антагонистами кининовых рецепторов B1 и В2; (10) средствами против подагры, например колхицином; (11) ингибиторами ксантиноксидазы, например аллопуринолом; (12) средствами, способствующими выделению мочевой кислоты, например пробенецидом, сульфинпиразоном и бензбромароном; (13) средствами, усиливающими секрецию гормона роста; (14) трансформирующим фактором роста (TGF ); (15) фактором роста тромбоцитов (PDGF); (16) фактором роста фибробластов, например основным фактором роста фибробластов (bFGF); (17) гранулоцитарно-макрофагальным колониестимулирующим фактором (GM-CSF); (18) капсаициновым кремом; (19) антагонистами рецепторов тахикинина NK1 и NK3, выбранными из группы, состоящей из NKP-608C; SB-233412 (талнетант); и D-4418; (20) ингибиторами эластазы, выбранными из группы, состоящей из UT-77 и ZD-0892; (21) ингибиторами TNF ); (15) фактором роста тромбоцитов (PDGF); (16) фактором роста фибробластов, например основным фактором роста фибробластов (bFGF); (17) гранулоцитарно-макрофагальным колониестимулирующим фактором (GM-CSF); (18) капсаициновым кремом; (19) антагонистами рецепторов тахикинина NK1 и NK3, выбранными из группы, состоящей из NKP-608C; SB-233412 (талнетант); и D-4418; (20) ингибиторами эластазы, выбранными из группы, состоящей из UT-77 и ZD-0892; (21) ингибиторами TNF -превращающего фермента (ТАСЕ); (22) ингибиторами индуцируемой синтазы оксида азота (iNOS) или (23) молекулой, гомологичной рецепторам хемоаттрактантов, экспрессируемой на поверхности Тh2-клеток (антагонистами CRTH2). -превращающего фермента (ТАСЕ); (22) ингибиторами индуцируемой синтазы оксида азота (iNOS) или (23) молекулой, гомологичной рецепторам хемоаттрактантов, экспрессируемой на поверхности Тh2-клеток (антагонистами CRTH2).
Соединения по настоящему изобретению также могут быть использованы в комбинации с противоостеопорозными агентами, такими как ралоксифен, дролоксифен, лазофоксифен или фосомакс, и иммунодепрессантами, такими как FK-506, рапамицин, циклоспорин, азатиоприн и метотрексат.
Соединения по изобретению также могут быть использованы в комбинации с существующими терапевтическими агентами для лечения остеоартрита. Подходящие агенты для использования в комбинации включают обычные нестероидные противовоспалительные агенты (здесь и далее NSAID), такие как пироксикам, диклофенак, пропионовые кислоты, как, например, напроксен, флубипрофен, фенопрофен, кетопрофен и ибупрофен, фенаматы, как, например, мефенамовая кислота, индометацин, сулиндак, апазон, пиразолоны, как, например, фенилбутазон, салицилаты, как, например, аспирин, ингибиторы СОХ-2, как, например, целекоксиб, валдекоксиб, рофекоксиб и эторикоксиб, аналгетики и внутрисуставные терапевтические средства, как, например, кортикостероиды и гиалуроновые кислоты, такие как гиалган и синвиск, и антагонисты рецепторов Р2Х7.
Соединения по изобретению также могут быть использованы в комбинации с существующими терапевтическими средствами для лечения рака. Подходящие средства для использования в комбинации включают:
(1) антипролиферативные/антинеопластические лекарственные средства и их комбинации, которые используются в медицинской онкологии, такие как алкилирующие агенты (например, цисплатин, карбоплатин, циклофосфамид, азотистый иприт, мелфалан, хлорамбуцил, бусульфан и нитрозомочевины); антиметаболиты (например, антифолаты, такие как фторпиримидины, подобные 5-фторурацилу и тегафуру, ралтитрексед, метотрексат, цитозинарабинозид, гидроксимочевина, гемцитабин и паклитаксел (TaxoI®)); противоопухолевые антибиотики (например, антрациклины, подобные адриамицину, блеомицину, доксорубицину, дауномицину, эпирубицину, идарубицину, митомицину-С, дактиномицину и митрамицину); антимитотические агенты (например, винка-алкалоиды, подобные винкристину, винбластину, виндезину и винорелбину, и таксоиды, подобные таксолу и таксотеру); и ингибиторы топоизомеразы (например, эпиподофиллотоксины, подобные этопозиду и тенипозиду, амсакрин, топотекан и камптотецин);
(2) цитостатические агенты, такие как антиэстрогены (например, тамоксифен, торемифен, ралоксифен, дролоксифен и иодоксифен), негативные регуляторы эстрогеновых рецепторов (например, фулвестрант), антиандрогены (например, бикалутамид, флутамид, нилутамид и ципротерона ацетат), антагонисты LHRH (релизинг-фактор лютеинизирующего гормона) или агонисты LHRH (например, госелерин, лейпрорелин и буселерин), прогестогены (например, мегестрола ацетат), ингибиторы ароматазы (например, как анастрозол, летрозол, воразол и эксеместан) и ингибиторы 5 -редуктазы, такие как финастерид; -редуктазы, такие как финастерид;
(3) агенты, ингибирующие инвазию раковых клеток (например, ингибиторы металлопротеиназы, подобные маримастату, и ингибиторы функционирования рецептора плазминогенного активатора урокиназы);
(4) ингибиторы функционирования факторов роста, например, такие ингибиторы включают антитела к факторам роста, антитела к рецепторам факторов роста (например, анти-еrbb2-антитело трастузумаб [HerceptinTM] и анти-еrbb2 -антитело цетуксимаб [С225]), ингибиторы фарнезилтрансферазы, ингибиторы тирозинкиназ и ингибиторы серин/треонинкиназ, например, ингибиторы семейства эпидермальных факторов роста (например, ингибиторы тирозинкиназ EGFR-семейства, такие как N-(3-хлор-4-фторфенил)-7-метокси-6-(3-морфолинопропокси)хиназолин-4-амин (гефитиниб, AZD1839), N-(3-этинилфенил)-6,7-бис(2-метоксиэтокси)хиназолин-4-амин (эрлотиниб, OSI-774) и 6-акриламидо-N-(3-хлор-4-фторфенил)-7-(3-морфолинопропокси)хиназолин-4-амин (CI 1033)), например ингибиторы семейства выделяемых тромбоцитами ростовых факторов и, например, ингибиторы семейства фактора роста гепатоцитов;
(5) противоангиогенные средства, такие как средства, ингибирующие эффекты фактора роста эндотелия сосудов (например, антитело против ростового фактора эндотелиальных клеток сосудов бевацизумаб [AvastinTM], соединения, такие как раскрытые в международных заявках на патент WO 97/22596, WO 97/30035, WO 97/32856 и WO 98/13354), и соединения, действующие по другим механизмам (например, линомид, ингибиторы функционирования интегринов  v v 3 и ангиостатин); 3 и ангиостатин);
(6) вызывающие повреждение сосудов агенты, такие как комбретастатин А4 и соединения, раскрытые в международных заявках на патент WO 99/02166, WO 00/40529, WO 00/41669, WO 01/92224, WO 02/04434 и WO 02/08213;
(7) виды антисмысловой терапии, например такие, которые направлены на мишени, приведенные выше, как например ISIS 2503, для анти-ras антисмысловой терапии;
(8) генотерапевтические подходы, включая, например, подходы по замене аберрантных генов, таких как аберрантный р53 или аберрантный BRCA1 либо BRCA2, подходы GDEPT (генотерапия на основе активации противоопухолевых препаратов генетическими конструкциями), такие как использующие цитозиндезаминазу, тимидинкиназу или бактериальный фермент нитроредуктазу, и подходы по усилению переносимости пациентами химиотерапии или лучевой терапии, как например генная терапия множественной лекарственной устойчивости; и
(9) иммунотерапевтические подходы, включая, например, ex-vivo и in-vivo подходы по повышению иммуногенности опухолевых клеток пациента, такие как трансфекция цитокинами, например интерлейкином-2, интерлейкином-4 или гранулоцитарно-макрофагальным колониестимулирующим фактором, подходы по снижению Т-клеточной анергии, подходы с использованием трансфецированных иммунных клеток, например цитокин-трансфецированных дендритных клеток, подходы с использованием цитокин-трансфецированных опухолевых клеточных линий и подходы с использованием антиидиотипических антител.
Теперь данное изобретение будет далее проиллюстрировано путем ссылки на следующие примеры. В этих примерах спектры ядерного магнитного резонанса (ЯМР) регистрировали на спектрометре Varian Unity Inova при 300 или 400 МГц и масс-спектрометрические (MS) спектры регистрировали на спектрометре Agilent MSD. Где было необходимо, реакции проводили в инертной атмосфере азота. В общем случае хроматографию проводили с использованием Matrex Silica 60® (35-70 микрон) или Prolabo Silica gel 60® (35-70 микрон), подходящих для флэш-хроматографии на силикагелях. Очистку путем высокоэффективной жидкостной хроматографии проводили с использованием системы автоочистки Gilson. Сокращения т.пл. и DMSO, использованные в примерах, означают точку плавления и диметилсульфоксид соответственно. Соединения названы с использованием программы по присваиванию наименований ACD/labs 6.0.
Пример 1
5-[[(2,3-дифторфенил)метил]тио]-7-[[2-гидрокси-1-(гидроксиметил)-1-метилэтил]амино]-тиазоло[4,5-d]пиримидин-2(3Н)-он
a) 6-амино-2-[[(2,3-дифторфенил)метил]тио]-4(3H)-пиримидинон
4-амино-6-гидрокси-2-меркаптопиримидин моногидрат (7,1 г) добавляли порциями к перемешиваемой суспензии 60% гидрида натрия (2,4 г) в безводном N,N-диметилформамиде (70 мл). Через 1 час добавляли раствор 2,3-дифторбензилбромида (10 г) в безводном N,N-диметилформамиде (10 мл). Перемешивали в течение выходных дней при комнатной температуре. Выливали в смесь лед/вода и осадок собирали фильтрованием с получением 9,6 г продукта. Выход 81%.
MS: (APCI) (химическая ионизация при атмосферном давлении) (+ve) 270 (М+Н, 94%).
b) 4-амино-2-[[(2,3-дифторфенил)метил]тио]-1,6-дигидро-6-оксо-5-пиримидиниловый эфир тиоциановой кислоты
Продукт со стадии (а) (28 г) и тиоцианат калия (40,5 г) в N,N-диметилформамиде (583 мл) нагревали совместно при 65°С. Добавляли пиридин (14,5 мл) и раствор охлаждали до 5°С. Медленно добавляли бром (5,0 мл) и реакционную смесь перемешивали в течение 2 часов при 5-10°С. Реакционную смесь выливали в ледяную воду (4200 мл), перемешивали в течение 1 часа и твердое вещество собирали фильтрованием, промывали водой и эфиром с получением 24 г продукта. Выход 70%.
MS: (APCI) (+ve)327(М+Н).
c) 2-амино-5-[[(2,3-дифторфенил)метил]тио]-тиазоло[4,5-d]пиримидин-7(6Н)-он
Смесь продукта со стадии (b) (12,1 г), N,N-диметилформамида (70 мл) и воды (20 мл) нагревали до 120°С в течение 24 часов. Бесцветное твердое вещество выпадало в осадок из раствора, которому позволяли охладиться, и твердое вещество собирали фильтрованием с получением 8,3 г продукта. Выход 70%.
MS: (APCI) (+ve) 327 (M+H).
d) 7-хлор-5-[[(2,3-дифторфенил)метил]тио]-тиазоло[4,5-d]пиримидин-2-амин
Продукт со стадии (с) (10,0 г) суспендировали в хлористом фосфориле (55 мл). Медленно добавляли N,N-диметиланилин (5,5 мл) и реакционную смесь нагревали при температуре дефлегмации в течение 2 часов. Оставляли охлаждаться, затем выливали на лед с интенсивным перемешиванием; температуре не позволяли подниматься выше 45°С (добавляли лед). Приблизительно через 20 минут устанавливалась температура 30°С. Образовавшееся твердое вещество собирали фильтрованием и промывали водой. Очищали колоночной хроматографией (EtOAc до 5%-ного МеОН в EtOAc) с получением 3,34 г продукта. Выход 31%.
MS: (APCI) (+ve) 345 (M+H).
e) 2-[[2-амино-5-[[(2,3-дифторфенил)метил]тио]тиазоло[4,5-d]пиримидин-7-ил]амино]-2-метил-1,3-пропандиол
Продукт со стадии (d) (1,5 г) суспендировали в NMP (10 мл), затем добавляли основание Хюнига (1,5 мл) и 2-амино-2-метилпропандиол (1,37 г). Реакционную смесь нагревали до 110°С в атмосфере N2 в течение 4 часов. Добавляли дополнительное количество 2-амино-2-метилпропандиола (0,685 г) и нагревали при 110°С в течение 5 часов. Смесь выливали в воду (400 мл) и твердое вещество собирали фильтрованием. Очищали колоночной хроматографией (EtOAc/метанол (95:5)) с получением 0,756 г продукта. Выход 42%.
MS: (APCI) (+ve) 414 (M+H).
f) 2-[[2-хлор-5-[[(2,3-дифторфенил)метил]тио]тиазоло[4,5-d]пиримидин-7-ил]амино]-2-метил-1,3-пропандиол
Продукт со стадии (е) (0,485 г) суспендировали в концентрированной HCl (18 мл), которую затем охлаждали до 15°С. Добавляли смесь воды (15 мл) и ацетонитрила (25 мл), получая раствор. Охлаждали до 5°С и по каплям добавляли раствор нитрита натрия (0,162 г) в воде (1 мл). Перемешивали при 5°С в течение нескольких часов, затем оставляли нагреваться в течение ночи. Раствор охлаждали до -10°С и нейтрализовали аммиаком, затем концентрировали в вакууме. Осадок желтого цвета собирали фильтрованием и промывали водой. Сушили в вакууме с получением 0,339 г продукта. Выход 67%.
MS: (APCI) (+ve) 433 (M+H).
g) 2-[[5-[[(2,3-дифторфенил)метил]тио]-2-метокситиазоло[4,5-d]пиримидин-7-ил]амино]-2-метил-1,3-пропандиол
Продукт со стадии (f) (0,339 г) суспендировали в метаноле (32 мл). Добавляли гидроксид калия (0,088 г) и смесь перемешивали при 50°С в течение 20 минут. Нейтрализовали 2 н. HCl и растворители удаляли в вакууме с получением остатка оранжевого цвета. Добавляли воду для удаления неорганических веществ и твердое вещество желтого цвета собирали фильтрованием с получением 0,3 г желаемого продукта. Выход 90%.
MS: (APCI) (+ve) 429 (M+H).
h) 5-[[(2,3-дифторфенил)метил]тио]-7-[[2-гидрокси-1-(гидроксиметил)-1-метилэтил]амино]-тиазоло[4,5-d]пиримидин-2(3Н)-он
Продукт со стадии (g) (0,3 г) суспендировали в смеси диоксана (50 мл) и концентрированной HCl (1 мл). Добавляли воду (1 мл) и полученный раствор нагревали при 60°С в течение 12 часов. Оставляли стоять на выходные. Растворители удаляли в вакууме и остаток переводили в воду. Осадок желтого цвета собирали фильтрованием и промывали водой. Очищали посредством препаративной ВЭЖХ (ацетонитрил/0,1% ацетат аммония (от 90:10 до 95:5)) в течение 25 минут с получением 0,063 г желаемого продукта. Выход 22%.
MS: (APCI) (+ve) 415 (M+H).
1H ЯМР:  (DMSO) 1.25 (3H, s), 3.54-3.66 (4H, m), 4.39 (2Н, s), 4.65-4.69 (2Н, t), 6.34 (1H, s), 7.12-7.20 (1H, m), 7.29-7.41 (2Н, m), 12.43 (1H, s). (DMSO) 1.25 (3H, s), 3.54-3.66 (4H, m), 4.39 (2Н, s), 4.65-4.69 (2Н, t), 6.34 (1H, s), 7.12-7.20 (1H, m), 7.29-7.41 (2Н, m), 12.43 (1H, s).
Т.пл. 230-233°С.
Пример 2
5-[[(2,3-дифторфенил)метил]тио]-7-[[2-гидрокси-1-(гидроксиметил)-1-метилэтил]амино]-тиазоло[4,5-d]пиримидин-2(3H)-он, мононатриевая соль
Продукт со стадии (h) Примера 1 (0,87 г) суспендировали в воде (80 мл), добавляли 1,0 М гидроксид натрия (3,0 мл), затем метанол (15 мл) и смесь нагревали на паровой бане. Когда растворение было почти полностью завершено, смесь фильтровали в горячем состоянии и фильтрат охлаждали в течение ночи с получением после фильтрования пушистого осадка белого цвета. Его сушили в вакуумной печи в течение ночи при 50°С (0,60 г).
MS: (APCI) (+ve) 415 (М+Н).
1H ЯМР:  (DMSO) 1.23 (3Н, s), 3.47-3.58 (4Н, m), 4.37 (2H, s), 4.94 (2H, t), 5.29 (1H, s), 7.14 (1H, m), 7.31 (1H, m), 7.35 (1H, m). (DMSO) 1.23 (3Н, s), 3.47-3.58 (4Н, m), 4.37 (2H, s), 4.94 (2H, t), 5.29 (1H, s), 7.14 (1H, m), 7.31 (1H, m), 7.35 (1H, m).
Т.пл. 238°С (разл.).
Фармакологические данные
Анализ связывания лиганда
[125I]IL-8 (человеческий, рекомбинантный) закупали у Amersham (U.K.) с удельной активностью 2000 Ки/ммоль. Все другие реагенты были химически чистыми. Высокие уровни hrCXCR2 экспрессировали в клетках НЕК 293 (клетках почки эмбриона человека 293, ЕСАСС №85120602) (Lee et al. (1992) J. Biol. Chem. 267 pp.16283-16291). кДНК hrCXCR2 амплифицировали и клонировали с мРНК нейтрофилов человека. ДНК клонировали в PCRScript (Stratagene) и клоны идентифицировали, используя ДНК. Кодирующую последовательность субклонировали в эукариотический вектор экспрессии RcCMV (Invitrogen). Плазмидную ДНК получали, используя Quiagen Megaprep 2500, и трансфецировали в клетки НЕК 293, используя реагент липофектамин (Gibco BRL). Клетки самого высокоэкспрессирующего клона собирали в забуференном фосфатом физиологическом растворе, содержащем 0,2% (мас./об.) этилендиаминтетрауксусную кислоту (EDTA), и центрифугировали (200 г, 5 мин). Клеточный осадок после центрифугирования ресуспендировали в охлажденном на льду буфере для гомогенизации [10 мМ HEPES (рН 7,4), 1 мМ дитиотреитол, 1 мМ EDTA и набор ингибиторов протеаз (1 мМ фенилметилсульфонилфторид, 2 мкг/мл соевого ингибитора трипсина, 3 мМ бензамидин, 0,5 мкг/мл лейпептина и 100 мкг/мл бацитрацина)] и клетки оставляли набухать в течение 10 минут. Клеточный препарат разрушали, используя ручную стеклянную ступку/пестиковый гомогенизатор PTFE, и собирали клеточные мембраны центрифугированием (45 минут, 100000g, 4°С). Мембранный препарат хранили при -70°С в буфере для гомогенизации, дополненном солевым раствором Тирода (Tyrode) (137 мМ NaCl, 2,7 мМ KCl, 0,4 мМ NaH2PO4), 0,1% (мас./об.) желатином и 10% (об./об.) глицерином. Все анализы проводили в 96-луночных фильтрационных планшетах MultiScreen 0,45 мкм (Millipore, U.K.). В каждом анализе использовали ˜50 пМ [125I]IL-8 и мембраны (эквивалентные ˜200000 клеткам) в буфере для анализа [солевой раствор Тирода, дополненный 10 мМ HEPES (рН 7,4), 1,8 мМ CaCl2, 1 мМ MgCl2, 0,125 мг/мл бацитрацина и 0,1% (мас./об.) желатином]. В дополнение к этому соединение формулы (I), соответствующее Примерам, предварительно растворяли в DMSO и добавляли до достижения конечной концентрации DMSO, равной 1% (об./об.). Анализ инициировали добавлением мембран и спустя 1,5 часа при комнатной температуре мембраны собирали фильтрованием, используя вакуумный коллектор Millipore MultiScreen, и дважды промывали буфером для анализа (без бацитрацина). Задний планшет удаляли из планшетного устройства MultiScreen, фильтры сушили при комнатной температуре, вынимали и просчитывали на  -счетчике Cobra. -счетчике Cobra.
Для соединения формулы (I) величина IC50 составляет менее (<) 10 мкМ.
Анализ мобилизации внутриклеточного кальция
Человеческие нейтрофилы готовили из обработанной EDTA периферической крови, как описано ранее (Baly et al. (1997) Methods in Enzimology 287, pp.70-72), в буфере для хранения [солевой раствор Тирода (137 мМ NaCl, 2,7 мМ KCl, 0,4 мМ NaH2РО4), дополненный 5,7 мМ глюкозой и 10 мМ HEPES (рН 7,4)].
Хемокин GRO (человеческий, рекомбинантный) закупали у R&D Systems (Abingdon, U.K.) Все другие реагенты были химически чистыми. Изменения содержания внутриклеточного свободного кальция измеряли флуориметрически путем внесения в нейтрофилы чувствительного к кальцию красителя fluo-3, как описано ранее (Merritt et al. (1990) Biochem. J. 269, pp.513-519). Клетки помещали на 1 час при 37°С в буфер для нанесения (буфер для хранения с 0,1% (мас./об.) желатином), содержащий 5 мкМ сложный эфир fluo-3 AM, промывали буфером для нанесения и затем ресуспендировали в солевом растворе Тирода, дополненном 5,7 мМ глюкозой, 0,1% (мас./об.) бычьим сывороточным альбумином (BSA), 1,8 мМ CaCl2 и 1 мМ MgCl2. Клетки пипетировали в 96-луночные микропланшеты с черными стенками и прозрачным дном (Costar, Boston, U.S.A.) и центрифугировали (200g, 5 минут, комнатная температура). (человеческий, рекомбинантный) закупали у R&D Systems (Abingdon, U.K.) Все другие реагенты были химически чистыми. Изменения содержания внутриклеточного свободного кальция измеряли флуориметрически путем внесения в нейтрофилы чувствительного к кальцию красителя fluo-3, как описано ранее (Merritt et al. (1990) Biochem. J. 269, pp.513-519). Клетки помещали на 1 час при 37°С в буфер для нанесения (буфер для хранения с 0,1% (мас./об.) желатином), содержащий 5 мкМ сложный эфир fluo-3 AM, промывали буфером для нанесения и затем ресуспендировали в солевом растворе Тирода, дополненном 5,7 мМ глюкозой, 0,1% (мас./об.) бычьим сывороточным альбумином (BSA), 1,8 мМ CaCl2 и 1 мМ MgCl2. Клетки пипетировали в 96-луночные микропланшеты с черными стенками и прозрачным дном (Costar, Boston, U.S.A.) и центрифугировали (200g, 5 минут, комнатная температура).
Соединение формулы (I), соответствующее Примерам, предварительно растворяли в DMSO и добавляли до достижения конечной концентрации DMSO, равной 1% (об./об.). Анализы инициировали добавлением концентрации GRO , равной A50, и регистрировали кратковременное увеличение флуоресценции fluo-3 ( , равной A50, и регистрировали кратковременное увеличение флуоресценции fluo-3 ( Ex=490 нм и Ex=490 нм и  Em=520 нм) регистрировали, используя FLIPR (Fluorometric Imaging Plate Reader, Molecular Devices, Sunnyvale, U.S.A.). Em=520 нм) регистрировали, используя FLIPR (Fluorometric Imaging Plate Reader, Molecular Devices, Sunnyvale, U.S.A.).
Соединение формулы (I) было протестировано и обнаружено, что оно является антагонистом рецептора CXCR2 в человеческих нейтрофилах.
Примеры фармацевтических композиций
Инъекционный раствор
| Соединение по изобретению |
5 мг |
| Глюкоза |
250 мг |
| Вода для инъекций |
сколько требуется до 5 мл |
Соединение по изобретению и глюкозу растворяют в воде для инъекций и полученный раствор ампулируют.
Желатиновая капсула
| Соединение по изобретению |
100 мг |
| Тальк |
24 мг |
| Силикагель |
1 мг |
| Общая масса на одну капсулу |
125 мг |
Указанные вещества смешивают и полученной смесью заполняют желатиновую капсулу.
Таблетка
| Соединение по изобретению |
400 мг |
| Силикагель |
10 мг |
| Стеариновая кислота |
20 мг |
| Кукурузный крахмал |
45 мг |
| Общая масса на одну таблетку |
475 мг |
Смешивают соединение по изобретению, силикагель и кукурузный крахмал (часть указанного количества). Смесь гранулируют с использованием крахмального клейстера, полученные гранулы опудривают стеариновой кислотой и прессуют в таблетку.
Формула изобретения
1. Мононатриевая соль 5-[[(2,3-дифторфенил)метил]тио]-7-[[2-гидрокси-1-(гидроксиметил)-1-метилэтил]амино]-тиазоло[4,5-d]пиримидин-2(3H)-она.
2. Соединение по п.1 для получения лекарственного средства в форме для перорального введения для лечения состояний или заболеваний дыхательных путей.
3. Соединение по п.1 для получения лекарственного средства в форме для перорального введения для лечения астмы, аллергического ринита, ХОЗЛ (хроническое обструктивное заболевание легких), воспалительной болезни кишечника, остеоартрита, ревматоидного артрита.
4. Соединение по п.1 для получения лекарственного средства в форме для перорального введения для лечения рака.
5. Применение соединения по п.1 в производстве лекарственного средства, обладающего свойством модулятора активности хемокиновых рецепторов, в форме для перорального введения.
6. Способ получения соединения по п.1, который включает взаимодействие соединения формулы (II):
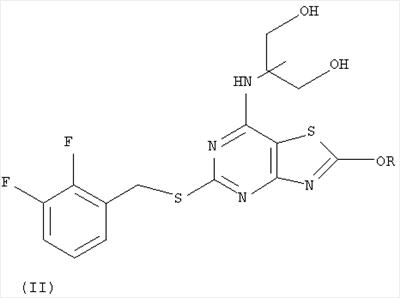
где R представляет собой C1-6алкил, с кислотой с последующим получением фармацевтически приемлемой мононатриевой соли.
7. Фармацевтическая композиция, обладающая свойством модулятора активности хемокиновых рецепторов, содержащая соединение по п.1 в ассоциации с фармацевтически приемлемым адъювантом, разбавителем или носителем.
8. Фармацевтическая композиция по п.7 для лечения астмы, аллергического ринита, ХОЗЛ, воспалительной болезни кишечника, остеоартрита, ревматоидного артрита.
9. Фармацевтическая композиция по п.7 для лечения рака.
10. Способ приготовления фармацевтической композиции по любому из пп.7-9, который включает смешивание соединения по п.1 с фармацевтически приемлемым адъювантом, разбавителем или носителем. |
|