
СПИСОК ПАТЕНТОВ С УПОМИНАНИЕМ ГИАЛУРОНОВОЙ КИСЛОТЫ
-
- 2017751 Способ получения гиалурона
- 2192150 БАД для профилактики йодной недостаточности
- 2112542 Препарат для лечения патологий соединительных тканей
- 2225206 Препарат для лечения рака молочной железы
- 2299733 Лечение опорно-двигательного аппарата
- 2299732 Способ лечения глаукомы
- 2299726 Противоинфекционная губная помада
- 2299725 Косметическое средство для ухода за кожей
- 2198878 Ароматическое соединение
- 2198702 Способ подготовки трофических язв к аутодермапластике
- 2198653 Вагинальные суппозитории
- 2197946 Композиция для ухода за волосами
- 2197923 Фармацевтическая композиция для лечения отеков роговицы
- 2298410 Биотрансплантант и способ лечения ревматических и аутоиммунных заболеваний
- 2197501 Фотоотверженный гель на основе сшитой гиалуроновой кислоты
- 2197228 Твердые лекарственные формы
- 2197222 Водная компазиция для ухода за волосами, лица и тела
- 2297425 Полипептиды
- 2297240 Композиция с гиалуроновой кислотой
- 2297230 Фармацевтическая компазиция с ксантоновой смолой
- 2196588 Глазные капли
- 2195955 Применение биологически активных веществ
- 2195926 Дерматологические композиции
- 2295954 Микрочастицы для доставки нуклеиновых кислот
- 2295951 Косметика для ухода за кожей лица и век
- 2195262 Фармакологическое средство на основе гиалуроновой кислоты
- 2194512 Способ профилактики и коррекции процесса старения кожи
- 2194478 Лечение экземы
- 2294716 Расширяемый стент
- 2194055 Сшитые сополимеры
- 2099350 Ассоциаты депротонированной гиалуроновой кислоты
- 2293557 Средство для лечения кожи и слизистых
- 2292878 Приготовление микроцастиц, содержащих метопропол
- 2292746 БАД
- 2192256 Защита кишечника
- 2191782 Получение модифицированной гиалуроновой кислоты
- 2292219 Паратиреоидный гормон человека
- 2291686 Микроцастицы
- 2191000 Косметическая маска
- 2290921 Фармацевтические и косметические средства против старения кожи
- 2290900 Модифицированный биоматериал для использования в офтальмологии
- 2290899 Получение биоматерьяла
- 2290397 Новые инданилиденовые соединения
- 2290186 Лечение сирингомиелии
- 2288702 Иррингационный раствор для офтальмологии
- 2288699 Гель для лечения стоматологических заболеваний
- 2188011 Активирующая остеогенез фармацевтическая композиция
- 2187327 Средство с антисептиком
- 2187325 Средство с радиопротекторным действием
- 2287330 Композиции миноксидила
- 2186786 Способ получения гиалуроновой кислоты
- 2186593 Лечение раненого процесса кожи
- 2286801 Очищение воды
- 2286781 Лечение ожогов пищевода у детей
- 2286764 Средство лечения воспалений полости рта
- 2185840 Лечение инфекционных заболеваний
- 2286151 Альфа-2-Дельта-Лиганда
- 2185149 Ранозаживляющий гель
- 2285527 Лечение ИЛ-6 заболеваний
- 2184448 Раствор хранения роговицы, включающий гиалуроновую кислоту
- 2090179 Крем для кожи
- 2183961 Способ лечения кожи
- 2284331 Соли алифотических аминов
- 2284187 Производные амида
- 2089191 Снизить внутрение давление
- 2283320 Получение гликозаминогликанов
- 2283129 Лечение опухолей
- 2283098 Косметические средства с Q
- 2182574 Ароматические соединения
- 2088257 Средство с гипохолестеролемическим действием
- 2088218 Состав для гигиенических салфеток
- 2088206 Способ получения препарата, создающего исскуственный загар
- 2282462 Противомикробные средства
- 2182008 Интровагинальная компазиция
- 2181999 Препарат с отсроченным высвобождением
- 2181998 Новые композиции липидов
- 2181995 Лечение болевого синдрома
- 2181295 Вирионная вакцина
- 2087144 Витамин Е
- 2379336 Способ стирки
- 2379052 Вакцинация
- 2180855Композиция в виде ионного комплекса
- 2379025 Противоинфекционный гель
- 2180825 Лечение травм роговицы
- 2281082 Способ коррекции эстетических и возрастных проблем кожи
- 2180576 Биоактивная добавка для косметических средств
- 2280459 Средство для изменения скорости роста или репродукции клеток
- 2179981 Соли переходного металла
- 2378010 Жидкие вакцины
- 2378008 Комбинированные вакцины
- 2378007 Анаболическое средство
- 2377973 Растительные экстракты
- 2280041 Способ получения водорастворимых комплексов гиалурил
- 2280038 Биополимеры
- 2323733 Йодный обмен
- 2377260 Гель
- 2178693 Противовирусное средство на основе гиалуроновой кислоты
- 2178692 Облегчающие зуд косметическое средство
- 2377022 Гемостатические спреи
- 2376982 Увлажняющая сыворотка для лица
- 2376974 Трансдермальный гель для лица
- 2362784 Гипо-и гиперацетилированные менингокковые капсульные сахариды
- 2177789 Устройство для доставки лекарства к шейке матки
- 2277954 Крем для лица омолаживающий
- 2376378 Способ получения метионина
- 2177332 Биоматериал для предотвращения послеоперационных спаек, с производной гиалуроновой кислотой
- 2177310 Способ получения таблеток
- 2376011 Средство для позвоночника
- 2277410 Косметическое средство
- 2323748 Медицинская повязка
- 2276998 Гидрогелевые композиции
- 2082416 Способ получения препарата с коллагенном из животного сырья
- 2375081 Адсорбирующее изделие
- 2375049 Охлаждающий пластырь
- 2346049 Способ получения гиалурона
- 2275913 Фармацевтические средства
- 2174985 Полисахарид с антиоксидантом
- 2373957 Носитель для лекарственных средств и биологически активных веществ
- 2373941 Способ коррекции возрастных и патологических изменений кожных покров
- 2174845 Композиции и способы доставки генетического материала
- 2174830 Средство для укрепления волос
- 2373769 Синбиотическая композиция
- 2274472 Лечение апорно-двигательного аппарата и болевых синдромов
- 2372929 Профилактическая композиция на основе веществ фенольной природы в липосомной форме
- 2173563 Способ нанесения на поверхность предметов покрытия на основе гиалуроновой кислоты, её производных и полусинтетических полимеров
- 2079304 фармацевтическая композиция, обладающая иммуносупрессорной и антимикробной активностью
- 2273645 Полипептид ожирения
- 2173154 Фракция кератансульфатолигосахаридов и содержащий ее фармацевтический препарат
- 2173136 Грязная мазь
- 2173128 Способ хирургического лечения центральных разрывов сечатки
- 2078561 Косметическое средство предотвращающее старение кожи
- 2172490 Способ прогнозирования воспалительных заболеваний молочной железы при эндопластике
- 2272645 Способ лечения ЦМВ-Инфекции у детей раннего возроста
- 2272636 Фармацевтическая композиция для местного лечения воспаления
- 2272635 Фармацевтически активная субстанция для офтальмологии
- 2272599 Биоматерьял для стабилизации прогрессирующей миопии "Коллаплант"
- 2172168 Средство для заживления ран на основе гиалуроновой кислоты
- 2371172 Фармацевтическая композиция для лечения нервной системы на основе стефаглабрина
- 2171470 Способ прогнозирования послеоперационной трансформации доброкачественных опухолей нервной системы
- 2077317 Состав для ванн
- 2271213 Комбинированные композиции, содержащие экстракты из растений и морских животных
- 2076872 Способ получения окрашенной гиалуроновой кислоты
- 2076671 Раствор для защиты роговицы
- 2370281 Конъюгаты гидроксиалкилкрахмал
- 2370275 Способ лечения (коррекции) косметических и возрастных дефектов кожи
- 2370258 Фармацевтическая композиция для парентальной доставки в форме лиофилизата
- 2270023 Способ экстракции и очистки протеогликана хрящего типа (варианты)
- 2369408 Гемостатическая композиция, включающая гиалуроновую кислоту
- 2369387 Фармацевтическая композиция для лечения нервной системы
- 2369379 Нетаблитированные жевательные формы для индивидуального введения
- 2169136 Производное коричной кислоты
- 70792 Медицинский аппликатор
- 20741717 Способ стабилизации аскорбиновой кислоты
- 2074712 Способ получения препарата, препятствующего преждевременной эякуляции
- 2367954 Способ прогнозирования развития кожной патологии у женщин с синдромом склерополикистозных яичников (СПКЯ)
- 2268075 Устройство для электрокинетической доставки
- 2268052 Средство для лечения воспалительных и дегенеративных заболеваний суставов
- 2167649 Способ получения твердой дисперсии умеренного водорастворимого лекарственного вещества
- 2167647 Гель для бритья
- 2073520 Лечение урологических инфекций
- 2367476 Биопластический материал
- 2367475 Мембрана для использования при направленной регенерации тканей
- 2367469 Фармацевтическая композиция на основе лизоамидазы
- 2367456 Фармацевтическая композиция обладающая антибактериальным и некролитическим действием
- 2367455 Фармацевтическая композиция обладающая некролитическим и антибактериальным действием
- 2267324 Применение антиадгезивных углеводов, препарат для уменьшения и /или блокирования адгезии патогенных веществ
- 2166934 Композиции включающие биологический агент
- 2166510 Псевдодипептиды
- 2366460 Композиции, имеющие высокую противовирусную и антибактериальную активность
- 2360901 Производные феноксиуксусной кислоты
- 2165749 Способ восстановления эндотелия роговицы
- 2265441 Способ укрепления склеры
- 2365382 Композиции и способы для регуляции развития сосудов
- 2070879 Соли гликозаминогликанов
- 2164914 Циклические и гетероциклические N - замещенные - иминогидроксамовые карбоновые кислоты
- 2264627 Хламидийный конъюктивит
- 2364399 Фармацевтический препарат на основе стефаглабрина
- 2264230 Препарат с замедленным высвобождением активного вещества
- 2363497 Фармацевтические композиции
- 2363496 Способ увеличения объема мягких тканей
- 2363473 Способ антифлогистической активации в эксперементе
- 2363461 Фармацевтический препарат на основе сигетина
- 2363459 Средства для введения в роговицу глаз для предотвращения офтальмологических нарушений
- 2363448 Фармацевтические композиции
- 2163123 Глазные капли
- 2162687 Усовершенствованнная лекарственная форма индуктора интерферана
- 2162343 Биосовместимый полимерный материал и способ его получения
- 2162327 Лечение рака
- 2067841 Способ получения ароматизатора
- 2161478 Способ консервированого лечения гонартроза
- 2361617 Вольфрамовые частицы в качестве рентгеноконтрастных веществ
- 2361552 Способы и устройства для дренирования жидкостей и понижения внутриглазного давления
- 2066996 Способ изготовления пленочного материала для офтальмохирургии
- 2361417 Корм с глюкозамином и экстрактом ивы для профилактики артроза у животных
- 2161002 Пищевой общеукрепляющий лечебно-профилактический продукт из хрящевой ткани акул
- 2360928 Комплексная матрица для медико-биологического применения
- 2160574 Способ лечения глаукомы
- 2360688 Способ лечения повреждений переферических нервов
- 2360670 Фармацевтическая композиция при климактерических расстройствах
- 2360646 Эндолюминальный протез
- 2260445 Способ усовершенствования транспортировки через легко прспосабливаемый полупроницаемый барьер
- 2260007 Производные амида
- 2359975 Способ получения модифицированных арабиногалактанов
- 2359974 Антигенные Пептиды
- 2159775 Псевдопептидный продукт
- 2259833 Фармацевтическая композиция для лечения роговицы глаза
- 2259816 Ранозаживляющее средство
- 2259815 Способ коррекции возрастных изменений, связанных с процессами старения кожи
- 2359706 Способ сохранения офтальмологических растворов
- 2359704 Антисептическое средство
- 2359662 Микрокапсулы
- 2159253 Катионные полимеры
- 2159111 Средство для ухода за кожей лица
- 2159105 Композиция для защиты кожи от опасных химических веществ Получение
- 2158593 Биосовместимый водный раствор
- 2358728 Способ лечения и предупреждения потери костной ткани
- 2258517 Способ хирургического лечения травмотических повреждений селезенки пленкой на основе гиалуроновой кислоты
- 2357968 Кристалические формы производной имидазола
- 2357957 Ингибиторы P38 и их применение
- 2157647 Пищевая добавка и ее получение
- 2357758 Препараты для чрескожной и чересслизистой добавки
- 2063244 Способ стабилизации растворов
- 2063140 Способ получения препарата для консервирования мяса
- 2157381 Способ получения гиалуроновой кислоты
- 2257198 Композиции микроцастиц
- 2356909 Белковый комплекс
- 2356570 Косметическая композиция
- 2256434 Способ закрытия перфорации барабанной перепонки
- 2356520 Способ лечения постконтузионного повреждения сечатки глаза
- 2156133 Гель
- 2255945 Полимерная композиция
- 2355761 Средства повторной дифференцировки
- 2061043 Способ повышения устойчивости урокиназы к нагреванию
- 2061005 Способ получения красителей для гистологических исследований
- 2355420 Зубная паста
- 2355385 Композиции пролонгированного действия с контролируемым высвобождением
- 2355240 Способ получения пищевого препарата хондропротекторного действия
- 2155057 Пихтово репейный бальзам
- 2354409 Способ производства высвобождающих лекарственные средчтва медицинских устройств
- 2254145 Раневое покрытие на основе коллаген-хитозанового комплекса
- 2254133 Лечение и профилактика ВИЧ-инфекции у человека
- 2253439 Фармацевтическая композиция для защиты и улучшения оптических свойств роговици при проведении эндовитреальных вмешательств
- 2253437 Способ омоложения кожи
- 2153352 Фармацевтическая композиция обладающая ранозаживляющим и противовоспалительным действием
- 2353354 Фармацевтический препарат на основе низкомолекулярного индуктора интерферона
- 2252787 Способ получения искусственной матрицы кожи
- 2252767 Способ нормализации иммунобиохимического гомеостаза коров в предродовом и послеродовом периодах
- 2352583 Фармацевтическая композиция содержащая Fc-область иммуноглобулина в качестве носителя
- 2152403 Модифицированные полисахариды
- 2352356 Иммуногенная композиция
- 2352342 Исскусственный физиологический солевый раствор Способ его получения
- 2352330 Фармацевтический препарат на основе низкомолекулярного индуктора интерферона
- 2352323 Фармацевтический препарат с модифицированным высвобождением
- 2152027 Способ подготовки ткани мозга для определения гликозаминогликанов
- 2251842 Интектицидный состав для борьбы с личинками оводов
- 2151580 Способ активации пролиферации эндотелия роговицы
- 2351648 Дифференцировка стромальных клеток, полученных из жировой ткани, в эндокринные клетки поджелудочной железы и их использование
- 2351595 N - гидроксиформамидные соединения в качестве ингибиторов металлопротеина
- 2251411 Косметическое средство в лиофилизированной фармацевтической форме
- 2251405 Косметика...ее композиции для косметических препаратов
- 2251367 Средство со сшитой гиалуроновой кислотой для наращивания тканей
- 2351359 Косметика для профилактики и лечения избыточной массы тела
- 2351322 Препарат на основе низкомолекулярного индуктора интерферона
- 2351153 Диета при остеортрите собак
- 2350958 Способ определения групповой принадлежности синовальной жидкости
- 2350625 Производные гиалуроновой кислоты с пониженной биодеградируемостью
- 2150266 Крем после бритья
- 2350354 Фармацевтическое средство содержащие антагонист и фактор некроза
- 2350340 Способ коррекции процессов регенерации
- 2350309 Способ лечения избыточной массы тела с помощью рефлексотерапии
- 2250047 Профилактический продукт из хрящевой ткани гидробионтов
- 2249467 Медицинский матерьял и изделия на его основе
- 2055079 Способ получения препарата гиалуроновой кислоты
- 2349599 Биоадгезив мидии
- 2054903 Способ лечения коллагеноза у бычков на откорме
- 2249210 Способ прогнозирования предрасположенности к развитию и тяжести течения деформирующего остеоартроза коленного сустава у взрослых
- 2349339 Средство для соединительной ткани
- 2148988 Человеческий интерферона
- 2148399 Лечение атеросклероза
- 2148396 Способ определения активного вещества в дифильных мазевых основах
- 2148375 Способ диагностики близорукости
- 2348415 Способ противоспаечной терапии после хирургического вмешательства
- 2348400 Препарат на основе низкомолекулярного индуктора интерферона
- 2348386 Способ непроникающего хирургического лечения первичной открытоугольной глаукомы
- 2248213 Лечение Галактозидальной А недостаточности
- 2347586 Микрофлюидизированные эмульсии типа "масло в воде" и вакцинные средства
- 2147243 Контрастное средство
- 2146526 Лечебный препарат дисбактериоза и урогенитальных инфекций
- 2146148 Терапевтическое применение фактора роста кератиноцитов (ФРК)
- 2146139 Способ повышения активности макрофагов и комбинации для его осуществления
- 2346277 Способ диагностики специфического синовита
- 2345793 Ультразвуковые контрастные вещества и их получение
- 2345782 Терапевтические комбинации на основе PORIFERA для лечения и предотвращения кожных заболеваний
- 2245131 Способ коррекции косметических недостатков кожи
- 2245130 Способ активации восстановительных процессов в коже
- 2144833 Хондроитиназа
- 2344809 Получение твердых дозированных форм с использованием сшитого нетермопластичного носителя
- 2244540 Косметический гель для ухода за кожей лица
- 2244536 Способ лечения дегенеративно-дистрофических заболеваний тазобедренного сустава
- 2344167 Хмелевый экстракт
- 2143884 Агент регулирования дифференциации клеток кожи, культурная среда для клеток или тканей и способ регулирования дифференциации клеток кожи
- 2343932 Способ получения обладающих пониженной растворимостью в воде пленночных материалов
- 2343903 Устройство доставки лекарств для контролируемого введения препаратов
- 2048817 Способ получения материала для лечения ожогов и гнойно - некронических ран
- 2048803 Гидратантный крем
- 2242974 Средства и способы лечения воспалительных заболнваний
- 2142816 Способ получения антигерпетической вакцины
- 2342923 Средство для обработки рук с увлажняющим эффектом
- 2142781 Косметика для макияжа ресниц и бровей и агент ингирирующий рост микроорганизмов в косметических средствах
- 2242251 Трансплантируемые стенты с биоактивными покрытиями
- 2142257 Способ обработки глазных имплантантов и контакных линз
- 2342389 Мононатриевая соль
- 2342107 Способ устранения западения верхнего века при анофтальме
- 2141828 Средство, пролонгирующее эффективность чесночного порошка
- 2241489 Косметическое средство матриксных протеинов для залечивания ран
- 2241443 Средство для лечения герпеса
- 2241414 Способ получения протезов кровеносных сосудов
- 2341539 Гидрогель
- 2141324 Регулятор скорости воздействия препарата для инъекций
- 2141312 Косметическое средство для ухода за кожей лица
- 2341296 Средства и способы покрытия медицинских имплантантов
- 2341272 Средство для неспецифической иммунотерапии
- 2341266 Стенты с нанесенным покрытием содержащим N - (5-(4-(4-
- 2341257 Иммуномодулирующее средство
- 2341255 Средство для лечения климактерических расстройств
- 2240821 Способ лечения урологических инфекций
- 2140786 Способ лечения лишая
- 2140243 Способ хирургического лечения диабетической ретинопатии и отслоек сечатной оболочки
- 2240140 Медицинская многослойная повязка и изделия на ее основе
- 2240135 Культура клеток, содержащая клетки - предшественники остеонегеза, имплантант на ее основе и его использование для восстановления целостности кости
- 2240123 Экзогенные биологически активные коньюгирующие вещества
- 2139886 Фотоотвержаемое производное гликозаминогликата, сшитое производное гликозаминогликата и способы их получения, способ предотвращения клеточной и тканевой адгезии
- 2139729 Вакцина. Способ стимулирования иммунной системы
- 2339386 Средство обладающее радио - и химиозащитным действием
- 2339369 Лечение офтальмологических нарушений с использованием мочевины и ее производных
- 2139041 Гидратантный регенерирующий крем и способ его получения
- 2139039 Косметический суперкрем для ухода за кожей
- 2139017 Способ получения боисовместимого материала
- 2138503 Производные камптотецина, способы их получения, уникальное средство
- 2338556 Средство содержащие антагонист Р2Х - рецептора и нестероидное противоспалительное лекарственное средство
- 2338514 Косметическое средство для профилактики старения кожи
- 2138297 Медицинские устройства, подверженные вызываемому разложению
- 2138295 Покрытие для ран
- 2337906 Ингибиторы цитозольной фосфолипазы А2 Применение физиологически допустимого корпускулярного ферримагнитного или ферромагнитного материала. Способ формирования магнитометрического изображения
- 2137501 Устройство формирования изображения
- 2137477 Способ лечения заболеваний характеризующихся аутоиммунной агрессией
- 2137467 Крем для кожи лица и тела
- 2137449 Способ коррекции дефектов преломления в глазу млекопитающего
- 2137402 Пищевая Добавка БАД
- 2336899 Способ стимуляции миелопоэза
- 2336862 Способ получения раствора для лечения роговицы
- 2336830 Способ восстановления костных структур челюсти
- 2136696 Новый полипептид и средство против ВИЧ - Инфекции
- 2336092 Биоадгезивное средство, по существу свободное от воды
- 2336089 Средство и способ лечения заболеваний периодонтальных и пульпы
- 2336074 Средства и способы лечения заднего сегмента глаза
- 2235548 Ранозаживляющее средство
- 2135186 Способ лечения рефлекторных синдромов при остеохондрозе
- 2234945 Стабилизатор водного раствора и водосодержащего сырья
- 2334762 Растворимая ассоциативная карбоксиметилцеллюлоза
- 2234514 Макропористые хитозановые гранулы и способ их получения. Способ культивирования клеток
- 2133615 Средство для лечения неврологических заболеваний
- 2233164 Способ профилактики развития послеоперационных спаек брюшной полости
- 2133127 Неткатный материал, способ его получения и способ лечения
- 2333223 Альдегидные производные сиаловой кислоты и средства на их основе
- 2333007 Полипептидные вакцины для широкой защиты против рядов поколений менингококов с повышенной вирулентностью
- 2332985 Дозированные формы анестезирующих средств с длительным высвобождением для обезболивания
- 2132677 Косметическая маска
- 38603 Пленочный аппликатор
- 2232594 Средство содержащие ингибирующие остеокластогенез фактор и полисахарид
- 2332238 Средство для прокладок, раневых повязок и других изделий, контактирующих с кожей
- 2331668 Стромальные клетки, получение из жировой ткани, для заживления дефектов роговицы и внутриглазных дефектов и их использование
- 2331438 Альфа - 2 - Дельта Лигант для лечения симптомов нижних мочевыводящих путей
- 2331411Электропряденые аморфные фармоцевтические средства
- 2331367 Способ профилактики образования спаек и их рецидива
- 2130767 Масло в воде для получения косметических и дерматологических средств, способ косметической обработки
- 2230752 Поперечносшитые гиалуроновые кислоты и их применение в медицине
- 2230558 Способ восстановления и сохранения здоровья скмьи
- 2230550 Средства длительного высвобождения, способ их получения и применения
- 2230458 Поддержания здоровья суставов
- 2330290 Способ определения состояния метаболических процессов в ткани суставного хряща
- 2230073 Способ поперечного сшивания карбоксилированных полисахаридов
- 2329059 Способ лечения полипозного риносинусита
- 2329037 Комбинированная терапия для лечения иммуновоспалительных заболеваний
- 2128666 Гиалуроновая кислота и ее соли, способ очистки гиалуроновой кислоты, способ получения гиалуроновой кислоты. Фармацевтический препарат с гиалуроновой кислотой и средства с гиалуроновой кислотой используемые в офтальмологии
- 2328740 Способ экспресс - оценки действия зубных паст
- 2128502 Косметический гель
- 2328272 Суппозитории индуктора интерферона
- 2328268 Косметика содержащая амфолитный сополимер
- 2128057 Композиционная мембрана, способ ее получения и способ направленной регенерации тканей с ее применением
- 2128055 Средство замедленного освобождения и способ его получения
- 2128049 Свечи
- 2227743 Полипептидные варианты с повышенной гепаринсвязывающей способностью
- 2326893 Ковалентное и нековалентное сшивание гидрофильных полимеров
- 2326697 Новый перевязочный материал для быстрого заживления раневой поверхности кожи
- 2126264 Фармацевтическое средство с гиалуроновой кислотой
- 2326137 Способ получения содержащих альгинат пористых формованных изделий
- 2325902 Способ выделения гликозаминогликанов из минерализованной соединительной ткани
- 2225195 Репелленты против насекомых
- 2325193 Сосудистый стент
- 2325184 Улучшенные везикулы наружной мембраны бактерий
- 2325153 Многокомпонентная фармацевтическая дозированная форма
- 2325152 Удерживаемая в желудке система регулируемой доставки лекарственного средства
- 2029955 Способ предоперационного определения помутнения задней капсулы хрусталика при экстракции катаракты
- 2324688 Производные бисбензизоселеназолонила с противоопухолевым, противовоспалительным и антитромбоническим действием
- 2323017 Устройство и способ контролируемый доставки активных веществ в кожу
- 2323011 Содержащий Коллаген I и Коллаген II способный к рассасыванию внеклеточный матрикс, предназначенный для реконструирования хряща
- 2322955 Способ изготовления имплантанта для пластики дефектов хрящевой ткани
- 2322454 Антитело против CCR5
- 2322263 Система продолжительного высвобождения растворимого лекарственного средства
- 2221561 Витамин Е и его сложные эфиры
- 2321634 Гены участвующие в метаболизме углерода и продуцировании энергии
- 2321597 Биоматерьял, способ его приготовления и его применение, медицинское средство, имплантант и вкладыш
- 2121340 Средство для похудения
- 2220737 Средство для улучшения состояния опорно-двигательного аппарата
- 2220729 Гель используемый в стоматологии
- 2320720 Способ культивирования фибропластов для заместительной терапии
- 2320378 Накожный аппликатор
- 2320369 Средства, содержащие Альфа - 2 - Дельта Лиганды и ингибиторы обратного захвата серотонина/норадреналина
- 2320362 Местные фармацевтические средства, содержащие проантоцианидины, для лечения дерматитов
- 2320322 Биоадгезивная доставка лекарств
- 2320318 Чувствительное к температуре изменяющие состояние средство гидрогеля
- 2025120 Способ получения препарата, содержащего Фактор /G-CSF/, стимулирующий рост колоний гранулоцитов
- 2319490 Средство для введения железа при лечении синдрома беспокойных ног
- 25995 Содержащее адгезив приспособление для фиксации зубных протезов в полости рта
- 2218907 Средство для ухода за кожей лица и веками
- 2318830 Способ получения модифицированного дерматансульфата
- 2118153 Косметика - туш для ресниц
- 2217441 Способ получения полимера
- 2317296 Изетионатная соль селективного ингибитора CDK4
- 2217171 Мембрана для использования при направленной регенерации тканей
- 2317095 Экстракты ECHINACEA ANGUSTIFOLIA
- 2216332 Препарат для лечения астроза
- 2216314 Крем - маска для обезвоженной кожи
- 2316333 Средство оздоровительно-восстановительных косметических панто-магниевых ванн
- 2021304 Способ получения биологически активного средства
- 2115662 Способ получения гиалуроновой кислоты
- 2315627 Впрыскиваемые имплантанты на керамической основе для заполнения морщин, кожных впадин, шрамов
- 2315623 Средство получаемое путем лиофилизации препарата
- 2114862 Способ получения гиалуроновой кислоты
- 2314791 Лечебно-Косметическое средство
- 2314791 Косметический крем-бальзам для ухода за кожей лица и шеи
- 2214600 Способ оценки эффективности лечения неврологических проявлений
- 2114602 Способ косметической обработки
- 2114587 Раствор для защиты роговицы
- 2214283 Имплантант для подкожного или внутрикожного введения
- 2313370 Медицинские протезы, имеющие улучшенную биологическую совместимость
- 2313356 Препарат для лечения демодекоза
- 2313338 Средство на основе этиллинолеата и триэтилцитрата для лечения себореи и угрей
- 2313328 Косметика содержащая тонкодисперный и пористый порошок
- 2212880 Способ получения препарата содержащего антибиотик, с замедленным высвобождением активного вещества
- 2312640 Способ лечения Блефароконьюнктивальной формы синдрома сухого глаза
- 2017751 Способ получения гиалуроновой кислоты
- 2312145 Гены CORYNEBACTERIUM GLUTAMICUM, кодирующие белки, участвующие в синтезе мембран и мембранном транспорте
- 2311458 Белки вызывающие измененную иммуногенную реакцию. Способ их получения и использования
- 2311183 Улучшенное разделение с использованием гталуроновой кислоты
- 2311177 Ингибиторы интегрина для лечения заболевания глаз
- 2300069 Косметическая маска
- 2211024 Уход за сухой кожей
- 2310440 Раствор для защиты роговицы от повреждений
- 2309684 Лечение межфалангового остеоатроза узелковой формы
- 2309406 Способ мониторинга фиброза печени у больных хроническим гепатитом с (ХГС)
- 2209088 Опосредованная рецепторами доставка генов с использованием векторов на основе бактериофагов
- 2308967 Уменьшение объема ткани
- 2308962 Средство для опорно-дигательного аппарата
- 2308957 Способ получения препарата для мезотерапии
- 2308954 Средство для лечения ран, содержащее плазму или сыворотку крови
- 2308951 Комплексный способ профилактики вагинальных дисбактериозов
- 2308937 Косметическая биологически активная добавка и косметический литофитокомплекс на ее основе
- 2208638 ДНК (варианты), способ получения белка
- 2207885 Способ подачи небольшого объема лечебного раствора к целевому месту
- 2207858 Лишенные побочных эффектов производные простагландинов для лечения глаукомы
- 2207845 Твердая лекарственная форма пролонгированного действия
- 2207844 Препарат для местного неинвазивного применения
- 2207841 Средства с антиферментативным действием
- 2306335 Стволовые клетки и решетки полученные из жировой ткани
- 2306140 Новые рецепторы для Helicobacter pylori и их применение
- 2205612 Способ эндотелизации IN VITRO протезов кровеносных сосудов
- 2105540 Депигментирующее средство
- 2304960 Косметическое средство для кожи
- 2304616 Гены участвующие в гомеостазе и адаптации
- 2204550Способ получения длинноцепочечной N-Ацилированной кислотой Аминокислот
- 2204415 Способ получения изображения
- 2204394 Средство для лечения грибковых инфекций, желудочных язв
- 2204366 Способ хирургического лечения глаукомы
- 2104034 Вагинальное увлажняющие средство, способ его получения
- 2303991 Биологически активная добавка
- 2303990 БАД
- 2303973 Адсорбирующее изделие
- 2203676 Средство обладающее иммунокорригирующим действием
- 2203672 Способ предупреждения беременности
- 2303635 Гены кодирующие белки резистентности и толерантности к стрессам
- 2303529 Способ фиксации альгинатного геля на твердой фазе, способ получения клеточного чипа на его основе
- 2203078 Способ лечения гнойных ран
- 2302412 Гидразоно-малонитрилы
- 2102400 Способ получения гиалуроновой кислоты
- 2202356 Способ стимуляции репаративных процессов длительно незаживающих ран и трофических язв
- 2202336 Средство для ухода за кожей
- 2302231 Глазные капли
- 2102082 Способ магнитометрического исследования тела человека или животного
- 2301814 Полиакриламидный гидрогель
- 2201765 Гибридные матричные имплантанты и эксплантанты
- 2301677 Биотрансплантант для лечения дегенеративных и трвматических заболеваний хрящевой ткани и способ его получения
- 2301676 Способ лечения ревматизма
- 2301674 Способ лечения больных с переломами нижней челюсти
- 2301661 Средство с регулируемым освобождением и способ его получения
- 2005488 Средство для лечения болезней соединительной ткани
- 2200001 Крем для кожи
|
РОССИЙСКАЯ ФЕДЕРАЦИЯ

ФЕДЕРАЛЬНАЯ СЛУЖБА
ПО ИНТЕЛЛЕКТУАЛЬНОЙ СОБСТВЕННОСТИ
ПАТЕНТАМ И ТОВАРНЫМ ЗНАКАМ
|
Патент №2362784 |
(54) ГИПО- И ГИПЕРАЦЕТИЛИРОВАННЫЕ МЕНИНГОКОККОВЫЕ КАПСУЛЬНЫЕ САХАРИДЫ
(57) Реферат:
Капсульные сахариды, полученные из серогрупп W135 и Y Neisseria meningitidis, имеют измененные уровни O-ацетилирования в положениях 7 и 9 остатков их сиаловых кислот. Модифицированный менингококковый капсульный сахарид серогруппы W135, где (а)  29% остатков сиаловых кислот в сахариде являются O-ацетилированными в 7 положении; и/или (b) 29% остатков сиаловых кислот в сахариде являются O-ацетилированными в 7 положении; и/или (b)  26% остатков сиаловых кислот в сахариде являются O-ацетилированными в 9 положении и модифицированный менингококковый капсульный сахарид серогруппы Y, где а) 26% остатков сиаловых кислот в сахариде являются O-ацетилированными в 9 положении и модифицированный менингококковый капсульный сахарид серогруппы Y, где а)  9% остатков сиаловых кислот в сахариде являются O-ацетилированными в 7 положении; и/или (b) 9% остатков сиаловых кислот в сахариде являются O-ацетилированными в 7 положении; и/или (b)  29% или 29% или  27% остатков сиаловых кислот в сахариде являются O-ацетилированными в 9 положении могут быть использованы для создания иммуногенных композиций - композиций для индукции образования антител у млекопитающих и продуктов конъюгирования с белками-носителями. Конъюгаты производных демонстрируют повышенную иммуногенность по сравнению с природными полисахаридами. 14 н. и 15 з.п. ф-лы, 3 табл., 6 ил. 27% остатков сиаловых кислот в сахариде являются O-ацетилированными в 9 положении могут быть использованы для создания иммуногенных композиций - композиций для индукции образования антител у млекопитающих и продуктов конъюгирования с белками-носителями. Конъюгаты производных демонстрируют повышенную иммуногенность по сравнению с природными полисахаридами. 14 н. и 15 з.п. ф-лы, 3 табл., 6 ил.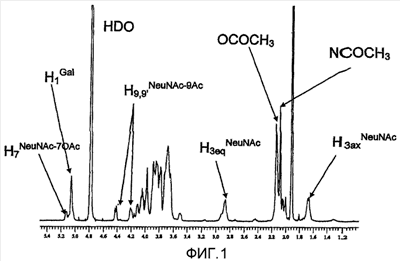
Все приведенные документы полностью включены сюда в качестве ссылки.
Техническая область
Это изобретение относится к области менингококковых капсульных сахаридов и их конъюгированных производных.
Предшествующий уровень техники
Полисахариды представляют собой важные биологические молекулы, и их широко применяли в фармацевтической промышленности для предотвращения и лечения заболеваний. Например, в течение многих лет капсульные полисахариды применяли в вакцинах против инкапсулированных бактерий, таких как менингококк (Neisseria meningitidis), пневмококк (Streptococcus pneumoniae) и Hib (Haemophilus influenzae типа B).
Разработаны конъюгатные вакцины для усиления иммуногенности капсульных полисахаридов, особенно у детей. Конъюгатные вакцины включают в себя капсульный сахарид, конъюгированный с белком-носителем [например, ссылки 1-3]. Конъюгация превращает Т-независимые антигены в Т-зависимые антигены.
Капсульный сахарид серогруппы W135 Neisseria meningitidis ("MenW135") включает в себя полимер из дисахаридных мотивов сиаловая кислота-галактоза:
 4)-D-Neup5Ac(7/9OAc)- 4)-D-Neup5Ac(7/9OAc)- -(2 -(2 6)-D-Gal- 6)-D-Gal- -(1 -(1 , ,
где "Neu" означает нейраминовую кислоту, общеизвестную как сиаловая кислота.
Аналогичным образом, капсульный сахарид серогруппы Y Neisseria meningitidis (MenY) включает в себя полимер из дисахаридных мотивов сиаловая кислота-глюкоза:
 4)-D-Neup5Ac(7/9ОAc)- 4)-D-Neup5Ac(7/9ОAc)- -(2 -(2 6)-D-Glc-б-(1 6)-D-Glc-б-(1 . .
Обнаружено, что в природе эти капсульные сахариды O-ацетилированы по некоторым 7 и 9 положениям некоторых остатков сиаловых кислот. В ссылке 4 "впервые сообщили" об O-ацетилировании сахарида W135, с O-ацетилированием в положениях O-7 и O-9. Также в положениях O-7 и O-9 наблюдали ацетилирование сахарида серогруппы Y, хотя авторы заметили, что в предыдущей работе указано на O-ацетилирование в O-7, O'-3 или O'-4 положениях. О дальнейших исследованиях содержания O-ацетилов в сахаридах сообщено в ссылке 5.
В ссылке 5 сообщают, что для серогруппы W135 "существует растущий объем данных, что O-ацетилирование не важно для вызова защитного ответа антителами". В отличие от этого, в ссылке 6 сообщают, что "существует доказательство того, что O-ацетилирование оказывает влияние на иммуногенность полисахаридных вакцин". Однако авторы ссылки 5 исследовали ацетилирование в серогруппах W135 и Y в предположении, что "O-ацетилирование CPS [капсульного полисахарида] может быть не важным для активации защитного иммунитета". Среди своих результатов они наблюдали отсутствие изменений в O-ацетилировании для этих двух серогрупп после хранения в основных условиях в течение 9 суток при комнатной температуре.
В ссылке 7 сообщают, что ранее "не сообщали о "состоянии O-ацетилирования штаммов W135 и Y", применяемых в тетравалентных полисахаридных вакцинах". В ссылке 8 авторы продолжили сообщение того, что "о состоянии O-ацетилирования серогрупп W135 и Y известно немного", и они указали, что дальнейшая работа "может обеспечить полезные представления для оптимального формулирования вакцин", хотя сущность такой дальнейшей работы и возможные представления не конкретизированы. В ссылке 9 сообщают, что для серогруппы W135 "важность O-ацетилирования для разработки вакцин остается неопределенной". Ссылка 6 выражает мнение, что данные  о влиянии O-ацетилирования полисахаридов на иммуногенность серогруппы W-135 или Y пока еще недоступны о влиянии O-ацетилирования полисахаридов на иммуногенность серогруппы W-135 или Y пока еще недоступны (январь 2004 г.). (январь 2004 г.).
Эти неопределенность и отсутствие информации для серогрупп W135 и Y отличаются от двух других серогрупп, для которых в настоящее время применяют сахаридные вакцины. С большими промежутками сообщалось [10, 11] о вариации O-ацетилирования капсульного полисахарида серогруппы C Neisseria meningitidis, но, по-видимому, это не оказывает никакого отрицательного влияния на иммуногенность, так как эффективны оба продукта, как MenjugateTM, так и NeisVac-CTM. В отличие от этого, де-O-ацетилирование полисахарида серогруппы A связано со "значительным снижением иммуногенности" [12].
Объектом изобретения является представление производных капсульного сахарида, которые можно применять для создания иммуногенных композиций, в частности, при конъюгировании с белками-носителями, и, особенно для менингококковых серогрупп W135 и Y.
Описание изобретения
Несмотря на неясность относительно роли O-ацетилирования в вакцинах для серогрупп W135 и Y менингококков, авторы изобретения обнаружили, что O-ацетилирование действительно может являться значимым, особенно для получения конъюгатных вакцин. Изобретение основано на открытии того, что полученные из MenW135 и MenY модифицированные капсульные сахариды с измененными уровнями O-ацетилирования в 7 и 9 положениях остатков сиаловых кислот можно применять для создания иммуногенных композиций. Относительно немодифицированных нативных сахаридов, производные по изобретению предпочтительно выбирают при конъюгировании с белками-носителями. Кроме того, конъюгаты этих производных демонстрируют увеличенную иммуногенность по сравнению с нативными полисахаридами.
Модифицированные сахариды
Таким образом, изобретение относится к модифицированному менингококковому капсульному сахариду серогруппы W135, где (a)  x% остатков сиаловых кислот в сахариде являются O-ацетилированными в 7 положении; и/или (b) x% остатков сиаловых кислот в сахариде являются O-ацетилированными в 7 положении; и/или (b)  y% остатков сиаловых кислот в сахариде являются O-ацетилированными в 9 положении. y% остатков сиаловых кислот в сахариде являются O-ацетилированными в 9 положении.
Подобно этому изобретение относится к модифицированному капсульному сахариду менингококковой серогруппы Y, где a)  x% остатков сиаловых кислот в сахариде являются O-ацетилированными в 7 положении; и/или (b) x% остатков сиаловых кислот в сахариде являются O-ацетилированными в 7 положении; и/или (b)  y% или y% или  z% остатков сиаловых кислот в сахариде являются O-ацетилированными в 9 положении. z% остатков сиаловых кислот в сахариде являются O-ацетилированными в 9 положении.
Значение x зависит от серогруппы: для серогруппы W135, x менее или равно 29 (например, 28, 27, 26, 25, 24, 23, 22, 21, 20, 19, 18, 17, 16, 15, 14, 13, 12, 11, 10, 9, 8, 7, 6, 5, 4, 3, 2, 1, 0,5 или 0); для серогруппы Y, x менее или равно 9 (например, 8, 7, 6, 5, 4, 3, 2, 1, 0,5 или 0).
Значение y также зависит от серогруппы: для серогруппы W135, y более или равно 26 (например, 27, 28, 29, 30, 31, 32, 33, 34, 35, 36, 37, 38, 39, 40, 41, 42, 43, 44, 45, 46, 47, 48, 49, 50, 51, 52, 53, 54, 55, 56, 57, 58, 59, 60, 61, 62, 63, 64, 65, 66, 67, 68, 69, 70, 71, 72, 73, 74, 75, 76, 77, 78, 79, 80, 81, 82, 83, 84, 85, 86, 87, 88, 89, 90, 91, 92, 93, 94, 95, 96, 97, 98, 99 или 100); для серогруппы Y, y более или равно 29 (например, 30, 31, 32, 33, 34, 35, 36, 37, 38, 39, 40, 41, 42, 43, 44, 45, 46, 47, 48, 49, 50, 51, 52, 53, 54, 55, 56, 57, 58, 59, 60, 61, 62, 63, 64, 65, 66, 67, 68, 69, 70, 71, 72, 73, 74, 75, 76, 77, 78, 79, 80, 81, 82, 83, 84, 85, 86, 87, 88, 89, 90, 91, 92, 93, 94, 95, 96, 97, 98, 99 или 100).
Значение z менее или равно 27 (например, 26, 25, 24, 23, 22, 21, 20, 19, 18, 17, 16, 15, 14, 13, 12, 11, 10, 9, 8, 7, 6, 5, 4, 3, 2, 1, 0,5 или 0).
Предпочтительно x>m, где m выбрано из 0, 0,5, 1, 2, 3, 4, 5, 6, 7, 8, 9 и 10.
Предпочтительно z>p, где p выбрано из 0, 0,5, 1, 2, 3, 4, 5, 6, 7, 8, 9 и 10.
Сахариды по изобретению
В широком смысле изобретение относится к модифицированному менингококковому капсульному сахариду, необязательно конъюгированному с белком-носителем, где сахарид включает в себя n или более повторяющихся мотивов дисахаридной единицы {[сиаловая кислота]-[гексоза]}, где гексоза представляет собой галактозу или глюкозу и n представляет собой целое число от 1 до 100, и где (a)  x% остатков сиаловых кислот в указанном n или более повторяющихся единиц являются O-ацетилированными в 7 положении; и/или (b) когда гексоза представляет собой галактозу, x% остатков сиаловых кислот в указанном n или более повторяющихся единиц являются O-ацетилированными в 7 положении; и/или (b) когда гексоза представляет собой галактозу,  y% остатков сиаловых кислот в указанном n или более повторяющихся единиц являются O-ацетилированными в 9 положении, и когда гексоза представляет собой глюкозу, y% остатков сиаловых кислот в указанном n или более повторяющихся единиц являются O-ацетилированными в 9 положении, и когда гексоза представляет собой глюкозу,  y% или y% или  z% остатков сиаловых кислот в указанном n или более повторяющихся единиц являются O-ацетилированными в 9 положении. z% остатков сиаловых кислот в указанном n или более повторяющихся единиц являются O-ацетилированными в 9 положении.
Значение x зависит от гексозы: когда гексоза представляет собой галактозу, x менее или равно 29 (например, 28, 27, 26, 25, 24, 23, 22, 21, 20, 19, 18, 17, 16, 15, 14, 13, 12, 11, 10, 9, 8, 7, 6, 5, 4, 3, 2, 1, 0,5 или 0); когда гексоза представляет собой глюкозу, x менее или равно 9 (например, 8, 7, 6, 5, 4, 3, 2, 1, 0,5 или 0).
Значение y зависит от гексозы: когда гексоза представляет собой галактозу, y более или равно 26 (например, 27, 28, 29, 30, 31, 32, 33, 34, 35, 36, 37, 38, 39, 40, 41, 42, 43, 44, 45, 46, 47, 48, 49, 50, 51, 52, 53, 54, 55, 56, 57, 58, 59, 60, 61, 62, 63, 64, 65, 66, 67, 68, 69, 70, 71, 72, 73, 74, 75, 76, 77, 78, 79, 80, 81, 82, 83, 84, 85, 86, 87, 88, 89, 90, 91, 92, 93, 94, 95, 96, 97, 98, 99 или 100); когда гексоза представляет собой глюкозу, y более или равно 29 (например, 30, 31, 32, 33, 34, 35, 36, 37, 38, 39, 40, 41, 42, 43, 44, 45, 46, 47, 48, 49, 50, 51, 52, 53, 54, 55, 56, 57, 58, 59, 60, 61, 62, 63, 64, 65, 66, 67, 68, 69, 70, 71, 72, 73, 74, 75, 76, 77, 78, 79, 80, 81, 82, 83, 84, 85, 86, 87, 88, 89, 90, 91, 92, 93, 94, 95, 96, 97, 98, 99 или 100).
Значение z менее или равно 27 (например, 26, 25, 24, 23, 22, 21, 20, 19, 18, 17, 16, 15, 14, 13, 12, 11, 10, 9, 8, 7, 6, 5, 4, 3, 2, 1, 0,5 или 0).
Предпочтительно x>m, как описано выше. Предпочтительно z>p, как описано выше.
Предпочтительно сиаловые кислоты представляют собой N-ацетилнейраминовую кислоту.
Предпочтительно дисахаридный мотив {[сиаловая кислота]-[гексоза]} представляет собой:
 4)-D-Neup5Ac(7/9OAc)-б-(2 4)-D-Neup5Ac(7/9OAc)-б-(2 6)-D-Gal-б-(1 6)-D-Gal-б-(1 , ,
когда гексоза представляет собой галактозу.
Предпочтительно дисахаридный мотив {[сиаловая кислота]-[гексоза]} представляет собой:
 4)-D-Neup5Ac(7/9OAc)- 4)-D-Neup5Ac(7/9OAc)- -(2 -(2 6)-D-Glc- 6)-D-Glc- -(1 -(1 , ,
когда гексоза представляет собой глюкозу.
Предпочтительно модифицированный менингококковый капсульный сахарид конъюгирован с белком-носителем. В таких конъюгатах: (i) предпочтительно от 2 до 9%, более предпочтительно от 4 до 8%, более предпочтительно от 5 до 7%, еще более предпочтительно около 6% остатков сиаловых кислот O-ацетилированы в 7 положении; (ii) предпочтительно от 35 до 55%, более предпочтительно от 40 до 50%, более предпочтительно от 42 до 46%, еще более предпочтительно около 43% (когда гексозой является Gal) или около 45% (когда гексозой является Glc) остатков сиаловых кислот O-ацетилированы в 9 положении.
По изобретению также представлена композиция, включающая в себя a молекул капсульного сахарида менингококковой серогруппы W135, где среднее количество остатков сиаловых кислот в молекуле капсульного сахарида представляет собой b, и где (a)  x%a·b остатков сиаловых кислот серогруппы W135 в композиции O-ацетилированы в 7 положении; и/или (b) x%a·b остатков сиаловых кислот серогруппы W135 в композиции O-ацетилированы в 7 положении; и/или (b)  y%a·b остатков сиаловых кислот серогруппы W135 в композиции O-ацетилированы в 9 положении, и где x и y представляют собой, как определено выше. y%a·b остатков сиаловых кислот серогруппы W135 в композиции O-ацетилированы в 9 положении, и где x и y представляют собой, как определено выше.
Также изобретение относится к композиции, включающей в себя a молекул капсульного сахарида менингококковой серогруппы Y, где среднее количество остатков сиаловых кислот в молекуле капсульного сахарида представляет собой b, и где (a)  x%a·b остатков сиаловых кислот серогруппы Y в композиции O-ацетилированы в 7 положении; и/или (b) x%a·b остатков сиаловых кислот серогруппы Y в композиции O-ацетилированы в 7 положении; и/или (b)  y% или y% или  z%a·b остатков сиаловых кислот серогруппы Y в композиции O-ацетилированы в 9 положении, и где x и y представляют собой, как определено выше. z%a·b остатков сиаловых кислот серогруппы Y в композиции O-ацетилированы в 9 положении, и где x и y представляют собой, как определено выше.
Сахариды в указанных группах могут быть конъюгированы с белками-носителями и/или быть свободны в растворе.
Предпочтительно сахариды или конъюгаты по изобретению находятся в очищенной форме, например, преимущественно в отсутствие нативного полисахарида.
Описания структур
По этому изобретению также представлен сахарид, необязательно конъюгированный с белком-носителем, включающим в себя n или более повторов следующего дисахаридного мотива:
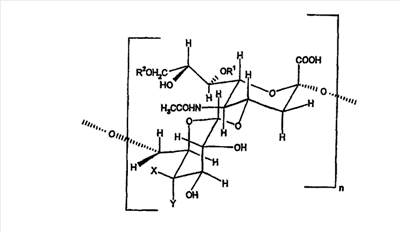
где - n представляет собой целое число от 1 до 100,
- X и Y представляют собой разные группы, выбранные из -H и -OH,
- R1 независимо выбран из -H и -COCH3 и может быть одним и тем же или разным в каждой дисахаридной единице,
- R2 независимо выбран из -H и -COCH3 и может быть одним и тем же или разным в каждой дисахаридной единице, и когда
- X представляет собой -OH и Y представляет собой -H, (a)  x% R1 представляют собой -COCH3 и/или (b) x% R1 представляют собой -COCH3 и/или (b)  y% R2 представляют собой -COCH3, y% R2 представляют собой -COCH3,
- X представляет собой -H и Y представляет собой -OH, (a)  x% R1 представляют собой -COCH3 и/или (b) x% R1 представляют собой -COCH3 и/или (b)  y% или y% или  z% R2 представляют собой -COCH3. z% R2 представляют собой -COCH3.
Когда X представляет собой -OH и Y представляет собой -H, x менее или равно 29 (например, 28, 27, 26, 25, 24, 23, 22, 21, 20, 19, 18, 17, 16, 15, 14, 13, 12, 11, 10, 9, 8, 7, 6, 5, 4, 3, 2, 1, 0,5 или 0) и y более или равно 26 (например, 27, 28, 29, 30, 31, 32, 33, 34, 35, 36, 37, 38, 39, 40, 41, 42, 43, 44, 45, 46, 47, 48, 49, 50, 51, 52, 53, 54, 55, 56, 57, 58, 59, 60, 61, 62, 63, 64, 65, 66, 67, 68, 69, 70, 71, 72, 73, 74, 75, 76, 77, 78, 79, 80, 81, 82, 83, 84, 85, 86, 87, 88, 89, 90, 91, 92, 93, 94, 95, 96, 97, 98, 99 или 100).
Когда X представляет собой -H и Y представляет собой -OH, x менее или равно 9 (например, 8, 7, 6, 5, 4, 3, 2, 1 или 0,5), y более или равно 29 (например, 30, 31, 32, 33, 34, 35, 36, 37, 38, 39, 40, 41, 42, 43, 44, 45, 46, 47, 48, 49, 50, 51, 52, 53, 54, 55, 56, 57, 58, 59, 60, 61, 62, 63, 64, 65, 66, 67, 68, 69, 70, 71, 72, 73, 74, 75, 76, 77, 78, 79, 80, 81, 82, 83, 84, 85, 86, 87, 88, 89, 90, 91, 92, 93, 94, 95, 96, 97, 98, 99 или 100) и z менее или равно 27 (например, 26, 25, 24, 23, 22, 21, 20, 19, 18, 17, 16, 15, 14, 13, 12, 11, 10, 9, 8, 7, 6, 5, 4, 3, 2, 1, 0,5 или 0).
Предпочтительно x>m, где m, как определено выше. Предпочтительно z>p, где p, как указано выше.
Предпочтительно сахарид конъюгирован с белком-носителем.
Когда сахарид конъюгирован с белком-носителем, и X представляет собой -OH и Y представляет собой -H: (a) предпочтительно приблизительно 2-10%, более предпочтительно приблизительно 4-8%, более предпочтительно приблизительно 5-7%, еще более предпочтительно приблизительно 6% R1 представляют собой -COCH3; и/или (b) предпочтительно приблизительно 35-55%, более предпочтительно приблизительно 40-50%, более предпочтительно приблизительно 42-44%, еще более предпочтительно приблизительно 43% R2 представляют собой -COCH3.
Когда сахарид конъюгирован с белком-носителем и X представляет собой -H и Y представляет собой -OH: (a) предпочтительно приблизительно 2-9%, более предпочтительно приблизительно 4-8%, более предпочтительно приблизительно 5-7%, еще более предпочтительно приблизительно 6% R1 представляют собой -COCH3; и/или (b) предпочтительно приблизительно 35-55%, более предпочтительно приблизительно 40-50%, более предпочтительно приблизительно 42-46%, еще более предпочтительно приблизительно 45% R2 представляют собой -COCH3.
Состояние O-ацетилирования остатков сиаловых кислот в положениях 7 и 9 в сахаридах и конъюгатах по изобретению можно измерять с применением 1D и 2D протонного ЯМР, как описано ниже. HPAEC можно применять для измерения общего O-ацетилирования, но он не может провести различия между различными положениями [234]. Для анализа O-ацетилирования MenA применяли MС с распылением ионов [235].
Способ получения модифицированного сахарида
Изобретение также относится к способу получения иммуногенных конъюгатов, включающему в себя стадии (1) предоставления исходного менингококкового капсульного сахарида и белка-носителя, любой или оба из которых необязательно модифицированы для приведения его/их в состояние реактивности по отношению друг к другу; (2) формирования ковалентной связи между сахаридом и белком-носителем; и (3) очистки полученных гликоконъюгатов, где между стадиями (1) и (3) (например, при реакции стадии (2)) увеличивается степень O-ацетилирования остатков сиаловых кислот в положении 9 в исходном сахариде.
Менингококковый капсульный сахарид предпочтительно происходит из серогрупп W135 или Y.
Исходное сырье капсульного сахарида
Модифицированные капсульные сахариды по изобретению получают из сахаридов, обнаруженных в капсуле серогрупп W135 или Y N.meningitidis. Таким образом, сахариды по изобретению предпочтительно представляют собой модифицированные сахариды серогруппы W135 N.meningitidis и модифицированные сахариды серогруппы Y N.meningitidis.
Менингококковые капсульные полисахариды обычно получают посредством способа, включающего в себя стадии преципитации полисахарида (например, с применением катионного детергента), фракционирования этанолом, экстракции холодным фенолом (для удаления белков) и ультрацентрифугирования (для удаления LPS) [например, ссылка 13].
Более предпочтительный способ [14] включает в себя преципитацию полисахарида с последующим растворением осажденного полисахарида с применением низшего спирта. Осаждение (или преципитацию) можно выполнять с применением катионного детергента, такого как тетрабутиламмоний и цетилтриметиламмониевые соли (например, бромидные соли) или гексадиметрина бромид и миристилтриметиламмониевые соли. Особенно предпочтителен бромид цетилтриметиламмония ('CTAB') [15]. Растворение осажденного вещества можно выполнять с применением низшего спирта, такого как метанол, пропан-1-ол, пропан-2-ол, бутан-1-ол, бутан-2-ол, 2-метилпропан-1-ол, 2-метилпропан-2-ол, диолы, и т.д., но особенно подходит для растворения комплексов CTAB-полисахарид этанол. К выпавшему в осадок полисахариду предпочтительно добавляют этанол для получения конечной концентрации (основанной на общем содержании этанола и воды) от 50% до 95%.
После повторного растворения полисахарид можно дополнительно обработать для удаления примесей. Это особенно важно в ситуациях, когда недопустима даже незначительная примесь (например, получение вакцины для человека). Обычно это включает в себя одну или несколько стадий фильтрации, например глубокую фильтрацию, фильтрацию через активированный уголь, фильтрацию по размеру и/или ультрафильтрацию. После фильтрации для удаления примесей полисахарид можно осаждать для дополнительной обработки и/или переработки. Это можно удобно выполнять посредством обмена катионов (например, посредством добавления солей кальция или натрия).
Сахариды по изобретению могут представлять собой полисахариды или олигосахариды. Олигосахариды имеют меньшую степень полимеризации по сравнению со степенью полимеризации, обнаруженной в нативных капсульных полисахаридах, представленных в бактериях.
По изобретению предпочтительно применяют олигосахариды. Предпочтительно они имеют среднюю степень полимеризации, меньшую 30, например от 15 до 25, предпочтительно приблизительно 15-20. Степень полимеризации можно удобно измерять посредством ионообменной хроматографии или посредством колориметрического анализа [16].
Олигосахариды обычно получают посредством фрагментации очищенного капсульного полисахарида (например, посредством гидролиза, посредством мягкой кислотной обработки, посредством нагревания и т.д.), обычно с последующей очисткой фрагментов желательного размера. При выполнении гидролиза, как правило, для удаления коротких олигосахаридов гидролизат разделяют по размеру. Этого можно достичь различными способами, такими как ультрафильтрация с последующей ионообменной хроматографией. Для серогрупп W135 и Y предпочтительно удаляют олигосахариды со степенью полимеризации менее чем приблизительно 4.
В качестве альтернативы очистке из нативных источников капсульные сахариды (и, в частности, олигосахариды) можно получать посредством полного или частичного синтеза, например синтез Hib, как описано в ссылке 17, и синтез MenA по ссылке 18.
Ковалентное конъюгирование
Модифицированные сахариды по изобретению можно подвергать любой обычной применяемой к сахаридам дальнейшей обработке (например, получение производных, конъюгирование, фрагментация и т.д.). Предпочтительно модифицированные сахариды по изобретению конъюгируют с белком-носителем для усиления иммуногенности. Конъюгирование с белками-носителями особенно полезно для педиатрических вакцин [19] и представляет собой хорошо известный способ [например, рассмотренный в ссылках от 20 до 28 и т.д.].
Таким образом, изобретение относится к конъюгату белка-носителя и сахарида по изобретению.
Предпочтительные белки-носители представляют собой бактериальные токсины или анатоксины, такие как дифтерийный анатоксин или столбнячный анатоксин. Особенно предпочтителен производный CRM197 дифтерийного анатоксина [29-31]. Другие пригодные белки-носители включают в себя наружный белок мембраны N.meningitidis [32], синтетические пептиды [33, 34], белки теплового шока [35, 36], коклюшные белки [37, 38], цитокины [39], лимфокины [39], гормоны [39], факторы роста [39], синтетические белки, содержащие множество эпитопов человеческих CD4+ T-клеток из различных происходящих из патогенных организмов антигенов [40], таких как белок N19 [41], белок D из H.influenzae [42, 43], пневмококковый поверхностный белок PspA [44], пневмолизин [45], захватывающие железо белки [46], токсин A или B из C.difficile [47], мутантные бактериальные токсины (например, холерный токсин 'CT' или E.coli термолабильный токсин 'LT'), такой как CT с заменой Glu-29 [48] и т.д. Предпочтительные носители представляют собой дифтерийный анатоксин, столбнячный анатоксин, белок D H.influenzae и CRM197.
В композиции по изобретению можно применять более одного белка-носителя, например, для снижения риска супрессии носителя. Таким образом, можно применять разные белки-носители для различных серогрупп, например, сахариды серогруппы W135 можно конъюгировать с CRM197, тогда как сахариды серогруппы Y можно конъюгировать со столбнячным анатоксином. Также можно применять более одного белка-носителя для конкретного сахаридного антигена, например, сахариды серогруппы Y могут принадлежать двум группам, конъюгированные с CRM197 сахариды и конъюгированные со столбнячным анатоксином сахариды. Однако в большинстве случаев предпочтительно применять один и тот же белок-носитель для всех серогрупп, предпочтительным вариантом является CRM197.
Один белок-носитель может нести более одного сахаридного антигена [49]. Например, один белок-носитель может быть конъюгирован с сахаридами серогрупп W135 и Y. Однако в большинстве случаев предпочтительно иметь отдельные конъюгаты для каждой серогруппы.
Предпочтительны конъюгаты с соотношением сахарид:носитель (мас./мас.) от 1:5 (т.е. избыток белка) до 5:1 (т.е. избыток сахарида). Предпочтительны соотношения от 1:2 до 5:1, хотя более предпочтительны соотношения от 1:1,25 до 1:2,5. Для конъюгатов MenW135 отношение может быть приблизительно 1,1 и для конъюгатов MenY 0,7. Предпочтительно конъюгаты содержат от 6,6-20 мкг носителя CRM197 исходя из количества 10 мкг сахарида MenW135 или MenY.
Конъюгаты можно применять вместе со свободным белком-носителем [50]. Когда в композиции по изобретению данный белок-носитель присутствует в свободной и конъюгированной формах, предпочтительно, чтобы неконъюгированная форма составляла не более 5% от общего количества белка-носителя в композиции в целом, и более предпочтительно присутствие менее 2% по массе.
Где необходимо, можно применять любую пригодную реакцию конъюгирования с любым пригодным линкером.
Как правило, сахарид активируют или функционализируют до конъюгирования. Активация может включать в себя, например, цианилирующие реагенты, такие как CDAP (например, 1-циано-4-диметиламинотетрафторборат пиридина [51, 52 и т.д.]). В других пригодных способах применяют карбодиимиды, гидразиды, активные сложные эфиры, норборан, p-нитробензойную кислоту, N-гидроксисукцинимид, S-NHS, EDC, TSTU; также см. введение к ссылке 26.
Выполнять связывания через линкерную группу можно с применением любого известного способа, например способов, описанных в ссылках 3 и 53. Один тип связывания включает в себя восстановительное аминирование полисахарида, связывающее возникшую аминогруппу с одним концом линкерной группы адипиновой кислоты и затем связывающее белок с другим концом линкерной группы адипиновой кислоты [24, 54, 55]. Предпочтительный тип связывания представляет собой карбонильный линкер, который можно формировать реакцией свободной гидроксильной группы модифицированного сахарида с CDI [56, 57] с последующей реакцией с белком для формирования карбаматной связи. Еще один предпочтительный тип связывания представляет собой линкер из адипиновой кислоты, формируемый связыванием свободной -NH2 группы на модифицированном сахариде с адипиновой кислотой (с применением, например, диимидной активации), и затем связыванием белка с полученным промежуточным соединением сахарида и адипиновой кислоты) [24, 54, 58]. Еще один тип связывания можно формировать посредством реакции свободной гидроксильной группы сахарида с цианилирующим агентом (например, п-нитрофенилцианат, 1-циано-4-(диметиламино)тетрафторборат пиридина (CDAP), N-тетрафторборат цианотриэтиламмония (CTEA)) или с последующей реакцией с аминогруппой белка (необязательно через спейсер, например, через гидразин) [59, 60]. Другие линкеры включают в себя B-пропионамид [61], нитрофенилэтиламин [62], галогенацилгалогениды [63], гликозидные связи [2, 64], 6-аминокапроновую кислоту [65], ADH [66], от C4 до C12 вещества [67], и т.д. В качестве альтернативы связыванию с применением линкера можно применять прямую связь. Прямые связи с белком могут включать в себя окисление полисахарида с последующим восстановительным аминированием белком, как описано, например, в ссылках 2 и 68.
Конъюгирование может включать в себя восстановление аномерного конца в первичную гидроксильную группу, необязательную защиту/снятие защиты первичной гидроксильной группы; реакцию первичной гидроксильной группы с CDI с образованием CDI карбаматного промежуточного соединения; и связывание карбаматного промежуточного соединения CDI с аминогруппой белка.
Предпочтителен процесс, включающий в себя введение аминогрупп в сахарид (например, посредством замещения концевых =О групп на -NH2) с последующим получением производных адипинового диэфира (например, N-гидроксисукцинимидодиэфира адипиновой кислоты) и реакцией с белком-носителем. В еще одной предпочтительной реакции применяют активацию CDAP с белком-носителем D.
После конъюгирования свободные и конъюгированные сахариды можно разделить. Существует множество пригодных способов, включающих в себя гидрофобную хроматографию, тангенциальную ультрафильтрацию, диафильтрацию и т.д. [также см. ссылки 69 и 70, и т.д.].
Предпочтительно, чтобы получение олигосахарида предшествовало конъюгированию в случаях, когда композиция по изобретению включает в себя конъюгированный олигосахарид.
Фармацевтические композиции
Изобретение относится к иммуногенной композиции (например, вакцине), содержащей (a) модифицированный капсульный сахарид по изобретению и/или конъюгат по изобретению и (b) фармацевтически приемлемый носитель. В данной области хорошо известны основанные на сахаридах или конъюгатах сахарид-белок вакцины, включающие в себя конъюгаты, основанные на де-O-ацетилированных сахаридах (NeisVac-C ). Вакцины по изобретению могут быть профилактическими (т.е. для предотвращения инфекции) или терапевтическими (т.е. для лечения инфекции), но, как правило, являются профилактическими. ). Вакцины по изобретению могут быть профилактическими (т.е. для предотвращения инфекции) или терапевтическими (т.е. для лечения инфекции), но, как правило, являются профилактическими.
"Фармацевтически приемлемые носители" включают в себя любой носитель, не индуцирующий самостоятельно образование антител, опасных для индивидуума, получающего фармацевтическую композицию. Как правило, пригодные носители представляют собой большие, медленно метаболизируемые макромолекулы, такие как белки, полисахариды, полимолочные кислоты, полигликолевые кислоты, полимерные аминокислоты, сополимерные аминокислоты, трегалозные липидные агрегаты [71] (такие как масляные капли или липосомы), и неактивные вирусные частицы. Такие носители хорошо известны специалисту в данной области. Также вакцины могут содержать разбавители, такие как вода, солевой раствор, глицерол и т.д. Кроме того, могут присутствовать вспомогательные вещества, такие как увлажняющие или эмульгаторы, забуферивающие pH вещества и т.п. Полное обсуждение фармацевтически приемлемых наполнителей доступно в ссылке 72.
Как правило, фармацевтические композиции получают в виде инъекций или в виде жидких растворов или суспензий; также можно получать твердые формы, пригодные для растворения или суспендирования в жидких носителях до инъекции. Также композицию можно эмульгировать или инкапсулировать в липосомы для усиления эффекта адъюванта. Как правило, прямая доставка фармацевтических композиций является парентеральной (например, посредством инъекции, либо подкожно, внутрибрюшинно, внутривенно или внутримышечно, или доставлена в интерстициальное пространство ткани). Также фармацевтические композиции можно вводить в участок повреждения. Другие способы введения включают в себя пероральное и легочное введение, ректальное (суппозитории) и трансдермальные аппликации или аппликации чрескожные [например, ссылка 73], иглы и безыгольные шприцы.
Предпочтительно pH композиции составляет от 6 до 8, предпочтительно приблизительно 7. Стабильный pH можно поддерживать посредством применения буфера. Предпочтительно применение гистидинового буфера, когда композиция включает в себя соль гидроксида алюминия [74]. Композиция должна быть стерильной и/или апирогенной. Композиции по изобретению должны быть изотоническими по отношению к человеку.
Композиции по изобретению могут быть в водной форме (т.е. растворы или суспензии) или в сухой форме (например, лиофилизированные порошки). Жидкая форма позволяет вводить композицию прямо из ее упакованной формы, без необходимости восстановления в водной среде, что, таким образом, идеально для инъекции. Такие композиции можно помещать в ампулы или в готовые заполненные шприцы. Шприцы могут быть снабжены иглами или без игл. Шприц включает в себя однократную дозу композиции, тогда как ампула может включать в себя однократную дозу или многократные дозы.
Жидкие композиции по изобретению также пригодны для восстановления других вакцин из лиофилизированных форм, например для восстановления лиофилизированных антигенов Hib или DTP. Когда композицию по изобретению следует применять для такого экстемпорального восстановления, по изобретению предоставлен набор, который может включать в себя две ампулы, или может содержать один готовый заполненный шприц и одну ампулу с содержанием шприца, применяемого для восстановления содержимого ампулы до инъекции.
Сухие композиции по изобретению характеризуются стабильностью при хранении, но их до введения необходимо восстанавливать в жидкую форму. По изобретению предоставлен набор, включающий в себя, во-первых, контейнер, содержащий сухую композицию по изобретению и, во-вторых, контейнер, содержащий водную композицию для восстановления содержимого первого контейнера. Водная композиция во втором контейнере может содержать антигены (например, неменингококковый) или может содержать только наполнители. Обычно первый контейнер представляет собой ампулу; второй контейнер также может представлять собой ампулу или может являться готовым заполненным шприцем.
При получении сухих композиций можно применять стабилизаторы, например дисахариды, такие как трегалоза и сахароза, или сахарные спирты, такие как маннитол. Эти компоненты добавляют до лиофилизации, и они находятся в восстановленной композиции.
Дополнительные компоненты композиций включают в себя хлорид натрия (для тоничности), например, приблизительно 9 мг/мл; детергент, например, Tween (полисорбат), такой как Tween 80, обычно в небольших количествах, например, <0,01%; и солевые буферы, например, фосфатный буфер. Композиция может включать в себя антибиотическое средство.
Композиции по изобретению можно фасовать в форме единичной дозы или в форме многократных доз. Для форм жидких многократных доз ампулы предпочтительно представляют собой предварительно заполненные шприцы. Эффективные дозы можно установить обычным способом, но для человека обычная доза композиции для инъекции имеет объем 0,5 мл.
Иммуногенные композиции, применяемые в качестве вакцин, содержат иммунологически эффективное количество антигена(ов), а также любых других необходимых компонентов. Под "иммунологически эффективным количеством" понимают, что введение такого количества индивидууму в виде однократной дозы или части серии эффективно для лечения или профилактики. Это количество варьирует в зависимости от самочувствия и физического состояния подлежащего лечению индивидуума, возраста, таксономической группы подлежащего лечению индивидуума (например, не являющийся человеком примат, примат и т.д.), способности иммунной системы индивидуума синтезировать антитела, степени желательной защиты, формулирования вакцины, оценки лечащим врачом медицинской ситуации и других значимых факторов. Ожидают, что количество находится в достаточно широком интервале, который можно определить посредством обычных исследований.
Обычное количество каждого менингококкового сахаридного антигена на дозу составляет от 1 мкг до 20 мкг, например, приблизительно 1 мкг, приблизительно 2,5 мкг, приблизительно 4 мкг, приблизительно 5 мкг или приблизительно 10 мкг (выраженного в виде сахарида).
Каждый сахарид может присутствовать, по существу, в том же количестве на дозу. Однако может быть предпочтительным избыток сахарида MenY, например, соотношение MenY:MenW135 (мас./мас.) 1,5:1 или более.
Когда присутствует конъюгат, композиция также может содержать свободный белок-носитель [50]. Предпочтительно свободный белок-носитель составляет менее 5% от массы композиции; более предпочтительно он составляет менее 2% от массы.
Композиции по изобретению обычно содержат один или несколько адъювантов. Такие адъюванты включают в себя в качестве неограничивающих примеров
А. Содержащие минералы композиции
Содержащие минералы композиции, пригодные для применения в качестве адъювантов по изобретению, включают в себя минеральные соли, такие как соли алюминия и кальция. Минеральные соли по изобретению включают в себя соли, такие как гидроксиды (например, оксигидроксиды), фосфаты (например, гидроксифосфаты, ортофосфаты), сульфаты и т.д. [например, см. главы 8 и 9 ссылки 75], или смеси различных минеральных соединений с соединениями, принимающими любую пригодную форму (например, гель, кристаллическую, аморфную и т.д.), и предпочтительно с адсорбцией. Содержащие минералы композиции также можно получать как часть соли металла [76].
В. Масляные эмульсии
Композиции в форме масляных эмульсий, пригодные для применения в качестве адъювантов по изобретению, включают в себя сквален-водные эмульсии, такие как MF59 [глава 10 ссылки 75; также см. ссылку 77] (5% сквален, 0,5% Tween 80 и 0,5% Span 85, формулированная в субмикронные частицы с применением микрофлюидизатора). Также можно применять полный адъювант Фрейнда (CFA) и неполный адъювант Фрейнда (IFA).
С. Препараты сапонина [глава 22 ссылки 75]
Препараты сапонина также можно применять в качестве адъювантов по изобретению. Сапонины представляют собой гетерогенную группу стероидных гликозидов и тритерпеноидных гликозидов, обнаруженных в коре, листьях, стеблях, корнях и даже цветках широкого спектра видов растений. Сапонин из коры дерева Quillaia saponaria Molina широко изучали в качестве адъювантов. Также сапонин можно промышленно получать из Smilax ornata (сарсапарель), Gypsophilla paniculata (brides veil) и Saponaria officianalis (мыльный корень). Препараты адъюванта сапонина включают в себя очищенные препараты, такие как QS21, а также липидные препараты, такие как ISCOM. QS21 продается как Stimulon . .
Композиции сапонина очищают с применением HPLC и RP-HPLC. С применением этих способов идентифицировали определенные очищенные фракции, включая QS7, QS17, QS18, QS21, QH-A, QH-B и QH-C. Предпочтительно сапонин представляет собой QS21. Способ получения QS21 сообщают в ссылке 78. Препараты сапонина также могут содержать стирол, такой как холестерин [79].
Можно применять сочетания сапонинов и холестеринов для формирования особых частиц, названных иммуностимулирующими комплексами (ISCOM) [глава 23 ссылки 75]. Обычно ISCOM также включают в себя фосфолипид, такой как фосфатидилэтаноламин или фосфатидилхолин. Любой известный сапонин можно применять в ISCOM. Предпочтительно ISCOM включают в себя один или несколько QuilA, QHA и QHC. ISCOM описаны далее в ссылках 79-81. Необязательно ISCOM можно лишать дополнительного детергента [82].
Рассмотрение разработки основанных на сапонине адъювантов можно найти в ссылках 83 и 84.
D. Виросомы и вирусоподобные частицы
Виросомы и вирусоподобные частицы (VLP) также можно применять в качестве адъювантов по изобретению. Как правило, эти структуры содержат один или несколько вирусных белков, необязательно сочетаемых или формулируемых с фосфолипидом. Как правило, они непатогенные, нереплицирующиеся и, как правило, не содержат никакого нативного вирусного генома. Вирусные белки можно рекомбинантно продуцировать или выделять из целых вирусов. Эти пригодные для применения в виросомах или VLP вирусные белки включают в себя белки, полученные из вируса гриппа (такие как HA или NA), вируса гепатита B (такие как ядерные или капсидные белки), вируса гепатита E, вируса кори, вируса Sindbis, ротавируса, вируса ящура, ретровируса, вируса Norwalk, вируса папилломы человека, HIV, РНК-содержащих фагов, фага Q (такие как белки оболочки), фага GA, фага fr, фага AP205 и Ty (такие как белок p1 ретротранспозона Ty). VLP дополнительно обсуждают в ссылках 85-90. Виросомы обсуждают далее, например, в ссылке 91. (такие как белки оболочки), фага GA, фага fr, фага AP205 и Ty (такие как белок p1 ретротранспозона Ty). VLP дополнительно обсуждают в ссылках 85-90. Виросомы обсуждают далее, например, в ссылке 91.
E. Бактериальные или микробные производные
Пригодные для применения адъюванты по изобретению включают в себя бактериальные или микробные производные, такие как нетоксичные производные липополисахарида (LPS) энтеробактерий, производные липида A, иммуностимуляторные олигонуклеотиды и АДФ-рибозилирующие токсины и их детоксифицированные производные.
Нетоксичные производные LPS включают в себя монофосфориллипид A (MPL) из 3-O-дезацилированный MPL (3dMPL). 3dMPL представляет собой смесь и 3 де-O-ацилированного монофосфорил липида A с 4, 5 или 6 ацилированными цепями. Предпочтительную форму "малой частицы" 3 де-O-ацилированного монофосфорил липида A описывают в ссылке 92. Такие "малые частицы" 3dMPL являются достаточно мелкими, чтобы стерильно фильтровать их через мембрану с размером пор 0,22 мкм [92]. Другие нетоксичные производные LPS включают в себя мимики (подражатели) монофосфорил липида A, такие как производные аминоалкил глюкозаминид фосфата, например, RC-529 [93, 94].
Производные липида A включают в себя производные липида A из Escherichia coli, такие как OM-174. OM-174 описано, например, в ссылках 95 и 96.
Иммуностимулирующие олигонуклеотиды, пригодные для применения в качестве адъювантов по изобретению, включают в себя нуклеотидные последовательности, содержащие мотив CpG (динуклеотидная последовательность, содержащая неметилированный цитозин, связанный фосфатной связью с гуанозином). Также показано, что двухцепочечные РНК и олигонуклеотиды, содержащие палиндромы или поли-(dG)-последовательности, являются иммуностимулирующими.
CpG могут включать в себя нуклеотидные модификации/аналоги, такие как фосфоротиоатные модификации, и могут являться двухцепочечными или одноцепочечными. В ссылках 97, 98 и 99 сообщают возможные аналоговые замены, например, замена гуанозина на 2'-дезокси-7-диазогуанозин. Адъювантный эффект олигонуклеотидов CpG дополнительно обсуждают в ссылках 100-105.
Последовательность CpG может быть направлена на TLR9, а именно к мотиву GTCGTT или TTCGTT [106]. Последовательность CpG, а именно CpG-A ODN, может специфично индуцировать Thl иммунный ответ, или такая как CpG-B ODN может быть более специфичной для индукции B-клеточного ответа. CpG-A и CpG-B ODN обсуждают в ссылках 107-109. Предпочтительно CpG представляет собой CpG-A ODN.
Предпочтительно олигонуклеотид CpG сконструирован таким образом, что 5'-конец доступен для рецепторного узнавания. Необязательно, две олигонуклеотидные последовательности CpG могут быть привязаны своими 3'-концами, образуя "иммуномеры". См., например, ссылки 106 и 110-112.
Бактериальные АДФ-рибозилирующие токсины и их детоксифицированные производные можно применять в качестве адъювантов по изобретению. Предпочтительно белок получают из E.coli (термолабильный энтеротоксин E.coli "LT"), холерных вибрионов ("CT") или коклюшных бактерий ("PT"). Применение детоксифицированных АДФ-рибозилирующих токсинов в качестве адъювантов для слизистой оболочки описывают в ссылке 113, и в качестве адъювантов для парентерального введения в ссылке 114. Токсин или анатоксин предпочтительно находится в форме голотоксина, содержащего субъединицы A и B. Предпочтительно субъединица A содержит детоксифицирующую мутацию; предпочтительно субъединица B не мутирована. Предпочтительно адъювант представляет собой детоксифицированный мутант LT, такой как LT-K63, LT-R72 и LT-G192. Применение АДФ-рибозилирующих токсинов и их детоксифицированных производных, особенно LT-K63 и LT-R72, в качестве адъювантов можно обнаружить в ссылках 115-122. Числовая ссылка для замен аминокислот, предпочтительно основанная на расположении субъединиц A и B АДФ-рибозилирующих токсинов, сформулирована в ссылке 123, конкретно включенной сюда полностью в качестве ссылки.
F. Человеческие иммуномодуляторы
Человеческие иммуномодуляторы, пригодные для применения в качестве адъювантов по изобретению, включают в себя цитокины, такие как интерлейкины (например, IL-1, IL-2, IL-4, IL-5, IL-6, IL-7, IL-12 и т.д.) [124], интерфероны (например, интерферон- ), макрофагальный колониестимулирующий фактор и фактор некроза опухоли. ), макрофагальный колониестимулирующий фактор и фактор некроза опухоли.
G. Биоадгезивы и мукоадгезивы
Биоадгезивы и мукоадгезивы также можно применять в качестве адъювантов по изобретению. Пригодные биоадгезивы включают в себя микросферы с эстерифицированной гиалуроновой кислотой [125] или мукоадгезивы, такие как поперечно сшитые производные поли(акриловой кислоты), поливинилового спирта, поливинилпирролидона, полисахаридов и карбоксиметилцеллюлозы. Хитозан и его производные также можно применять в качестве адъювантов по изобретению [126].
H. Микрочастицы
Микрочастицы также можно применять в качестве адъювантов по изобретению. Микрочастицы (т.е. частица в диаметре от ~100 нм до ~150 мкм, более предпочтительно от ~200 нм до ~30 мкм в диаметре и наиболее предпочтительно от ~500 нм до ~l0 мкм в диаметре), образованные из биоразлагаемых и нетоксичных веществ (например, из поли( -оксикислоты), полигидроксимасляной кислоты, полиортоэфира, полиангидрида, поликапролактона и т.д.) предпочтительно с поли(лактид-ко-гликолидом), необязательно обработанным для получения отрицательно заряженной поверхности (например, SDS) или для получения положительно заряженной поверхности (например, катионным детергентом, таким как CTAB). -оксикислоты), полигидроксимасляной кислоты, полиортоэфира, полиангидрида, поликапролактона и т.д.) предпочтительно с поли(лактид-ко-гликолидом), необязательно обработанным для получения отрицательно заряженной поверхности (например, SDS) или для получения положительно заряженной поверхности (например, катионным детергентом, таким как CTAB).
I. Липосомы (главы 13 и 14 ссылки 75)
Пригодные для применения в качестве адъювантов примеры препаратов липосом описаны в ссылках 127-129.
J. Эфир полиоксиэтилена и препараты эфира полиоксиэтилена
Пригодные для применения по изобретению адъюванты включают в себя эфиры полиоксиэтилена и сложные эфиры полиоксиэтилена [130]. Такие препараты дополнительно включают в себя поверхностно-активные вещества на основе сложных эфиров полиоксиэтиленсорбитана в сочетании с октоксинолом [131], а также алкиловые эфиры полиоксиэтилена или поверхностно-активные вещества на основе сложного эфира в сочетании с, по меньшей мере, одним дополнительным неионным сурфактантом, таким как октоксинол [132]. Предпочтительно сложные эфиры полиоксиэтилена выбирают из следующей ниже группы: полиоксиэтилен-9-лауриловый эфир (лаурет 9), полиоксиэтилен-9-стеориловый эфир, полиоксиэтилен-8-стеориловый эфир, полиоксиэтилен-4-лауриловый эфир, полиоксиэтилен-35-лауриловый эфир и полиоксиэтилен-9-лауриловый эфир.
K. Полифосфазен (PCPP)
Препараты PCPP описаны, например, в ссылках 133 и 134.
L. Мурамиловые пептиды
Примеры мурамиловых пептидов, пригодных для применения в качестве адъювантов по изобретению, включают в себя N-ацетилмурамил-L-треонил-D-изоглутамин (thr-MDP), N-ацетил-нормурамил-L-аланил-D-изоглутамин (nor-MDP) и N-ацетилмурамил-L-аланил-D-изоглутаминил-L-аланин-2-(1'-2'-дипальмитоил-sn-глицеро-3-гидроксифосфорилокси)этиламин (MTP-PE).
M. Соединения имидазохинолона
Примеры соединений имидазохинолона, пригодных для применения в качестве адъювантов по изобретению, включают в себя Imiquamod и его гомологи (например, "Resiquimod 3M"), описанный далее в ссылках 135 и 136.
Изобретение также может относиться к сочетанию аспектов одного или нескольких идентифицированных выше адъювантов. Например, следующие композиции адъювантов можно применять по изобретению: (1) сапонин и эмульсию типа масло-в-воде [137]; (2) сапонин (например, QS21) + нетоксичное производное LPS (например, 3dMPL) [138]; (3) сапонин (например, QS21) + нетоксичное производное LPS (например, 3dMPL) + холестерин; (4) сапонин (например, QS21) + 3dMPL + IL-12 (необязательно + стирол) [139]; (5) сочетания 3dMPL с, например, QS21 и/или эмульсиями типа масло-в-воде [140]; (6) SAF, содержащий 10% сквалена, 0,4% Tween 80TM, 5% плуроник блок-сополимер полиоксиэтилена L121 и thr-MDP, или микрофлюидизированный в субмикронную эмульсию или встряхнутый для образования эмульсии с большим размером частиц, (7) адъювантная система Ribi (RAS), (Ribi Immunochem), содержащая 2% сквалена, 0,2% Tween 80 и один или более компонентов клеточной стенки бактерии из группы, состоящей из монофосфориллипида А (MPL), трегалозы димиколата (TDM) и скелета клеточной стенки (CWS), предпочтительно, MPL + CWS (DetoxTM); и (8) одну или несколько минеральных солей (таких как алюминиевая соль) + нетоксичное производное LPS (такое как 3dMPL). (RAS), (Ribi Immunochem), содержащая 2% сквалена, 0,2% Tween 80 и один или более компонентов клеточной стенки бактерии из группы, состоящей из монофосфориллипида А (MPL), трегалозы димиколата (TDM) и скелета клеточной стенки (CWS), предпочтительно, MPL + CWS (DetoxTM); и (8) одну или несколько минеральных солей (таких как алюминиевая соль) + нетоксичное производное LPS (такое как 3dMPL).
Другие вещества, действующие как иммуностимулирующие средства, описаны в главе 7 ссылки 75.
Соли алюминия и фосфата кальция предпочтительны для адъювантов для парентерального введения. Мутантные токсины предпочтительны для адъювантов для слизистой оболочки.
Предпочтительны композиции по изобретению, включающие в себя адъювант с фосфатом алюминия. Гидроксид алюминия предпочтительно отсутствует. Адъювант с фосфатом алюминия может включать в себя приблизительно 0,6 мг Al3+ в мл.
Сочетания иммуногенов
Композиции по изобретению могут содержать модифицированный по изобретению менингококковый капсульный сахарид серогруппы W135 и модифицированный по изобретению менингококковый капсульный сахарид серогруппы Y.
Другие антигены также могут быть включены в композиции по изобретению. Таким образом, изобретение относится к композиции, включающей в себя модифицированный по изобретению менингококковый капсульный сахарид серогруппы W135 и/или модифицированный по изобретению менингококковый капсульный сахарид серогруппы Y и дополнительно включающий в себя один или несколько антиген(ов), выбранный из следующего списка:
- капсульный сахаридный антиген серогруппы A N.meningitides,
- капсульный сахаридный антиген серогруппы C N.meningitides,
- белковый антиген серогруппы B N.meningitidis, такой как белковые антигены в ссылках от 141 до 150,
- препараты микровезикул серогруппы B N.meningitidis [151], 'природные OMV' [152], везикулы или везикулы наружной мембраны [например, ссылки от 153 до 158 и т.д.]. Их можно получать из бактерий, которых подвергали генетическим манипуляциям [159-162], например, для повышения иммуногенности (например, повышенная экспрессия иммуногенов), для снижения токсичности, для ингибирования синтеза капсульного полисахарида, для снижения экспрессии PorA и т.д. Их можно получать из везикулярных штаммов [163-166]. Везикулы из непатогенных Neisseria могут быть включены [167]. OMV можно получать без применения детергентов [168, 169]. Они могут экспрессировать не принадлежащие Neisseria белки на своей поверхности [170]. Они могут быть лишены LPS. Их можно смешивать с рекомбинантными антигенами [153, 171]. Для везикул из бактерий с разным классом I подтипов белков внешней мембраны можно применять, например, шесть различных подтипов [172, 173] с применением созданных способами генетической инженерии двух различных популяций, каждая из которых обнаруживает три подтипа, или девять различных подтипов с применением трех различных популяций, созданных способами генетической инженерии, каждая из которых обнаруживает три подтипа, и т.д. Полезные подтипы включают в себя P1.7,16; P1.5-1,2-2; P1.19,15-1; P1.5-2,10; P1.12-1,13; P1.7-2,4; P1.22,14; P1.7-1,1; P1.18-1,3,6,
- сахаридный антиген из Haemophilus influenzae B [например, 174],
- антиген из Streptococcus pneumoniae [например, 208, 209, 210],
- антиген из вируса гепатита A, такой как инактивированный вирус [например, 175, 176],
- антиген из вируса гепатита B, такой как поверхностный и/или ядерный антигены [например, 176, 177],
- антиген из Bordetella pertussis, такой как голотоксин коклюша (PT), и нитевидный гемагглютинин (FHA) из B.pertussis, необязательно также в сочетании с пертактином и/или агглютиногенами 2 и 3 [например, ссылки 178 и 179]. Клеточные антигены коклюша можно применять,
- дифтерийный антиген, такой как дифтерийный токсоид [например, глава 3 ссылки 180], например, мутант CRM197 [например, ссылка 181],
- антиген столбняка, такой как столбнячный токсоид [например, глава 4 ссылки 180],
- антиген(ы) полиомиелита [например, ссылки 182, 183], такой как IPV.
Токсичные белковые антигены можно детоксифицировать, где необходимо (например, детоксикация коклюшного токсина посредством химических и/или генетических способов [179]).
Когда дифтерийный антиген включен в фармацевтическую композицию, предпочтительно также включить антиген столбняка и коклюшные антигены. Сходным образом, когда включен антиген столбняка, предпочтительно также включить дифтерийный и коклюшный антигены.
Антигены в фармацевтических композициях, как правило, представлены в концентрациях, по меньшей мере, 1 мкг/мл каждого. Как правило, концентрация любого данного антигена достаточна для того, чтобы вызвать иммунный ответ против этого антигена.
Антигены предпочтительно адсорбируют на адъюванте с алюминиевой солью.
В качестве альтернативы применению белковых антигенов в фармацевтической композиции по изобретению можно применять нуклеиновую кислоту, кодирующую антиген [например, ссылки от 184 до 192]. Белковые компоненты фармацевтических композиций по изобретению можно, таким образом, заменять нуклеиновой кислотой (предпочтительно ДНК, например, в форме плазмиды), кодирующей белок. Сходным образом, композиции по изобретению могут содержать белки, имитирующие сахаридные антигены, например, мимеотопы [193] или антиидиотипические антитела. Они могут замещать отдельные компоненты сахаридов или могут дополнять их. В качестве примера вакцина может содержать пептид, имитирующий капсульный полисахарид MenC [194] или MenA [195] вместо самого сахарида.
Комбинированные менингококковые вакцины
Предпочтительные композиции по изобретению содержат модифицированный менингококковый капсульный сахарид серогруппы W135 по изобретению, модифицированный менингококковый капсульный сахарид серогруппы Y по изобретению и капсульный сахарид серогруппы C, где капсульные сахариды конъюгированы с белками-носителями. Композиция может также включать в себя капсульный сахарид серогруппы А, предпочтительно конъюгированный с белком-носителем. Сахариды в этих композициях предпочтительно представляют собой олигосахариды. Конъюгаты олигосахаридов можно получать, как сообщают в ссылке 14.
Сахариды серогруппы А могут быть О-ацетилированы или де-О-ацетилированы. Сахариды серогруппы C могут быть О-ацетилированы или де-О-ацетилированы.
Предпочтительные конъюгаты MenC включают в себя, основываясь на 10 мкг сахарида, 12,5-25 мкг носителя CRM197. Предпочтительные конъюгаты MenА включают в себя, основываясь на 10 мкг сахарида, 12,5-33 мкг носителя CRM197.
Как правило, дозы для конъюгатов MenC и MenA те же, что и для MenW135 и MenY, т.е. от 1 мкг до 20 мкг, например, приблизительно 1 мкг, приблизительно 2,5 мкг, приблизительно 4 мкг, приблизительно 5 мкг или приблизительно 10 мкг.
Предпочтительные соотношения (масс./масс.) для сахаридов из серогрупп C:W135:Y представляют собой 1:1:1; 1:1:2; 1:1:1; 2:1:1; 4:2:1; 2:1:2; 4:1:2; 2:2:1 и 2:1:1. Предпочтительные соотношения для сахаридов из серогрупп A:C:W135:Y представляют собой 1:1:1:1; 1:1:1:2; 2:1:1:1; 4:2:1:1; 8:4:2:1; 4:2:1:2; 8:4:1:2; 4:2:2:1; 2:2:1:1; 4:4:2:1; 2:2:1:2; 4:4:1:2; и 2:2:2:1. По существу, предпочтительно применять равную массу каждого сахарида на дозу.
Когда композиция включает в себя сахарид серогруппы A, его можно получать посредством восстановления сахарида серогруппы A из лиофилизированной формы с применением водной композиции, включающей в себя один или несколько сахаридов серогруппы C, W135 и/или Y.
Когда композиция включает в себя сахарид серогруппы A, это может быть модифицированный сахарид, в котором одна или несколько гидроксильных групп на нативном сахариде были замещены блокирующей группой [196]. Эта модификация повышает устойчивость к гидролизу. Предпочтительно, чтобы все или в основном все моносахаридные единицы могли иметь замены блокирующими группами.
Так же как и включая в себя сахаридные антигены из серогрупп Y, W135 и C (и необязательно A), композиции по изобретению могут включать в себя один или несколько антигенов из серогруппы B. В отличие от этого, капсульный сахарид MenB непригоден для применения как иммуноген у людей из-за своего сходства с их антигенами. Если нужно применять сахаридный антиген для MenB, следовательно, необходимо использовать модифицированный сахарид, такой как сахарид, в котором N-ацетильные группы в остатках сиаловых кислот сахарида заменены N-ацильными группами. Пригодными N-ацильными группами являются ацильные группы от C1 до C8, такие как N-пропионил [197]. Однако вместо применения сахаридного антигена предпочтительно применение полипептидного антигена.
Таким образом, композиция может включать в себя один или несколько полипептидных антигенов, индуцирующий(их) иммунный ответ, защищающий против инфекции MenB. Более широко, композиция может после введения в субъекта индуцировать в субъекте ответ посредством антител, являющихся бактерицидными против двух или более (например, 2 или 3) линий с повышенной вирулентностью A4, ET-5 и линии 3 серогруппы B N.meningitidis.
Опубликована геномная последовательность серогруппы B N.meningitidis [148] и из кодируемых полипептидов можно выделить пригодные антигены [150]. Примеры антигенов сообщают в ссылках от 141 до 150. предпочтительные композиции включают в себя один или несколько из следующих пяти антигенов [198]: (1) белок 'NadA', предпочтительно в олигомерной форме (например, в тримерной форме); (2) белок '741'; (3) белок '936'; (4) белок '953' и (5) белок '287'.
Прототипические последовательности для этих пяти белков установлены в ссылке 143, как следует ниже из таблицы 1
Таблица 1

При применении в композициях по изобретению белок серогруппы B может содержать аминокислотную последовательность одной из этих прототипических последовательностей или может содержать аминокислотную последовательность, которая (a) имеет 50% или более идентичности (например, 60%, 70%, 80%, 90%, 95%, 99% или более) с прототипической последовательностью; и/или (b) содержит фрагмент, по меньшей мере, n последовательных аминокислот прототипической последовательности, где n равно 7 или более (например, 8, 10, 12, 14, 16, 18, 20, 25, 30, 35, 40, 50, 60, 70, 80, 90, 100, 150, 200, 250 или более). Предпочтительные фрагменты для (b) отсутствие одной или нескольких аминокислот (например, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 15, 20, 25 или более) от C-конца и/или N-конца прототипической последовательности. Другие предпочтительные фрагменты содержат эпитоп последовательности.
Эти пять антигенов MenB могут быть представлены в композиции как пять отдельных белков, но предпочтительно, что, по меньшей мере, два из антигенов экспрессированы в виде одноцепочечного полипептида ('гибридный' белок [ссылки 145-147]), т.е. так, что пять антигенов формируют менее чем пять полипептидов. Гибридные белки характеризуются двумя принципиальными преимуществами: во-первых, белку, который может быть нестабильным или слабо экспрессированным у своего хозяина, можно способствовать посредством добавления пригодного гибридного партнера, который решит проблему; во-вторых, упрощается коммерческое получение, так как необходимо использовать только одну экспрессию и очистку, чтобы произвести два отдельно полезных белка. Включенный в композицию по изобретению гибридный белок может содержать два или несколько (т.е. 2, 3, 4 или 5) из пяти основных антигенов. Предпочтительны гибриды, состоящие из двух из пяти антигенов, например, включающие в себя NadA и 741; NadA и 936; NadA и 953; NadA и 287; 741 и 936; 741 и 953; 741 и 287; 936 и 953; 936 и 287; 953 и 287.
Три предпочтительных антигена MenB для комбинированного включения в композиции по изобретению представляют собой:

Как отмечено выше, композиции по изобретению, включающие в себя антигены MenB, могут индуцировать сывороточный ответ антителами, что эффективно против двух или трех MenB гипервирулентных линий A4, ET-5 и линии 3. Кроме того, они могут индуцировать бактерицидные ответы антител против одного или нескольких гипервирулентных линий подгруппы I, подгруппы III, подгруппы IV-1 или комплекса ET-37, и против других линий, например гиперинвазивных линий. Эти ответы антителами удобно измеряют у мышей и представляют собой индикатор эффективности вакцины [например, см. заключительное примечание 14 ссылки 150]. Композиция не должна вызывать бактерицидные антитела против каждого и любого штамма MenB без этих гипервирулентных линий; скорее, для любой данной группы из четырех или более менингококковых штаммов серогруппы B без конкретной гипервирулентной линии антитела индуцируют посредством композиции, являющейся бактерицидной против, по меньшей мере, 50% (например, 60%, 70%, 80%, 90% или более) группы. Предпочтительные группы штаммов включают в себя штаммы, выделенные, по меньшей мере, в четырех из следующих стран: GB, AU, CA, NO, IT, US, NZ, NL, BP и CU. Сыворотка предпочтительно имеет бактериальный титр, по меньшей мере, 1024 (например, 210, 211, 212, 213, 214, 215, 216, 217, 218 или выше, предпочтительно, по меньшей мере, 214), т.е. сыворотка способна убить, по меньшей мере, 50% тестируемых бактерий конкретного штамма при разведении 1/1024, как описано в ссылке 150. Предпочтительные композиции могут индуцировать бактерицидные ответы против следующих штаммов менингококковой серогруппы B: (i) из кластера A4, штамма 961-5945 (B:2b:P1.21,16) и/или штамма G2136 (B:-); (ii) из ET-5 комплекса, штамма MC58 (B:15:P1.7,16b) и/или штамма 44/76 (B:15:P1.7,16); (iii) из линии 3, штамма 394/98 (B:4:P1.4) и/или штамма BZ198(B:NT:-). Более предпочтительные композиции могут индуцировать бактерицидные ответы против штаммов 961-5945, 44/76 и 394/98. Штаммы 961-5945 и G2136 представляют собой референсные штаммы Neisseria MLST [ids 638 и 1002 в ссылке 199]. Штамм MC58 широко доступен (например, ATCC BAA-335) и является штаммом, секвенированным по ссылке 148. Штамм 44/76 широко применяют, и охарактеризован (например, ссылка 200), и представляет собой один из Neisseria MLST референсных штаммов [id 237 в ссылке 199; ряд 32 таблицы 2 в ссылке 201]. Штамм 394/98 впервые выделили в Новой Зеландии в 1998 г., и там напечатано несколько исследований с применением этого штамма (например, ссылки 202 и 203). Штамм BZ198 представляет собой еще один референсный штамм [id 409 в ссылке 199; ряд 41 таблицы 2 в ссылке 201]. Кроме того, композиция может индуцировать бактерицидный ответ против серогруппы W135 штамма LNP17592 (W135:2a:P1.5,2) из комплекса ET-37. Этот штамм Haji выделен во Франции в 2000 г.
Другие полипептидные антигены MenB, которые могут быть включены в композиции по изобретению, включают в себя полипептидные антигены MenB, содержащие одну из следующих аминокислотных последовательностей: SEQ ID NO: 650 из ссылки 141; SEQ ID NO: 878 из ссылки 141; SEQ ID NO: 884 из ссылки 141; SEQ ID NO: 4 из ссылки 142; SEQ ID NO: 598 из ссылки 143; SEQ ID NO: 818 из ссылки 143; SEQ ID NO: 864 из ссылки 143; SEQ ID NO: 866 из ссылки 143; SEQ ID NO: 1196 из ссылки 143; SEQ ID NO: 1272 из ссылки 143; SEQ ID NO: 1274 из ссылки 143; SEQ ID NO: 1640 из ссылки 143; SEQ ID NO: 1788 из ссылки 143; SEQ ID NO: 2288 из ссылки 143; SEQ ID NO: 2466 из ссылки 143; SEQ ID NO: 2554 из ссылки 143; SEQ ID NO: 2576 из ссылки 143; SEQ ID NO: 2606 из ссылки 143; SEQ ID NO: 2608 из ссылки 143; SEQ ID NO: 2616 из ссылки 143; SEQ ID NO: 2668 из ссылки 143; SEQ ID NO: 2780 из ссылки 143; SEQ ID NO: 2932 из ссылки 143; SEQ ID NO: 2958 из ссылки 143; SEQ ID NO: 2970 из ссылки 143; SEQ ID NO: 2988 из ссылки 143 или полипептид, содержащий аминокислотную последовательность, которая (a) имеет 50% или более идентичности (например, 60%, 70%, 80%, 90%, 95%, 99% или более) с указанным сиквенсом; и/или (b) содержит фрагмент из, по меньшей мере, n последовательных аминокислот из указанных последовательностей, где n представляет собой 7 или более (например, 8, 10, 12, 14, 16, 18, 20, 25, 30, 35, 40, 50, 60, 70, 80, 90, 100, 150, 200, 250 или более). Предпочтительно фрагменты для (b) содержат эпитоп из соответствующей последовательности. Более одного из этих полипептидов (например, 2, 3, 4, 5, 6) могут быть включены.
Сочетания с сахаридами Hib
Где композиция включает в себя антиген H.influenzae типа B, как правило, антигеном является капсульный сахаридный антиген Hib. Сахаридные антигены из H.influenzae b хорошо известны.
Альтернативно, сахарид Hib успешно ковалентно конъюгирован с белком-носителем для повышения его иммуногенности, особенно у детей. В общем, получение конъюгатов полисахарида и капсульного полисахарида Hib, в частности, хорошо задокументировано. По изобретению можно применять любой пригодный конъюгат Hib. Пригодные белки-носители описаны выше, и предпочтительными носителями для сахаридов Hib являются CRMI97 ('HbOC'), токсоид столбняка ('PRP-T') и комплекс наружной мембраны N.meningitidis ('PRP-OMP').
Сахаридная часть конъюгата может представлять собой полисахарид (например, полный полирибозилрибитол фосфат (PRP)), но предпочтительно гидролизовать полисахариды для формирования олигосахаридов (например, MW от ~1 до ~5 кДа).
Предпочтительно конъюгат содержит олигосахарид Hib, ковалентно связанный с CRM197 через линкер адипиновой кислоты [16, 204]. Токсоид столбняка также является предпочтительным носителем.
Введение антигена Hib предпочтительно приводит к концентрации антител к PRP 0,15 мкг/мл и более предпочтительно 0,15 мкг/мл и более предпочтительно  1 мкг/мл. 1 мкг/мл.
Где композиция включает в себя сахаридный антиген Hib, предпочтительно, чтобы она также не включала в себя адъюванта с гидроксидом алюминия. Если композиция включает в себя адъювант с фосфатом алюминия, тогда можно адсорбировать антиген Hib к адъюванту [205] или он может быть не адсорбированным [206]. Предотвратить адсорбцию можно выполнением посредством выбора корректного pH при смешивании антигена/адъюванта адъюванта с соответствующей точкой нулевого заряда и соответствующей степенью смешивания для многих различных антигенов в композиции [207].
Композиции по изобретению могут включать в себя более одного антигена Hib. Антигены Hib можно лиофилизировать, например, для восстановления менингококковых композиций по изобретению.
Сочетания с пневмококковыми антигенами
Где композиция включает в себя антиген S.pneumoniae, как правило, это капсульный сахаридный антиген, который предпочтительно конъюгирован с белком-носителем [например, ссылки от 208 до 210]. Предпочтительно он включает в себя сахариды из более одного серотипа S.pneumoniae. Например, широко применяют смеси полисахаридов из 23 различных серотипов в виде конъюгатных вакцин с полисахаридами из от 5 до 11 различных серотипов [211]. Например, PrevNar [212] содержит антигены из семи серотипов (4, 6B, 9V, 14, 18C, 19F и 23F) с каждым сахаридом, отдельно конъюгированным с CRMl97 посредством восстановительного аминирования с 2 мкг каждого сахарида на 0,5 мл дозы (4 мкг серотипа 6B) и конъюгатами, адсорбированными на адъюванте с фосфатом алюминия. Композиции по изобретению предпочтительно включают в себя, по меньшей мере, серотипы 6B, 14, 19F и 23F. Конъюгаты можно адсорбировать на фосфате алюминия. [212] содержит антигены из семи серотипов (4, 6B, 9V, 14, 18C, 19F и 23F) с каждым сахаридом, отдельно конъюгированным с CRMl97 посредством восстановительного аминирования с 2 мкг каждого сахарида на 0,5 мл дозы (4 мкг серотипа 6B) и конъюгатами, адсорбированными на адъюванте с фосфатом алюминия. Композиции по изобретению предпочтительно включают в себя, по меньшей мере, серотипы 6B, 14, 19F и 23F. Конъюгаты можно адсорбировать на фосфате алюминия.
В качестве альтернативы применению сахаридных антигенов из пневмококков композиция может включать в себя один или несколько полипептидных антигенов. Геномные последовательности для некоторых штаммов пневмококков доступны [213, 214] и могут быть подвергнуты обратной вакцинации [215-218] для идентификации пригодных полипептидных антигенов [219, 220]. Например, композиция может включать в себя один или несколько из следующих антигенов: PhtA, PhtD, PhtB, PhtE, SpsA, LytB, LytC, LytA, Spl25, Spl01, Spl28, Spl30 и Spl30, как определено в ссылке 221. Композиция может включать в себя более одного из этих антигенов (например, 2, 3, 4, 5, 6, 7, 8, 9 10, 11, 12, 13 или 14).
В некоторых вариантах осуществления композиция может включать в себя сахаридные и полипептидные антигены из пневмококков. Их можно применять в простых смесях или пневмококковый сахаридный антиген можно конъюгировать с пневмококковым белком. Пригодные белки-носители по таким вариантам осуществления включают в себя антигены, перечисленные в предыдущем параграфе [221].
Пневмококковые антигены можно лиофилизировать, например, вместе с антигеном Hib.
Способы лечения
Изобретение также относится к способу индукции образования антител у млекопитающих, где способ включает в себя введение млекопитающему фармацевтической композиции по изобретению.
Изобретение относится к способу индукции иммунного ответа у млекопитающего, где способ включает в себя стадию введения эффективного количества композиции по изобретению. Иммунный ответ предпочтительно является протективным и предпочтительно в него вовлечены антитела. Способ может индуцировать вторичный ответ.
Млекопитающее предпочтительно представляет собой человека. В тех случаях, когда вакцина предназначена для профилактического применения, человек предпочтительно представляет собой ребенка (например, начинающий ходить ребенок или младенец) или подростка; в тех случаях, когда вакцина предназначена для терапевтического применения, человек предпочтительно представляет собой взрослого. Предназначенную для ребенка вакцину также можно вводить взрослым, например, для оценки безопасности, дозировки, иммуногенности и т.д.
Изобретение также относится к композиции по изобретению для применения в качестве лекарственного средства. Лекарственное средство предпочтительно способно индуцировать иммунный ответ у млекопитающего (т.е. оно представляет собой иммуногенную композицию), а более предпочтительно оно является вакциной.
Изобретение также относится к применению модифицированного менингококкового капсульного сахарида серогруппы W135 по изобретению и/или модифицированного менингококкового капсульного сахарида серогруппы Y по изобретению при получении лекарственного средства для индукции иммунного ответа у млекопитающего. Сахариды предпочтительно являются конъюгированными. Лекарственное средство предпочтительно является вакциной.
Эти применения и способы предпочтительно предназначены для профилактики и/или лечения заболевания, вызванного Neisseria (например, meningitis, septicaemia, bacteremia, gonorrhoea и т.д.). Предпочтительны профилактика и/или лечение бактериального и/или менингококкового менингита.
Один из способов проверки эффективности терапевтического лечения включает в себя мониторинг инфекции Neisseria после введения композиции по изобретению. Один из способов проверки эффективности профилактического лечения включает в себя мониторинг иммунного ответа на пять основных антигенов после введения композиции. Иммуногенность композиций по изобретению можно определить введением их тестовым субъектам (например, детям в возрасте 12-16 месяцев или в моделях на животных [222]), а затем определением стандартных параметров, включающих сывороточную бактериальную активность и титры ELISA (GMT) общих IgG и высокоавидных IgG к капсуле. Этот иммунный ответ, по меньшей мере, определяют приблизительно через 4 недели после введения композиции и сравнивают со значениями, определенными до введения композиции. SBA измеряет уничтожение бактерий, опосредуемое комплементом, и его можно оценить с применением человеческого или кроличьего комплемента. Стандарты ВОЗ требуют, чтобы вакцина индуцировала, по меньшей мере, 4-кратное повышение SBA у более чем 90% реципиентов. Предпочтительно увеличение SBA, по меньшей мере, от 4 до 8 раз. Когда вводят более чем одну дозу композиции, можно проводить более чем одно определение после введения.
Предпочтительные композиции по изобретению могут обеспечивать титр антител у пациента, превышающий критерий для серопротекции для каждого антигенного компонента для приемлемого процента пациентов. Антигены с указанным выше ассоциированным титром антител, которые, как полагают, проводят сероконверсию хозяина к антигену, хорошо известны, а такие титры публикуются такими организациями, как ВОЗ. Предпочтительно более чем 80% статистически значимой выборки субъектов сероконвертированно, более предпочтительно - более чем 90%, даже более предпочтительно - более чем 93% и наиболее предпочтительно 96-100%.
Композиции по изобретению, как правило, вводят прямо пациенту. Прямую доставку можно проводить посредством парентеральной инъекции (например, подкожно, интраперитонеально, внутривенно, внутримышечно или в интерстициальное пространство ткани) или посредством ректального, перорального, вагинального, топического, трансдермального, интраназального, глазного, ушного, легочного или другого слизистого введения. Предпочтительно внутримышечное введение в бедро или плечо. Инъекцию можно проводить иглой (например, игла для подкожных инъекций), но, альтернативно, можно применять безыгольную инъекцию. Типичная внутримышечная доза составляет 0,5 мл.
Изобретение можно применять для вызова системного и/или слизистого иммунитета.
Протокол дозирования при лечении может представлять собой введение однократной дозы или многократной дозы. Многократные дозы можно применять в протоколе первичной иммунизации и/или в протоколе вторичной иммунизации. За протоколом первичного дозирования может следовать протокол вторичного дозирования. Выбор подходящего времени между первичным дозированием (например, от 4 до 16 недель), и между первичным и вторичным дозированием можно определить обычным способом.
Инфекции Neisseria поражают различные области организма и, таким образом, композиции по изобретению можно получать в различных формах. Например, композиции можно получать в виде инъецируемых препаратов или в виде жидких растворов или суспензий. Также можно получать твердые формы, пригодные для растворения или суспендирования в жидких носителях до инъекции (например, лиофилизированные композиции). Можно получать композицию для топического введения, например, в виде мази, крема или порошка. Можно получать композицию для перорального введения, например, в виде таблетки или капсулы или в виде сиропа (необязательно ароматизированного). Можно получать композицию для легочного введения, например, в виде ингалятора с применением тонкодисперсного порошка или аэрозоля. Можно получать композицию в виде суппозитория или пессария. Можно получать композицию для назального, ушного или глазного введения например, в виде аэрозоля, капель, геля или порошка [например, ссылки 223 и 224]. Сообщалось об успехе назального введения пневмококковых сахаридов [225, 226], пневмококковых полипептидов [227], сахаридов Hib [228], сахаридов MenC [229] и смесей конъюгатов сахаридов Hib и MenC [230].
Общие положения
Термин "содержащий" означает "включающий в себя", а также "состоящий из", например, композиция, "содержащая" X, может состоять исключительно из X или может включать в себя что-либо дополнительное, например, X+Y.
Выражение "в значительной степени" не исключает "полностью", например, композиция, "в значительной степени очищенная" от Y, может совсем не содержать Y. Когда необходимо, выражение "в значительной степени" можно изъять из определения по изобретению.
Термин "приблизительно" в отношении числовых значений означает, например, x±10%.
Такие выражения как " x% остатков сиаловых кислот в сахариде являются O-ацетилированными в 7 положении" не означают того, что каждая молекула сахарида в композиции должна обязательно обладать одинаковой степенью O-ацетилирования в положении 7. Это также не означает, что каждая молекула сахарида в композиции должна обязательно иметь x% остатков сиаловых кислот в сахариде являются O-ацетилированными в 7 положении" не означают того, что каждая молекула сахарида в композиции должна обязательно обладать одинаковой степенью O-ацетилирования в положении 7. Это также не означает, что каждая молекула сахарида в композиции должна обязательно иметь  x% O-ацетилирования в положении 7. Более правильно, что некоторые имеют >x%, тогда как другие имеют <x%, но средний уровень ацетилирования среди всех положений 7 всех остатков сиаловой кислоты во всей совокупности сахаридов составляет x% O-ацетилирования в положении 7. Более правильно, что некоторые имеют >x%, тогда как другие имеют <x%, но средний уровень ацетилирования среди всех положений 7 всех остатков сиаловой кислоты во всей совокупности сахаридов составляет  x%. Это же применяется для выражений, подобных " x%. Это же применяется для выражений, подобных " y% остатков сиаловых кислот в сахариде являются O-ацетилированными в 9 положении" и сходных с ними. y% остатков сиаловых кислот в сахариде являются O-ацетилированными в 9 положении" и сходных с ними.
Необходимо понимать, что циклические сахара могут существовать в открытой или закрытой форме и что, хотя в структурной формуле показаны закрытые формы, изобретение также относится к открытым формам.
Сиаловая кислота также известна как нейраминовая кислота.
Краткое описание чертежей
На фиг.1 и 2 показан аннотированный спектр ЯМР, гидролизованных MenW135 и MenY соответственно.
На фиг.3 и 4 показан статус O-ацетилирования остатков сиаловой кислоты в положениях 7 и 9 в течение получения конъюгатов MenW135-CRM197 и MenY-CRM197 соответственно.
На фиг.5 и 6 показаны титры IgG, полученные у мышей, против олигосахаридных антигенов с применением MenW135 и MenY соответственно.
СПОСОБЫ ОСУЩЕСТВЛЕНИЯ ИЗОБРЕТЕНИЯ
A. Получение и очистка менингококковых полисахаридов
Капсульные полисахариды очищали из MenW135 и MenY, как описано в ссылке 14.
B. Получение модифицированных конъюгатов полисахаридов серогруппы W135 и Y
Очищенные полисахариды гидролизовали в уксусном 50 мМ натрий-ацетатном буфере, pH 4,7 приблизительно в течение 3 часов при 80°C. Это давало в результате олигосахариды со средним DP приблизительно от 15 до 20, как определено посредством соотношения между сиаловой кислотой (SA) и восстановленной терминальной SA.
Гидролизат подвергали ультрафильтрованию через отделяющую 30 кДа мембрану (от 12 до 20 объемов диафильтрации 5 мМ ацетатного буфера/15-30 мМ NaCl, pH 6,5). Концентрат, содержащий молекулы с высокой MМ, отбрасывали, тогда как фильтрат помещали на колонку Q-Sepharose Fast Flow, уравновешенную 5 мМ ацетатным буфером/15мМ NaCl, pH 6,5. Затем колонку промывали 10 CV уравновешивающего буфера для удаления олигосахаридов с DP  3-4 и элюировали 3 CV 5 мМ ацетатного буфера/500 мМ NaCl, pH 6,5. 3-4 и элюировали 3 CV 5 мМ ацетатного буфера/500 мМ NaCl, pH 6,5.
К раствору отсортированных по размеру олигосахаридов добавляли хлорид аммония или ацетат аммония до конечной концентрации 300 г/л, затем добавляли натрий-циано-борогидрид до конечной концентрации 49 г/л или 73 г/л. Затем смесь инкубировали при 50°C в течение 3 суток для получения аминоолигосахаридов, которые затем очищали посредством ультрафильтрации с тангенциальным потоком с отделяющей 1 кДа или 3 кДа мембраной с применением 13 объемов диафильтрации 0,5 M NaCl с последующими 7 объемами диафильтрации 20 мМ NaCl. Затем очищенные олигосахариды сушили на роторном испарителе для удаления воды.
Высушенные аминоолигосахариды растворяли в дистиллированной воде при концентрации аминогруппы 40 мМ, затем добавляли 9 объемов DMSO с последующим триэтиламином до конечной концентрации 200 мМ. К полученному в результате раствору добавляли N-гидроксисуксинимидиновый диэфир адипиновой кислоты до конечной концентрации 480 мМ. Реакцию проводили при перемешивании при комнатной температуре в течение 2 часов, затем активированный олигосахарид осаждали ацетоном (конечная концентрация 80% об./об.). Осадок собирали центрифугированием и несколько раз промывали ацетоном для удаления не вступившего в реакцию N-гидроксисуксинимидинового диэфира адипиновой кислоты и побочных продуктов. В завершении активированный олигосахарид сушили под вакуумом. Количество активных сложноэфирных групп, введенных в структуру олигосахарида, определяли колориметрическим способом, как описано в ссылке 231.
Высушенный активированный олигосахарид добавляли к 45 мг/мл раствору CRM197 в 0,01 М фосфатном буфере, pH 7,2 при активном соотношении сложный эфир/белок (моль/моль) 12:1. Реакцию проводили при перемешивании при комнатной температуре в течение ночи. Затем конъюгат очищали посредством диафильтрации через отделяющую 30 кДа мембрану (50 объемов диафильтрации 10 мМ фосфатного буфера, pH 7,2). Очищенный конъюгат стерильно фильтровали и хранили при -20°C или -60°C до формулирования вакцины.
C. Состояние O-ацетилирования полисахаридов в течение конъюгации
Состояние O-ацетилирования в положениях C7 и C9 остатков сиаловой кислоты в совокупности модифицированных сахаридов, полученных из MenW135 и MenY, измеряли с применением анализа ЯМР.
Промежуточные поли- и олигосахариды процесса конъюгации (нативный полисахарид, после гидролиза, до аминирования, после активации и после конъюгации) охарактеризовывали с применением экспериментов по одномерному и двумерному протонному ЯМР. Образцы для 1H ЯМР получали растворением лиофилизированных олигосахаридов в 0,75 мл на 99,9% дейтерированного 2H2O (Aldrich ) с получением 10-15 мМ концентрированных растворов. Во всех экспериментах применяли 5 мм пробирки для ЯМР Wilmad. ) с получением 10-15 мМ концентрированных растворов. Во всех экспериментах применяли 5 мм пробирки для ЯМР Wilmad.
Спектры 1H ЯМР записывали при 298 K на Bruker NMR Spectrometer Avance DRX 600 МГц, оборудованном устройством BGU и с применением стандартных программ импульсов Bruker. Применяли тройной резонансный датчик TBI 5 мм с самоэкранируемыми z-градиентами. Для обработки данных применяли программное обеспечение Bruker XWINNMR 3.0.
Стандартные условия спектрального накопления протонов предназначались для сбора 32 k точек данных в спектральном окне 6000 Гц при 4 сканированиях. Спектры 1H ЯМР после применения функции уширения спектра на 0,1 Гц и соотнесения относительно подвергали преобразованию Фурье монотритиевой воды (HDO) при 4,72 имп./мин.
Соотнесение резонансов и определение, таким образом, молекулярной структуры основывались на литературных данных [232, 4].
Чтобы показать соотнесение пиков, на фиг.1 и 2 представлены аннотируемые спектры ЯМР гидролизованного MenW135 и гидролизованного MenY соответственно.
В следующей таблице 2 дана доля всех сиаловых кислот (N-ацетилнейраминовой кислоты) в положениях C7 и C9 в совокупности сахаридов, полученных из MenW135, которые выявили O-ацетилированными в течение получения конъюгатов:
| Таблица 2 |
| Стадия получения |
% O-ацетилирования
в положении 7 |
% O-ацетилирования
в положении 9 |
| Природный полисахарид |
30,1 |
25,0 |
| После гидролиза |
16,9 |
26,4 |
| До аминирования |
15,0 |
26,2 |
| После активации |
5,1 |
26,3 |
| После конъюгации |
6,3 |
43,1 |
Таким образом, суммарная доля O-ацетилирования сиаловой кислоты в 7 положении в течение получения конъюгата падает приблизительно от 30% до приблизительно 6%. В то же самое время доля O-ацетилирования в 9 положении увеличивается от приблизительно 25% до приблизительно 43% (фиг.3). Существенное изменение, наблюдаемое в положении 9, на конечной стадии, показывает, что при конъюгации выбираются преимущественно те сахариды, которые O-ацетилированы в положении 9.
Подобным образом, состояние O-ацетилирования остатков сиаловой кислоты в совокупности модифицированных сахаридов, полученных из MenY, после каждой стадии процесса конъюгации приведено в следующей таблице 3
| Таблица 3 |
| Стадия получения |
% O-ацетилирования
в положении 7 |
% O-ацетилирования
в положении 9 |
| Природный полисахарид |
10,3 |
28,0 |
| После гидролиза |
3,3 |
24,1 |
| До аминирования |
5,1 |
25,1 |
| После активации |
2,4 |
20,9 |
| После конъюгации |
6,1 |
45,1 |
Таким образом, доля O-ацетилирования сиаловой кислоты в 7 положении в течение получения конъюгата падает приблизительно от 10% до приблизительно 2% до конечного увеличения приблизительно до 6% в течение реакции конъюгации. В то же самое время доля O-ацетилирования в 9 положении падает приблизительно от 28% до приблизительно 21% до конечного увеличения приблизительно до 45% в течение реакции конъюгации (фиг.4). Существенное изменение, наблюдаемое в положении 9, на конечной стадии, показывает, что при конъюгации выбираются преимущественно те сахариды, которые O-ацетилированы в положении 9.
D. Иммуногенность конъюгатов
Замороженные сыпучие конъюгаты подвергали оттаиванию. Каждый растворяли при перемешивании до конечной концентрации 20 мкг сахарида/мл, 5 мМ фосфата, 9 мг/мл NaCl, фосфата алюминия (с получением концентрации Al3+ 0,6 мг/мл), pH 7,2. Затем смеси оставляли без перемешивания при 2-8°C на ночь и дополнительно разводили физиологическим раствором до 4 мкг/мл для иммунизации мышей.
Для обеих серогрупп тем же способом получали второй набор вакцин, но добавление фосфата алюминия заменили тем же объемом воды.
Десяти мышам Balb/c в каждой иммунизируемой группе дважды подкожно инъецировали 0,5 мл вакцины на неделях 0 и 4. Перед иммунизацией за день до второй дозы и через 2 недели после второй дозы проводили забор крови. Иммунизацию проводили (a) конъюгатной вакциной с алюминием и без (b) физиологическим раствором в качестве контроля и (c) неконъюгированным полисахаридом в качестве контроля.
Специфические антитела IgG выявляли в сыворотках иммунизированных животных по существу, как описано в ссылке 233. Каждую индивидуальную мышь анализировали дважды посредством кривой титрования и для каждой иммунизируемой группы подсчитывали GMT. Затем считали титры в Mouse Elisa Units (MEU) с применением программного обеспечения "Titerun" (FDA). Специфичность титра антител к полисахаридам определяли конкурентным ELISA с релевантным полисахаридом в качестве конкурента.
Как показано на фиг.5, конъюгат MenW135 индуцировал у животных высокий титр антител. Как ожидалось, неконъюгированный полисахарид не являлся иммуногенным. Препарат конъюгата с фосфатом алюминия в качестве адъюванта индуцировал больший уровень антител по сравнению с титром, полученным только посредством конъюгата. Сходные результаты наблюдали для MenY (фиг.6).
Сыворотки после инъекции II (Post-II) тестировали на бактериологическую активность с применением анализа in vitro для измерения опосредованного комплементом лизиса бактерий. Перед применением в анализе сыворотки Post-II инактивировали в течение 30 минут при 56°C, а в качестве источника комплемента использовали 25% комплемент детеныша кролика. Бактерицидный титр выражен как реципрокное разведение сыворотки, приводящее к гибели 50% бактерий в отношению к следующим штаммам: MenW135, 5554 (OAc+); MenY, 242975 (OAc+).
Капсульный полисахарид, происходящий из МenW135, не приводил к значению GMT и давал бактерицидную активность только 4. В отличие от этого де-O-ацетилированные конъюгаты по изобретению давали значения GMT от 14 до 565, с бактерицидными титрами от 64 до 2048.
Капсульный полисахарид, происходящий из MenY, не приводил к значению GMT и давал бактерицидную активность только 256. В отличие от этого де-O-ацетилированные конъюгаты по изобретению давали значения GMT от 256 до 1618, с бактерицидными титрами от 256 до 16384.
Следует понимать, что изобретение только описано посредством примеров, и можно проводить модификации, все еще оставаясь в пределах объема и сущности изобретения. В частности, также можно осуществлять незначительные модификации, не влияющие на иммуногенность модифицированного капсульного сахарида по настоящему изобретению.
ССЫЛКИ (содержание которых включено сюда в качестве ссылки)
[1] Патент США 4711779.
[2] Патент США 4761283.
[3] Патент США 4882317.
[4] Lemercinier et al. (1996) Carbohydr. Res. 296: 83-96.
[5] Jones & Lemercinier (2002) J. Pharm. Biomed. Anal. 30: 1233-47.
[6] Claus et al. (2004) Molecular Microbiology 51: 227-39.
[7] Longworth et al. (2002) 13th International Pathogenic Neisseria Conference. Abstract, p. 272.
[8] Longworth et al. (2002) FEMS Immunol. Med. Microbiol. 32: 119-23.
[9] Pollard et al. (2003) Emerging Infectious Diseases 9: 1503-4.
[10] Glode M.P. et al. (1979) J. Infect. Dis. 139:52-56.
[11] WO 94/05325; патент США 5425946.
[12] Berry et al. (2002) Infect. Immun. 70: 3707-13.
[13] Frash (1990) p.123-145 of Advances in Biotechnological Processes vol. 13 (eds. Mizrahi & Van Wezel.
[14] WO 03/007985.
[15] Inzana (1987) Infect. Immun. 55: 1573-1579.
[16] Ravenscroft et al. (1999) Vaccine 17: 2802-2816.
[17] Kandil et al. (1997) Glycoconj J. 14: 13-17.
[18] Berkin et al. (2002) Chemistry 8: 4424-4433.
[19] Ramsay et al. (2001) Lancet 357 (9251): 195-6.
[20] Lindberg (1999) Vaccine 17 Suppl 2: S28-36.
[21] Buttery & Moxon (2000) J. R. Coll. Physicians Lond 34: 163-8.
[22] Ahmad & Chapnick (1999) Infect. Dis. Clin. North. Am. 13: 113-33, vii.
[23] Goldblatt (1998) J. Med. Microbiol. 47: 563-567.
[24] EP-B-0 477 508.
[25] Патент США 5306492.
[26] WO 98/42721.
[27] Dick et al. в Conjugate Vaccines (eds. Cruse et al.) Karger, Basel, 1989, Vol. 10, 48-114.
[28] Hermanson Bioconjugate Techniques, Academic Press, San Diego CA (1996).
[29] Anonymous (Jan. 2002) Research Disclosure, 453077.
[30] Anderson (1983) Infect. Immun. 39(l): 233-238.
[31] Anderson et al. (1985) J. Clin. Invest. 76(l): 52-59.
[32] EP-A-0372501.
[33] EP-A-0378881.
[34] EP-A-0427347.
[35] WO 93/17712.
[36] WO 94/03208.
[37] WO 98/58668.
[38] EP-A-0471177.
[39] WO 91/01146.
[40] Falugi et al.(2001) Eur. J. Immunol. 31: 3816-3824.
[41] Baraldo et al. (2004) Infect. Immun. 72: 4884-7.
[42] EP-A-0594610.
[43] WO 00/56360.
[44] WO 02/091998.
[45] Kuo et al. (1995) Infect. Immun. 63: 2706-13.
[46] WO 01/72337.
[47] WO 00/61761.
[48] WO 2004/083251.
[49] WO 99/42130.
[50] WO 96/40242.
[51] Lees et al. (1996) Vaccine 14: 190-198.
[52] WO 95/08348.
[53] Патент США 4695624.
[54] Mol. Immunol., 1985, 22, 907-919.
[55] EP-A-0208375.
[56] Bethell G.S. et al., J. Biol. Chem., 1979, 254, 2572-4.
[57] Hearn M.T.W., J. Chromatogr., 1981, 218, 509-18.
[58] EP-A-0208375.
[59] EP0720485.
[60] EP0814833.
[61] WO 00/10599.
[62] Gever et al. (1979) Med. Microbiol. Immunol. 165: 171-288.
[63] Патент США 4057685.
[64] Патенты США 4673574 и 4808700.
[65] Патент США 4459286.
[66] Патент США 4965338
[67] Патент США 4663160.
[68] Патент США 4356170.
[69] Lei et al. (2000) Dev. Biol. (Basel) 103: 259-264.
[70] WO 00/38711; патент США 6146902.
[71] WO 00/56365.
[72] Gennaro (2000) Remington: The Science and Practice of Pharmacy. 20th edition, ISBN: 0683306472.
[73] WO 98/20734.
[74] WO 03/009869.
[75] Vaccine design: the subunit and adjuvant approach (1995) Powell & Newman. ISBN 0-306-44867-X.
[76] WO 00/23105.
[77] WO 90/14837.
[78] Патент США 5057540.
[79] WO 96/33739.
[80] EP-A-0109942.
[81] WO 96/11711.
[82] WO 00/07621.
[83] Barr et al. (1998) Advanced Drug Delivery Reviews 32: 247-271.
[84] Sjolanderet et al. (1998) Advanced Drug Delivery Reviews 32: 321-338.
[85] Niikura et al. (2002) Virology 293: 273-280.
[86] Lenz et al. (2001) J. Immunol. 166: 5346-5355.
[87] Pinto et al. (2003) J. Infect. Dis. 188: 327-338.
[88] Gerber et al. (2001) Virol. 75: 4752-4760.
[89] WO 03/024480.
[90] WO 03/024481.
[91] Gluck et al. (2002) Vaccine 20: B10-B16.
[92] EP-A-0689454.
[93] Johnson et al. (1999) Bioorg. Med. Chem. Lett. 9: 2273-2278.
[94] Evans et al. (2003) Expert. Rev. Vaccines 2: 219-229.
[95] Meraldi et al. (2003) Vaccine 21: 2485-2491.
[96] Pajak et al. (2003) Vaccine 21: 836-842.
[97] Kandimalla et al. (2003) Nucleic Acids Research 31: 2393-2400.
[98] WO 02/26757.
[99] WO 99/62923.
[100] Krieg (2003) Nature Medicine 9: 831-835.
[101] McCluskie et al. (2002) FEMS Immunology and Medical Microbiology 32: 179-185.
[102] WO 98/40100.
[103] Патент США 6207646.
[104] Патент США 6239116.
[105] Патент США 6429199.
[106] Kandimalla et al. (2003) Biochemical Society Transactions 31 (part 3): 654-658.
[107] Blackwell et al. (2003) J. Immunol. 170: 4061-4068.
[108] Krieg (2002) Trends Immunol. 23: 64-65.
[109] WO 01/95935.
[110] Kandimalla et al. (2003) BBRC 306: 948-953.
[111] Bhagat et al. (2003) BBRC 300: 853-861.
[112] WO 03/035836.
[113] WO 95/17211.
[114] WO 98/42375.
[115] Beignon et al. (2002) Infect Immun. 70: 3012-3019.
[116] Pizza et al. (2001) Vaccine 19: 2534-2541.
[117] Pizza et al. (2000) Int. J. Med. Microbiol. 290: 455-461.
[118] Scharton-Kersten et al. (2000) Infect. Immun. 68: 5306-5313.
[119] Ryan et al. (1999) Infect. Immun. 67: 6270-6280.
[120] Partidos et al. (1999) Immunol. Lett. 67: 209-216.
[121] Peppoloni et al. (2003) Expert Rev. Vaccines 2: 285-293.
[122] Pine et al. (2002) J. Control Release 85: 263-270.
[123] Domenighini et al. (1995) Mol. Microbiol. 15: 1165-1167.
[124] WO 99/44636.
[125] Singh et al. (2001) J. Cont. Release 70: 267-276.
[126] WO99/27960.
[127] Патент США 6090406.
[128] Патент США 5916588.
[129] EP-A-0626169.
[130] WO 99/52549.
[131] WO 01/21207.
[132] WO 01/21152.
[133] Andrianov et al. (1998) Biomaterials 19: 109-115.
[134] Payne et al. (1998) Adv. Drug Delivery Review 31: 185-196.
[135] Stanley (2002) Clin. Exp. Dermatol. 27: 571-577.
[136] Jones (2003) Curr. Opin. Investig. Drugs 4: 214-218.
[137] WO 99/11241.
[138] WO 94/00153.
[139] WO 98/57659.
[140] Заявки на европейские патенты 0835318, 0735898 и 0761231.
[141] WO 99/24578.
[142] WO 99/36544.
[143] WO 99/57280.
[144] WO 00/22430.
[145] WO01/64920.
[146] WO01/64922.
[147] WO 03/020756.
[148] Tettelin et al. (2000) Science 287: 1809-1815.
[149] WO 96/29412.
[150] Pizza et al. (2000) Science 287: 1816-1820.
[151] WO 02/09643.
[152] Katial et al. (2002) Infect. Immun. 70: 702-707.
[153] WO 01/52885.
[154] Европейский патент 0301992.
[155] Bjune et al. (1991) Lancet 338 (8775): 1093-1096.
[156] Fukasawa et al. (1999) Vaccine 17: 2951-2958.
[157] WO 02/09746.
[158] Rosenqvist et al. (1998) Dev. Biol. Stand. 92: 323-333.
[159] WO 01/09350.
[160] Европейский патент 0449958.
[161] EP-A-0996712.
[162] EP-A-0680512.
[163] WO 02/062378.
[164] WO 99/59625.
[165] Патент США 6180111.
[166] WO 01/34642.
[167] WO03/051379.
[168] Патент США 6558677.
[169] WO 2004/019977.
[170] WO 02/062380.
[171] WO 00/25811.
[172] Peeters et al. (1996) Vaccine 14: 1008-1015.
[173] Vermont et al. (2003) Infect. Immun. 71: 1650-1655.
[174] Costantino et al. (1999) Vaccine 17: 1251-1263.
[175] Bell (2000) Pediatr. Infect. Dis. J. 19: 1187-1188.
[176] Iwarson (1995) APMIS 103: 321-326.
[177] Gerlich et al. (1990) Vaccine 8 Suppl.: S63-68 & 79-80.
[178] Gustafsson et al. (1996) N. Engl. J. Med. 334: 349-355.
[179] Rappuoli et al. (1991) TIBTECH 9: 232-238.
[180] Vaccines (1988) eds. Plotkin & Mortimer. ISBN 0-7216-1946-0.
[181] Del Guidice et al. (1998) Molecular Aspects of Medicine 19: 1-70.
[182] Suiter et al. (2000) Pediatr. Clin. North. Am. 47: 287-308.
[183] Zimmerman & Spann (1999) Am. Fam. Physician. 59: 113-118, 125-126.
[184] Robinson & Torres (1997) Seminars in Immunology 9: 271-283.
[185] Donnelly et al. (1997) Annu Rev. Immunol. 15: 617-648.
[186] Scott-Taylor & Dalgleish (2000) Expert. Opin. Imestig Drugs 9: 471-480.
[187] Apostolopoulos & Plebanski (2000) Curr. Opin. Mol. Ther. 2: 441-447.
[188] Ilan (1999) Curr. Opin. Mol. Ther. 1: 116-120.
[189] Dubensky et al. (2000) Mol. Med. 6: 723-732.
[190] Robinson & Pertmer (2000) Adv. Virus Res. 55: 1-74.
[191] Donnelly et al. (2000) Am. J.Respir. Crit. Care Med. 162 (4 Pt 2): S190-193.
[192] Davis (1999) Mt. Sinai J. Med. 66: 84-90.
[193] Charalambous & Feavers (2001) J. Med. Microbiol. 50: 937-939.
[194] Westerink (2001) Int. Rev. Immunol. 20: 251-261.
[195] Grothaus et al. (2000) Vaccine 18: 1253-1263.
[196] WO 03/080678.
[197] WO 98/08543.
[198] WO 2004/032958 и заявки на патенты Великобритании 0223741.0, 0305831.0 и 0309115.4.
[199] http://neisseria.org/nm/typing/mlst/
[200] Pettersson et al. (1994) Microb. Pathog. 17(6): 395-408.
[201] Maiden et al. (1998) PNAS USA 95: 3140-3145.
[202] Welsch et al. (2002) 13th International Pathogenic Neisseria Conference, Norwegian Institute of Public Health, Oslo, Norway; Sept. 1-6, 2002. Genome-derived antigen (GNA) 2132 elicits protective serum antibodies to groups В and С Neisseria meningitidis strains.
[203] Santos et al. (2002) 13th International Pathogenic Neisseria Conference, Norwegian Institute of Public Health, Oslo, Norway; Sept. 1-6, 2002. Serum bactericidal responses in rhesus macaques immunized with novel vaccines containing recombinant proteins derived from the genome of N.meningitidis.
[204] Kanra et al. (1999) The Turkish Journal of Paediatrics 42: 421 -427.
[205] WO 97/00697.
[206] WO 02/00249.
[207] WO 96/37222; патент США 6333036.
[208] Watson (2000) Pediatr. Infect. Dis. J. 19: 331-332.
[209] Rubin (2000) Pediatr. Clin. North. Am. 47: 269-285, v.
[210] Jedrzejas (2001) Microbiol. Mol. Вiol. Rev. 65:187-207.
[211] Zielen et al. (2000) Infect. Immun. 68: 1435-1440.
[212] Darkes & Plosker (2002) Paediatr. Drugs 4: 609-630.
[213] Tettelin et al. (2001) Science 293: 498-506.
[214] Hoskins et al. (2001) J. Bacteriol. 183: 5709-5717.
[215] Rappuoli (2000) Curr. Opin. Microbiol. 3: 445-450.
[216] Rappuoli (2001) Vaccine 19: 2688-2691.
[217] Masignani et al. (2002) Expert. Opin. Вiol. Ther. 2: 895-905.
[218] Mora et al. (2003) Drug Discov. Today 8: 459-464.
[219] Wizemann et al. (2001) Infect. Immun. 69: 1593-1598.
[220] Rigden et al. (2003) Crit. Rev. Biochem. Mol. Вiol. 38: 143-168.
[221] WO 02/22167.
[222] WO 01/30390.
[223] Almeida & Alpar (1996) J. Drug Targeting 3: 455-467.
[224] Agarwal & Mishra (1999) Indian J. Exp. Вiol. 37: 6-16.
[225] WO 00/53221.
[226] Jakobsen et al. (2002) Infect. Immun. 70: 1443-1452.
[227] Wu et al. (1997) J. Infect. Dis. 175: 839-846.
[228] Bergquist et al. (1998) APMIS 106: 800-806.
[229] Baudner et al. (2002) Infect. Immun 70: 4785-4790.
[230] Ugozzoli et al. (2002) J. Infect. Dis. 186: 1358-1361.
[231] Miron & Wilchek (1982) Anal. Biochem. 126: 433-435.
[232] Ravenscroft et al. (1999) Vaccine 17: 2802-2816.
[233] Carlone et al. (1992) J. Clin. Microbiol. 30: 154-159.
[234] Kao & Tsai (2004) Vaccine 22: 335-44.
[235] Cescutti et al. (1996) Biochem. Biophys. Res. Commun. 224: 444-50.
Формула изобретения
1. Модифицированный менингококковый капсульный сахарид серогруппы W135, где (а)  29% остатков сиаловых кислот в сахариде являются O-ацетилированными в 7 положении; и/или (b) 29% остатков сиаловых кислот в сахариде являются O-ацетилированными в 7 положении; и/или (b)  26% остатков сиаловых кислот в сахариде являются O-ацетилированными в 9 положении. 26% остатков сиаловых кислот в сахариде являются O-ацетилированными в 9 положении.
2. Модифицированный менингококковый капсульный сахарид серогруппы Y, где а)  9% остатков сиаловых кислот в сахариде являются O-ацетилированными в 7 положении; и/или (b) 9% остатков сиаловых кислот в сахариде являются O-ацетилированными в 7 положении; и/или (b)  29% или 29% или  27% остатков сиаловых кислот в сахариде являются O-ацетилированными в 9 положении. 27% остатков сиаловых кислот в сахариде являются O-ацетилированными в 9 положении.
3. Модифицированный менингококковый капсульный сахарид по пп.1 и 2, где >0% остатков сиаловых кислот в сахариде являются O-ацетилированными в 7 положении.
4. Модифицированный менингококковый капсульный сахарид по пп.1 и 2, где >0% остатков сиаловых кислот в сахариде являются O-ацетилированными в 9 положении.
5. Модифицированный менингококковый капсульный сахарид серогруппы W135 или Y, где сахарид включает в себя n повторяющихся звеньев дисахаридного мотива:
[сиаловая кислота]-[гексоза],
где гексоза представляет собой галактозу или глюкозу, и n представляет собой целое число от 1 до 100, и где
(a)  х% остатков сиаловых кислот в указанных n или более повторяющихся мотивах являются O-ацетилированными в 7 положении; и/или х% остатков сиаловых кислот в указанных n или более повторяющихся мотивах являются O-ацетилированными в 7 положении; и/или
(b) когда гексоза представляет собой галактозу,  у% остатков сиаловых кислот в указанных n повторяющихся мотивах являются O-ацетилированными в 9 положении, и когда гексоза представляет собой глюкозу, у% остатков сиаловых кислот в указанных n повторяющихся мотивах являются O-ацетилированными в 9 положении, и когда гексоза представляет собой глюкозу,  у% или у% или  z% остатков сиаловых кислот в указанных n повторяющихся мотивах являются O-ацетилированными в 9 положении, z% остатков сиаловых кислот в указанных n повторяющихся мотивах являются O-ацетилированными в 9 положении,
где когда гексоза представляет собой галактозу, х равен 29 и у равен 26; и когда гексоза представляет собой глюкозу, х равен 9 и у равен 29 и z равен 27.
6. Модифицированный менингококковый капсульный сахарид серогруппы W135 или Y, конъюгированный с белком-носителем, где сахарид включает в себя n повторяющихся звеньев дисахаридного мотива:
[сиаловая кислота]-[гексоза],
где гексоза представляет собой галактозу или глюкозу, и n представляет собой целое число от 1 до 100, и где
(a)  х% остатков сиаловых кислот в указанных n или более повторяющихся мотивах являются O-ацетилированными в 7 положении; и/или х% остатков сиаловых кислот в указанных n или более повторяющихся мотивах являются O-ацетилированными в 7 положении; и/или
(b) когда гексоза представляет собой галактозу,  у% остатков сиаловых кислот в указанных n повторяющихся мотивах являются O-ацетилированными в 9 положении, и когда гексоза представляет собой глюкозу, у% остатков сиаловых кислот в указанных n повторяющихся мотивах являются O-ацетилированными в 9 положении, и когда гексоза представляет собой глюкозу,  у% или у% или  z% остатков сиаловых кислот в указанных n повторяющихся мотивах являются O-ацетилированными в 9 положении, z% остатков сиаловых кислот в указанных n повторяющихся мотивах являются O-ацетилированными в 9 положении,
где когда гексоза представляет собой галактозу, х равен 29 и у равен 26; и когда гексоза представляет собой глюкозу, х равен 9 и у равен 29 и z равен 27.
7. Сахарид по п.5 или 6, где гексоза представляет собой галактозу, приблизительно 6% остатков сиаловых кислот в указанных n повторяющихся мотивах являются O-ацетилированными в 7 положении и приблизительно 43% остатков сиаловых кислот в указанных n повторяющихся мотивах являются O-ацетилированными в 9 положении.
8. Сахарид по п.5 или 6, где гексоза представляет собой глюкозу, приблизительно 6% остатков сиаловых кислот в указанных n повторяющихся мотивах являются O-ацетилированными в 7 положении и приблизительно 45% остатков сиаловых кислот в указанных n или более повторяющихся мотивах являются O-ацетилированными в 9 положении.
9. Композиция для индукции образования антител у млекопитающих, включающая в себя  молекул менингококкового капсульного сахарида серогруппы W135, где среднее количество остатков сиаловых кислот в молекуле капсульного сахарида представляет собой b и где: (а) молекул менингококкового капсульного сахарида серогруппы W135, где среднее количество остатков сиаловых кислот в молекуле капсульного сахарида представляет собой b и где: (а)  29% 29%  ·b остатков сиаловых кислот серогруппы W135 в композиции O-ацетилированы в 7 положении; и/или (b) ·b остатков сиаловых кислот серогруппы W135 в композиции O-ацетилированы в 7 положении; и/или (b)  26% 26%  ·b остатков сиаловых кислот серогруппы W135 в композиции O-ацетилированы в 9 положении. ·b остатков сиаловых кислот серогруппы W135 в композиции O-ацетилированы в 9 положении.
10. Композиция для индукции образования антител у млекопитающих, включающая в себя  молекул менингококкового капсульного сахарида серогруппы Y, где среднее количество остатков сиаловых кислот в молекуле капсульного сахарида представляет собой b, и где (а) молекул менингококкового капсульного сахарида серогруппы Y, где среднее количество остатков сиаловых кислот в молекуле капсульного сахарида представляет собой b, и где (а)  9% 9%  ·b остатков сиаловых кислот серогруппы Y в композиции O-ацетилированы в 7 положении; и/или (b) ·b остатков сиаловых кислот серогруппы Y в композиции O-ацетилированы в 7 положении; и/или (b)  29% или 29% или  27% 27%  ·b остатков сиаловых кислот серогруппы Y в композиции O-ацетилированы в 9 положении. ·b остатков сиаловых кислот серогруппы Y в композиции O-ацетилированы в 9 положении.
11. Композиция для индукции образования антител у млекопитающих, включающая в себя  молекул менингококкового капсульного сахарида серогруппы W135, конъюгированного с белком-носителем, где среднее количество остатков сиаловых кислот в молекуле капсульного сахарида представляет собой b и где: (а) молекул менингококкового капсульного сахарида серогруппы W135, конъюгированного с белком-носителем, где среднее количество остатков сиаловых кислот в молекуле капсульного сахарида представляет собой b и где: (а)  29% 29%  ·b остатков сиаловых кислот серогруппы W135 в композиции O-ацетилированы в 7 положении; и/или (b) ·b остатков сиаловых кислот серогруппы W135 в композиции O-ацетилированы в 7 положении; и/или (b)  26% 26%  ·b остатков сиаловых кислот серогруппы W135 в композиции O-ацетилированы в 9 положении. ·b остатков сиаловых кислот серогруппы W135 в композиции O-ацетилированы в 9 положении.
12. Композиция для индукции образования антител у млекопитающих, включающая в себя  молекул менингококкового капсульного сахарида серогруппы Y, конъюгированного с белком-носителем, где среднее количество остатков сиаловых кислот в молекуле капсульного сахарида представляет собой b, и где (а) молекул менингококкового капсульного сахарида серогруппы Y, конъюгированного с белком-носителем, где среднее количество остатков сиаловых кислот в молекуле капсульного сахарида представляет собой b, и где (а)  9% 9%  ·b остатков сиаловых кислот серогруппы Y в композиции O-ацетилированы в 7 положении; и/или (b) ·b остатков сиаловых кислот серогруппы Y в композиции O-ацетилированы в 7 положении; и/или (b)  29% или 29% или  27% 27%  ·b остатков сиаловых кислот серогруппы Y в композиции O-ацетилированы в 9 положении. ·b остатков сиаловых кислот серогруппы Y в композиции O-ацетилированы в 9 положении.
13. Сахарид, содержащий n повторов следующего дисахаридного мотива:
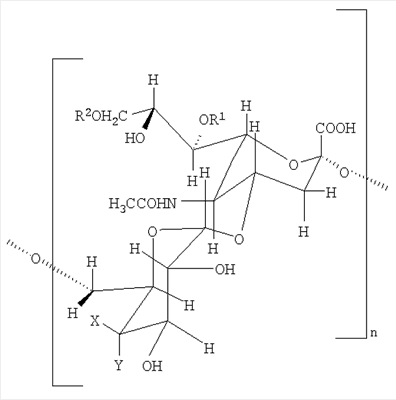
где
n представляет целое число от 1 до 100,
Х и Y представляют собой разные группы, выбранные из -Н и -ОН,
R1 независимо выбран из -Н и -СОСН3 и может быть одним и тем же или разным в каждом дисахаридном мотиве,
R2 независимо выбран из -Н и -СОСН3 и может быть одним и тем же или разным в каждом дисахаридном мотиве, и
когда X представляет собой -ОН и Y представляет собой -Н, (а)  29% R1 представляют собой -СОСН3 и/или (b) 29% R1 представляют собой -СОСН3 и/или (b)  26% R2 представляют собой -СОСН3, 26% R2 представляют собой -СОСН3,
когда Х представляет собой -Н и Y представляет собой -ОН, (а)  9% R1 представляют собой -СОСН3 и/или (b) 9% R1 представляют собой -СОСН3 и/или (b)  29% или 29% или  27% R2 представляют собой -СОСН3. 27% R2 представляют собой -СОСН3.
14. Сахарид по любому из предшествующих пунктов, где сахарид имеет среднюю степень полимеризации менее 30.
15. Продукт конъюгирования (i) сахарида по любому из предшествующих пунктов и (ii) белка-носителя, выбранного из группы, состоящей из дифтерийного токсоида, столбнячного токсоида, белка D H.influenzae и CRM197.
16. Иммуногенная композиция, содержащая (а) модифицированный капсульный сахарид или конъюгат по любому из предшествующих пунктов и (b) фармацевтически приемлемый носитель.
17. Композиция по п.16 в водной форме.
18. Композиция по п.16 в лиофилизированной форме.
19. Композиция по любому из пп.16-18, дополнительно содержащая антиген капсульного сахарида серогруппы С N.meningitidis.
20. Композиция по любому из пп.16-18, дополнительно содержащая антиген капсульного сахарида серогруппы A N.meningitidis.
21. Композиция по п.20, где антиген серогруппы А представляет собой модифицированный сахарид, в котором одна или несколько гидроксильных групп природного сахарида замещены блокирующей группой.
22. Композиция по любому из пп.16-18, дополнительно содержащая антиген серогруппы В N.meningitidis.
23. Композиция по любому из пп.16-18, дополнительно содержащая сахаридный антиген из Haemophilus influenzae типа В.
24. Композиция по любому из пп.16-18, дополнительно содержащая антиген Streptococcus pneumoniae.
25. Композиция по любому из пп.16-18, дополнительно содержащая один или несколько из антигена вируса гепатита А, антигена вируса гепатита В, антигена Bordetella pertussis, дифтерийного токсоида, столбнячного токсоида и/или антигена вируса полиомиелита.
26. Композиция по любому из пп.16-18 для применения в качестве лекарственного средства.
27. Способ индукции образования антител у млекопитающих, включающий в себя введение млекопитающему композиции по любому из пп.16-25.
28. Применение модифицированного менингококкового капсульного сахарида серогруппы W135 и/или модифицированного менингококкового капсульного сахарида серогруппы Y, как определено в любом из пп.1-15 для получения лекарственного средства для защиты от менингококкового менингита.
29. Способ получения иммуногенного конъюгата, включающий в себя стадии: (1) предоставления исходного менингококкового капсульного сахарида серогруппы W135 или серогруппы Y и белка-носителя, любой или оба из которых необязательно модифицированы для приведения его/их в состояние реактивности по отношению друг к другу; (2) формирования ковалентной связи между сахаридом и белком-носителем; и (3) очистки полученных гликоконъюгатов, где между стадиями (1) и (3) увеличивается степень O-ацетилирования остатков сиаловых кислот в положении 9 в исходном сахариде.
|