
СПИСОК ПАТЕНТОВ С УПОМИНАНИЕМ ГИАЛУРОНОВОЙ КИСЛОТЫ
-
- 2017751 Способ получения гиалурона
- 2192150 БАД для профилактики йодной недостаточности
- 2112542 Препарат для лечения патологий соединительных тканей
- 2225206 Препарат для лечения рака молочной железы
- 2299733 Лечение опорно-двигательного аппарата
- 2299732 Способ лечения глаукомы
- 2299726 Противоинфекционная губная помада
- 2299725 Косметическое средство для ухода за кожей
- 2198878 Ароматическое соединение
- 2198702 Способ подготовки трофических язв к аутодермапластике
- 2198653 Вагинальные суппозитории
- 2197946 Композиция для ухода за волосами
- 2197923 Фармацевтическая композиция для лечения отеков роговицы
- 2298410 Биотрансплантант и способ лечения ревматических и аутоиммунных заболеваний
- 2197501 Фотоотверженный гель на основе сшитой гиалуроновой кислоты
- 2197228 Твердые лекарственные формы
- 2197222 Водная компазиция для ухода за волосами, лица и тела
- 2297425 Полипептиды
- 2297240 Композиция с гиалуроновой кислотой
- 2297230 Фармацевтическая компазиция с ксантоновой смолой
- 2196588 Глазные капли
- 2195955 Применение биологически активных веществ
- 2195926 Дерматологические композиции
- 2295954 Микрочастицы для доставки нуклеиновых кислот
- 2295951 Косметика для ухода за кожей лица и век
- 2195262 Фармакологическое средство на основе гиалуроновой кислоты
- 2194512 Способ профилактики и коррекции процесса старения кожи
- 2194478 Лечение экземы
- 2294716 Расширяемый стент
- 2194055 Сшитые сополимеры
- 2099350 Ассоциаты депротонированной гиалуроновой кислоты
- 2293557 Средство для лечения кожи и слизистых
- 2292878 Приготовление микроцастиц, содержащих метопропол
- 2292746 БАД
- 2192256 Защита кишечника
- 2191782 Получение модифицированной гиалуроновой кислоты
- 2292219 Паратиреоидный гормон человека
- 2291686 Микроцастицы
- 2191000 Косметическая маска
- 2290921 Фармацевтические и косметические средства против старения кожи
- 2290900 Модифицированный биоматериал для использования в офтальмологии
- 2290899 Получение биоматерьяла
- 2290397 Новые инданилиденовые соединения
- 2290186 Лечение сирингомиелии
- 2288702 Иррингационный раствор для офтальмологии
- 2288699 Гель для лечения стоматологических заболеваний
- 2188011 Активирующая остеогенез фармацевтическая композиция
- 2187327 Средство с антисептиком
- 2187325 Средство с радиопротекторным действием
- 2287330 Композиции миноксидила
- 2186786 Способ получения гиалуроновой кислоты
- 2186593 Лечение раненого процесса кожи
- 2286801 Очищение воды
- 2286781 Лечение ожогов пищевода у детей
- 2286764 Средство лечения воспалений полости рта
- 2185840 Лечение инфекционных заболеваний
- 2286151 Альфа-2-Дельта-Лиганда
- 2185149 Ранозаживляющий гель
- 2285527 Лечение ИЛ-6 заболеваний
- 2184448 Раствор хранения роговицы, включающий гиалуроновую кислоту
- 2090179 Крем для кожи
- 2183961 Способ лечения кожи
- 2284331 Соли алифотических аминов
- 2284187 Производные амида
- 2089191 Снизить внутрение давление
- 2283320 Получение гликозаминогликанов
- 2283129 Лечение опухолей
- 2283098 Косметические средства с Q
- 2182574 Ароматические соединения
- 2088257 Средство с гипохолестеролемическим действием
- 2088218 Состав для гигиенических салфеток
- 2088206 Способ получения препарата, создающего исскуственный загар
- 2282462 Противомикробные средства
- 2182008 Интровагинальная компазиция
- 2181999 Препарат с отсроченным высвобождением
- 2181998 Новые композиции липидов
- 2181995 Лечение болевого синдрома
- 2181295 Вирионная вакцина
- 2087144 Витамин Е
- 2379336 Способ стирки
- 2379052 Вакцинация
- 2180855Композиция в виде ионного комплекса
- 2379025 Противоинфекционный гель
- 2180825 Лечение травм роговицы
- 2281082 Способ коррекции эстетических и возрастных проблем кожи
- 2180576 Биоактивная добавка для косметических средств
- 2280459 Средство для изменения скорости роста или репродукции клеток
- 2179981 Соли переходного металла
- 2378010 Жидкие вакцины
- 2378008 Комбинированные вакцины
- 2378007 Анаболическое средство
- 2377973 Растительные экстракты
- 2280041 Способ получения водорастворимых комплексов гиалурил
- 2280038 Биополимеры
- 2323733 Йодный обмен
- 2377260 Гель
- 2178693 Противовирусное средство на основе гиалуроновой кислоты
- 2178692 Облегчающие зуд косметическое средство
- 2377022 Гемостатические спреи
- 2376982 Увлажняющая сыворотка для лица
- 2376974 Трансдермальный гель для лица
- 2362784 Гипо-и гиперацетилированные менингокковые капсульные сахариды
- 2177789 Устройство для доставки лекарства к шейке матки
- 2277954 Крем для лица омолаживающий
- 2376378 Способ получения метионина
- 2177332 Биоматериал для предотвращения послеоперационных спаек, с производной гиалуроновой кислотой
- 2177310 Способ получения таблеток
- 2376011 Средство для позвоночника
- 2277410 Косметическое средство
- 2323748 Медицинская повязка
- 2276998 Гидрогелевые композиции
- 2082416 Способ получения препарата с коллагенном из животного сырья
- 2375081 Адсорбирующее изделие
- 2375049 Охлаждающий пластырь
- 2346049 Способ получения гиалурона
- 2275913 Фармацевтические средства
- 2174985 Полисахарид с антиоксидантом
- 2373957 Носитель для лекарственных средств и биологически активных веществ
- 2373941 Способ коррекции возрастных и патологических изменений кожных покров
- 2174845 Композиции и способы доставки генетического материала
- 2174830 Средство для укрепления волос
- 2373769 Синбиотическая композиция
- 2274472 Лечение апорно-двигательного аппарата и болевых синдромов
- 2372929 Профилактическая композиция на основе веществ фенольной природы в липосомной форме
- 2173563 Способ нанесения на поверхность предметов покрытия на основе гиалуроновой кислоты, её производных и полусинтетических полимеров
- 2079304 фармацевтическая композиция, обладающая иммуносупрессорной и антимикробной активностью
- 2273645 Полипептид ожирения
- 2173154 Фракция кератансульфатолигосахаридов и содержащий ее фармацевтический препарат
- 2173136 Грязная мазь
- 2173128 Способ хирургического лечения центральных разрывов сечатки
- 2078561 Косметическое средство предотвращающее старение кожи
- 2172490 Способ прогнозирования воспалительных заболеваний молочной железы при эндопластике
- 2272645 Способ лечения ЦМВ-Инфекции у детей раннего возроста
- 2272636 Фармацевтическая композиция для местного лечения воспаления
- 2272635 Фармацевтически активная субстанция для офтальмологии
- 2272599 Биоматерьял для стабилизации прогрессирующей миопии "Коллаплант"
- 2172168 Средство для заживления ран на основе гиалуроновой кислоты
- 2371172 Фармацевтическая композиция для лечения нервной системы на основе стефаглабрина
- 2171470 Способ прогнозирования послеоперационной трансформации доброкачественных опухолей нервной системы
- 2077317 Состав для ванн
- 2271213 Комбинированные композиции, содержащие экстракты из растений и морских животных
- 2076872 Способ получения окрашенной гиалуроновой кислоты
- 2076671 Раствор для защиты роговицы
- 2370281 Конъюгаты гидроксиалкилкрахмал
- 2370275 Способ лечения (коррекции) косметических и возрастных дефектов кожи
- 2370258 Фармацевтическая композиция для парентальной доставки в форме лиофилизата
- 2270023 Способ экстракции и очистки протеогликана хрящего типа (варианты)
- 2369408 Гемостатическая композиция, включающая гиалуроновую кислоту
- 2369387 Фармацевтическая композиция для лечения нервной системы
- 2369379 Нетаблитированные жевательные формы для индивидуального введения
- 2169136 Производное коричной кислоты
- 70792 Медицинский аппликатор
- 20741717 Способ стабилизации аскорбиновой кислоты
- 2074712 Способ получения препарата, препятствующего преждевременной эякуляции
- 2367954 Способ прогнозирования развития кожной патологии у женщин с синдромом склерополикистозных яичников (СПКЯ)
- 2268075 Устройство для электрокинетической доставки
- 2268052 Средство для лечения воспалительных и дегенеративных заболеваний суставов
- 2167649 Способ получения твердой дисперсии умеренного водорастворимого лекарственного вещества
- 2167647 Гель для бритья
- 2073520 Лечение урологических инфекций
- 2367476 Биопластический материал
- 2367475 Мембрана для использования при направленной регенерации тканей
- 2367469 Фармацевтическая композиция на основе лизоамидазы
- 2367456 Фармацевтическая композиция обладающая антибактериальным и некролитическим действием
- 2367455 Фармацевтическая композиция обладающая некролитическим и антибактериальным действием
- 2267324 Применение антиадгезивных углеводов, препарат для уменьшения и /или блокирования адгезии патогенных веществ
- 2166934 Композиции включающие биологический агент
- 2166510 Псевдодипептиды
- 2366460 Композиции, имеющие высокую противовирусную и антибактериальную активность
- 2360901 Производные феноксиуксусной кислоты
- 2165749 Способ восстановления эндотелия роговицы
- 2265441 Способ укрепления склеры
- 2365382 Композиции и способы для регуляции развития сосудов
- 2070879 Соли гликозаминогликанов
- 2164914 Циклические и гетероциклические N - замещенные - иминогидроксамовые карбоновые кислоты
- 2264627 Хламидийный конъюктивит
- 2364399 Фармацевтический препарат на основе стефаглабрина
- 2264230 Препарат с замедленным высвобождением активного вещества
- 2363497 Фармацевтические композиции
- 2363496 Способ увеличения объема мягких тканей
- 2363473 Способ антифлогистической активации в эксперементе
- 2363461 Фармацевтический препарат на основе сигетина
- 2363459 Средства для введения в роговицу глаз для предотвращения офтальмологических нарушений
- 2363448 Фармацевтические композиции
- 2163123 Глазные капли
- 2162687 Усовершенствованнная лекарственная форма индуктора интерферана
- 2162343 Биосовместимый полимерный материал и способ его получения
- 2162327 Лечение рака
- 2067841 Способ получения ароматизатора
- 2161478 Способ консервированого лечения гонартроза
- 2361617 Вольфрамовые частицы в качестве рентгеноконтрастных веществ
- 2361552 Способы и устройства для дренирования жидкостей и понижения внутриглазного давления
- 2066996 Способ изготовления пленочного материала для офтальмохирургии
- 2361417 Корм с глюкозамином и экстрактом ивы для профилактики артроза у животных
- 2161002 Пищевой общеукрепляющий лечебно-профилактический продукт из хрящевой ткани акул
- 2360928 Комплексная матрица для медико-биологического применения
- 2160574 Способ лечения глаукомы
- 2360688 Способ лечения повреждений переферических нервов
- 2360670 Фармацевтическая композиция при климактерических расстройствах
- 2360646 Эндолюминальный протез
- 2260445 Способ усовершенствования транспортировки через легко прспосабливаемый полупроницаемый барьер
- 2260007 Производные амида
- 2359975 Способ получения модифицированных арабиногалактанов
- 2359974 Антигенные Пептиды
- 2159775 Псевдопептидный продукт
- 2259833 Фармацевтическая композиция для лечения роговицы глаза
- 2259816 Ранозаживляющее средство
- 2259815 Способ коррекции возрастных изменений, связанных с процессами старения кожи
- 2359706 Способ сохранения офтальмологических растворов
- 2359704 Антисептическое средство
- 2359662 Микрокапсулы
- 2159253 Катионные полимеры
- 2159111 Средство для ухода за кожей лица
- 2159105 Композиция для защиты кожи от опасных химических веществ Получение
- 2158593 Биосовместимый водный раствор
- 2358728 Способ лечения и предупреждения потери костной ткани
- 2258517 Способ хирургического лечения травмотических повреждений селезенки пленкой на основе гиалуроновой кислоты
- 2357968 Кристалические формы производной имидазола
- 2357957 Ингибиторы P38 и их применение
- 2157647 Пищевая добавка и ее получение
- 2357758 Препараты для чрескожной и чересслизистой добавки
- 2063244 Способ стабилизации растворов
- 2063140 Способ получения препарата для консервирования мяса
- 2157381 Способ получения гиалуроновой кислоты
- 2257198 Композиции микроцастиц
- 2356909 Белковый комплекс
- 2356570 Косметическая композиция
- 2256434 Способ закрытия перфорации барабанной перепонки
- 2356520 Способ лечения постконтузионного повреждения сечатки глаза
- 2156133 Гель
- 2255945 Полимерная композиция
- 2355761 Средства повторной дифференцировки
- 2061043 Способ повышения устойчивости урокиназы к нагреванию
- 2061005 Способ получения красителей для гистологических исследований
- 2355420 Зубная паста
- 2355385 Композиции пролонгированного действия с контролируемым высвобождением
- 2355240 Способ получения пищевого препарата хондропротекторного действия
- 2155057 Пихтово репейный бальзам
- 2354409 Способ производства высвобождающих лекарственные средчтва медицинских устройств
- 2254145 Раневое покрытие на основе коллаген-хитозанового комплекса
- 2254133 Лечение и профилактика ВИЧ-инфекции у человека
- 2253439 Фармацевтическая композиция для защиты и улучшения оптических свойств роговици при проведении эндовитреальных вмешательств
- 2253437 Способ омоложения кожи
- 2153352 Фармацевтическая композиция обладающая ранозаживляющим и противовоспалительным действием
- 2353354 Фармацевтический препарат на основе низкомолекулярного индуктора интерферона
- 2252787 Способ получения искусственной матрицы кожи
- 2252767 Способ нормализации иммунобиохимического гомеостаза коров в предродовом и послеродовом периодах
- 2352583 Фармацевтическая композиция содержащая Fc-область иммуноглобулина в качестве носителя
- 2152403 Модифицированные полисахариды
- 2352356 Иммуногенная композиция
- 2352342 Исскусственный физиологический солевый раствор Способ его получения
- 2352330 Фармацевтический препарат на основе низкомолекулярного индуктора интерферона
- 2352323 Фармацевтический препарат с модифицированным высвобождением
- 2152027 Способ подготовки ткани мозга для определения гликозаминогликанов
- 2251842 Интектицидный состав для борьбы с личинками оводов
- 2151580 Способ активации пролиферации эндотелия роговицы
- 2351648 Дифференцировка стромальных клеток, полученных из жировой ткани, в эндокринные клетки поджелудочной железы и их использование
- 2351595 N - гидроксиформамидные соединения в качестве ингибиторов металлопротеина
- 2251411 Косметическое средство в лиофилизированной фармацевтической форме
- 2251405 Косметика...ее композиции для косметических препаратов
- 2251367 Средство со сшитой гиалуроновой кислотой для наращивания тканей
- 2351359 Косметика для профилактики и лечения избыточной массы тела
- 2351322 Препарат на основе низкомолекулярного индуктора интерферона
- 2351153 Диета при остеортрите собак
- 2350958 Способ определения групповой принадлежности синовальной жидкости
- 2350625 Производные гиалуроновой кислоты с пониженной биодеградируемостью
- 2150266 Крем после бритья
- 2350354 Фармацевтическое средство содержащие антагонист и фактор некроза
- 2350340 Способ коррекции процессов регенерации
- 2350309 Способ лечения избыточной массы тела с помощью рефлексотерапии
- 2250047 Профилактический продукт из хрящевой ткани гидробионтов
- 2249467 Медицинский матерьял и изделия на его основе
- 2055079 Способ получения препарата гиалуроновой кислоты
- 2349599 Биоадгезив мидии
- 2054903 Способ лечения коллагеноза у бычков на откорме
- 2249210 Способ прогнозирования предрасположенности к развитию и тяжести течения деформирующего остеоартроза коленного сустава у взрослых
- 2349339 Средство для соединительной ткани
- 2148988 Человеческий интерферона
- 2148399 Лечение атеросклероза
- 2148396 Способ определения активного вещества в дифильных мазевых основах
- 2148375 Способ диагностики близорукости
- 2348415 Способ противоспаечной терапии после хирургического вмешательства
- 2348400 Препарат на основе низкомолекулярного индуктора интерферона
- 2348386 Способ непроникающего хирургического лечения первичной открытоугольной глаукомы
- 2248213 Лечение Галактозидальной А недостаточности
- 2347586 Микрофлюидизированные эмульсии типа "масло в воде" и вакцинные средства
- 2147243 Контрастное средство
- 2146526 Лечебный препарат дисбактериоза и урогенитальных инфекций
- 2146148 Терапевтическое применение фактора роста кератиноцитов (ФРК)
- 2146139 Способ повышения активности макрофагов и комбинации для его осуществления
- 2346277 Способ диагностики специфического синовита
- 2345793 Ультразвуковые контрастные вещества и их получение
- 2345782 Терапевтические комбинации на основе PORIFERA для лечения и предотвращения кожных заболеваний
- 2245131 Способ коррекции косметических недостатков кожи
- 2245130 Способ активации восстановительных процессов в коже
- 2144833 Хондроитиназа
- 2344809 Получение твердых дозированных форм с использованием сшитого нетермопластичного носителя
- 2244540 Косметический гель для ухода за кожей лица
- 2244536 Способ лечения дегенеративно-дистрофических заболеваний тазобедренного сустава
- 2344167 Хмелевый экстракт
- 2143884 Агент регулирования дифференциации клеток кожи, культурная среда для клеток или тканей и способ регулирования дифференциации клеток кожи
- 2343932 Способ получения обладающих пониженной растворимостью в воде пленночных материалов
- 2343903 Устройство доставки лекарств для контролируемого введения препаратов
- 2048817 Способ получения материала для лечения ожогов и гнойно - некронических ран
- 2048803 Гидратантный крем
- 2242974 Средства и способы лечения воспалительных заболнваний
- 2142816 Способ получения антигерпетической вакцины
- 2342923 Средство для обработки рук с увлажняющим эффектом
- 2142781 Косметика для макияжа ресниц и бровей и агент ингирирующий рост микроорганизмов в косметических средствах
- 2242251 Трансплантируемые стенты с биоактивными покрытиями
- 2142257 Способ обработки глазных имплантантов и контакных линз
- 2342389 Мононатриевая соль
- 2342107 Способ устранения западения верхнего века при анофтальме
- 2141828 Средство, пролонгирующее эффективность чесночного порошка
- 2241489 Косметическое средство матриксных протеинов для залечивания ран
- 2241443 Средство для лечения герпеса
- 2241414 Способ получения протезов кровеносных сосудов
- 2341539 Гидрогель
- 2141324 Регулятор скорости воздействия препарата для инъекций
- 2141312 Косметическое средство для ухода за кожей лица
- 2341296 Средства и способы покрытия медицинских имплантантов
- 2341272 Средство для неспецифической иммунотерапии
- 2341266 Стенты с нанесенным покрытием содержащим N - (5-(4-(4-
- 2341257 Иммуномодулирующее средство
- 2341255 Средство для лечения климактерических расстройств
- 2240821 Способ лечения урологических инфекций
- 2140786 Способ лечения лишая
- 2140243 Способ хирургического лечения диабетической ретинопатии и отслоек сечатной оболочки
- 2240140 Медицинская многослойная повязка и изделия на ее основе
- 2240135 Культура клеток, содержащая клетки - предшественники остеонегеза, имплантант на ее основе и его использование для восстановления целостности кости
- 2240123 Экзогенные биологически активные коньюгирующие вещества
- 2139886 Фотоотвержаемое производное гликозаминогликата, сшитое производное гликозаминогликата и способы их получения, способ предотвращения клеточной и тканевой адгезии
- 2139729 Вакцина. Способ стимулирования иммунной системы
- 2339386 Средство обладающее радио - и химиозащитным действием
- 2339369 Лечение офтальмологических нарушений с использованием мочевины и ее производных
- 2139041 Гидратантный регенерирующий крем и способ его получения
- 2139039 Косметический суперкрем для ухода за кожей
- 2139017 Способ получения боисовместимого материала
- 2138503 Производные камптотецина, способы их получения, уникальное средство
- 2338556 Средство содержащие антагонист Р2Х - рецептора и нестероидное противоспалительное лекарственное средство
- 2338514 Косметическое средство для профилактики старения кожи
- 2138297 Медицинские устройства, подверженные вызываемому разложению
- 2138295 Покрытие для ран
- 2337906 Ингибиторы цитозольной фосфолипазы А2 Применение физиологически допустимого корпускулярного ферримагнитного или ферромагнитного материала. Способ формирования магнитометрического изображения
- 2137501 Устройство формирования изображения
- 2137477 Способ лечения заболеваний характеризующихся аутоиммунной агрессией
- 2137467 Крем для кожи лица и тела
- 2137449 Способ коррекции дефектов преломления в глазу млекопитающего
- 2137402 Пищевая Добавка БАД
- 2336899 Способ стимуляции миелопоэза
- 2336862 Способ получения раствора для лечения роговицы
- 2336830 Способ восстановления костных структур челюсти
- 2136696 Новый полипептид и средство против ВИЧ - Инфекции
- 2336092 Биоадгезивное средство, по существу свободное от воды
- 2336089 Средство и способ лечения заболеваний периодонтальных и пульпы
- 2336074 Средства и способы лечения заднего сегмента глаза
- 2235548 Ранозаживляющее средство
- 2135186 Способ лечения рефлекторных синдромов при остеохондрозе
- 2234945 Стабилизатор водного раствора и водосодержащего сырья
- 2334762 Растворимая ассоциативная карбоксиметилцеллюлоза
- 2234514 Макропористые хитозановые гранулы и способ их получения. Способ культивирования клеток
- 2133615 Средство для лечения неврологических заболеваний
- 2233164 Способ профилактики развития послеоперационных спаек брюшной полости
- 2133127 Неткатный материал, способ его получения и способ лечения
- 2333223 Альдегидные производные сиаловой кислоты и средства на их основе
- 2333007 Полипептидные вакцины для широкой защиты против рядов поколений менингококов с повышенной вирулентностью
- 2332985 Дозированные формы анестезирующих средств с длительным высвобождением для обезболивания
- 2132677 Косметическая маска
- 38603 Пленочный аппликатор
- 2232594 Средство содержащие ингибирующие остеокластогенез фактор и полисахарид
- 2332238 Средство для прокладок, раневых повязок и других изделий, контактирующих с кожей
- 2331668 Стромальные клетки, получение из жировой ткани, для заживления дефектов роговицы и внутриглазных дефектов и их использование
- 2331438 Альфа - 2 - Дельта Лигант для лечения симптомов нижних мочевыводящих путей
- 2331411Электропряденые аморфные фармоцевтические средства
- 2331367 Способ профилактики образования спаек и их рецидива
- 2130767 Масло в воде для получения косметических и дерматологических средств, способ косметической обработки
- 2230752 Поперечносшитые гиалуроновые кислоты и их применение в медицине
- 2230558 Способ восстановления и сохранения здоровья скмьи
- 2230550 Средства длительного высвобождения, способ их получения и применения
- 2230458 Поддержания здоровья суставов
- 2330290 Способ определения состояния метаболических процессов в ткани суставного хряща
- 2230073 Способ поперечного сшивания карбоксилированных полисахаридов
- 2329059 Способ лечения полипозного риносинусита
- 2329037 Комбинированная терапия для лечения иммуновоспалительных заболеваний
- 2128666 Гиалуроновая кислота и ее соли, способ очистки гиалуроновой кислоты, способ получения гиалуроновой кислоты. Фармацевтический препарат с гиалуроновой кислотой и средства с гиалуроновой кислотой используемые в офтальмологии
- 2328740 Способ экспресс - оценки действия зубных паст
- 2128502 Косметический гель
- 2328272 Суппозитории индуктора интерферона
- 2328268 Косметика содержащая амфолитный сополимер
- 2128057 Композиционная мембрана, способ ее получения и способ направленной регенерации тканей с ее применением
- 2128055 Средство замедленного освобождения и способ его получения
- 2128049 Свечи
- 2227743 Полипептидные варианты с повышенной гепаринсвязывающей способностью
- 2326893 Ковалентное и нековалентное сшивание гидрофильных полимеров
- 2326697 Новый перевязочный материал для быстрого заживления раневой поверхности кожи
- 2126264 Фармацевтическое средство с гиалуроновой кислотой
- 2326137 Способ получения содержащих альгинат пористых формованных изделий
- 2325902 Способ выделения гликозаминогликанов из минерализованной соединительной ткани
- 2225195 Репелленты против насекомых
- 2325193 Сосудистый стент
- 2325184 Улучшенные везикулы наружной мембраны бактерий
- 2325153 Многокомпонентная фармацевтическая дозированная форма
- 2325152 Удерживаемая в желудке система регулируемой доставки лекарственного средства
- 2029955 Способ предоперационного определения помутнения задней капсулы хрусталика при экстракции катаракты
- 2324688 Производные бисбензизоселеназолонила с противоопухолевым, противовоспалительным и антитромбоническим действием
- 2323017 Устройство и способ контролируемый доставки активных веществ в кожу
- 2323011 Содержащий Коллаген I и Коллаген II способный к рассасыванию внеклеточный матрикс, предназначенный для реконструирования хряща
- 2322955 Способ изготовления имплантанта для пластики дефектов хрящевой ткани
- 2322454 Антитело против CCR5
- 2322263 Система продолжительного высвобождения растворимого лекарственного средства
- 2221561 Витамин Е и его сложные эфиры
- 2321634 Гены участвующие в метаболизме углерода и продуцировании энергии
- 2321597 Биоматерьял, способ его приготовления и его применение, медицинское средство, имплантант и вкладыш
- 2121340 Средство для похудения
- 2220737 Средство для улучшения состояния опорно-двигательного аппарата
- 2220729 Гель используемый в стоматологии
- 2320720 Способ культивирования фибропластов для заместительной терапии
- 2320378 Накожный аппликатор
- 2320369 Средства, содержащие Альфа - 2 - Дельта Лиганды и ингибиторы обратного захвата серотонина/норадреналина
- 2320362 Местные фармацевтические средства, содержащие проантоцианидины, для лечения дерматитов
- 2320322 Биоадгезивная доставка лекарств
- 2320318 Чувствительное к температуре изменяющие состояние средство гидрогеля
- 2025120 Способ получения препарата, содержащего Фактор /G-CSF/, стимулирующий рост колоний гранулоцитов
- 2319490 Средство для введения железа при лечении синдрома беспокойных ног
- 25995 Содержащее адгезив приспособление для фиксации зубных протезов в полости рта
- 2218907 Средство для ухода за кожей лица и веками
- 2318830 Способ получения модифицированного дерматансульфата
- 2118153 Косметика - туш для ресниц
- 2217441 Способ получения полимера
- 2317296 Изетионатная соль селективного ингибитора CDK4
- 2217171 Мембрана для использования при направленной регенерации тканей
- 2317095 Экстракты ECHINACEA ANGUSTIFOLIA
- 2216332 Препарат для лечения астроза
- 2216314 Крем - маска для обезвоженной кожи
- 2316333 Средство оздоровительно-восстановительных косметических панто-магниевых ванн
- 2021304 Способ получения биологически активного средства
- 2115662 Способ получения гиалуроновой кислоты
- 2315627 Впрыскиваемые имплантанты на керамической основе для заполнения морщин, кожных впадин, шрамов
- 2315623 Средство получаемое путем лиофилизации препарата
- 2114862 Способ получения гиалуроновой кислоты
- 2314791 Лечебно-Косметическое средство
- 2314791 Косметический крем-бальзам для ухода за кожей лица и шеи
- 2214600 Способ оценки эффективности лечения неврологических проявлений
- 2114602 Способ косметической обработки
- 2114587 Раствор для защиты роговицы
- 2214283 Имплантант для подкожного или внутрикожного введения
- 2313370 Медицинские протезы, имеющие улучшенную биологическую совместимость
- 2313356 Препарат для лечения демодекоза
- 2313338 Средство на основе этиллинолеата и триэтилцитрата для лечения себореи и угрей
- 2313328 Косметика содержащая тонкодисперный и пористый порошок
- 2212880 Способ получения препарата содержащего антибиотик, с замедленным высвобождением активного вещества
- 2312640 Способ лечения Блефароконьюнктивальной формы синдрома сухого глаза
- 2017751 Способ получения гиалуроновой кислоты
- 2312145 Гены CORYNEBACTERIUM GLUTAMICUM, кодирующие белки, участвующие в синтезе мембран и мембранном транспорте
- 2311458 Белки вызывающие измененную иммуногенную реакцию. Способ их получения и использования
- 2311183 Улучшенное разделение с использованием гталуроновой кислоты
- 2311177 Ингибиторы интегрина для лечения заболевания глаз
- 2300069 Косметическая маска
- 2211024 Уход за сухой кожей
- 2310440 Раствор для защиты роговицы от повреждений
- 2309684 Лечение межфалангового остеоатроза узелковой формы
- 2309406 Способ мониторинга фиброза печени у больных хроническим гепатитом с (ХГС)
- 2209088 Опосредованная рецепторами доставка генов с использованием векторов на основе бактериофагов
- 2308967 Уменьшение объема ткани
- 2308962 Средство для опорно-дигательного аппарата
- 2308957 Способ получения препарата для мезотерапии
- 2308954 Средство для лечения ран, содержащее плазму или сыворотку крови
- 2308951 Комплексный способ профилактики вагинальных дисбактериозов
- 2308937 Косметическая биологически активная добавка и косметический литофитокомплекс на ее основе
- 2208638 ДНК (варианты), способ получения белка
- 2207885 Способ подачи небольшого объема лечебного раствора к целевому месту
- 2207858 Лишенные побочных эффектов производные простагландинов для лечения глаукомы
- 2207845 Твердая лекарственная форма пролонгированного действия
- 2207844 Препарат для местного неинвазивного применения
- 2207841 Средства с антиферментативным действием
- 2306335 Стволовые клетки и решетки полученные из жировой ткани
- 2306140 Новые рецепторы для Helicobacter pylori и их применение
- 2205612 Способ эндотелизации IN VITRO протезов кровеносных сосудов
- 2105540 Депигментирующее средство
- 2304960 Косметическое средство для кожи
- 2304616 Гены участвующие в гомеостазе и адаптации
- 2204550Способ получения длинноцепочечной N-Ацилированной кислотой Аминокислот
- 2204415 Способ получения изображения
- 2204394 Средство для лечения грибковых инфекций, желудочных язв
- 2204366 Способ хирургического лечения глаукомы
- 2104034 Вагинальное увлажняющие средство, способ его получения
- 2303991 Биологически активная добавка
- 2303990 БАД
- 2303973 Адсорбирующее изделие
- 2203676 Средство обладающее иммунокорригирующим действием
- 2203672 Способ предупреждения беременности
- 2303635 Гены кодирующие белки резистентности и толерантности к стрессам
- 2303529 Способ фиксации альгинатного геля на твердой фазе, способ получения клеточного чипа на его основе
- 2203078 Способ лечения гнойных ран
- 2302412 Гидразоно-малонитрилы
- 2102400 Способ получения гиалуроновой кислоты
- 2202356 Способ стимуляции репаративных процессов длительно незаживающих ран и трофических язв
- 2202336 Средство для ухода за кожей
- 2302231 Глазные капли
- 2102082 Способ магнитометрического исследования тела человека или животного
- 2301814 Полиакриламидный гидрогель
- 2201765 Гибридные матричные имплантанты и эксплантанты
- 2301677 Биотрансплантант для лечения дегенеративных и трвматических заболеваний хрящевой ткани и способ его получения
- 2301676 Способ лечения ревматизма
- 2301674 Способ лечения больных с переломами нижней челюсти
- 2301661 Средство с регулируемым освобождением и способ его получения
- 2005488 Средство для лечения болезней соединительной ткани
- 2200001 Крем для кожи
|
РОССИЙСКАЯ ФЕДЕРАЦИЯ

ФЕДЕРАЛЬНАЯ СЛУЖБА
ПО ИНТЕЛЛЕКТУАЛЬНОЙ СОБСТВЕННОСТИ
ПАТЕНТАМ И ТОВАРНЫМ ЗНАКАМ
|
Патент №2333007 |
54) ПОЛИПЕПТИДНЫЕ ВАКЦИНЫ ДЛЯ ШИРОКОЙ ЗАЩИТЫ ПРОТИВ РЯДОВ ПОКОЛЕНИЙ МЕНИНГОКОККОВ С ПОВЫШЕННОЙ ВИРУЛЕНТНОСТЬЮ
(57) Реферат:
Изобретение относится к области медицины и касается полипептидных вакцин для широкой защиты против сверхвирулентных рядов поколений менингококков. Сущность изобретения включает композицию, которая после введения индивидууму способна индуцировать гуморальный иммунный ответ у данного индивидуума, причем гуморальный иммунный ответ оказывает бактерицидное действие против двух или трех из сверхвирулентных рядов поколений А4, ЕТ5 и ряда поколений 3 серогруппы В N.meningitidis наружной мембраны. Используются пять белковых антигенов, в частности: (1) белок "NadA"; (2) белок «741»; (3) белок «936»; (4) белок «953» и (5) белок «287». Преимущество изобретения состоит в разработке вакцины против двух или более рядов поколений сверхвирулентных менингококков. 6 н. и 23 з.п. ф-лы, 1 табл.
Все приведенные в настоящем описании документы полностью включены в него в качестве ссылки.
Область техники, к которой относится изобретение
Изобретение относится к области иммунологии и вакцинологии. В частности, оно относится к антигенам из Neisseria meningitidis (менингококка) и их применению при иммунизации.
Уровень техники
N. meningitidis представляет собой неподвижный, грамотрицательный человеческий патоген, который колонизирует глотку и вызывает менингит (и, изредка, септицемию в отсутствие менингита). Он вызывает и эндемическое, и эпидемическое заболевание. После внедрения конъюгированной вакцины против Haemophilus influenzae, N. meningitidis представляет собой основную причину бактериального менингита в США.
На основании капсулярного полисахарида организма были идентифицированы различные серогруппы N. meningitidis. Серогруппа А представляет собой патоген, чаще всего вызывающий эпидемическую заболеваемость в Африке южнее Сахары. Серогруппы В и С ответственны за огромное количество случаев в США и в большинстве развитых стран. Серогруппы W135 и Y ответственны за остальные случаи в США и развитых странах. После серогруппы классификация включает серотип, сероподтип, а затем иммунотип и в стандартной номенклатуре перечисляется серогруппа, серотип, сероподтип и иммунотип, каждый из которых отделен двоеточием, например, B:4:P1.15:L3,7,9. В пределах серогруппы В некоторые ряды поколений вызывают заболевание часто (сверхинвазивные), некоторые ряды (последовательности) поколений вызывают более тяжелые формы заболевания, чем другие (сверхвирулентные), а другие вообще редко вызывают заболевание. Признаны 7 сверхвирулентных рядов поколений, а именно, подгруппы I, III и IV-1, комплекс ЕТ-5, комплекс ЕТ-37, кластер А4 и ряд поколений 3. Они были определены многолокусным ферментным электрофорезом (MLEE), но многолокусное типирование последовательностей (MLST) также использовалось для классификации менингококков (ссылка 1).
Полисахаридная вакцина против серогрупп А, С, W135 и Y была известна в течение многих лет [2,3], но получить вакцину против серогруппы В оказалось невозможным. Были испытаны вакцины на основе пузырьков наружной оболочки (например, см. ссылку 4), но защита, обеспечиваемая этими вакцинами, обычно ограничена штаммом, используемым для изготовления вакцины. Поэтому остается потребность в широко эффективной вакцине против серогруппы В.
Сообщалось о геномных последовательностях для менингококковых серогрупп А [5] и В [6,7], и последовательность серогруппы В исследовали для идентификации антигенов вакцины (например, ссылки 8-13). Перспективными антигенами манипулировали для улучшения гетерологичной экспрессии (ссылки 14-16).
Задачей изобретения является получение дополнительных и улучшенных композиций для обеспечения иммунитета против менингококкового заболевания и/или инфекции и, в частности, для обеспечения широкого иммунитета против менингококка серогруппы В.
Раскрытие изобретения
Вакцины против патогенов, таких как вирус гепатита В (HBV), возбудителей дифтерии и столбняка, содержат один белковый антиген (например, поверхностный антиген HBV, или столбнячный токсоид). Напротив, бесклеточные вакцины против коклюша обычно содержат, по меньшей мере, 3 белка B.pertussis, а пневмококковая вакцина PrevenarTM содержит 7 отдельных конъюгированных сахаридных антигенов. Другие вакцины, такие как клеточная вакцина против коклюша, вакцина против кори, инактивированная вакцина против полиомиелита (IPV) и менингококковые OMV вакцины по происхождению представляют собой сложные смеси большого числа антигенов.
Поэтому то, может ли защита против инфекции патогеном быть вызвана одним антигеном, небольшим количеством определенных антигенов или сложной смесью неопределенных антигенов, зависит от рассматриваемого патогена. Изобретение основано на открытии, что небольшое количество определенных антигенов способно обеспечить широкий спектр защиты против менингококковой инфекции, и изобретение включает композицию, которая после введения индивидууму способна вызвать (индуцировать) антительный ответ (гуморальный иммунный ответ) у данного индивидуума, причем гуморальный иммунный ответ оказывает бактерицидное действие против двух или нескольких (например, 2 или 3) сверхвирулентных рядов поколений А4, ЕТ-5 и ряда поколений 3 серогруппы В N.meningitidis.
Предпочтительнее, чтобы композиция изобретения состояла не из одного антигена, а включала смесь 10 или менее (например, 9, 8, 7, 6, 5, 4, 3, 2) очищенных антигенов, и особенно предпочтительно, чтобы композиция не включала сложные или неопределенные смеси антигенов, например, предпочтительно, чтобы композиция не включала пузырьки наружной мембраны.
Для менингококка серогруппы В было обнаружено, что смесь пяти определенных белковых антигенов белков вызывает хорошую защитную иммунную реакцию. Таким образом, изобретение включает композицию, включающую следующие пять менингококковых белковых антигенов: (1) белок "NadA" (2) белок «741»; (3) белок «936»; (4) белок «953» и (5) белок «287». Указанные антигены именуются в данном описании как «5 основных антигенов».
Белок "NadA"
"NadA" (адгезин А Neisseriae) из серогруппы В. N.meningitidis раскрыт в виде белка «961» в ссылке 10 (SEQ ID NO 2943 и NO 2944) и в виде «NMB1994» в ссылке 6 (см. также номера доступа генного банка 11352904 и 7227256). Подробное описание белка можно найти в ссылке 17. В серогруппе А нет соответствующего белка (5, 17).
При использовании в соответствии с настоящим изобретением, NadA может принимать различные формы. Предпочтительными формами NadA являются усеченные или делеционные варианты, такие как варианты, раскрытые в ссылках 14-16. В частности, предпочтителен NadA без его С-концевого мембранного якоря (например, делеция остатков 351-405 для штамма 2996 [SEQ ID NO 1]), который иногда определяется в настоящем описании использованием надстрочного «С», например, NadA(С). Экспрессия NadA без его домена мембранного якоря (например, SEQ ID NO 1) в E.coli приводит к секреции белка в надосадочную жидкость культуры с сопутствующим удалением его 23-мерного лидерного пептида (например, для оставления 327-мера для штамма 2996 [SEQ ID NO 2]). Полипептиды без их лидерных пептидов иногда определяются в настоящем описании использованием надстрочного «NL», например, NadA(NL) или NadA(С)(NL).
Предпочтительные последовательности NadA имеют идентичность 50% или более (например, 60%, 70%, 80%, 90%, 95%, 99% или более) с SEQ ID NO 2. Она включает варианты NadA (например, аллельные варианты, гомологи, ортологи, паралоги, мутанты и т.д.). Аллельные формы NadA показаны на фиг.9 ссылки 18.
Другие предпочтительные последовательности NadA включают, по меньшей мере, n последовательных аминокислот из SEQ ID NO 1, где n равно 7 или более (например, 8, 10, 12, 14, 16, 18, 20, 25, 30, 35, 40, 50, 60, 70, 80, 90, 100, 150, 200, 250 или более). Предпочтительные фрагменты включают эпитоп из NadA. Другие предпочтительные фрагменты лишены одной или нескольких аминокислот (например, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 15, 20, 25 или более) из С-конца и/или N-конца SEQ ID NO 1 (например, NadA(С), NadA(NL) или NadA(С)(NL)). Когда остатки N-конца устраняются, предпочтительно, чтобы делеция не устранила способность NadA прилипать к человеческим эпителиальным клеткам. Предпочтительным фрагментом SEQ ID NO 1 является SEQ ID NO 2.
Секретируемый NadA можно удобно получить в высоко очищенной форме из надосадочной жидкости культуры способом, включающим этапы: концентрации и диафильтрации против буфера ультрафильтрацией; анионной колоночной хроматографии; гидрофобной колоночной хроматографии; колоночной хроматографии на гидроксиапатитной керамике; диафильтрации против буфера и фильтрационной стерилизации. Дополнительные детали способа представлены в примерах.
NadA предпочтительно используется в олигомерной форме (например, в тримерной форме).
Белок 741
Белок «741» из серогруппы В раскрыт в ссылке 10 (SEQ ID NO 2535 & 2536) и в виде "NMB1870" в ссылке 6 (см. также номер доступа генного банка GI:7227128). Соответствующий белок в серогруппе А (5) имеет номер доступа генного банка 7379322. 741 по структуре представляет собой липопротеин.
При использовании в соответствии с настоящим изобретением белок 741 может иметь различные формы. Предпочтительными формами 741 являются усеченные или делеционные варианты, такие как формы, раскрытые в ссылках 14-16. В частности, N-конец 741 может подвергнуться делеции до поли-глициновой последовательности и включая ее (т.е. делеции остатков 1-72 для штамма МС58 [SEQ ID NO 3]), которая иногда определяется в настоящем описании использованием приставки " G". Данная делеция может усилить экспрессию. Делеция также удаляет сайт липидирования «741». G". Данная делеция может усилить экспрессию. Делеция также удаляет сайт липидирования «741».
Предпочтительные последовательности 741 имеют идентичность 50% или более (например, 60%, 70%, 80%, 90%, 95%, 99% или более) с SEQ ID NO 3. Она включает варианты 741 (например, аллельные варианты, гомологи, ортологи, паралоги, мутанты и т.д.). Аллельные формы 741 можно найти в SEQ ID NO от 1 до 22 ссылки 16 и в SEQ ID NO от 1 до 23 ссылки 19. В SEQ ID NO 1-299 ссылки 20 представлены дополнительные последовательности 741.
Другие предпочтительные последовательности 741 включают, по меньшей мере, n последовательных аминокислот из SEQ ID NO 3, где n = 7 или более (например, 8, 10, 12, 14, 16, 18, 20, 25, 30, 35, 40, 50, 60, 70, 80, 90, 100, 150, 200, 250 или более). Предпочтительные фрагменты включают эпитоп из 741. Другие предпочтительные фрагменты лишены одной или более аминокислот (например, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 15, 20, 25 или более) из С-конца и/или N-конца SEQ ID NO 3.
Белок 741 представляет собой крайне эффективный антиген для того, чтобы вызвать гуморальный иммунный ответ против менингококков, и он экспрессирован во всех менингококковых серогруппах. Филогенетический анализ показывает, что белок расщепляется на 2 группы и что одна из них расщепляется снова для получения всего трех вариантов (21), и, хотя сыворотка, выработанная против данного варианта, является бактерицидной в пределах группы того же варианта, она не активна против штаммов, которые экспрессируют один из других двух вариантов, т.е. существует перекрестная защита внутри вариантов, но неперекрестная защита между вариантами. Поэтому для максимальной эффективности между штаммами предпочтительно, чтобы композиция включала более одного варианта белка 741. Иллюстративная последовательность из каждого варианта представлена в настоящем описании в SEQ ID NO 10, 11 и 12, начиная с N-концевого цистеинового остатка, к которому будет ковалентно прикреплен липид в липопротеиновой форме 741.
Поэтому предпочтительно, чтобы композиция включала, по меньшей мере, 2 из: (1) первого белка, включающего аминокислотную последовательность, имеющую, по меньшей мере, а% идентичность с последовательностью SEQ ID NO 10 и/или включающего аминокислотную последовательность, состоящую из фрагмента, по меньшей мере, х смежных аминокислот из SEQ ID NO 10; (2) второго белка, включающего аминокислотную последовательность, имеющую, по меньшей мере, b% идентичность с SEQ ID NO 11 и/или включающего аминокислотную последовательность, состоящую из фрагмента, по меньшей мере, из у смежных аминокислот из SEQ ID NO 11; и (3) третьего белка, включающего аминокислотную последовательность, имеющую, по меньшей мере, с% идентичность с SEQ ID NO 12 и/или включающую аминокислотную последовательность, состоящую из фрагмента, по меньшей мере, z смежных аминокислот из SEQ ID NO 12.
Величина а составляет, по меньшей мере, 85, например, 86, 87, 88, 89, 90, 91, 92, 93, 94, 95, 96, 97, 98, 99, 99,5 или более. Величина b составляет, по меньшей мере, 85, например, 86, 87, 88, 89, 90, 91, 92, 93, 94, 95, 96, 97, 98, 99, 99,5 или более. Величина с составляет, по меньшей мере, 85, например, 86, 87, 88, 89, 90, 91, 92, 93, 94, 95, 96, 97, 98, 99, 99,5 или более. Величины а, b и с не имеют взаимосвязи друг с другом.
Величина х составляет, по меньшей мере, 7, например, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 35, 40, 45, 50, 60, 70, 80, 90, 100, 120, 140, 160, 180, 200, 225, 250). Величина y составляет, по меньшей мере, 7, например, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 35, 40, 45, 50, 60, 70, 80, 90, 100, 120, 140, 160, 180, 200, 225, 250). Величина z составляет, по меньшей мере, 7, например, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 35, 40, 45, 50, 60, 70, 80, 90, 100, 120, 140, 160, 180, 200, 225, 250). Величины x, y и z не имеют взаимосвязи друг с другом.
Предпочтительно, чтобы каждая данная аминокислотная последовательность 741 не подпадала под более одной категории (1), (2) и (3). Таким образом, любая данная последовательность 741 должна подпадать только под одну из категорий (1), (2) и (3). Таким образом, предпочтительно, чтобы: белок (1) имел менее чем i% идентичность последовательности с белком (2); белок (1) имел менее, чем j% идентичность последовательности с белком (3); и белок (2) имел менее, чем k% идентичность последовательности с белком (3). Величина i составляет 60 или более (например, 61, 62, 63, 64, 65, 66, 67, 68, 69, 70, 71, 72, 73, 74, 75, 76, 77, 78, 79, 80, 81, 82, 83, 84, 85, 86, 87, 88. 89, 90 и т.д.) и составляет, максимум а. Величина j составляет 60 или более (например, 61, 62, 63, 64, 65, 66, 67, 68, 69, 70, 71, 72, 73, 74, 75, 76, 77, 78, 79, 80, 81, 82, 83, 84, 85, 86, 87, 88, 89, 90 и т.д.) и составляет, максимум b. Величина k составляет 60 или более (например, 61, 62, 63, 64, 65, 66, 67, 68, 69, 70, 71, 72, 73, 74, 75, 76, 77, 78, 79, 80, 81, 82, 83, 84, 85, 86, 87, 88. 89, 90 и т.д.) и составляет, максимум c. Величины i, j и k не имеют взаимосвязи друг с другом.
Белок 936
Белок «936» из серогруппы В раскрыт в ссылке 10 (SEQ ID NO 2883 и 2884) и в виде "NMB2091" в ссылке 6 (см. также номер доступа генного банка GI:7227353). Соответствующий ген в серогруппе А (5) имеет номер доступа генного банка 7379093.
При использовании в соответствии с настоящим изобретением, белок 936 может иметь различные формы. Предпочтительными формами 936 являются усеченный или делеционный варианты, такие как варианты, раскрытые в ссылках 14-16. В частности, N-концевой лидерный пептид 936 может быть подвергнут делеции (т.е. делеции остатков 1-23 для штамма МС58 [SEQ ID NO 4]) для получения 936(NL).
Предпочтительные последовательности 936 имеют идентичность 50% или более (например, 60%, 70%, 80%, 90%, 95%, 99% или более) с SEQ ID NO 4. Они включают варианты (например, аллельные варианты, гомологи, ортологи, паралоги, мутанты и т.д.).
Другие предпочтительные последовательности 936 включают, по меньшей мере, n последовательных аминокислот из SEQ ID NO 4, где n = 7 или более (например, 8, 10, 12, 14, 16, 18, 20, 25, 30, 35, 40, 50, 60, 70, 80, 90, 100, 150, 200, 250 или более). Предпочтительные фрагменты включают эпитоп из 936. Другие предпочтительные фрагменты лишены одной или более аминокислот (например, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 15, 20, 25 или более) из С-конца и/или N-конца SEQ ID NO 4.
Белок 953
Белок «953» из серогруппы В раскрыт в ссылке 10 (SEQ ID NO 2917 и 2918) и в виде "NMB1030" в ссылке 6 (см. также номер доступа генного банка GI:7226269). Соответствующий белок в серогруппе А (5) имеет номер доступа генного банка 7380108.
При использовании в соответствии с настоящим изобретением белок 953 может иметь различные формы. Предпочтительными формами 953 являются усеченные или делеционные варианты, такие как варианты, раскрытые в ссылках 14-16. В частности, N-концевой лидерный пептид 953 может быть подвергнут делеции (т.е. делеции остатков 1-19 для штамма МС58 (SEQ ID NO 5) для получения 953(NL).
Предпочтительные последовательности 953 имеют идентичность с SEQ ID NO 5 50% или более (например, 60%, 70%, 80%, 90%, 95%, 99% или более). Они включают варианты 953 (например, аллельные варианты, гомологи, ортологи, паралоги, мутанты и т.д.). Аллельные формы 953 показаны на фиг.19 ссылки 12.
Другие предпочтительные последовательности 953 включают, по меньшей мере, n последовательных аминокислот из SEQ ID NO 5, где n = 7 или более (например, 8, 10, 12, 14, 16, 18, 20, 25, 30, 35, 40, 50, 60, 70, 80, 90, 100, 150, 200, 250 или более). Предпочтительные фрагменты включают эпитоп из 953. Другие предпочтительные фрагменты лишены одной или более аминокислот (например, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 15, 20, 25 или более) из С-конца и/или N-конца SEQ ID NO 5.
Белок 287
Белок «287» из серогруппы В раскрыт в ссылке 10 (SEQ ID NO 3103 и 3104) и в виде "NMB2132" в ссылке 6 и в виде "GNA2132" в ссылке 13 (см. также номер доступа генного банка GI:7227388). Соответствующий белок в серогруппе А (5) имеет номер доступа генного банка 7379057.
При использовании в соответствии с настоящим изобретением, белок 287 может иметь различные формы. Предпочтительными формами 287 являются усеченные или делеционные варианты, такие как варианты, раскрытые в ссылках 14-16. В частности, N-конец 287 может быть подвергнут делеции до его полиглициновой последовательности и включая ее (т.е. делеции остатков 1-24 для штамма МС58 (SEQ ID NO 6)), которая иногда идентифицируется в настоящем описании использованием приставки " G". Делеция может усилить экспрессию. G". Делеция может усилить экспрессию.
Предпочтительные последовательности 287 имеют идентичность с SEQ ID NO 6 50% или более (например, 60%, 70%, 80%, 90%, 95%, 99% или более). Они включают варианты 287 (например, аллельные варианты, гомологи, ортологи, паралоги, мутанты и т.д.). Аллельные формы 287 показаны на фиг.5 и 15 ссылки 12 и в примере 13 и на фиг.21 ссылки 10 (SEQ ID NO 3179-3184).
Другие предпочтительные последовательности 287 включают, по меньшей мере, n последовательных аминокислот из SEQ ID NO 6, где n = 7 или более (например, 8, 10, 12, 14, 16, 18, 20, 25, 30, 35, 40, 50, 60, 70, 80, 90, 100, 150, 200, 250 или более). Предпочтительные фрагменты включают эпитоп из 287. Другие предпочтительные фрагменты лишены одной или более аминокислот (например, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 15, 20, 25 или более) из С-конца и/или N-конца SEQ ID NO 6.
Слитые белки
5 антигенов могут присутствовать в композиции в виде 5 отдельных белков, но предпочтительно, чтобы, по меньшей мере, 2 из антигенов были экспрессированы в виде одиночной полипептидной цепи (слитый («гибридный») белок (ссылки 14-16)), например, 5 антигенов из менее, чем 5 полипептидов. Гибридные белки предоставляют 2 основных преимущества: во-первых, белку, который может быть неустойчивым или слабо экспрессированным сам по себе, можно помочь добавлением подходящего гибридного партнера, который преодолевает указанную проблему; во-вторых, упрощается промышленное изготовление, поскольку необходимо использовать только одну экспрессию и очистку для продукции двух отдельно используемых белков.
Гибридный белок, включенный в композицию по изобретению, может включать 2 или более (т.е., 2, 3, 4 или 5) из 5 основных антигенов. Предпочтительны гибриды, состоящие из 2 из 5 основных антигенов.
В пределах комбинации 5 основных антигенов антиген может присутствовать в более, чем одном гибридном белке и/или в виде негибридного белка. Однако предпочтительно, чтобы антиген присутствовал или виде гибрида, или в виде не гибрида, но не в виде обоих, хотя может быть полезным включить белок 741 как в виде гибридного, так и в виде негибридного (предпочтительно, липопротеинового) антигена, в частности, когда используют более одного варианта 741.
Двухантигенные гибриды для использования в изобретении включают: NadA и 741; NadA и 936; NadA и 953; NadA и 287; 741 и 936; 741 и 953; 741 и 287; 936 и 953; 936 и 297; 953 и 287. Предпочтительные двухантигенные гибриды включают: 741 и 936; 953 и 287.
Гибридные белки могут быть представлены формулой NH2-A-[-X-L-]n-B-COOH, где: Х представляет собой аминокислотную последовательность одного из пяти основных антигенов; L представляет собой необязательную линкерную аминокислотную последовательность; А представляет собой необязательную N-концевую аминокислотную последовательность; В представляет собой необязательную С-концевую аминокислотную последовательность и n=2, 3, 4 или 5.
Если часть -Х- имеет лидерную пептидную последовательность в ее форме дикого типа, то она может быть включена в гибридный белок или пропущена в нем. В некоторых вариантах реализации лидерные пептиды будут подвергнуты делеции, за исключением таковых части -Х-, расположенной на N-конце гибридного белка, т.е., лидерный пептид Х1 будет сохранен, но лидерные пептиды Х2...Хn будут пропущены. Это представляет собой эквивалент делеции всех лидерных пептидов и использованию лидерного пептида Х1 в качестве части -А-.
Для каждых n случаев [-X-L-] линкерная аминокислотная последовательность -L- может присутствовать или отсутствовать. Например, когда n=2, гибрид может представлять собой NH2-X1-L1-X2-L2-COOH, NH2-X1-X2-COOH, NH2-X1-L1-X2-COOH, NH2-X1-X2-L2-COOH, и т.д. Линкерная аминокислотная последовательность(и) -L- будет обычно короткой (например, из 20 или менее аминокислот, т.е., 19, 18, 17, 16, 15, 14, 13, 12, 11, 10, 9, 8, 7, 6, 5, 4, 3, 2, 1). Примеры включают короткие пептидные последовательности, которые способствуют клонированию, полиглициновые линкеры (т.е., включающие Clyn, где n = 2, 3, 4, 5, 6, 7, 8, 9, 10 или более) и гистидиновые метки (т.е., Hisn, где n = 3, 4, 5, 6, 7, 8, 9, 10 или более). Другие подходящие линкерные аминокислотные последовательности будут очевидны для специалистов в данной области. Полезным линкером является GSGGGG (SEQ ID NO 9), причем дипептид Gly-Ser образован из сайта рестрикции BamHI, таким образом, способствуя клонированию и манипуляции, а тетрапептид (Gly)4 представляет собой типичный полиглициновый линкер. Если Хn+1 представляет собой белок  G, а Ln представляет собой глициновый линкер, то он может быть эквивалентен Хn+1, не представляющему собой белок G, а Ln представляет собой глициновый линкер, то он может быть эквивалентен Хn+1, не представляющему собой белок  G, и отсутствующему Ln. G, и отсутствующему Ln.
-А- представляет собой необязательную N-концевую аминокислотную последовательность. Она обычно будет короткой (например, из 40 или менее аминокислот, т.е. 39, 38, 37, 36, 35, 34, 33, 32, 31, 30, 29, 28, 27, 26, 25, 24, 23, 22, 21, 20, 19, 18, 17, 16, 15, 14, 13, 12, 11, 10, 9, 8, 7, 6, 5, 4, 3, 2, 1). Примеры включают лидерные последовательности для направления транспорта белка или короткие пептидные последовательности, которые облегчают клонирование или очистку (например, гистидиновые метки, т.е., Hisn, где n = 3, 4, 5, 6, 7, 8, 9, 10 или более). Другие подходящие N-концевые аминокислотные последовательности будут очевидны для специалистов в данной области. Если Х1 лишен его собственного метионина N-конца, -А- представляет собой предпочтительно олигопептид (например, с 1, 2, 3, 4, 5, 6, 7 или 8 аминокислотами), который обеспечивает наличие метионина на N-конце.
-В- представляет собой необязательную С-концевую аминокислотную последовательность. Она обычно будет короткой (например из 40 или менее аминокислот, т.е., 39, 38, 37, 36, 35, 34, 33, 32, 31, 30, 29, 28, 27, 26, 25, 24, 23, 22, 21, 20, 19, 18, 17, 16, 15, 14, 13, 12, 11, 10, 9, 8, 7, 6, 5, 4, 3, 2, 1). Примеры включают последовательности для направления транспорта белка, короткие пептидные последовательности, которые облегчают клонирование или очистку (например, гистидиновые метки, т.е., Hisn, где n = 3, 4, 5, 6, 7, 8, 9, 10 или более) или последовательности, которые усиливают устойчивость белка. Другие подходящие С-концевые аминокислотные последовательности будут очевидны для специалистов в данной области.
Наиболее предпочтительно, n = 2. Двумя предпочтительными белками данного типа являются: Х1 представляет собой 936 и Х2 представляет собой 741; Х1 представляет собой 287 и Х2 представляет собой 953.
Двумя особенно предпочтительными гибридными белками изобретения являются следующие:
| n |
A |
X1 |
L1 |
X2 |
L2 |
B |
[SEQ ID] |
| 2 |
MA |
 G287 G287 |
GSGGGG |
953(NL) |
- |
- |
7 |
| 2 |
M |
936(NL) |
GSGGGG |
 G741 G741 |
- |
- |
8 |
Указанные 2 белка можно использовать в комбинации с NadA (в частности, с SEQ ID NO 2).
Гибрид 936- G741 можно удобно получить в высоко очищенной форме при его экспрессии у E.coli способом, включающим этапы: гомогенизации; центрифугирования; катионной колоночной хроматографии; анионной колоночной хроматографии; гидрофобной колоночной хроматографии; диафильтрации против буфера; и стерилизации фильтрованием. Дополнительные детали способа представлены в примерах. G741 можно удобно получить в высоко очищенной форме при его экспрессии у E.coli способом, включающим этапы: гомогенизации; центрифугирования; катионной колоночной хроматографии; анионной колоночной хроматографии; гидрофобной колоночной хроматографии; диафильтрации против буфера; и стерилизации фильтрованием. Дополнительные детали способа представлены в примерах.
Последовательности
Изобретение включает полипептид, имеющий аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO 1-8. Оно также включает полипептиды, имеющие аминокислотную последовательность с идентичностью с аминокислотной последовательностью, выбранной из группы, состоящей из SEQ ID NO 1-8. Как описано выше, степень идентичности последовательности составляет предпочтительно более 50% (например, 60%, 70%, 80%, 90%, 95%, 99% или более).
Изобретение также включает полипептид, содержащий фрагмент последовательности NadA N.meningitidis, где указанный фрагмент сохраняет способность адгезии NadA к эпителиальным клеткам человека. Таким образом, предпочтительны фрагменты, которые сохраняют аминокислоты 24-87 NadA полной длины. Предпочтительные фрагменты лишены N-концевого лидерного пептида указанной NadA и/или С-концевого мембранного якорного домена указанной NadA. Настоящее изобретение не включает в свой объем ни один из фрагментов NadA, раскрытый в предшествующем уровне техники, например, в ссылках 6-18. У NadA полной длины (17), SEQ ID NO 1 лишена мембранного якорного домена, а SEQ ID NO 2 лишена лидерного пептида.
Изобретение также включает нуклеиновую кислоту, кодирующую такие полипептиды. Кроме того, изобретение включает нуклеиновую кислоту, которая может гибридизироваться к данной нуклеиновой кислоте, предпочтительно в «жестких условиях» (например, 65°С в 0,1хSSC, 0,5% раствор SDS, додецилсульфата натрия).
Полипептиды по изобретению можно получить различными средствами (например, рекомбинантной экспрессией, очисткой из культуры клеток, химическим синтезом (по меньшей мере, частично) и т.д.) и в различных формах (например, нативной, гибридной, негликозилированной, липидированной и т.д.). Их предпочтительно получают по существу в чистой форме (т.е., по существу лишенными белков другой N.meningitidis или белков клеток-хозяев).
Нуклеиновую кислоту в соответствии с изобретением можно получить многими путями (например, химическим синтезом (по меньшей мере, частично) из геномной или кДНК библиотек, из самого организма и т.д.), и она может принимать различные формы (например, однонитевую, двухнитевую, векторов, зондов и т.д.). Их предпочтительно получают по существу в чистой форме (т.е., по существу лишенными нуклеиновых кислот другой N.meningitidis или нуклеиновых кислот клеток-хозяев).
Термин «нуклеиновая кислота» включает ДНК и РНК, а также их аналоги, такие как аналоги, содержащие модифицированные каркасы (например, фосфоротиоаты и т.д.), а также пептидные нуклеиновые кислоты (PNA) и т.д. Изобретение включает нуклеиновую кислоту, включающую последовательности, комплементарные таковым, описанным выше (например, для антисмысловых или зондирующих целей).
Изобретение также включает способ получения полипептида по изобретению, предусматривающий этап культивирования клетки-хозяина, трансформированной нуклеиновой кислотой по изобретению, в условиях, которые вызывают экспрессию полипептида.
Изобретение включает способ получения полипептида по изобретению, включающий этап синтеза, по меньшей мере, части полипептида химическими средствами.
Изобретение включает способ получения нуклеиновой кислоты по изобретению, предусматривающий этап амплификации нуклеиновой кислоты с использованием способа амплификации на основе праймера (затравки) (например, PCR, полимеразной реакцией синтеза цепи).
Изобретение включает способ получения нуклеиновой кислоты по изобретению, предусматривающий этап синтеза, по меньшей мере, части нуклеиновой кислоты химическими средствами.
Штаммы
Предпочтительные белки по изобретению включают аминокислотную последовательность, обнаруженную в серогруппе В N.meningitidis. В пределах серогруппы В предпочтительными штаммами являются 2996, МС58, 95N477 и 394/98. Штамм 394/98 иногда именуется в настоящем описании "NZ", поскольку он представляет собой новозеландский штамм.
Белок 287 предпочтительно происходит из штамма 2996 или, предпочтительнее, из штамма 394/98.
Белок 741 предпочтительно происходит из штаммов МС58, 2996, 394/98 или 95N477 серогруппы В или из штамма 90/18311 серогруппы С. Предпочтительнее штамм МС58.
Белки 936, 953 и NadA предпочтительно происходит из штамма 2996.
Штаммы могут быть указаны в виде подстрочной надписи, например, 741МС58 представляет собой белок 741 из штамма МС58. При отсутствии других указаний, указанные в настоящем описании белки (например, без подстрочной надписи) получены из штамма 2996 N.meningitidis, который может быть принят за «эталонный» штамм. Однако следует понимать, что изобретение в целом не ограничено данным штаммом. Как указано выше, общие ссылки на белок (например, «287», «919» и т.д.) могут применяться для включения указанного белка из любого штамма. Он обычно будет иметь идентичность последовательности с 2996 90% или более (например, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или более).
Когда композиция включает конкретный белковый антиген (например, 741 или 287), композиция может включать указанный антиген в форме нескольких вариантов, например, один и тот же белок, но из нескольких штаммов. Данные белки могут быть включены в виде тандемных или отдельных белков.
Когда используются гибридные белки, отдельные антигены в пределах гибрида (т.е., отдельные части -Х-) могут быть из одного или нескольких штаммов. Например, когда n=2, Х2 может быть из того же штамма, что Х1 или из другого штамма. Когда n=3, штамм может представлять собой (i) X1=X2=X3 (ii) X1=X2 X3 (iii) X1 X3 (iii) X1 X2=X3 (iv) X1 X2=X3 (iv) X1 X2 X2 X3 или (v) X1=X3 X3 или (v) X1=X3 X2 и т.д. X2 и т.д.
Сверхвирулентные ряды поколений и реакции бактерицидных антител
В целом, композиции по изобретению способны вызвать бактерицидные реакции сывороточных антител после введения индивидууму. Данные реакции можно измерить у мышей, и они представляют собой стандартный показатель эффективности вакцины (например, см. концевое примечание 14 ссылки 13). Бактерицидная активность сыворотки (SBA) измеряет уничтожение бактерий, опосредованное комплементом, и ее можно анализировать с использованием комплемента человека или крольчонка. Стандарты ВОЗ требуют, чтобы вакцина вызывала, по меньшей мере, 4-кратное увеличение SBA более, чем у 90% реципиентов.
Вместо обеспечения узкой защиты композиции по изобретению могут вызвать бактерицидный гуморальный иммунный ответ против нескольких сверхвирулентных рядов поколений серогруппы В. В частности, они могут вызывать бактерицидные реакции против 2 или 3 из следующих трех сверхвирулентных рядов поколений: (i) кластер А4; (ii) комплекс ЕТ5 и (ii) ряд поколений 3. Они могут дополнительно вызывать бактерицидные гуморальные иммунные ответы против одного или нескольких сверхвирулентных рядов поколений подгруппы I, подгруппы III, подгруппы IV-1 или комплекса ЕТ-37 и против других рядов поколений, например, сверхинвазивные ряды поколений.
Это необязательно означает, что композиция может вызвать выработку бактерицидных антител против каждого и всех штаммов менингококка группы В в пределах указанных сверхвирулентных рядов поколений, например, скорее для каждой данной группы из 4 или более штаммов менингококка серогруппы В в пределах конкретного сверхвирулентного ряда поколений, антитела, вызванные композицией, являются бактерицидными против, по меньшей мере, 50% (например, 60%, 70%, 80%, 90% или более) группы. Предпочтительные группы штаммов будут включать штаммы, выделенные, по меньшей мере, в четырех из следующих стран: GB, AU, CA, NO, IT, US, NZ, NL, BR и CU. Сыворотка предпочтительно имеет бактерицидный титр, по меньшей мере, 1024 (например, 210, 211, 212, 213, 214, 215, 216, 217, 218 или выше, предпочтительно, по меньшей мере, 214), т.е., сыворотка способна уничтожить, по меньшей мере, 50% испытуемых бактерий определенного штамма при разведении 1/1024, как описано в ссылке 13.
Предпочтительные композиции могут включать бактерицидные реакции против следующих штаммов менингококка серогруппы В: (i) из кластера А4, штамма 961-5945 (B:2b:P1.21,16) и/или штамма G2136 (B:-); (ii) из комплекса ЕТ-5, штамма МС58 (В:15:Р1.7,16b) и/или штамма 44/76 (В:15:Р1.7,16); (iii) из ряда поколений 3, штамма 394/98 (В:4:P1.4) и/или штамма BZ198 (B:NT:-). Более предпочтительные композиции могут вызвать бактерицидные реакции против штаммов 961-5945, 44/76 и 394/98.
Оба штамма 961-5945 и G2136 представляют собой эталонные штаммы Neisseria MLST (идентификационные №№ 638 и 1002 в ссылке 22). Штамм МС58 широко доступен (например, АТСС ВАА-335) и представлял собой штамм, секвенированный в ссылке 6. Штамм 44/76 широко использовался и характеризовался (например, ссылка 23) и представляет собой один из эталонных штаммов Neisseria MLST (идентификационный № 237 в ссылке 22; ряд 32 табл.2 в ссылке 1). Штамм 394/98 был первоначально выделен в Новой Зеландии в 1998 г, и было несколько опубликованных исследований с использованием данного штамма (например, ссылки 24 и 25). Штамм BZ198 представляет собой другой эталонный штамм MLST (идентификационный № 409 в ссылке 22; ряд 41 табл.2 в ссылке 1).
Композиция может дополнительно вызывать бактерицидную реакцию против штамма LNP17592 (W135:2a:P1.5,2) серогруппы W135 из комплекса ЕТ-37. Он представляет собой штамм Haji, выделенный во Франции в 2000 г.
Гетерологичный хозяин
Хотя экспрессия белков по изобретению может происходить у Neisseria, согласно настоящему изобретению, предпочтительно используется гетерологичный хозяин. Гетерологичный хозяин может быть прокариотическим (например, бактерией) или эукариотическим. Он представляет собой предпочтительно E.coli, но другие подходящие хозяева включают Bacillus subtilis, Vibrio cholerae, Salmonella typhi, Salmonella typhimurium, Neisseria lactamica, Neisseria cinerea, Mycobacteria (т.е. M.tuberculosis), дрожжи и т.д.
Таким образом, изобретение включает композицию, которая после введения индивидууму способна вызвать гуморальный иммунный ответ у данного индивидуума, причем гуморальный иммунный ответ является бактерицидным против двух или более (например, 2 или 3) сверхвирулентных рядов поколений А4, ЕТ-5 и ряда поколений 3 серогруппы В N.meningitidis, и в которой иммуногены в композиции, которые вызывают развитие гуморального иммунного ответа, получены рекомбинантной экспрессией у хозяина, не являющегося Neisseria. Таким образом, иммуногены в композициях по изобретению представляют собой предпочтительно рекомбинантные иммуногены. Таким образом, могут быть предпочтительны композиции, которые не включают препараты OMV.
Иммуногенные композиции и лекарственные средства
Композиции по изобретению являются иммуногенными и, предпочтительнее, представляют собой вакцинные композиции. Вакцины в соответствии с изобретением могут быть или профилактическими (т.е. для предотвращения инфекции), или терапевтическими (т.е. для лечения инфекции), но обычно будут профилактическими.
рН композиции составляет предпочтительно от 6 до 8, предпочтительно, приблизительно 7. Устойчивый рН можно поддерживать использованием буфера. Когда композиция включает гидроокись алюминия, предпочтительно использовать гистидиновый буфер (26). Композиция может быть стерильной и/или лишенной пирогенов. Композиции по изобретению могут быть изотоничными при введении людям.
Композиции могут быть представлены во флакончиках, или они могут быть представлены в виде готовых к употреблению заполненных шприцев. Шприцы могут поставляться с иглами или без них. Шприц будет включать одну дозу композиции, тогда как флакончик может включать одну дозу или множество доз. Композиции для инъекций будут обычно представлять собой жидкие растворы или суспензии. Альтернативно, они могут быть представлены в твердой форме (например, лиофилизированными) для растворения или суспендирования в жидких носителях перед инъекцией.
Композиции по изобретению могут быть упакованы в стандартной дозированной форме, содержащей одну дозу или множество доз. Для форм, содержащих множество доз, флакончики предпочтительнее предварительно заполненных шприцев. Эффективные дозированные формы можно установить обычными способами, но типичная доза композиции для инъекции человеку имеет объем 0,5 мл.
Когда композицию по изобретению предстоит готовить непосредственно перед применением (например, когда компонент представлен в лиофилизированной форме), и она представлена в виде набора, набор может включать 2 флакончика или он может включать один готовый к использованию заполненный шприц и один флакончик, причем содержимое шприца используется для реактивации содержимого флакончика перед инъекцией.
Изобретение также включает композицию по изобретению для применения в качестве лекарственного средства. Лекарственное средство предпочтительно способно вызвать иммунную реакцию у млекопитающего (т.е. оно представляет собой иммуногенную композицию) и, предпочтительнее, представляет собой вакцину.
Изобретение также включает применение композиции по изобретению в приготовлении лекарственного средства для того, чтобы вызвать иммунную реакцию у млекопитающего. Оно также включает применение белка "NadA", белка «741», белка «936», белка «953» и белка «287» (и других необязательных антигенов) в приготовлении лекарственного средства для того, чтобы вызвать иммунную реакцию у млекопитающего. Лекарственное средство предпочтительно представляет собой вакцину.
Изобретение также включает способ получения иммунной реакции у млекопитающего, предусматривающий этап введения эффективного количества композиции по изобретению. Иммунная реакция является предпочтительно защитной и предпочтительно включает антитела. Способ может вызвать бустерную реакцию.
Млекопитающее предпочтительно представляет собой человека. Когда вакцина предназначена для профилактического применения, человек предпочтительно представляет собой ребенка (например, начинающего ходить ребенка или младенца); когда вакцина предназначена для терапевтического применения, человек предпочтительно представляет собой взрослого. Вакцину, предназначенную для детей, можно также вводить взрослым, например, для оценки безопасности, дозировки, иммуногенности и т.д.
Указанные виды применения и способы предпочтительно предназначены для предотвращения и/или лечения заболевания, вызванного Neisseria (например, менингита, септицемии, бактеремии, гонореи и т.д.). Предпочтительно предотвращение и/или лечение бактериального или менингококкового менингита.
Один путь проверки эффективности терапевтического лечения включает контроль инфекции Neisseria после введения композиции по изобретению. Один путь проверки эффективности профилактического лечения включает контроль иммунных реакций против 5 основных антигенов после введения композиции. Иммуногенность композиций по изобретению можно определить введением их испытуемым индивидуумам (например, детям в возрасте 12-16 мес, или экспериментальным моделям [27]), а затем определением стандартных параметров, включая сывороточные бактерицидные антитела (SBA) и титры ELISA (GMT) общего и антикапсулярного IgG с высокой авидностью. Данные иммунные реакции в целом будут определяться приблизительно через 4 нед после введения композиции и сравниваться с величинами, определяемыми перед введением композиции. Предпочтительно увеличение SBA, по меньшей мере, в 4 раза или в 8 раз. Когда вводится несколько доз композиции, можно произвести несколько определений после введения.
Предпочтительные композиции по изобретению могут обеспечить у пациента титр антител, которые выше критерия серологической защиты для каждого антигенного компонента для приемлемой процентной доли людей. Антигены со связанным титром антител, выше которого хозяин считается серологически превращенным против антигена, хорошо известны, и такие титры опубликованы организациями, таким как ВОЗ. Предпочтительно, серологически превращенными являются более, чем 80% статистически значимого образца индивидуумов, предпочтительнее, более чем 90%, еще предпочтительнее, более чем 93% и наиболее предпочтительно, 96-100%.
Композиции по изобретению в целом будут вводиться непосредственно пациенту. Прямую доставку можно осуществить парентеральной инъекцией (например, подкожно, внутрибрюшинно, внутривенно, внутримышечно или в интерстициальное пространство ткани) или ректальным, пероральным, влагалищным, местным, трансдермальным, интраназальным, глазным, ушным, легочным введением или введением через другую слизистую оболочку. Предпочтительно внутримышечное введение в бедро или верхнюю часть плеча. Инъекцию можно произвести посредством иглы (например, игла для подкожных инъекций), но альтернативно можно использовать инъекцию без иглы. Типичной внутримышечной дозой является 0,5 мл.
Изобретение можно использовать для того, чтобы вызвать системный иммунитет и/или иммунитет слизистой оболочки.
Дозированное лечение может представлять собой схему, включающую введение одной дозы или множественных доз. Множественные дозы можно использовать в схеме первичной иммунизации и/или в схеме повторной иммунизации. За схемой, включающей первичную дозу, может следовать схема, включающая дозу для повторной иммунизации. Определение подходящего времени между дозами затравки (например, от 4 до 16 недель) и между затравкой и повторной иммунизацией можно определить обычным способом.
Инфекции Neisseria поражают различные области тела, и поэтому композиции по изобретению можно получить в различных формах. Например, композиции можно получить в виде растворов для инъекций, или в форме жидких растворов, или в форме суспензий. Можно также получить твердые формы, подходящие для растворения или суспендирования в жидких носителях перед инъекцией (например, лиофилизированную композицию). Композицию можно получить для местного введения, например, в виде мази, крема или порошка. Композицию можно получить для перорального введения, например, в виде таблетки или капсулы, или в виде сиропа (необязательно, ароматизированного). Композицию можно получить для легочного введения, например, в виде ингаляции, с использованием мелкого порошка или аэрозоля. Композицию можно получить в виде суппозитория или пессария. Композицию можно получить для интраназального, внутриушного или внутриглазного введения, например, в виде аэрозоля, капель, геля или порошка (например, ссылки 28 и 29). Сообщалось об успехе интраназального введения пневмококковых сахаридов (30, 31), пневмококковых полипептидов (32), сахаридов Hib (33), сахаридов MenC (34) и смесей конъюгатов сахаридов Hib и MenC (35).
Иммуногенные композиции, используемые в качестве вакцин, включают иммунологически эффективное количество антигена (антигенов), а также, при необходимости, любые другие компоненты. Под «иммунологически эффективным количеством» подразумевается, что введение данного количества индивидуума, или в одной дозе, или части серии, эффективно для лечения или предотвращения. Данное количество варьируется в зависимости от состояния здоровья и физического состояния индивидуума, подлежащего лечению, возраста, таксономической группы индивидуума, подлежащего лечению (например, не человекообразная обезьяна, обезьяна и т.д.), способности иммунной системы индивидуума синтезировать антитела, степени желательной защиты, композиции вакцины, оценки лечащим врачом медицинской ситуации и других релевантных факторов. Ожидается, что количество должно подпадать под относительно широкий диапазон, который может быть определен посредством обычных испытаний, и типичное количество каждого менингококкового сахаридного антигена на дозу составляет от 1 мкг до 20 мкг, например, приблизительно 1 мкг, приблизительно 2,5 мкг, приблизительно 4 мкг, приблизительно 5 мкг, или приблизительно 10 мкг (выраженные в виде сахарида).
Другие неантигенные компоненты композиции
Композиция по изобретению будет обычно, кроме указанных выше компонентов, содержать один или несколько «фармацевтически приемлемых носителей», которые включают любой носитель, которые сами по себе не вызывают продукцию антител, вредных для индивидуума, получающего композицию. Подходящие носители обычно представляют собой крупные, медленно метаболизируемые макромолекулы, такие как белки, полисахариды, полимолочные кислоты, полигликолевые кислоты, полимерные аминокислоты, сополимеры аминокислот, сахарозу (36), трегалозу (37), лактозу и агрегаты липидов (такие как масляные капельки или липосомы). Такие носители хорошо известны средним специалистам в данной области. Вакцины могут также содержать разбавители, такие как воду, солевой раствор, глицерин и т.д. Кроме того, могут присутствовать вспомогательные вещества, такие как смачивающие или эмульгирующие вещества, буферные вещества, стабилизирующие рН и им подобные. Типичным носителем является лишенный пирогенов физиологический солевой раствор с фосфатным буфером. Подробное обсуждение фармацевтически приемлемых эксципиентов дано в ссылке 38.
Композиции по изобретению могут включать антимикробное средство, в частности, при упаковке в формат множественных дозировок.
Композиции по изобретению могут включать детергент, например, Tween (полисорбат), такой как Tween 80. Детергенты в целом присутствуют на низких уровнях, например, <0,01%.
Композиции по изобретению могут включать соли натрия (например, хлорид натрия) для придания тоничности. Типична концентрация NaCl 10±2 мг/мл.
Композиции по изобретению будут в целом включать буфер. Типичен фосфатный буфер.
Композиции по изобретению могут включать сахарный спирт (например, манит) или дисахарид (например, сахарозу или трегалозу), например, в концентрации приблизительно 15-30 мг/мл (например, 25 мг/мл), в частности, если их предстоит лиофилизировать, или если они включают материал, который был растворен из лиофилизированного материала. рН композиции для лиофилизации можно довести до приблизительно 6,1 перед лиофилизацией.
Вакцины по изобретению можно вводить в сочетании с другими иммунорегуляторными средствами. В частности, композиции будут обычно включать адъювант. Адъюванты, которые можно использовать в композициях по изобретению, включают, но не ограничиваются:
А. Композиции, содержащие минералы
Содержащие минералы композиции, пригодные для использования в качестве адъювантов в изобретении, включают минеральные соли, такие как соли алюминия и соли кальция. Изобретение включает минеральные соли, такие как гидроокиси (например, оксигидроокиси), фосфаты (например, гидроксифосфаты, ортофосфаты), сульфаты и т.д. (например, см. главы 8 и 9 ссылки 39), или смеси различных минеральных соединений, причем соединения принимают любую походящую форму (например, гелевую, кристаллическую, аморфную и т.д.) причем, предпочтительной является адсорбция. Содержащие минералы композиции можно также составлять в виде частицы соли металла (40).
Особенно предпочтительны фосфаты алюминия, особенно, в композициях, которые включают сахаридный антиген H.influenzae, а типичным адъювантом является аморфный гидроксифосфат алюминия с молярным соотношением PO4/Al от 0,84 до 0,92, включенный в концентрации 0,6 мг Al3+/мл. Можно использовать адсорбцию при низкой дозе фосфата алюминия, например, от 50 до 100 мкг Al3+ на конъюгат на 1 дозу. Когда имеется несколько конъюгатов в композиции, не все конъюгаты должны адсорбироваться.
В. Масляные эмульсии
Композиции в виде масляных эмульсий, подходящие для использования в качестве адъювантов, включают эмульсии сквалена в воде, такие как MF59 [глава 10 ссылки 39; см. также ссылку 41]) (5% сквалена, 0,5% Tween 80 и 0,5% Span 85, составленные в субмикронные частицы, с использованием микрофлюидизатора). Можно также использовать полный адъювант Фрейнда (CFA) и неполный адъювант Фрейнда (IFA).
С. Композиции сапонина (глава 22 ссылки 39)
Композиции сапонина можно также использовать в качестве адъювантов в изобретении. Сапонины представляют собой гетерологичную группу стериновых гликозидов и тритерпеноидных гликозидов, которые обнаруживаются в коре, листьях, стволах, корнях и даже цветах широкого диапазона видов растений. В качестве адъювантов широко исследовались сапонины из коры Quillaia saponaria дерева Молина. Сапонин можно также получить промышленным способом из Smilax ornate (аралии), Gypsophilla paniculata («фата») и Saponaria officianalis (мыльный корень). Композиции сапонинового адъюванта включают очищенные композиции, такие как QS21, а также липидные композиции, такие как композиции ISCOM. QS21 имеется в продаже в виде StimulonTM.
Композиции сапонина были очищены с использованием ВЭЖХ и ВЭЖХ с обращенной фазой. С использованием данных методик были идентифицированы специфические очищенные фракции, включая QS7, QS17, QS18, QS21, QH-A, QH-B и QH-C. Предпочтительно, сапонин представляет собой QS21. Способ получения QS21 раскрыт в ссылке 42. Композиции сапонина могут также включать стерин, такой как холестерин (43).
Комбинации сапонинов и холестеринов можно использовать для образования уникальных частиц, называемых иммуностимулирующими комплексами (ISCOM) (глава 23 ссылки 39). ISCOM обычно также включают фосфолипид, такой как фосфатидилэтаноламин или фосфатидилхолин. В ISCOM можно использовать любой известный сапонин. Предпочтительно, ISCOM включает один или несколько из QuilA, QHA и QHC. ISCOM дополнительно описаны в ссылках 43-45. Необязательно, ISCOM могут быть лишены дополнительного детергента (46).
Обзор разработки адъювантов на основе сапонина можно найти в ссылках 47 и 48.
D. Виросомы и вирусоподобные частицы
Виросомы и вирусоподобные частицы (VLP) можно также использовать в качестве адъювантов в изобретении. Данные структуры в целом один или несколько белков из вируса, необязательно комбинированных или составленных в композицию с фосфолипидом. Они в целом непатогенные, нереплицирующиеся и в целом не содержат ни одного из нативных вирусных геномов. Вирусные белки могут рекомбинантно продуцироваться или выделяться из цельных вирусов. Данные вирусные белки, подходящие для использования в виросомах или VLP, включают белки, полученные из вируса гриппа (такого как НА или NA), вируса гепатита В (такого как коровые или капсидные белки), вирус гепатита Е, вирус кори, вирус Синдбис, ротавирус, вирус ящура, ретровирус, Норфолкский вирус, вирус папилломы человека, ВИЧ, РНК-фаги, Q -фаг (такой как белки покрытия), GA-фаг, fr-фаг, фаг АР205 и Ty (такой как белок р1 ретротранспозона Ty). VLP обсуждены дополнительно в ссылках 49-54. Виросомы обсуждены дополнительно, например, в ссылке 55. -фаг (такой как белки покрытия), GA-фаг, fr-фаг, фаг АР205 и Ty (такой как белок р1 ретротранспозона Ty). VLP обсуждены дополнительно в ссылках 49-54. Виросомы обсуждены дополнительно, например, в ссылке 55.
Е. Производные бактерий или микробов
Адъюванты, подходящие для использования в изобретении, включают бактериальные или микробные производные, такие как нетоксичные производные энтеробактериального липополисахарида (LPS), производные липида А, иммуностимулирующие олигонуклеотиды и ADP-рибозилирующие токсины и их детоксифицированные производные.
Нетоксичные производные LPS включают монофосфориловый липид А (MPL) и 3-О-деацилированный MPL (3dMPL). 3dMPL представляет собой смесь 3-О-деацилированного монофосфорилового липида А с 4, 5 или 6 ацилированными цепями. Предпочтительная форма 3-О-деацилированного монофосфорилового липида А в виде «мелких частиц» раскрыта в ссылке 56. Такие «мелкие частицы» 3dMPL достаточно малы для того, чтобы подвергнуться стерилизации фильтрованием через мембрану с размером пор 0,22 мкм (56). Другие нетоксичные производные LPS включают имитаторы монофосфорилового липида А, такие как производные фосфата аминоалкилглюкозаминида, например, RC-529 (57, 58).
Производные липида А включает производные липида А из Escherishia coli, такие как ОМ-174. ОМ-174, описаны, например, в ссылках 59 и 60.
Иммуностимулирующие олигонуклеотиды, подходящие для использования в качестве адъювантов в изобретении, включают нуклеотидные последовательности, содержащие мотив CpG (динуклеотидную последовательность, содержащую неметилированный цитозин, связанный фосфатной связью с гуанозином). Было также показано, что двухнитевые РНК и олигонуклеотиды, содержащие палиндромные или поли(dG) последовательности являются иммуностимулирующими.
CpG могут включать нуклеотидные модификации/аналоги, такие как модификации фосфоротиоата, и они могут быть двухнитевыми или однонитевыми. В ссылках 61, 62 и 63 раскрыты возможные аналоговые замещения, например, замещение гуанозина 2'-деокси-7-деазагуанозином. Адъювантный эффект олигонуклеотидов CpG дополнительно обсужден в ссылках 64-69.
Последовательность CpG может быть направлена на TLR9, такую как GTCGTT или TTCGTT (70). Последовательность CpG может быть специфичной для индукции иммунной реакции Th1, такой как CpG-A ODN, или она может быть более специфичной для индукции реакции В клеток, такой как CpG-В ODN. CpG-A и CpG-В ODN обсуждены в ссылках 71-73. Предпочтительно, CpG представляет собой CpG-A ODN.
Предпочтительно, олигонуклеотид CpG сконструирован так, что конец 5' доступен для распознавания рецептора. Необязательно, 2 последовательности олигонуклеотида CpG могут быть прикреплены на их концах 3' для образования «иммуномеров» (см., например, ссылки 70 и 74-76).
Бактериальные рибозилирующие ADP токсины и их детоксифицированные производные можно использовать в качестве адъювантов в изобретении. Предпочтительно, белок получен из E.coli (термолабильный энтеротоксин E.coli "LT"), холерной ("CT") или коклюшной ("PT") палочки. Использование детоксифицированных рибозилирующих ADP токсинов в качестве адъювантов слизистой оболочки описано в ссылке 77 и в качестве парентеральных адъювантов в ссылке 78. Токсин или токсоид находится предпочтительно в форме голотоксина, включающего и А, и В субъединицы. Предпочтительно, субъединица А содержит детоксифицирующую мутацию; предпочтительно, субъединица В не мутирована. Предпочтительно, адъювант представляет собой детоксифицированный мутант LT, такой как LT-K63, LT-R72 и LT-G192. Использование рибозилирующих ADP токсинов и их детоксифицированных производных, в частности, LT-K63 и LT-R72, в качестве адъювантов, можно найти в ссылках 79-86. Цифровая ссылка на аминокислотные последовательности предпочтительно основана на совмещениях субъединиц А и В рибозилирующих ADP токсинов, представленная в ссылке 87, специально полностью включенной в настоящее описание в качестве ссылки.
F. Человеческие иммуномодуляторы
Человеческие иммуномодуляторы, подходящие для использования в качестве адъювантов, включают цитокины, такие как интерлейкины (например, IL-1, IL-2, IL-4, IL-5, IL-6, IL-7, IL-12 (88) и т.д.) (89), интерфероны (например, интерферон- ), макрофагальный колониестимулирующий фактор, и фактор некроза опухолей. ), макрофагальный колониестимулирующий фактор, и фактор некроза опухолей.
G. Биоадгезионные и мукоадгезионные вещества
Биоадгезионные и мукоадгезионные вещества можно также использовать в качестве адъювантов в изобретении. Подходящие биоадгезионные вещества включают микросферы эстерифицированной гиалуроновой кислоты (90) или мукоадгезионные вещества, такие как поперечно сшитые производные поли(акриловой кислоты), поливинилового спирта, поливинилпирролидона, полисахариды и карбоксиметилцеллюлозу. Хитозан и его производные можно также использовать в качестве адъювантов в изобретении (91).
H. Микрочастицы
Микрочастицы можно также использовать в качестве адъювантов в изобретении. Предпочтительны микрочастицы (т.е. частицы диаметром от  100 нм до 100 нм до  150 нм, предпочтительнее, диаметром от 150 нм, предпочтительнее, диаметром от  200 нм до 200 нм до  30 мкм, а наиболее предпочтительно, диаметром от 30 мкм, а наиболее предпочтительно, диаметром от  500 нм до 500 нм до  10 мкм), образованные из материалов, которые являются биологически разлагаемыми и нетоксичными (например, поли( 10 мкм), образованные из материалов, которые являются биологически разлагаемыми и нетоксичными (например, поли( -гидрокси кислота), полигидроксимасляная кислота, сложный полиортоэфир, полиангидрид, поликапролактон и т.д.) с поли(лактидсогликолидом), необязательно обработанные для получения отрицательно заряженной поверхности (например, SDS) или положительно заряженной поверхности (например, катионным детергентом, таким как СТАВ (бромид цетилтриметиламмония)). -гидрокси кислота), полигидроксимасляная кислота, сложный полиортоэфир, полиангидрид, поликапролактон и т.д.) с поли(лактидсогликолидом), необязательно обработанные для получения отрицательно заряженной поверхности (например, SDS) или положительно заряженной поверхности (например, катионным детергентом, таким как СТАВ (бромид цетилтриметиламмония)).
I. Липосомы (главы 13 и 14 ссылки 39)
Примеры липосомных композиций, подходящих для использования в качестве адъювантов, описаны в ссылках 92-94.
J. Композиции простого эфира полиоксиэтилена и сложного эфира полиоксиэтилена
Адъюванты, подходящие для применения в изобретении, включают простые эфиры полиоксиэтилена и сложные эфиры полиоксиэтилена (95). Такие композиции, кроме того, включают поверхностно-активные агенты сложного эфира полиоксиэтиленсорбитана в комбинации с октоксинолом (96), а также простые алкиловые эфиры полиоксиэтилена или поверхностно-активные сложные эфиры в комбинации, по меньшей мере, с одним дополнительным неионным поверхностно-активным веществом, таким как октоксинол (97). Предпочтительные простые эфиры полиоксиэтилена выбраны из следующей группы: простой эфир полиоксиэтилен-9-лаурила (лаурет 9), простой эфир полиоксиэтилен-9-стеарила, простой эфир полиоксиэтилен-8-стеарила, простой эфир полиоксиэтилен-4-лаурила, простой эфир полиоксиэтилен-35-лаурила и простой эфир полиоксиэтилен-23-лаурила.
К. Полифосфазен (РСРР)
Композиции РСРР описаны, например, в ссылках 98 и 99.
L. Мурамилпептиды
Примеры мурамилпептидов, пригодных для использования в качестве адъювантов в изобретении, включают N-ацетилмурамил-L-треонил-D-изоглутамин (thr-MDP), N-ацетилнормурамил-L-аланил-D-изоглутамин (nor-MDP) и N-ацетилмурамил-L-аланил-D-изоглутаминил-L-аланил-2-(1'2'-дипальмитоил-sn-глицеро-3-гидроксифосфорилокси)этиламин MTP-PE).
М. Соединения имидазохинолона
Примеры соединений имидазохинолона, подходящие для использования в качестве адъювантов в изобретении, включают имихамод и его гомологи (например, «резихимод 3М»), описанный дополнительно в ссылках 100 и 101.
Изобретение может также включать комбинации аспектов одного или нескольких адъювантов, идентифицированных выше. Например, следующие адъювантные композиции можно использовать в изобретении: (1) эмульсию сапонина и масла в воде (102); (2) сапонин (например, QS21) + нетоксичное производное LPS (например, 3dMPL) (103); (3) сапонин (например, QS21) + нетоксичное производное LPS (например, 3dMPL) + холестерин; (4) сапонин (например, QS21) + 3dMPL + IL-12 (необязательно + стерин) (104); (5) комбинации 3dMPL, например, с QS21 и/или эмульсиями масла в воде (105); (6) SAF, содержащий 10% сквалан, 0,4% Tween 80TM, 5% плуроник-блоксополимер L121 и thr-MDP, или микрофлюидизированный в субмикронную эмульсию или смешанный с использованием вихревой мешалки для создания эмульсии с более крупными частицами; (7) адъювантную систему RibiTM (RAS), (Ribi Immunochem), содержащую 2% сквален, 0,2% Tween 80 и один или несколько компонентов стенки бактериальной клетки из группы, состоящей из монофосфорилипида А (MPL), димиколата трегалозы (TDM) и каркаса клеточной стенки (CWS), предпочтительно, MPL + CWS (DetoxTM); и (8) одной или нескольких минеральных солей (таких как соль алюминия) + нетоксичное производное LPS (таким как 3dMPL).
Другие вещества, которые действуют в качестве иммуностимулирующих средств, раскрыты в главе 7 ссылки 39.
Особенно предпочтительно использование в качестве адъюванта гидроокиси алюминия или фосфата алюминия, и антигены в целом адсорбируются к этим солям. Предпочтительно следует избегать использования гидроокиси алюминия в качестве адъюванта, если композиция включает антиген Hib. Когда используется фосфат алюминия и нежелательно, чтобы антиген не адсорбировался к адъюванту, этому способствует включение свободных ионов фосфата в раствор (например, использованием фосфатного буфера). Предотвращение адсорбции можно также достичь выбором правильного рН во время смешивания антигена/адъюванта, адъюванта с соответствующей точкой нулевого заряда и соответствующего порядка смешивания для различных антигенов в композиции (106).
Другим предпочтительным адъювантом является фосфат кальция.
Дополнительные антигены
Композиции по изобретению содержат 5 основных менингококковых белковых антигенов. Они могут также включать дополнительные антигены, хотя они могут содержать менингококковые белковые антигены, отличные от 5 основных антигенов. Дополнительные антигены для включения могут представлять собой, например:
- сахаридный антиген из Haemophilus influenzae B.
- сахаридный антиген из N.meningitidis серогруппы А, C, W135 и/или Y, такой как олигосахарид, раскрытый в ссылке 107, из серогруппы С или олигосахариды ссылки 108.
- сахаридный антиген из Streptococcus pneumoniae (например, 155, 156, 157).
- антиген из вируса гепатита А, такого как инактивированный вирус (например, 109, 110).
- антиген из вируса гепаптита В, такой как поверхностный и/или коровый антигены (например, 110, 111).
- дифтерийный антиген, такой как дифтерийный токсоид (например, глава 3 ссылки 112), например, мутант CRM197 (например, 113).
- столбнячный антиген, такой как столбнячный токсоид (например, глава 4 ссылки 112).
- антиген из Bordetella pertussis, такой как коклюшный голотоксин (РТ) и филаментный гемагглютинин (FHA) из B.pertussis, необязательно также в комбинации с пертактином и/или агглютиногенами 2 и 3 (например, ссылки 114 и 115). Можно использовать клеточный коклюшный антиген.
- препарат пузырька наружной мембраны (OMV) из N.meningitidis серогруппы В, такой, как раскрытые в ссылках 4, 116, 117, 118 и т.д.
- антиген(ы) полиомиелита (например, 119, 120), такие как OPV или, предпочтительно, IPV.
Композиция может включать один или несколько из указанных дополнительных антигенов. Антигены обычно должны присутствовать в концентрации, по меньшей мере, 1 мкг/мл каждый. В целом, концентрация любого данного антигена должна быть достаточной для того, чтобы вызвать иммунную реакцию против указанного антигена. Предпочтительно, чтобы защитная эффективность отдельных сахаридных антигенов не устранялась их комбинированием, хотя действительная иммуногенность (например, титры ELISA) может быть снижена.
Когда дифтерийный антиген включен в композицию, предпочтительно также включать столбнячный антиген и коклюшный антиген. Аналогичным образом, когда включен столбнячный антиген, предпочтительно также включить дифтерийный и коклюшный антигены. Аналогичным образом, когда включен коклюшный антиген, предпочтительно также включить дифтерийный и столбнячный антигены. Такие комбинации DTP можно использовать для растворения лиофилизированных конъюгатов.
Когда используется сахаридный или углеводородный антиген, он предпочтительно конъюгирован с белком-носителем для усиления иммуногенности (см. ниже).
Токсичные белковые антигены можно детоксифицировать, когда это необходимо (например, детоксификация коклюшного токсина химическими и/или генетическими средствами (115)).
В качестве альтернативы использованию белковых антигенов в композиции по изобретению можно использовать нуклеиновую кислоту, кодирующую антиген (например, ссылки 121-129). Таким образом, белковые компоненты композиций по изобретению можно заместить нуклеиновой кислотой (предпочтительно, ДНК, например, в форме плазмиды), которая кодирует белок. Аналогичным образом, композиции по изобретению могут включать белки, которые имитируют сахаридные антигены, например, мимотопы (130) или анти-идиотипические антитела. Они могут замещать отдельные сахаридные компоненты или могут дополнять их. В качестве примера, вакцина может включать пептид, имитирующий капсулярный полисахарид MenC (131) или MenA (132) вместо самого сахарида.
Особенно предпочтительные композиции по изобретению включают 1, 2 или 3 из: (а) сахаридных антигенов из менингококка серогрупп Y, W135, C и (необязательно) А; (b) сахаридный антиген из Haemophilus influenzae типа В; и/или (с) антиген из Streptococcus pneumoniae. Особенно предпочтительна композиция, включающая антигены серогруппы В и конъюгат Hib.
Менингококк серогрупп Y, W135, C и (необязательно) А
Как указано выше, полисахаридные вакцины против серогрупп А, С, W135 и Y были известны в течение многих лет. Эти вакцины (MENCEVAX ACWYTM и MENOMUNETM) основаны на капсулярных полисахаридах организма, но хотя они эффективны у подростков и взрослых, они дают слабый иммунный ответ и короткую продолжительность защиты, и их нельзя использовать в раннем возрасте.
В отличие от неконъюгированных полисахаридных антигенов в данных вакцинах, недавно одобренные вакцины серогруппы С (MenjugateTM (133, 107), MeningitecTM и NeisVac-CTM) включают конъюгированные сахариды. MenjugateTM и MeningitecTM имеют олигосахаридные антигены, конъюгированные с носителем CRM197, тогда как в NeisVac-CTM используется полный полисахарид (де-О-ацетилированный), конъюгированный со столбнячным токсоидным носителем.
Композиции по настоящему изобретению предпочтительно включают капсулярные сахаридные антигены из одной или нескольких серогрупп Y, W135, C и (необязательно) А менингококка, причем антигены конъюгированы с белком (белками)-носителем и/или представляют собой олигосахариды.
Типичное количество каждого менингококкового сахаридного антигена на 1 дозу составляет от 1 мкг до 20 мкг, например, приблизительно 1 мкг, приблизительно 2,5 мкг, приблизительно 4 мкг, приблизительно 5 мкг, или приблизительно 10 мкг (выраженные в виде сахарида).
Когда смесь включает капсулярные сахариды из обеих серогрупп А и С, соотношение (мас./мас.) сахарида MenA:сахарида MenC может быть более, чем 1 (например, 2:3, 3:1, 4:1, 5:1, 10:1 или выше). Когда смесь включает капуслярные сахариды из серогруппы Y и одной или обеих серогрупп С и W135, соотношение (масс./масс.) сахарида MenY:сахарида MenW135 может быть более, чем 1 (например, 2:3, 3:1, 4:1, 5:1, 10:1 или выше) и/или соотношение (масс./масс.) сахарида MenY:сахарида MenC может быть менее, чем 1 (например, 1:2, 1:3, 1:4, 1:5 или ниже). Предпочтительные соотношения (масс./масс.) для сахаридов из серогрупп А:С:W135:Y составляют: 1:1:1:1, 1:1:1:2, 2:1:1:1, 4:2:1:1, 8:4:2:1, 4:2:1:2, 8:4:1:2, 4:2:2:1, 2:2:1:1, 4:4:2:1, 2:2:1:2, 4:4:1:2, и 2:2:2:1. Предпочтительные соотношения (масс./масс.) для сахаридов из серогрупп С:W135:Y составляют: 1:1:1, 1:1:2, 1:1:1, 2:1:1, 4:2:1, 2:1:2, 4:1:2, 2:2:1 и 2:1:1. Предпочтительно использование по существу равной массы каждого сахарида.
Капсулярные сахариды в целом используются в форме олигосахаридов. Они могут быть образованы фрагментацией очищенного капсулярного полисахарида (например, гидролизом), за которой обычно следует очистка фрагментов желательного размера.
Фрагментацию полисахаридов предпочтительно выполняют для получения конечной средней степени полимеризации (DP) в олигосахариде менее, чем 30 (например, от 10 до 20, предпочтительно, приблизительно 10 для серогруппы А; от 15 до 25 для серогрупп W135 и Y, предпочтительно, приблизительно 15-20; от 12 до 22 для серогруппы С и т.д.). DP можно подходящим образом измерить ионообменной хроматографией или колориметрическими анализами (134).
Если выполняется гидролиз, то гидролизат должен быть в целом классифицирован по размеру для удаления олигосахаридов короткой длины (135). Это можно достичь различными путями, такими ультрафильтрация, с последующей ионообменной хроматографией. Олигосахариды со степенью полимеризации менее, чем приблизительно 6 или равной ей, предпочтительно удаляют для серогруппы А, а олигосахариды менее, чем приблизительно 4 предпочтительно удаляют для серогрупп W135 и Y.
Предпочтительные сахаридные антигены MenC раскрыты в ссылке 133, как сахариды, используемые в MenjugateTM.
Сахаридный антиген можно химически модифицировать. Это особенно полезно для снижения гидролиза для серогруппы А (136; см. ниже). Можно выполнять де-О-ацетилирование менингококковых сахаридов. Для олигосахаридов модификация может происходить перед или после деполимеризации.
Когда композиция по изобретению включает сахаридный антиген MenA, антиген предпочтительно представляет собой модифицированный сахарид, в котором одна или несколько гидроксильных групп на нативном сахариде были замещены блокирующей группой (136). Данная модификация повышает устойчивость к гидролизу и означает, что антиген серогруппы А можно хранить и использовать в жидкой композиции,
и он не требует лиофилизации.
Количество моносахаридных единиц, имеющих блокирующие группы, может варьироваться. Например, все или по существу все моносахаридные единицы могут иметь блокирующие группы. Альтернативно, по меньшей мере, 10%, 20%, 30%, 40%, 50%, 60%, 70%, 80% или 90% моносахаридных единиц могут иметь блокирующие группы. По меньшей мере, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29 или 30 моносахаридных единиц могут иметь блокирующие группы.
Аналогичным образом, количество блокирующих групп на моносахаридной единице может варьироваться. Например, количество блокирующих групп на моносахаридной единице может составлять 1 или 2. Блокирующая группа в целом находится в положении 4 и/или положении 3 моносахаридных единиц.
Концевая моносахаридная единица может иметь или не иметь блокирующую группу вместо ее нативного гидроксила. Предпочтительно сохранить свободную аномерную гидроксильную группу на концевой моносахаридной единице для обеспечения манипулятора для дальнейших реакций (например, конъюгации). Аномерные гидроксильные группы могут быть превращены в аминогруппы (-NH2 или -NH-E, где Е представляет собой группу, защищающую азот) восстановительным аминированием (с использованием, например, NaBH3CN/NH4Cl), а затем могут регенерироваться после того как другие гидроксильные группы были превращены в блокирующие группы.
Блокирующие группы для замещения гидроксильных групп могут быть непосредственно доступны посредством реакции дериватизации гидроксильной группы, т.е. замещением атома водорода гидроксильной группы с другой группой. Подходящие производные гидроксильных групп, которые действуют в качестве блокирующих групп, представляют собой, например, карбаматы, сульфонаты, карбонаты, сложные эфиры, простые эфиры (например, простые силиловые эфиры или простые алкиловые эфиры) и ацетали. Некоторыми определенными примерами таких блокирующих групп являются аллил, Aloc, бензил, BOM, трет-бутил, тритил, TBS, TBDPS, TES, TMS, TIPS, PMB, MEM, MOM, MTM, THP и т.д. Другие блокирующие группы, которые непосредственно недоступны, и которые полностью замещают гидроксильную группу, включают С1-12алкил, С3-12алкил, С5-12арил, С5-12арил-С1-6алкил, NR1R2 (R1 и R2 определяются в следующем абзаце), H, F, Cl, Br, CO2H, CO2(С1-6алкил), CN, CF3, CCl3 и т.д. Предпочтительными блокирующими группами являются группы, удаляющие электроны.
Предпочтительные блокирующие группы имеют формулу: -O-X-Y или -OR3, где Х представляет собой С(О), S(O) или SO2; Y представляет собой С1-12алкил, С1-12алкокси, С3-12циклоалкил, С5-12арил или С5-12арил-С1-6алкил, каждый из которых может необязательно быть замещен 1, 2 или 3 группами, независимо выбранными из F, Cl, Br, CO2H, CO2(С1-6алкил), CN, CF3 или CCl3; или Y представляет собой NR1R2; R1 и R2 независимо выбраны из Н, С1-12алкила, С3-12циклоалкила, С5-12арила, С5-12арил-С1-6алкила; или R1 и R2 могут соединяться для образования С3-12 насыщенной гетероциклической группы; R3 представляет собой С1-12алкил или С3-12циклоалкил, каждый из которых может необязательно быть замещен 1, 2 или 3 группами, независимо выбранными из F, Cl, Br, CO2(С1-6алкила), CN, CF3 или CCl3; или R3 представляет собой С5-12арил или С5-12арил-С1-6алкил, каждый из которых может необязательно быть замещен 1, 2, 3, 4 или 5 группами, выбранными из F, Cl, Br, CO2H, CO2(С1-6алкила), CN, CF3 или CCl3. Когда R3 представляет собой С1-12алкил или С3-12циклоалкил, он обычно замещен 1, 2 или 3 группами, как определено выше. Когда R1 и R2 соединяются с образованием С3-12 насыщенной гетероциклической группы, это значит, что R1 и R2 вместе с атомом азота образуют насыщенную гетероциклическую группу, содержащую любое количество атомов углерода от 2 до 12 (например, С3, С4, С5, С6, С7, С8, С9, С10, С11, С12). Гетероциклическая группа может содержать 1 или 2 гетероатома (таких как N, O или S), отличных от атома водорода. Примерами С3-12 насыщенных гетероциклических групп являются пирролидинил, пиперидинил, морфолинил, пиперазинил, имидазолидинил, азетидинил и азиридинил.
Блокирующие группы -O-X-Y и -OR3 можно получить из -ОН групп стандартными дериватизирующими процедурами, такими как реакция гидроксильной группы с галидом ацила, галидом алкила, галидом сульфонила и т.д. Следовательно, атом кислорода в -O-X-Y предпочтительно представляет собой атом кислорода гидроксильной группы, тогда как группа -X-Y в -O-X-Y предпочтительно замещает атом водорода гидроксильной группы.
Альтернативно, блокирующая группа может быть доступна посредством реакции замещения, такого как замещение типа Мицонобу. Эти и другие способы получения блокирующих групп из гидроксильных групп хорошо известны.
Предпочтительнее, блокирующая группа представляет собой -OC(O)CF3 (137) или группу карбамата -OC(O)NR1R2, где R1 и R2 независимо выбраны из С1-6алкила. Предпочтительнее, R1 и R2 оба представляют собой метил, т.е., блокирующая группа представляет собой -OC(O)NMe2. Карбаматные блокирующие группы оказывают стабилизирующий эффект на гликозидную связь, и их можно получить в мягких условиях.
Предпочтительные модифицированные сахариды MenA содержат n моносахаридных единиц, где, по меньшей мере, h% моносахаридных единиц не имеют -ОН группы в обоих положениях 3 и 4. Величина h составляет 24 или более (например, 25, 26, 27, 28, 29, 30, 35, 40, 45, 50, 55, 60, 65, 70, 75, 80, 85, 90, 95, 98, 99 или 100) и предпочтительно составляет 50 или более. Отсутствующие -ОН группы представляют собой предпочтительно блокирующие группы, определенные выше.
Другие предпочтительные модифицированные сахариды MenA включают моносахаридные единицы, в которых, по меньшей мере, s моносахаридных единиц не имеют -ОН в положении 3 и не имеют -ОН в положении 4. Величина s составляет, по меньшей мере, 1 (например, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 35, 40, 45, 50, 60, 70, 80, 90). Отсутствующие -ОН группы представляют собой предпочтительно блокирующие группы, определенные выше.
Подходящие модифицированные сахариды MenA для использования в изобретении имеют формулу:
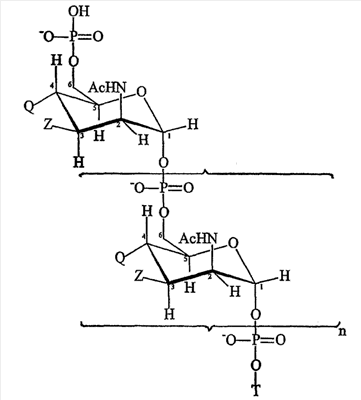
где
n равно целому числу от 1 до 100 (предпочтительно, целому числу от 15 до 25);
Т имеет формулу (А) или (В);
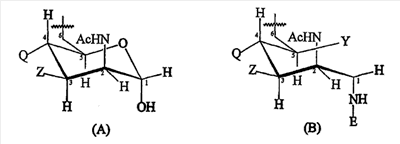
каждая группа Z независимо выбрана из ОН или блокирующей группы, как определено выше; и
каждая группа Q независимо выбрана из ОН или блокирующей группы, как определено выше;
Y выбран из ОН или блокирующей группы, как определено выше;
Е представляет собой Н или группу, защищающую азот;
и где более, чем приблизительно 7% (например, 8%, 9%, 10% или более) групп Q представляют собой блокирующие группы.
Каждая из групп n+2 Z может быть одинаковой или отличной друг от друга. Аналогичным образом, каждая из групп n+2 Q может быть одинаковой или отличной друг от друга. Все группы Z могут представлять собой ОН. Альтернативно, по меньшей мере, 10%, 20% 30%, 40%, 50% или 60% групп Z могут представлять собой ОАс. Предпочтительно, приблизительно 70% групп Z представляют собой ОАс, причем остальные из групп Z представляют собой ОН или блокирующие группы, как определено выше. По меньшей мере, приблизительно 7% групп Q представляют собой блокирующие группы. Предпочтительно, по меньшей мере, приблизительно 10%, 20%, 30%, 40%, 50%, 60%, 70%, 80%, 90% или даже 100% групп Q представляют собой блокирующие группы.
Предпочтительные композиции по изобретению можно хранить в течение 28 дней при 37°С, и после этого периода менее, чем f% исходного общего количества конъюгированного сахарида MenA будет не конъюгировано, где f = 20, 19, 18, 17, 16, 15, 14, 13, 12, 11, 10, 9, 8, 7, 6, 5 или ниже.
Менингококковые капсулярные полисахариды обычно получают способом, включающем стадии осаждения полисахарида (например, с использованием катионного детергента), фракционирования этанолом, холодной фенольной экстракции (для удаления белка) и ультрацентрифугирования (для удаления LPS) (например, ссылка 138). Однако более предпочтительный способ (108) включает осаждение полисахарида с последующей солюбилизацией осажденного полисахарида с использованием низшего спирта. Осаждение можно достичь с использованием катионного детергента, такого как соли тетрабутиламмония и цетилтриметиламмония (например, бромиды), или бромид гексадиметрина и соли миристилтриметиламмония. Бромид цетилтриметиламмония («СТАВ») особенно предпочтительнее (139). Солюбилизацию осажденного материала можно достичь с использованием низшего спирта, такого как метанол, пропан-1-ол, пропан-2-ол, бутан-1-ол, бутан-2-ол, 2-метилпропан-1-ол, 2-метилпропан-2-ол, диолы и т.д., но этанол особенно подходит для солюбилизации комплексов СТАВ-полисахарида. Этанол предпочтительно добавляют к осажденному полисахариду для получения конечной концентрации (на основании общего содержания этанола и воды) или от 50% до 95%.
После повторной солюбилизации полисахарид можно далее обработать для удаления примесей. Это особенно важно в ситуациях, когда даже небольшое загрязнение неприемлемо (например, для производства человеческих вакцин). Это обычно должно включать один или более этапов фильтрации, например, можно использовать глубинную фильтрацию, фильтрацию через активированный уголь, фильтрацию по размеру и/или ультрафильтрацию. После фильтрации для удаления примесей полисахарид можно осадить для дальнейшей обработки и/или переработки. Это можно приемлемо достичь обменом катионов (например, добавлением солей кальция или натрия).
В качестве альтернативы очистке, капсулярные сахариды по настоящему изобретению можно получить полным или частичным синтезом, например, синтез Hib раскрыт в ссылке 140, а синтез MenA в ссылке 141.
Композиции по изобретению включают капсулярные сахариды, по меньшей мере, двух серогрупп N.meningitidis. Сахариды предпочтительно получают отдельно (включая любую фрагментацию, конъюгацию, модификацию и т.д.), а затем смешивают для получения композиции по изобретению.
Однако, когда композиция включает капсулярный сахарид из серогруппы А, предпочтительно, чтобы сахарид серогруппы А не комбинировался с другим сахаридом (сахаридами) до периода незадолго до применения для минимизации возможного гидролиза. Это можно допустимо достичь наличием компонента серогруппы А (обычно вместе с соответствующими эксципиентами) в лиофилизированной форме, а компонента (компонентов) других серогрупп в жидкой форме (также с соответствующими эксципиентами), причем жидкие компоненты используются для растворения лиофилизированного компонента MenA при готовности к применению. Когда используется адъювант в виде соли алюминия, предпочтительно включить адъювант во флакончик, содержащий жидкую вакцину, и лиофилизировать компонент MenA без адъюванта.
Таким образом, композицию по изобретению можно получить из набора, включающего: (а) капсулярный сахарид из N.meningitis серогруппы А в лиофилизированной форме; и (b) другие антигены из композиции в жидкой форме. Изобретение также включает способ получения композиции по изобретению, предусматривающий смешивание лиофилизированного капсулярного сахарида из N.meningitidis серогруппы А с другими антигенами, причем указанные другие антигены находятся в жидкой форме.
Изобретение также включает набор, включающий: (а) первый контейнер, содержащий капсулярные сахариды из двух или более N.meningitidis серогрупп С, W135 и Y, все в лиофилизированной форме; и (b) второй контейнер, содержащий в жидкой форме (i) композицию, которая после введения индивидууму способна вызвать гуморальный иммунный ответ у индивидуума, причем гуморальный иммунный ответ является бактерицидным против двух или более (например, 2 или 3) сверхвирулентных последовательностей поколений А4, ЕТ-5 и последовательность поколений 3 N.meningitidis серогруппы В, (ii) капсулярные сахариды ни из одной или из одной из серогрупп С, W135 и Y N.meningitidis, и, необязательно (iii) другие антигены (см. ниже), которые не включают менингококковые капсулярные сахариды, причем растворение содержимого контейнера (а) содержимым контейнера (b) включает композицию по изобретению.
В пределах каждой дозы количество отдельного сахаридного антигена в целом составляет от 1 до 50 мкг (измеренное в виде массы сахарида), причем предпочтительно каждое количество приблизительно 2,5 мкг, 5 мкг, или 10 мкг. Поэтому при соотношениях масс А:С:W135:Y 1:1:1:1, 1:1:1:2, 2:1:1:1, 4:2:1:1, 8:4:2:1, 4:2:1:2, 8:4:1:2, 4:2:2:1, 2:2:1:1, 4:4:2:1, 2:2:1:2, 4:4:1:2, и 2:2:2:1 количество, представленное фиг.1, предпочтительно составляет приблизительно 2,5 мкг, 5 мкг, или 10 мкг. Поэтому для композиции с соотношением А:С:W135:Y 1:1:1:1 и 10 мкг на сахарид, вводится 40 мкг сахарида на дозу. Предпочтительно композиции имеют следующее количество мкг сахарида на дозу:
| А |
10 |
0 |
0 |
0 |
10 |
5 |
2,5 |
| С |
10 |
10 |
5 |
2,5 |
5 |
5 |
2,5 |
| W135 |
10 |
10 |
5 |
2,5 |
5 |
5 |
2,5 |
| Y |
10 |
10 |
5 |
2,5 |
5 |
5 |
2,5 |
Предпочтительные композиции по изобретению включают менее чем 50 мкг менингококкового сахарида на дозу. Другие предпочтительные композиции включают  40 мкг менингококкового сахарида на дозу. Другие предпочтительные композиции включают 40 мкг менингококкового сахарида на дозу. Другие предпочтительные композиции включают  30 мкг менингококкового сахарида на дозу. Другие предпочтительные композиции включают 30 мкг менингококкового сахарида на дозу. Другие предпочтительные композиции включают  25 мкг менингококкового сахарида на дозу. Другие предпочтительные композиции включают 25 мкг менингококкового сахарида на дозу. Другие предпочтительные композиции включают  20 мкг менингококкового сахарида на дозу. Другие предпочтительные композиции включают 20 мкг менингококкового сахарида на дозу. Другие предпочтительные композиции включают  10 мкг менингококкового сахарида на дозу, но в идеале композиции по изобретению включают, по меньшей мере, 10 мкг менингококкового сахарида на дозу. 10 мкг менингококкового сахарида на дозу, но в идеале композиции по изобретению включают, по меньшей мере, 10 мкг менингококкового сахарида на дозу.
В конъюгатах MenC MenjugateTM и NeisVacTM используется гидроокисный адъювант, тогда как в MeningitecTM используется фосфат. В композициях по изобретению можно адсорбировать некоторые антигены на гидроокиси алюминия, но другие антигены могут присутствовать в сочетании с фосфатом алюминия. Например, для комбинаций четырехвалентной серогруппы доступны следующие композиции:
| Серогруппа |
Соль алюминия (Н = гидроокись; Р = фосфат) |
| А |
P |
H |
P |
H |
H |
H |
P |
P |
P |
H |
H |
H |
P |
P |
P |
H |
| С |
P |
H |
H |
P |
H |
H |
P |
H |
H |
P |
P |
H |
P |
H |
P |
P |
| W135 |
P |
H |
H |
H |
P |
H |
H |
P |
H |
H |
P |
P |
P |
P |
H |
P |
| Y |
P |
H |
H |
H |
H |
P |
H |
H |
P |
P |
H |
P |
H |
P |
P |
P |
Для комбинаций трехвалентной серогруппы N.meningitidis доступны следующие композиции:
| Серогруппа |
Соль алюминия (Н = гидроокись; Р = фосфат) |
| C |
P |
H |
H |
H |
P |
P |
P |
H |
| W135 |
P |
H |
H |
P |
H |
P |
H |
P |
| Y |
P |
H |
P |
H |
H |
H |
P |
P |
Haemophilus influenzae типа В
Когда композиция включает антиген H.influenzae типа В, он обычно является капсулярным сахаридным антигеном Hib. Сахаридные антигены из H.influenzae b хорошо известны.
Преимущественно, сахарид Hib ковалентно конъюгирован с белком-носителем для усиления иммуногенности, особенно у детей. Получение полисахаридных конъюгатов в целом, и капсулярного полисахарида Hib в частности, хорошо документировано (например, ссылки 142-150 и т.д.). В изобретении можно использовать любой подходящий конъюгат Hib. Подходящие белки-носители описаны ниже, и предпочтительные носители для сахаридов Hib представляют собой CRM197 ("HbOC"), столбнячный токсоид ("PRP-T") и комплекс наружной мембраны N.meningitidis ("PRP-OMP").
Сахаридный фрагмент конъюгата может представлять собой полисахарид (например, фосфат полирибозилрибитола (PRP) полной длины), но предпочтительно гидролизировать полисахариды для образования олигосахаридов (например, с молекулярной массой от приблизительно 1 до приблизительно 5 кДа).
Предпочтительный конъюгат включает олигосахарид Hib, ковалентно связанный с CRM197 через линкер адипиновой кислоты (151, 152). Предпочтительным носителем является также столбнячный токсоид.
Введение антигена Hib предпочтительно приводит к концентрации антитела против PRP  0,15 мкг/мл, а предпочтительнее, 0,15 мкг/мл, а предпочтительнее,  1 мкг/мл. 1 мкг/мл.
Композиции по изобретению могут включать несколько антигенов Hib.
Когда композиция включает сахаридный антиген Hib, предпочтительно, чтобы она также не включала адъювант гидроокиси алюминия. Если композиция включает адъювант фосфата алюминия, то антиген Hib может адсорбироваться к адъюванту (153) или он может быть не адсорбирован (154).
Антигены Hib могут быть лиофилизированы, например, вместе с менингококковыми антигенами.
Streptococcus pneumoniae
Когда композиция включает антиген S.pneumoniae, она обычно будет представлять собой капсулярный сахаридный антиген, который предпочтительно конъюгирован с белком-носителем (например, ссылки 155-157). Предпочтительно включить сахариды из нескольких серотипов S.pneumoniae. Например, широко используются смеси полисахаридов из 23 различных серотипов, каковыми являются конъюгированные вакцины с полисахаридами из 5-11 различных серотипов (158). Например, PrevNarTM (159) содержит антигены из 7 серотипов (4, 6B, 9V, 14, 18C, 19F и 23F) с каждым сахаридом, отдельно конъюгированным с CRM197 восстановительным аминированием, с 2 мкг каждого сахарида на дозу 0,5 мл (4 мкг серотипа 6В) и с конъюгатами, адсорбированными на адъюванте фосфата алюминия. Композиции по изобретению предпочтительно включают, по меньшей мере, серотипы 6B, 14, 19F и 23F. Конъюгаты могут быть адсорбированы на фосфате алюминия.
В качестве альтернативы использованию сахаридных антигенов из пневмококка, композиция может включать один или несколько полипептидных антигенов. Имеются геномные последовательности для нескольких штаммов пневмококков (160, 161), и они могут подвергаться обратной вакцинации (162-165) для идентификации подходящих полипептидных антигенов (166, 167). Например, композиция может включать один или несколько из следующих антигенов: PhtA, PhtD, PhtB, PhtE, SpsA, LytB, LytC, LytA, Sp125, Sp101, Sp128, Sp130 и Sp130, как определено в ссылке 168. Композиция может включать несколько (например, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13 или 14) этих антигенов.
В некоторых вариантах осуществления композиция может включать и сахаридные, и полипептидные антигены из пневмококка. Их можно использовать в простой смеси, или пневмококковый сахаридный антиген может быть конъюгирован с пневмококковым белком. Подходящие белки-носители для таких вариантов осуществления включают антигены, перечисленные в предыдущем абзаце (168).
Пневмококковые антигены могут лиофилизироваться, например, вместе с менингококковыми и/или антигенами Hib.
Ковалентная конъюгация
Капсулярные сахариды в композициях обычно будут конъюгированы с белком (белками)-носителем. В целом, конъюгация усиливает иммуногенность сахаридов, поскольку она превращает их из Т-независимых антигенов в Т-зависимые антигены, таким образом, обеспечивая возможность примирования для возникновения иммунологической памяти. Конъюгацию, в частности, можно использовать для педиатрических вакцин, и она представляет собой хорошо известную методику (например, обзоры в ссылках 169 и 142-150).
Предпочтительными белками-носителями являются бактериальные токсины или токсоиды, такие как дифтерийный токсоид или столбнячный токсоид. Особенно предпочтителен дифтерийный токсоид CRM197 (170-172). Другие подходящие белки-носители включают белок наружной мембраны N.meningitidis (173), синтетические пептиды (174, 175), белки теплового шока (176, 177), коклюшные белки (178, 179), цитокины (180), лимфокины (180), гормоны (180), ростовые факторы (180), искусственные белки, включающие множественные человеческие Т клеточные эпитопы CD4+ из антигенов, полученных из различных патогенов (181), белок D из H.influenzae (182, 183), пневмококковый поверхностный белок PspA (184), белки захвата железа (185), токсины А или В из C.difficile (186) и т.д. Предпочтительными носителями являются дифтерийный токсоид, столбнячный токсоид, белок D H.influenzae и CRM197.
В пределах композиции по изобретению можно использовать более одного белка-носителя, например, для снижения риска подавления носителя. Таким образом, различные белки-носители можно использовать для различных серогрупп, например сахариды серогруппы А можно конъюгировать с CRM197, тогда как сахариды серогруппы С можно конъюгировать со столбнячным токсоидом. Можно также использовать несколько белков-носителей для определенного сахаридного антигена, например, сахариды серогруппы А могут быть в двух группах, причем некоторые конъюгированы с CRM197, а другие конъюгированы со столбнячным токсоидом. Однако в целом, предпочтительно использовать один и тот же белок-носитель для всех сахаридов.
Один белок-носитель может нести несколько сахаридных антигенов (187). Например, один белок-носитель может быть конъюгирован с сахаридами из серогрупп А и С. Для достижения этой цели сахариды можно смешать перед реакцией конъюгации. Однако в целом предпочтительно иметь отдельные конъюгаты для каждой серогруппы.
Предпочтительны конъюгаты с соотношением сахарида:белка (мас./мас.) между от 1:5 (т.е. излишек белка) до 5:1 (т.е. излишек сахарида). Предпочтительно соотношение от 1:2 до 5:1, а предпочтительнее соотношения от 1:1,25 до 1:2,5. Избыточное количество белка-носителя может быть предпочтительно для MenA и MenC.
Конъюгаты можно использовать в сочетании со свободным белком-носителем (188). Когда данный белок-носитель присутствует и в свободной, и в конъюгированной форме в композиции по изобретению, неконъюгированная форма составляет предпочтительно не более, чем 5% общего количества белка-носителя в композиции как в целом, а предпочтительнее, присутствует в количестве менее чем 2 мас.%.
Можно использовать любую подходящую реакцию конъюгации, при необходимости с любым подходящим линкером.
Сахарид обычно должен активироваться или функционализироваться перед конъюгацией. Активация может включать, например, реагенты цианилирования, такие как CDAP (например, тетрафторборат 1-циано-4-диметиламинопиридина (189, 190 и т.д.)). В других подходящих методиках используют карбодиимиды, гидразиды, активные сложные эфиры, норборан, пара-нитробензойную кислоту, N-гидроксисукцинимид, S-NHS, EDC, TSTU; см. также вступление к ссылке 148).
Связи через линкерную группу можно получить с использованием любой известной процедуры, например, процедур, описанных в ссылках 191 и 192. Один тип связи включает восстановительное аминирование полисахарида, соединение полученной аминогруппы с одним концом линкерной группы адипиновой кислоты, а затем соединение белка с другим концом линкерной группы адипиновой кислоты (146, 193, 194). Другие линкеры включают В-пропионамидо (195), нитрофенил-этиламин (196), галиды галоидацила (197), гликозидные связи (198), 6-аминокапроновую кислоту (199), ADH (200), части С4-С12 (201) и т.д. В качестве альтернативы использованию линкера, можно использовать прямую связь. Прямые связи с белком могут включать окисление полисахарида с последующим восстановительным аминированием с белком, как описано, например, в ссылках 202 и 203.
Предпочтителен способ, предусматривающий введение аминогрупп в сахарид (например, замещением концевых групп =О группами -NH2) с последующей дериватизацией сложным адипиновым эфиром (например, сложным N-гидроксисукцинимидо эфиром адипиновой кислоты), и реакцией с белком-носителем. В другой предпочтительной реакции используется активация CDAP с белком-носителем D, например, MenA или MenC.
После конъюгации свободные и конъюгированные сахариды разделяют. Существует много подходящих способов, включая гидрофобную хроматографию, тангенциальную ультрафильтрацию, диафильтрацию и т.д. (см. также ссылки 204 и 205).
Когда композиция по изобретению включает конъюгированный олигосахарид, предпочтительно, чтобы осаждение олигосахарида предшествовало конъюгации.
Дополнительные и альтернативные полипептидные антигены серогруппы В
Изобретение включает композицию, которая после введения индивидууму способна вызвать гуморальный иммунный ответ у индивидуума, причем гуморальный иммунный ответ оказывает бактерицидное действие против двух или трех из сверхвирулентных рядов поколений А4, ЕТ-5 и ряда поколений 3 N.meningitidis серогруппы В.
Хотя NadA, 741, 936, 953 и 287 являются предпочтительными антигенами для достижения данной широкой защиты, другие полипептидные антигены MenB, которые можно включить в композиции по изобретению (необязательно в комбинации с одним или несколькими пятью основными антигенами) включают антигены, включающие одну из следующих аминокислотных последовательностей: SEQ ID NO:650 из ссылки 8; SEQ ID NO:878 из ссылки 8; SEQ ID NO:884 из ссылки 8; SEQ ID NO:4 из ссылки 9; SEQ ID NO:598 из ссылки 10; SEQ ID NO:818 из ссылки 10; SEQ ID NO:864 из ссылки 10; SEQ ID NO:866 из ссылки 10; SEQ ID NO:1196 из ссылки 10; SEQ ID NO:1272 из ссылки 10; SEQ ID NO:1274 из ссылки 10; SEQ ID NO:1640 из ссылки 10; SEQ ID NO:1788 из ссылки 10; SEQ ID NO:2288 из ссылки 10; SEQ ID NO:2466 из ссылки 10; SEQ ID NO:2554 из ссылки 10; SEQ ID NO:2576 из ссылки 10; SEQ ID NO:2606 из ссылки 10; SEQ ID NO:2608 из ссылки 10; SEQ ID NO:2616 из ссылки 10; SEQ ID NO:2668 из ссылки 10; SEQ ID NO:2780 из ссылки 10; SEQ ID NO:2932 из ссылки 10; SEQ ID NO:2958 из ссылки 10; SEQ ID NO:2970 из ссылки 10; SEQ ID NO:2988 из ссылки 10; или полипептид, включающий аминокислотную последовательность, которая: (а) имеет 50% или более идентичность (например, 60%, 70%, 80%, 90%, 95%, 99% или более) с указанными последовательностями; и/или (b) включает фрагмент, по меньшей мере, из n последовательных аминокислот из указанных последовательностей, где n = 7 или более (8, 10, 12, 14, 16, 18, 20, 25, 30, 35, 40, 50, 60, 70, 80, 90, 100, 150, 200, 250 или более). Предпочтительные фрагменты для (b) включают эпитоп из релевантной последовательности. Может быть включено несколько (например, 2, 3, 4, 5, 6) из указанных полипептидов.
Общие положения
Термин «содержащий» означает «включающий», а также «состоящий», например, композиция, «содержащая» Х, может состоять исключительно из Х, или может включать что-то дополнительное, например, X+Y.
Термин «приблизительно» относительно числовой величины х означает, например, х±10%.
Слово «по существу» не исключает «полностью», например, композиция, которая «по существу лишена» Y может быть полностью лишена Y. При необходимости слово «по существу» можно опустить из определения изобретения.
Ссылки на процентную идентичность последовательностей между двумя аминокислотными последовательностями означают, что при совмещении, эта процентная доля аминокислот одинакова при сравнении двух последовательностей. Данное совмещение и процентная гомология или идентичность последовательностей можно определить с использованием программных обеспечений, известных в данной области техники, например, программного обеспечения, описанного в разделе 7.7.18 ссылки 206. Предпочтительное совмещение определяют алгоритмом поиска гомологии Smith-Waterman с использованием поиска аффинного гэпа со штрафом за открытый гэп 12 и штрафом за расширение гэпа 2, матрицы BLOSUM из 62. Об алгоритме поиска гомологии Smith-Waterman речь идет в ссылке 207.
Термин «алкил» относится к алькильным группам и в прямой, и в разветвленной формах. Алкильную группу можно прервать 1, 2 или 3 гетероатомами, выбранными из -O-, -NH- или -S-. Алкильную группу можно также прервать 1, 2 или 3 двойными и/или тройными связями. Однако термин «алкил» обычно относится к алкильным группам, не имеющим гетероатомных прерываний или прерываний двойной или тройной связью. Когда делается ссылка на С1-12алкил, это значит, что алкильная группа может содержать любое количество атомов углерода от 1 до 12 (например, С1, С2, С3, С4, С5, С6, С7, С8, С9, С10, С11, С12). Аналогичным образом, когда делается ссылка на С1-6алкил, это значит, что алкильная группа может содержать любое количество атомов углерода от 1 до 6 (например, С1, С2, С3, С4, С5, С6).
Термин «циклоалкил» включает циклоалкильную, полициклоалкильную и циклоалкенильную группы, а также комбинации указанных групп с алкильными группами, такими как циклоалкилалкильные группы. Циклоалкильная группа может прерываться 1, 2 или 3 гетероатомами, выбранными из -O-, -NH- или -S-. Однако термин «циклоалкил» обычно относится к циклоалкильной группе, не имеющей гетероатомные «прерывания». Примеры циклоалкильных групп включают циклопентильную, циклогексильную, циклогексенильную, циклогексилметильную и адамантильную группы. Когда делается ссылка на С3-12циклоалкил, это значит, что циклоалкильная группа может содержать любое количество атомов углерода от 3 до 12 (например, С3, С4, С5, С6, С7, С8, С9, С10, С11, С12).
Термин «арил» относится к ароматической группе, такой как фенил или нафтил. Когда делается ссылка на С5-12арил, это значит, что арильная группа может содержать любое количество атомов углерода от 5 до 12 (например, С5, С6, С7, С8, С9, С10, С11, С12).
Термин «С5-12арил-С1-6алкил» относится к таким группам как бензил, фенилэтил и нафтилметил.
Защищающие азот группы включают силильные группы (такие как TMS, TES, TBS, TIPS), ацильные производные (такие как фталимиды, трифторацетамиды, метоксикарбонил, этоксикарбонил, трет-бутоксикарбонил (Вос), бензилоксикарбонил (Z или Cbz), 9-фторенилметоксикарбонил (Fmoc), 2-(триметилсилил)этоксикарбонил, 2,2,2-трихлорэтоксикарбонил (Troc)), производные сульфонила (такие как  -триметилсилилэтансульфонил (SES)), производные сульфенила, С1-12алкил, бензил, бензгидрил, тритил, 9-фенилфторенил и т.д. Предпочтительной защищающей азот группой является Fmoc. -триметилсилилэтансульфонил (SES)), производные сульфенила, С1-12алкил, бензил, бензгидрил, тритил, 9-фенилфторенил и т.д. Предпочтительной защищающей азот группой является Fmoc.
Последовательности, включенные для облегчения клонирования или очистки и т.д., не обязательно вносят вклад в изобретение и могут быть опущены или удалены.
Следует понимать, что сахарные кольца могут существовать в открытой и закрытой форме и что, хотя закрытые формы показаны в структурных формулах в настоящем описании, открытые формы также охвачены изобретением.
Осуществление изобретения
Гибридный белок  G287-953 G287-953
Кодирующий ДНК белок 287 из штамма 394/98 менингококковой серогруппы В и белок 953 из штамма 2996 менингококковой серогруппы В подвергали перевариванию и лигированию вместе с короткой линкерной последовательностью для получения плазмиды, кодирующей аминокислотную последовательность SEQ ID NO 7. Плазмиду трансфицировали в E.coli, и бактерии выращивали для экспрессии белка.
После адекватного роста бактерии собирали и очищали белок. Из культуры бактерии центрифугировали, и полученный после центрифугирования осадок гомогенизировали в присутствии 50 мМ ацетатного буфера (рН 5) при соотношении между объемами осадка и буфера 1:8. Лизис выполняли с использованием гомогенизатора под высоким давлением (AVESTIN, 4 цикла при 14000 фунтов/кв. дюйм). После лизиса добавляют мочевину в конечной концентрации 5М с последующим перемешиванием в течение 1 ч при комнатной температуре. рН снижали с 6 до 5 с использованием 200 мМ ацетатного буфера (рН 4) + 5 М мочевины. Смесь центрифугировали при 16800 g в течение 60 мин при 2-8°С. Надосадочную жидкость собирали и фильтровали SARTOBRAN P (0,45-0,22 мкм SARTORIUS).
Белок в отфильтрованной надосадочной жидкости был устойчив в течение  30 дней при -20°С и течение 30 дней при -20°С и течение  15 дней при 2-8°С. 15 дней при 2-8°С.
Белок далее очищали на катионной обменной колонке (SPFF, Amersham Biosciences) элюированием с использованием 350 мМ NaCl + 50 мМ ацетата + 5 М мочевины при рН 5,00. Большая часть примесей присутствовала в проточной жидкости. Промывание перед элюированием с использованием более низкой концентрации NaCl (180 мМ) преимущественно устраняло 2 загрязняющих белка E.coli.
рН элюированного материала доводили до 8 (с использованием 200 мМ TRIS/HCl + 5 М мочевины при рН 9) и далее очищали на колонке Q Sepharose HP (Amersham) элюированием с использованием 150 мМ NaCl + 20 мМ TRIS/HCl при рН 8,00 в 5 М мочевине. И снова использовали промывание перед элюированием с использованием более низкой концентрации соли (90 мМ) для устранения примесей.
Отфильтрованный элюированный материал из колонки Q HP разводили 1:2 с использованием PBS (солевого раствора с фосфатным буфером) при рН 7,00 (150 мМ NaCl + 10 мМ фосфата калия, рН 7,00), а затем подвергали диафильтрации против 10 объемов PBS при рН 7,00 тангенциальной ультрафильтрацией. В конце диафильтрации материал концентрировали 1,6 раза приблизительно до 1,2 мг/мл общих белков. При использовании мембраны, отсекающей 30000 Да (мембраны из регенерированной целлюлозы 50 см2, Millipore PLCTK 30), можно было диализировать материал с выходом приблизительно 90%.
Гибридный белок 936- G741 G741
Кодирующий ДНК белок 936 из штамма 2996 менингококковой серогруппы В и белок 741 из штамма МС58 менингококковой серогруппы В подвергали перевариванию и лигированию вместе с короткой линкерной последовательностью для получения плазмиды, кодирующей аминокислотную последовательность SEQ ID NO 8. Плазмиду трансфицировали в E.coli, и бактерии выращивали для экспрессии белка. Рекомбинантный белок не секретировался, но оставался растворимым внутри бактерий.
После адекватного роста бактерии центрифугировали для получения влажной пасты и обрабатывали следующим образом:
- Гомогенизация системой высокого давления в присутствии 20 мМ фосфата натрия при рН 7,00.
- Центрифугирование и осветление ортогональной фильтрацией.
- Хроматография на катионной колонке (SP Sepharose Fast Flow) с элюированием 150 мМ NaCl в 20 мМ фосфата натрия при рН 7,00.
- Хроматография на анионной колонке (Q Sepharose XL) с проточным сбором.
- Хроматография на гидрофобной колонке (Phenyl Sepharose 6 Fast Flow High Sub) с элюированием 20 мМ фосфата натрия при рН 7,00.
- Диафильтрация против PBS при рН 7,4 с отсечкой 10 кДа.
- Конечная стерилизующая фильтрация и хранение при -20°С.
Белок в конечном материале был устойчив в течение, по меньшей мере, 3 месяцев и при -20°С, и при 2-8°С.
Белок NadA(NL)(C)
Кодирующий ДНК белок NadA из штамма 2996 менингококковой серогруппы В переваривали для удаления последовательности, кодирующей его С-конец для получения плазмиды, кодирующей аминокислотную последовательность SEQ ID NO 1. Плазмиду трансфицировали в E.coli, и бактерии выращивали для экспрессии белка. Рекомбинантный белок секретировался в культуральную среду, и лидерный пептид отсутствовал в секретированном белке (SEQ ID NO 2). Надосадочную жидкость обрабатывали следующим образом:
- Концентрация в 7 раз и диафильтрация против буфера 20 мМ TRIS/HCl при рН 7,6 ультрафильтрацией в перекрестном потоке (отсечка 30 кДа).
- Хроматография на анионной колонке (Q Sepharose XL) с элюированием 400 мМ NaCl в 20 мМ TRIS/HCl при рН 7,6.
- Хроматография на гидрофобной колонке (Phenyl Sepharose 6 Fast Flow High Sub) с элюированием 50 мМ NaCl в TRIS/HCl при рН 7,6.
- Хроматография на гидроксиапатитной керамической колонке (HA Marco. Prep) с элюированием 200 мМ фосфата натрия при рН 7,4.
- Диафильтрация (отсечка 30 кДа) против PBS при рН 7,4.
- Конечная стерилизующая фильтрация и хранение при -20°С.
Белок в конечном материале был устойчив в течение, по меньшей мере, 6 месяцев и при -20°С, и при 2-8°С.
Белок NadA восприимчив к разложению, и усеченные формы NadA можно выявить вестерн-блоттингом или масс-спектрометрией (например, MALDI-TOF), указывая на потерю молекулярной массы до 10 кДа. Продукты разложения отделяли от нативного NadA гель-фильтрацией (например, с использованием колонки TSK 300SWXL, предварительной колонки TSKSWXL, TOSOHAAS). Такая фильтрация дает 3 пика: (i) первый пик с временем удерживания 12,637 мин и видимой молекулярной массой 885036 Да; (ii) с временем удерживания 13,871 мин и видимой молекулярной массой 530388 Да; (iii) с временем удерживания 13,871 мин и видимой молекулярной массой 530388 Да. Анализ рассеивания света трех пиков выявляет действительные величины молекулярной массы (i) 208500 Да, (ii) 98460 Да, (iii) 78760 Да. Таким образом, первый пик содержит агрегаты NadA, а третий пик содержит продукты разложения.
Поскольку прогнозируемая молекулярная масса NadA(NL)(C) составляет 34113 Да, пик (ii) содержит тримерный белок, который представляет собой желательный антиген.
Антигенные комбинации
Мышей иммунизировали композицией, включающей 3 белка и адъювант гидроокиси алюминия. В целях сравнения, 3 белка также испытывали в отдельности. Использовали 10 мышей на группу. Смесь могла вызвать высокие бактериальные титры против различных штаммов:
| |
Менингококковый штамм(Серогруппа) |
| |
2996(В) |
МС58(В) |
NGH38 |
394/98(В) |
H44/76(В) |
F6124(A) |
BZ133(C) |
C11(C) |
| (1) |
32000 |
16000 |
130000 |
16000 |
32000 |
8000 |
16000 |
8000 |
| (2) |
256 |
131000 |
128 |
16000 |
32000 |
8000 |
16000 |
<4 |
| (3) |
32000 |
8000 |
- |
- |
- |
8000 |
- |
32000 |
| Смесь |
32000 |
32000 |
65000 |
16000 |
260000 |
65000 |
>65000 |
8000 |
| «-» указывает, что данный штамм не содержит ген NadA |
Рассматривая отдельных мышей, тройная смесь вызывала высокие и согласованные бактериальные титры против трех штаммов серогруппы В, из которых были получены отдельные антигены:
| # |
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
| 2996 |
32768 |
16384 |
65536 |
32768 |
32768 |
65536 |
65536 |
32768 |
65536 |
8192 |
| MC58 |
65536 |
32768 |
65536 |
65536 |
65536 |
8192 |
65536 |
32768 |
32768 |
65536 |
| 394/98 |
65536 |
4096 |
16384 |
4096 |
8192 |
4096 |
32768 |
16384 |
8192 |
16384 |
Комбинация и сравнение с OMV
В дальнейших экспериментах соединенные с адъювантами антигены (20 мкг каждого антигена на дозу) вводили в комбинации с 10 мкг OMV, полученных или из штамма Н44/76 (Норвегия) или штамма 394/98 (Новая Зеландия). Положительными контролями являлись антикапсулярное антитело SEAM-3 mAb для серогруппы В или конъюгированные с CRM197 капсулярные сахариды для других штаммов. Результаты (бактериальные титры) показаны в табл.1. Смесь почти всегда дает лучшие титры, чем простые OMV, и, кроме того, добавление смеси к OMV почти всегда значительно повышает эффективность OMV. Более того, во многих случаях смесь антигенов соответствует или превосходит реакцию, наблюдающуюся у положительного контроля.
Испытания сверхвирулентных рядов поколений
Следующие антигены испытывали против разнообразных штаммов серогруппы В из разнообразных сверхвирулентных последовательностей поколений:
(a) NadA(NL)(C)
(b)  G287-953 G287-953
(c) 936- G741 G741
(d) смесь (а), (b) и (с)
(е) OMV, полученные из штамма H44/76 (Норвегия)
(f) OMV, полученные из штамма 394/98 (Новая Зеландия)
(g) Смесь  G287 и (е) G287 и (е)
(h) Смесь (d) и (е)
(i) Смесь (d) и (f)
SEAM-3 использовали в качестве положительного контроля.
Получены следующие результаты, выраженные в виде процентной доли штаммов в указанной сверхвирулентной последовательности поколений, где сывороточный бактерицидный титр превышал 1024:
| |
штаммы |
(a) |
(b) |
(c) |
(d) |
(e) |
(f) |
(g) |
(h) |
(i) |
S-3 |
| А4 |
4 |
50 |
50 |
0 |
100 |
25 |
25 |
25 |
100 |
100 |
+ |
| ЕТ-5 |
8 |
25 |
75 |
88 |
100 |
71 |
14 |
71 |
100 |
100 |
+ |
| Последовательность поколений 3 |
13 |
0 |
75 |
15 |
93 |
8 |
85 |
8 |
92 |
93 |
+ |
| ЕТ-37 |
4 |
11 |
22 |
0 |
33 |
0 |
0 |
0 |
22 |
25 |
+ |
Против определенных эталонных штаммов были получены следующие бактерицидные титры:
| |
штаммы |
(a) |
(b) |
(c) |
(d) |
(e) |
(f) |
(g) |
(h) |
(i) |
S-3 |
| А4 |
961-5945 |
128 |
2048 |
<8 |
2048 |
262144 |
8192 |
262144 |
262144 |
4096 |
8192 |
| ЕТ-5 |
44/76 |
<4 |
2048 |
32768 |
131072 |
524288 |
8192 |
524288 |
524288 |
524288 |
16384 |
| Последовательность поколений 3 |
394/98 |
<4 |
1024 |
32 |
4096 |
<4 |
16384 |
256 |
16384 |
16384 |
16384 |
| ЕТ-37 |
LPN17592 |
2048 |
1024 |
256 |
4096 |
<8 |
<8 |
512 |
16384 |
65536 |
1024 |
Поэтому композиции (d), (h) и (i) вызывают бактерицидные гуморальные иммунные ответы против широкого разнообразия штаммов менингококка серогруппы В в пределах сверхвирулентных последовательностей поколений А4, ЕТ-5 и последовательности поколений 3. Титры при использовании композиций (h) и (i) были в целом выше, чем при использовании (d), но охват штаммов в пределах сверхвирулентных последовательностей поколений А4, ЕТ-5 и последовательностей поколений 3 не был лучше.
Охват нетипированных штаммов был также высоким при использовании композиций (d), (h) и (i).
Анализ домена N-конца NadA
Известно, что очищенный белок NadA N.meningitidis связывается с человеческими эпителиальными клетками (17) (например, клетками Chang, клетками HeLa, клетками Нер-2), а рекомбинантные E.coli, которые экспрессируют NadA, проявляют прикрепляемый фенотип (18). Эти E.coli также способны внедряться в эпителиальные клетки, и внутриклеточный NadA+ve E.coli можно выявить в клетках Chang иммунофлюоресценцией (после вызванной проницаемости мембраны) и электронной микроскопией. Поэтому считают, что NadA функционирует в качестве адгезина и инвазина для эпителиальных клеток.
На основании анализа вторичной структуры зрелый NadA был подразделен на 3 предполагаемых домена: N-концевой глобулярный домен (аа 24-87),  -спиральную внутреннюю область (аа 88-350) с высокой склонностью к витой спирали и С-концевой мембранный якорь (аа 351-405). Исследовали роль N-концевого глобулярного домена во взаимодействии клетки-хозяина. -спиральную внутреннюю область (аа 88-350) с высокой склонностью к витой спирали и С-концевой мембранный якорь (аа 351-405). Исследовали роль N-концевого глобулярного домена во взаимодействии клетки-хозяина.
Усеченный ген nadA, кодирующий белок, лишенный аминокислот 30-87, был клонирован в вектор рЕТ-21 (pET-NadA 30-87) и экспрессирован у штамма BL21(DE3) E.coli. Аминокислоты 24-29 удерживались для обеспечения возможности переработки лидерного пептида и коррекции созревания белка. Анализ вестерн блота и FACS (лазерным анализатором клеток по интенсивности флюоресценции) подтвердил, что NadA 30-87) и экспрессирован у штамма BL21(DE3) E.coli. Аминокислоты 24-29 удерживались для обеспечения возможности переработки лидерного пептида и коррекции созревания белка. Анализ вестерн блота и FACS (лазерным анализатором клеток по интенсивности флюоресценции) подтвердил, что NadA 30-87 был экспрессирован и образовывал олигомеры на клеточной поверхности E.coli, т.е. делеция N-концевого домена не мешает экспрессии, экспорту и мембранной локализации NadA. Однако рекомбинантный штамм E.coli полностью утратил способность прикрепляться к эпителиальным клеткам Chang. Таким образом, N-концевой домен участвует в активности адгезина. 30-87 был экспрессирован и образовывал олигомеры на клеточной поверхности E.coli, т.е. делеция N-концевого домена не мешает экспрессии, экспорту и мембранной локализации NadA. Однако рекомбинантный штамм E.coli полностью утратил способность прикрепляться к эпителиальным клеткам Chang. Таким образом, N-концевой домен участвует в активности адгезина.
Для дальнейшего исследования того, какая часть N-концевого домена участвует во взаимодействии, область дополнительно делили на 3 предполагаемых субдомена: аминокислоты 24-42, содержащие прогнозируемую  -спиральную область с гидрофобными остатками; аминокислоты 43-70, внутреннюю часть без прогнозированной определенной вторичной структуры; и аминокислоты 71-87, содержащие другую прогнозированную -спиральную область с гидрофобными остатками; аминокислоты 43-70, внутреннюю часть без прогнозированной определенной вторичной структуры; и аминокислоты 71-87, содержащие другую прогнозированную  -спиральную структуру. Были созданы 3 конструкта, каждый кодирующий белок с делецией одного субдомена, а затем внедренный в E.coli BL21(DE3), получая следующие штаммы: BL21(DE3)/pET-NadA -спиральную структуру. Были созданы 3 конструкта, каждый кодирующий белок с делецией одного субдомена, а затем внедренный в E.coli BL21(DE3), получая следующие штаммы: BL21(DE3)/pET-NadA 24-42, BL21(DE3)/pET-NadA 24-42, BL21(DE3)/pET-NadA 43-70 и BL21(DE3)/pET-NadA 43-70 и BL21(DE3)/pET-NadA 71-87. Поверхностная локализация олигомеров была подтверждена вестерн-блоттингом и анализом FACS, но прилипание к эпителиальным клеткам Chang было не лучше, чем у контрольного штамма E.coli BL21(DE3)/pET. Данные результаты, подтвержденные также с использованием анализа иммунофлюоресцентной микроскопией, указывают на то, что весь глобулярный N-концевой домен NadA важен при взаимодействии с клетками человека. 71-87. Поверхностная локализация олигомеров была подтверждена вестерн-блоттингом и анализом FACS, но прилипание к эпителиальным клеткам Chang было не лучше, чем у контрольного штамма E.coli BL21(DE3)/pET. Данные результаты, подтвержденные также с использованием анализа иммунофлюоресцентной микроскопией, указывают на то, что весь глобулярный N-концевой домен NadA важен при взаимодействии с клетками человека.
Комбинация с конъюгатами менингококков и/или Hib
Тройную композицию MenB комбинируют со смесью олигосахаридных конъюгатов для серогрупп C, W135 и Y для получения вакцины, содержащей следующие антигены:
| Компонент |
Количество на дозу 0,5 мл |
| Конъюгат серогруппы С |
10 мкг сахарида + 12,5-25 мкг CRM197 |
| Конъюгат серогруппы W135 |
10 мкг сахарида + 6,6-20 мкг CRM197 |
| Конъюгат серогруппы Y |
10 мкг сахарида + 6,6-20 мкг CRM197 |
 G287-953 G287-953 |
20 мкг полипептида |
936- G741 G741 |
20 мкг полипептида |
| NadA |
20 мкг полипептида |
Получают аналогичную вакцину, включающую конъюгат MenB (10 мкг сахарида + 12,5-33 мкг CRM197) и/или конъюгат HbOC Hib (10 мкг сахарида + 2-5 мкг CRM197).
Использование модифицированного сахарида MenA
Капсулярный полисахарид очищали из MenA и гидролизировали для получения олигосахарида MenA. Полисахарид (2 г) гидролизировали при 50°С в буфере 50 мМ ацетата натрия, рН 4,75 при концентрации полисахарида 10 мг/мл в течение приблизительно 4 ч (135). После гидролиза раствор сушили роторным выпариванием.
Олигосахарид активировали с использованием следующей схемы реакции:
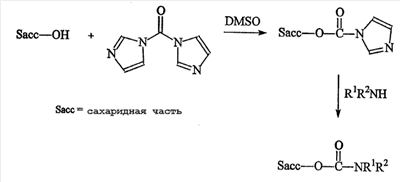
Олигосахарид растворяли в DMSO (диметилсульфоксиде) для получения концентрации сахарида 10 мг/мл. В соответствии с молярным соотношением между олигосахаридом и CDI, равным 1:20, затем добавляли 21,262 г CDI, и реакционную смесь перемешивали в течение 16 ч при комнатной температуре. Полученное соединение MenA-CDI очищали селективным осаждением в смеси 80:20 (об./об.) ацетона:DMSO с последующим центрифугированием. По расчетам путем определения соотношения между свободным имидазолом и связанным имидазолом, эффективность активации реакции составила приблизительно 67,9%.
На втором этапе взаимодействия олигосахарид MenA-CDI солюбилизировали в DMSO при концентрации сахарида приблизительно 10 мг/мл. В соответствии с молярным соотношением между единицей MenA-CDI и DMA (диметиламина), равным 1:100, добавляли 36,288 г 99% гидрохлорида диметиламина (т.е. R1 и R2 = Me) и реакционную смесь перемешивали в течение 16 ч при комнатной температуре. Продукт реакции лиофилизировали и повторно растворяли в водном растворе в концентрации 10 мг/мл.
Для удаления реагента взаимодействия с низкой молекулярной массой (в частности, диметиламина (DMA)) из препарата олигосахарида выполняли этап диализа через мембрану MWCO 3,5 кДа (Spectra/PorTM). Проводили 4 этапа диализа: (i) 16 ч против 2 л 1 М хлорида натрия (диализный фактор 1:20), (ii) 16 ч против 2 л 0,5 М хлорида натрия (диализный фактор 1:20), (iii) и (iv) 16 ч против 2 л WFI (диализный фактор 1:20). Для улучшения очистки также выполняли этап диафильтрации через мембрану 1 кДа MWCO (CentriconTM).
Очищенному продукту MenA-CDI-DMA придавали буферные свойства при рН6,5 в 25 мМ L-гистидине (FlukaTM).
Для получения конъюгатов модифицированного сахарида MenA (MenA-CDI-DMA), в целом способ представлял собой следующее:
- гидролиз полисахарида для получения олигосахаридных фрагментов
- классификация по размерам олигосахаридных фрагментов
- восстановительное аминирование концевых альдегидных групп на классифицированных по размерам олигосахаридах
- защита концевых групп -NH2 группой Fmoc перед реакцией CDI
- эндогенное снятие защиты групп -NH2 во время реакции DMA
-активация концевых групп -NH2 SIDEA (N-гидроксисукцинимидадипиновой кислоты)
- ковалентное присоединение к белку CRM197
Модифицированный конъюгат олигосахарида MenA гораздо более устойчив к гидролизу, чем его естественный аналог, при повышенных температурах. Через 28 дней при 37°С, например, процентная доля высвобожденного сахарида составляет 6,4% для модифицированного олигосахарида, в сравнении с 23,5% для естественного антигена. Более того, титры, вызванные модифицированными олигосахаридами, значимо не ниже, чем титры, полученные с использованием нативных сахарных структур.
Модифицированный конъюгат MenA комбинируют с конъюгатами MenC, MenW135 и MenY в качестве заместителя конъюгата немодифицированного олигосахарида. Данную четырехвалентную смесь смешивают с тремя полипептидами MenB для получения вакцины, эффективной против серогрупп A, B, C, W135 и Y N.meningitidis в одной дозе.
Пневмококковые комбинации
3 комбинированных белка MenB смешивают с конъюгатами пневмококковых сахаридов для получения конечной концентрации 2 мкг/дозу каждого из пневмококковых серотипов (двойной для серотипа 6В). Таким образом, растворенная вакцина содержит следующие антигены:
| Компонент |
Количество на дозу 0,5 мл |
| Конъюгат серогруппы А |
5 мкг сахарида + 6,25-16,5 мкг CRM197 |
| Конъюгат серогруппы С |
5 мкг сахарида + 6,25-12,5 мкг CRM197 |
| Конъюгат серогруппы W135 |
5 мкг сахарида + 3,3-10 мкг CRM197 |
| Конъюгат серогруппы Y |
5 мкг сахарида + 3,3-10 мкг CRM197 |
| Конъюгат пневмококка серотипа 4 |
2 мкг сахарида + 2,5 мкг CRM197 |
| Конъюгат пневмококка серотипа 9V |
2 мкг сахарида + 2,5 мкг CRM197 |
| Конъюгат пневмококка серотипа 14 |
2 мкг сахарида + 2,5 мкг CRM197 |
| Конъюгат пневмококка серотипа 18С |
2 мкг сахарида + 2,5 мкг CRM197 |
| Конъюгат пневмококка серотипа 19F |
2 мкг сахарида + 2,5 мкг CRM197 |
| Конъюгат пневмококка серотипа 23F |
2 мкг сахарида + 2,5 мкг CRM197 |
| Конъюгат пневмококка серотипа 6B |
4 мкг сахарида + 5 мкг CRM197 |
Следует понимать, что изобретение было описано только в виде примера и модификации можно произвести не выходя за пределы объема и сущности изобретения
Формула изобретения
1. Композиция, которая после введения индивидууму способна индуцировать гуморальный иммунный ответ у данного индивидуума, причем гуморальный иммунный ответ оказывает бактерицидное действие против двух или более сверхвирулентных рядов поколений А4, ЕТ-5 и ряда поколений 3 серогруппы В N.meningitidis, где указанная композиция содержит пять менингококковых антигенов:
(1) белок "NadA", представленный последовательностью SEQ ID NO 1 или последовательностью, которая на 85% или более идентична SEQ ID NO 2;
(2) белок «741», представленный последовательностью, которая на 85% или более идентична SEQ ID NO 3;
(3) белок «936», представленный последовательностью, которая на 85% или более идентична SEQ ID NO 4;
(4) белок «953» представленный последовательностью, которая на 85% или более идентична SEQ ID NO 5; и
(5) белок «287», представленный последовательностью, которая на 85% или более идентична SEQ ID NO 6.
2. Композиция по п.1, в которой компоненты, которые индуцируют бактерицидный гуморальный иммунный ответ, получены рекомбинантной экспрессией.
3. Композиция для индуцирования гуморального иммунного ответа у млекопитающего, содержащая пять менингококковых антигенов: (1) белок "NadA"; (2) белок «741»; (3) белок «936»; (4) белок «953» и (5) белок «287».
4. Композиция по п.3, в которой белок NadA имеет идентичность 85% или более с SEQ ID NO 2.
5. Композиция по п.4, в которой белок NadA включает SEQ ID NO 2.
6. Композиция по п.3, в которой белок 741 имеет идентичность 85% или более с SEQ ID NO 3.
7. Композиция по п.6, в которой белок 741 включает SEQ ID NO 3.
8. Композиция по п.3, в которой белок 936 имеет идентичность 85% или более с SEQ ID NO 4.
9. Композиция по п.8, в которой белок 936 включает SEQ ID NO 4.
10. Композиция по п.3, в которой белок 953 имеет идентичность 85% или более с SEQ ID NO 5.
11. Композиция по п.10, в которой белок 953 включает SEQ ID NO 5.
12. Композиция по п.3, в которой белок 287 имеет идентичность 85% или более с SEQ ID NO 6.
13. Композиция по п.12, в которой белок 287 включает SEQ ID NO 6.
14. Композиция по п.3, в которой, по меньшей мере, два из антигенов с (1) по (5) экспрессированы в виде одной полипептидной цепи.
15. Композиция по п.3, содержащая полипептид, который включает пару антигенов в пределах одной полипептидной цепи, выбранную из группы, состоящей из: NadA и 741; NadA и 936; NadA и 953; NadA и 287; 741 и 936; 741 и 953; 741 и 287; 936 и 953; 936 и 287; 953 и 287.
16. Композиция по п.3, содержащая полипептид формулы NH2-A-[-X-L-]n-B-COOH, где Х представляет собой аминокислотную последовательность одного из пяти антигенов от (1) до (5); L представляет собой необязательную линкерную аминокислотную последовательность; А представляет собой необязательную N-концевую аминокислотную последовательность; В представляет собой необязательную С-концевую аминокислотную последовательность и n=2, 3, 4 или 5.
17. Композиция по п.16, в которой n=2, X1 представляет собой белок 936, а Х2 представляет собой белок 741.
18. Композиция по п.16, в которой n=2, X1 представляет собой белок 287, a X2 представляет собой белок 953.
19. Композиция по п.3, содержащая белок, включающий SEQ ID NO 7.
20. Композиция по п.3, содержащая белок, включающий SEQ ID NO 8.
21. Композиция по п.3, дополнительно содержащая сахаридные антигены из серогрупп менингококка Y, W135, С и, необязательно, А.
22. Композиция по п.3, дополнительно содержащая сахаридные антигены из Haemophilus influenzae типа В.
23. Композиция по п.21 или 22, в которой сахаридный антиген конъюгирован с носителем, выбранным из: дифтерийного токсоида, столбнячного токсоида, CRM197 или белка D H.influenzae.
24. Композиция по п.3, дополнительно содержащая антиген из Streptococcus pneumoniae.
25. Композиция по п.3 для использования в качестве лекарственного средства.
26. Применение композиции по любому из предыдущих пунктов в производстве лекарственного средства для предотвращения и/или лечения заболевания, вызванного Neisseria.
27. Способ индуцирования гуморального иммунного ответа у млекопитающего, включающий этап введения эффективного количества композиции по любому из пп.1-26.
28. Полипептид для индуцирования гуморального иммунного ответа у млекопитающего, имеющий аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO от 1 до 8.
29. Способ очистки растворимого NadA из культуральной среды, включающий этапы концентрации и диафильтрации против буфера ультрафильтрацией; хроматографии на анионной колонке; хроматографии на гидрофобной колонке; хроматографии на гидроксиапатитной керамической колонке; диафильграции против буфера и стерилизации через фильтр.
Приоритет по пунктам:
11.10.2002 по 13.03.2003 и 22.04.2003 по пп.1-29. |
|
|
|