
СПИСОК ПАТЕНТОВ С УПОМИНАНИЕМ ГИАЛУРОНОВОЙ КИСЛОТЫ
-
- 2017751 Способ получения гиалурона
- 2192150 БАД для профилактики йодной недостаточности
- 2112542 Препарат для лечения патологий соединительных тканей
- 2225206 Препарат для лечения рака молочной железы
- 2299733 Лечение опорно-двигательного аппарата
- 2299732 Способ лечения глаукомы
- 2299726 Противоинфекционная губная помада
- 2299725 Косметическое средство для ухода за кожей
- 2198878 Ароматическое соединение
- 2198702 Способ подготовки трофических язв к аутодермапластике
- 2198653 Вагинальные суппозитории
- 2197946 Композиция для ухода за волосами
- 2197923 Фармацевтическая композиция для лечения отеков роговицы
- 2298410 Биотрансплантант и способ лечения ревматических и аутоиммунных заболеваний
- 2197501 Фотоотверженный гель на основе сшитой гиалуроновой кислоты
- 2197228 Твердые лекарственные формы
- 2197222 Водная компазиция для ухода за волосами, лица и тела
- 2297425 Полипептиды
- 2297240 Композиция с гиалуроновой кислотой
- 2297230 Фармацевтическая компазиция с ксантоновой смолой
- 2196588 Глазные капли
- 2195955 Применение биологически активных веществ
- 2195926 Дерматологические композиции
- 2295954 Микрочастицы для доставки нуклеиновых кислот
- 2295951 Косметика для ухода за кожей лица и век
- 2195262 Фармакологическое средство на основе гиалуроновой кислоты
- 2194512 Способ профилактики и коррекции процесса старения кожи
- 2194478 Лечение экземы
- 2294716 Расширяемый стент
- 2194055 Сшитые сополимеры
- 2099350 Ассоциаты депротонированной гиалуроновой кислоты
- 2293557 Средство для лечения кожи и слизистых
- 2292878 Приготовление микроцастиц, содержащих метопропол
- 2292746 БАД
- 2192256 Защита кишечника
- 2191782 Получение модифицированной гиалуроновой кислоты
- 2292219 Паратиреоидный гормон человека
- 2291686 Микроцастицы
- 2191000 Косметическая маска
- 2290921 Фармацевтические и косметические средства против старения кожи
- 2290900 Модифицированный биоматериал для использования в офтальмологии
- 2290899 Получение биоматерьяла
- 2290397 Новые инданилиденовые соединения
- 2290186 Лечение сирингомиелии
- 2288702 Иррингационный раствор для офтальмологии
- 2288699 Гель для лечения стоматологических заболеваний
- 2188011 Активирующая остеогенез фармацевтическая композиция
- 2187327 Средство с антисептиком
- 2187325 Средство с радиопротекторным действием
- 2287330 Композиции миноксидила
- 2186786 Способ получения гиалуроновой кислоты
- 2186593 Лечение раненого процесса кожи
- 2286801 Очищение воды
- 2286781 Лечение ожогов пищевода у детей
- 2286764 Средство лечения воспалений полости рта
- 2185840 Лечение инфекционных заболеваний
- 2286151 Альфа-2-Дельта-Лиганда
- 2185149 Ранозаживляющий гель
- 2285527 Лечение ИЛ-6 заболеваний
- 2184448 Раствор хранения роговицы, включающий гиалуроновую кислоту
- 2090179 Крем для кожи
- 2183961 Способ лечения кожи
- 2284331 Соли алифотических аминов
- 2284187 Производные амида
- 2089191 Снизить внутрение давление
- 2283320 Получение гликозаминогликанов
- 2283129 Лечение опухолей
- 2283098 Косметические средства с Q
- 2182574 Ароматические соединения
- 2088257 Средство с гипохолестеролемическим действием
- 2088218 Состав для гигиенических салфеток
- 2088206 Способ получения препарата, создающего исскуственный загар
- 2282462 Противомикробные средства
- 2182008 Интровагинальная компазиция
- 2181999 Препарат с отсроченным высвобождением
- 2181998 Новые композиции липидов
- 2181995 Лечение болевого синдрома
- 2181295 Вирионная вакцина
- 2087144 Витамин Е
- 2379336 Способ стирки
- 2379052 Вакцинация
- 2180855Композиция в виде ионного комплекса
- 2379025 Противоинфекционный гель
- 2180825 Лечение травм роговицы
- 2281082 Способ коррекции эстетических и возрастных проблем кожи
- 2180576 Биоактивная добавка для косметических средств
- 2280459 Средство для изменения скорости роста или репродукции клеток
- 2179981 Соли переходного металла
- 2378010 Жидкие вакцины
- 2378008 Комбинированные вакцины
- 2378007 Анаболическое средство
- 2377973 Растительные экстракты
- 2280041 Способ получения водорастворимых комплексов гиалурил
- 2280038 Биополимеры
- 2323733 Йодный обмен
- 2377260 Гель
- 2178693 Противовирусное средство на основе гиалуроновой кислоты
- 2178692 Облегчающие зуд косметическое средство
- 2377022 Гемостатические спреи
- 2376982 Увлажняющая сыворотка для лица
- 2376974 Трансдермальный гель для лица
- 2362784 Гипо-и гиперацетилированные менингокковые капсульные сахариды
- 2177789 Устройство для доставки лекарства к шейке матки
- 2277954 Крем для лица омолаживающий
- 2376378 Способ получения метионина
- 2177332 Биоматериал для предотвращения послеоперационных спаек, с производной гиалуроновой кислотой
- 2177310 Способ получения таблеток
- 2376011 Средство для позвоночника
- 2277410 Косметическое средство
- 2323748 Медицинская повязка
- 2276998 Гидрогелевые композиции
- 2082416 Способ получения препарата с коллагенном из животного сырья
- 2375081 Адсорбирующее изделие
- 2375049 Охлаждающий пластырь
- 2346049 Способ получения гиалурона
- 2275913 Фармацевтические средства
- 2174985 Полисахарид с антиоксидантом
- 2373957 Носитель для лекарственных средств и биологически активных веществ
- 2373941 Способ коррекции возрастных и патологических изменений кожных покров
- 2174845 Композиции и способы доставки генетического материала
- 2174830 Средство для укрепления волос
- 2373769 Синбиотическая композиция
- 2274472 Лечение апорно-двигательного аппарата и болевых синдромов
- 2372929 Профилактическая композиция на основе веществ фенольной природы в липосомной форме
- 2173563 Способ нанесения на поверхность предметов покрытия на основе гиалуроновой кислоты, её производных и полусинтетических полимеров
- 2079304 фармацевтическая композиция, обладающая иммуносупрессорной и антимикробной активностью
- 2273645 Полипептид ожирения
- 2173154 Фракция кератансульфатолигосахаридов и содержащий ее фармацевтический препарат
- 2173136 Грязная мазь
- 2173128 Способ хирургического лечения центральных разрывов сечатки
- 2078561 Косметическое средство предотвращающее старение кожи
- 2172490 Способ прогнозирования воспалительных заболеваний молочной железы при эндопластике
- 2272645 Способ лечения ЦМВ-Инфекции у детей раннего возроста
- 2272636 Фармацевтическая композиция для местного лечения воспаления
- 2272635 Фармацевтически активная субстанция для офтальмологии
- 2272599 Биоматерьял для стабилизации прогрессирующей миопии "Коллаплант"
- 2172168 Средство для заживления ран на основе гиалуроновой кислоты
- 2371172 Фармацевтическая композиция для лечения нервной системы на основе стефаглабрина
- 2171470 Способ прогнозирования послеоперационной трансформации доброкачественных опухолей нервной системы
- 2077317 Состав для ванн
- 2271213 Комбинированные композиции, содержащие экстракты из растений и морских животных
- 2076872 Способ получения окрашенной гиалуроновой кислоты
- 2076671 Раствор для защиты роговицы
- 2370281 Конъюгаты гидроксиалкилкрахмал
- 2370275 Способ лечения (коррекции) косметических и возрастных дефектов кожи
- 2370258 Фармацевтическая композиция для парентальной доставки в форме лиофилизата
- 2270023 Способ экстракции и очистки протеогликана хрящего типа (варианты)
- 2369408 Гемостатическая композиция, включающая гиалуроновую кислоту
- 2369387 Фармацевтическая композиция для лечения нервной системы
- 2369379 Нетаблитированные жевательные формы для индивидуального введения
- 2169136 Производное коричной кислоты
- 70792 Медицинский аппликатор
- 20741717 Способ стабилизации аскорбиновой кислоты
- 2074712 Способ получения препарата, препятствующего преждевременной эякуляции
- 2367954 Способ прогнозирования развития кожной патологии у женщин с синдромом склерополикистозных яичников (СПКЯ)
- 2268075 Устройство для электрокинетической доставки
- 2268052 Средство для лечения воспалительных и дегенеративных заболеваний суставов
- 2167649 Способ получения твердой дисперсии умеренного водорастворимого лекарственного вещества
- 2167647 Гель для бритья
- 2073520 Лечение урологических инфекций
- 2367476 Биопластический материал
- 2367475 Мембрана для использования при направленной регенерации тканей
- 2367469 Фармацевтическая композиция на основе лизоамидазы
- 2367456 Фармацевтическая композиция обладающая антибактериальным и некролитическим действием
- 2367455 Фармацевтическая композиция обладающая некролитическим и антибактериальным действием
- 2267324 Применение антиадгезивных углеводов, препарат для уменьшения и /или блокирования адгезии патогенных веществ
- 2166934 Композиции включающие биологический агент
- 2166510 Псевдодипептиды
- 2366460 Композиции, имеющие высокую противовирусную и антибактериальную активность
- 2360901 Производные феноксиуксусной кислоты
- 2165749 Способ восстановления эндотелия роговицы
- 2265441 Способ укрепления склеры
- 2365382 Композиции и способы для регуляции развития сосудов
- 2070879 Соли гликозаминогликанов
- 2164914 Циклические и гетероциклические N - замещенные - иминогидроксамовые карбоновые кислоты
- 2264627 Хламидийный конъюктивит
- 2364399 Фармацевтический препарат на основе стефаглабрина
- 2264230 Препарат с замедленным высвобождением активного вещества
- 2363497 Фармацевтические композиции
- 2363496 Способ увеличения объема мягких тканей
- 2363473 Способ антифлогистической активации в эксперементе
- 2363461 Фармацевтический препарат на основе сигетина
- 2363459 Средства для введения в роговицу глаз для предотвращения офтальмологических нарушений
- 2363448 Фармацевтические композиции
- 2163123 Глазные капли
- 2162687 Усовершенствованнная лекарственная форма индуктора интерферана
- 2162343 Биосовместимый полимерный материал и способ его получения
- 2162327 Лечение рака
- 2067841 Способ получения ароматизатора
- 2161478 Способ консервированого лечения гонартроза
- 2361617 Вольфрамовые частицы в качестве рентгеноконтрастных веществ
- 2361552 Способы и устройства для дренирования жидкостей и понижения внутриглазного давления
- 2066996 Способ изготовления пленочного материала для офтальмохирургии
- 2361417 Корм с глюкозамином и экстрактом ивы для профилактики артроза у животных
- 2161002 Пищевой общеукрепляющий лечебно-профилактический продукт из хрящевой ткани акул
- 2360928 Комплексная матрица для медико-биологического применения
- 2160574 Способ лечения глаукомы
- 2360688 Способ лечения повреждений переферических нервов
- 2360670 Фармацевтическая композиция при климактерических расстройствах
- 2360646 Эндолюминальный протез
- 2260445 Способ усовершенствования транспортировки через легко прспосабливаемый полупроницаемый барьер
- 2260007 Производные амида
- 2359975 Способ получения модифицированных арабиногалактанов
- 2359974 Антигенные Пептиды
- 2159775 Псевдопептидный продукт
- 2259833 Фармацевтическая композиция для лечения роговицы глаза
- 2259816 Ранозаживляющее средство
- 2259815 Способ коррекции возрастных изменений, связанных с процессами старения кожи
- 2359706 Способ сохранения офтальмологических растворов
- 2359704 Антисептическое средство
- 2359662 Микрокапсулы
- 2159253 Катионные полимеры
- 2159111 Средство для ухода за кожей лица
- 2159105 Композиция для защиты кожи от опасных химических веществ Получение
- 2158593 Биосовместимый водный раствор
- 2358728 Способ лечения и предупреждения потери костной ткани
- 2258517 Способ хирургического лечения травмотических повреждений селезенки пленкой на основе гиалуроновой кислоты
- 2357968 Кристалические формы производной имидазола
- 2357957 Ингибиторы P38 и их применение
- 2157647 Пищевая добавка и ее получение
- 2357758 Препараты для чрескожной и чересслизистой добавки
- 2063244 Способ стабилизации растворов
- 2063140 Способ получения препарата для консервирования мяса
- 2157381 Способ получения гиалуроновой кислоты
- 2257198 Композиции микроцастиц
- 2356909 Белковый комплекс
- 2356570 Косметическая композиция
- 2256434 Способ закрытия перфорации барабанной перепонки
- 2356520 Способ лечения постконтузионного повреждения сечатки глаза
- 2156133 Гель
- 2255945 Полимерная композиция
- 2355761 Средства повторной дифференцировки
- 2061043 Способ повышения устойчивости урокиназы к нагреванию
- 2061005 Способ получения красителей для гистологических исследований
- 2355420 Зубная паста
- 2355385 Композиции пролонгированного действия с контролируемым высвобождением
- 2355240 Способ получения пищевого препарата хондропротекторного действия
- 2155057 Пихтово репейный бальзам
- 2354409 Способ производства высвобождающих лекарственные средчтва медицинских устройств
- 2254145 Раневое покрытие на основе коллаген-хитозанового комплекса
- 2254133 Лечение и профилактика ВИЧ-инфекции у человека
- 2253439 Фармацевтическая композиция для защиты и улучшения оптических свойств роговици при проведении эндовитреальных вмешательств
- 2253437 Способ омоложения кожи
- 2153352 Фармацевтическая композиция обладающая ранозаживляющим и противовоспалительным действием
- 2353354 Фармацевтический препарат на основе низкомолекулярного индуктора интерферона
- 2252787 Способ получения искусственной матрицы кожи
- 2252767 Способ нормализации иммунобиохимического гомеостаза коров в предродовом и послеродовом периодах
- 2352583 Фармацевтическая композиция содержащая Fc-область иммуноглобулина в качестве носителя
- 2152403 Модифицированные полисахариды
- 2352356 Иммуногенная композиция
- 2352342 Исскусственный физиологический солевый раствор Способ его получения
- 2352330 Фармацевтический препарат на основе низкомолекулярного индуктора интерферона
- 2352323 Фармацевтический препарат с модифицированным высвобождением
- 2152027 Способ подготовки ткани мозга для определения гликозаминогликанов
- 2251842 Интектицидный состав для борьбы с личинками оводов
- 2151580 Способ активации пролиферации эндотелия роговицы
- 2351648 Дифференцировка стромальных клеток, полученных из жировой ткани, в эндокринные клетки поджелудочной железы и их использование
- 2351595 N - гидроксиформамидные соединения в качестве ингибиторов металлопротеина
- 2251411 Косметическое средство в лиофилизированной фармацевтической форме
- 2251405 Косметика...ее композиции для косметических препаратов
- 2251367 Средство со сшитой гиалуроновой кислотой для наращивания тканей
- 2351359 Косметика для профилактики и лечения избыточной массы тела
- 2351322 Препарат на основе низкомолекулярного индуктора интерферона
- 2351153 Диета при остеортрите собак
- 2350958 Способ определения групповой принадлежности синовальной жидкости
- 2350625 Производные гиалуроновой кислоты с пониженной биодеградируемостью
- 2150266 Крем после бритья
- 2350354 Фармацевтическое средство содержащие антагонист и фактор некроза
- 2350340 Способ коррекции процессов регенерации
- 2350309 Способ лечения избыточной массы тела с помощью рефлексотерапии
- 2250047 Профилактический продукт из хрящевой ткани гидробионтов
- 2249467 Медицинский матерьял и изделия на его основе
- 2055079 Способ получения препарата гиалуроновой кислоты
- 2349599 Биоадгезив мидии
- 2054903 Способ лечения коллагеноза у бычков на откорме
- 2249210 Способ прогнозирования предрасположенности к развитию и тяжести течения деформирующего остеоартроза коленного сустава у взрослых
- 2349339 Средство для соединительной ткани
- 2148988 Человеческий интерферона
- 2148399 Лечение атеросклероза
- 2148396 Способ определения активного вещества в дифильных мазевых основах
- 2148375 Способ диагностики близорукости
- 2348415 Способ противоспаечной терапии после хирургического вмешательства
- 2348400 Препарат на основе низкомолекулярного индуктора интерферона
- 2348386 Способ непроникающего хирургического лечения первичной открытоугольной глаукомы
- 2248213 Лечение Галактозидальной А недостаточности
- 2347586 Микрофлюидизированные эмульсии типа "масло в воде" и вакцинные средства
- 2147243 Контрастное средство
- 2146526 Лечебный препарат дисбактериоза и урогенитальных инфекций
- 2146148 Терапевтическое применение фактора роста кератиноцитов (ФРК)
- 2146139 Способ повышения активности макрофагов и комбинации для его осуществления
- 2346277 Способ диагностики специфического синовита
- 2345793 Ультразвуковые контрастные вещества и их получение
- 2345782 Терапевтические комбинации на основе PORIFERA для лечения и предотвращения кожных заболеваний
- 2245131 Способ коррекции косметических недостатков кожи
- 2245130 Способ активации восстановительных процессов в коже
- 2144833 Хондроитиназа
- 2344809 Получение твердых дозированных форм с использованием сшитого нетермопластичного носителя
- 2244540 Косметический гель для ухода за кожей лица
- 2244536 Способ лечения дегенеративно-дистрофических заболеваний тазобедренного сустава
- 2344167 Хмелевый экстракт
- 2143884 Агент регулирования дифференциации клеток кожи, культурная среда для клеток или тканей и способ регулирования дифференциации клеток кожи
- 2343932 Способ получения обладающих пониженной растворимостью в воде пленночных материалов
- 2343903 Устройство доставки лекарств для контролируемого введения препаратов
- 2048817 Способ получения материала для лечения ожогов и гнойно - некронических ран
- 2048803 Гидратантный крем
- 2242974 Средства и способы лечения воспалительных заболнваний
- 2142816 Способ получения антигерпетической вакцины
- 2342923 Средство для обработки рук с увлажняющим эффектом
- 2142781 Косметика для макияжа ресниц и бровей и агент ингирирующий рост микроорганизмов в косметических средствах
- 2242251 Трансплантируемые стенты с биоактивными покрытиями
- 2142257 Способ обработки глазных имплантантов и контакных линз
- 2342389 Мононатриевая соль
- 2342107 Способ устранения западения верхнего века при анофтальме
- 2141828 Средство, пролонгирующее эффективность чесночного порошка
- 2241489 Косметическое средство матриксных протеинов для залечивания ран
- 2241443 Средство для лечения герпеса
- 2241414 Способ получения протезов кровеносных сосудов
- 2341539 Гидрогель
- 2141324 Регулятор скорости воздействия препарата для инъекций
- 2141312 Косметическое средство для ухода за кожей лица
- 2341296 Средства и способы покрытия медицинских имплантантов
- 2341272 Средство для неспецифической иммунотерапии
- 2341266 Стенты с нанесенным покрытием содержащим N - (5-(4-(4-
- 2341257 Иммуномодулирующее средство
- 2341255 Средство для лечения климактерических расстройств
- 2240821 Способ лечения урологических инфекций
- 2140786 Способ лечения лишая
- 2140243 Способ хирургического лечения диабетической ретинопатии и отслоек сечатной оболочки
- 2240140 Медицинская многослойная повязка и изделия на ее основе
- 2240135 Культура клеток, содержащая клетки - предшественники остеонегеза, имплантант на ее основе и его использование для восстановления целостности кости
- 2240123 Экзогенные биологически активные коньюгирующие вещества
- 2139886 Фотоотвержаемое производное гликозаминогликата, сшитое производное гликозаминогликата и способы их получения, способ предотвращения клеточной и тканевой адгезии
- 2139729 Вакцина. Способ стимулирования иммунной системы
- 2339386 Средство обладающее радио - и химиозащитным действием
- 2339369 Лечение офтальмологических нарушений с использованием мочевины и ее производных
- 2139041 Гидратантный регенерирующий крем и способ его получения
- 2139039 Косметический суперкрем для ухода за кожей
- 2139017 Способ получения боисовместимого материала
- 2138503 Производные камптотецина, способы их получения, уникальное средство
- 2338556 Средство содержащие антагонист Р2Х - рецептора и нестероидное противоспалительное лекарственное средство
- 2338514 Косметическое средство для профилактики старения кожи
- 2138297 Медицинские устройства, подверженные вызываемому разложению
- 2138295 Покрытие для ран
- 2337906 Ингибиторы цитозольной фосфолипазы А2 Применение физиологически допустимого корпускулярного ферримагнитного или ферромагнитного материала. Способ формирования магнитометрического изображения
- 2137501 Устройство формирования изображения
- 2137477 Способ лечения заболеваний характеризующихся аутоиммунной агрессией
- 2137467 Крем для кожи лица и тела
- 2137449 Способ коррекции дефектов преломления в глазу млекопитающего
- 2137402 Пищевая Добавка БАД
- 2336899 Способ стимуляции миелопоэза
- 2336862 Способ получения раствора для лечения роговицы
- 2336830 Способ восстановления костных структур челюсти
- 2136696 Новый полипептид и средство против ВИЧ - Инфекции
- 2336092 Биоадгезивное средство, по существу свободное от воды
- 2336089 Средство и способ лечения заболеваний периодонтальных и пульпы
- 2336074 Средства и способы лечения заднего сегмента глаза
- 2235548 Ранозаживляющее средство
- 2135186 Способ лечения рефлекторных синдромов при остеохондрозе
- 2234945 Стабилизатор водного раствора и водосодержащего сырья
- 2334762 Растворимая ассоциативная карбоксиметилцеллюлоза
- 2234514 Макропористые хитозановые гранулы и способ их получения. Способ культивирования клеток
- 2133615 Средство для лечения неврологических заболеваний
- 2233164 Способ профилактики развития послеоперационных спаек брюшной полости
- 2133127 Неткатный материал, способ его получения и способ лечения
- 2333223 Альдегидные производные сиаловой кислоты и средства на их основе
- 2333007 Полипептидные вакцины для широкой защиты против рядов поколений менингококов с повышенной вирулентностью
- 2332985 Дозированные формы анестезирующих средств с длительным высвобождением для обезболивания
- 2132677 Косметическая маска
- 38603 Пленочный аппликатор
- 2232594 Средство содержащие ингибирующие остеокластогенез фактор и полисахарид
- 2332238 Средство для прокладок, раневых повязок и других изделий, контактирующих с кожей
- 2331668 Стромальные клетки, получение из жировой ткани, для заживления дефектов роговицы и внутриглазных дефектов и их использование
- 2331438 Альфа - 2 - Дельта Лигант для лечения симптомов нижних мочевыводящих путей
- 2331411Электропряденые аморфные фармоцевтические средства
- 2331367 Способ профилактики образования спаек и их рецидива
- 2130767 Масло в воде для получения косметических и дерматологических средств, способ косметической обработки
- 2230752 Поперечносшитые гиалуроновые кислоты и их применение в медицине
- 2230558 Способ восстановления и сохранения здоровья скмьи
- 2230550 Средства длительного высвобождения, способ их получения и применения
- 2230458 Поддержания здоровья суставов
- 2330290 Способ определения состояния метаболических процессов в ткани суставного хряща
- 2230073 Способ поперечного сшивания карбоксилированных полисахаридов
- 2329059 Способ лечения полипозного риносинусита
- 2329037 Комбинированная терапия для лечения иммуновоспалительных заболеваний
- 2128666 Гиалуроновая кислота и ее соли, способ очистки гиалуроновой кислоты, способ получения гиалуроновой кислоты. Фармацевтический препарат с гиалуроновой кислотой и средства с гиалуроновой кислотой используемые в офтальмологии
- 2328740 Способ экспресс - оценки действия зубных паст
- 2128502 Косметический гель
- 2328272 Суппозитории индуктора интерферона
- 2328268 Косметика содержащая амфолитный сополимер
- 2128057 Композиционная мембрана, способ ее получения и способ направленной регенерации тканей с ее применением
- 2128055 Средство замедленного освобождения и способ его получения
- 2128049 Свечи
- 2227743 Полипептидные варианты с повышенной гепаринсвязывающей способностью
- 2326893 Ковалентное и нековалентное сшивание гидрофильных полимеров
- 2326697 Новый перевязочный материал для быстрого заживления раневой поверхности кожи
- 2126264 Фармацевтическое средство с гиалуроновой кислотой
- 2326137 Способ получения содержащих альгинат пористых формованных изделий
- 2325902 Способ выделения гликозаминогликанов из минерализованной соединительной ткани
- 2225195 Репелленты против насекомых
- 2325193 Сосудистый стент
- 2325184 Улучшенные везикулы наружной мембраны бактерий
- 2325153 Многокомпонентная фармацевтическая дозированная форма
- 2325152 Удерживаемая в желудке система регулируемой доставки лекарственного средства
- 2029955 Способ предоперационного определения помутнения задней капсулы хрусталика при экстракции катаракты
- 2324688 Производные бисбензизоселеназолонила с противоопухолевым, противовоспалительным и антитромбоническим действием
- 2323017 Устройство и способ контролируемый доставки активных веществ в кожу
- 2323011 Содержащий Коллаген I и Коллаген II способный к рассасыванию внеклеточный матрикс, предназначенный для реконструирования хряща
- 2322955 Способ изготовления имплантанта для пластики дефектов хрящевой ткани
- 2322454 Антитело против CCR5
- 2322263 Система продолжительного высвобождения растворимого лекарственного средства
- 2221561 Витамин Е и его сложные эфиры
- 2321634 Гены участвующие в метаболизме углерода и продуцировании энергии
- 2321597 Биоматерьял, способ его приготовления и его применение, медицинское средство, имплантант и вкладыш
- 2121340 Средство для похудения
- 2220737 Средство для улучшения состояния опорно-двигательного аппарата
- 2220729 Гель используемый в стоматологии
- 2320720 Способ культивирования фибропластов для заместительной терапии
- 2320378 Накожный аппликатор
- 2320369 Средства, содержащие Альфа - 2 - Дельта Лиганды и ингибиторы обратного захвата серотонина/норадреналина
- 2320362 Местные фармацевтические средства, содержащие проантоцианидины, для лечения дерматитов
- 2320322 Биоадгезивная доставка лекарств
- 2320318 Чувствительное к температуре изменяющие состояние средство гидрогеля
- 2025120 Способ получения препарата, содержащего Фактор /G-CSF/, стимулирующий рост колоний гранулоцитов
- 2319490 Средство для введения железа при лечении синдрома беспокойных ног
- 25995 Содержащее адгезив приспособление для фиксации зубных протезов в полости рта
- 2218907 Средство для ухода за кожей лица и веками
- 2318830 Способ получения модифицированного дерматансульфата
- 2118153 Косметика - туш для ресниц
- 2217441 Способ получения полимера
- 2317296 Изетионатная соль селективного ингибитора CDK4
- 2217171 Мембрана для использования при направленной регенерации тканей
- 2317095 Экстракты ECHINACEA ANGUSTIFOLIA
- 2216332 Препарат для лечения астроза
- 2216314 Крем - маска для обезвоженной кожи
- 2316333 Средство оздоровительно-восстановительных косметических панто-магниевых ванн
- 2021304 Способ получения биологически активного средства
- 2115662 Способ получения гиалуроновой кислоты
- 2315627 Впрыскиваемые имплантанты на керамической основе для заполнения морщин, кожных впадин, шрамов
- 2315623 Средство получаемое путем лиофилизации препарата
- 2114862 Способ получения гиалуроновой кислоты
- 2314791 Лечебно-Косметическое средство
- 2314791 Косметический крем-бальзам для ухода за кожей лица и шеи
- 2214600 Способ оценки эффективности лечения неврологических проявлений
- 2114602 Способ косметической обработки
- 2114587 Раствор для защиты роговицы
- 2214283 Имплантант для подкожного или внутрикожного введения
- 2313370 Медицинские протезы, имеющие улучшенную биологическую совместимость
- 2313356 Препарат для лечения демодекоза
- 2313338 Средство на основе этиллинолеата и триэтилцитрата для лечения себореи и угрей
- 2313328 Косметика содержащая тонкодисперный и пористый порошок
- 2212880 Способ получения препарата содержащего антибиотик, с замедленным высвобождением активного вещества
- 2312640 Способ лечения Блефароконьюнктивальной формы синдрома сухого глаза
- 2017751 Способ получения гиалуроновой кислоты
- 2312145 Гены CORYNEBACTERIUM GLUTAMICUM, кодирующие белки, участвующие в синтезе мембран и мембранном транспорте
- 2311458 Белки вызывающие измененную иммуногенную реакцию. Способ их получения и использования
- 2311183 Улучшенное разделение с использованием гталуроновой кислоты
- 2311177 Ингибиторы интегрина для лечения заболевания глаз
- 2300069 Косметическая маска
- 2211024 Уход за сухой кожей
- 2310440 Раствор для защиты роговицы от повреждений
- 2309684 Лечение межфалангового остеоатроза узелковой формы
- 2309406 Способ мониторинга фиброза печени у больных хроническим гепатитом с (ХГС)
- 2209088 Опосредованная рецепторами доставка генов с использованием векторов на основе бактериофагов
- 2308967 Уменьшение объема ткани
- 2308962 Средство для опорно-дигательного аппарата
- 2308957 Способ получения препарата для мезотерапии
- 2308954 Средство для лечения ран, содержащее плазму или сыворотку крови
- 2308951 Комплексный способ профилактики вагинальных дисбактериозов
- 2308937 Косметическая биологически активная добавка и косметический литофитокомплекс на ее основе
- 2208638 ДНК (варианты), способ получения белка
- 2207885 Способ подачи небольшого объема лечебного раствора к целевому месту
- 2207858 Лишенные побочных эффектов производные простагландинов для лечения глаукомы
- 2207845 Твердая лекарственная форма пролонгированного действия
- 2207844 Препарат для местного неинвазивного применения
- 2207841 Средства с антиферментативным действием
- 2306335 Стволовые клетки и решетки полученные из жировой ткани
- 2306140 Новые рецепторы для Helicobacter pylori и их применение
- 2205612 Способ эндотелизации IN VITRO протезов кровеносных сосудов
- 2105540 Депигментирующее средство
- 2304960 Косметическое средство для кожи
- 2304616 Гены участвующие в гомеостазе и адаптации
- 2204550Способ получения длинноцепочечной N-Ацилированной кислотой Аминокислот
- 2204415 Способ получения изображения
- 2204394 Средство для лечения грибковых инфекций, желудочных язв
- 2204366 Способ хирургического лечения глаукомы
- 2104034 Вагинальное увлажняющие средство, способ его получения
- 2303991 Биологически активная добавка
- 2303990 БАД
- 2303973 Адсорбирующее изделие
- 2203676 Средство обладающее иммунокорригирующим действием
- 2203672 Способ предупреждения беременности
- 2303635 Гены кодирующие белки резистентности и толерантности к стрессам
- 2303529 Способ фиксации альгинатного геля на твердой фазе, способ получения клеточного чипа на его основе
- 2203078 Способ лечения гнойных ран
- 2302412 Гидразоно-малонитрилы
- 2102400 Способ получения гиалуроновой кислоты
- 2202356 Способ стимуляции репаративных процессов длительно незаживающих ран и трофических язв
- 2202336 Средство для ухода за кожей
- 2302231 Глазные капли
- 2102082 Способ магнитометрического исследования тела человека или животного
- 2301814 Полиакриламидный гидрогель
- 2201765 Гибридные матричные имплантанты и эксплантанты
- 2301677 Биотрансплантант для лечения дегенеративных и трвматических заболеваний хрящевой ткани и способ его получения
- 2301676 Способ лечения ревматизма
- 2301674 Способ лечения больных с переломами нижней челюсти
- 2301661 Средство с регулируемым освобождением и способ его получения
- 2005488 Средство для лечения болезней соединительной ткани
- 2200001 Крем для кожи
|
РОССИЙСКАЯ ФЕДЕРАЦИЯ

ФЕДЕРАЛЬНАЯ СЛУЖБА
ПО ИНТЕЛЛЕКТУАЛЬНОЙ СОБСТВЕННОСТИ
ПАТЕНТАМ И ТОВАРНЫМ ЗНАКАМ
|
Патент №2317296 |
(54) ИЗЕТИОНАТНАЯ СОЛЬ СЕЛЕКТИВНОГО ИНГИБИТОРА CDK4
(57) Реферат:
Изобретение относится к изетионатной соли 6-ацетил-8-циклопентил-5-метил-2-(5-пиперазин-1-илпиридин-2-иламино)-8Н-пиридо[2,3-d]пиримидин-7-она и ее кристаллическим формам, которые обладают свойствами селективного ингибитора циклинзависимой киназы 4 (CDK4) и могут найти применение при лечении, например, воспалительных и клеточных пролиферативных заболеваний. Кристаллические формы соли имеют порошковую рентгенограмму при величинах 2 примерно 8,7, 13,5 и 17,6 (форма А), 5,1, 11,8, 12,1, 12,8, 13,1 и 14,7 (форма В) и 8,4, 8,9 и 21,9 (форма D). Изобретение также относится к способам получения кристаллической изетионатной соли 6-ацетил-8-циклопентил-5-метил-2-(5-пиперазин-1-илпиридин-2-иламино)-8Н-пиридо[2,3-d]пиримидин-7-она, к лекарственному средству и применению для получения лекарственного средства. 6 н. и 11 з.п. ф-лы, 5 табл., 18 ил. примерно 8,7, 13,5 и 17,6 (форма А), 5,1, 11,8, 12,1, 12,8, 13,1 и 14,7 (форма В) и 8,4, 8,9 и 21,9 (форма D). Изобретение также относится к способам получения кристаллической изетионатной соли 6-ацетил-8-циклопентил-5-метил-2-(5-пиперазин-1-илпиридин-2-иламино)-8Н-пиридо[2,3-d]пиримидин-7-она, к лекарственному средству и применению для получения лекарственного средства. 6 н. и 11 з.п. ф-лы, 5 табл., 18 ил.
Изобретение относится к солевым формам 6-ацетил-8-циклопентил-5-метил-2-(5-пиперазин-1-илпиридин-2-иламино)-8Н-пиридо[2,3-d]пиримидин-7-она, который является селективным ингибитором циклинзависимой киназы 4 (CDK4), пригодным для лечения воспалительных и клеточных пролиферативных заболеваний, таких как рак и рестеноз.
Циклинзависимые киназы и родственные серин/треонинпротеин-киназы являются важными клеточными ферментами, которые выполняют основные функции в регуляции клеточного деления и пролиферации. Каталитические единицы циклинзависимой киназы активируются посредством регуляторных субъединиц, известных как циклины. По меньшей мере, идентифицированы шестнадцать циклинов млекопитающих (D.G. Johnson и C.L. Walker, Annu. Rev. Pharmacol. Toxicol. (1999), 39: 295-312). Циклин B/CDK1, циклин А/CDK2, циклин Е/CDK2, циклин D/CDK4, циклин D/CDK6 и, вероятно, другие гетеродимеры, включая CDK3 и CDK7, являются важными регуляторами развития клеточного цикла. Дополнительные функции гетеродимеров циклин/CDK включают регуляцию транскрипции, репарацию ДНК, дифференцировку и апоптоз (D.O. Morgan, Annu. Rev. Cell. Dev. Biol. (1997), 13261-13291).
Ингибиторы циклинзависимой киназы могут оказаться пригодными при лечении рака. Показано, что увеличенная активность или временно аномальная стимуляция циклинзависимых киназ приводит к развитию опухолей у человека (C.J. Sherr, Science (1996), 274: 1672-1677). Действительно, развитие человеческих опухолей обычно ассоциируется с изменениями или в самих CDK-белках или в их регуляторах (C. Cordon-Cardo, Am. J. Pathol. (1995), 147: 545-560; J.E. Karp и S. Broder, Nat. Med. (1995), 1: 309-320; M. Hall et al., Adv. Cancer Res. (1996), 68:67-108). Встречающиеся в природе белковые ингибиторы циклинзависимых киназ, такие как р16 и р27, вызывают in vitro ингибирование роста в линиях раковых клеток при раке легкого (A. Kamb, Curr. Top. Microbiol. Immunol. (1998), 227: 139-148).
Имеющие малую молекулу ингибиторы CDK также могут использоваться при лечении сердечно-сосудистых нарушений, таких как рестеноз и атеросклероз, и других сосудистых нарушений, которые приводят к аберрантной клеточной пролиферации. Сосудистая гладкомышечная пролиферация и интимальная гиперплазия с последующей баллонной ангиопластикой ингибируются путем сверхэкспрессии белкового ингибитора циклинзависимой киназы р21 (M.W. Chang et al., J. Clin. Invest. (1995), 96: 2260; Z-Y. Yang et al., Proc. Natl. Acad. Sci. (США), (1996), 93: 9905). Кроме того, результатом воздействия пурин-CDK2-ингибитора CVT-313 (константа ингибирования (Ки)=95 нМ) является ингибирование образования неоинтимы у крыс более чем на 80% (E.E. Brooks et al., J. Biol. Chem. (1997), 29207-29211).
Ингибиторы CDK можно использовать для лечения заболеваний, вызванных различными инфекционными агентами, включая грибы, простейшие паразиты, такие как Plasmodium falciparum, и ДНК-овые и РНК-овые вирусы. Например, циклинзависимые киназы необходимы для вирусной репликации с последующей инфекцией вирусом простого герпеса (HSV) (L.M. Schang et al., J. Virol. (1998), 72: 5626) и известны гомологи CDK, играющие существенную роль в дрожжах.
Селективные ингибиторы CDK можно использовать для улучшения последствий различных аутоиммунных нарушений. Ревматоидный артрит, или хроническое воспалительное заболевание, характеризуется гиперплазией синовиальной ткани. Ингибирование пролиферации синовиальной ткани будет минимизировать воспаление и предотвращать разрушение суставов. Обнаружено, что экспрессия белкового ингибитора CDK р16 в синовиальных фибробластах ингибирует рост (K. Taniguchi et al., Nat. Med. (1999), 5: 760-767). Подобным образом, при артрите у используемой в качестве модели крысы припухлость сустава, по существу, ингибируют путем лечения экспрессирующим р16 аденовирусом. Ингибиторы CDK могут быть эффективны против других нарушений клеточной пролиферации, включая псориаз (характеризуется кератиноцитной гиперпролиферацией), гломерулонефрит и волчанку.
Определенные ингибиторы CDK могут быть пригодны в качестве химиозащитных агентов вследствие их способности ингибировать прогрессирование клеточного цикла нормальных нетрансформированных клеток (Chen et al., J. Natl. Cancer Institute (2000), 92: 1999-2008). Предварительная обработка ингибитором CDK ракового больного перед использованием цитотоксических агентов может уменьшать побочные эффекты, обычно ассоциируемые с химиотерапией. Нормально пролиферирующие ткани защищают от цитотоксических эффектов путем воздействия селективного ингибитора CDK.
В обзорных статьях в отношении ингибиторов циклинзависимых киназ, имеющих малые молекулы, указывается на трудность идентификации соединений, которые ингибируют специфические белки CDK без ингибирования других ферментов. Таким образом, несмотря на их потенциал для лечения различных заболеваний, ингибиторы CDK в настоящее время не одобрены для коммерческого использования (P.M. Fischer, Curr. Opin. Drug Discovery (2001), 4: 623-634; D.W. Fry and M.D. Garrett, Curr. Opin. Oncologic, Endocrine & Metabolic Invest. (2000), 2: 40-59; K.R. Webster and D. Kimball, Emerging Drugs (2000), 5: 45-59; T.M. Sielecki et al., J. Med. Chem. (2000), 43: 1-18).
Несмотря на эти трудности согласно последним исследованиям идентифицировано некоторое количество селективных ингибиторов CDK4, которые, как рассмотрено выше, могут быть пригодны при лечении рака - или в качестве противораковых агентов или в качестве химиозащитных агентов - и при лечении сердечно-сосудистых нарушений, таких как рестеноз и атеросклероз, заболеваний, вызванных инфекционными агентами, и аутоиммунных нарушений, включая ревматоидный артрит. В отношении раскрытия этих селективных ингибиторов CDK4 см. международную патентную заявку PCT/IB03/00059, зарегистрированную 10 января 2003 г. (заявка '059), которая включена в данный контекст путем ссылки во всей ее полноте.
В заявке '059 раскрывается особенно эффективный и селективный ингибитор CDK4, 6-ацетил-8-циклопентил-5-метил-2-(5-пиперазин-1-илпиридин-2-иламино)-8Н-пиридо[2,3-d]пиримидин-7-он:
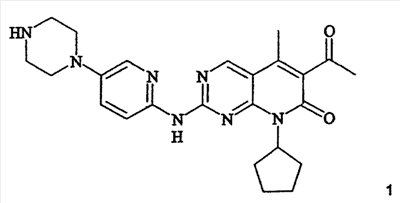
В стандартных ферментных анализах соединения формулы 1 показывают концентрации ингибирования ИК50 (концентрация, приводящая к 50% ингибирования) для CDK4 и CDК2 (при 25оС) 0,011 мкМ и >5 мкМ, соответственно. В отношении обсуждения стандартных анализов определений ИК50 для CDK4 и CDК2 см. D.W. Fry et al., J. Biol. Chem. (2001), 16617-16623.
Несмотря на то, что соединение формулы 1 является эффективным и селективным ингибитором CDK4, его использование в фармацевтических продуктах вызывает проблемы. Например, свободное основание имеет плохую растворимость в воде (9 мкг/мл) и показывает низкую биодоступность в исследованиях на животных. Дигидрохлоридная соль соединения формулы 1 проявляет адекватную растворимость в воде. Однако исследования в отношении влажности показывают, что даже при низкой относительной влажности (10% относительной влажности (RH)), дигидрохлоридная соль абсорбирует воду в количествах более чем примерно 2% от ее массы, делая ее неподходящей для использования в твердом лекарственном продукте. Моногидрохлоридная соль соединения формулы 1 является незначительно гигроскопичной, абсорбируя более чем 2% от ее массы, при относительной влажности более чем 80%. Однако способ получения моногидрохлоридной соли приводит к частично кристаллическому лекарственному веществу, что означает возможные проблемы при использовании способа в крупных масштабах. Таким образом, необходимы другие солевые формы соединения формулы 1.
Краткое изложение сущности изобретения
Настоящее изобретение относится к моноизетионатной соли 6-ацетил-8-циклопентил-5-метил-2-(5-пиперазин-1-илпиридин-2-иламино)-8Н-пиридо[2,3-d]пиримидин-7-она, которая представлена формулой 2:
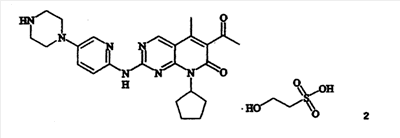
Изетионатная соль может существовать в виде одного или более полиморфов, включая форму А, форму В и форму D. Каждый из полиморфов можно различать с помощью порошковой рентгенограммы (PXRD) (дифрактограмма), или с помощью рамановского спектра, или термограммы дифференциальной сканирующей калориметрии (DSC), или любой комбинации PXRD, рамановского спектра и термограммы DSC. Изетионатная соль может быть безводной или может содержать различные количества воды или одного, или более растворителей.
Таким образом, один аспект согласно настоящему изобретению относится к моноизетионатной соли 6-ацетил-8-циклопентил-5-метил-2-(5-пиперазин-1-илпиридин-2-иламино)-8Н-пиридо[2,3-d]пиримидин-7-она, которую обозначают как форма А и которая характеризуется одним или более из следующего: порошковая рентгенограмма имеет пики при величинах 2 от примерно 8,7, 13,5 и 17,6, или рамановский спектр имеет пики с величинами сдвига частот комбинационного рассеяния от примерно 1600 см-1, 1290 см-1, 675 см-1, 470 см-1, 450 см-1 и 425 см-1, или термограмма DSC имеет отчетливый эндотермический пик при 273оС. от примерно 8,7, 13,5 и 17,6, или рамановский спектр имеет пики с величинами сдвига частот комбинационного рассеяния от примерно 1600 см-1, 1290 см-1, 675 см-1, 470 см-1, 450 см-1 и 425 см-1, или термограмма DSC имеет отчетливый эндотермический пик при 273оС.
Другой аспект согласно настоящему изобретению относится к моноизетионатной соли 6-ацетил-8-циклопентил-5-метил-2-(5-пиперазин-1-илпиридин-2-иламино)-8Н-пиридо[2,3-d]пиримидин-7-она, которую обозначают как форма В и которая характеризуется одним или более из следующего: порошковая рентгенограмма имеет пики при величинах 2 примерно 5,1, 11,8, 12,1, 12,8, 13,1 и 14,7, рамановский спектр имеет пики с величинами сдвига частот комбинационного рассеяния примерно 1600 см-1, 1290 см-1, 470 см-1, 450 см-1 и 425 см-1, но без основного пика при 675 см-1, или термограмма DSC имеет отчетливый эндотермический пик при 271оС. примерно 5,1, 11,8, 12,1, 12,8, 13,1 и 14,7, рамановский спектр имеет пики с величинами сдвига частот комбинационного рассеяния примерно 1600 см-1, 1290 см-1, 470 см-1, 450 см-1 и 425 см-1, но без основного пика при 675 см-1, или термограмма DSC имеет отчетливый эндотермический пик при 271оС.
Дальнейший аспект согласно настоящему изобретению относится к моноизетионатной соли 6-ацетил-8-циклопентил-5-метил-2-(5-пиперазин-1-илпиридин-2-иламино)-8Н-пиридо[2,3-d]пиримидин-7-она, которую обозначают как форма D и которая характеризуется одним или более из следующего: порошковая рентгенограмма имеет пики при величинах 2 примерно 8,4, 8,9 и 21,9, рамановский спектр имеет пик с величиной сдвига частот комбинационного рассеяния примерно 463 см-1, или термограмма DSC имеет отчетливый эндотермический пик при 277оС. Для каждой солевой формы порошковую рентгенограмму получают, используя CuK примерно 8,4, 8,9 и 21,9, рамановский спектр имеет пик с величиной сдвига частот комбинационного рассеяния примерно 463 см-1, или термограмма DSC имеет отчетливый эндотермический пик при 277оС. Для каждой солевой формы порошковую рентгенограмму получают, используя CuK -излучение, а термограмму DSC получают, используя скорость нагрева 5оС/мин. -излучение, а термограмму DSC получают, используя скорость нагрева 5оС/мин.
Настоящее изобретение также относится к фармацевтическим дозированным формам, которые включают изетионатную соль 6-ацетил-8-циклопентил-5-метил-2-(5-пиперазин-1-илпиридин-2-иламино)-8Н-пиридо[2,3-d]пиримидин-7-она и один или более фармацевтически приемлемых эксципиентов. Пригодные эксципиенты включают дезинтеграторы, связующие вещества, растворители, поверхностно-активные вещества, смазывающие вещества, консерванты, антиоксиданты, ароматизаторы, красители и тому подобное.
Настоящее изобретение также относится к способам получения изетионатной соли 6-ацетил-8-циклопентил-5-метил-2-(5-пиперазин-1-илпиридин-2-иламино)-8Н-пиридо[2,3-d]пиримидин-7-она. Один из способов включает добавление раствора изетионовой кислоты и первого растворителя к водной суспензии 6-ацетил-8-циклопентил-5-метил-2-(5-пиперазин-1-илпиридин-2-иламино)-8Н-пиридо[2,3-d]пиримидин-7-она, с получением первой смеси. Способ также включает сушку вымораживанием смеси для получения аморфной соли, которая далее объединяется со вторым растворителем с получением второй смеси, включающей изетионатную соль 6-ацетил-8-циклопентил-5-метил-2-(5-пиперазин-1-илпиридин-2-иламино)-8Н-пиридо[2,3-d]пиримидин-7-она.
Другой способ включает получение затравочного кристалла изетионатной солевой формы 6-ацетил-8-циклопентил-5-метил-2-(5-пиперазин-1-илпиридин-2-иламино)-8Н-пиридо[2,3-d]пиримидин-7-она и добавление затравочного кристалла к дисперсии 6-ацетил-8-циклопентил-5-метил-2-(5-пиперазин-1-илпиридин-2-иламино)-8Н-пиридо[2,3-d]пиримидин-7-она и первого растворителя с получением первой смеси. Способ также включает объединение первой смеси с раствором изетионовой кислоты и вторым растворителем с получением второй смеси, включающей изетионатную соль 6-ацетил-8-циклопентил-5-метил-2-(5-пиперазин-1-илпиридин-2-иламино)-8Н-пиридо[2,3-d]пиримидин-7-она.
В обоих вышеуказанных способах первый и второй растворители могут быть одинаковыми или различными и являться смешиваемыми с водой растворителями, включая метанол, этанол и другие спирты. Для улучшения выходов способы могут включать нагрев, охлаждение или нагрев и охлаждение второй смеси до температур выше или ниже комнатной температуры. Например, вторую смесь можно нагревать до температуры в диапазоне от примерно 30оС до примерно 60оС и потом дать ей возможность охладиться до комнатной температуры. Альтернативно, вторую смесь можно выдерживать при комнатной температуре, а потом охлаждать до температуры примерно 0оС или ниже. Подобным образом вторую смесь можно нагревать до температуры в диапазоне от примерно 30оС до примерно 60оС и потом охлаждать до температуры примерно 0оС или ниже.
Другой способ включает взаимодействие трет-бутилового эфира 4-{6-[6-(1-бутоксивинил)-8-циклопентил-5-метил-7-оксо-7,8-дигидропиридо[2,3-d]пиримидин-2-иламино]пиридин-3-ил}пиперазин-1-карбоновой кислоты с изетионовой кислотой в растворителе и воде с получением смеси, которая включает диизетионатную соль 6-ацетил-8-циклопентил-5-метил-2-(5-пиперазин-1-илпиридин-2-иламино)-8Н-пиридо[2,3-d]пиримидин-7-она. Способ необязательно включает добавление блокирующего основания к реакционной смеси для получения моноизетионатной соли 6-ацетил-8-циклопентил-5-метил-2-(5-пиперазин-1-илпиридин-2-иламино)-8Н-пиридо[2,3-d]пиримидин-7-она.
Настоящее изобретение, далее, относится к способу лечения нарушения или состояния млекопитающего, включая человека, вызванного аномальной клеточной пролиферацией, или вирусными или грибковыми инфекциями, или аутоиммунным заболеванием. Способ включает введение млекопитающему такого количества изетионатной соли 6-ацетил-8-циклопентил-5-метил-2-(5-пиперазин-1-илпиридин-2-иламино)-8Н-пиридо[2,3-d]пиримидин-7-она, которое эффективно для лечения нарушения или состояния. Нарушения или состояния, вызванные аномальной клеточной пролиферацией, включают рак и сосудистую гладкомышечную пролиферацию, связанную с атеросклерозом, послеоперационным сосудистым стенозом и рестенозом, и эндометриоз. Аутоиммунные заболевания включают псориаз, подобный воспалению ревматоидный артрит, волчанку, диабет типа 1, диабетическую нефропатию, рассеянный склероз, гломерулонефрит и отторжение трансплантированного органа, включая реакцию "трансплантат против хозяина".
Изетионатная соль обладает значительными преимуществами по отношению к свободному основанию (формула 1) и другим солевым формам, включая аддитивные гидрохлоридные и дигидрохлоридные соли. По сравнению со свободным основанием, изетионатная соль показывает более чем 20000-кратное улучшение растворимости в воде. В случае дигидрохлоридной соли, однако, улучшение растворимости не сопровождается существенным увеличением гигроскопичности. Кроме того, изетионатная соль является, в основном, кристаллической, и, следовательно, не возникает дополнительных проблем, связанных с моногидрохлоридной солью. Эти и другие преимущества должны помогать облегчать решение множества проблем, встречающихся при получении фармацевтических продуктов, содержащих селективный ингибитор CDK4 формулы 1.
Краткое описание чертежей
Разнообразные особенности, преимущества и другие использования согласно настоящему изобретению станут более очевидны при рассмотрении следующего описания и чертежей, на которых:
Фиг.1 показывает PXRD моноизетионатной соли (форма А) 6-ацетил-8-циклопентил-5-метил-2-(5-пиперазин-1-илпиридин-2-иламино)-8Н-пиридо[2,3-d]пиримидин-7-она;
Фиг.2 показывает PXRD моноизетионатной соли (форма В и форма D) 6-ацетил-8-циклопентил-5-метил-2-(5-пиперазин-1-илпиридин-2-иламино)-8Н-пиридо[2,3-d]пиримидин-7-она;
Фиг.3 показывает PXRD мономезилатной соли (форма А, форма В, форма С и форма D) 6-ацетил-8-циклопентил-5-метил-2-(5-пиперазин-1-илпиридин-2-иламино)-8Н-пиридо[2,3-d]пиримидин-7-она;
Фиг.4 показывает PXRD димезилатной соли 6-ацетил-8-циклопентил-5-метил-2-(5-пиперазин-1-илпиридин-2-иламино)-8Н-пиридо[2,3-d]пиримидин-7-она;
Фиг.5 показывает PXRD моногидрохлорида 6-ацетил-8-циклопентил-5-метил-2-(5-пиперазин-1-илпиридин-2-иламино)-8Н-пиридо[2,3-d]пиримидин-7-она;
Фиг.6 показывает PXRD дигидрохлорида 6-ацетил-8-циклопентил-5-метил-2-(5-пиперазин-1-илпиридин-2-иламино)-8Н-пиридо[2,3-d]пиримидин-7-она;
Фиг.7 показывает рамановский спектр моноизетионатной соли (форма А, форма В и форма D) 6-ацетил-8-циклопентил-5-метил-2-(5-пиперазин-1-илпиридин-2-иламино)-8Н-пиридо[2,3-d]пиримидин-7-она, имеющий сдвиги частот комбинационного рассеяния в пределах от 0 до 1850 см-1;
Фиг.8 показывает рамановский спектр моноизетионатной соли (форма А, форма В и форма D) 6-ацетил-8-циклопентил-5-метил-2-(5-пиперазин-1-илпиридин-2-иламино)-8Н-пиридо[2,3-d]пиримидин-7-она, имеющий сдвиги частот комбинационного рассеяния в пределах от 1350 до 1800 см-1;
Фиг.9 показывает рамановский спектр моноизетионатной соли (форма А, форма В и форма D) 6-ацетил-8-циклопентил-5-метил-2-(5-пиперазин-1-илпиридин-2-иламино)-8Н-пиридо[2,3-d]пиримидин-7-она, имеющий сдвиги частот комбинационного рассеяния в пределах от 1100 до 1350 см-1;
Фиг.10 показывает рамановский спектр моноизетионатной соли (форма А, форма В и форма D) 6-ацетил-8-циклопентил-5-метил-2-(5-пиперазин-1-илпиридин-2-иламино)-8Н-пиридо[2,3-d]пиримидин-7-она, имеющий сдвиги частот комбинационного рассеяния в пределах от 500 до 850 см-1;
Фиг.11 показывает рамановский спектр моноизетионатной соли (форма А, форма В и форма D) 6-ацетил-8-циклопентил-5-метил-2-(5-пиперазин-1-илпиридин-2-иламино)-8Н-пиридо[2,3-d]пиримидин-7-она, имеющий сдвиги частот комбинационного рассеяния в пределах от 340 до 550 см-1;
Фиг.12 показывает термограмму DSC моноизетионатной соли (форма А) 6-ацетил-8-циклопентил-5-метил-2-(5-пиперазин-1-илпиридин-2-иламино)-8Н-пиридо[2,3-d]пиримидин-7-она;
Фиг.13 показывает термограммы DSC моноизетионатной соли (форма В и форма D) 6-ацетил-8-циклопентил-5-метил-2-(5-пиперазин-1-илпиридин-2-иламино)-8Н-пиридо[2,3-d]пиримидин-7-она;
Фиг.14 показывает термограммы DSC мономезилатной соли (форма А, форма В, форма С и форма D) 6-ацетил-8-циклопентил-5-метил-2-(5-пиперазин-1-илпиридин-2-иламино)-8Н-пиридо[2,3-d]пиримидин-7-она;
Фиг.15 показывает термограмму DSC димезилатной соли 6-ацетил-8-циклопентил-5-метил-2-(5-пиперазин-1-илпиридин-2-иламино)-8Н-пиридо[2,3-d]пиримидин-7-она;
Фиг.16 показывает термограмму DSC дигидрохлорида 6-ацетил-8-циклопентил-5-метил-2-(5-пиперазин-1-илпиридин-2-иламино)-8Н-пиридо[2,3-d]пиримидин-7-она;
Фиг.17 показывает изотермы адсорбции/десорбции воды для свободного основания 6-ацетил-8-циклопентил-5-метил-2-(5-пиперазин-1-илпиридин-2-иламино)-8Н-пиридо[2,3-d]пиримидин-7-она; и
Фиг.18 показывает изотермы адсорбции/десорбции воды для различных солей 6-ацетил-8-циклопентил-5-метил-2-(5-пиперазин-1-илпиридин-2-иламино)-8Н-пиридо[2,3-d]пиримидин-7-она, включая моноизетионат (форма В и форма D), гидрохлорид и дигидрохлорид, мономезилат (форма А и форма С), димезилат и монотозилат.
Подробное описание определений и сокращений
Если не указано иначе, в данном описании используются определения, рассмотренные ниже.
Термин "рак" включает, но не ограничиваясь этим, следующие формы рака: рак молочной железы, рак яичника, рак шейки матки, рак предстательной железы, рак яичка, рак пищевода, рак желудка, рак кожи, рак легкого, рак костей, рак толстой кишки, рак поджелудочной железы, рак щитовидной железы, рак желчных протоков, рак полости рта и глотки (оральный), рак губы, рак языка, рак рта, рак глотки, рак тонкой кишки, рак ободочной кишки, рак прямой кишки, рак головного мозга и рак центральной нервной системы, глиобластома, нейробластома, кератоакантома, эпидермоидная карцинома, крупноклеточный рак, аденокарцинома, аденома, фолликулярная карцинома, недифференцированный рак, сосковидная карцинома, семинома, меланома, саркома, рак мочевого пузыря, рак печени, рак почки, миелоидные нарушения, лимфоидные нарушения, болезнь Ходжкина, рак волосковых клеток и лейкоз.
Фраза "фармацевтически приемлемый" относится к веществам, которые, в рамках действительного медицинского заключения, пригодны для применения при контактировании с тканями пациентов без чрезмерной токсичности, раздражения, аллергической реакции и тому подобного, в соответствии с приемлемым соотношением пользы и риска и эффективным для их применения по назначению.
Термин "лечить" относится к реверсированию, облегчению, ингибированию прогрессирования болезни или предупреждения нарушения или состояния, для которого применим такой термин, или предупреждения одного или более симптомов такого нарушения или состояния.
Термин "лечение" относится к действию "лечить", как непосредственно определено выше.
В таблице 1 перечислены сокращения, используемые в описании.
| Таблица 1 |
| Сокращения |
| Сокращение |
Описание |
| aq |
водный |
| ACN |
ацетонитрил |
| BOC |
трет-бутоксикарбонил |
| DCM |
дихлорметан |
| DSC |
дифференциальная сканирующая калориметрия |
| Et3N |
триэтиламин |
| EtOH |
этиловый спирт |
| h, min, s |
час, минута, секунда |
| IPA |
изопропиловый спирт |
| МеОН |
метанол |
| PXRD |
порошковая рентгенограмма |
| RH |
относительная влажность |
| RT |
комнатная температура, то есть 20-25оС |
| THF |
тетрагидрофуран |
| mgA/mL |
миллиграммы активного вещества на миллилитр раствора |
Моноизетионатная соль (формула 2) может существовать в виде одного или более полиморфов, включая форму А, форму В и форму D. Как указано выше, каждый из полиморфов можно различать с помощью порошковой рентгенограммы (PXRD), или с помощью рамановской спектроскопии, или дифференциальной сканирующей калориметрии (DSC), или любой комбинации этих характеристических способов. Моноизетионатная соль (формула 2) может быть безводной или может содержать различные количества воды или один или более растворителей. Кроме того, моноизетионатная соль (формула 2) может быть, в основном, чистой, то есть содержать, по меньшей мере, примерно 99% масс. индивидуального полиморфа, или может быть смесью двух или более полиморфов (например, формы В и формы D, и т.д.).
Свободное основание (формула 1) является двухосновным соединением, которое может образовывать аддитивные соли как моно-, так и дикислот. Соединяющаяся с ними кислота имеет pKas от 7,3 до 4,1, таким образом, для получения дисоли необходимы сравнительно сильные кислоты. Хотя возможно получение диизетионатной соли соединения формулы 1, показано, что моноизетионатная соль более пригодна, так как для нее необходимо меньшее количество противоиона.
Фиг.1 и 2 представляют дифрактограммы PXRD для моноизетионатных солевых форм 6-ацетил-8-циклопентил-5-метил-2-(5-пиперазин-1-илпиридин-2-иламино)-8Н-пиридо[2,3-d]пиримидин-7-она (формула 2). Эти формы обозначены как форма А на Фиг.1 и форма В и форма D на Фиг.2. Для улучшения читаемости дифрактограмма формы D на Фиг.2 смещена вверх примерно на 700 единиц. В таблице 2, ниже, перечислены основные PXRD-пики (то есть показана высота пика по отношению к уровню шума более чем 3,5) для моноизетионатных полиморфов А, В и D и представлена в подчеркнутом виде подгруппа характерных пиков, которые могут быть использованы для отличия одного полиморфа от другого. Перечень характерных пиков, представленный в таблице 2, не является единственно возможным перечнем характерных пиков. Специалисты в области идентификации полиморфов могут выбирать другие группы характерных пиков, чтобы также отличить один полиморф от другого.
Для сравнения результатов Фиг.3-6 показывают дифрактограммы PXRD для мономезилата, димезилата, гидрохлорида и дигидрохлорида 6-ацетил-8-циклопентил-5-метил-2-(5-пиперазин-1-илпиридин-2-иламино)-8Н-пиридо[2,3-d]пиримидин-7-она, соответственно. Несмотря на то, что эти соли могут существовать более чем в одной форме, отдельные полиморфы имеют только идентифицированную мономезилатную соль, которая на Фиг.3 представлена как форма А, форма В, форма С и форма D. Для выделения различий между формами мономезилатной соли дифрактограммы формы В, формы С и формы D на Фиг.3 смещены вверх на различные величины.
Каждая из дифрактограмм PXRD, представленных на Фиг.1-6, получена на рентгеновском дифрактометре для порошкообразных образцов RIGAKU D/Max 2200 с использованием CuK -излучения. Дифрактометр оборудован тонкосфокусированной рентгеновской трубкой. Во время каждого эксперимента напряжение и ток трубки устанавливают при 40 кВ и 40 мА, соответственно, щели отклонения и рассеивания устанавливают при 0,5о, а щель приемного устройства устанавливают при 0,3 мм. Дифрагированное излучение определяют с использованием сцинтилляционного детектора NaI. Для каждого эксперимента используют -излучения. Дифрактометр оборудован тонкосфокусированной рентгеновской трубкой. Во время каждого эксперимента напряжение и ток трубки устанавливают при 40 кВ и 40 мА, соответственно, щели отклонения и рассеивания устанавливают при 0,5о, а щель приемного устройства устанавливают при 0,3 мм. Дифрагированное излучение определяют с использованием сцинтилляционного детектора NaI. Для каждого эксперимента используют  -2 -2 непрерывное сканирование со скоростью приблизительно 1о/мин (3 с/0,040о за один шаг) от 3,0 до 40,0о 2 непрерывное сканирование со скоростью приблизительно 1о/мин (3 с/0,040о за один шаг) от 3,0 до 40,0о 2 . Образцы для анализа подготавливают путем помещения их на кремниевую пластину-держатель. Данные получают, используя программное обеспечение RIGAKU's RIGMEAS, и анализируют, используя пакет собственного программного обеспечения, разработанный с использованием базовых программных средств JADE. . Образцы для анализа подготавливают путем помещения их на кремниевую пластину-держатель. Данные получают, используя программное обеспечение RIGAKU's RIGMEAS, и анализируют, используя пакет собственного программного обеспечения, разработанный с использованием базовых программных средств JADE.
Для каждого измерения дифракции рентгеновских лучей порошкообразного образца образец солевой формы помещают в полость, расположенную на плоской поверхности держателя, и используют предметное стекло для выравнивания поверхности образца. Держатель, который удерживает образец, помещают в дифрактометр и пучком рентгеновских лучей облучают образец, сначала при малом угле относительно плоской поверхности держателя. Потом пучок рентгеновских лучей шагообразно перемещают по дуге, последовательно увеличивая угол между падающим пучком (лучом) и плоской поверхностью держателя. При каждом шаге сканирования сцинтилляционный счетчик определяет количество дифрагированного излучения, которое регистрирует в виде функции от 2. Прибор с программным обеспечением показывает результаты сканирования дифрагированного излучения в виде интенсивности по сравнению с 2 (Фиг.1-6).
Дифрактограммы PXRD между отдельными измерениями одного и того же полиморфа могут различаться по многим причинам. Источники ошибки включают вариации подготовки образца (например, высота образца), ошибки прибора, ошибки калибровки и ошибки оператора (включая ошибки в определении местоположения пиков). Предпочтительная ориентация, то есть отсутствие беспорядочной ориентации кристаллов в образце PXRD, может происходить в результате значительных различий в относительной высоте пиков. Ошибки калибровки и ошибки в высоте образца часто являются результатом смещения всех пиков дифрактограммы в одинаковом направлении и на одну и ту же величину. Небольшие различия в высоте образцов на плоском держателе могут приводить к большим сдвигам в положениях пиков PXRD. Вследствие систематических исследований показано, что различия в высоте образца в 1 мм могут приводить к смещениям пика так же сильно, как 1о 2, см. Chen et al., J. Pharmaceutical and Biomedical Analysis (2001), 26: 63.
Во многих случаях смещения пиков в дифракционных картинах, получаемые в результате систематической ошибки, могут быть устранены путем компенсации смещения (например, использование поправочного коэффициента для всех значений положения пика) или путем перекалибровки дифрактометра. Обычно одинаковые методики могут быть использованы для компенсации различий дифрактометров так, что местоположение пика PXRD, полученного на двух различных приборах, можно привести в согласование. Кроме того, когда эти методики применяют к измерениям PXRD для одинаковых или различных дифрактометров, местоположения пика для отдельного полиморфа обычно находятся в пределах примерно ±0,2о 2.

Фиг.7-11 показывают рамановские спектры моноизетионатных солевых форм 6-ацетил-8-циклопентил-5-метил-2-(5-пиперазин-1-илпиридин-2-иламино)-8Н-пиридо[2,3-d]пиримидин-7-она (формула 2). Фиг.7 показывает рамановские спектры моноизетионатной соли формы А, В и D со сдвигом частот комбинационного рассеяния в диапазоне от 0 до 1850 см-1, в то время как Фиг.8-11 представляют рамановские спектры моноизетионатной соли формы А, В и D со сдвигом частот комбинационного рассеяния в диапазоне от 1350 до 1800 см-1, 1100 до 1350 см-1, от 500 до 850 см-1 и от 340 до 550 см-1, соответственно. На некоторых из фигур для одного или более рамановских спектров можно применять другое масштабирование ординаты (например, форма А на Фиг.7, 8, 10 и 11) или другие базисные линии (например, форма А и форма В на Фиг.9) или другое масштабирование ординаты и другие базисные линии (Фиг.10) для подчеркивания отличий моноизетионатных солевых форм.
В таблице 3, ниже, перечислены характерные пики рамановских спектров, которые могут быть использованы для отличия одной моноизетионатной солевой формы от другой. В качестве данных PXRD перечень характерных пиков, представленных в таблице 3, не является единственно возможным перечнем характерных пиков, и специалисты в области идентификации полиморфов могут выбирать другие группы характерных пиков, с помощью которых также можно отличать один полиморф от другого.
Рамановские спектры, показанные на Фиг.7-11, получены с использованием рамановского микроскопа и спектрографа KAISER OPTICAL SYSTEMS HOLOLAB. В рамановском спектрографе применяется твердотельный диодный лазер, работающий при длине волны 785 нм, с выходной мощностью приблизительно 90 мВт. Мощность, передаваемая образцу через объектив микроскопа, составляет приблизительно 27 мВт. Термоэлектрически охлажденный детектор CCD используют для обнаружения рамановского сигнала. Волоконно-оптические кабели, соединяющие рамановский микроскоп и спектрограф, используют для направления возбуждаемого лазером видимого излучения и рамановского рассеянного света на образец и от образца, соответственно.
Для получения характерных рамановских спектров образцы каждой из полиморфных форм исследуют в отношении многочисленных местоположений или мест. Для каждого образца рамановские спектры получают в четырех или пяти местах, с четырьмя воспроизведениями спектров для каждого места. Обычно, в случае с твердыми образцами, данные для исследованных полиморфных форм показывают наибольшую вариацию интенсивности пика и показывают сравнительно небольшую вариацию местоположения пика. Для каждой из форм величины сдвига частот комбинационного рассеяния (местоположения пика в виде функции волнового числа) различаются меньше, чем на 1 см-1, тем не менее, как можно ожидать, местоположения пиков у различных форм могут отличаться больше, чем на 1 см-1. Полагают, что, по меньшей мере, некоторая вариация интенсивности пика или местоположения пика возникает вследствие отличий в направлении лазерного излучения, проходящего разные кристаллы в образце.
| Таблица 3 |
| Характерные пики рамановского спектра моноизетионатной соли форм А, В и D |
| Пик (см-1) |
Пик, являющийся характерным для данного полиморфа |
| 1600 |
А и В |
| 1290 |
А и В |
| 675 |
А |
| 470 |
А и В |
| 463 |
D |
| 450 |
А и В |
| 425 |
А и В |
Изменения от эксперимента к эксперименту, описанные выше, рамановские спектры отдельного полиморфа, полученные при использовании различных приборов, показывают небольшие различия (то есть, 1 см-1 или менее) в положении пика и сравнительно гораздо большие различия в интенсивности пика. Показано, что комбинационное рассеяние света не зависит от используемой длины волны возбуждения, положение пика должно быть одним и тем же между приборами, в которых используют различные источники возбуждения. Интенсивности пиков могут изменяться в зависимости от, среди других обстоятельств, типа детектора или оптики, мощности возбуждающего лазера и положения образца.
Фиг.12 и 13 показывают термограммы DSC моноизетионатных солевых форм 6-ацетил-8-циклопентил-5-метил-2-(5-пиперазин-1-илпиридин-2-иламино)-8Н-пиридо[2,3-d]пиримидин-7-она (формула 2), определяемых как форма А (Фиг.12) и формы В и D (Фиг.13). Кроме того, Фиг.14-16 показывают термограммы DSC мономезилатной соли (формы А, В, С и D), димезилатной соли и дигидрохлорида, соответственно. Данные DSC получают, используя прибор TA INSTRUMENTS 2920, модулированный DSC V2.6. Отдельные полиморфные образцы анализируют в герметичных алюминиевых чашках с отверстием, используя скорость нагрева 5оС/мин до 350оС, и продувают азотом со скоростью 50 мл/мин.
Как показано на Фиг.12-15, моноизетионатная соль (формы А, В и D), мономезилатная соль (формы А, В, С и D) и димезилатная соль имеют определенные температуры плавления, показывая отчетливые эндотермические пики при примерно 273, 271, 277, 309, 307, 302, 304 и 289оС, соответственно. В отличие от этого дигидрохлорид (Фиг.16) обладает относительно сложной термограммой DSC, которая включает широкие эндотермические пики от примерно 40 до 110оС и от примерно 160 до 200оС, которые, вероятно, показывают потерю увлажняющей и кристаллизационной воды, соответственно. На следовое количество дигидрохлорида согласно DSC также указывает относительно отчетливый экзотермический пик, начинающийся при примерно 207оС, и широкий эндотермический пик, начинающийся при примерно 275оС, который, вероятно, показывает, соответственно, трансформацию формы и плавление или деструкцию или и плавление, и деструкцию.
Фиг.17 и 18 показывают изотермические пики адсорбции и десорбции воды (при 25оС) для свободного основания (формула 1) и различных солей 6-ацетил-8-циклопентил-5-метил-2-(5-пиперазин-1-илпиридин-2-иламино)-8Н-пиридо[2,3-d]пиримидин-7-она, включая моноизетионат (формы В и D), гидрохлорид и дигидрохлорид, мономезилат (формы А и С), димезилат и монотозилат. Данные по адсорбции и десорбции воды получают, используя симметричный гравиметрический анализатор фирмы VTI CORPORATION, модель SGA-100. Чтобы получить изотерму водяного пара, образец полиморфа помещают на микровесы в герметичной экологически чистой камере и затем нагревают со скоростью 5оС/мин до тех пор, пока температура в камере не достигнет 40оС. Чтобы получить массу сухого образца, полиморфу дают возможность уравновеситься при 40оС до тех пор, пока опытный образец не будет изменять массу менее чем на 0,0270% масс. в течение 2 мин. После сушки образец охлаждают до 25оС и затем подвергают воздействию различных уровней влажности в диапазоне от 5% или 10% относительной влажности (RH) до 90% RH и от 90% RH до 10 или 5% RH, в 10%-ном возрастании RH. При каждом уровне влажности полиморфу дают возможность уравновеситься до тех пор, пока опытный образец не будет изменять массу менее чем на 0,0270% масс. в течение 2 мин. Уравновешенную массу при каждом уровне влажности регистрируют и вместе с массой сухого образца используют для построения графика зависимости изменения массы от относительной влажности.
Из соединений, показанных на Фиг.17 и 18, только свободное основание, моноизетионатная соль (формы В и D), и монотозилатная соль показывают менее чем на 2% изменение массы, когда их подвергают воздействию уровней влажности в диапазоне от 10% RH до 90% RH при 25оС.
В таблице 4 перечислена растворимость в воде свободного основания (его наиболее стабильной кристаллической фазы в соответствии с экспериментами с суспензией) и изетионатной соли (форма В, ее наиболее стабильная форма в соответствии с экспериментами с суспензией). Так как оказывается, что форма В является наиболее стабильной изетионатной солевой формой, она должна показывать наименьшую растворимость в воде среди исследуемых изетионатных солевых форм. Другие изетионатные солевые формы не оценивали на метастабильную растворимость. Растворимости в воде изетионатной соли достигают путем растворения соли в воде вплоть до приблизительно 300 мг/мл, причем уравновешивают в течение времени примерно 48 часов, спустя которое замечают присутствие некоторого количества твердого вещества и измеряют концентрацию соли в водной фазе, используя высокоэффективную жидкостную хроматографию (ВЭЖХ). См. таблицу 5 с перечисленными условиями ВЭЖХ. Растворимости в воде свободного основания достигают уравновешиванием твердого вещества в воде в течение 14 часов и измерением концентрации свободного основания в водной фазе, используя полуавтоматический UV-vis метод, при котором используют спектрофотометр для прочтения планшетов SPECTRMAX PLUS.
Данные в таблице 4 показывают, что растворимость в воде моноизетионатной соли (при рН 5,4) в 20000 раз больше, чем свободного основания (при рН 7,9). Это большое несоответствие в растворимости в воде не может быть объяснено с помощью сравнительно умеренного различия в рН насыщенных растворов свободного основания и моноизетионатной соли. Действительно, теоретическая растворимость в воде свободного основания составляет только 0,62 мгА/мл при рН 5,4 путем расчета Henderson-Hasselbalch (используя растворимость свободного основания 0,0092 мг/мл при рН 7,9 и pKаs=7,3 и 4,1). Затравка водного раствора моноизетионатной соли, полученного с 117 мгА/мл, рН 5,4 (перенасыщенный, в том, что касается свободного основания) кристаллами свободного основания, не вызывает осаждения. Взамен, растворенные затравки указывают на некоторую способность изетионатного иона повышать растворимость свободного основания в воде.
| Таблица 4 |
| Растворимость в воде свободного основания и изетионатной соли (форма В) |
| Образец |
Растворимость
мгА/мл |
Конечное рН |
Время уравновешивания, ч |
| Свободное основание |
0,009 |
7,9 |
14 |
| Изетионат |
213 |
5,4 |
48 |
| Таблица 5 |
| Общие условия ВЭЖХ для измерений растворимости в воде |
| Контролируемый параметр |
Значение |
| Объемная скорость потока через колонку |
1 мл/мин |
| Время остановки |
45 мин |
| Растворитель А |
10 мМ ацетат, рН 5,7 |
| Растворитель В |
ACN |
| Растворитель А/растворитель В (объем/объем) |
|
| 0 мин |
80/20 |
| 30 мин |
25/75 |
| 35 мин |
25/75 |
| 36 мин |
80/20 |
| 45 мин |
80/20 |
| Детектированная длина волны |
260 нм |
| Объем введенной в колонку пробы |
10 мкл |
| Температура колонки |
25оС |
| Тип колонки (YMC PAC PRO) |
С18, 150×4,6 мм, размер частиц 3 микрона |
Растворимость изетионатной соли в нормальном солевом растворе составляет 0,58 мгА/мл, которая является намного меньшей, чем ее растворимость в воде, и очень близка к теоретическому значению 0,43 мгА/мл (расчет по Henderson-Hasselbalch) при конечном рН этого раствора (рН 5,56). В нормальном солевом растворе неожиданная растворяющая способность изетионатного иона, по существу, пропадает и растворимость соединения становится более подобной типичному основному соединению.
Изетионатная соль может быть получена с использованием различных методик. Например, согласно одному из способов раствор изетионовой кислоты и первого растворителя смешивают с водной суспензией 6-ацетил-8-циклопентил-5-метил-2-(5-пиперазин-1-илпиридин-2-иламино)-8Н-пиридо[2,3-d]пиримидин-7-она. Смесь отфильтровывают для удаления любых твердых веществ, и полученный фильтрат подвергают сушке вымораживанием (лиофилизируют) с получением аморфной изетионатной соли. Аморфную соль переводят в кристаллическую форму путем растворения ее во втором растворителе, растворение может сопровождаться нагреванием, что способствует полному растворению. Полученный раствор затем охлаждают до комнатной температуры или ниже для осаждения кристаллической формы соли, которая может быть выделена с помощью фильтрации и затем высушена в вакуумном сушильном шкафу.
В способе, как правило, используют стехиометрические (то есть молярные соотношения 1:1 или 2:1) или более близкие к стехиометрическим количества изетионовой кислоты и 6-ацетил-8-циклопентил-5-метил-2-(5-пиперазин-1-илпиридин-2-иламино)-8Н-пиридо[2,3-d]пиримидин-7-она. Первый и второй растворители могут быть одинаковыми или различными и являются типичными смешиваемыми с водой растворителями, включая спирты, такие как метанол и этанол. Степень нагрева, необходимая для растворения аморфной соли во втором растворителе, зависит от используемого растворителя, но температура смеси обычно находится в диапазоне от примерно 30оС до примерно 60оС и обычно составляет от примерно 30оС до примерно 50оС. В некоторых случаях температура смеси находится в диапазоне от примерно 30оС до примерно 40оС или от примерно 35оС до примерно 40оС.
В другом способе свободное основание (формула 1) диспергируют (суспендируют) в первом растворителе и вводят затравку в виде кристаллической изетионатной солевой формы. Полученную смесь перемешивают с раствором изетионовой кислоты и вторым растворителем. Обычно раствор изетионовой кислоты добавляют многократными порциями в течение определенного периода времени. Полученную суспензию или дисперсию перемешивают при комнатной температуре или выше, как правило, при температуре выше, чем примерно 35 или 40оС. Для повышения выхода полученную смесь можно охлаждать до температуры ниже примерно 0оС, при которой осаждаются дополнительные кристаллы изетионатной соли. Кристаллы изетионатной соли могут быть выделены с помощью фильтрации и затем высушены в вакуумном сушильном шкафу. Подобно вышеописанному способу в этой методике используют стехиометрические или более близкие к стехиометрическим количества изетионовой кислоты и 6-ацетил-8-циклопентил-5-метил-2-(5-пиперазин-1-илпиридин-2-иламино)-8Н-пиридо[2,3-d]пиримидин-7-она. В дополнение, первый и второй растворители могут быть одинаковыми или различными и являются типичными смешиваемыми с водой растворителями, включая спирты, такие как метанол и этанол. В сравнении с ранее описанным процессом, этот способ часто приводит к повышенным выходам и лучшим (например, более крупные, более однородные) кристаллам.
В другом способе не используют свободное основание (формула 1), а изетионатную соль получают прямо из защищенных промежуточных продуктов процесса. Способ включает взаимодействие N-BOC-защищенного соединения формулы 3:
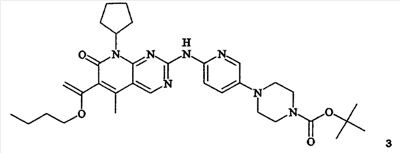
с примерно 3,5 эквивалентами (или более) изетионовой кислоты в первом растворителе и воде, при котором удаляется защитная группа BOC и демаскируется ацетильная группа, с получением диизетионатной соли 6-ацетил-8-циклопентил-5-метил-2-(5-пиперазин-1-илпиридин-2-иламино)-8Н-пиридо[2,3-d]пиримидин-7-она. Реакцию можно осуществлять при комнатной температуре или выше, и часто при температуре в диапазоне от примерно 30оС до примерно 60оС. К этой реакционной смеси добавляют блокирующее основание (например, Et3N) во втором растворителе, образующее соль с изетионовой кислотой, растворимую в реакционной смеси. Добавляемое количество основания является достаточным для поддержания - в присутствии диизетионатной соли - незначительного избытка свободной изетионовой кислоты в реакционной смеси. Например, если 3,5 эквивалентов изетионовой кислоты реагируют с BOC-защищенным соединением формулы 3, то можно использовать примерно 1,45 эквивалентов блокирующего основания, получая в результате примерно избыток 0,05 эквивалентов свободной изетионовой кислоты. Если, желательно, диизетионатную соль можно выделять с помощью фильтрации.
Чтобы получить моноизетионатную соль 6-ацетил-8-циклопентил-5-метил-2-(5-пиперазин-1-илпиридин-2-иламино)-8Н-пиридо[2,3-d]пиримидин-7-она, дополнительное основание добавляют в течение длительного периода времени (например, по каплям), чтобы обеспечить образование необходимой моноизетионатной солевой формы (например, формы В). Очень быстрое добавление блокирующего основания может вызывать образование других метастабильных полиморфов. Для повышения выхода полученную суспензию можно охлаждать до температуры примерно 5оС или ниже и затем отфильтровывать и высушивать. Как в способах, описанных выше, первый и второй растворители могут быть одинаковыми или различными и являются смешиваемыми с водой растворителями, включая спирты, такие как метанол и этанол.
Другие раскрываемые солевые формы, например гидрохлорид или дигидрохлорид, мезилатные или тозилатные соли, можно получать подобным образом по методикам, описанным выше для изетионатной соли (формула 2).
Раскрываемые соединения (формула 1 и соли) охватывают все фармацевтически приемлемые изотопные варианты. Изотопный вариант является соединением, в котором, по меньшей мере, один атом замещен атомом, имеющим одинаковое атомное число, но атомная масса которого отличается от атомной массы, обычно встречающейся в природе. Пригодные изотопы включают изотопы водорода, углерода, азота, кислорода, фосфора, серы, фтора и хлора. Примеры изотопов, таким образом, включают, без ограничения, 2Н, 3Н, 13С, 14С, 15N, 17O, 18O, 32P, 35S, 18F и 36Cl.
Замещение раскрываемых соединений изотопами, такими как дейтерий, то есть 2Н, может давать определенные терапевтические преимущества, вследствие более продолжительной метаболической стабильности, например, в отношении требований увеличенного периода полураспада in vivo или уменьшенной дозировки, и, следовательно, они могут быть более пригодны в некоторых случаях. Кроме того, определенные изотопные варианты, например, те, которые включают радиоактивный изотоп, пригодны для исследований распределения лекарственных средств и/или субстратов в ткани. Радиоактивные изотопы тритий, то есть 3Н, и углерод-14, то есть 14С, особенно пригодны для этой цели с точки зрения легкости их введения и доступности средствам детектирования.
Изотопные варианты раскрываемых соединений, как правило, можно получать с помощью традиционных методик, известных специалисту в данной области, или с помощью способов, аналогичных таковым, раскрываемым в сопроводительных примерах, используя подходящие изотопные варианты пригодных реагентов. Фармацевтически приемлемые сольваты раскрываемых соединений включают такие, в которых растворитель кристаллизации может быть изотопно замещен, например, D2O, d6-ацетон, d6-ДМСО.
Раскрываемые соединения (формула 1 и соли) можно вводить в виде кристаллических или аморфных продуктов. Их можно получать, например, в виде твердых "пробок", порошков или пленок, способами, такими как осаждение, кристаллизация, сушка вымораживанием, распылительная сушка или сушка выпариванием. Микроволновая или радиочастотная сушка также может быть использована для этой цели.
Раскрываемые соединения можно вводить сами по себе или в комбинации с другими лекарственными средствами и, как правило, вводить в виде готовой лекарственной формы в сочетании с одним или более фармацевтически приемлемыми эксципиентами. Термин "эксципиент" описывает любой ингредиент, отличный от соединений, представленных формулой 1, и их солей. Выбор эксципиента в большой степени зависит от индивидуального способа введения.
Раскрываемые соединения можно вводить перорально. Пероральное введение может включать проглатывание, так что соединение проникает в желудочно-кишечный тракт, или может быть использовано буккальное или подъязычное введение, при котором соединение проникает в кровоток прямо через рот.
Готовые лекарственные формы, пригодные для перорального введения, включают твердые готовые лекарственные формы, такие как таблетки, капсулы, содержащие макрочастицы, жидкости или порошки, лепешки (включая заполненные жидкостью), жевательные резинки, мульти- и наночастицы, гели, твердые растворы, липосомы, пленки (включая мукоадгезивные), овули, спреи и жидкие готовые лекарственные формы. Жидкие готовые лекарственные формы включают суспензии, растворы, сиропы и эликсиры. Такие готовые лекарственные формы можно применять в виде наполнителей в мягких или твердых капсулах, и обычно они включают носитель, например воду, этанол, полиэтиленгликоль, пропиленгликоль, метилцеллюлозу или пригодное масло, и один или более эмульгаторов и/или суспендирующих агентов. Жидкие лекарственные формы также можно получать путем восстановления влагосодержания твердого вещества, например, из саше.
Соединения также можно использовать в быстро растворяющихся, быстро дезинтегрирующихся дозированных формах, таких как таковые, описанные Liang and Chen, Expert Opinion in Therapeutic Patents (2001), 11(6): 981-986.
Для таблетированных дозированных форм, в зависимости от дозы, лекарственное средство может составлять от 1 до 80% масс. дозированной формы, более типично, от 5 до 60% масс. дозированной формы. В дополнение к лекарственному средству таблетки обычно содержат дезинтегрирующий агент. Примеры дезинтегрирующих агентов включают натрийкрахмалгликолят, натрийкарбоксиметилцеллюлозу, кальцийкарбоксиметилцеллюлозу, натрийкроскармеллозу, кросповидон, поливинилпирролидон, метилцеллюлозу, микрокристаллическую целлюлозу, замещенную низшим алкилом гидроксипропилцеллюлозу, крахмал, пептизированный крахмал и альгинат натрия. Обычно, дезинтегрирующий агент составляет от 1 до 25% масс., предпочтительно, от 5 до 20% масс. дозированной формы.
Связующие вещества обычно используют для придания когезивных свойств для получения таблетки. Пригодные связующие вещества включают микрокристаллическую целлюлозу, желатин, сахара, полиэтиленгликоль, природные и синтетические камеди, поливинилпирролидон, пептизированный крахмал, гидроксипропилцеллюлозу и гидроксипропилметилцеллюлозу. Таблетки также могут содержать разбавители, такие как лактоза (моногидрат, высушенный распылением моногидрат, безводный моногидрат и тому подобное), маннит, ксилит, декстроза, сахароза, сорбит, микрокристаллическая целлюлоза, крахмал и дикальцийортофосфатдигидрат.
Таблетки также могут необязательно включать поверхностно-активные вещества, такие как лаурилсульфат натрия и полисорбат 80, и придающие скользкость таблеткам агенты, такие как диоксид кремния и тальк. Если присутствуют, поверхностно-активные вещества могут составлять от 0,2 до 5% масс. таблетки, и придающие скользкость таблеткам агенты могут составлять от 0,2 до 1% масс. таблетки.
Таблетки также обычно содержат смазочные вещества, такие как стеарат магния, стеарат кальция, стеарат цинка, стеарилфумарат натрия и смеси стеарата магния с лаурилсульфатом натрия. Смазочные вещества обычно составляют от 0,25 до 10% масс., предпочтительно, от 0,5 до 3% масс. таблетки. Другие ингредиенты могут включать консерванты, антиоксиданты, ароматизаторы и красители.
Смеси для таблеток могут быть прямо подвергнуты прессованию для придания формы таблеток. Смеси для таблеток или части смесей, альтернативно, могут быть гранулированы мокрым путем, сухим путем или из расплава, заморожены в расплавленном состоянии или экструдированы перед таблетированием. Конечная готовая лекарственная форма может содержать один или более слоев и может быть с покрытием или без него. Типичные таблетки содержат до примерно 80% лекарственного средства, от примерно 10% масс. до примерно 90% масс. связующего вещества, от примерно 0% масс. до примерно 85% масс. разбавителя, от примерно 2% масс. до примерно 10% масс. дезинтегрирующего агента и от примерно 0,25% масс. до примерно 10% масс. смазочного вещества. В отношении дополнительных деталей относительно получения таблеток, см. H. Lieberman and L. Lachman, Pharmaceutical Dosage Forms: Tablets, Vol.1 (1980).
Твердые готовые лекарственные формы для перорального введения могут быть получены в виде обладающих немедленным и/или модифицированным высвобождением. Готовые лекарственные формы с модифицированным высвобождением включают замедленное, непрерывное, импульсное, контролируемое, заданное и программируемое высвобождение. В отношении общего описания пригодных готовых лекарственных форм с модифицированным высвобождением см. патент США № 6106864. В отношении деталей других пригодных способов высвобождения, таких как высокоэнергетические дисперсии и осмотические и с нанесенным покрытием частицы, см. Verma et al., Pharmaceutical Technology On-line (2001), 25(2): 1-14. В отношении обсуждения использования жевательной резинки для достижения контролируемого высвобождения, см. WO 00/35298.
Раскрываемые соединения (формула 1 и соли) также можно вводить непосредственно в кровоток, в мышцу или во внутренний орган. Пригодные способы для парентерального введения включают внутривенное, внутриартериальное, внутрибрюшинное, подоболочечное, внутрижелудочковое, внутриуретральное, внутригрудинное, внутричерепное, внутримышечное и подкожное введения. Подходящие устройства для парентерального введения включают игольные (включая микроигольные) шприцы, безыгольные инъекторы и средства для вливания.
Парентеральные готовые лекарственные формы обычно являются водными растворами, которые могут содержать эксципиенты, такие как соли, углеводороды и буферные агенты (предпочтительно, с рН 3-9), но для некоторых применений они могут быть более подходящим образом получены в виде стерильного неводного раствора или в виде сухой формы, используемой в сочетании с приемлемым разбавителем, таким как стерильная апирогенная вода. Приготовление парентеральных готовых лекарственных форм в стерильных условиях, например путем лиофилизации, может быть без труда достигнуто, используя стандартные фармацевтические методики, хорошо известные специалисту в данной области.
Растворимость раскрываемых соединений, используемых для приготовления парентеральных растворов, может быть повышена путем применения соответствующих методик получения, таких как введение увеличивающих растворимость агентов. Готовые лекарственные формы для парентерального введения могут быть получены в виде обладающих немедленным и/или модифицированным высвобождением, как описано выше. Таким образом, раскрываемые соединения можно получать в более твердой форме для введения, в качестве имплантируемого "депо", обеспечивающего длительное высвобождение активного соединения.
Соединения согласно данному изобретению также можно вводить локально через кожу или через слизистую оболочку, или дермально, или трансдермально. Типичные готовые лекарственные формы для этой цели включают гели, гидрогели, лосьоны, растворы, кремы, мази, присыпки, перевязочные материалы, пены, пленки, кожные пластыри, облатки, имплантаты, тампоны, волокна, бинты и микроэмульсии. Можно также использовать липосомы. Типичные носители включают спирт, воду, минеральное масло, вазелиновое масло, белый вазелин, глицерин, полиэтиленгликоль и пропиленгликоль. Местные готовые лекарственные формы также могут включать промоторы всасывания, см., например, Finnin and Morgan, J. Pharm. Sci. (1999), 88(10): 955-958.
Другие средства для местного введения включают доставку лекарственного средства путем ионофореза, электропорации, фонофореза, сонофореза и безыгольной (например, POWDERJECT) или микроигольной инъекции. Готовые лекарственные формы для местного введения могут быть получены в виде обладающих немедленным и/или модифицированным высвобождением, как описано выше.
Раскрываемые соединения также можно вводить интраназально или путем ингаляции, обычно в форме сухого порошка (или одного, в виде микстуры, например, в виде сухой смеси с лактозой, или в виде смешанной составной частицы, например, смешанной с фосфолипидами) из ингалятора для сухого порошка, или в виде аэрозольного спрея из аэрозольной тары, насоса, разбрызгивателя, пульверизатора (предпочтительно, пульверизатора с использованием электрогидродинамики для получения легкого тумана), или распылителя, с использованием или без использования пригодного пропеллента, такого как дихлорфторметан. Аэрозольная тара, насос, разбрызгиватель, пульверизатор или распылитель содержат раствор или суспензию, который (которая) включает активное соединение, агент для диспергирования, растворения или длительного высвобождения активного соединения (например, этанол или водный этанол), один или более растворителей, которые служат в качестве пропеллента, и, необязательно, поверхностно-активное вещество, такое как сорбитантриолеат или олигомолочная кислота.
Перед использованием готовой лекарственной формы в виде сухого порошка или суспензии лекарственный продукт тонко измельчают до размера, подходящего для доставки путем ингаляции (обычно меньше чем 5 микрон). Этого можно достичь путем любого соответствующего способа измельчения до порошка, такого как размол при помощи винтовой струйной мельницы, размол при помощи струйной мельницы с псевдоожиженным слоем, обработка жидкостью в сверхкритическом состоянии для образования наночастиц, гомогенизация высокого давления или сушка распылением.
Капсулы, пластыри и ампулы цилиндрической формы (сделанные, например, из желатина или гидроксипропилметилцеллюлозы) для использования в ингаляторе или инсуффляторе можно получать с содержанием порошковой смеси активного соединения, пригодного порошкообразного основания, такого как лактоза или крахмал, и эффективного модификатора, такого как L-лейцин, маннит или стеарат магния. Лактоза может быть безводной или, предпочтительно, моногидратированной. Другие подходящие эксципиенты включают декстран, глюкозу, мальтозу, сорбит, ксилит, фруктозу, сахарозу и трегалозу.
Подходящая готовая лекарственная форма в виде раствора для использования в пульверизаторе с применением электрогидродинамики для получения легкого тумана может содержать от 1 мкг до 20 мг соединения согласно данному изобретению на одно воздействие и объем на одно воздействие может изменяться от 1 до 100 мкл. Типичная готовая лекарственная форма может содержать соединение формулы 1 или формулы 2, пропиленгликоль, стерильную воду, этанол и NaCl. Альтернативные растворители, которые можно использовать вместо пропиленгликоля, включают глицерин и полиэтиленгликоль.
Готовые лекарственные формы для ингаляционного/интраназального введения могут быть получены в виде обладающих немедленным и/или модифицированным высвобождением при использовании, например, сополимера (DL)-молочной и гликолевой кислот (PGLA). Пригодные ароматизаторы, такие как ментол и левоментол, или заменители сахара, такие как сахарин или натрийсахарин, можно добавлять к готовым лекарственным формам, предназначенным для ингаляционного/интраназального введения.
В случае ингаляторов и аэрозолей на основе сухого порошка единичную дозу определяют посредством клапана, который высвобождает определенное количество. Устройства согласно данному изобретению обычно приспособлены для введения определенной дозы или "дымки", содержащей от 100 до 1000 мкг активного фармацевтического ингредиента. Общая суточная доза обычно находится в диапазоне от 100 мкг до 10 мг, которую можно вводить в виде единичной дозы или, более типично, в виде раздельных доз в течение суток.
Активные соединения можно вводить ректально или вагинально, например, в форме суппозитория, пессария или клизмы. Традиционной основой суппозитория является масло какао, но можно использовать в качестве подходящих различные альтернативы. Готовые лекарственные формы для ректального/вагинального введения могут быть получены в виде обладающих немедленным и/или модифицированным высвобождением, как описано выше.
Раскрываемые соединения также можно вводить прямо в глаз или в ухо, обычно в форме капель микронизированной суспензии или в изотоническом, с установленным рН-значением, стерильном солевом растворе. Другие готовые лекарственные формы, пригодные для глазного или ушного введения, включают мази, биоразлагающиеся (например, гемостатические губки, коллаген) или биологически не разлагающиеся (например, силикон) имплантаты, облатки, линзы и системы макрочастиц и везикулярные системы, такие как ниосомы или липосомы. Полимер, такой как сшитая полиакриловая кислота, поливиниловый спирт, гиалуроновая кислота, целлюлозный полимер (например, гидроксипропилметилцеллюлоза, гидроксиэтилцеллюлоза или метилцеллюлоза), или гетерополисахарид (например, гумми на желатиновой основе), можно вводить совместно с консервантом, таким как бензалконийхлорид. Такие готовые лекарственные формы также могут быть доставлены путем ионофореза. Готовые лекарственные формы для глазного/ушного введения могут быть получены в виде обладающих немедленным и/или модифицированным высвобождением, как описано выше.
Раскрываемые соединения можно комбинировать с растворимыми макромолекулярными частицами, такими как циклодекстрин или полимеры, содержащие полиэтиленгликоль, для повышения их растворимости, скорости растворения, маскировки вкуса, биодоступности и/или устойчивости. Например, обнаружено, что комплексы лекарственное средство - циклодекстрин обычно пригодны для наиболее дозированных форм и путей введения. Можно использовать как комплексы включения, так и не комплексы включения. В качестве альтернативы прямого комплексообразования с лекарственным средством циклодекстрин можно использовать в качестве вспомогательной добавки, то есть, в качестве носителя, разбавителя или солюбилизатора. Для этих целей, как правило, используют альфа-, бета- и гамма-циклодекстрины, см., например, международные патентные заявки WO 91/11172, WO 94/02518 и WO 98/55148.
Терапевтически эффективная доза соединений формулы 1, формулы 2 или других солей может изменяться от приблизительно 0,01 мг/кг до приблизительно 100 мг/кг массы тела в сутки. Обычные дозы взрослого человека составляют от приблизительно 0,1 мг до приблизительно 3000 мг в сутки. Количество активного компонента при приготовлении единичной дозы можно изменять или устанавливать от приблизительно 0,1 мг до приблизительно 500 мг, предпочтительно от приблизительно 0,6 до 100 мг, в соответствии с индивидуальным применением и эффективностью активного компонента. Композиция может, если желательно, также содержать другие совместимые терапевтические агенты. Субъекту, нуждающемуся в лечении, вводят дозу от примерно 0,6 мг до примерно 500 мг в сутки, или отдельно или в виде множественных доз в течение 24-часового периода. Такое лечение можно повторять с последующими интервалами настолько долго, насколько это необходимо.
ПРИМЕРЫ
Подразумевают, что следующие примеры являются пояснительными и не ограничивающими объема охраны изобретения и представляют собой специфические воплощения настоящего изобретения.
Пример 1
Получение трет-бутилового эфира 4-[6-(6-бром-8-циклопентил-5-метил-7-оксо-7,8-дигидропиридо[2,3-d]пиримидин-2-иламино)пиридин-3-ил]пиперазин-1-карбоновой кислоты
Суспензию 6-бром-8-циклопентил-2-метансульфинил-5-метил-8Н-пиридо[2,3-d]пиримидин-7-она (10,00 г, 0,027 моль, полученную как в примере 6 заявки WO 01/707041, которая включена в данный контекст в качестве ссылки) и 10,37 г (0,0373 моль) трет-бутилового эфира 4-(6-аминопиридин-3-ил)пиперазин-1-карбоновой кислоты в толуоле (100 мл) нагревают в атмосфере азота на масляной бане в течение 7 часов. Тонкослойной хроматографией (SiO2, 10% метанол/DCM) определяют присутствие обоих исходных материалов. Суспензию нагревают с обратным холодильником в течение дополнительных 18 часов. Полученную суспензию охлаждают до комнатной температуры и отфильтровывают с получением трет-бутилового эфира 4-[6-(6-бром-8-циклопентил-5-метил-7-оксо-7,8-дигидропиридо[2,3-d]пиримидин-2-иламино)пиридин-3-ил]пиперазин-1-карбоновой кислоты (5,93 г, 38%). Температура плавления >250оС.
MS (APCI) (масс-спектрометрия с химической ионизацией при атмосферном давлении) М++1: рассчитано 584,2, найдено 584,2.
Пример 2
Получение трет-бутилового эфира 4-{6-[8-циклопентил-6-(1-этоксивинил)-5-метил-7-оксо-7,8-дигидропиридо[2,3-d]пиримидин-2-иламино]пиридин-3-ил}пиперазин-1-карбоновой кислоты
Суспензию трет-бутилового эфира 4-[6-(6-бром-8-циклопентил-5-метил-7-оксо-7,8-дигидропиридо[2,3-d]пиримидин-2-иламино)пиридин-3-ил]пиперазин-1-карбоновой кислоты (5,93 г, 0,010 моль, получен как в примере 1), тетракис(трифенилфосфин)палладий(0) (1,40 г, 0,00121 моль) и трибутил(1-этоксивинил)олово (5,32 мл, 0,0157 моль) в толуоле (30 мл) нагревают с обратным холодильником в течение 3,5 часов. Смесь охлаждают и отфильтровывают с получением твердого вещества. Очищают твердое вещество хроматографией на силикагеле с использованием градиента 5%-66% этилацетат/гексан в течение 15 минут с получением трет-бутилового эфира 4-{6-[8-циклопентил-6-(1-этоксивинил)-5-метил-7-оксо-7,8-дигидропиридо[2,3-d]пиримидин-2-иламино]пиридин-3-ил}пиперазин-1-карбоновой кислоты в виде желтого пенообразного вещества (4,50 г, 78%).
MS (APCI) М++1: рассчитано 576,2, найдено 576,3.
Пример 3
Получение гидрохлорида 6-ацетил-8-циклопентил-5-метил-2-(5-пиперазин-1-илпиридин-2-иламино)-8Н-пиридо[2,3-d]пиримидин-7-она
В охлажденный на ледяной бане раствор трет-бутилового эфира 4-{6-[8-циклопентил-6-(1-этоксивинил)-5-метил-7-оксо-7,8-дигидропиридо[2,3-d]пиримидин-2-иламино]пиридин-3-ил}пиперазин-1-карбоновой кислоты (4,50 г, 0,00783 моль, получен как в примере 2) в DCM (100 мл) барботируют газообразный хлористый водород. Полученную суспензию закупоривают и перемешивают при комнатной температуре в течение ночи, затем разбавляют диэтиловым эфиром (200 мл). Твердое вещество собирают фильтрацией, промывают диэтиловым эфиром и сушат с получением гидрохлорида 6-ацетил-8-циклопентил-5-метил-2-(5-пиперазин-1-илпиридин-2-иламино)-8Н-пиридо[2,3-d]пиримидин-7-она в виде желтого твердого вещества (4,01 г, 92%). Температура плавления: 200оС. ВЭЖХ с обращенной фазой, колонка С18, с 10%-95% градиентом 0,1% ТФУК/CH3CN в 0,1% ТФУК/Н2О, в течение 22 минут: 99,0% при 11,04 минут.
MS (APCI) М++1: рассчитано 448,2, найдено 448,3. Аналитически рассчитано для С24Н29N7O2·2,4H2O·1,85HCl: С, 51,64; Н, 6,44; N, 17,56, Cl (общий), 11,75. Найдено: С, 51,31; Н, 6,41; N, 17,20, Cl (общий), 12,11.
Пример 4
Получение моноизетионатной соли 6-ацетил-8-циклопентил-5-метил-2-(5-пиперазин-1-илпиридин-2-иламино)-8Н-пиридо[2,3-d]пиримидин-7-она (форма В)
К суспензии 6-ацетил-8-циклопентил-5-метил-2-(5-пиперазин-1-илпиридин-2-иламино)-8Н-пиридо[2,3-d]пиримидин-7-она (7,0 г, 15,64 ммоль, получен как в примере 3 с последующим контактированием с NaOH), диспергированного в 250 мл воды, добавляют по каплям 30 мл 0,52 М раствора изетионовой кислоты в метаноле (15,64 ммоль) до значения рН 5,2. Раствор отфильтровывают через стеклянный (мелкопористый) фильтр и прозрачный раствор подвергают сушке вымораживанием с получением 9,4 г аморфной соли. Аморфную соль (3,16 г) смешивают с 25 мл метанола и после почти полного растворения получают новый осадок. Добавляют еще 25 мл метанола и смесь перемешивают от 46 до 49оС в течение четырех часов. Смесь медленно охлаждают до 32оС и выдерживают в холодильной камере (+4оС) в течение ночи. Отбирают образец для PXRD, который показывает образование формы В. Смесь отфильтровывают и осадок сушат в течение ночи при 50оС в вакуумном сушильном шкафу. Получают 2,92 г моноизетионатной соли соединения формулы 1 с выходом 92%.
ВЭЖХ - 99,25%, PXRD - форма В, элементный анализ CHNS, Н-ЯМР согласуются со структурой.
Пример 5
Получение моноизетионатной соли 6-ацетил-8-циклопентил-5-метил-2-(5-пиперазин-1-илпиридин-2-иламино)-8Н-пиридо[2,3-d]пиримидин-7-она (форма В)
Метанол (100 мл) помещают в колбу емкостью 250 мл, снабженную механической мешалкой, карманом для термопары с контроллером, конденсатором и рубашкой для обогрева, и подогревают до 35оС. Аморфную изетионатную соль (2 г, полученную как в примере 4) медленно добавляют тремя равными порциями с интервалом между добавлениями от 25 до 30 минут. Реакционную смесь перемешивают в течение ночи при 35оС и потом охлаждают. Образец отфильтровывают и исследуют с помощью PXRD. Он представляет собой чистую форму В. Всю реакционную смесь затем используют в качестве затравок формы В для эксперимента в более широком масштабе.
Пример 6
Получение моноизетионатной соли 6-ацетил-8-циклопентил-5-метил-2-(5-пиперазин-1-илпиридин-2-иламино)-8Н-пиридо[2,3-d]пиримидин-7-она (форма В)
Метанол (50 мл) помещают в колбу емкостью 250 мл, снабженную магнитной мешалкой, карманом для термопары с контроллером, конденсатором и рубашкой для обогрева, и подогревают до 40оС. Аморфную изетионатную соль (1 г, полученную как в примере 4) медленно добавляют тремя равными порциями с интервалом между добавлениями по 30 минут и затем перемешивают в течение ночи при 40оС. Реакцию контролируют с помощью in situ рамановской спектроскопии. Образец отбирают, отфильтровывают и анализируют с помощью PXRD. Он представляет собой чистую форму В по PXRD и рамановской спектроскопии. Смесь охлаждают до 25оС при скорости 3оС/час, охлаждают до -10оС, отфильтровывают и сушат в вакууме, получая 0,85 г кристаллического продукта формы В.
Пример 7
Получение моноизетионатной соли 6-ацетил-8-циклопентил-5-метил-2-(5-пиперазин-1-илпиридин-2-иламино)-8Н-пиридо[2,3-d]пиримидин-7-она (форма В)
Свободное основание (формула 1, 0,895 мг, 2 ммоль) смешивают с 10 мл метанола и вносят затравку из 33 мг моноизетионатной соли соединения формулы 1 (форма В). Затем добавляют 5,6 мл 0,375 М раствора изетионовой кислоты в метаноле (2,1 ммоль) в виде 10 равных порций в течение периода времени 75 минут. Смесь перемешивают дополнительный час и отбирают образец для PXRD-анализа. Подтверждают образование кристаллической формы В. Смесь перемешивают при комнатной температуре в течение ночи и еще осуществляют PXRD-анализ. Не наблюдают изменения в кристаллической форме. Смесь охлаждают в холодильнике при -8оС в течение ночи, отфильтровывают и сушат при 50оС в вакуумном сушильном шкафу с получением 1,053 г (91,8% от теоретического выхода) вышеназванного соединения (форма В).
ВЭЖХ - 99,8%, элементный анализ CHNS, Н-ЯМР, ИК-спектроскопия согласуется со структурой; согласно PXRD - форма В.
Пример 8
Получение моноизетионатной соли 6-ацетил-8-циклопентил-5-метил-2-(5-пиперазин-1-илпиридин-2-иламино)-8Н-пиридо[2,3-d]пиримидин-7-она (форма А)
Аморфную изетионатную соль (47 мг, полученную как в примере 4) смешивают с 4 мл этанола в колбе емкостью 15 мл, снабженной магнитной мешалкой, карманом для термопары и конденсатором. Смесь нагревают до температуры кипения с обратным холодильником, в результате чего образуется почти прозрачный раствор. После кипячения с обратным холодильником в течение 10-15 минут смесь становится мутной. Ее медленно охлаждают до 50оС и вносят затравку при 69оС с помощью формы А. Смесь выдерживают при 50оС в течение 5 часов и оставляют охлаждаться до комнатной температуры в течение ночи. Смесь затем охлаждают до 1оС с помощью ледяной бани, выдерживают в течение 1,5 часов, отфильтровывают, промывают 0,5 мл холодного этанола, сушат на воздухе и затем сушат в вакуумном сушильном шкафу при 70оС в течение ночи, получая 38,2 мг мелкокристаллического вещества. Кристаллическое вещество представляет собой моноизетионатную соль формы А по PXRD. Н-ЯМР согласуется с моноизетионатной солью и показывает присутствие остаточного этанола примерно 5,9% мол. или 0,6% масс.
Пример 9
Получение моноизетионатной соли 6-ацетил-8-циклопентил-5-метил-2-(5-пиперазин-1-илпиридин-2-иламино)-8Н-пиридо[2,3-d]пиримидин-7-она (форма D)
Аморфную изетианатную соль (9,0 г, полученную как в примере 4) смешивают с 300 мл метанола, перемешивают и нагревают до 63,8оС (температура кипения с обратным холодильником). К слегка мутной смеси двумя порциями по 50 мл добавляют метанол. Горячую смесь отфильтровывают в колбу емкостью 2 л, снабженную механической мешалкой. Смесь кратковременно нагревают до температуры кипения с обратным холодильником и затем охлаждают до 60оС. Добавляют к смеси IPA (100 мл). Смесь снова нагревают до 60оС и добавляют дополнительные 110 мл IPA. Осадок начинает образовываться при 59,7оС. Смесь снова нагревают до 67,5оС, охлаждают до 50оС и выдерживают в течение ночи. Следующим утром отбирают образец для PXRD-анализа. Смесь охлаждают до 25оС при скорости 3оС/час и отбирают другой образец для PXRD, когда температура смеси достигает 28оС. Смесь оставляют охлаждаться до комнатной температуры в течение ночи. Осадок собирают и сушат в вакуумном сушильном шкафу при 65оС и 30 Торр. По этой методике получают 7,45 г (выход 82,8%) кристаллического соединения (форма D по PXRD-анализу). Предварительно проанализированные образцы также являются формой D. ВЭЖХ показывает 98,82% чистоты, а микроанализ CHNS осуществляют с точностью ±0,4%. Из суспензии изетионатной соли форм А, В и D в метаноле получают, по существу, чистую форму В в течение времени меньше, чем три дня.
Пример 10
Получение изетионовой кислоты (2-гидроксиэтансульфоновая кислота)
Круглодонную четырехгорлую колбу емкостью 5 л, снабженную механической мешалкой, карманом для термопары, барботером для газа и выходным отверстием в атмосферу через водоотделитель, заполняют 748 г (5,05 моль) изетионата натрия (ALDRICH) и 4 л IPA. Суспензию перемешивают при комнатной температуре. Ледяную баню используют для сохранения внутренней температуры ниже 50оС, когда 925 г (25,4 моль) газообразного хлористого водорода (ALDRICH) пропускают через систему с такой скоростью, что он растворяется так же быстро, как его добавляют (что замечают по отсутствию барботирования через водоотделитель). Достаточное количество газообразного хлористого водорода добавляют до тех пор, пока система не будет насыщена (что замечают по началу барботирования через водоотделитель). Во время добавления хлористого водорода температура повышается до 45оС. Суспензию охлаждают до комнатной температуры и отфильтровывают на крупнопористом стеклянном фильтре. Осадок на фильтре промывают 100 мл IPA и мутный фильтрат отфильтровывают через 10-20-микронный фильтр. Полученный прозрачный бесцветный фильтрат концентрируют при пониженном давлении в роторном испарителе, все время поддерживая температуру бани ниже 50оС. Полученные 1,07 кг прозрачного светло-желтого масла разбавляют 50 мл водопроводной воды и 400 мл толуола и концентрируют при пониженном давлении в роторном испарителе в течение трех дней, все время поддерживая температуру бани ниже 50оС. Полученные 800 г прозрачного светло-желтого масла разбавляют 500 мл толуола и 250 мл IPA и концентрируют при пониженном давлении в роторном испарителе в течение 11 дней, поддерживая температуру бани ниже 50оС. Полученные 713 г прозрачного светло-желтого масла титруют до 81% масс. (580 г, выход 91,1%), включая 7,9% масс. воды и 7,5% масс. IPA.
Пример 11
Получение трет-бутилового эфира 4-{6-[6-(1-бутоксивинил)-8-циклопентил-5-метил-7-оксо-7,8-дигидропиридо[2,3-d]пиримидин-2-иламино]пиридин-3-ил}пиперазин-1-карбоновой кислоты
В круглодонной трехгорлой колбе емкостью 5 л, снабженной механической мешалкой, карманом для термопары и входным/выходным отверстием для азота через барботер с силиконовым маслом, создают атмосферу азота и заполняют ее трет-бутиловым эфиром 4-[6-(6-бром-8-циклопентил-5-метил-7-оксо-7,8-дигидропиридо[2,3-d]пиримидин-2-иламино)пиридин-3-ил]пиперазин-1-карбоновой кислоты (300 г, 0,51 моль, получен как в примере 2), бутилвиниловым эфиром (154 г, 1,54 моль, ALDRICH), н-бутанолом (1,5 л, ALDRICH) и диизопропилэтиламином (107 мл, 0,62 моль, ALDRICH). Суспензию 3 раза помещают в вакуум приблизительно 50 Торр и затем снова создают атмосферу азота. К ней добавляют 8,3 г (0,01 моль) бис(дифенилфосфинферроцен)палладийдихлорид- дихлорметана (JOHNSON MATTHEY, серийный номер 077598001) и полученную суспензию продувают дополнительно три раза, как описано выше. Смесь затем нагревают до 95оС и перемешивают в течение 20 часов. Полученную суспензию красноватого цвета разбавляют 2 л гептана и охлаждают до приблизительно 5оС. При этой температуре добавляют 400 мл насыщенного водного раствора карбоната калия и смесь отфильтровывают и промывают 250 мл гептана. После сушки в сушильном шкафу в течение 16 часов при 45оС получают 231,7 г (выход 75%) указанного в заголовке соединения в виде желтого твердого вещества.
Пример 12
Получение моноизетионатной соли 6-ацетил-8-циклопентил-5-метил-2-(5-пиперазин-1-илпиридин-2-иламино)-8Н-пиридо[2,3-d]пиримидин-7-она (форма В)
В круглодонной трехгорлой колбе емкостью 22 л, снабженной механической мешалкой, карманом для термопары, входным/выходным отверстием для азота через барботер с силиконовым маслом, создают атмосферу азота и заполняют ее трет-бутиловым эфиром 4-{6-[6-(1-бутоксивинил)-8-циклопентил-5-метил-7-оксо-7,8-дигидропиридо[2,3-d]пиримидин-2-иламино]пиридин-3-ил}пиперазин-1-карбоновой кислоты (725 г, 1,20 моль, получен как в примере 11) и метанолом (14 л). Суспензию перемешивают при комнатной температуре в течение добавления раствора изетионовой кислоты (530 г, 4,20 моль, полученной как в примере 10), метанол (1,5 л) и воду (70 мл, 3,89 моль). Полученную суспензию нагревают до 55оС в течение 30 минут и затем перемешивают при 55оС в течение 30 минут. Раствор 175 г (1,73 моль) Et3N (ALDRICH) в 200 мл метанола добавляют к суспензии, в то время как ее охлаждают до 30оС. Суспензию выдерживают при 30оС, когда добавляют раствор 128 г (1,26 моль) Et3N в 2 л метанола по каплям в течение 6 часов. Из полученной суспензии отбирают образцы для определения кристаллической формы (формы В). Суспензию охлаждают и выдерживают при 5оС в течение 15 минут и потом отфильтровывают через крупнопористый стеклянный фильтр. Полученный осадок на фильтре многократно промывают 200 мл холодного метанола. Твердый продукт сушат при 55оС в вакууме, получая 710 г (выход 91%) указанного в заголовке соединения в виде желтых кристаллов.
Подразумевают, что вышеприведенное описание предназначено только для иллюстрации и не является ограничивающим объем охраны изобретения. Множество воплощений могут быть очевидны специалисту в данной области из текста вышеприведенного описания. Объем данного изобретения, следовательно, должен определяться не ссылкой на вышеприведенное описание, а должен определяться ссылкой на прилагаемые пункты формулы изобретения, вместе дающие полный объем эквивалентов, для которых указаны такие пункты формулы изобретения. Раскрытие всех статей и ссылок, включая патенты, заявки на патенты и патентные публикации, включено в данный контекст путем ссылки во всей их полноте и для всех целей.
Формула изобретения
1. Изетионатная соль 6-ацетил-8-циклопентил-5-метил-2-(5-пиперазин-1-илпиридин-2-иламино)-8Н-пиридо[2,3-d]пиримидин-7-она.
2. Изетионатная соль по п.1, содержащая моноизетионатную соль формы А, которая характеризуется одним или более из следующего: порошковая рентгенограмма имеет пики при величинах 2 от примерно 8,7, 13,5 и 17,6, или рамановский спектр имеет пики с величинами сдвига частот комбинационного рассеяния от примерно 1600 см-1, 1290 см-1, 675 см-1, 470 см-1, 450 см-1 и 425 см-1, или термограмма DSC имеет отчетливый эндотермический пик при 273°С. от примерно 8,7, 13,5 и 17,6, или рамановский спектр имеет пики с величинами сдвига частот комбинационного рассеяния от примерно 1600 см-1, 1290 см-1, 675 см-1, 470 см-1, 450 см-1 и 425 см-1, или термограмма DSC имеет отчетливый эндотермический пик при 273°С.
3. Изетионатная соль по п.1, содержащая моноизетионатную соль формы В, которая характеризуется одним или более из следующего: порошковая рентгенограмма имеет пики при величинах 2 примерно 5,1, 11,8, 12,1, 12,8, 13,1 и 14,7, рамановский спектр имеет пики с величинами сдвига частот комбинационного рассеяния примерно 1600 см-1, 1290 см-1, 470 см-1, 450 см-1 и 425 см-1, но без основного пика 675 см-1, или термограмма DSC имеет отчетливый эндотермический пик при 271°С. примерно 5,1, 11,8, 12,1, 12,8, 13,1 и 14,7, рамановский спектр имеет пики с величинами сдвига частот комбинационного рассеяния примерно 1600 см-1, 1290 см-1, 470 см-1, 450 см-1 и 425 см-1, но без основного пика 675 см-1, или термограмма DSC имеет отчетливый эндотермический пик при 271°С.
4. Изетионатная соль по п.1, содержащая моноизетионатную соль формы D, которая характеризуется одним или более из следующего: порошковая рентгенограмма имеет пики при величинах 2 примерно 8,4, 8,9 и 21,9, рамановский спектр имеет пик с величиной сдвига частот комбинационного рассеяния примерно 463 см-1 или термограмма DSC имеет отчетливый эндотермический пик при 277°С. примерно 8,4, 8,9 и 21,9, рамановский спектр имеет пик с величиной сдвига частот комбинационного рассеяния примерно 463 см-1 или термограмма DSC имеет отчетливый эндотермический пик при 277°С.
5. Лекарственное средство, обладающее свойствами селективного ингибитора циклинзависимой киназы 4 (CDK4), содержащее изетионатную соль 6-ацетил-8-циклопентил-5-метил-2-(5-пиперазин-1-илпиридин-2-иламино)-8Н-пиридо[2,3-d]пиримидин-7-она и один или более фармацевтически приемлемых эксципиентов.
6. Способ получения кристаллической изетионатной соли 6-ацетил-8-циклопентил-5-метил-2-(5-пиперазин-1-илпиридин-2-иламино)-8Н-пиридо[2,3-d]пиримидин-7-она, включающий
смешивание раствора изетионовой кислоты и первого растворителя с дисперсией 6-ацетил-8-циклопентил-5-метил-2-(5-пиперазин-1-илпиридин-2-иламино)-8Н-пиридо[2,3-d]пиримидин-7-она и воды с получением первой смеси;
сушку вымораживанием первой смеси с получением аморфной соли;
перемешивание аморфной соли со вторым растворителем с получением второй смеси, которая включает кристаллическую изетионатную соль 6-ацетил-8-циклопентил-5-метил-2-(5-пиперазин-1-илпиридин-2-иламино)-8Н-пиридо[2,3-d]пиримидин-7-она, причем второй растворитель является тем же самым или иным, чем первый растворитель; и,
необязательно, нагрев второй смеси, или охлаждение второй смеси, или нагрев и охлаждение второй смеси.
7. Способ получения изетионатной соли 6-ацетил-8-циклопентил-5-метил-2-(5-пиперазин-1-илпиридин-2-иламино)-8Н-пиридо[2,3-d]пиримидин-7-она, включающий
получение затравочного кристалла изетионатной солевой формы 6-ацетил-8-циклопентил-5-метил-2-(5-пиперазин-1-илпиридин-2-иламино)-8Н-пиридо[2,3-d]пиримидин-7-она, полученного в условиях способа по п.6;
добавление затравочного кристалла к дисперсии 6-ацетил-8-циклопентил-5-метил-2-(5-пиперазин-1-илпиридин-2-иламино)-8Н-пиридо[2,3-d]пиримидин-7-она и первого растворителя с получением первой смеси;
смешивание первой смеси с раствором изетионовой кислоты и второго растворителя с получением второй смеси, которая включает изетионатную соль 6-ацетил-8-циклопентил-5-метил-2-(5-пиперазин-1-илпиридин-2-иламино)-8Н-пиридо[2,3-d]пиримидин-7-она; и,
необязательно, нагрев второй смеси, или охлаждение второй смеси, или нагрев и охлаждение второй смеси.
8. Способ по п.6 или 7, где первый и второй растворители являются смешивающимися с водой.
9. Способ по п.6 или 7, где первый и второй растворители являются спиртами.
10. Способ по п.6 или 7, где первый и второй растворители являются метанолом.
11. Способ по п.6 или 7, где первую смесь или вторую смесь, соответственно, получают путем смешивания приблизительно эквимолярных количеств изетионовой кислоты и 6-ацетил-8-циклопентил-5-метил-2-(5-пиперазин-1-илпиридин-2-иламино)-8Н-пиридо[2,3-d]пиримидин-7-она.
12. Способ по п.6 или 7, дополнительно включающий перемешивание второй смеси при температуре от примерно 30 до примерно 60°С.
13. Способ по п.6 или 7, дополнительно включающий охлаждение второй смеси до температуры примерно 0°С или ниже.
14. Способ получения изетионатной соли 6-ацетил-8-циклопентил-5-метил-2-(5-пиперазин-1-илпиридин-2-иламино)-8Н-пиридо[2,3-d]пиримидин-7-она, включающий
взаимодействие трет-бутилового эфира 4-{6-[6-(1-бутоксивинил)-8-циклопентил-5-метил-7-оксо-7,8-дигидропиридо[2,3-d]пиримидин-2-иламино]пиридин-3-ил}пиперазин-1-карбоновой кислоты с изетионовой кислотой в первом растворителе и воде с получением смеси, которая включает диизетионатную соль 6-ацетил-8-циклопентил-5-метил-2-(5-пиперазин-1-илпиридин-2-иламино)-8Н-пиридо[2,3-d]пиримидин-7-она.
15. Способ по п.14, дополнительно включающий добавление блокирующего основания к реакционной смеси с получением моноизетионатной соли 6-ацетил-8-пиклопентил-5-метил-2-(5-пиперазин-1-илпиридин-2-иламино)-8Н-пиридо[2,3-d]пиримидин-7-она.
16. Применение изетионатной соли 6-ацетил-8-циклопентил-5-метил-2-(5-пиперазин-1-илпиридин-2-иламино)-8Н-пиридо[2,3-d]пиримидин-7-она, обладающей свойствами селективного ингибитора циклинзависимой киназы 4 (CDK4), для получения лекарственного средства, эффективного при лечении нарушения или состояния, опосредованного действием CDK4.
17. Применение по п.16, где нарушением или состоянием, опосредованным действием CDK4, является рак.
|