
СПИСОК ПАТЕНТОВ С УПОМИНАНИЕМ ГИАЛУРОНОВОЙ КИСЛОТЫ
-
- 2017751 Способ получения гиалурона
- 2192150 БАД для профилактики йодной недостаточности
- 2112542 Препарат для лечения патологий соединительных тканей
- 2225206 Препарат для лечения рака молочной железы
- 2299733 Лечение опорно-двигательного аппарата
- 2299732 Способ лечения глаукомы
- 2299726 Противоинфекционная губная помада
- 2299725 Косметическое средство для ухода за кожей
- 2198878 Ароматическое соединение
- 2198702 Способ подготовки трофических язв к аутодермапластике
- 2198653 Вагинальные суппозитории
- 2197946 Композиция для ухода за волосами
- 2197923 Фармацевтическая композиция для лечения отеков роговицы
- 2298410 Биотрансплантант и способ лечения ревматических и аутоиммунных заболеваний
- 2197501 Фотоотверженный гель на основе сшитой гиалуроновой кислоты
- 2197228 Твердые лекарственные формы
- 2197222 Водная компазиция для ухода за волосами, лица и тела
- 2297425 Полипептиды
- 2297240 Композиция с гиалуроновой кислотой
- 2297230 Фармацевтическая компазиция с ксантоновой смолой
- 2196588 Глазные капли
- 2195955 Применение биологически активных веществ
- 2195926 Дерматологические композиции
- 2295954 Микрочастицы для доставки нуклеиновых кислот
- 2295951 Косметика для ухода за кожей лица и век
- 2195262 Фармакологическое средство на основе гиалуроновой кислоты
- 2194512 Способ профилактики и коррекции процесса старения кожи
- 2194478 Лечение экземы
- 2294716 Расширяемый стент
- 2194055 Сшитые сополимеры
- 2099350 Ассоциаты депротонированной гиалуроновой кислоты
- 2293557 Средство для лечения кожи и слизистых
- 2292878 Приготовление микроцастиц, содержащих метопропол
- 2292746 БАД
- 2192256 Защита кишечника
- 2191782 Получение модифицированной гиалуроновой кислоты
- 2292219 Паратиреоидный гормон человека
- 2291686 Микроцастицы
- 2191000 Косметическая маска
- 2290921 Фармацевтические и косметические средства против старения кожи
- 2290900 Модифицированный биоматериал для использования в офтальмологии
- 2290899 Получение биоматерьяла
- 2290397 Новые инданилиденовые соединения
- 2290186 Лечение сирингомиелии
- 2288702 Иррингационный раствор для офтальмологии
- 2288699 Гель для лечения стоматологических заболеваний
- 2188011 Активирующая остеогенез фармацевтическая композиция
- 2187327 Средство с антисептиком
- 2187325 Средство с радиопротекторным действием
- 2287330 Композиции миноксидила
- 2186786 Способ получения гиалуроновой кислоты
- 2186593 Лечение раненого процесса кожи
- 2286801 Очищение воды
- 2286781 Лечение ожогов пищевода у детей
- 2286764 Средство лечения воспалений полости рта
- 2185840 Лечение инфекционных заболеваний
- 2286151 Альфа-2-Дельта-Лиганда
- 2185149 Ранозаживляющий гель
- 2285527 Лечение ИЛ-6 заболеваний
- 2184448 Раствор хранения роговицы, включающий гиалуроновую кислоту
- 2090179 Крем для кожи
- 2183961 Способ лечения кожи
- 2284331 Соли алифотических аминов
- 2284187 Производные амида
- 2089191 Снизить внутрение давление
- 2283320 Получение гликозаминогликанов
- 2283129 Лечение опухолей
- 2283098 Косметические средства с Q
- 2182574 Ароматические соединения
- 2088257 Средство с гипохолестеролемическим действием
- 2088218 Состав для гигиенических салфеток
- 2088206 Способ получения препарата, создающего исскуственный загар
- 2282462 Противомикробные средства
- 2182008 Интровагинальная компазиция
- 2181999 Препарат с отсроченным высвобождением
- 2181998 Новые композиции липидов
- 2181995 Лечение болевого синдрома
- 2181295 Вирионная вакцина
- 2087144 Витамин Е
- 2379336 Способ стирки
- 2379052 Вакцинация
- 2180855Композиция в виде ионного комплекса
- 2379025 Противоинфекционный гель
- 2180825 Лечение травм роговицы
- 2281082 Способ коррекции эстетических и возрастных проблем кожи
- 2180576 Биоактивная добавка для косметических средств
- 2280459 Средство для изменения скорости роста или репродукции клеток
- 2179981 Соли переходного металла
- 2378010 Жидкие вакцины
- 2378008 Комбинированные вакцины
- 2378007 Анаболическое средство
- 2377973 Растительные экстракты
- 2280041 Способ получения водорастворимых комплексов гиалурил
- 2280038 Биополимеры
- 2323733 Йодный обмен
- 2377260 Гель
- 2178693 Противовирусное средство на основе гиалуроновой кислоты
- 2178692 Облегчающие зуд косметическое средство
- 2377022 Гемостатические спреи
- 2376982 Увлажняющая сыворотка для лица
- 2376974 Трансдермальный гель для лица
- 2362784 Гипо-и гиперацетилированные менингокковые капсульные сахариды
- 2177789 Устройство для доставки лекарства к шейке матки
- 2277954 Крем для лица омолаживающий
- 2376378 Способ получения метионина
- 2177332 Биоматериал для предотвращения послеоперационных спаек, с производной гиалуроновой кислотой
- 2177310 Способ получения таблеток
- 2376011 Средство для позвоночника
- 2277410 Косметическое средство
- 2323748 Медицинская повязка
- 2276998 Гидрогелевые композиции
- 2082416 Способ получения препарата с коллагенном из животного сырья
- 2375081 Адсорбирующее изделие
- 2375049 Охлаждающий пластырь
- 2346049 Способ получения гиалурона
- 2275913 Фармацевтические средства
- 2174985 Полисахарид с антиоксидантом
- 2373957 Носитель для лекарственных средств и биологически активных веществ
- 2373941 Способ коррекции возрастных и патологических изменений кожных покров
- 2174845 Композиции и способы доставки генетического материала
- 2174830 Средство для укрепления волос
- 2373769 Синбиотическая композиция
- 2274472 Лечение апорно-двигательного аппарата и болевых синдромов
- 2372929 Профилактическая композиция на основе веществ фенольной природы в липосомной форме
- 2173563 Способ нанесения на поверхность предметов покрытия на основе гиалуроновой кислоты, её производных и полусинтетических полимеров
- 2079304 фармацевтическая композиция, обладающая иммуносупрессорной и антимикробной активностью
- 2273645 Полипептид ожирения
- 2173154 Фракция кератансульфатолигосахаридов и содержащий ее фармацевтический препарат
- 2173136 Грязная мазь
- 2173128 Способ хирургического лечения центральных разрывов сечатки
- 2078561 Косметическое средство предотвращающее старение кожи
- 2172490 Способ прогнозирования воспалительных заболеваний молочной железы при эндопластике
- 2272645 Способ лечения ЦМВ-Инфекции у детей раннего возроста
- 2272636 Фармацевтическая композиция для местного лечения воспаления
- 2272635 Фармацевтически активная субстанция для офтальмологии
- 2272599 Биоматерьял для стабилизации прогрессирующей миопии "Коллаплант"
- 2172168 Средство для заживления ран на основе гиалуроновой кислоты
- 2371172 Фармацевтическая композиция для лечения нервной системы на основе стефаглабрина
- 2171470 Способ прогнозирования послеоперационной трансформации доброкачественных опухолей нервной системы
- 2077317 Состав для ванн
- 2271213 Комбинированные композиции, содержащие экстракты из растений и морских животных
- 2076872 Способ получения окрашенной гиалуроновой кислоты
- 2076671 Раствор для защиты роговицы
- 2370281 Конъюгаты гидроксиалкилкрахмал
- 2370275 Способ лечения (коррекции) косметических и возрастных дефектов кожи
- 2370258 Фармацевтическая композиция для парентальной доставки в форме лиофилизата
- 2270023 Способ экстракции и очистки протеогликана хрящего типа (варианты)
- 2369408 Гемостатическая композиция, включающая гиалуроновую кислоту
- 2369387 Фармацевтическая композиция для лечения нервной системы
- 2369379 Нетаблитированные жевательные формы для индивидуального введения
- 2169136 Производное коричной кислоты
- 70792 Медицинский аппликатор
- 20741717 Способ стабилизации аскорбиновой кислоты
- 2074712 Способ получения препарата, препятствующего преждевременной эякуляции
- 2367954 Способ прогнозирования развития кожной патологии у женщин с синдромом склерополикистозных яичников (СПКЯ)
- 2268075 Устройство для электрокинетической доставки
- 2268052 Средство для лечения воспалительных и дегенеративных заболеваний суставов
- 2167649 Способ получения твердой дисперсии умеренного водорастворимого лекарственного вещества
- 2167647 Гель для бритья
- 2073520 Лечение урологических инфекций
- 2367476 Биопластический материал
- 2367475 Мембрана для использования при направленной регенерации тканей
- 2367469 Фармацевтическая композиция на основе лизоамидазы
- 2367456 Фармацевтическая композиция обладающая антибактериальным и некролитическим действием
- 2367455 Фармацевтическая композиция обладающая некролитическим и антибактериальным действием
- 2267324 Применение антиадгезивных углеводов, препарат для уменьшения и /или блокирования адгезии патогенных веществ
- 2166934 Композиции включающие биологический агент
- 2166510 Псевдодипептиды
- 2366460 Композиции, имеющие высокую противовирусную и антибактериальную активность
- 2360901 Производные феноксиуксусной кислоты
- 2165749 Способ восстановления эндотелия роговицы
- 2265441 Способ укрепления склеры
- 2365382 Композиции и способы для регуляции развития сосудов
- 2070879 Соли гликозаминогликанов
- 2164914 Циклические и гетероциклические N - замещенные - иминогидроксамовые карбоновые кислоты
- 2264627 Хламидийный конъюктивит
- 2364399 Фармацевтический препарат на основе стефаглабрина
- 2264230 Препарат с замедленным высвобождением активного вещества
- 2363497 Фармацевтические композиции
- 2363496 Способ увеличения объема мягких тканей
- 2363473 Способ антифлогистической активации в эксперементе
- 2363461 Фармацевтический препарат на основе сигетина
- 2363459 Средства для введения в роговицу глаз для предотвращения офтальмологических нарушений
- 2363448 Фармацевтические композиции
- 2163123 Глазные капли
- 2162687 Усовершенствованнная лекарственная форма индуктора интерферана
- 2162343 Биосовместимый полимерный материал и способ его получения
- 2162327 Лечение рака
- 2067841 Способ получения ароматизатора
- 2161478 Способ консервированого лечения гонартроза
- 2361617 Вольфрамовые частицы в качестве рентгеноконтрастных веществ
- 2361552 Способы и устройства для дренирования жидкостей и понижения внутриглазного давления
- 2066996 Способ изготовления пленочного материала для офтальмохирургии
- 2361417 Корм с глюкозамином и экстрактом ивы для профилактики артроза у животных
- 2161002 Пищевой общеукрепляющий лечебно-профилактический продукт из хрящевой ткани акул
- 2360928 Комплексная матрица для медико-биологического применения
- 2160574 Способ лечения глаукомы
- 2360688 Способ лечения повреждений переферических нервов
- 2360670 Фармацевтическая композиция при климактерических расстройствах
- 2360646 Эндолюминальный протез
- 2260445 Способ усовершенствования транспортировки через легко прспосабливаемый полупроницаемый барьер
- 2260007 Производные амида
- 2359975 Способ получения модифицированных арабиногалактанов
- 2359974 Антигенные Пептиды
- 2159775 Псевдопептидный продукт
- 2259833 Фармацевтическая композиция для лечения роговицы глаза
- 2259816 Ранозаживляющее средство
- 2259815 Способ коррекции возрастных изменений, связанных с процессами старения кожи
- 2359706 Способ сохранения офтальмологических растворов
- 2359704 Антисептическое средство
- 2359662 Микрокапсулы
- 2159253 Катионные полимеры
- 2159111 Средство для ухода за кожей лица
- 2159105 Композиция для защиты кожи от опасных химических веществ Получение
- 2158593 Биосовместимый водный раствор
- 2358728 Способ лечения и предупреждения потери костной ткани
- 2258517 Способ хирургического лечения травмотических повреждений селезенки пленкой на основе гиалуроновой кислоты
- 2357968 Кристалические формы производной имидазола
- 2357957 Ингибиторы P38 и их применение
- 2157647 Пищевая добавка и ее получение
- 2357758 Препараты для чрескожной и чересслизистой добавки
- 2063244 Способ стабилизации растворов
- 2063140 Способ получения препарата для консервирования мяса
- 2157381 Способ получения гиалуроновой кислоты
- 2257198 Композиции микроцастиц
- 2356909 Белковый комплекс
- 2356570 Косметическая композиция
- 2256434 Способ закрытия перфорации барабанной перепонки
- 2356520 Способ лечения постконтузионного повреждения сечатки глаза
- 2156133 Гель
- 2255945 Полимерная композиция
- 2355761 Средства повторной дифференцировки
- 2061043 Способ повышения устойчивости урокиназы к нагреванию
- 2061005 Способ получения красителей для гистологических исследований
- 2355420 Зубная паста
- 2355385 Композиции пролонгированного действия с контролируемым высвобождением
- 2355240 Способ получения пищевого препарата хондропротекторного действия
- 2155057 Пихтово репейный бальзам
- 2354409 Способ производства высвобождающих лекарственные средчтва медицинских устройств
- 2254145 Раневое покрытие на основе коллаген-хитозанового комплекса
- 2254133 Лечение и профилактика ВИЧ-инфекции у человека
- 2253439 Фармацевтическая композиция для защиты и улучшения оптических свойств роговици при проведении эндовитреальных вмешательств
- 2253437 Способ омоложения кожи
- 2153352 Фармацевтическая композиция обладающая ранозаживляющим и противовоспалительным действием
- 2353354 Фармацевтический препарат на основе низкомолекулярного индуктора интерферона
- 2252787 Способ получения искусственной матрицы кожи
- 2252767 Способ нормализации иммунобиохимического гомеостаза коров в предродовом и послеродовом периодах
- 2352583 Фармацевтическая композиция содержащая Fc-область иммуноглобулина в качестве носителя
- 2152403 Модифицированные полисахариды
- 2352356 Иммуногенная композиция
- 2352342 Исскусственный физиологический солевый раствор Способ его получения
- 2352330 Фармацевтический препарат на основе низкомолекулярного индуктора интерферона
- 2352323 Фармацевтический препарат с модифицированным высвобождением
- 2152027 Способ подготовки ткани мозга для определения гликозаминогликанов
- 2251842 Интектицидный состав для борьбы с личинками оводов
- 2151580 Способ активации пролиферации эндотелия роговицы
- 2351648 Дифференцировка стромальных клеток, полученных из жировой ткани, в эндокринные клетки поджелудочной железы и их использование
- 2351595 N - гидроксиформамидные соединения в качестве ингибиторов металлопротеина
- 2251411 Косметическое средство в лиофилизированной фармацевтической форме
- 2251405 Косметика...ее композиции для косметических препаратов
- 2251367 Средство со сшитой гиалуроновой кислотой для наращивания тканей
- 2351359 Косметика для профилактики и лечения избыточной массы тела
- 2351322 Препарат на основе низкомолекулярного индуктора интерферона
- 2351153 Диета при остеортрите собак
- 2350958 Способ определения групповой принадлежности синовальной жидкости
- 2350625 Производные гиалуроновой кислоты с пониженной биодеградируемостью
- 2150266 Крем после бритья
- 2350354 Фармацевтическое средство содержащие антагонист и фактор некроза
- 2350340 Способ коррекции процессов регенерации
- 2350309 Способ лечения избыточной массы тела с помощью рефлексотерапии
- 2250047 Профилактический продукт из хрящевой ткани гидробионтов
- 2249467 Медицинский матерьял и изделия на его основе
- 2055079 Способ получения препарата гиалуроновой кислоты
- 2349599 Биоадгезив мидии
- 2054903 Способ лечения коллагеноза у бычков на откорме
- 2249210 Способ прогнозирования предрасположенности к развитию и тяжести течения деформирующего остеоартроза коленного сустава у взрослых
- 2349339 Средство для соединительной ткани
- 2148988 Человеческий интерферона
- 2148399 Лечение атеросклероза
- 2148396 Способ определения активного вещества в дифильных мазевых основах
- 2148375 Способ диагностики близорукости
- 2348415 Способ противоспаечной терапии после хирургического вмешательства
- 2348400 Препарат на основе низкомолекулярного индуктора интерферона
- 2348386 Способ непроникающего хирургического лечения первичной открытоугольной глаукомы
- 2248213 Лечение Галактозидальной А недостаточности
- 2347586 Микрофлюидизированные эмульсии типа "масло в воде" и вакцинные средства
- 2147243 Контрастное средство
- 2146526 Лечебный препарат дисбактериоза и урогенитальных инфекций
- 2146148 Терапевтическое применение фактора роста кератиноцитов (ФРК)
- 2146139 Способ повышения активности макрофагов и комбинации для его осуществления
- 2346277 Способ диагностики специфического синовита
- 2345793 Ультразвуковые контрастные вещества и их получение
- 2345782 Терапевтические комбинации на основе PORIFERA для лечения и предотвращения кожных заболеваний
- 2245131 Способ коррекции косметических недостатков кожи
- 2245130 Способ активации восстановительных процессов в коже
- 2144833 Хондроитиназа
- 2344809 Получение твердых дозированных форм с использованием сшитого нетермопластичного носителя
- 2244540 Косметический гель для ухода за кожей лица
- 2244536 Способ лечения дегенеративно-дистрофических заболеваний тазобедренного сустава
- 2344167 Хмелевый экстракт
- 2143884 Агент регулирования дифференциации клеток кожи, культурная среда для клеток или тканей и способ регулирования дифференциации клеток кожи
- 2343932 Способ получения обладающих пониженной растворимостью в воде пленночных материалов
- 2343903 Устройство доставки лекарств для контролируемого введения препаратов
- 2048817 Способ получения материала для лечения ожогов и гнойно - некронических ран
- 2048803 Гидратантный крем
- 2242974 Средства и способы лечения воспалительных заболнваний
- 2142816 Способ получения антигерпетической вакцины
- 2342923 Средство для обработки рук с увлажняющим эффектом
- 2142781 Косметика для макияжа ресниц и бровей и агент ингирирующий рост микроорганизмов в косметических средствах
- 2242251 Трансплантируемые стенты с биоактивными покрытиями
- 2142257 Способ обработки глазных имплантантов и контакных линз
- 2342389 Мононатриевая соль
- 2342107 Способ устранения западения верхнего века при анофтальме
- 2141828 Средство, пролонгирующее эффективность чесночного порошка
- 2241489 Косметическое средство матриксных протеинов для залечивания ран
- 2241443 Средство для лечения герпеса
- 2241414 Способ получения протезов кровеносных сосудов
- 2341539 Гидрогель
- 2141324 Регулятор скорости воздействия препарата для инъекций
- 2141312 Косметическое средство для ухода за кожей лица
- 2341296 Средства и способы покрытия медицинских имплантантов
- 2341272 Средство для неспецифической иммунотерапии
- 2341266 Стенты с нанесенным покрытием содержащим N - (5-(4-(4-
- 2341257 Иммуномодулирующее средство
- 2341255 Средство для лечения климактерических расстройств
- 2240821 Способ лечения урологических инфекций
- 2140786 Способ лечения лишая
- 2140243 Способ хирургического лечения диабетической ретинопатии и отслоек сечатной оболочки
- 2240140 Медицинская многослойная повязка и изделия на ее основе
- 2240135 Культура клеток, содержащая клетки - предшественники остеонегеза, имплантант на ее основе и его использование для восстановления целостности кости
- 2240123 Экзогенные биологически активные коньюгирующие вещества
- 2139886 Фотоотвержаемое производное гликозаминогликата, сшитое производное гликозаминогликата и способы их получения, способ предотвращения клеточной и тканевой адгезии
- 2139729 Вакцина. Способ стимулирования иммунной системы
- 2339386 Средство обладающее радио - и химиозащитным действием
- 2339369 Лечение офтальмологических нарушений с использованием мочевины и ее производных
- 2139041 Гидратантный регенерирующий крем и способ его получения
- 2139039 Косметический суперкрем для ухода за кожей
- 2139017 Способ получения боисовместимого материала
- 2138503 Производные камптотецина, способы их получения, уникальное средство
- 2338556 Средство содержащие антагонист Р2Х - рецептора и нестероидное противоспалительное лекарственное средство
- 2338514 Косметическое средство для профилактики старения кожи
- 2138297 Медицинские устройства, подверженные вызываемому разложению
- 2138295 Покрытие для ран
- 2337906 Ингибиторы цитозольной фосфолипазы А2 Применение физиологически допустимого корпускулярного ферримагнитного или ферромагнитного материала. Способ формирования магнитометрического изображения
- 2137501 Устройство формирования изображения
- 2137477 Способ лечения заболеваний характеризующихся аутоиммунной агрессией
- 2137467 Крем для кожи лица и тела
- 2137449 Способ коррекции дефектов преломления в глазу млекопитающего
- 2137402 Пищевая Добавка БАД
- 2336899 Способ стимуляции миелопоэза
- 2336862 Способ получения раствора для лечения роговицы
- 2336830 Способ восстановления костных структур челюсти
- 2136696 Новый полипептид и средство против ВИЧ - Инфекции
- 2336092 Биоадгезивное средство, по существу свободное от воды
- 2336089 Средство и способ лечения заболеваний периодонтальных и пульпы
- 2336074 Средства и способы лечения заднего сегмента глаза
- 2235548 Ранозаживляющее средство
- 2135186 Способ лечения рефлекторных синдромов при остеохондрозе
- 2234945 Стабилизатор водного раствора и водосодержащего сырья
- 2334762 Растворимая ассоциативная карбоксиметилцеллюлоза
- 2234514 Макропористые хитозановые гранулы и способ их получения. Способ культивирования клеток
- 2133615 Средство для лечения неврологических заболеваний
- 2233164 Способ профилактики развития послеоперационных спаек брюшной полости
- 2133127 Неткатный материал, способ его получения и способ лечения
- 2333223 Альдегидные производные сиаловой кислоты и средства на их основе
- 2333007 Полипептидные вакцины для широкой защиты против рядов поколений менингококов с повышенной вирулентностью
- 2332985 Дозированные формы анестезирующих средств с длительным высвобождением для обезболивания
- 2132677 Косметическая маска
- 38603 Пленочный аппликатор
- 2232594 Средство содержащие ингибирующие остеокластогенез фактор и полисахарид
- 2332238 Средство для прокладок, раневых повязок и других изделий, контактирующих с кожей
- 2331668 Стромальные клетки, получение из жировой ткани, для заживления дефектов роговицы и внутриглазных дефектов и их использование
- 2331438 Альфа - 2 - Дельта Лигант для лечения симптомов нижних мочевыводящих путей
- 2331411Электропряденые аморфные фармоцевтические средства
- 2331367 Способ профилактики образования спаек и их рецидива
- 2130767 Масло в воде для получения косметических и дерматологических средств, способ косметической обработки
- 2230752 Поперечносшитые гиалуроновые кислоты и их применение в медицине
- 2230558 Способ восстановления и сохранения здоровья скмьи
- 2230550 Средства длительного высвобождения, способ их получения и применения
- 2230458 Поддержания здоровья суставов
- 2330290 Способ определения состояния метаболических процессов в ткани суставного хряща
- 2230073 Способ поперечного сшивания карбоксилированных полисахаридов
- 2329059 Способ лечения полипозного риносинусита
- 2329037 Комбинированная терапия для лечения иммуновоспалительных заболеваний
- 2128666 Гиалуроновая кислота и ее соли, способ очистки гиалуроновой кислоты, способ получения гиалуроновой кислоты. Фармацевтический препарат с гиалуроновой кислотой и средства с гиалуроновой кислотой используемые в офтальмологии
- 2328740 Способ экспресс - оценки действия зубных паст
- 2128502 Косметический гель
- 2328272 Суппозитории индуктора интерферона
- 2328268 Косметика содержащая амфолитный сополимер
- 2128057 Композиционная мембрана, способ ее получения и способ направленной регенерации тканей с ее применением
- 2128055 Средство замедленного освобождения и способ его получения
- 2128049 Свечи
- 2227743 Полипептидные варианты с повышенной гепаринсвязывающей способностью
- 2326893 Ковалентное и нековалентное сшивание гидрофильных полимеров
- 2326697 Новый перевязочный материал для быстрого заживления раневой поверхности кожи
- 2126264 Фармацевтическое средство с гиалуроновой кислотой
- 2326137 Способ получения содержащих альгинат пористых формованных изделий
- 2325902 Способ выделения гликозаминогликанов из минерализованной соединительной ткани
- 2225195 Репелленты против насекомых
- 2325193 Сосудистый стент
- 2325184 Улучшенные везикулы наружной мембраны бактерий
- 2325153 Многокомпонентная фармацевтическая дозированная форма
- 2325152 Удерживаемая в желудке система регулируемой доставки лекарственного средства
- 2029955 Способ предоперационного определения помутнения задней капсулы хрусталика при экстракции катаракты
- 2324688 Производные бисбензизоселеназолонила с противоопухолевым, противовоспалительным и антитромбоническим действием
- 2323017 Устройство и способ контролируемый доставки активных веществ в кожу
- 2323011 Содержащий Коллаген I и Коллаген II способный к рассасыванию внеклеточный матрикс, предназначенный для реконструирования хряща
- 2322955 Способ изготовления имплантанта для пластики дефектов хрящевой ткани
- 2322454 Антитело против CCR5
- 2322263 Система продолжительного высвобождения растворимого лекарственного средства
- 2221561 Витамин Е и его сложные эфиры
- 2321634 Гены участвующие в метаболизме углерода и продуцировании энергии
- 2321597 Биоматерьял, способ его приготовления и его применение, медицинское средство, имплантант и вкладыш
- 2121340 Средство для похудения
- 2220737 Средство для улучшения состояния опорно-двигательного аппарата
- 2220729 Гель используемый в стоматологии
- 2320720 Способ культивирования фибропластов для заместительной терапии
- 2320378 Накожный аппликатор
- 2320369 Средства, содержащие Альфа - 2 - Дельта Лиганды и ингибиторы обратного захвата серотонина/норадреналина
- 2320362 Местные фармацевтические средства, содержащие проантоцианидины, для лечения дерматитов
- 2320322 Биоадгезивная доставка лекарств
- 2320318 Чувствительное к температуре изменяющие состояние средство гидрогеля
- 2025120 Способ получения препарата, содержащего Фактор /G-CSF/, стимулирующий рост колоний гранулоцитов
- 2319490 Средство для введения железа при лечении синдрома беспокойных ног
- 25995 Содержащее адгезив приспособление для фиксации зубных протезов в полости рта
- 2218907 Средство для ухода за кожей лица и веками
- 2318830 Способ получения модифицированного дерматансульфата
- 2118153 Косметика - туш для ресниц
- 2217441 Способ получения полимера
- 2317296 Изетионатная соль селективного ингибитора CDK4
- 2217171 Мембрана для использования при направленной регенерации тканей
- 2317095 Экстракты ECHINACEA ANGUSTIFOLIA
- 2216332 Препарат для лечения астроза
- 2216314 Крем - маска для обезвоженной кожи
- 2316333 Средство оздоровительно-восстановительных косметических панто-магниевых ванн
- 2021304 Способ получения биологически активного средства
- 2115662 Способ получения гиалуроновой кислоты
- 2315627 Впрыскиваемые имплантанты на керамической основе для заполнения морщин, кожных впадин, шрамов
- 2315623 Средство получаемое путем лиофилизации препарата
- 2114862 Способ получения гиалуроновой кислоты
- 2314791 Лечебно-Косметическое средство
- 2314791 Косметический крем-бальзам для ухода за кожей лица и шеи
- 2214600 Способ оценки эффективности лечения неврологических проявлений
- 2114602 Способ косметической обработки
- 2114587 Раствор для защиты роговицы
- 2214283 Имплантант для подкожного или внутрикожного введения
- 2313370 Медицинские протезы, имеющие улучшенную биологическую совместимость
- 2313356 Препарат для лечения демодекоза
- 2313338 Средство на основе этиллинолеата и триэтилцитрата для лечения себореи и угрей
- 2313328 Косметика содержащая тонкодисперный и пористый порошок
- 2212880 Способ получения препарата содержащего антибиотик, с замедленным высвобождением активного вещества
- 2312640 Способ лечения Блефароконьюнктивальной формы синдрома сухого глаза
- 2017751 Способ получения гиалуроновой кислоты
- 2312145 Гены CORYNEBACTERIUM GLUTAMICUM, кодирующие белки, участвующие в синтезе мембран и мембранном транспорте
- 2311458 Белки вызывающие измененную иммуногенную реакцию. Способ их получения и использования
- 2311183 Улучшенное разделение с использованием гталуроновой кислоты
- 2311177 Ингибиторы интегрина для лечения заболевания глаз
- 2300069 Косметическая маска
- 2211024 Уход за сухой кожей
- 2310440 Раствор для защиты роговицы от повреждений
- 2309684 Лечение межфалангового остеоатроза узелковой формы
- 2309406 Способ мониторинга фиброза печени у больных хроническим гепатитом с (ХГС)
- 2209088 Опосредованная рецепторами доставка генов с использованием векторов на основе бактериофагов
- 2308967 Уменьшение объема ткани
- 2308962 Средство для опорно-дигательного аппарата
- 2308957 Способ получения препарата для мезотерапии
- 2308954 Средство для лечения ран, содержащее плазму или сыворотку крови
- 2308951 Комплексный способ профилактики вагинальных дисбактериозов
- 2308937 Косметическая биологически активная добавка и косметический литофитокомплекс на ее основе
- 2208638 ДНК (варианты), способ получения белка
- 2207885 Способ подачи небольшого объема лечебного раствора к целевому месту
- 2207858 Лишенные побочных эффектов производные простагландинов для лечения глаукомы
- 2207845 Твердая лекарственная форма пролонгированного действия
- 2207844 Препарат для местного неинвазивного применения
- 2207841 Средства с антиферментативным действием
- 2306335 Стволовые клетки и решетки полученные из жировой ткани
- 2306140 Новые рецепторы для Helicobacter pylori и их применение
- 2205612 Способ эндотелизации IN VITRO протезов кровеносных сосудов
- 2105540 Депигментирующее средство
- 2304960 Косметическое средство для кожи
- 2304616 Гены участвующие в гомеостазе и адаптации
- 2204550Способ получения длинноцепочечной N-Ацилированной кислотой Аминокислот
- 2204415 Способ получения изображения
- 2204394 Средство для лечения грибковых инфекций, желудочных язв
- 2204366 Способ хирургического лечения глаукомы
- 2104034 Вагинальное увлажняющие средство, способ его получения
- 2303991 Биологически активная добавка
- 2303990 БАД
- 2303973 Адсорбирующее изделие
- 2203676 Средство обладающее иммунокорригирующим действием
- 2203672 Способ предупреждения беременности
- 2303635 Гены кодирующие белки резистентности и толерантности к стрессам
- 2303529 Способ фиксации альгинатного геля на твердой фазе, способ получения клеточного чипа на его основе
- 2203078 Способ лечения гнойных ран
- 2302412 Гидразоно-малонитрилы
- 2102400 Способ получения гиалуроновой кислоты
- 2202356 Способ стимуляции репаративных процессов длительно незаживающих ран и трофических язв
- 2202336 Средство для ухода за кожей
- 2302231 Глазные капли
- 2102082 Способ магнитометрического исследования тела человека или животного
- 2301814 Полиакриламидный гидрогель
- 2201765 Гибридные матричные имплантанты и эксплантанты
- 2301677 Биотрансплантант для лечения дегенеративных и трвматических заболеваний хрящевой ткани и способ его получения
- 2301676 Способ лечения ревматизма
- 2301674 Способ лечения больных с переломами нижней челюсти
- 2301661 Средство с регулируемым освобождением и способ его получения
- 2005488 Средство для лечения болезней соединительной ткани
- 2200001 Крем для кожи
|
РОССИЙСКАЯ ФЕДЕРАЦИЯ

ФЕДЕРАЛЬНАЯ СЛУЖБА
ПО ИНТЕЛЛЕКТУАЛЬНОЙ СОБСТВЕННОСТИ
ПАТЕНТАМ И ТОВАРНЫМ ЗНАКАМ
|
Патент №2341296 |
(54) КОМПОЗИЦИИ И СПОСОБЫ ПОКРЫТИЯ МЕДИЦИНСКИХ ИМПЛАНТАТОВ
(57) Реферат:
Изобретение относится к медицине. Описаны медицинские имплантаты, которые высвобождают антрациклин, фторпиримидин, антагонист фолиевой кислоты, подофилотоксин, камптотецин, гидроксимочевину или комплекс платины, тем самым подавляя или снижая частоту развития инфекции, связанной с имплантатом. 3 н. и 80 з.п. ф-лы, 1 ил., 1 табл.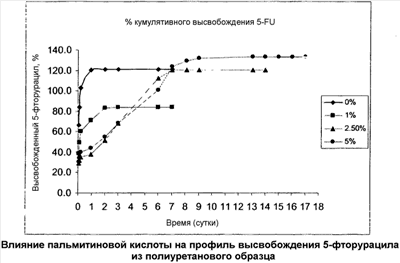
Настоящее изобретение в основном относится к фармацевтическим композициям, способам и устройствам и, конкретнее, к композициям и способам, которые снижают вероятность развития инфекции, связанной с медицинским имплантатом.
Описание предшествующего уровня техники
Инфекции, связанные с медицинскими имплантатами, представляют большую проблему для здравоохранения. Например, у 5% пациентов, поступивших в отделения неотложной помощи, развивается приобретенная в больнице инфекция. Приобретенные в больнице инфекции (нозокомиальные инфекции) занимают 11 место в качестве причины смерти в США, и их лечение ежегодно обходится в 2 биллиона долларов. Нозокомиальные инфекции являются непосредственной причиной смерти 19000 людей ежегодно в США и, так или иначе, вносят свой негативный вклад в более чем 58000 случаев.
Наиболее распространенными четырьмя причинами нозокомиальных инфекций являются инфекция органов мочевой системы (28%); инфекция в месте проведения операции (19%); инфекция дыхательных путей (17%) и инфекция тока крови (16% и выше). Значительный процент данных инфекций связан с колонизацией бактерий на имплантированных медицинских имплантатах, таких как катетеры Фолея (инфекции мочевых путей); хирургические дренажи, сита, шовные материалы, искусственные суставы, сосудистые имплантаты (раневые инфекции); эндотрахеальные и трахеостомические трубки (инфекции дыхательных путей) и сосудистые катетеры для инфузий (инфекции тока крови). Несмотря на то, что любой возбудитель инфекции может инфицировать медицинский имплантат, наиболее распространенными являются стафилококки (S. aureus, S. epidermidis, S. pyogenes), энтерококки (E. coli), грамотрицательные аэробные бациллы и Pseudomonas aeruginosa. В случае, если происходит колонизация медицинского имплантата бактериями, то часто его необходимо заменять, что приводит к повышенной заболеваемости пациентов и повышенной стоимости лечения для системы здравоохранения. Часто инфицированные устройства служат в качестве источника диссеминированной инфекции, которая может привести к высокой заболеваемости или даже фатальному исходу.
Для борьбы с данной серьезной клинической проблемой устройства покрывали антибактериальными препаратами. Показательные примеры включают патент США № 5520664 («Катетер с поверхностью, длительно выделяющей противомикробные препараты»), патент США № 5709672 («Силиконовые и полимерные катетеры с улучшенными противомикробными/противогрибковыми свойствами»), патент США № 6361526 («Тимпаностомические трубки с противомикробными препаратами и способы их приготовления»), патент США № 6261271 («Медицинские устройства с противоинфекционными и антитромбогенными препаратами»), патент США № 5902283 («Пропитанные антибактериальными препаратами катетеры и другие медицинские имплантаты»), патент США № 5624704 («Пропитанные противомикробными препаратами катетеры и другие медицинские имплантаты, и способ пропитки катетеров и других медицинских имплантатов противомикробным средством») и патент США № 5709672 («Силиконовые и полимерные катетеры с улучшенными противомикробными /противогрибковыми свойствами»).
Однако одним недостатком данных устройств является их возможная колонизация бактериями, резистентными к антибиотикам, находящимся в покрытии. Это может приводить, по меньшей мере, к двум различным клиническим проблемам. Во-первых, устройство служит в качестве источника инфекции в организме с развитием в результате местной или диссеминированной инфекции. Во-вторых, если инфекция развивается, то ее невозможно лечить антибиотиком(ами), использованными в покрытии устройства. Развитие устойчивых к антибиотикам штаммов микроорганизмов остается существенной проблемой в здравоохранении, не только для инфицированного пациента, но и для учреждения здравоохранения, в котором она возникает.
Таким образом, в данной области существует необходимость в медицинских имплантатах, которые обладают пониженной вероятностью развития связанной с ними инфекции. В настоящем изобретении раскрываются подобные устройства (а также композиции и способы изготовления подобных устройств), которые снижают вероятность инфицирования медицинских имплантатов, и, кроме того, обеспечивают другие, преимущества.
Краткое описание чертежей
На чертеже показано влияние пальмитиновой кислоты на профиль высвобождения 5-фторурацила из полиуретановой пробы.
Краткое описание изобретения
Кратко констатируется, что настоящее изобретение обеспечивает композиции и способы профилактики, снижения или подавления вероятности возникновения инфекций, связанных с медицинскими имплантатами. Конкретнее, в одном аспекте изобретения обеспечиваются медицинские имплантаты или устройства, которые высвобождают химиотерапевтическое средство, где химиотерапевтическое средство снижает, подавляет или предупреждает рост или распространение чужеродных микроорганизмов (например, бактерий грибов или вирусов), которые находятся на или которые связаны с медицинским устройством или имплантатом. Например, в одном аспекте изобретения обеспечиваются медицинский имплантат или устройства, которые высвобождают антрациклин, фторпиримидин, антагонист фолиевой кислоты, подофилотоксин, камптотецин, гидроксимочевину или комплекс платины. В различных вариантах воплощения имплантат покрыт целиком или частично композицией, содержащей антрациклин, фторпиримидин, антагонист фолиевой кислоты, подофилотоксин, камптотецин, гидроксимочевину или комплекс платины.
Другие аспекты настоящего изобретения обеспечивают способы изготовления медицинских имплантатов, включающих адаптацию медицинского имплантата (например, покрытие имплантата) антрациклином, фторпиримидином, антагонистом фолиевой кислоты, подофилотоксином, камптотецином, гидроксимочевиной или комплексом платины. В некоторых вариантах воплощения желаемое терапевтическое средство наносится на и/или высвобождается из медицинского имплантата в дозе и/или концентрации, которая меньше, чем обычная доза, и/или концентрация средства при его использовании для лечения злокачественных опухолей.
Можно создать самые разнообразные медицинские имплантаты с использованием предлагаемых здесь способов, включая, например, катетеры (например, сосудистые катетеры или катетеры для диализа), сердечные клапаны, кардиостимуляторы, имплантируемые электрические дефибрилляторы сердца, имплантаты (например, сосудистые имплантаты), ушные, носовые или горловые имплантаты, урологические имплантаты, эндотрахеальные или трахеостомические трубки, шунты для ЦНС, ортопедические имплантаты и глазные имплантаты. В некоторых вариантах воплощения катетер (например, сосудистый катетер или катетер для диализа), сердечный клапан, кардиостимулятор, имплантируемый электрический дефибриллятор сердца, имплантат (например, сосудистый имплантат), ушной, носовой или горловой имплантат, урологический имплантат, эндотрахеальная или трахеостомическая трубка, шунт для ЦНС, ортопедический имплантат и глазной имплантат высвобождают фторпиримидин (например, 5-FU) в дозе и/или концентрации, которая используется для лечения злокачественных опухолей.
В дополнительных аспектах изобретения обеспечивается катетер, который высвобождает средство, выбранное из группы, состоящей из антрациклина, фторпиримидина, антагониста фолиевой кислоты, подофилотоксина, камптотецина, гидроксимочевины или комплекса платины. В одном варианте воплощения катетер высвобождает фторпиримидин, и еще в одном варианте воплощения фторпиримидином является 5-FU. В других вариантах воплощения катетер дополнительно содержит полимер, где средство высвобождается из полимера в катетере. В некоторых вариантах воплощения катетер имеет полимер, который представляет собой полиуретан или поли(лактид-со-гликолид)(PLG). В близких вариантах воплощения катетером является сосудистый катетер или катетер для диализа. В других вариантах воплощения катетер высвобождает средство, которое находится в катетере в концентрации, которая меньше, чем обычная доза, и/или концентрации, которая используется для лечения злокачественных опухолей.
В дополнительных аспектах изобретения обеспечивается сердечный клапан, который высвобождает средство, выбранное из группы, состоящей из антрациклина, фторпиримидина, антагониста фолиевой кислоты, подофилотоксина, камптотецина, гидроксимочевины или комплекса платины. В одном варианте воплощения сердечный клапан высвобождает фторпиримидин, и в еще одном варианте воплощения фторпиримидином является 5-FU. В других вариантах воплощения сердечный клапан дополнительно содержит полимер, где средство высвобождается из полимера в сердечном клапане. В некоторых вариантах воплощения сердечный клапан имеет полимер, который представляет собой полиуретан или PLG. В близких вариантах воплощения сердечный клапан представляет собой искусственный сердечный клапан. В других вариантах воплощения сердечный клапан высвобождает средство, которое находится в сердечном клапане в концентрации, которая меньше, чем обычная доза, и/или в концентрации, которая используется для лечения злокачественных опухолей.
В дополнительных аспектах изобретения обеспечивается кардиостимулятор, который высвобождает средство, выбранное из группы, состоящей из антрациклина, фторпиримидина, антагониста фолиевой кислоты, подофилотоксина, камптотецина, гидроксимочевины или комплекса платины. В одном варианте воплощения кардиостимулятор высвобождает фторпиримидин, и в еще одном варианте воплощения фторпиримидином является 5-FU. В других вариантах воплощения кардиостимулятор дополнительно содержит полимер, где средство высвобождается из полимера в кардиостимуляторе. В некоторых вариантах воплощения кардиостимулятор имеет полимер, который представляет собой полиуретан или PLG. В других вариантах воплощения кардиостимулятор высвобождает средство, которое находится в кардиостимуляторе в концентрации, которая меньше, чем обычная доза, и/или в концентрации, которая используется для лечения злокачественных опухолей.
В дополнительных аспектах изобретения обеспечивается имплантируемый электрический дефибриллятор сердца, который высвобождает средство, выбранное из группы, состоящей из антрациклина, фторпиримидина, антагониста фолиевой кислоты, подофилотоксина, камптотецина, гидроксимочевины или комплекса платины. В одном варианте воплощения имплантируемый электрический дефибриллятор сердца высвобождает фтопиримидин, и в еще одном варианте воплощения фторпиримидином является 5-FU. В других вариантах воплощения имплантируемый электрический дефибриллятор сердца дополнительно содержит полимер, где средство высвобождается из полимера в имплантируемом электрическом дефибрилляторе сердца. В некоторых других вариантах воплощения имплантируемый электрический дефибриллятор сердца имеет полимер, который представляет собой полиуретан или PLG. В других вариантах воплощения имплантируемый электрический дефибриллятор сердца высвобождает средство, которое находится в имплантируемом электрическом дефибрилляторе сердца в концентрации, которая меньше, чем обычная доза, и/или в концентрации, которая используется для лечения злокачественных опухолей.
В дополнительных аспектах изобретения обеспечивается имплантат, который высвобождает средство, выбранное из группы, состоящей из антрациклина, фторпиримидина, антагониста фолиевой кислоты, подофилотоксина, камптотецина, гидроксимочевины или комплекса платины. В одном варианте воплощения имплантат высвобождает фторпиримидин, и в еще одном варианте воплощения фторпиримидином является 5-FU. В других вариантах воплощения имплантат дополнительно содержит полимер, где средство высвобождается из полимера в имплантате. В некоторых вариантах воплощения имплантат имеет полимер, который представляет собой полиуретан или PLG. В близких вариантах воплощения имплантат представляет имплантат сосуда или имплантат для доступа при гемодиализе. В других вариантах воплощения имплантат высвобождает средство, которое находится в имплантате в концентрации, которая меньше, чем обычная доза, и/или в концентрации, которая используется для лечения злокачественных опухолей.
В дополнительных аспектах изобретения обеспечивается ушной, носовой или горловой имплантат, который высвобождает средство, выбранное из группы, состоящей из антрациклина, фторпиримидина, антагониста фолиевой кислоты, подофилотоксина, камптотецина, гидроксимочевины или комплекса платины. В одном варианте воплощения ушной, носовой или горловой имплантат высвобождает фторпиримидин, и в еще одном варианте воплощения фторпиримидином является 5-FU. В других вариантах воплощения ушной, носовой или горловой имплантат дополнительно содержит полимер, где средство высвобождается из полимера в ушном, носовом или горловом имплантате. В некоторых вариантах воплощения ушной, носовой или горловой имплантат имеет полимер, который представляет собой полиуретан или PLG. В близких вариантах воплощения ушной, носовой или горловой имплантат представляет собой тимпаностомическую трубку или синусный стент. В других вариантах воплощения ушной, носовой или горловой имплантат высвобождает средство, которое находится в ушном, носовом или горловом имплантате в концентрации, которая меньше, чем обычная доза, и/или в концентрации, которая используется для лечения злокачественных опухолей.
В других аспектах изобретения обеспечивается урологический имплантат, который высвобождает средство, выбранное из группы, состоящей из антрациклина, фторпиримидина, антагониста фолиевой кислоты, подофилотоксина, камптотецина, гидроксимочевины или комплекса платины. В одном варианте воплощения урологический имплантат высвобождает фторпиримидин, и в еще одном варианте воплощения фторпиримидином является 5-FU. В других вариантах воплощения урологический имплантат дополнительно содержит полимер, где средство высвобождается из полимера в урологическом имплантате. В некоторых вариантах воплощения урологический имплантат имеет полимер, который представляет собой полиуретан или PLG. В близких вариантах воплощения урологический имплантат представляет собой уретральный катетер, мочеточниковый стент, уретральный стент, сфинктер мочевого пузыря или имплантат полового члена. В других вариантах воплощения урологический имплантат высвобождает средство, которое находится в урологическом имплантате в концентрации, которая меньше, чем обычная доза, и/или в концентрации, которая используется для лечения злокачественных опухолей.
В дополнительных аспектах изобретения обеспечивается эндотрахеальная или трахеостомическая трубка, которая высвобождает средство, выбранное из группы, состоящей из антрациклина, фторпиримидина, антагониста фолиевой кислоты, подофилотоксина, камптотецина, гидроксимочевины или комплекса платины. В одном варианте воплощения эндотрахеальная или трахеостомическая трубка высвобождает фторпиримидин, и в еще одном варианте воплощения фторпиримидином является 5-FU. В других вариантах воплощения эндотрахеальная или трахеостомическая трубка дополнительно содержит полимер, где средство высвобождается из полимера в эндотрахеальной или трахеостомической трубке. В некоторых вариантах воплощения эндотрахеальная или трахеостомическая трубка имеет полимер, который представляет собой полиуретан или PLG. В других вариантах воплощения эндотрахеальная или трахеостомическая трубка высвобождает средство, которое находится в эндотрахеальной или трахеостомической трубке в концентрации, которая меньше, чем обычная доза, и/или в концентрации, которая используется для лечения злокачественных опухолей.
В дополнительных аспектах изобретения обеспечивается шунт для ЦНС, который высвобождает средство, выбранное из группы, состоящей из антрациклина, фторпиримидина, антагониста фолиевой кислоты, подофилотоксина, камптотецина, гидроксимочевины или комплекса платины. В одном варианте воплощения шунт для ЦНС высвобождает фторпиримидин, и в еще одном варианте воплощения фторпиримидином является 5-FU. В других вариантах воплощения шунт для ЦНС дополнительно содержит полимер, где средство высвобождается из полимера в шунте для ЦНС. В некоторых вариантах воплощения шунт для ЦНС имеет полимер, который представляет собой полиуретан или PLG. В близких вариантах воплощения шунт для ЦНС представляет собой вентрикулоплевральный шунт, VA-шунт или VP-шунт. В других вариантах воплощения шунт для ЦНС высвобождает средство, которое находится в шунте для ЦНС в концентрации, которая меньше, чем обычная доза, и/или в концентрации, которая используется для лечения злокачественных опухолей.
В дополнительных аспектах изобретения обеспечивается ортопедический имплантат, который высвобождает средство, выбранное из группы, состоящей из антрациклина, фторпиримидина, антагониста фолиевой кислоты, подофилотоксина, камптотецина, гидроксимочевины или комплекса платины. В одном варианте воплощения ортопедический имплантат высвобождает фторпиримидин, и в еще одном варианте воплощения фторпиримидином является 5-FU. В других вариантах воплощения ортопедический имплантат дополнительно содержит полимер, где средство высвобождается из полимера в ортопедическом имплантате. В некоторых вариантах воплощения ортопедический имплантат имеет полимер, который представляет собой полиуретан или PLG. В близких вариантах воплощения ортопедический имплантат представляет собой искусственный сустав или устройство для фиксации. В других вариантах воплощения ортопедический имплантат высвобождает средство, которое находится в ортопедическом имплантате в концентрации, которая меньше, чем обычная доза, и/или в концентрации, которая используется для лечения злокачественных опухолей.
В других аспектах изобретения обеспечивается глазной имплантат, который высвобождает средство, выбранное из группы, состоящей из антрациклина, фторпиримидина, антагониста фолиевой кислоты, подофилотоксина, камптотецина, гидроксимочевины или комплекса платины. В одном варианте воплощения глазной имплантат высвобождает фторпиримидин, и в еще одном варианте воплощения фторпиримидином является 5-FU. В других вариантах воплощения глазной имплантат дополнительно содержит полимер, где средство высвобождается из полимера в глазном имплантате. В некоторых вариантах воплощения глазной имплантат имеет полимер, который представляет собой полиуретан или PLG. В близких вариантах воплощения глазной имплантат представляет собой внутриглазные линзы или контактные линзы. В других вариантах воплощения глазной имплантат высвобождает средство, которое находится в глазном имплантате в концентрации, которая меньше, чем обычная доза, и/или в концентрации, которая используется для лечения злокачественных опухолей.
В других аспектах изобретения обеспечиваются композиции, содержащие полимер и антрациклин, фторпиримидин, антагонист фолиевой кислоты, подофилотоксин, камптотецин, гидроксимочевину или комплекс платины, где указанные антрациклин, фторпиримидин, антагонист фолиевой кислоты, подофилотоксин, камптотецин, гидроксимочевина или комплекс платины находятся в указанной композиции в количестве, по меньшей мере, ниже 10-4 М, 10-5 М, 10-6 М или 10-7 М.
Также обеспечиваются способы снижения или подавления инфекции, связанной с медицинским имплантатом, включающие стадию введения пациенту медицинского имплантата, который покрыт антрациклином, фторпиримидином, антагонистом фолиевой кислоты, подофилотоксином, камптотецином, гидроксимочевиной или комплексом платины.
В различных вариантах воплощения, указанных выше, антрациклин представляет собой доксорубицин или митоксантрон, фторпиримидин представляет собой 5-фторурацил, антагонист фолиевой кислоты представляет собой метотрексат, и подофилотоксин представляет собой этопозид. В дополнительных вариантах воплощения композиция дополнительно содержит полимер.
Эти и другие аспекты настоящего изобретения станут понятными при обращении к последующему подробному описанию и прилагаемым фигурам. Кроме того, здесь приведены различные источники, которые описывают более подробно некоторые способы и композиции (например, соединения или средства, и способы получения таких соединений или средств и т.д.) и, следовательно, они в полном объеме включены в описание изобретения путем ссылки. При обращении к заявкам РСТ также следует понимать, что лежащие в основе или цитированные заявки на патент США также в полном объеме включены в описание путем ссылки.
Подробное описание изобретения
Перед изложением сущности изобретения может быть полезным для его понимания представить определения некоторых терминов, которые будут использоваться в дальнейшем.
«Медицинский имплантат» относится к устройствам или предметам, которые имплантируют или вводят в организм. Показательные примеры включают сосудистые катетеры, искусственные сердечные клапаны, кардиостимуляторы, имплантируемые электрические дефибрилляторы, имплантаты сосудов, ушные, носовые или горловые имплантаты, урологические имплантаты, эндотрахеальные или трахеостомические трубки, катетеры для диализа, шунты для ЦНС, ортопедические имплантаты и глазные имплантаты.
В том смысле, в котором он здесь используется, термин «примерно» или «состоит в основном из» относится к ±15% любой указанной структуры, значения или предела. Любые указанные здесь цифровые пределы следует понимать как включающие любое целое число в пределах и где применима (например, в отношении концентраций) его часть такая как одна десятая и одна сотая целого числа (если не указано иначе).
Кратко, как указано выше, настоящее изобретение раскрывает медицинские имплантаты (а также композиции и способы изготовления медицинских имплантатов), которые снижают вероятность развития инфекций в медицинских имплантатах. Конкретнее, как указывалось выше, инфекция является распространенным осложнением при имплантации чужеродных тел, таких как медицинские устройства. Чужеродные вещества представляют собой идеальное место для прикрепления и колонизации микроорганизмов. Также гипотетически можно предположить, что имеется нарушение защитных механизмов хозяина от инфекции в микросреде, окружающей чужеродное вещество. Данные факторы делают медицинские имплантаты особенно предрасположенными к инфицированию и делают в большинстве случаев ликвидацию подобной инфекции затруднительной, если даже невозможной.
Повреждение медицинского имплантата в результате инфекции, с или без необходимости в замене имплантата, приводит к тяжелым болезненным состояниям, смертности и расходам для системы здравоохранения. Поскольку имеется широкий ряд возбудителей, способных инфицировать медицинские имплантаты, то имеется насущная потребность в препаратах, с помощью которых можно было бы подавлять рост различного спектра бактерий и грибов на имплантируемых устройствах. Настоящее изобретение направлено на решение данной проблемы посредством препаратов, которые могут высвобождаться из имплантируемого устройства и которые обладают высокой антибактериальной активностью в очень низких дозах. Кроме того, данные средства обладают дополнительным преимуществом, заключающимся в том, что при развитии резистентности к химиотерапевтическому средству препарат, используемый для покрытия, будет другим, чем те, с помощью которых будут бороться с последующей инфекцией (т.е. при развитии резистентности бактерий это будет иное средство, чем то, которое применяется в качестве антибиотика).
Обсуждаемое ниже более подробно представляет (I) средства; (II) композиции и составы; (III) устройства и (IV) клинические применения.
I. Средства
Кратко, в контексте настоящего изобретения можно использовать самые разнообразные средства (также относящиеся здесь к «терапевтическим средствам» или «лекарственным препаратам») с носителем или без носителя (например, полимера, см. раздел II ниже). Более подробно ниже обсуждаются (А) антрациклины (например, доксорубицин и митоксантрон), (В) фторпиримидины (например, 5-FU), (С) антагонисты фолиевой кислоты (например, метотрексат), (D) подофилотоксины (например, этопозид), (Е) камтотецины, (F) гидроксимочевины и (G) комплексы платины (например, цисплатин).
А. Антрациклины
Антрациклины имеют следующую общую структуру, где радикалы R могут представлять собой различные органические группы:
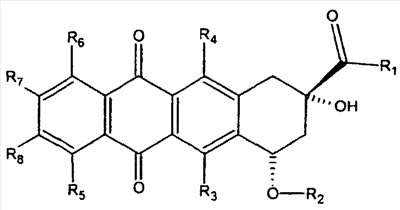
Согласно патенту США № 5594158 подходящие группы R являются следующими: R1 представляет собой CH3 или CH2OH; R2 представляет собой дауносамин или H; R3 и R4 независимо представляют собой одно из OH, NO2, NH2, F, Cl, Br, I, CN, H или группы их производных; R5 представляет собой водород, гидрокси или метокси; и R6-8 все представляют собой водород. Альтернативно R5 и R6 представляют собой водород, и R7 и R8 представляют собой алкил или галоген или наоборот.
Согласно патенту США № 5843903 R1 может представлять собой конъюгированный пептид. Согласно патенту США № 4296105 R5 может представлять собой эфирный связанный алкил. Согласно патенту США № 4215062 R5 может представлять собой ОН или эфирный связанный алкил. R1 также может быть связан с антрациклиновым кольцом посредством иной группы, чем С(О), такой как алкил или разветвленный алкил, имеющий связующую группу С(О) на ее конце, такую как -CH2CH(CH2-X)C(O)-R1, где Х является Н или алкильной группой (см., например, патент США № 4215062). Альтернативно R2 может представлять собой группу, связанную с функциональной группой =N-NHC(O)-Y, где Y представляет собой группу, такую как фенильное или замещенное фенильное кольцо. Альтернативно R3 может иметь следующую структуру:
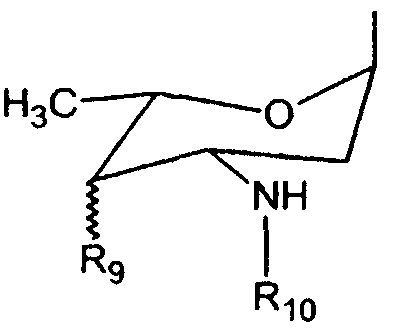
в которой R9 представляет собой ОН либо в плоскости кольца, либо вне ее, или вторую группу сахара, такую как R3. R10 может представлять собой Н или образовывать вторичный амин с группой, такой как ароматическая группа; насыщенный или частично насыщенный 5- или 6-членный гетероцикл, имеющий в кольце, по меньшей мере, один атом азота (смотри, патент США № 5843903). Альтернативно, R10 может быть производным аминокислоты, имеющим структуру -C(O)CH(NHR11)(R12), в котором R11 представляет собой Н или образует с R12 С3-4-членный алкилен. R12 может представлять собой Н, алкил, аминоалкил, амино, гидрокси, меркапто, фенил, бензил или метилтио (см. патент США № 4296105).
Примерами антрациклинов являются доксорубицин, даунорубицин, идарубицин, эпирубицин, пирарубицин, зорубицин и карубицин. Подходящие соединения имеют структуры:
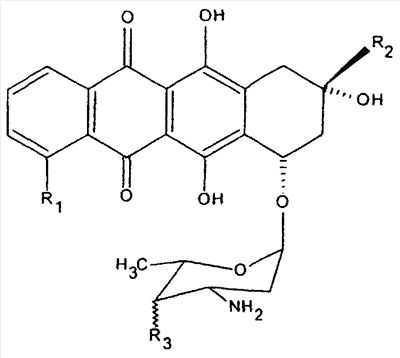
| |
R1 |
R2 |
R3 |
| Доксорубицин |
OCH3 |
C(O)CH2OH |
ОН вне плоскости кольца |
| Эпирубицин: (4' эпимер доксорубицина) |
OCH3 |
C(O)CH2OH |
ОН внутри плоскости кольца |
| Даунорубицин |
OCH3 |
C(O)CH3 |
ОН вне плоскости кольца |
| Идарубицин |
H |
C(O)CH3 |
ОН вне плоскости кольца |
| Пирарубицин |
OCH3 |
C(O)CH2OH |
 |
| Зорубицин |
OCH3 |
C(CH3)(=N)NHC(O)C6H5 |
ОН |
| Карубицин |
ОН |
C(O)CH3 |
ОН вне плоскости кольца |
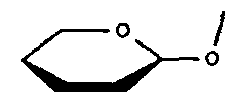
Другими подходящими антрациклинами являются антрамицин, митоксантрон, меногарил, ногаламицин, аклациномицин А, оливомицин А, хромомицин А3 и пликамицин, имеющие структуры: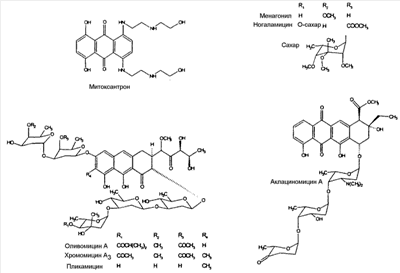
Другие показательные антрациклины включают производное доксорубицина FCE 23762 (Quaglia et al., J. Liq. Chromatogr. 17(18):3911-3923, 1994), аннамицин (Zou et al., J. Pharm. Sci. 82(11):1151-1154, 1993), рубоксил (Rapoport et al., J. Controlled Release 58(2):153-162, 1999), аналог дисахарида антрациклина доксорубицина (Pratesi et al., Clin. Cancer Res. 4(11):2833-2839, 1998), N-(трифторацетил)доксорубицин и 4'-О-ацетил-N-(трифторацетил)доксорубицин (Berube & Lepage, Synth. Commun. 28(6):1109-1116, 1998), 2-пирролинодоксорубицин (Nagy et al., Proc. Nat'l Acad. Sci. U.S.A. 95(4):1794-1799, 1998), аналоги дисахарида доксорубицина (Arcamone et al., J. Nat'l Cancer Inst. 89(16):1217-1223, 1997), аналог доксорубицина 4-деметокси-7-О-[2,6-дидезокси-4-О-(2,3,6-тридезокси-3-амино- -L-ликсо-гексопиранозил)- -L-ликсо-гексопиранозил)- -L-ликсо-гексопиранозил]адриамицинон дисахарид (Monteagudo et al., Carbohydr. Res. 300(1):11-16, 1997), 2-пирролинодоксорубицин (Nagy et al., Proc. Nat'l Acad. Sci. U.S.A. 94(2):652-656, 1997), аналоги доксорубицина, содержащие группу морфолинил (Duran et al., Cancer Chemother. Pharmacol. 38(3):210-216, 1996), производные доксорубицина, содержащие энаминомалонил- -L-ликсо-гексопиранозил]адриамицинон дисахарид (Monteagudo et al., Carbohydr. Res. 300(1):11-16, 1997), 2-пирролинодоксорубицин (Nagy et al., Proc. Nat'l Acad. Sci. U.S.A. 94(2):652-656, 1997), аналоги доксорубицина, содержащие группу морфолинил (Duran et al., Cancer Chemother. Pharmacol. 38(3):210-216, 1996), производные доксорубицина, содержащие энаминомалонил- -аланин (Seitz et al., Tetrahedron Lett. 36(9):1413-16, 1995), цефалоспориновые производные доксорубицина (Vrudhula et al., J. Med. Chem. 38(8):1380-5, 1995), гидроксирубицин (Solary et al., Int. J. Cancer 58(1):85-94, 1994), производное доксорубицина, содержащее группу метоксиморфолино (Kuhl et al., Cancer Chemother. Pharmacol. 33(1):10-16, 1993), производные доксорубицина на основе (6-малеимидокапроил)гидразона (Willner et al., Bioconjugate Chem. 4(6):521-7, 1993), N-(5,5-диацетоксипент-1-ил) доксорубицина (Cherif & Farquhar, J. Med. Chem. 35(17):3208-14, 1992), производное доксорубицина, содержащее группу метоксиморфолинил, FCE 23762 (Ripamonti et al., Br. J. Cancer 65(5):703-7, 1992), производные N-гидроксисукцинимидового эфира доксорубицина (Demant et al., Biochim. Biophys. Acta 1118(1):83-90, 1991), полидезоксинуклеотидные производные доксорубицина (Ruggiero et al., Biochim. Biophys. Acta 1129(3):294-302, 1991), производные доксорубицина, содержащие группу морфолинил (Европейский патент 434960), аналог доксорубицина митоксантрон (Krapcho et al., J. Med. Chem. 34(8):2373-80, 1991), аналог доксорубицина AD198 (Traganos et al., Cancer Res. 51(14):3682-9, 1991), 4-деметокси-3'-N-трифторацетилдоксорубицин (Horton et al., Drug. Des. Delivery 6(2):123-9, 1990), 4'-эпидоксорубицин (Drzewoski et al., Pol. J. Pharmacol. Pharm. 40(2):159-65, 1988; Weenen et al., Eur. J. Cancer Clin. Oncol. 20(7):919-26, 1984), алкилирующее производное доксорубицина, содержащее группу цианоморфолино (Scudder et al., J. Nat'l Cancer Inst. 80(16):1294-8, 1988), дезоксидигидройододоксорубицин (Европейский патент 275966), адрибластин (Kalishevskaya et al., Vestn. Mosk. Univ., 16(Biol. 1):21-7, 1988), 4'-дезоксидоксорубицин (Schoelzel et al., Leuk. Res. 10(12):1455-9, 1986), 4-деметиокси-4'-о-метилдоксорубицин (Giuliani et al., Proc. Int. Congr. Chemother. 16:285-70-285-77, 1983), 3'-деамино-3'-гидроксидоксорубицин (Horton et al., J. Antibiot. 37(8):853-8, 1984), аналоги 4-деметиоксидоксорубицина (Barbieri et al., Drugs Exp. Clin. Res. 10(2):85-90, 1984), производные N-L-лейцилдоксорубицин (Trouet et al., Antharacyclines (Proc. Int. Symp. Tumor Pharmacother.), 179-81, 1983), производные 3'-деамино-3'-(4-метокси-1-пиперидинил)доксорубицина (патент США № 4314054), производные 3'-деамино-3'-(4-мортолинил)доксорубицина (патент США № 4301277), 4'-дезоксидоксорубицин и 4'-о-метилдоксорубицин (Giuliani et al., Int. J. Cancer 27(1):5-13, 1981), производные агликонов доксорубицина (Chan & Watson, J. Pharm. Sci. 67(12):1748-52, 1978), SM 5887 (Pharma Japan 1468-20: 1995), MX-2 (Pharma Japan 1420:19, 1994), 4'-дезокси-13(S)-дигидро-4'-йододоксорубицин (EP 275966), производные морфонинилдоксорубицина (Европейский патент 434960), производные 3'-деамино-3'-(4-метокси-1-пиперидинил)доксорубицина (патент США № 4314054), доксорубицин-14-валерат, морфолинодоксорубицин (патент США № 5004606,) 3'-деамино-3'-(3"-циано-4"-морфолинилдоксорубицин; 3'-деамино-3'-(3"-циано-4"-морфолинил)-13-дигидродоксорубицин; (3'-деамино-3'-(3"-циано-4"-морфолинил)даунорубицин; 3'-деамино-3'-(3"-циано-4"-морфолинил)-3-дигидродаунорубицин и 3'-деамино-3'-(4"-морфолинил-5-иминодоксорубицин и их производные (патент США № 4585859), производные 3'-деамино-3'-(4-метокси-1-пиперидинил)доксорубицина (патент США № 4314054) и производные 3-деамино-3-(4-морфолинил)доксорубицина (патент США № 4301277). -аланин (Seitz et al., Tetrahedron Lett. 36(9):1413-16, 1995), цефалоспориновые производные доксорубицина (Vrudhula et al., J. Med. Chem. 38(8):1380-5, 1995), гидроксирубицин (Solary et al., Int. J. Cancer 58(1):85-94, 1994), производное доксорубицина, содержащее группу метоксиморфолино (Kuhl et al., Cancer Chemother. Pharmacol. 33(1):10-16, 1993), производные доксорубицина на основе (6-малеимидокапроил)гидразона (Willner et al., Bioconjugate Chem. 4(6):521-7, 1993), N-(5,5-диацетоксипент-1-ил) доксорубицина (Cherif & Farquhar, J. Med. Chem. 35(17):3208-14, 1992), производное доксорубицина, содержащее группу метоксиморфолинил, FCE 23762 (Ripamonti et al., Br. J. Cancer 65(5):703-7, 1992), производные N-гидроксисукцинимидового эфира доксорубицина (Demant et al., Biochim. Biophys. Acta 1118(1):83-90, 1991), полидезоксинуклеотидные производные доксорубицина (Ruggiero et al., Biochim. Biophys. Acta 1129(3):294-302, 1991), производные доксорубицина, содержащие группу морфолинил (Европейский патент 434960), аналог доксорубицина митоксантрон (Krapcho et al., J. Med. Chem. 34(8):2373-80, 1991), аналог доксорубицина AD198 (Traganos et al., Cancer Res. 51(14):3682-9, 1991), 4-деметокси-3'-N-трифторацетилдоксорубицин (Horton et al., Drug. Des. Delivery 6(2):123-9, 1990), 4'-эпидоксорубицин (Drzewoski et al., Pol. J. Pharmacol. Pharm. 40(2):159-65, 1988; Weenen et al., Eur. J. Cancer Clin. Oncol. 20(7):919-26, 1984), алкилирующее производное доксорубицина, содержащее группу цианоморфолино (Scudder et al., J. Nat'l Cancer Inst. 80(16):1294-8, 1988), дезоксидигидройододоксорубицин (Европейский патент 275966), адрибластин (Kalishevskaya et al., Vestn. Mosk. Univ., 16(Biol. 1):21-7, 1988), 4'-дезоксидоксорубицин (Schoelzel et al., Leuk. Res. 10(12):1455-9, 1986), 4-деметиокси-4'-о-метилдоксорубицин (Giuliani et al., Proc. Int. Congr. Chemother. 16:285-70-285-77, 1983), 3'-деамино-3'-гидроксидоксорубицин (Horton et al., J. Antibiot. 37(8):853-8, 1984), аналоги 4-деметиоксидоксорубицина (Barbieri et al., Drugs Exp. Clin. Res. 10(2):85-90, 1984), производные N-L-лейцилдоксорубицин (Trouet et al., Antharacyclines (Proc. Int. Symp. Tumor Pharmacother.), 179-81, 1983), производные 3'-деамино-3'-(4-метокси-1-пиперидинил)доксорубицина (патент США № 4314054), производные 3'-деамино-3'-(4-мортолинил)доксорубицина (патент США № 4301277), 4'-дезоксидоксорубицин и 4'-о-метилдоксорубицин (Giuliani et al., Int. J. Cancer 27(1):5-13, 1981), производные агликонов доксорубицина (Chan & Watson, J. Pharm. Sci. 67(12):1748-52, 1978), SM 5887 (Pharma Japan 1468-20: 1995), MX-2 (Pharma Japan 1420:19, 1994), 4'-дезокси-13(S)-дигидро-4'-йододоксорубицин (EP 275966), производные морфонинилдоксорубицина (Европейский патент 434960), производные 3'-деамино-3'-(4-метокси-1-пиперидинил)доксорубицина (патент США № 4314054), доксорубицин-14-валерат, морфолинодоксорубицин (патент США № 5004606,) 3'-деамино-3'-(3"-циано-4"-морфолинилдоксорубицин; 3'-деамино-3'-(3"-циано-4"-морфолинил)-13-дигидродоксорубицин; (3'-деамино-3'-(3"-циано-4"-морфолинил)даунорубицин; 3'-деамино-3'-(3"-циано-4"-морфолинил)-3-дигидродаунорубицин и 3'-деамино-3'-(4"-морфолинил-5-иминодоксорубицин и их производные (патент США № 4585859), производные 3'-деамино-3'-(4-метокси-1-пиперидинил)доксорубицина (патент США № 4314054) и производные 3-деамино-3-(4-морфолинил)доксорубицина (патент США № 4301277).
В. Аналоги фторпиримидина
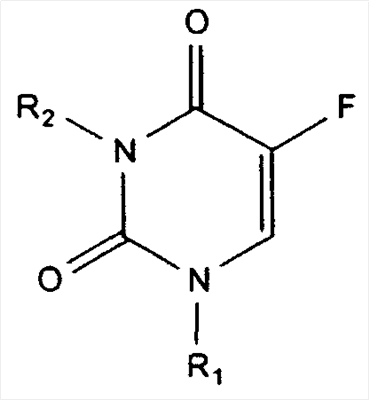
В другом аспекте терапевтическое средство представляет собой аналог фторпиримидина, такой как 5-фторурацил или его аналог или производное, включая кармофур, доксифлуридин, эмитефур, тегафур и флоксуридин. Примерные соединения имеют структуру:
| |
R1 |
R2 |
| 5-фторурацил |
H |
H |
| Кармофур |
C(O)NH(CH2)5CH3 |
H |
| Доксифлуридин |
A1 |
H |
| Флоксуридин |
A2 |
H |
| Эмитефур |
CH2OCH2CH3 |
B |
| Тегафур |
C |
H |
Другие подходящие аналоги фторпиримидина включают 5-FudR (5-фтордезоксиуридин) или его аналог или производное, включая 5-йдодезоксиуридин (5-IudR), 5-бромдезоксиуридин (5-BudR), фторуридина трифосфат (5-FUTP) и фтордезоксиуридина монофосфат (5-dFUMP). Примерные соединения имеют структуры:
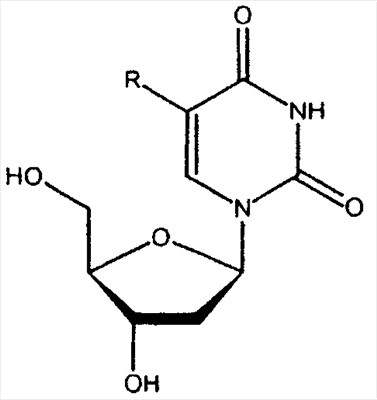
| 5-Фтор-2'-дезоксиуридин: |
R = F |
| 5-Бром-2'-дезоксиуридин: |
R = Br |
| 5-Йод-2'-дезоксиуридин: |
R = I |
Другие показательные примеры аналогов фторпиримидина включают N3-алкилированные аналоги 5-фторурацила (Kozai et al., J. Chem. Soc., Perkin Trans. 1(19):3145-3146, 1998), производные 5-фторурацила с группами 1,4-оксагетероэпана (Gomez et al., Tetrahedron 54(43):13295-13312, 1998), 5-фторурацил и нуклеозидные аналоги (Li, Anticancer Res. 17(1A):21-27, 1997), цис- и транс-5-фтор-5,6-дигидро-6-алкоксиурацил (Van der Wilt et al., Br. J. Cancer 68(4):702-7, 1993), аналоги циклопентан-5-фторурацила (Hronowski & Szarek, Can. J. Chem. 70(4):1162-9, 1992), A-OT-фторурацил (Zhang et al., Zongguo Yiyao Gongye Zazhi 20(11):513-15, 1989), N4-триметоксибензоил-5'-дезокси-5-фторцитидин и 5'-дезокси-5-фторуридин (Miwa et al., Chem. Pharm. Bull. 38(4):998-1003, 1990), 1-гексилкарбамоил-5-фторурацил (Hoshi et al., J. Pharmacobio-Dun. 3(9):478-81, 1980; Maehara et al., Chemotherapy (Basel) 34(6):484-9, 1988), B-3839 (Prajda et al., In Vivo 2(2):151-4, 1988), урацил-1-(2-тетрагидрофурил)-5-фторурацил (Anai et al., Oncology 45 (3):144-7, 1988), 1-(2'-дезокси-2'-фтор- -D-арабинофуранозил)-5-фторурацил (Suzuko et al., Mol. Pharmacol. 31(3):301-6, 1987), доксифлуридин (Matuura et al., Oyo Yakuri 29(5):803-31, 1985), 5'-дезокси-5-фторуридин (Bollag & Hartmann, Eur. J. Cancer 16(4):427-32, 1980), 1-аетил-3-O-толуил-5-фторурацил (Okada, Hiroshima J. Med. Sci. 28(1):49-66, 1979), 5-фторурацил-м-формилбензолсульфонат (патентная публикация Японии № 55059173), N'-(2-фуранидил)-5-фторурацил (патентная публикация Японии № 53149985) и 1-(2-тетрагидрофурил)-5-фторурацил (патентная публикация Японии № 52089680). -D-арабинофуранозил)-5-фторурацил (Suzuko et al., Mol. Pharmacol. 31(3):301-6, 1987), доксифлуридин (Matuura et al., Oyo Yakuri 29(5):803-31, 1985), 5'-дезокси-5-фторуридин (Bollag & Hartmann, Eur. J. Cancer 16(4):427-32, 1980), 1-аетил-3-O-толуил-5-фторурацил (Okada, Hiroshima J. Med. Sci. 28(1):49-66, 1979), 5-фторурацил-м-формилбензолсульфонат (патентная публикация Японии № 55059173), N'-(2-фуранидил)-5-фторурацил (патентная публикация Японии № 53149985) и 1-(2-тетрагидрофурил)-5-фторурацил (патентная публикация Японии № 52089680).
Полагают, что данные соединения действуют в качестве терапевтических средств, будучи антиметаболитами пиримидина.
С. Антагонисты фолиевой кислоты
В другом аспекте терапевтическое средство представляет собой антагонист фолиевой кислоты, такой как метотрексат или его производные, или его аналоги, включая эдатрексат, триметрексат, ралтитрексед, пиритрексим, деноптерин, томудекс и птероптерин. Аналоги метотрексата имеют следующую общую структуру:
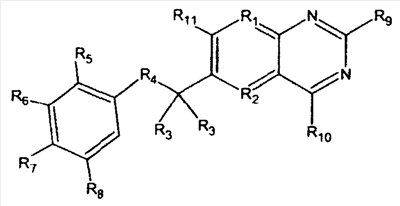
Группа R может быть выбрана из органических групп, в частности групп, представленных в патентах США №№ 5166149 и 5382582. Например, R1 может представлять собой N, R2 может быть N или С(СН3), R3 и R3 ' могут представлять собой Н или алкил, например СН3, R4 может быть простой связью или NR, где R представляет собой Н или алкильную группу. R5,6,8 могут представлять собой Н, ОСН3 или альтернативно они могут быть атомами галогена или гидроксигруппами. R7 представляет собой боковую цепь общей структуры:
где n = 1 для метотрексата, n = 3 для птероптерина. Карбоксильные группы в боковой цепи могут быть эстерифицированы или образовывать соль, такую как соль Zn2+. R9 и R10 могут представлять собой NH2 или замещенный алкил.
Примерные антагонисты фолиевой кислоты имеют структуры:
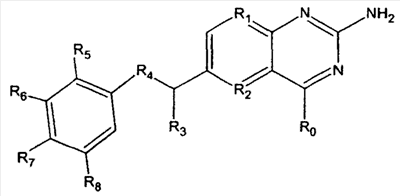
| |
R0 |
R1 |
R2 |
R3 |
R4 |
R5 |
R6 |
R7 |
R8 |
| Метотрексат |
NH2 |
N |
N |
H |
N(CH3) |
H |
H |
A(n=1) |
H |
| Эдатрексат |
NH2 |
N |
N |
H |
CH(CH2CH3) |
H |
H |
A(n=1) |
H |
| Триметрексат |
NH2 |
CH |
CH |
H |
NH |
H |
OCH3 |
OCH3 |
OCH3 |
| Птероптерин |
OH |
N |
N |
H |
NH |
H |
H |
A(n=3) |
H |
| Деноптерин |
OH |
N |
N |
CH3 |
N(CH3) |
H |
H |
A(n=1) |
H |
| Перитрексин |
NH2 |
N |
C(CH3) |
H |
Простая связь |
OCH3 |
H |
H |
OCH3 |
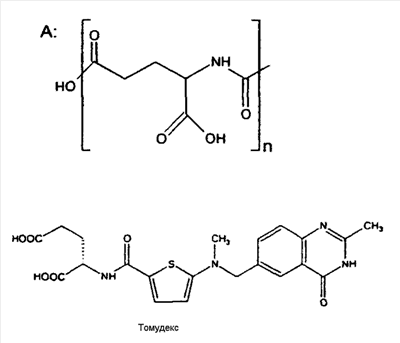
Другие показательные примеры включают производные 6-S-аминоацилоксиметилмеркаптопурина (Harada et al., Chem. Pharm. Bull. 43(10):793-6, 1995), 6-меркаптопурин (6-МР) (Kashida et al., Biol. Pharm. Bull. 18(11):1492-7, 1995), 7,8-полиметиленимидазо-1,3,2-диазафосфорины (Nilov et al., Mendeleev Commun. 2:67, 1995), азатиоприн (Chifotides et al., J. Inorg. Biochem. 56(4):249-64, 1994), производные метил-D-глюкопиранозида меркаптопурина (Da Silva et al., Eur. J. Med. Chem. 29(2): 149-52, 1994) и производные s-алкинилмеркаптопурина (Ratsino et al., Khim.-Farm. Zh. 15(8):65-7, 1981); производные метокситрексата, содержащие индолиновое кольцо и модифицированный орнитин или глутаминовую кислоту (Matsuoka et al., Chem. Pharm. Bull. 45(7):1146-1150, 1997), производные метотрексата, содержащие алкилзамещенное бензольное кольцо С (Matsuoka et al., Chem. Pharm. Bull. 44(12):2287-2293, 1996), производные метотрексата, содержащие группы бензоксазин или бензотиазин (Matsuoka et al., J. Med. Chem. 40(1):105-111, 1997), аналоги 10-деазааминоптерина (DeGraw et al., J. Med. Chem. 40(3):370-376, 1997), аналоги метотрексата 5-дазааминоптерин и 5,10-дидеазааминоптерин (Piper et al., J. Med. Chem. 40(3):377-384, 1997), производные метотрексата, содержащие индолин (Matsuoka et al., Chem. Pharm. Bull. 44(7): 1332-1337, 1996), производные липофильных амидов метотрексата (Pignatello et al., World Meet. Pharm., Biopharm. Pharm. Technol., 563-4, 1995), аналоги метотрексата, включающие остатки L-трео-(2S,4S)-4-фторглутаминовой кислоты и DL-3,3-дифторглутаминовой кислоты (Hart et al., J. Med. Chem. 39(1):56-65, 1996), аналоги метотрексата тетрагидрохиназолина (Gangjee, et al., J. Heterocycl. Chem. 32(1):243-8, 1995), производные N-( -аминоацил) метотрексата (Cheung et al., Pteridines 3(1-2):101-2, 1992), производные биотин метотрексата (Fan et al., Pteridines 3(1-2): 131-2, 1992), аналоги метотрексата, содержащие остатки D-глутаминовой кислоты или D-эритро, трео-4-фторглутаминовой кислоты (McGuire et al., Biochem. Pharmacol. 42(12):2400-3, 1991), аналоги -аминоацил) метотрексата (Cheung et al., Pteridines 3(1-2):101-2, 1992), производные биотин метотрексата (Fan et al., Pteridines 3(1-2): 131-2, 1992), аналоги метотрексата, содержащие остатки D-глутаминовой кислоты или D-эритро, трео-4-фторглутаминовой кислоты (McGuire et al., Biochem. Pharmacol. 42(12):2400-3, 1991), аналоги  , , -метанометотрексата (Rosowsky et al., Pteridines 2(3): 133-9,1991), аналог 10-деазааминоптерина (10-EDAM) (Braakhuis et al., Chem. Biol. Pteridines, Proc. Int. Symp. Pteridines Folic Acid Deriv., 1027-30, 1989), аналог -метанометотрексата (Rosowsky et al., Pteridines 2(3): 133-9,1991), аналог 10-деазааминоптерина (10-EDAM) (Braakhuis et al., Chem. Biol. Pteridines, Proc. Int. Symp. Pteridines Folic Acid Deriv., 1027-30, 1989), аналог  -тетразолметотрексата (Kalman et al., Chem. Biol. Pteridines, Proc. Int. Symp. Pteridines Folic Acid Deriv., 1154-7, 1989), производные N-(L- -тетразолметотрексата (Kalman et al., Chem. Biol. Pteridines, Proc. Int. Symp. Pteridines Folic Acid Deriv., 1154-7, 1989), производные N-(L- -аминоацил) метотрексата (Cheung et al., Heterocycles 28(2):751-8, 1989), мета- и орто-изомеры аминоптерина (Rosowsky et at., J. Med. Chem. 32(12):2582, 1989), гидроксиметилметотрексат (DE 267495), -аминоацил) метотрексата (Cheung et al., Heterocycles 28(2):751-8, 1989), мета- и орто-изомеры аминоптерина (Rosowsky et at., J. Med. Chem. 32(12):2582, 1989), гидроксиметилметотрексат (DE 267495),  -фторметотрексат (McGuire et al., Cancer Res. 49(16):4517-25, 1989), производные полиглутамилметотрексата (Kumar et al., Cancer Res. 46(10):5020-3, 1986), аналоги метотрексата гем-дифосфоната (публикация WO 88/06158), -фторметотрексат (McGuire et al., Cancer Res. 49(16):4517-25, 1989), производные полиглутамилметотрексата (Kumar et al., Cancer Res. 46(10):5020-3, 1986), аналоги метотрексата гем-дифосфоната (публикация WO 88/06158),  - и - и  -замещенные аналоги метотрексата (Tsushima et al., Tetrahedron 44(17):5375-87, 1988), аналоги 5-метил-5-деазаметотрексата (патент США № 4725687), производные N -замещенные аналоги метотрексата (Tsushima et al., Tetrahedron 44(17):5375-87, 1988), аналоги 5-метил-5-деазаметотрексата (патент США № 4725687), производные N -ацил-N -ацил-N -(4-амино-4-дезоксиптероил)-L-орнитина (Rosowsky et al., J. Med. Chem. 31(7):1332-7, 1988), аналоги 8-деазаметотрексата (Kuehl et al., Cancer Res. 48(6):1481-8, 1988), аналог ацивицина метотрексата (Rosowsky et al., J. Med. Chem. 30(8): 1463-9, 1987), полимерное производное метотрексата, платинол (Carraher et al., Polym. Sci. Technol. (Plenum), 35 (Adv. Biomed. Polym.):311-24, 1987), метотрексат- -(4-амино-4-дезоксиптероил)-L-орнитина (Rosowsky et al., J. Med. Chem. 31(7):1332-7, 1988), аналоги 8-деазаметотрексата (Kuehl et al., Cancer Res. 48(6):1481-8, 1988), аналог ацивицина метотрексата (Rosowsky et al., J. Med. Chem. 30(8): 1463-9, 1987), полимерное производное метотрексата, платинол (Carraher et al., Polym. Sci. Technol. (Plenum), 35 (Adv. Biomed. Polym.):311-24, 1987), метотрексат- -димиристоилфосфатидилэтаноламин (Kinsky et al., Biochim. Biophys. Acta 917(2):211-18, 1987), аналоги метотрексата полиглутамата (Rosowsky et al., Chem. Biol. Pteridines, Pteridines Folid Acid Deriv., Proc. Int. Symp. Pteridines Folid Acid Deriv.: Chem., Biol. Clin. Aspects: 985-8, 1986), производные поли- -димиристоилфосфатидилэтаноламин (Kinsky et al., Biochim. Biophys. Acta 917(2):211-18, 1987), аналоги метотрексата полиглутамата (Rosowsky et al., Chem. Biol. Pteridines, Pteridines Folid Acid Deriv., Proc. Int. Symp. Pteridines Folid Acid Deriv.: Chem., Biol. Clin. Aspects: 985-8, 1986), производные поли- -глутамилметотрексата (Kisliuk et al., Chem. Biol. Pteridines, Pteridines Folid Acid Deriv., Proc. Int. Symp. Pteridines Folid Acid Deriv.: Chem., Biol. Clin. Aspects: 989-92, 1986), производные метотрексата дезоксиуридилата (Webber et al., Chem. Biol. Pteridines, Pteridines Folid Acid Deriv., Proc. Int. Symp. Pteridines Folid Acid Deriv.: Chem., Biol. Clin. Aspects: 659-62, 1986), аналоги йодацетиллизинметотрексата (Delcamp et al., Chem. Biol. Pteridines, Pteridines Folid Acid Deriv., Proc. Int. Symp. Pteridines Folid Acid Deriv.: Chem., Biol. Clin. Aspects: 807-9, 1986), аналоги метотрексата, содержащие остаток 2,.омега-диаминоалканоидной кислоты (McGuire et al., Biochem. Pharmacol. 35(15):2607-13, 1986), производные метотрексата полиглутамата (Kamen & Winick, Methods Enzymol. 122(Vitam. Coenzymes, Pt. G):339-46, 1986), 5-метил-5-деаза-аналоги (Piper et al., J. Med. Chem. 29(6):1080-7, 1986), аналог хиназолина метотрексата (Mastropaolo et al., J. Med. Chem. 29(1):155-8, 1986), аналог пиразина метотрексата (Lever & Vestal, J. Heterocycl. Chem. 22(1):5-6, 1985), аналоги метотрексата, содержащие остатки цистеиновой кислоты и гомоцистеиновой кислоты (патент США № 4490529), -глутамилметотрексата (Kisliuk et al., Chem. Biol. Pteridines, Pteridines Folid Acid Deriv., Proc. Int. Symp. Pteridines Folid Acid Deriv.: Chem., Biol. Clin. Aspects: 989-92, 1986), производные метотрексата дезоксиуридилата (Webber et al., Chem. Biol. Pteridines, Pteridines Folid Acid Deriv., Proc. Int. Symp. Pteridines Folid Acid Deriv.: Chem., Biol. Clin. Aspects: 659-62, 1986), аналоги йодацетиллизинметотрексата (Delcamp et al., Chem. Biol. Pteridines, Pteridines Folid Acid Deriv., Proc. Int. Symp. Pteridines Folid Acid Deriv.: Chem., Biol. Clin. Aspects: 807-9, 1986), аналоги метотрексата, содержащие остаток 2,.омега-диаминоалканоидной кислоты (McGuire et al., Biochem. Pharmacol. 35(15):2607-13, 1986), производные метотрексата полиглутамата (Kamen & Winick, Methods Enzymol. 122(Vitam. Coenzymes, Pt. G):339-46, 1986), 5-метил-5-деаза-аналоги (Piper et al., J. Med. Chem. 29(6):1080-7, 1986), аналог хиназолина метотрексата (Mastropaolo et al., J. Med. Chem. 29(1):155-8, 1986), аналог пиразина метотрексата (Lever & Vestal, J. Heterocycl. Chem. 22(1):5-6, 1985), аналоги метотрексата, содержащие остатки цистеиновой кислоты и гомоцистеиновой кислоты (патент США № 4490529),  -трет-бутиловые эфиры метотрексата (Rosowsky et al., J. Med. Chem. 28(5):660-7, 1985), фторированные аналоги метотрексата (Tsushima et al., Heterocycles 23(1):45-9, 1985), фолатный аналог метотрексата (Trombe, J. Bacteriol. 160(3):849-53, 1984), аналоги фосфоноглутаминовой кислоты (Sturtz & Guillamot, Eur. J. Med. Chem.-Chim. Ther. 79(3):267-73, 1984), конъюгаты поли(L-лизин) метотрексата (Rosowsky et al., J. Med. Chem. 27(7):888-93, 1984), производные дилизина и трилизина метотрексат (Forsch & Rosowsky, J. Org. Chem. 49(7): 1305-9, 1984), 7-гдроксиметотрексат (Fabre et al., Cancer Res. 43(10):4648-52, 1983), аналоги поли- -трет-бутиловые эфиры метотрексата (Rosowsky et al., J. Med. Chem. 28(5):660-7, 1985), фторированные аналоги метотрексата (Tsushima et al., Heterocycles 23(1):45-9, 1985), фолатный аналог метотрексата (Trombe, J. Bacteriol. 160(3):849-53, 1984), аналоги фосфоноглутаминовой кислоты (Sturtz & Guillamot, Eur. J. Med. Chem.-Chim. Ther. 79(3):267-73, 1984), конъюгаты поли(L-лизин) метотрексата (Rosowsky et al., J. Med. Chem. 27(7):888-93, 1984), производные дилизина и трилизина метотрексат (Forsch & Rosowsky, J. Org. Chem. 49(7): 1305-9, 1984), 7-гдроксиметотрексат (Fabre et al., Cancer Res. 43(10):4648-52, 1983), аналоги поли- -глутамилметотрексата (Piper & Montgomery, Adv. Exp. Med. Biol., 163(Folyl Antifolyl Polyglutamates):95-100, 1983), 3',5'-дихлорметотрексат (Rosowsky & Yu, J. Med. Chem. 26(10):1448-52, 1983), аналоги диазокетона и хлорметилкетона метотрексата (Gangjee et al., J. Pharm. Sci. 71(6):717-19, 1982), гомологи 10-пропаргиламиноптерина и алкилметотрексата (Piper et al., J. Med. Chem. 25(7):877-80, 1982), лектиновые производные метотрексата (Lin et al., JNCI 66(3):523-8, 1981), производные полиглутамата метотрексата (Galivan, Mol. Pharmacol. 17(1): 105-10, 1980), галогенированные производные метотрексата (Fox, JNCI 58(4):J955-8, 1977), 8-акил-7,8-дигидро аналоги (Chaykovsky et al., J. Med. Chem. 20(10):J1323-7, 1977), производные 7-метилметотрексата и дихлорметотрексат (Rosowsky & Chen, J. Med. Chem. 17( 12): J1308-11, 1974), липофильные производные метотрексата и 3',5'-дхлорметотрексат (Rosowsky, J. Med. Chem. 16(10):J1190-3, 1973), аналоги деазааметоптерина (Montgomery et al., Ann. N.Y. Acad. Sci. 186:J227-34, 1971), MX068 (Pharma Japan, 1658:18, 1999) и аналоги метотрексата, содержащие остатки цистеиновой кислоты и гомоцистеиновой кислоты (Европейский патент 0142220). -глутамилметотрексата (Piper & Montgomery, Adv. Exp. Med. Biol., 163(Folyl Antifolyl Polyglutamates):95-100, 1983), 3',5'-дихлорметотрексат (Rosowsky & Yu, J. Med. Chem. 26(10):1448-52, 1983), аналоги диазокетона и хлорметилкетона метотрексата (Gangjee et al., J. Pharm. Sci. 71(6):717-19, 1982), гомологи 10-пропаргиламиноптерина и алкилметотрексата (Piper et al., J. Med. Chem. 25(7):877-80, 1982), лектиновые производные метотрексата (Lin et al., JNCI 66(3):523-8, 1981), производные полиглутамата метотрексата (Galivan, Mol. Pharmacol. 17(1): 105-10, 1980), галогенированные производные метотрексата (Fox, JNCI 58(4):J955-8, 1977), 8-акил-7,8-дигидро аналоги (Chaykovsky et al., J. Med. Chem. 20(10):J1323-7, 1977), производные 7-метилметотрексата и дихлорметотрексат (Rosowsky & Chen, J. Med. Chem. 17( 12): J1308-11, 1974), липофильные производные метотрексата и 3',5'-дхлорметотрексат (Rosowsky, J. Med. Chem. 16(10):J1190-3, 1973), аналоги деазааметоптерина (Montgomery et al., Ann. N.Y. Acad. Sci. 186:J227-34, 1971), MX068 (Pharma Japan, 1658:18, 1999) и аналоги метотрексата, содержащие остатки цистеиновой кислоты и гомоцистеиновой кислоты (Европейский патент 0142220).
Полагают, что данные соединения действуют в качестве антиметаболитов фолиевой кислоты.
D. Подофиллотоксины
В другом аспекте терапевтическое средство является подофиллотоксином или его производным, или его аналогом. Примерными соединениями данного типа являются этопозид или тенипозид, которые имеют следующие структуры:
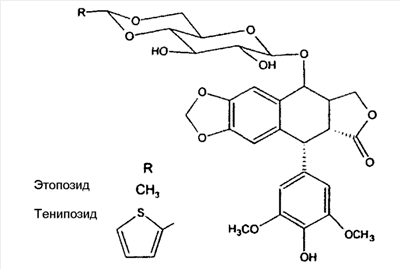
Другие показательные примеры подофиллотоксинов включают комплекс Cu(II)-VP-16 (этопозид) (Tawa et al., Bioorg. Med. Chem. 6(7):1003-1008, 1998), аналоги этопозида, содержащие пирролкарбоксамидиногруппу (Ji et al., Bioorg. Med. Chem. Lett. 7(5):607-612, 1997), аналоги 4 -амино-этопозида (Hu, University of North Carolina Dissertation, 1992), аналоги ариламино этопозида с модифицированным -амино-этопозида (Hu, University of North Carolina Dissertation, 1992), аналоги ариламино этопозида с модифицированным  -лактонным кольцом (Zhou et al., J. Med. Chem. 37(2):287-92, 1994), аналоги N-глюкозилэтопозида (Allevi et al., Tetrahedron Lett. 34(45):7313-16, 1993), этопозид A-кольцевые аналоги (Kadow et al., Bioorg. Med. Chem. Lett. 2(1):17-22, 1992), 4'-десгидрокси-4'-метилэтопозид (Saulnier et al., Bioorg. Med. Chem. Lett. 2(10):1213-18, 1992), аналоги этопозида с подвесным кольцом (Sinha et al., Eur. J. Cancer 26(5):590-3, 1990) и аналоги дезоксиэтопозида с E-кольцом (Saulnier et al., J. Med. Chem. 32(7):1418-20, 1989). -лактонным кольцом (Zhou et al., J. Med. Chem. 37(2):287-92, 1994), аналоги N-глюкозилэтопозида (Allevi et al., Tetrahedron Lett. 34(45):7313-16, 1993), этопозид A-кольцевые аналоги (Kadow et al., Bioorg. Med. Chem. Lett. 2(1):17-22, 1992), 4'-десгидрокси-4'-метилэтопозид (Saulnier et al., Bioorg. Med. Chem. Lett. 2(10):1213-18, 1992), аналоги этопозида с подвесным кольцом (Sinha et al., Eur. J. Cancer 26(5):590-3, 1990) и аналоги дезоксиэтопозида с E-кольцом (Saulnier et al., J. Med. Chem. 32(7):1418-20, 1989).
Полагают, что данные соединения действуют в качестве ингибиторов топоизомеразы II и/или агентов, расщепляющих ДНК.
Е. Камптотецины
В другом аспекте терапевтическое средство представляет собой камптотецин или его аналог, или его производное. Камптотецины имеют следующую общую структуру:
В данной структуре Х, как правило, является О, но может представлять собой другие группы, например NH в случае 21-лктамных производных. Как правило, R1 является Н или ОН, но может представлять собой другие группы, например С1-3алкан с концевой гидроксильной группой. Обычно R2 представляет собой Н или аминогруппу, содержащую такую группу, как (СН3)2NHCH2, но может быть другими группами, например NO2, NH2, атомом галогена (как раскрыто, например, в патенте США № 5552156) или коротким алканом, содержащим данные группы. Обычно R3 представляет собой Н или короткий алкил такой, как С2Н5. Обычно R4 представляет собой Н, но может быть другими группами, например метилендиокси группой с R1.
Примерные камптотецины включают топотекан, иринотекан (СРТ-11), 9-аминокамптотецин, 21-лактам-20(S)-камптотецин, 10,11-мтилендиоксикамптотецин, SN-38, 9-нитрокамптотецин, 10-гдроксикамптотецин. Примерные соединения имеют структуры:
Х: О для большинства аналогов, NH - для 21 лактамных аналогов.
Камптотецины содержат пять колец, представленных здесь. Кольцо, обозначенное Е, должно быть интактным (больше в лактонной форме, чем в карбоксилатной) для проявления максимальной активности и минимальной токсичности.
Полагают, что камптотецины действуют в качестве ингибиторов топоизомеразы I и/или агентов, расщепляющих ДНК.
F. Гидроксимочевины
Терапевтическое средство по настоящему изобретению может представлять собой гидроксимочевину. Гидроксимочевины имеют следующую общую структуру:
Подходящие гидроксимочевины раскрыты, например, в патенте США № 6080874, где R1 представляет собой:
и R2 представляет собой алкильную группу, имеющую 1-4 атомов углерода, и R3 является одним из Н, ацила, метила, этила и их сочетаний, таких как метиловый эфир.
Другие подходящие гидроксимочевины раскрыты, например, в патенте США № 5665768, где R1 представляет собой циклоалкенильную группу, например N-[3-[5-(4-фторфенилтио)фурил]-2-циклопентен-1-ил]N-гидроксимочевина; R2 представляет собой Н или алкильную группу, имеющую 1-4 атомов углерода, и R3 является Н; Х представляет собой Н или катион.
Другие подходящие гидроксимочевины раскрыты, например, в патенте США № 4299778, где R1 представляет собой фенильную группу, замещенную одним или несколькими атомами фтора; R2 представляет собой циклопропильную группу и R3 и Х представляют собой Н.
Другие подходящие гидроксимочевины раскрыты, например, в патенте США № 5066658, где R2 и R3 вместе со смежным атомом азота образуют:
где m равно 1 или 2, n равно 0-2 и Y представляет собой алкильную группу.
В одном аспекте гидроксимочевина имеет структуру:
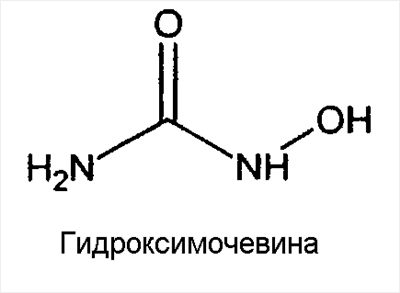
Полагают, что данные соединения действуют в качестве ингибиторов синтеза ДНК.
G. Комплексы платины
В другом аспекте терапевтическое средство представляет собой соединение платины. В основном подходящие комплексы платины могут содержать Pt(II) или Pt(IV) и иметь следующую основную структуру:
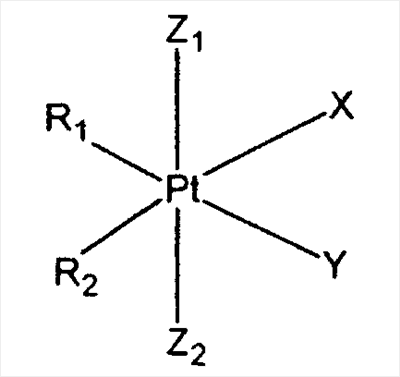
где Х и Y являются анионными отщепляемыми группами, такими как сульфат, фосфат, карбоксилат и атом галогена; R1 и R2 представляют алкил, амин, аминоалкил, каждый из которых может быть дополнительно замещен, и в основном они являются инертными или связывающими группами. Для комплексов Pt(II) Z1 и Z2 отсутствуют. Для Pt(IV) Z1 и Z2 могут представлять собой анионные группы, такие как атом галогена, гидрокси, карбоксилат, сложный эфир, сульфат или фосфат. См., например, патенты США № 4588831 и 4250189.
Подходящие комплексы платины могут содержать многочисленные атомы Pt. См., например, патенты США № 5409915 и 5380897. Например, комплексы бисплатины и триплатины типа:
Примерными соединениями платины являются цисплатин, карбоплатин, оксалиплатин и мибоплатин, имеющие структуры:
Другие показательные соединения платины включают (CPA)2Pt[DOLYM] и (DACH)Pt[DOLYM] цисплатин (Choi et al., Arch. Pharmacal Res. 22(2):151-156, 1999), цис-[PtCl2(4,7-H-5-метил-7-оксо]1,2,4[триазоло[1,5-a]пиримидин)2] (Navarro et al., J. Med. Chem. 41(3):332-338, 1998), [Pt(цис-1,4-DACH)(транс-Cl2)(CBDCA)]×1/2MeOH цисплатин (Shamsuddin et at., Inorg. Chem. 36(25):5969-5971, 1997), 4-пиридоксатдиамингидроксиплатина (Tokunaga et al., Pharm. Sci. 3(7):353-356, 1997), Pt(II)...Pt(II)(Pt2[NHCHN(C(CH2)(CH3))]4) (Navarro et al., Inorg. Chem. 35(26):7829-7835, 1996), аналог цисплатина 254-S (Koga et al., Neurol. Res. 18(3):244-247, 1996), аналоги цисплатина, содержащего o-фенилендиаминовый лиганд (Koeckerbauer & Bednarski, J. Inorg. Biochem. 62(4):281-298, 1996), транс-, цис-[Pt(OAc)2I2(ен)] (Kratochwil et al., J. Med. Chem. 39(13):2499-2507, 1996), эстрогенные аналоги цисплатина, содержащие 1,2-диарилэтилендиаминовый лиганд (с серусодержащими аминокислотами и глутатионом) (Bednarski, J. Inorg. Biochem. 62(1):75, 1996), аналоги цис-1,4-диаминоциклогексана цисплатина (Shamsuddin et at., J. Inorg. Biochem. 61(4):291-301, 1996), 5'-оиентационный изомер цис-[Pt(NH3)(4-аминоТЕМР-O){d(GpG)}] (Dunham & Lippard, J. Am. Chem. Soc. 117(43):10702-12, 1995), хелатообразующие аналоги цисплатина, содержащие диамин (Koeckerbauer & Bednarski, J. Pharm. Sci. 84(7):819-23, 1995), аналоги цисплатина, содержащие 1,2-диарилэтиленаминовый лиганд (Otto et al., J. Cancer Res. Clin. Oncol. 121(1):31-8, 1995), комплексы (этилендиамин)платины(II)(Pasini et al., J. Chem. Soc., Dalton Trans. 4:579-85, 1995), аналог цисплатина CI-973 (Yang et al., Int. J. Oncol. 5(3):597-602, 1994), цис-диаминдихлорплатина (II) и ее аналог цис-1,1-циклобутандикарбосилато(2R)-2-метил-1,4-бутандиаминплатина (II) и цис-диамин(гликолато)платина (Claycamp & Zimbrick, J. Inorg. Biochem. 26(4):257-67, 1986; Fan et al., Cancer Res. 48(11):3135-9, 1988; Heiger-Bernays et al., Biochemistry 29(36):8461-6, 1990; Kikkawa et al., J. Exp. Clin. Cancer Res. 72(4):233-40, 1993; Murray et al., Biochemistry 31(47):11812-17, 1992; Takahashi et al., Cancer Chemother. Pharmacol. 33(1):31-5, 1993), цис-аминциклогексиламинодихлорплатина (II) (Yoshida et al., Biochem. Pharmacol. 48(4):793-9, 1994), аналоги цисплатина гем-дифосфоната (FR 2683529), (мезо-1,2-бис(2,6-дихлор-4-гидроксифенил)этилендиамин) дихлорплатина (II)(Bednarski et al., J. Med. Chem. 35(23):4479-85, 1992), аналоги цисплатина, содержащие связанную дансильную группу (Hartwig et al., J. Am. Chem. Soc. 114(21):8292-3, 1992), полиамины платины (II) (Siegmann et al., Inorg. Met.-Containing Polym. Mater, (Proc. Am. Chem. Soc. Int. Symp.), 335-61, 1990), цис-(3H)дихлор(этилендиамин)платина (II) (Eastman, Anal. Biochem. 197(2):311-15, 1991), транс-диаминдихлорплатина (II) и цис-(Pt(NH3)2(N3-цитозин)Cl) (Bellon & Lippard, Biophys. Chem. 35(2-3):179-88, 1990), 3H-цис-1,2-диаминоциклогександихлорплатина (II) и 3H-цис-1,2-диаминоциклогексанмалонатоплатина (II) (Oswald et al., Res. Commun. Chem. Pathol. Pharmacol. 64(1):41-58, 1989), диаминокарбоксилатоплатина (Европейский патент 296321), аналоги платины, содержащие транс-(D,1)-1,2-диаминоциклогексановый носитель (Wyrick & Chaney, J. Labelled Compd. Radiopharm. 25(4):349-57, 1988), аналоги цисплатина на основе аминоалкиламиноантрахинона (Kitov et al., Eur. J. Med. Chem. 23(4):381-3, 1988), аналоги платины спироплатин, карбоплатин, ипроплатин и JM40 (Schroyen et al., Eur. J. Cancer Clin. Oncol. 24(8):1309-12, 1988), производные цисплатина, содержащие бидентатный третичный диамин (Orbell et al., Inorg. Chim. Acta 152(2):125-34, 1988), платина (II), платина (IV) (Liu & Wang, Shandong Yike Daxue Xuebao 24(1):35-41, 1986), цис-диаммин(1,1-циклобутандикарбоксилато)платина (II) (карбоплатин, JM8) и этилендиамминмалонатоплатина (II) (JM40) (Begg et al., Radiother. Oncol. 9(2):157-65, 1987), аналоги цисплатина JM8 и JM9 (Harstrick et al., Int. J. Androl. 10(1); 139-45, 1987), (NPr4)2((PtCl4)цис-(PtCl2-(NH2Me)2)) (Brammer et al., J. Chem. Soc., Chem. Commun. 6:443-5, 1987), комплексы платины и алифатической трикарбоновой кислоты (Европейский патент 185225) и комплексы цис-дихлор(аминокислота)(трет-бутиламин)платины (II) (Pasini & Bersanetti, Inorg. Chim. Acta 107(4):259-67, 1985). Полагают, что данные соединения действуют посредством связывания с ДНК, например, в качестве алкилирующих ДНК агентов.
II. Композиции и составы
Как указывалось выше, описанные здесь терапевтические средства можно формулировать различными способами, и таким образом они могут дополнительно включать носитель. В этом отношении можно выбрать самые различные носители, полимерные или неполимерные. Носители и композиции на основе полимеров и не полимеров, которые более подробно обсуждаются ниже, приводятся только в качестве неограничивающих примеров.
В одном варианте воплощения изобретения можно применять самые разнообразные полимеры для включения и/или доставки одного или нескольких средств, указанных выше, включая, например, биоразлагаемые и небиоразлагаемые композиции. Показательные примеры биоразлагаемых композиций включают альбумин, коллаген, желатин, хитозан, гиалуроновую кислоту, крахмал, целлюлозу и ее производные (например, метилцеллюлозу, гидроксипропилцеллюлозу, гидроксипропилметилцеллюлозу, карбоксиметилцеллюлозу, ацетофталат целлюлозы, ацетосукцинат целлюлозы, гидроксипропилметилцеллюлозу фталат), альгинаты, казеин, декстраны, полисахариды, фибриноген, поли(L-лактид), поли(D,L-лактид), поли(L-лактид-со-гликолид), поли(D,L-лактид-со-гликолид), поли(гликолид), поли(триметиленкарбонат), поли(гидроксивалерат), поли(гидроксибутират), поли(капролактон), поли(алкилкарбонат) и поли(ортоэфиры), сложные полиэфиры, поли(гидроксивалериановую кислоту), полидиоксанон, поли(яблочную кислоту), поли(тартроновую кислоту), полиангидриды, полифосфазены, поли(аминокислоты), сополимеры данных полимеров и смеси данных полимеров (в основном смотри Illum, L, Davids, S.S. (eds.) "Polymers in Controlled Drug Delivery" Wright, Bristol, 1987; Arshady, J. Controlled Release 17:1-22, 1991; Pitt, Int. J. Phar. 59:173-196, 1990; Holland et al., J. Controlled Release 4:155-180, 1986). Показательные примеры неразлагаемых полимеров включают сополимеры поли(этилен-со-винилацетата) ("EVA"), силиконовый каучук, акриловые полимеры (например, полиакриловую кислоту, полиметакриловую кислоту, поли(гидроксиэтилметакрилат), полиметилметакрилат, полиалкилцианоакрилат), полиэтилен, полипропилен, полиамиды (например, найлон 6,6), полиуретан (например, поли(сложные эфиры уретанов), поли(простые эфиры уретанов), поли(эфир-мочевину), поли(карбонатные эфиры уретанов)), простые полиэфиры (например, поли(этиленоксид), поли(пропиленоксид), плуроники и поли(тетраметиленгликоль)) и виниловые полимеры [(например, поливинилпирролидон, поли(виниловый спирт), поли(винилацетатфталат)]. Можно также получить полимеры, которые являются анионными (например, альгинат, каррагенин, карбоксиметилцеллюлозу и поли(акриловую кислоту) или катионными (например, хитозан, поли-L-лизин, полиэтиленимин и поли(аллиламин)) (в основном, см. Dunn et al.;J. Applied Polymer Sci. 50:353-365, 1993; Cascone et al., J. Materials Sci.: Materials in Medicine 5:770-774, 1994; Shiraishi et al., Biol. Pharm. Bull. 16(11):1164-1168, 1993; Thacharodi and Rao, Int'l J. Pharm. 120:115-118, 1995; Miyazaki et al., Int'l J. Pharm. 118:257-263, 1995). Особенно предпочтительные полимерные носители включают поли(этилен-со-винилацетат), полиуретан, кислоту, поли(капролактон), поли(валеролактон), полиангидриды, сополимеры поли(капролактона) или поли(молочной кислоты) с полиэтиленгликолем (например, MePEG) и их смеси.
Другие показательные полимеры включают карбоновые полимеры, полиацетаты, полиакриламиды, поликарбонаты, простые полиэфиры, сложные полиэфиры, полиэтилены, поливинилбутиралы, полисиланы, полимочевины, полиуретаны, полиоксиды, полистиролы, полисульфиды, полисульфоны, полисульфониды, поливинилгалогениды, пирролидоны, каучуки, термоотверждающиеся полимеры, поперечносшитые акриловые и метакриловые полимеры, сополимеры этилена и акриловой кислоты, сополимеры стирола и акриловой кислоты, винилацетатполимеры и сополимеры, винилацетальполимеры и сополимеры, эпокси, меламин, другие аминополимеры, феноловые полимеры и их сополимеры, нерастворимые в воде эфиры целлюлозы (включая ацетопропионат целлюлозы, ацетатцеллюлозу, ацетобутират целлюлозы, нитроцеллюлозу, ацетофталат целлюлозы и их смеси), поливинилпирролидон, полиэтиленгликоли, полиэтиленоксид, поливиниловый спирт, простые полиэфиры, полисахариды, гидрофильный полиуретан, полигидроксиакрилат, декстран, ксантан, гидроксипропилцеллюлозу, метилцеллюлозу и гомополимеры и сополимеры N-винилпирролидона, N-виниллактама, N-внилбутиролактама, N-винилкапролактама и другие виниловые соединения, имеющие полярные боковые группы, акрилат и метакрилат, имеющие гидрофильные эстерифицирующие группы, гидроксиакрилат и акриловую кислоту и их сочетания; сложные и простые эфиры целлюлозы, этилцеллюлозу, гидроксиэтилцеллюлозу, нитроцеллюлозу, ацетатцеллюлозу, ацетобутират целлюлозы, ацетопропионат целлюлозы, полиуретан, полиакрилат, природные и синтетические эластомеры, каучуки, ацеталь, найлон, сложный полиэфир, стиролполибутадиен, акриловый полимер, поливинилиденхлорид, поликарбонат, гомополимеры и сополимеры виниловых соединений, поливинилхлорид, поливинилхлоридацетат.
Показательные примеры патентов, относящихся к полимерам и их получению, включают публикации РСТ № WO72827, 98/12243, 98/19713, 98/41154, 99/07417, 00/33764, 00/21842, 00/09190, 00/09088, 00/09087, 2001/17575 и 2001/15526 (а также соответствующие им заявки на патент США) и патенты США № 4500676, 4582865, 4629623, 4636524, 4713448, 4795741, 4913743, 5069899, 5099013, 5128326, 5143724, 5153174, 5246698, 5266563, 5399351, 5525348, 5800412, 5837226, 5942555, 5997517, 6007833, 6071447, 6090995, 6099563, 6106473, 6110483, 6121027, 6156345, 6179817, 6197051, 6214901, 6335029, 6344035, которые, как уже указывалось выше, в полном объеме включены в описание путем ссылки.
Полимерам можно придать любые разнообразные формы с желаемыми свойствами высвобождения и/или специфическими желаемыми свойствами. Например, можно получить полимеры, начинающие высвобождать терапевтическое средство в ответ на определенный «запускающий» фактор, такой как значение рН (см., например, Heller et al., «Chemically Self-Regulated Drug Delivery Systems», in Polymers in Medicine III, Elsevier Science Publishers B.V., Amsterdam, 1988, pp. 175-188; Kang et al., J. Applied Polymer Sci. 48:343-354, 1993; Dong et al., J. Controlled Release 19:171-178, 1992; Dong and Hoffman, J. Controlled Release 15:141-152, 1991; Kim et al., J. Controlled Release 28:143-152, 1994; Cornejo-Bravo et at., J. Controlled Release 33:223-229, 1995; Wu and Lee, Pharm. Res. 10(10): 1544-1547, 1993; Serres et al., Pharm. Res. 13(2):196-201,1996; Peppas, «Fundamentals of pH- and Temperature-Sensitive Delivery Systems», in Gurny et al. (eds.), Pulsatile Drug Delivery, Wissenschaftliche Vertagsgesellschaft mbH, Stuttgart, 1993, pp. 41-55; Doelker, «Cellulose Derivatives», 1993, in Peppas and Langer (eds.), Biopolymers I, Springer-Verlag, Berlin). Типичные примеры рН-чувствительных полимеров включают полимеры и производные на основе поли(акриловой кислоты) (включая, например, гомополимеры, такие как поли(аминокарбоновую кислоту), поли(акриловую кислоту), поли(метилакриловую кислоту), сополимеры подобных гомополимеров и сополимеры поли(акриловой кислоты) и акриломономеров, таких, как указаны выше). Другие чувствительные к рН полимеры включают полисахариды, такие как карбоксиметилцеллюлоза, фталат гидроксипропилметилцеллюлозы, ацетосукцинат гидроксипропилметилцеллюлозы, ацетотримеллилат целлюлозы, хитозан и альгинаты. Еще одни чувствительные к рН полимеры включают любую смесь чувствительного к рН полимера и водорастворимого полимера.
Аналогично можно получить чувствительные к температуре полимеры (см., например, Chen et al., «Novel Hydrogels of a Temperature-Sensitive Pluronic Grafted to a Bioadhesive Polyacrylic Acid Backbone for Vaginal Drug Delivery», in Proceed. Intern. Symp. Control. Rel. Bioact. Mater. 22:167-168, Controlled Release Society, Inc., 1995; Okano, «Molecular Design of Stimuli-Responsive Hydrogels for Temporal Controlled Drug Delivery», in Proceed. Intern. Symp. Control. Rel. Bioact. Mater. 22:111-112, Controlled Release Society, Inc., 1995; Johnston et al., Pharm. Res. 9(3):425-433, 1992; Tung, Int'l J. Pharm. 107:85-90, 1994; Harsh and Gehrke, J. Controlled Release 17:175-186, 1991; Bae et al., Pharm. Res. 8(4):531-537, 1991; Dinarvand and D'Emanuele, J. Controlled Release 36:221-227, 1995; Yu and Grainger, «Novel Thermo-sensitive Amphiphilic Gels: Poly N-isopropylacrylamide-co-sodium acrylate-co-n-N-alkylacrylamide Network Synthesis and Physicochemical Characterization», Dept. of Chemical & Biological Sci., Oregon Graduate Institute of Science & Technology, Beaverton, OR, pp. 820-821; Zhou and Smid, «Physical Hydrogels of Associative Star Polymers», Polymer Research Institute, Dept. of Chemistry, College of Environmental Science and Forestry, State Univ. of New York, Syracuse, NY, pp. 822-823; Hoffman et al., «Characterizing Pore Sizes and Water 'Structure' in Stimuli-Responsive Hydrogels», Center for Bioengineering, Univ. of Washington, Seattle, WA, p. 828; Yu and Grainger, «Thermo-sensitive Swelling Behavior in Crosslinked N-isopropylacrylamide Networks: Cationic, Anionic and Ampholytic Hydrogels», Dept. of Chemical & Biological Sci., Oregon Graduate Institute of Science & Technology, Beaverton, OR, pp. 829-830; Kim et al., Pharm. Res. 9(3):283-290, 1992; Bae et al., Pharm. Res. 8(5):624-628, 1991; Kono et al., J. Controlled Release 30:69-75, 1994; Yoshida et al., J. Controlled Release 32:97-102, 1994; Okano et al., J. Controlled Release 36:125-133, 1995; Chun and Kim, J. Controlled Release 38:39-47, 1996; D'Emanuele and Dinarvand, Int'l J. Pharm. 118:237-242, 1995; Katono et al., J. Controlled Release 16:215-228, 1991; Hoffman, «Thermally Reversible Hydrogels Containing Biologically Active Species», in Migliaresi et al. (eds.), Polymers in Medicine III, Elsevier Science Publishers B.V., Amsterdam, 1988, pp. 161-167; Hoffman, «Applications of Thermally Reversible Polymers and Hydrogels in Therapeutics and Diagnostics», in Third International Symposium on Recent Advances in Drug Delivery Systems, Salt Lake City, UT, Feb. 24-27, 1987, pp. 297-305; Gutowska ef al., J. Controlled Release 22:95-104,1992; Palasis and Gehrke, J. Controlled Release 18:1-12, 1992; Paavola et al., Pharm. Res. 12(12):1997-2002, 1995).
Типичные примеры терможелатинирующихся полимеров включают гомополимеры, такие как поли(N-метил-N-н-пропилакриламид), поли(N-н-пропилакриламид), поли(N-метил-N-изопропилакриламид), поли(N-н-пропилметакриламид), поли(N-изопропилакриламид), поли(N,н-диэтилакриламид), поли(N-изопропилметакриламид), поли(N-циклопропилакриламид), поли(N-этилметилакриламид), поли(N-метил-N-этилакриламид), поли(N-циклопропилметакриламид) и поли(N-этилакриламид). Другие терможелатинирующиеся полимеры можно получить путем приготовления сополимеров мономеров вышеуказанных полимеров или сочетанием подобных гомополимеров с другими водорастворимыми полимерами, такими как акрилмономеры (например, акриловая кислота и ее производные, такие как метакриловая кислота, акрилат и их производные, такие как бутилметакрилат, акриламид и N-н-бутилакриламид).
Другие показательные примеры терможелатинирующихся эфиров целлюлозы включают такие как гидроксипропилцеллюлозу, метилцеллюлозу, гидроксипропилметилцеллюлозу, этилгидроксиэтилцеллюлозу и плуроники, такие как F-127.
Полимерам по настоящему изобретению можно придать самую разнообразную форму, включая, например, такие как палочки, гранулы, пластинки, частицы, мицеллы, пленки, отлитые формы, шовные материалы, нити, гели, кремы, мази, спреи или капсулы (см., например, Goodell et al., Am. J. Hosp. Pharm. 43:1454-1461, 1986; Langer et al., «Controlled release of macromolecules from polymers», in Biomedical Polymers, Polymeric Materials and Pharmaceuticals for Biomedical Use, Goldberg, E.P., Nakagim, A. (eds.) Academic Press, pp. 113-137, 1980; Rhine et al., J. Pharm. Sci. 69:265-270, 1980; Brown et al., J. Pharm. Sci. 72:1181-1185, 1983 и Bawa et al., J. Controlled Release 1:259-267, 1985). Средство может быть включено путем растворения в полимере, введения в матриксы из полимера, присоединения ковалентными связями и инкапсулирования в микрокапсулы. В некоторых предпочтительных вариантах воплощения изобретения терапевтические композиции предлагаются в некапсулированных лекарственных формах, таких как микросферы для покрытия (размером в пределах от нанометров до микрометров), пасты, нити или шовные материалы различного размера, пленки и спреи.
Другие соединения, которые можно использовать для включения и/или доставки средств, обеспеченных здесь, включают композиции на основе витаминов (например, на основе витаминов A, D, E и/или K, см., например, публикации РСТ № WO 98/30205 и WO 00/71163) и липосомы (см. патенты США № 5534499, 5683715, 5776485, 5882679, 6143321, 6146659, 6200598 и публикации PCT № WO 98/34597, WO 99/65466, WO 00/01366, WO 00/53231, WO 99/35162, WO 00/117508, WO 00/125223, WO 00/149268, WO 00/1565438 и WO 00/158455).
Предпочтительно терапевтические композиции по настоящему изобретению получают способом, подходящим для предназначаемого применения. В некоторых аспектах настоящего изобретения терапевтическая композиция должна быть биосовместимой и высвобождать одно или несколько средств в течение периода от нескольких суток до месяцев. Кроме того, терапевтические композиции по настоящему изобретению предпочтительно должны быть стабильными в течение нескольких месяцев, и их можно было бы получать и хранить в стерильных условиях.
В некоторых аспектах настоящего изобретения терапевтические композиции можно получать любого размера в пределах от 50 нм до 500 мкм в зависимости от конкретного применения. Альтернативно подобные композиции можно также легко использовать в виде «спрея», который затвердевает в пленку или оболочку. Подобные спреи можно приготовить из микросфер различного размера, включая, например, от 0,1 мкм до 9 мкм, от 10 мкм до 30 мкм и от 30 мкм до 100 мкм.
Терапевтические композиции по настоящему изобретению можно также получить в виде различных «паст» или гелей. Например, в одном варианте воплощения изобретения терапевтические композиции готовят в виде жидкости при одной температуре (например, при температуре выше 37°С) и твердого или полутвердого вещества при другой температуре (например, при температуре тела или при температуре ниже 37°С). Также включаются полимеры, такие как плуроник F-127, которые являются жидкими при низкой температуре (например, 4°C) и становятся гелями при температуре тела. Подобные «термопасты» можно легко приготовить с помощью представленного здесь описания.
В других аспектах изобретения терапевтические композиции по настоящему изобретению можно приготовить в виде пленки. Предпочтительно, подобные пленки имеют толщину менее 5, 4, 3, 2 или 1 мм, более предпочтительно, толщину менее 0,75 мм или 0,5 мм и, наиболее предпочтительно, менее 500 мкм. Подобные пленки предпочтительно являются гибкими с высокой прочностью на растяжение (например, выше 50, предпочтительно, выше 100 и, более предпочтительно, выше 150 или 200 N/см2), обладают хорошими адгезивными свойствами (т.е. легко прилипают к увлажненным или влажным поверхностям) и имеют контролируемую проницаемость.
В некоторых вариантах воплощения изобретения терапевтические композиции могут также содержать дополнительные ингредиенты, такие как поверхностно-активные вещества (например, плуроники, такие как F-127, L-122, L-92, L-81 и L-61).
В дополнительных аспектах настоящего изобретения обеспечиваются полимеры, которые адаптированы для включения и высвобождения гидрофобного соединения, носителя, включающего гидрофобное соединение, в комбинации с углеводом, белком или полипептидом. В некоторых вариантах воплощения полимерный носитель содержит или включает области включения или гранулы одного или несколько гидрофобных соединений. Например, в одном варианте воплощения изобретения гидрофобные соединения можно включить в матрикс, который содержит гидрофобное соединение с последующим включением матрикса в полимерный носитель. В данном отношении можно использовать различные матриксы, включая, например, углеводы и полисахариды, такие как крахмал, целлюлоза, декстран, метилцеллюлоза и гиалуруновая кислота, белки или полипептиды, такие как альбумин, коллаген и желатин. В альтернативных вариантах воплощения гидрофобные соединения могут находиться в гидрофобном ядре, и данное ядро находится в гидрофильной оболочке.
Другие носители, которые также можно использовать для включения и доставки средств, описанных здесь, включают гидроксипропил- -циклодекстрин (Cserhati and Hollo, Int. J. Pharm. 108:69-75, 1994), липосомы (см., например, Sharma et al., Cancer Res. 53:5877-5881, 1993; Sharma и Straubinger, Pharm. Res. 11(60):889-896, 1994; публикация WO 93/18751; патент США № 5242073), липосому/гель (публикация WO 94/26254), нанокапсулы (Bartoli et al., J. Microencapsulation 7(2):191-197, 1990), мицеллы (Alkan-Onyuksel et al., Pharm. Res. 11(2):206-212, 1994), имплантаты (Jampel et al., Invest. Ophthalm. Vis. Science 34(11):3076-3083, 1993; Walter et al., Cancer Res. 54:2217-2212, 1994), наночастицы (Violante и Lanzafame PAACR), модифицированные наночастицы (патент США № 5145684), наночастицы (поверхностно-модифицированные) (патент США № 5399363), эмульсию/раствор таксола (патент США № 5407683), мицеллы (поверхностно-активные) (патент США № 5403858), синтетические фосфолипиды (патент США № 4534899), газообразные дисперсии (патент США № 5301664), пену, спрей, гель, лосьон, крем, мазь, диспергированные везикулы, твердые или жидкие аэрозоли в виде частиц или капель, микроэмульсии (патент США № 5330756), полимерную оболочку (нано- и микрокапсулы) (патент США № 5439686), композиции на основе таксоидов в поверхностно-активном веществе (патент США № 5438072), жидкие эмульсии (Tarr et al., Pharm Res. 4:62-165, 1987), наносферы (Hagan et al., Proc. Intern. Symp. Control Rel. Bioact. Mater. 22, 1995; Kwon et al., Pharm Res. 12(2): 192-195; Kwon et al., Pharm Res. 10(7):970-974; Yokoyama et al., J. Contr. Rel. 32:269-277, 1994; Gref ef al., Science 263:1600-1603, 1994; Bazile et al., J. Pharm. Sci. 84:493-498, 1994) и имплантаты (патент США № 4882168). -циклодекстрин (Cserhati and Hollo, Int. J. Pharm. 108:69-75, 1994), липосомы (см., например, Sharma et al., Cancer Res. 53:5877-5881, 1993; Sharma и Straubinger, Pharm. Res. 11(60):889-896, 1994; публикация WO 93/18751; патент США № 5242073), липосому/гель (публикация WO 94/26254), нанокапсулы (Bartoli et al., J. Microencapsulation 7(2):191-197, 1990), мицеллы (Alkan-Onyuksel et al., Pharm. Res. 11(2):206-212, 1994), имплантаты (Jampel et al., Invest. Ophthalm. Vis. Science 34(11):3076-3083, 1993; Walter et al., Cancer Res. 54:2217-2212, 1994), наночастицы (Violante и Lanzafame PAACR), модифицированные наночастицы (патент США № 5145684), наночастицы (поверхностно-модифицированные) (патент США № 5399363), эмульсию/раствор таксола (патент США № 5407683), мицеллы (поверхностно-активные) (патент США № 5403858), синтетические фосфолипиды (патент США № 4534899), газообразные дисперсии (патент США № 5301664), пену, спрей, гель, лосьон, крем, мазь, диспергированные везикулы, твердые или жидкие аэрозоли в виде частиц или капель, микроэмульсии (патент США № 5330756), полимерную оболочку (нано- и микрокапсулы) (патент США № 5439686), композиции на основе таксоидов в поверхностно-активном веществе (патент США № 5438072), жидкие эмульсии (Tarr et al., Pharm Res. 4:62-165, 1987), наносферы (Hagan et al., Proc. Intern. Symp. Control Rel. Bioact. Mater. 22, 1995; Kwon et al., Pharm Res. 12(2): 192-195; Kwon et al., Pharm Res. 10(7):970-974; Yokoyama et al., J. Contr. Rel. 32:269-277, 1994; Gref ef al., Science 263:1600-1603, 1994; Bazile et al., J. Pharm. Sci. 84:493-498, 1994) и имплантаты (патент США № 4882168).
Средства, обеспеченные здесь, можно также формулировать в виде стерильной композиции (например, обработкой композиции этиленоксидом или облучением), упакованной с консервантами или другими подходящими добавками, пригодными для введения людям. Аналогичным образом обеспеченные здесь устройства (например, покрытый катетер) можно стерилизовать и сделать подходящими для имплантации людям.
III. Медицинские имплантаты
А. Типичные медицинские имплантаты
Самые разнообразные имплантаты или устройства можно покрыть или сконструировать иначе для включения и/или высвобождения терапевтических средств, обеспеченных здесь. Показательные примеры включают сердечно-сосудистые устройства (например, имплантируемые венозные катетеры, венозные порты, туннелизированные венозные катетеры, инфузионные линии или порты для длительной постановки, включая инфузионные катетеры для печеночной артерии, кардиостимуляторы (см., например, патенты США №№ 4662382, 4782836, 4856521, 4860751, 5101824, 5261419, 5284491, 6055454, 6370434 и 6370434), имплантируемые дефибрилляторы сердца (см. патенты США №№ 3614954, 3614955, 4375817, 5314430, 5405363, 5607385, 5697953, 5776165, 6067471, 6169923 и 6152955)); неврологические и нейрохирургические устройства (например, вентрикулярные перитонеальные шунты, вентрикулярные предсердные шунты, устройства для стимуляции нервов, пластыри для твердой оболочки мозга и имплантаты для предупреждения развития эпидурального фиброза после ламинэктомии, устройства для постоянных субарахноидальных инфузий); желудочно-кишечные устройства (например, постоянные катетеры для длительного нахождения, трубки для кормления, портосистемные шунты, шунты, используемые при асците, перитонеальные имплантаты для введения лекарственных препаратов, катетеры для перитонеального диализа и имплантаты с суспензиями или твердыми веществами для предупреждения образования спаек после операций); устройства для мочеполовой системы (например, маточные имплантаты, включая внутриматочные устройства (IUD) и устройства для предупреждения гиперплазии эндометрия, имплантаты для фаллопиевых труб, включая устройства для обратимой стерилизации, стенты для фаллопиевых труб, искусственные сфинктеры и периуретральные имплантаты при недержании мочи, мочеточниковые стенты, постоянные катетеры для длительного нахождения, устройства для увеличения объема мочевого пузыря или покровы или шины для вазовазостомии, катетеры для центральных вен (см., например, патенты США №№ 3995623, 4072146 4096860, 4099528, 4134402, 4180068, 4385631, 4406656, 4568329, 4960409, 5176661, 5916208), уретральные катетеры (см., например, патенты США №№ 2819718, 4227533, 4284459, 4335723, 4701162, 4571241, 4710169 и 5300022), искусственные сердечные клапаны (см., например, патенты США №№ 3656185, 4106129, 4892540, 5528023, 5772694, 6096075, 6176877, 6358278 и 6371983), имплантаты сосудов (см., например, патенты США №№ 3096560, 3805301, 3945052, 4140126, 4323525, 4355426, 4475972, 4530113, 4550447, 4562596, 4601718, 4647416, 4878908, 5024671, 5104399, 5116360, 5151105, 5197977, 5282824, 5405379, 5609624, 5693088 и 5910168), офтальмологические имплантаты (например, имплантаты мультино и другие имплантаты при неоваскулярной глаукоме, контактные линзы, выделяющие лекарственный препарат при птеричиях, шины при неудачной дакроцисталриностомии, контактные линзы, выделяющие лекарственный препарат при неоваскуляризации роговицы, имплантаты при диабетической ретинопатии, контактные линзы, выделяющие лекарственный препарат при наличии высокого риска при трансплантации роговицы); отоларингологические устройства (например, имплантаты косточки, шины или стенты евстахиевой трубы при повреждении уха или хроническом отите как альтернатива дренажам); пластические хирургические имплантаты (например, имплантаты молочной железы или имплантаты подбородка); манжетки катетеров и ортопедические имплантаты (например, цементированные ортопедические протезы).
В. Способы получения медицинских имплантатов, содержащих терапевтические средства
Имплантаты или другие хирургические или медицинские устройства могут быть обернутыми, покрытыми, контактированными, комбинированными, нагруженными, наполненными, связанными с или адаптированными иначе для высвобождения терапевтических средств и композиций по настоящему изобретению с помощью самых различных способов, например, включая: (а) непосредственное присоединение терапевтического средства или композиции к имплантату или устройству (например, опрыскиванием имплантата или устройства пленкой из полимера/лекарственного препарата или погружением имплантата или устройства в раствор полимера/лекарственного препарата или с помощью другого ковалентного или нековалентного способа присоединения; (b) покрытие имплантата или устройства веществом, таким как гидрогель, который, в свою очередь, абсорбирует терапевтическую композицию (или терапевтический фактор, указанный выше); (с) вплетение нити, покрытой терапевтической композицией (или сам полимер формируют в виде нити) в имплантат или устройство; (d) включение имплантата или устройства в муфту или сеть, которые состоят или покрыты терапевтической композицией; (e) конструирование самого имплантата или устройства, содержащим терапевтическое средство, или композицию, или (f) адаптирование иначе имплантата или устройства к высвобождению терапевтического средства. В предпочтительных вариантах воплощения изобретения композиция должна плотно прилегать к имплантату или устройству во время хранения и во время вставки. Предпочтительно также, чтобы терапевтическое средство или композиция не разлагались во время хранения, перед вставкой или при нагревании до температуры тела после вставки в организм (если это требуется). Кроме того, предпочтительно, чтобы оно накрывало или покрывало желаемые области имплантата или устройства гладко и равномерно с однородным распределением терапевтического средства. В предпочтительных вариантах воплощения изобретения терапевтическое средство или композиция должны обеспечивать однородное, предсказуемое, пролонгированное высвобождение терапевтического фактора в ткани, окружающие имплантат или устройство, при его применении. Для сосудистых стентов в дополнение к вышеуказанным свойствам композиция не должна придавать стенту способность к тромбообразованию (вызывать свертывание крови) или вызывать существенную турбулентность кровотока (в большей степени, чем это предполагается для непокрытого стента).
В некоторых вариантах воплощения изобретения терапевтическое средство может располагаться непосредственно на всем или части устройства (см., например, патенты США №№ 6096070 и 6299604) или находиться в смеси с системой доставки или носителем (например, полимером, липосомой или витамином, упомянутыми выше), которые находятся на всем устройстве или его части (см. патенты, заявки на патенты и источники, перечисленные выше в разделе «Композиции и составы»).
В некоторых аспектах изобретения терапевтические средства можно присоединить к медицинскому имплантату с использованием нековалентных связей. Например, для соединений, которые являются относительно плохо растворимыми в воде или нерастворимыми в воде, соединение можно растворить в органическом растворителе в определенной концентрации. Растворитель, выбранный для данного применения, не должен приводить к растворению или набуханию полимерной поверхности устройства. Медицинский имплантат затем можно погрузить в раствор, извлечь и затем высушить (высушить на воздухе и/или вакуумной сушкой). Альтернативно данный раствор лекарственного препарата можно распылить на поверхность имплантата. Это можно осуществить с использованием обычной технологии покрытия распылением. Продолжительность высвобождения при данном способе покрытия будет являться относительно короткой и будет функцией растворимости лекарственного препарата в жидкости организма, в которую он помещается.
В другом аспекте терапевтическое средство можно растворить в растворителе, обладающем способностью приводить к набуханию или частичному растворению поверхности полимерного имплантата. В зависимости от сочетания растворитель/полимер имплантата имплантат можно погрузить в раствор лекарственного препарата на период времени, в течение которого лекарственный препарат может диффундировать в поверхностный слой полимерного устройства. Альтернативно раствор лекарственного препарата можно нанести распылением на всю поверхности имплантата или на его часть. Профиль высвобождения лекарственного препарата зависит от растворимости препарата в поверхностном полимерном слое. При использовании данного подхода можно гарантировать, что растворитель не приведет к значительному нарушению или изменению размеров медицинского имплантата.
Если имплантат состоит из материалов, которые не дают возможности включать терапевтическое средство в поверхностный слой с использованием вышеуказанного способа с растворителем, можно обработать поверхность устройства способом плазменной полимеризации таким образом, чтобы поверхность устройства покрывалась тонким полимерным слоем. Примеры подобных способов включают покрытие париленом устройств и применение различных мономеров, таких как мономеры гидроциклосилоксана, акриловая кислота, мономеры акрилата, мономеры метакриловой кислоты или метакрилата. Затем можно использовать способы покрытия погружением или покрытия распылением, описанные выше, для включения терапевтического средства в покрытую поверхность имплантата.
Для терапевтических средств, которые в некоторой степени обладают растворимостью в воде, удерживание данных соединений на поверхности устройства является относительно непродолжительным. Для терапевтических средств, содержащих ионные группы, возможно образование ионных комплексов данных средств с соединениями с противоположным зарядом, которые имеют гидрофобный компонент. Например, терапевтические средства, содержащие аминогруппы, можно комплексовать с такими соединениями, как додецилсульфат натрия (SDS). Соединения, включающие карбоксильные группы, можно комплексовать с хлоридом тридодецилметиламмония (TDMAC). Например, митоксантрон имеет две вторичные аминогруппы и находится в виде хлорида. Данное соединение можно добавить к додецилсульфату натрия для образования комплекса. Данный комплекс можно растворить в органическом растворителе, который затем можно использовать для покрытия погружением или покрытия распылением. Доксорубицин имеет в своей молекуле аминогруппу и таким образом его можно комплексовать с SDS. Затем данный комплекс можно нанести на устройство способом покрытия погружением или покрытия распылением. Например, метотрексат включает 2 карбоксильные кислотные группы и таким образом его можно комплексовать с TDMAC и затем нанести на медицинский имплантат.
Для терапевтических средств, обладающих способностью образовывать ионные комплексы или водородные связи, высвобождение данных средств из устройства можно модифицировать при использовании органических соединений, которые обладают способностью образовывать ионные или водородные связи с терапевтическим средством. Как описано выше, комплекс заряженного ионами терапевтического средства и противоположно заряженного гидрофобного соединения можно получить перед нанесением данного комплекса на медицинский имплантат. В другом варианте воплощения соединение, обладающее способностью образовывать ионные или водородные связи с терапевтическим средством, можно включить в имплантат во время производственного процесса или во время процесса покрытия. Альтернативно, данное соединение можно включить в полимер для покрытия, который наносят на имплантат, или во время процесса загрузки терапевтического средства в или на имплантат. Данные средства могут включать жирные кислоты (например, пальмитиновую кислоту, стериновую кислоту, лауриновую кислоту), алифатические кислоты, ароматические кислоты (например, бензойную кислоту, салициловую кислоту), циклоалифатические кислоты, алифатические (стериловый спирт, лауриловый спирт, цетиловый спирт) и ароматические спирты, а также многофункциональные спирты (например, лимонную кислоту, винную кислоту, пентаэритрит), липиды (например, фосфатидилхолин, фосфатидилэтаноламин), углеводы, сахара, спермин, спермидин, алифатические и ароматические амины, природные и синтетические аминокислоты, пептиды или белки. Например, жирную кислоту, такую как пальмитиновая кислота, можно использовать для модуляции высвобождения 5-фторурацила из имплантата.
Для терапевтических средств, обладающих способностью образовывать ионные комплексы или водородные связи, высвобождение данных средств из имплантата можно модифицировать при использовании полимеров, обладающих способностью образовывать ионные или гидрофобные связи с терапевтическим средством. Например, терапевтические средства, содержащие аминогруппы, могут образовывать ионные комплексы с боковыми группами сульфоновой или карбоновой кислот или концевыми группами полимера. Примеры полимеров, которые можно использовать для данного применения, включают, но не ограничиваются только ими, полимеры и сополимеры, которые получены при использовании акриловой кислоты, метакриловой кислоты, стирол сульфоната натрия, стиролсульфоновой кислоты, малеиновой кислоты или 2-ариламидо-2-метилпропансульфоновой кислоты. Полимеры, которые были модифицированы сульфированием после полимеризации, также можно использовать в данном применении. Например, медицинский имплантат можно покрыть или получить с полимером, который включает нафион, сульфированный фторполимер. Затем данное медицинское устройство можно погрузить в раствор, содержащий включающее аминогруппу терапевтическое средство. Включающее аминогруппу терапевтическое средство также можно нанести способом покрытия распылением. Метотрексат и доксорубицин представляют собой примеры терапевтических средств, которые можно использовать в данном применении.
Известно, что присутствие бактерий на поверхности имплантата может приводить к локализованному снижению рН. Для полимеров, которые содержат ионообменные группы, например карбоксильные группы, известно, что данные полимеры могут локально повышать высвобождение терапевтического средства в ответ на локализованное снижение рН в результате присутствия бактерий. Для терапевтических средств, содержащих карбоксильные кислые группы, можно использовать полимеры с боковыми концевыми группами, включающими первичные, вторичные, третичные или четвертичные амины для модуляции высвобождения терапевтического средства.
Терапевтические средства с доступными функциональными группами можно ковалентно присоединить к поверхности медицинского имплантата с использованием нескольких химических способов. Если полимерный материал, который применяется для производства имплантата, имеет доступные поверхностные функциональные группы, то их можно использовать для ковалентного соединения со средством. Например, если поверхность имплантата содержит карбоксильные кислые группы, то данные группы можно превратить в активированные карбоксильные кислые группы (например, хлорангидриды кислот, сукцинимидильные производные, производные 4-нитрофенилэфиров и т.д.). Данные активированные карбоксильные кислые группы могут затем взаимодействовать с функциональными аминогруппами, которые находятся в молекуле терапевтического средства (например, метотрексат, митоксантрон).
Для поверхностей, которые не содержат соответствующие функциональные группы, данные группы можно ввести в поверхность полимера посредством плазменной обработки. Например, карбоксильные кислые группы можно ввести посредством способа плазменной обработки (например, при использовании О2 и/или СО2 в качестве компонента в подаваемой газовой смеси). Также карбоксильные кислые группы можно ввести с использованием акриловой кислоты или метакриловой кислоты в газовом потоке. Затем данные карбоксильные группы можно превратить в активированные карбоксильные группы (например, хлорангидриды кислот, сукцинимидильные производные, производные 4-нитрофенилэфиров и т.д.), которые затем будут взаимодействовать с функциональными аминогруппами, которые находятся в молекуле терапевтического средства.
В дополнение к непосредственному ковалентному связыванию с поверхностью имплантата, терапевтические средства с доступными функциональными группами можно ковалентно связать с медицинским имплантатом посредством линкера. Данные линкеры могут быть разлагаемыми или неразлагаемыми. Предпочтительными являются линкеры, которые расщепляются в результате гидролиза или под действием ферментов. Данные линкеры могут включать азо, эфирные, амидные, тиоэфирные, ангидридные или фосфоэфирные связи.
Для дополнительной модуляции высвобождения терапевтического средства из медицинского имплантата, участки или весь медицинский имплантат можно дополнительно покрыть полимером. Полимерное покрытие может содержать полимеры, описанные выше. Полимерное покрытие можно наносить способом покрытия погружением, способом покрытия распылением или способом плазменной обработки. Данную оболочку, если желательно, можно дополнительно поперечно «сшить» с использованием термического, химического метода или облучения (например, видимым светом, ультрафиолетовым светом, е-пучком, гамма-облучением, облучением рентгеновскими лучами) для дополнительной модуляции высвобождения терапевтического средства из медицинского имплантата.
Данное полимерное покрытие может дополнительно включать агенты, которые повышают гибкость (например, пластификаторы-глицерин, триэтилцитрат), смазывающую способность (например, гиалуроновую кислоту), биосовместимость или гемосовместимость (например, гепарин) покрытия.
Представленные выше способы описывают способы включения терапевтического средства в или на медицинский имплантат. В или на медицинский имплантат можно также включить дополнительные антибактериальные или противогрибковые средства. Данные антибактериальные или противогрибковые средства можно включить в или на медицинский имплантат до, одновременно или после включения терапевтических средств, описанных выше, в или на медицинский имплантат. Средства, которые можно использовать, включают, но не ограничиваются только ими, соединения серебра (например, хлорид серебра, нитрат серебра, оксид серебра), ионы серебра, частицы серебра, йод, повидон/йод, хлоргексидин, 2-п-сульфаниланилиноэтанол, 4,4-сульфинилдианилин, 4-сльфаниламидосалициловую кислоту, ацедиасульфон, ацетосульфон, амикацин, амоксициллин, амфотерицин В, ампициллин, апалциллин, апициклин, апрамицин, арбекацин, аспоксициллин, азидамфеникол, азитромицин, азтреонам, бацитрацин, бамбермицин(цины), биапенем, бродимоприм, бутирозин, капреомицин, карбенициллин, карбомицин, карумонам, цефадроксил, цефамандол, цефатризин, сефбуперазон, цефклидин, цефдинир, цефдиторен, цефепим, цефетамет, цефиксим, цефиненоксим, цефминокс, цефодизим, цефоницид, цефоперазон, цефоранид, цефотаксим, цефотетан, цефотиам, цефозопран, цефпимизол, цефпирамид, цефпиром, цефпрозил, цефроксадин, цефтазидим, цефтерам, цефтибутен, цефтриаксон, цефузонам, цефалексин, цефалоглицин, цефалоспорин С, цефрадин, хлорамфеникол, хлортетрациклин, ципрофлоксацин, кларитромицин, клинафлоксацин, клиндамицин, кломоциклин, колистин, циклациллин, дапзон, демеклоциклин, диатимосульфон, дибекацин, дигидрострептомицин, диритромицин, доксициклин, эноксацин, энвиомицин, эпициллин, эритромицин, фломоксеф, фортимицин(ы), гентамицин(ы), глюкосульфон соласульфон, грамицидин S, грамицидин(ы), грепафлоксацин, гуамециклин, гетациллин, имипенем, изепамицин, йозамицин, канамицин(ы), лейкомицин(ы), линкомицин, ломефлоксацин, луценсомицин, лимециклин, меклоциклин, меропенем, метациклин, микрономицин, мидекамицин(ы), миноциклин, моксалактам, мупироцин, надифлоксацин, натамицин, неомицин, нетилмицин, норфлоксацин, олендомицин, окситетрациклин, п-сльфанилбензиламин, панипенем, паромомицин, пазуфлоксацин, пенициллин N, пипациклин, пипемидовая кислота, полимиксин, примицин, хинациллин, рубостамицин, рифамид, рифампин, рифамицин SV, рифапентин, рифаксимин, ристоцетин, ритипенем, рокитамицин, ролитетрациклин, розарамицин, рокситромицин, салазосульфадимидин, санциклин, сисомицин, спарфлоксацин, спектиномицин, спирамицин, стрептомицин, сукцисульфон, сульфахризоидин, сульфалоксиковая кислота, сульфамидохризоидин, сульфаниликовая кислота, сульфоксон, теикопланин, темафлоксацин, темоциллин, тетрациклин, тетроксоприм, тиамфеникол, тиазолсульфон, тиострептон, тикарциллин, тигемонам, тобрамицин, тозуфлоксацин, триметоприм, тиоспектомицин, тровафлоксацин, туберактиномицин, ванкомицин, азасерин, кандицидин(ы), хлорфенезин, дермостатин(ы), филипин, фунгихромин, мепартрицин, нистатин, олигомицин(ы), ципрофлаксацин, норфлоксацин, офлоксацин, пефлоксацин, эноксацин, розоксацин, амифлоксацин, флероксацин, темафлоаксицин, ломефлоксацин, перимицин А или туберцидин и тому подобное.
IV. Клинические применения
Для дополнительного понимания изобретения ниже подробно обсуждаются различные клинические применения композиций, способов и устройств, представленных здесь.
Кратко, как указывалось выше, в одном аспекте изобретения обеспечиваются способы профилактики, снижения и/или подавления инфекции, связанной с медицинским устройством или имплантатом, включающие стадию введения пациенту медицинского имплантата, который высвобождает химиотерапевтическое средство, где химиотерапевтическое средство снижает, подавляет или предупреждает рост или распространение чужеродных микроорганизмов (например, бактерий, грибов или вирусов). В том смысле, в котором этот термин здесь используется, средства, которые снижают, подавляют или предупреждают рост или распространение чужеродных микроорганизмов у пациента, означает, что рост или распространение чужеродного микроорганизма снижаются, подавляются или предупреждаются статистически значимым образом, по меньшей мере, по одному клиническому результату или по критериям, обычно используемым специалистами в данной области в качестве диагностических показателей. В предпочтительном варианте воплощения медицинский имплантат обернут или покрыт антрациклином (например, доксорубицином и митоксантроном), фторпиримидином (например, 5-FU), антагонистом фолиевой кислоты (например, метотрексатом), подофилотоксином (например, этопозидом), камптотецином, гидроксимочевиной и/или комплексом платины (например, цисплатином).
Особо предпочтительные средства, которые применяются в контексте настоящего изобретения, должны иметь MIC (минимальную ингибирующую концентрацию) ниже или, равную одному из следующих значений 10-4 М, 10-5 М, 10-6 М или 10-7 М. Кроме того, особенно предпочтительные средства подходят для применения в концентрациях ниже 10%, 5% или даже 1% от концентрации, обычно используемой в химиотерапевтических применених (Goodman and Gilman's The Pharmacological Basis of Therapeutics. Editors J.G. Hardman L.L. Limbird. Consulting editor A.Goodman Gilman Tenth Edition. McGraw-Hill Medical publishing division. 10th edition, 2001, 2148 pp.). Наконец, устройства предпочтительно должны быть стерильными и подходящими для применения у людей.
А. Инфекции, связанные с сосудистыми катетерами
Ежегодно в США более чем 30 млн пациентам проводят инфузионную терапию. Фактически 30% от всех госпитализированных пациентов ставят, по меньшей мере, один сосудистый катетер во время их пребывания в больнице. Для инфузионной терапии применяются самые разнообразные медицинские устройства, включая, но не ограничиваясь только ими, периферические внутривенные катетеры, катетеры для центральных вен, катетеры для общего парентерального питания, введенные периферически катетеры для центральных вен (линии PIC), имплантируемые внутрисосудистые устройства для доступа, катетеры-баллоны для легочной артерии с направленным потоком, артериальные линии и катетеры для центральных вен для длительной постановки (линии Hickman, катетеры Broviac).
К сожалению, сосудистые катетеры предрасположены к инфицированию различными бактериями и являются частой причиной инфекции системы кровообращения. Из 100000 случаев инфекций кровообращения, ежегодно регистрируемых в больницах США, многие связаны с присутствием внутрисосудистого устройства. Например, 55000 случаев инфекций кровообращения вызваны катетерами для центральных вен, в то время как значительный процент остальных случаев относится к катетерам для периферических вен и артериальным линиям.
Бактериемия, связанная с присутствием внутрисосудистых устройств, не является простой клинической проблемой: 50% всех пациентов, у которых развивается данный тип инфекции, погибает в результате этого (более 23000 смертельных исходов ежегодно), и у выживших пациентов пребывание в больнице возрастает в среднем на 24 дня. Осложнения, связанные с инфекциями кровообращения, включают целлюлиты, образование абсцессов, септический тромбофлебит и инфекционный эндокардит. Следовательно, в клинике имеется насущная потребность в снижении заболеваемости и смертности, связанных с инфекциями, вызванными внутрисосудистыми катетерами.
Наиболее частой точкой проникновения для вызывающих инфекции бактерий является путь вдоль устройства от места введения в кожу. Микрофлора кожи распространяется по внешней стороне устройства с получением, в конечном итоге, доступа в кровоток. Другие возможные источники инфекции включают загрязненный инфузат, загрязнение сочленения поршневых инфузионных трубок катетера для инфузии и больничный персонал. Частота развития инфекций возрастает с удлинением времени нахождения катетера на месте, и любое устройство, остающееся in situ в течение более чем 72 ч, является особенно чувствительным. Наиболее распространенные возбудители инфекции включают обычную микрофлору кожи, такую как отрицательные на коагулазу стафилококки (S. epidermidis, S. saprophyticus) и Staphylococcus aureus (особенно MRSA, резистетные к метициллину S. aureus), которые являются причиной 2/3 всех инфекций. Отрицательные на коагулазу стафилококки (CNS) представляют наиболее часто выделяемые микроорганизмы из крови госпитализированных больных. Инфекции, вызываемые CNS, имеют тенденцию быть вялотекущими; часто проявляются после длительного латентного периода между обсеменением (т.е. воздействием на медицинское устройство бактерий CNS кожи во время имплантации) и началом клинического проявления заболевания. К сожалению, причиной большей части клинически значимых инфекций, вызываемых CNS, являются штаммы бактерий, которые резистентны ко многим антибиотикам, что особенно затрудняет их лечение. Другие микроорганизмы, о которых известно, что они вызывают инфекции, связанные с сосудистыми катетерами, включают энтерококки (например, E. coli, VRE, резистентные к ванкомицину энтерококки), грамотрицательные аэробные бациллы, Pseudomonas aeruginosa, Klebsiella spp., Serratia marcescens, Burkholderia cepacia, Citrobacter freundii, Corynebacteria spp. и виды Candida.
Для большинства случаев инфекций, вызванных сосудистым катетером, необходимо удаление катетера и лечение системными антибиотиками (хотя существует мало антибиотиков, являющихся действительно эффективными), при том, что ванкомицин является препаратом выбора. Как указывалось ранее, смертность, связанная с инфекциями, причиной которых является сосудистый катетер, высокая, одновременно также высокими являются показатели заболеваемости и стоимости лечения выживших людей.
Следовательно, очень важно разработать сосудистые катетеры, способные снижать частоту развития инфекций кровообращения. Поскольку невозможно предугадать заранее, какие катетеры будут инфицированы, целесообразно любой катетер, который предназначен для нахождения на месте в течение более двух суток, покрывать терапевтическим средством, способным снижать частоту колонизации бактерий на устройстве. Идеальная терапевтическая оболочка будет обладать одним или несколькими из следующих свойств: а) способностью убивать, предупреждать или подавлять колонизацию широкого ряда потенциальных возбудителей инфекций, включая большинство или все перечисленные выше виды; b) способностью убивать, предупреждать или подавлять колонизацию бактерий (таких, как CNS и VRE), которые резистентны ко многим антибиотикам; с) применением терапевтического средства, которое маловероятно будет использоваться для лечения инфекции кровообращения (т.е. не следует покрывать устройство антибиотиком широкого спектра действия, поскольку, если на устройстве появится штамм бактерий, устойчивый к антибиотикам, то будет бесполезным системное лечение пациента, поскольку возбудитель инфекции будет резистентным к потенциально используемому терапевтическому средству).
Несколько групп противоопухолевых средств являются особенно подходящими для включения в покрытие для сосудистых катетеров, а именно антрациклины (например, доксорубицин и митоксантрон), фторпиримидины (например, 5-FU), антагонисты фолиевой кислоты (например, метотрексат) и подофилотоксины (например, этопозид). Данные средства обладают высокой антибактериальной активностью против CNS (S. epidermidis) и Staphylococcus aureus - наиболее распространенных возбудителей инфекций, связанных с сосудистыми катетерами. Особенно предпочтительными средствами являются доксорубицин, митоксантрон, 5-фторурацил и их аналоги и производные, которые также обладают активностью против Escheridia coli и Pseudomonas aeruginosa. Важно отметить, что не все противоопухолевые средства подходят для практики настоящего изобретения, поскольку несколько средств, включая, например, 2-меркаптопурин, 6-меркаптопурин, гидроксимочевину, цитарабин, цисплатин, туберцидин, паклитаксел и камптотецин не обладают антибактериальным действием против микроорганизмов, о которых известно, что они вызывают инфекции, связанные с сосудистыми катетерами.
1. Катетеры для центральных вен
Для целей настоящего изобретения термин «катетер для центральных вен» подразумевается для включения любого катетера или линии, используемых для введения жидкостей в крупные (центральные) вены организма (например, яремную, легочную, бедренную, подвздошную, нижнюю полую вену, верхнюю полую вену, подмышечную и т.д.). Примеры данных катетеров включают катетеры для центральных вен, катетеры для общего парентерального питания, введенные периферически катетеры для центральных вен, катетеры-баллоны для легочной артерии с направленным потоком, катетеры для центральных вен для длительной постановки (такие, как линии Hickman и катетеры Broviac). Типичные примеры данных катетеров описаны в патентах США № 3995623, 4072146, 4096860, 4099528, 4134402, 4180068, 4385631, 4406656, 4568329, 4960409, 5176661, 5916208.
Как уже указывалось выше, 55000 случаев инфекций крови ежегодно в США вызваны катетерами для центральных вен, приводя в 23000 случаев к фатальному исходу. Риск инфицирования возрастает с увеличением продолжительности нахождения катетера на месте, особенно если он используется более чем в течение 72 ч. Тяжелые инфекционные осложнения от катетеров для центральных вен также включают инфекционный эндокардит и гнойный флебит крупных вен. Если устройство становится инфицированным, его нужно переместить на новое место (замена вне проводов неприемлема), что способствует возникновению риска развития у пациента механических осложнений от введения таких, как кровотечение, пневмоторакс и гемоторакс. Кроме того, также требуется терапия системными антибиотиками. Эффективная терапия будет снижать частоту инфицирования устройства, уменьшать частоту развития инфекций кровообращения, уменьшать смертность, снижать частоту осложнений (таких, как эндокардит или гнойный флебит), пролонгировать эффективность катетера для центральных вен и/или уменьшать необходимость в замене катетера. Все это будет приводить к снижению заболеваемости и смертности пациентов с катетерами для центральных вен.
В предпочтительном варианте воплощения доксорубицин, митоксантрон, 5-фторурацил и/или этопозид включают в покрытие, наносимое на поверхность сосудистого катетера. Лекарственный препарат(ы) можно наносить на систему катетера для центральных вен несколькими способами: а) в виде покрытия, нанесенного на внешнюю поверхность внутрисосудистого участка катетера и/или сегмента катетера, который проходит через кожу; b) в виде покрытия, нанесенного на внутреннюю или внешнюю поверхность внутрисосудистого участка катетера и/или сегмента катетера, который проходит через кожу; с) в виде включения в полимеры, которые составляют внутрисосудистый участок катетера; d) в виде включения или нанесения на поверхность подкожной «манжеты» вокруг катетера; е) в виде включения в раствор инфузата; f) в виде включения в или нанесения в виде оболочки на поршень катетера, соединения и/или инфузионную трубку и g) при любом сочетании вышеуказанного.
Покрытие лекарственным препаратом или включение лекарственного препарата в катетер для центральных вен позволит обеспечить концентрации бактерицидного препарата местно на поверхности катетера, тем самым снижая частоту колонизации бактерий на сосудистом катетере (и последующего развития инфекций кровообращения), одновременно обеспечивая незначительное системное действие препаратов. Несмотря на то, что для некоторых средств не требуется полимерных носителей для прикрепления лекарственного препарата к поверхности катетера, некоторые полимерные носители особенно подходят для применения в данном варианте воплощения. Особый интерес представляют такие полимерные носители, как полиуретаны (например, ChronoFlex AL 85A [CT Biomaterials], HydroMed640 [CT Biomaterials], HYDROSLIP C [CT Biomaterials], HYDROSLIP C [CT Biomaterials], HYDROTHANE [CT Biomaterials], HYDROTHANE [CT Biomaterials]), акриловые и метакриловые сополимеры (например, поли(этилен-со-акриловая кислота), полимеры, производные целлюлозы (например, нитроцеллюлоза, ацетобутират целлюлозы, ацетопропионат целлюлозы), сополимеры акрилата и метакрилата (например, поли(этилен-со-винилацетат)), а также их смеси. [CT Biomaterials]), акриловые и метакриловые сополимеры (например, поли(этилен-со-акриловая кислота), полимеры, производные целлюлозы (например, нитроцеллюлоза, ацетобутират целлюлозы, ацетопропионат целлюлозы), сополимеры акрилата и метакрилата (например, поли(этилен-со-винилацетат)), а также их смеси.
Поскольку катетеры для центральных вен изготавливают в самых различных конфигурациях и размерах, точное вводимое количество будет варьироваться в зависимости от размера, площади поверхности и конструкции устройства. Однако можно использовать определенные принципы при применении в данной области. Количество лекарственного препарата можно рассчитать как функцию количества на единицу площади (участка устройства, который подлежит покрытию), можно определить общее количество препарата для введения и соответствующие поверхностные концентрации активного препарата. Независимо от способа нанесения препарата на катетер для центральных вен предпочтительные противоопухолевые препараты, используемые по отдельности или в комбинации, следует вводить, руководствуясь следующими правилами дозирования:
(а) Антрациклины. При использовании доксорубицина в качестве примера антрациклинов в виде полимерного покрытия, включения в полимеры, из которых изготовлен катетер, или нанесенного без полимерного носителя, общее количество доксорубицина, наносимого на катетер для центральных вен (и другие компоненты инфузионной системы), не должно превышать 25 мг (в пределах от 0,1 мкг до 25 мг). В особо предпочтительном варианте воплощения общее количество препарата, нанесенного на катетер для центральных вен (и другие компоненты инфузионной системы), должно находиться в пределах от 1 мкг до 5 мг. Доза на единицу площади устройства (т.е. количество препарата как функция площади поверхности участка устройства, на который наносят и/или в который включают лекарственный препарат) должна находиться в пределах 0,01 мкг-100 мкг на 1 мм2 площади поверхности. В особо предпочтительном варианте воплощения доксорубицин следует наносить на поверхность устройства в дозе в пределах 0,1-10 мкг/мм2. Поскольку различные полимерные и неполимерные оболочки будут высвобождать доксорубицин с различной скоростью, вышеуказанные параметры дозирования следует использовать с учетом скорости высвобождения лекарственного препарата с поверхности устройства так, чтобы на поверхности устройства поддерживалась минимальная концентрация доксорубицина 10-7-10-4 М. Необходимо обеспечить гарантию того, чтобы концентрации лекарственного препарата на поверхности устройства превышали концентрации доксорубицина, известные как летальные для многих видов бактерий и грибов (т.е. выше 10-4 М, хотя для некоторых вариантов воплощения требуются более низкие концентрации). В предпочтительном варианте воплощения доксорубицин высвобождается с поверхности устройства таким образом, что противоинфекционная активность сохраняется в течение периода времени от нескольких часов до нескольких месяцев. В особо предпочтительном варианте воплощения лекарственный препарат высвобождается в эффективных концентрациях в течение периода времени в пределах 1-30 суток. Из представленного здесь обсуждения понятно, что аналоги и производные доксорубицина (описанные ранее) с аналогичной функциональной активностью можно использовать для целей настоящего изобретения; кроме того, указанные выше параметры дозирования можно скорректировать с учетом относительной активности аналога или производного по сравнению с исходным соединением (например, соединение, которые активнее доксорубицина в два раза, вводят в половинной части указанных параметров, в то время как соединение, наполовину менее активное чем доксорубицин, вводят в количестве, в два раза превышающем вышеуказанные параметры, и т.д.).
При использовании митоксантрона в качестве другого примера антрациклина в виде полимерного покрытия, включения в полимеры, из которых изготовлено устройство, или нанесенного без полимера-носителя, общее количество митоксантрона, нанесенного на катетер для центральных вен (и другие компоненты инфузионной системы), не должно превышать 5 мг (в пределах от 0,01 мкг до 5 мг). В особо предпочтительном варианте воплощения общее количество препарата, нанесенного на катетер для центральных вен (и другие компоненты инфузионной системы), должно находиться в пределах от 0,1 мкг до 1 мг. Доза на единицу площади устройства (т.е. количество лекарственного препарата как функция площади поверхности участка устройства, на который наносят и/или в который включают лекарственный препарат) должна находиться в пределах 0,01 мкг-20 мкг на мм2 площади поверхности. В особо предпочтительном варианте воплощения митоксантрон следует наносить на поверхность устройства в дозе в пределах 0,05 мкг/мм2-3 мкг/мм2. Поскольку различные полимерные и неполимерные оболочки будут высвобождать митоксантрон с различной скоростью, вышеуказанные параметры дозирования следует использовать с учетом скорости высвобождения лекарственного препарата с поверхности устройства так, чтобы на поверхности устройства поддерживалась минимальная концентрация митоксантрона 10-5-10-6 М. Необходимо обеспечить гарантию того, чтобы концентрации лекарственного препарата на поверхности устройства превышали концентрацию митоксантрона, известные как летальные для многих видов бактерий и грибов (т.е. выше 10-5 М, хотя для некоторых вариантов воплощения требуются более низкие концентрации). В предпочтительном варианте воплощения митоксантрон высвобождается с поверхности устройства таким образом, что противоинфекционная активность сохраняется в течение периода времени от нескольких часов до нескольких месяцев. В особо предпочтительном варианте воплощения лекарственный препарат высвобождается в эффективных концентрациях в течение периода времени в пределах 1-30 суток. Из представленного здесь обсуждения понятно, что аналоги и производные митоксантрона (описанные ранее) с аналогичной функциональной активностью можно использовать для целей настоящего изобретения; кроме того, указанные выше параметры дозирования можно скорректировать с учетом относительной активности аналога или производного по сравнению с исходным соединением (например, соединение, которое активнее митоксантрона в два раза, вводят в половинной части указанных параметров, в то время как соединение, наполовину менее активное чем митоксантрон, вводят в количестве, в два раза превышающем вышеуказанные параметры и т.д.).
(b) Фторпиримидины. При использовании 5-фторурацила в качестве примера фторпиримидина в виде полимерного покрытия, включения в полимеры, из которых изготовлено устройство, или нанесенного без полимера-носителя, общее количество 5-фторурацила, нанесенного на катетер для центральных вен (и другие компоненты инфузионной системы), не должно превышать 250 мг (в пределах от 1,0 мкг до 250 мг). В особо предпочтительном варианте воплощения общее количество препарата, нанесенного на катетер для центральных вен (и другие компоненты инфузионной системы), должно находиться в пределах от 10 мкг до 25 мг. Доза на единицу площади устройства (т.е. количество лекарственного препарата, как функция площади поверхности участка устройства, на который наносят и/или в который включают лекарственный препарат) должна находиться в пределах 0,1 мкг-1 мг на 1 мм2 площади поверхности. В особо предпочтительном варианте воплощения 5-фторурацил следует наносить на поверхность устройства в дозе в пределах 1,0-50 мкг/мм2. Поскольку различные полимерные и неполимерные оболочки будут высвобождать 5-фторурацил с различной скоростью, вышеуказанные параметры дозирования следует использовать с учетом скорости высвобождения лекарственного препарата с поверхности устройства так, чтобы на поверхности устройства поддерживалась минимальная концентрация 5-фторурацила 10-4-10-7 М. Необходимо обеспечить гарантию того, чтобы концентрации лекарственного препарата на поверхности устройства превышали концентрации 5-фторурацила, известные как летальные для многих видов бактерий и грибов (т.е. выше 10-4 М, хотя для некоторых вариантов воплощения требуются более низкие концентрации). В предпочтительном варианте воплощения 5-форурацил высвобождается с поверхности устройства таким образом, что противоинфекционная активность сохраняется в течение периода времени от нескольких часов до нескольких месяцев. В особо предпочтительном варианте воплощения лекарственный препарат высвобождается в эффективных концентрациях в течение периода времени в пределах 1-30 суток. Из представленного здесь обсуждения понятно, что аналоги и производные 5-фторурацила (описанные ранее) с аналогичной функциональной активностью можно использовать для целей настоящего изобретения; кроме того, указанные выше параметры дозирования можно скорректировать с учетом относительной активности аналога или производного по сравнению с исходным соединением (например, соединение, которое активнее 5-форурацила в два раза, вводят в половинной части указанных параметров, в то время как соединение, наполовину менее активное чем 5-фторурацил, вводят в количестве, в два раза превышающем вышеуказанные параметры, и т.д.).
(с) Подофилотоксины. При использовании этопозида в качестве примера подофилотоксина в виде полимерного покрытия, включения в полимеры, из которых изготовлено устройство, или нанесенного без полимера-носителя, общее количество этопозида, нанесенного на катетер для центральных вен (и другие компоненты инфузионной системы), не должно превышать 25 мг (в пределах от 0,1 мкг до 25 мг). В особо предпочтительном варианте воплощения общее количество препарата, нанесенного на катетер для центральных вен (и другие компоненты инфузионной системы), должно находиться в пределах от 1 мкг до 5 мг. Доза на единицу площади устройства (т.е. количество лекарственного препарата, как функция площади поверхности участка устройства, на который наносят и/или в который включают лекарственный препарат) должна находиться в пределах 0,01 мкг-100 мкг на мм2 площади поверхности. В особо предпочтительном варианте воплощения этопозид следует наносить на поверхность устройства в дозе в пределах 0,1 мкг/мм2-10 мкг/мм2. Поскольку различные полимерные и неполимерные оболочки будут высвобождать этопозид с различной скоростью, вышеуказанные параметры дозирования следует использовать с учетом скорости высвобождения лекарственного препарата с поверхности устройства так, чтобы на поверхности устройства поддерживалась минимальная концентрация этопозида 10-5-10-6 М. Необходимо обеспечить гарантию того, чтобы концентрации лекарственного препарата на поверхности устройства превышали концентрации этопозида, известные как летальные для многих видов бактерий и грибов (т.е. выше 10-5 М, хотя для некоторых вариантов воплощения требуются более низкие концентрации). В предпочтительном варианте воплощения этопозид высвобождается с поверхности устройства таким образом, что противоинфекционная активность сохраняется в течение периода времени от нескольких часов до нескольких месяцев. В особо предпочтительном варианте воплощения лекарственный препарат высвобождается в эффективных концентрациях в течение периода времени в пределах 1-30 суток. Из представленного здесь обсуждения понятно, что аналоги и производные этопозида (описанные ранее) с аналогичной функциональной активностью можно использовать для целей настоящего изобретения; кроме того, указанные выше параметры дозирования можно скорректировать с учетом относительной активности аналога или производного по сравнению с исходным соединением (например, соединение, которые активнее этопозида в два раза, вводят в половинной части указанных параметров, в то время как соединение, наполовину менее активное чем этопозид, вводят в количестве, в два раза превышающем вышеуказанные параметры, и т.д.).
(d) Комбинированная терапия. Из представленного выше обсуждения понятно, что можно использовать комбинации антрациклинов (например, доксорубицина или митоксантрона), фторпиримидинов (например, 5-фторурацила), антагонистов фолиевой кислоты (например, метотрексата) и/или подофилотоксинов (например, этопозида) для повышения антибактериальной активности покрытия катетера для центральных вен. Аналогичным образом антрациклин (например, доксорубицин или митоксантрон), фторпиримидин (например, 5-фторурацил), антагонист фолиевой кислоты (например, метотрексат) и/или подофилотоксин (например, этопозид) можно сочетать с обычными антибиотиками и/или противогрибковыми препаратами для усиления эффективности. Поскольку способность к тромбообразованию у катетера связана с повышенным риском возникновения инфекции, комбинации антрациклинов (например, доксорубицина или митоксантрона), фторпиримидинов (например, 5-фторурацила), антагонистов фолиевой кислоты (например, метотрексата) и/или подофилотоксинов (например, этопозида) можно сочетать со средствами против тромбообразования и/или противотромбоцитарными средствами (например, гепарином, декстраном сульфатом, данапароидом, лепирудином, гирудином, АМФ, аденозином, 2-хлораденозином, аспирином, фенилбутазоном, индометацином, меклофенаматом, гидрохлорохином, дипиридамолом, илопростом, тиклопидином, клопидогрелом, абциксамабом, эптифибатидом, тирофибаном, стрептокиназой и/или активатором тканевого плазминогена) для усиления эффективности.
2. Катетеры для периферических вен
Для целей настоящего изобретения термин «катетеры для периферических вен» следует понимать, как включающий любой катетер или линию, которые используются для введения жидкостей в более мелкие (периферические) поверхностные вены организма.
Катетеры для периферических вен в меньшей степени подвержены инфицированию по сравнению с катетерами для центральных вен, особенно, если они поставлены на период менее 72 ч. Одним исключением являются периферические катетеры для введения в бедренную вену (так называемые «бедренные линии»), которые обладают значительно более высокой степенью инфицирования. Микроорганизмы, которые вызывают инфицирование катетеров для периферических вен, аналогичны таковым, описанным выше (в отношении катетеров для центральных вен).
В предпочтительном варианте воплощения доксорубицин, митоксантрон, 5-фторурацил и/или этопозид включают в покрытие, наносимое на поверхность катетера для периферических вен. Лекарственный(ие) препарат(ы) можно наносить на систему катетера для периферических вен несколькими способами: а) в виде покрытия, нанесенного на внешнюю и/или внутреннюю поверхность внутрисосудистого участка катетера и/или сегмента катетера, который проходит через кожу; b) в виде включения в полимеры, которые составляют внутрисосудистый участок катетера; с) в виде включения или нанесения на поверхность подкожной «манжеты» вокруг катетера; е) в виде включения в раствор инфузата; f) в виде включения в или нанесения в виде оболочки на поршень катетера, соединения и/или инфузионную трубку и g) при любом сочетании вышеуказанного.
Правила подбора состава и дозирования для данного варианта воплощения аналогичны таковым, описанным в отношении катетеров для центральных вен.
3. Артериальные линии и трансдукторы
Артериальные линии применяются для отбора газов из артериальной крови, получения точной регистрации кровяного давления и введения жидкостей. Их вводят в периферическую артерию (обычно лучевую артерию) и часто оставляют на месте на несколько дней. Артериальные линии в очень высокой степени подвержены инфицированию (12-20% артериальных линий становятся инфицированными), и микроорганизмы-возбудители являются аналогичными, описанным выше (для катетеров центральных вен).
В предпочтительном варианте воплощения доксорубицин, митоксантрон, 5-фторурацил и/или этопозид включают в покрытие, наносимое на артериальную линию, несколькими способами: а) в виде покрытия, нанесенного на внешнюю и/или внутреннюю поверхность внутрисосудистого участка катетера и/или сегмента катетера, который проходит через кожу; b) в виде включения в полимеры, которые составляют внутрисосудистый участок катетера; с) в виде включения или нанесения на поверхность подкожной «манжеты» вокруг катетера; е) в виде включения в раствор инфузата; f) в виде включения в или нанесения в виде оболочки на поршень катетера, соединения и/или инфузионную трубку и g) при любом сочетании вышеуказанного.
Правила подбора состава и дозирования для данного варианта воплощения аналогичны таковым, описанным в отношении катетеров для центральных вен.
В. Эндокардит, вызванный искусственным сердечным клапаном (PVE)
Искусственные сердечные клапаны, механические и биопростетические, подвержены большому риску инфицирования. Фактически у 3-6% пациентов развивается инфекция, связанная с клапаном, в течение 5 лет после проведения операции по поводу установки клапана, и эндокардит, вызванный искусственным клапаном, составляет до 15% от всех случаев эндокардитов. Риск развития инфекции не является равноценным - риск является самым высоким в первый год после операции с максимальной частотой между вторым и третьим месяцем после операции. Механические клапаны особенно подвержены инфицированию в течение 3 месяцев после операции, и по данным микробиологических исследований можно предположить, что это нозокомиальная инфекция. Следовательно, содержащее лекарственный препарат покрытие для предупреждения колонизации и инфицирования клапанов в первые месяцы после операции может быть очень полезным для профилактики данной важной медицинской проблемы. Частота развития эндокардита, вызванного искусственным клапаном, не претерпела изменений в течение последних 40 лет, несмотря на существенные достижения в способах хирургии и стерилизации.
Показательные примеры искусственных сердечных клапанов включают описанные в патентах США № 3656185, 4106129, 4892540, 5528023, 5772694, 6096075, 6176877, 6358278 и 6371983.
Вскоре после имплантации клапана шовное кольцо и кольцо искусственного клапана еще не эндотелизируются. Скопление тромбоцитов и тромбов в месте имплантации обеспечивают благоприятное место для прикрепления и колонизации микроорганизмов. Бактерии могут быть высеяны во время самой операции или в результате бактериемии, возникающей в раннем послеоперационном периоде (обычно в результате загрязнения внутривенных катетеров, катетеров для определения сердечной деятельности, из трубок для грудной клетки и раневых инфекций). Обычно возбудители PVE включают отрицательные на коагулазу стафилококки (Staphylococcus epidermidis; 30%), Staphylococcus aureus (23%), грамотрицательные энтерококки (Enterobacteriaceae, Pseudomonas arugenosa; 14%), грибы (Candida albicans, Aspergillis: 12%) и Corynebacterium diptheriae. PVE при биопростетических клапанах в основном ограничен лепестками (и редко кольцом), в то время, как кольцо затрагивается в большинстве случаев PVE при использовании механических клапанов (82%).
К сожалению, подавление возбудителя инфекции с помощью только противомикробной терапии часто является затруднительным или невозможным. В результате для многих пациентов, у которых развивается данное осложнение, требуется повторная операция на открытом сердце в целях замены инфицированного клапана, что приводит к значительной заболеваемости и смертности. Даже, если инфекция успешно лечится, повреждение лепестков в биопростетических клапанах снижает продолжительность функционирования клапана. Особенно много проблем возникает у пациентов, у которых развивается инфекция, вызванная Staphylococcus aureus, поскольку у них смертность составляет 50-85%, а необходимость в проведении повторной операции возникает в 50-65% случаев. Лечение инфекций, вызванных Staphylococcus epidermis, также является затруднительным, поскольку большинство из них вызвано микроорганизмами, резистентными ко всем промышленно доступным в настоящее время бета-лактамным антибиотикам. Другие осложнения эндокардита, вызванного искусственным клапаном, включают нарушение функции клапанов (стеноз, регургитация), образование абсцесса, осложнения в результате эмболии (такие, как инсульт, кровотечение в ЦНС, церебрит), аномалии проводимости и смерть (55-75% пациентов, у которых развилась инфекция, погибают в первые 2 месяца после операции).
Покрытие клапана эффективным лекарственным препаратом будет снижать частоту развития эндокардита, связанного с искусственным клапаном, снижать смертность, снижать частоту развития осложнений, повышать эффективность искусственного клапана и/или снижать необходимость в замене клапана. Все это будет приводить к меньшей смертности и заболеваемости пациентов с искусственными сердечными клапанами.
В предпочтительном варианте воплощения доксорубицин, митоксантрон, 5-фторурацил и/или этопозид включают в покрытие, наносимое на поверхность биопростетического или механического клапана. Лекарственный препарат(ы) можно наносить на искусственный клапан несколькими способами: а) в виде покрытия, нанесенного на поверхность кольца (особенно для механических клапанов); b) в виде покрытия, нанесенного на поверхность лепестков клапана (особенно для биопростетических клапанов); с) в виде включения в полимеры, которые составляют кольцо или d) при любом сочетании вышеуказанного.
Покрытие лекарственным препаратом или включение лекарственного препарата в искусственные сердечные клапаны позволит обеспечить концентрации бактерицидного препарата местно на поверхности клапана, тем самым снижая частоту колонизации бактерий и последующего развития PVE, одновременно обеспечивая незначительное системное действие препаратов. Несмотря на то, что для некоторых средств не требуется полимерных носителей для прикрепления лекарственного препарата к поверхности кольца и/или лепестков клапана, некоторые полимерные носители особенно подходят для применения в данном варианте воплощения. Особый интерес представляют такие полимерные носители, как полиуретаны (например, ChronoFlex AL 85A [CT Biomaterials], HydroMed640 [CT Biomaterials], HYDROSLIP C [CT Biomaterials], HYDROSLIP C [CT Biomaterials], HYDROTHANE [CT Biomaterials], HYDROTHANE [CT Biomaterials]), акриловые и метакриловые сополимеры (например, поли(этилен-со-акриловая кислота), полимеры, производные целлюлозы (например, нитроцеллюлоза, ацетобутират целлюлозы, ацетопропионат целлюлозы), сополимеры акрилата и метакрилата (например, поли(этилен-со-винилацетат)), а также их смеси. [CT Biomaterials]), акриловые и метакриловые сополимеры (например, поли(этилен-со-акриловая кислота), полимеры, производные целлюлозы (например, нитроцеллюлоза, ацетобутират целлюлозы, ацетопропионат целлюлозы), сополимеры акрилата и метакрилата (например, поли(этилен-со-винилацетат)), а также их смеси.
Поскольку искусственные сердечные клапаны изготавливают в самых различных конфигурациях и размерах, точное вводимое количество будет варьироваться в зависимости от размера, площади поверхности и конструкции устройства. Однако можно использовать определенные принципы при применении в данной области. Количество лекарственного препарата можно рассчитать, как функцию количества на единицу площади (участка устройства, который подлежит покрытию), можно определить общее количество препарата для введения и соответствующие поверхностные концентрации активного препарата. Независимо от способа нанесения препарата на искусственный сердечный клапан предпочтительные противоопухолевые препараты, используемые по отдельности или в комбинации, следует вводить, руководствуясь следующими правилами дозирования:
(а) Антрациклины. При использовании доксорубицина в качестве примера антрациклинов, в виде полимерного покрытия, включения в полимеры, из которых изготовлен искусственный сердечный клапан, или нанесенного без полимерного носителя, общее количество доксорубицина, наносимого на искусственный сердечный клапан, не должно превышать 25 мг (в пределах от 0,1 мкг до 25 мг). В особо предпочтительном варианте воплощения общее количество препарата, нанесенного на искусственный сердечный клапан, должно находиться в пределах от 1 мкг до 5 мг. Доза на единицу площади устройства (т.е. количество препарата как функция площади поверхности участка клапана, на который наносится и/или в который включается лекарственный препарат), должна находиться в пределах 0,01 мкг-100 мкг на 1 мм2 площади поверхности. В особо предпочтительном варианте воплощения доксорубицин следует наносить на поверхность клапана в дозе в пределах 0,1-10 мкг/мм2. Поскольку различные полимерные и неполимерные оболочки будут высвобождать доксорубицин с различной скоростью, вышеуказанные параметры дозирования следует использовать с учетом скорости высвобождения лекарственного препарата с поверхности клапана так, чтобы на поверхности поддерживалась минимальная концентрация доксорубицина 10-7-10-4 М. Необходимо обеспечить гарантию того, чтобы концентрации лекарственного препарата на поверхности искусственного сердечного клапана превышали концентрации доксорубицина, известные как летальные для многих видов бактерий и грибов (т.е. выше 10-4 М, хотя для некоторых вариантов воплощения требуются более низкие концентрации). В предпочтительном варианте воплощения доксорубицин высвобождается с поверхности клапана таким образом, что противоинфекционная активность сохраняется в течение периода времени от нескольких часов до нескольких месяцев. В особо предпочтительном варианте воплощения лекарственный препарат высвобождается в эффективных концентрациях в течение периода времени в пределах 1-6 месяцев. Из представленного здесь обсуждения понятно, что аналоги и производные доксорубицина (описанные ранее) с аналогичной функциональной активностью можно использовать для целей настоящего изобретения; кроме того, указанные выше параметры дозирования можно скорректировать с учетом относительной активности аналога или производного по сравнению с исходным соединением (например, соединение, которое активнее доксорубицина в два раза, вводят в половинной части указанных параметров, в то время как соединение, наполовину менее активное чем доксорубицин, вводят в количестве, в два раза превышающем вышеуказанные параметры, и т.д.).
При использовании митоксантрона в качестве другого примера антрациклина в виде полимерного покрытия, включения в полимеры, из которых изготовлен искусственный сердечный клапан, или нанесенного без полимера-носителя, общая доза митоксантрона, нанесенного на искусственный сердечный клапан, не должна превышать 5 мг (в пределах от 0,01 мкг до 5 мг). В особо предпочтительном варианте воплощения общее количество препарата, нанесенного на искусственный сердечный клапан, должно находиться в пределах от 0,1 мкг до 1 мг. Доза на единицу площади клапана (т.е. количество лекарственного препарата как функция площади поверхности участка клапана, на который наносят и/или в который включают лекарственный препарат) должна находиться в пределах 0,01 мкг-20 мкг на мм2 площади поверхности. В особо предпочтительном варианте воплощения митоксантрон следует наносить на поверхность клапана в дозе в пределах 0,05 мкг/мм2-3 мкг/мм2. Поскольку различные полимерные и неполимерные оболочки будут высвобождать митоксантрон с различной скоростью, вышеуказанные параметры дозирования следует использовать с учетом скорости высвобождения лекарственного препарата с поверхности клапана так, чтобы на поверхности клапана поддерживалась минимальная концентрация митоксантрона 10-5-10-6 М. Необходимо обеспечить гарантию того, чтобы концентрации лекарственного препарата на поверхности клапана превышали концентрации митоксантрона, известные как летальные для многих видов бактерий и грибов (т.е. выше 10-5 М, хотя для некоторых вариантов воплощения требуются более низкие концентрации). В предпочтительном варианте воплощения митоксантрон высвобождается с поверхности клапана таким образом, что противоинфекционная активность сохраняется в течение периода времени от нескольких часов до нескольких месяцев. В особо предпочтительном варианте воплощения лекарственный препарат высвобождается в эффективных концентрациях в течение периода времени в пределах 1-6 месяцев. Из представленного здесь обсуждения понятно, что аналоги и производные митоксантрона (описанные ранее) с аналогичной функциональной активностью можно использовать для целей настоящего изобретения; кроме того, указанные выше параметры дозирования можно скорректировать с учетом относительной активности аналога или производного по сравнению с исходным соединением (например, соединение, которое активнее митоксантрона в два раза вводят в половинной части указанных параметров, в то время как соединение, наполовину менее активное чем митоксантрон, вводят в количестве, в два раза превышающем вышеуказанные параметры, и т.д.).
(b) Фторпиримидины. При использовании 5-фторурацила в качестве примера фторпиримидина в виде полимерного покрытия, включения в полимеры, из которых изготовлен искусственный сердечный клапан, или нанесенного без полимера-носителя, общее количество 5-фторурацила, нанесенного на искусственный сердечный клапан, не должно превышать 250 мг (в пределах от 1,0 мкг до 250 мг). В особо предпочтительном варианте воплощения общее количество препарата, нанесенного на искусственный сердечный клапан, должно находиться в пределах от 10 мкг до 25 мг. Доза на единицу площади клапана (т.е. количество лекарственного препарата как функция площади поверхности участка клапана, на который наносят и/или в который включают лекарственный препарат) должна находиться в пределах 0,1 мкг-1 мг на 1 мм2 площади поверхности. В особо предпочтительном варианте воплощения 5-форурацил следует наносить на поверхность клапана в дозе в пределах 1,0-50 мкг/мм2. Поскольку различные полимерные и неполимерные оболочки будут высвобождать 5-фторурацил с различной скоростью, вышеуказанные параметры дозирования следует использовать с учетом скорости высвобождения лекарственного препарата с поверхности клапана так, чтобы на поверхности клапана поддерживалась минимальная концентрация 5-фторурацила 10-4-10-7 М. Необходимо обеспечить гарантию того, чтобы концентрации лекарственного препарата на поверхности искусственного сердечного клапана превышали концентрации 5-форурацила, известные как летальные для многих видов бактерий и грибов (т.е. выше 10-4 М, хотя для некоторых вариантах воплощения требуются более низкие концентрации). В предпочтительном варианте воплощения 5-фторурацил высвобождается с поверхности клапана таким образом, что противоинфекционная активность сохраняется в течение периода времени от нескольких часов до нескольких месяцев. В особо предпочтительном варианте воплощения лекарственный препарат высвобождается в эффективных концентрациях в течение периода времени в пределах 1-6 месяцев. Из представленного здесь обсуждения понятно, что аналоги и производные 5-фторурацила (описанные ранее) с аналогичной функциональной активностью можно использовать для целей настоящего изобретения; кроме того, указанные выше параметры дозирования можно скорректировать с учетом относительной активности аналога или производного по сравнению с исходным соединением (например, соединение, которое активнее 5-фторурацила в два раза, вводят в половинной части указанных параметров, в то время как соединение, наполовину менее активное чем 5-фторурацил, вводят в количестве, в два раза превышающем вышеуказанные параметры, и т.д.).
(с) Подофилотоксины. При использовании этопозида в качестве примера подофилотоксина в виде полимерного покрытия, включения в полимеры, из которых изготовлен искусственный сердечный клапан, или нанесенного без полимера-носителя, общее количество этопозида, нанесенного на искусственный сердечный клапан, не должно превышать 25 мг (в пределах от 0,1 мкг до 25 мг). В особо предпочтительном варианте воплощения общее количество препарата, нанесенного на искусственный сердечный клапан, должно находиться в пределах от 1 мкг до 5 мг. Доза на единицу площади клапана (т.е. количество лекарственного препарата как функция площади поверхности участка клапана, на который наносят и/или в который включают лекарственный препарат) должна находиться в пределах 0,01 мкг-100 мкг на 1 мм2 площади поверхности. В особо предпочтительном варианте воплощения этопозид следует наносить на поверхность искусственного сердечного клапана в дозе в пределах 0,1-10 мкг/мм2. Поскольку различные полимерные и неполимерные оболочки будут высвобождать этопозид с различной скоростью, вышеуказанные параметры дозирования следует использовать с учетом скорости высвобождения лекарственного препарата с поверхности клапана так, чтобы на поверхности клапана поддерживалась минимальная концентрация этопозида 10-5-10-6 М. Необходимо обеспечить гарантию того, чтобы концентрации лекарственного препарата на поверхности клапана превышали концентрации этопозида, известные как летальные для многих видов бактерий и грибов (т.е. выше 10-5 М, хотя для некоторых вариантов воплощения требуются более низкие концентрации). В предпочтительном варианте воплощения этопозид высвобождается с поверхности клапана таким образом, что противоинфекционная активность сохраняется в течение периода времени от нескольких часов до нескольких месяцев. В особо предпочтительном варианте воплощения лекарственный препарат высвобождается в эффективных концентрациях в течение периода времени в пределах 1-6 месяцев. Из представленного здесь обсуждения понятно, что аналоги и производные этопозида (описанные ранее) с аналогичной функциональной активностью можно использовать для целей настоящего изобретения; кроме того, указанные выше параметры дозирования можно скорректировать с учетом относительной активности аналога или производного по сравнению с исходным соединением (например, соединение, которое активнее этопозида в два раза, вводят в половинной части указанных параметров, в то время как соединение, наполовину менее активное чем этопозид, вводят в количестве, в два раза превышающем вышеуказанные параметры, и т.д.).
(d) Комбинированная терапия. Из представленного выше обсуждения понятно, что можно использовать комбинации антрациклинов (например, доксорубицина или митоксантрона), фторпиримидинов (например, 5-фторурацила), антагонистов фолиевой кислоты (например, метотрексата) и/или подофилотоксинов (например, этопозида) для повышения антибактериальной активности покрытия искусственного сердечного клапана. Аналогичным образом антрациклины (например, доксорубицин или митоксантрон), фторпиримидины (например, 5-фторурацил), антагонисты фолиевой кислоты (например, метотрексат) и/или подофилотоксины (например, этопозид) можно сочетать с обычными антибиотиками и/или противогрибковыми препаратами для усиления эффективности. Поскольку способность к тромбообразованию у искусственного сердечного клапана связана с повышенным риском возникновения инфекции, антрациклины (например, доксорубицина или митоксантрона), фторпиримидины (например, 5-фторурацила), антагонисты фолиевой кислоты (например, метотрексата) и/или подофилотоксины (например, этопозида) можно сочетать со средствами против тромбообразования и/или противотромбоцитарными средствами (например, гепарином, декстраном сульфатом, данапароидом, лепирудином, гирудином, АМФ, аденозином, 2-хораденозином, аспирином, фенилбутазоном, индометацином, меклофенаматом, гидрохлорохином, дипиридамолом, илопростом, тиклопидином, клопидогрелом, абциксамабом, эптифибатидом, тирофибаном, стрептокиназой и/или активатором тканевого плазминогена) для усиления эффективности.
С. Инфекции, вызванные кардиостимуляторами
В целом, немного более чем 5% кардиостимуляторов становятся инфицированными после имплантации. Кардиостимуляторы подвергаются инфицированию двумя основными путями: а) при инфицировании зоны импульсного генератора и/или подкожного участка ввода и b) при инфицировании трансвенного внутрисосудистого электрода и/или генератора. Показательные примеры патентов, в которых описаны кардиостимуляторы и водители ритма, включают патенты США № 4662382, 4782836, 4856521, 4860751, 5101824, 5261419, 5284491, 6055454 и 6370434.
Наиболее частый тип инфицирования кардиостимулятора включает подкожный генератор или провода ввода в период вскоре после имплантации. Полагают, что данный тип инфекции является результатом обсеменения места операции кожной микрофлорой во время установки. Staphylococcus epidermidis (65-75% случаев), Staphylococcus aureus, Streptococci, Corynebacterium, Proprionibacterium acnes, Enterobacteriaceae и виды Candida являются частыми возбудителями инфекций данного типа. Лечение данной инфекции на этой стадии является относительно результативным, инфицированный участок устройства удаляется и пациенту проводят курс лечения антибиотиками и проводят установку нового кардиостимулятора в другое место. К сожалению, инфицирование зоны генератора может затем распространиться на эпикардиальные электроды, вызвав более серьезные осложнения, такие как перикардит, медиастинит и бактериемию.
Инфицирование внутрисосудистого участка трансвенного электрода представляет более серьезную проблему для клиники. Полагают, что данная инфекция возникает в результате инфицирования подкожного участка кардиостимулятора, который проходит вдоль устройства во внутрисосудистые и внутрисердечные участки устройства. Данная инфекция имеет тенденцию проявляться в более поздние периоды времени (через 1-6 месяцев после операции) и может приводить к развитию сепсиса, эндокардита, пневмонии, бронхита, легочной эмболии, патологическому разрастанию сердечной ткани и даже смерти. Наиболее частой причиной данной тяжелой формы инфекции, связанной с кардиостимулятором, являются отрицательные на коагулазу стафилококки (56% инфекций), Staphylococcus aureus (27%), Enterobacteriaceae (6%), Pseudomonas arugenosa (3%) и виды Candida (2%). Лечение данной формы инфекции является более сложным. Генератор и электроды необходимо удалить (часто хирургически), в течение длительного периода времени требуется проводить лечение антибиотиками и необходима установка целого нового кардиостимулятора. Смертность, связанная с данным состоянием, может быть довольно высокой и доходить до 41%, если проводится только лечение антибиотиками, 20% - если лечение включает удаление электродов и курс антибиотиков.
Покрытие кардиостимулятора эффективным лекарственным препаратом будет снижать частоту развития подкожной инфекции и последующее распространение инфекции на поверхности перикарда и эндокарда сердца. В клинике оно будет приводить к снижению частоты развития инфекции в целом и снижать частоту развития более тяжелых осложнений, таких как сепсис, эндокардит, пневмония, бронхит, легочная эмболия, патологическое разрастание сердечной ткани и даже смерть. Эффективное покрытие может также пролонгировать эффективность кардиостимулятора и уменьшать число необходимых замен кардиостимуляторов, приводя к более низкой смертности и заболеваемости пациентов с данными имплантатами.
В предпочтительном варианте воплощения антрациклин (например, доксорубицин или митоксантрон), фторпиримидин (например, 5-FU), антагонист фолиевой кислоты (например, метотрексат) и/или подофилотоксин (например, этопозид) включают в покрытие, наносимое на поверхность компонентов кардиостимулятора. Лекарственный препарат(ы) можно наносить на кардиостимулятор несколькими способами: а) в виде покрытия, нанесенного на поверхность генератора; b) в виде покрытия, нанесенного на поверхность подкожного участка проводов ввода; с) в виде включения или нанесения на поверхность подкожной «манжеты» вокруг места подкожного введения; d) в виде покрытия, нанесенного на поверхность эпикардиальных электродов; е) в виде покрытия, нанесенного на поверхность трансвенного электрода и/или f) при любом сочетании вышеуказанного.
Покрытие лекарственным препаратом или включение лекарственного препарата в кардиостимуляторы позволит обеспечить концентрации бактерицидного препарата местно на поверхности кардиостимулятора, тем самым снижая частоту колонизации бактерий и последующего развития инфекционных осложнений, одновременно обеспечивая незначительное системное действие препаратов. Несмотря на то, что для некоторых средств не требуется полимерных носителей для прикрепления лекарственного препарата к генератору, вводу и электродам, некоторые полимерные носители особенно подходят для применения в данном варианте воплощения. Особый интерес представляют такие полимерные носители, как полиуретаны (например, ChronoFlex AL 85A [CT Biomaterials], HydroMed640 [CT Biomaterials], HYDROSLIP C [CT Biomaterials], HYDROSLIP C [CT Biomaterials], HYDROTHANE [CT Biomaterials], HYDROTHANE [CT Biomaterials]), акриловые и метакриловые сополимеры (например, поли(этилен-со-акриловая кислота), полимеры, производные целлюлозы (например, нитроцеллюлоза, ацетобутират целлюлозы, ацетопропионат целлюлозы), сополимеры акрилата и метакрилата (например, поли(этилен-со-винилацетат)), а также их смеси. [CT Biomaterials]), акриловые и метакриловые сополимеры (например, поли(этилен-со-акриловая кислота), полимеры, производные целлюлозы (например, нитроцеллюлоза, ацетобутират целлюлозы, ацетопропионат целлюлозы), сополимеры акрилата и метакрилата (например, поли(этилен-со-винилацетат)), а также их смеси.
Поскольку кардиостимуляторы изготавливают в самых различных конфигурациях и размерах, точное вводимое количество будет варьироваться в зависимости от размера, площади поверхности, конструкции и участков устройства покрываемого кардиостимулятора. Однако можно использовать определенные принципы при применении в данной области. Количество лекарственного препарата можно рассчитать как функцию количества на единицу площади (участка устройства, который подлежит покрытию), можно определить общее количество препарата для введения и соответствующие поверхностные концентрации активного препарата. Независимо от способа нанесения препарата на кардиостимулятор предпочтительные противоопухолевые препараты, используемые по отдельности или в комбинации, следует вводить, руководствуясь следующими правилами дозирования:
(а) Антрациклины. При использовании доксорубицина в качестве примера антрациклинов, в виде полимерного покрытия, включения в полимеры, из которых изготовлены компоненты кардиостимулятора, или нанесенного без полимерного носителя, общее количество доксорубицина, наносимого на кардиостимулятор, не должно превышать 25 мг (в пределах от 0,1 мкг до 25 мг). В особо предпочтительном варианте воплощения общее количество нанесенного препарата должно находиться в пределах от 1 мкг до 5 мг. Доза на единицу площади устройства (т.е. количество препарата, как функция площади поверхности участка кардиостимулятора, на который наносят и/или в который включают лекарственный препарат), должна находиться в пределах 0,01 мкг-100 мкг на мм2 площади поверхности. В особо предпочтительном варианте воплощения доксорубицин следует наносить на поверхность кардиостимулятора в дозе в пределах 0,1 мкг/мм2-10 мкг/мм2. Поскольку различные полимерные и неполимерные оболочки будут высвобождать доксорубицин с различной скоростью, вышеуказанные параметры дозирования следует использовать с учетом скорости высвобождения лекарственного препарата с поверхности кардиостимулятора так, чтобы на поверхности устройства поддерживалась минимальная концентрация доксорубицина 10-7-10-4 М. Необходимо обеспечить гарантию того, чтобы концентрации лекарственного препарата на поверхности превышали концентрации доксорубицина, известные как летальные для многих видов бактерий и грибов (т.е. выше 10-4 М, хотя для некоторых вариантов воплощения требуются более низкие концентрации). В предпочтительном варианте воплощения доксорубицин высвобождается с поверхности кардиостимулятора таким образом, что противоинфекционная активность сохраняется в течение периода времени от нескольких часов до нескольких месяцев. В особо предпочтительном варианте воплощения лекарственный препарат высвобождается в эффективных концентрациях в течение периода времени в пределах 1 недели - 6 месяцев. Из представленного здесь обсуждения понятно, что аналоги и производные доксорубицина (описанные ранее) с аналогичной функциональной активностью можно использовать для целей настоящего изобретения; кроме того, указанные выше параметры дозирования можно скорректировать с учетом относительной активности аналога или производного по сравнению с исходным соединением (например, соединение, которое активнее доксорубицина в два раза, вводят в половинной части указанных параметров, в то время как соединение, наполовину менее активное чем доксорубицин, вводят в количестве, в два раза превышающем вышеуказанные параметры, и т.д.).
При использовании митоксантрона в качестве другого примера антрациклина в виде полимерного покрытия, включения в полимеры, из которых изготовлен кардиостимулятор, или нанесенного без полимера-носителя, общее количество нанесенного митоксантрона не должно превышать 5 мг (в пределах от 0,01 мкг до 5 мг). В особо предпочтительном варианте воплощения общее количество нанесенного препарата должно находиться в пределах от 0,1 мкг до 1 мг. Доза на единицу площади устройства (т.е. количество лекарственного препарата как функция площади поверхности участка кардиостимулятора, на который наносят и/или в который включают лекарственный препарат) должна находиться в пределах 0,01 мкг-20 мкг на 1 мм2 площади поверхности. В особо предпочтительном варианте воплощения митоксантрон следует наносить на поверхность кардиостимулятора в дозе в пределах 0,05-3 мкг/мм2. Поскольку различные полимерные и неполимерные оболочки будут высвобождать митоксантрон с различной скоростью, вышеуказанные параметры дозирования следует использовать с учетом скорости высвобождения лекарственного препарата с поверхности кардиостимулятора так, чтобы поддерживалась минимальная концентрация митоксантрона 10-5-10-6 М. Необходимо обеспечить гарантию того, чтобы концентрации лекарственного препарата на поверхности устройства превышали концентрации митоксантрона, известные как летальные для многих видов бактерий и грибов (т.е. выше 10-5 М, хотя для некоторых вариантов воплощения требуются более низкие концентрации). В предпочтительном варианте воплощения митоксантрон высвобождается с поверхности кардиостимулятора таким образом, что противоинфекционная активность сохраняется в течение периода времени от нескольких часов до нескольких месяцев. В особо предпочтительном варианте воплощения лекарственный препарат высвобождается в эффективных концентрациях в течение периода времени в пределах 1 недели - 6 месяцев. Из представленного здесь обсуждения понятно, что аналоги и производные митоксантрона (описанные ранее) с аналогичной функциональной активностью можно использовать для целей настоящего изобретения; кроме того, указанные выше параметры дозирования можно скорректировать с учетом относительной активности аналога или производного по сравнению с исходным соединением (например, соединение, которые активнее митоксантрона в два раза, вводят в половинной части указанных параметров, в то время как соединение, наполовину менее активное чем митоксантрон, вводят в количестве, в два раза превышающем вышеуказанные параметры, и т.д.).
(b) Фторпиримидины. При использовании 5-фторурацила в качестве примера фторпиримидина в виде полимерного покрытия, включения в полимеры, из которых изготовлен кардиостимулятор, или нанесенного без полимера-носителя, общее количество нанесенного 5-фторурацила не должно превышать 250 мг (в пределах от 1,0 мкг до 250 мг). В особо предпочтительном варианте воплощения общее количество нанесенного препарата должно находиться в пределах от 10 мкг до 25 мг. Доза на единицу площади устройства (т.е. количество лекарственного препарата как функция площади поверхности участка кардиостимулятора, на который наносят и/или в который включают лекарственный препарат) должна находиться в пределах 0,1 мкг-1 мг на 1 мм2 площади поверхности. В особо предпочтительном варианте воплощения 5-фторурацил следует наносить на поверхность кардиостимулятора в дозе в пределах 1,0-50 мкг/мм2. Поскольку различные полимерные и неполимерные оболочки будут высвобождать 5-фторурацил с различной скоростью, вышеуказанные параметры дозирования следует использовать с учетом скорости высвобождения лекарственного препарата с поверхности кардиостимулятора так, чтобы поддерживалась минимальная концентрация 5-фторурацил 10-4-10-7 М. Необходимо обеспечить гарантию того, чтобы концентрации лекарственного препарата на поверхности превышали концентрации 5-фторурацила, известные как летальные для многих видов бактерий и грибов (т.е. выше 10-4 М, хотя для некоторых вариантов воплощения требуются более низкие концентрации). В предпочтительном варианте воплощения 5-форурацил высвобождается с поверхности кардиостимулятора таким образом, что противоинфекционная активность сохраняется в течение периода времени от нескольких часов до нескольких месяцев. В особо предпочтительном варианте воплощения лекарственный препарат высвобождается в эффективных концентрациях в течение периода времени в пределах 1 недели - 6 месяцев. Из представленного здесь обсуждения понятно, что аналоги и производные 5-фторурацила (описанные ранее) с аналогичной функциональной активностью можно использовать для целей настоящего изобретения; кроме того, указанные выше параметры дозирования можно скорректировать с учетом относительной активности аналога или производного по сравнению с исходным соединением (например, соединение, которое активнее 5-форурацила в два раза, вводят в половинной части указанных параметров, в то время как соединение, наполовину менее активное чем 5-фторурацил, вводят в количестве, в два раза превышающем вышеуказанные параметры, и т.д.).
(с) Подофилотоксины. При использовании этопозида в качестве примера подофилотоксина в виде полимерного покрытия, включения в полимеры, из которых изготовлен кардиостимулятор, или нанесенного без полимера-носителя, общее количество нанесенного этопозида не должно превышать 25 мг (в пределах от 0,1 мкг до 25 мг). В особо предпочтительном варианте воплощения общее количество нанесенного препарата должно находиться в пределах от 1 мкг до 5 мг. Доза на единицу площади устройства (т.е. количество лекарственного препарата как функция площади поверхности участка кардиостимулятора, на который наносят и/или в который включают лекарственный препарат) должна находиться в пределах 0,01 мкг-100 мкг на 1 мм2 площади поверхности. В особо предпочтительном варианте воплощения этопозид следует наносить на поверхность кардиостимулятора в дозе в пределах 0,1-10 мкг/мм2. Поскольку различные полимерные и неполимерные оболочки будут высвобождать этопозид с различной скоростью, вышеуказанные параметры дозирования следует использовать с учетом скорости высвобождения лекарственного препарата с поверхности кардиостимулятора так, чтобы поддерживалась минимальная концентрация этопозида 10-5-10-6 М. Необходимо обеспечить гарантию того, чтобы концентрации лекарственного препарата на поверхности превышали концентрации этопозида, известные как летальные для многих видов бактерий и грибов (т.е. выше 10-5 М, хотя для некоторых вариантов воплощения требуются более низкие концентрации). В предпочтительном варианте воплощения этопозид высвобождается с поверхности кардиостимулятора таким образом, что противоинфекционная активность сохраняется в течение периода времени от нескольких часов до нескольких месяцев. В особо предпочтительном варианте воплощения лекарственный препарат высвобождается в эффективных концентрациях в течение периода времени в пределах 1 недели - 6 месяцев. Из представленного здесь обсуждения понятно, что аналоги и производные этопозида (описанные ранее) с аналогичной функциональной активностью можно использовать для целей настоящего изобретения; кроме того, указанные выше параметры дозирования можно скорректировать с учетом относительной активности аналога или производного по сравнению с исходным соединением (например, соединение, которое активнее этопозида в два раза, вводят в половинной части указанных параметров, в то время как соединение, наполовину менее активное чем этопозид, вводят в количестве, в два раза превышающем вышеуказанные параметры, и т.д.).
(d) Комбинированная терапия. Из представленного выше обсуждения понятно, что можно использовать комбинации антрациклинов (например, доксорубицина или митоксантрона), фторпиримидинов (например, 5-фторурацила), антагонистов фолиевой кислоты (например, метотрексата) и подофилотоксинов (например, этопозида) для повышения антибактериальной активности покрытия кардиостимулятора. Аналогичным образом антрациклины (например, доксорубицин или митоксантрон), фторпиримидины (например, 5-форурацил), антагонисты фолиевой кислоты (например, метотрексат) и/или подофилотоксины (например, этопозид) можно сочетать с обычными антибиотиками и/или противогрибковыми препаратами для усиления эффективности. Поскольку способность к тромбообразованию у внутрисосудистого участка трансвенного электрода связана с повышенным риском возникновения инфекции, антрациклины (например, доксорубицина или митоксантрона), фторпиридины (например, 5-фторурацила), антагонисты фолиевой кислоты (например, метотрексата) и/или подофилотоксины (например, этопозида) можно сочетать со средствами против тромбообразования и/или противотромбоцитарными средствами (например, гепарином, декстрансульфатом, данапароидом, лепирудином, гирудином, АМФ, аденозином, 2-хлораденозином, аспирином, фенилбутазоном, индометацином, меклофенаматом, гидрохлорохином, дипиридамолом, илопростом, тиклопидином, клопидогрелом, абциксамабом, эптифибатидом, тирофибаном, стрептокиназой и/или активатором тканевого плазминогена) для усиления эффективности.
D. Инфекции, вызванные имплантируемыми электрическими дефибрилляторами сердца (ИДС)
В целом примерно 5-10% имплантируемых электрических дефибрилляторов становятся инфицированными после имплантации (самая высокая частота, если требуется хирургическая установка). Подобно кардиостимуляторам имплантируемые дефибрилляторы подвергаются инфицированию двумя основными путями: а) при инфицировании подкожного участка устройства (подкожных электродов и импульсного генератора) и b) при инфицировании интраторакальных компонентов (индикаторных электродов частоты сердечных сокращений, спирального электрода SVC и эпикардиальных электродов). Типичные примеры ICD и связанных компонентов описаны в патентах США № 3614954, 3614955, 4375817, 5314430, 5405363, 5607385, 5697953, 5776165, 6067471, 6169923 и 6152955.
Большая часть инфекций развивается вскоре после установки, и полагают, что они являются результатом обсеменения места операции кожной микрофлорой. Staphylococcus epidermidis, Staphylococcus aureus, Streptococci, Corynebacterium, Proprionibacterium acnes, Enterobacteriaceae и виды Candida являются распространенными возбудителями инфекций данного типа. К сожалению, лечение часто включает удаление всей системы и длительную терапию антибиотиками.
Покрытие ICD эффективным лекарственным препаратом будет снижать частоту развития связанных с инфицированием побочных эффектов, таких как подкожная инфекция, сепсис и перикардит. Эффективное покрытие будет также пролонгировать эффективность ICD и уменьшать число пациентов, для которых необходима замена, приводя к более низкой смертности и заболеваемости пациентов с данными имплантатами.
В предпочтительном варианте воплощения доксорубицин, митоксантрон, 5-фторурацил и/или этопозид включают в покрытие, наносимое на поверхность ICD. Лекарственный препарат(ы) можно наносить несколькими способами: а) в виде покрытия, нанесенного на поверхность импульсного генератора; b) в виде покрытия, нанесенного на поверхность подкожного участка проводов ввода; с) в виде включения в или нанесения на поверхность подкожной «манжеты» вокруг места подкожного введения; d) в виде покрытия, нанесенного на поверхность спиральных электродов SVC; е) в виде покрытия, нанесенного на поверхность эпикардиального электрода и/или f) при любом сочетании вышеуказанного.
Покрытие лекарственным препаратом или включение лекарственного препарата в дефибриллятор сердца позволит обеспечить концентрации бактерицидного препарата местно на поверхности ICD, тем самым снижая частоту колонизации бактерий и последующего развития инфекционных осложнений, одновременно обеспечивая незначительное системное действие препаратов. Несмотря на то, что для некоторых средств не требуется полимерных носителей для прикрепления лекарственного препарата к генератору, вводу и электродам, некоторые полимерные носители особенно подходят для применения в данном варианте воплощения. Особый интерес представляют такие полимерные носители, как полиуретаны (например, ChronoFlex AL 85A [CT Biomaterials], HydroMed640 [CT Biomaterials], HYDROSLIP C [CT Biomaterials], HYDROSLIP C [CT Biomaterials], HYDROTHANE [CT Biomaterials], HYDROTHANE [CT Biomaterials]), акриловые и метакриловые сополимеры (например, поли(этилен-со-акриловая кислота), полимеры, производные целлюлозы (например, нитроцеллюлоза, ацетобутират целлюлозы, ацетопропионат целлюлозы), сополимеры акрилата и метакрилата (например, поли(этилен-со-винилацетат)), а также их смеси. [CT Biomaterials]), акриловые и метакриловые сополимеры (например, поли(этилен-со-акриловая кислота), полимеры, производные целлюлозы (например, нитроцеллюлоза, ацетобутират целлюлозы, ацетопропионат целлюлозы), сополимеры акрилата и метакрилата (например, поли(этилен-со-винилацетат)), а также их смеси.
Поскольку имплантируемые электрические дефибрилляторы сердца имеют много конструктивных особенностей, аналогичных особенностям кардиостимуляторов, правила дозирования доксорубицина, митоксантрона, 5-фторурацила и этопозида при покрытии IDC аналогичны описанным выше для кардиостимуляторов.
Е. Инфекции, связанные с имплантатами сосудов
Частота развития инфекций, связанных с синтетическими имплантатами сосудов, находится в пределах 1-5% и является наиболее высокой для имплантатов, проходящих через паховую область (таких, как аорто-бедренный имплантаты и бедренно-подколенные имплантаты). Несмотря на то, что инфекция возникает в результате распространения инфекции со смежной обсемененной ткани или гематогенного обсеменения, наиболее частой причиной инфекции является загрязнение во время операции. Фактически более половины всех случаев имеет место в первые 3 месяца после операции. Наиболее распространенными возбудителями инфекции являются Staphylococcus aureus (25-35% случаев), Enterobacteriaceae, Pseudomonas aerugenosa и отрицательные на коагулазу стафилококки.
Осложнения, возникающие в результате инфицирования имплантатов сосудов, включают сепсис, подкожную инфекцию, образование ложной аневризмы, тромбоз имплантата, кровотечение, септическую или тромботическую эмболию и тромбоз имплантата. Для лечения необходимо удаление имплантата в сочетании, фактически во всех случаях, с терапией системными антибиотиками. Часто операцию необходимо проводить постадийно (полная резекция инфицированного имплантата, санация смежных инфицированных тканей, получение здоровой культи артерии, реперфузия через незараженный путь), что дополнительно повышает показатели заболеваемости и смертности, связанные с данными состоянием. Например, если имплантат аорты становится инфицированным, то смертность в этом случае составляет 37%, а у выживших пациентов в 21% случае проводится ампутация конечности; в случае имплантатов в области паха аналогичные показатели соответственно составляют 18% и 40%.
Показательные примеры имплантатов сосудов описаны в патентах США № 3096560, 3805301,3945052, 4140126, 4323525, 4355426, 4475972, 4530113, 4550447, 4562596, 4601718, 4647416, 4878908, 5024671, 5104399, 5116360, 5151105, 5197977, 5282824, 5405379, 5609624, 5693088 и 5910168.
Покрытие имплантата сосудов эффективным лекарственным препаратом будет снижать частоту развития осложнений, таких как сепсис, кровотечение, тромбоз, эмболия, ампутация и даже смерть. Эффективное покрытие будет также сокращать число необходимых замен имплантатов сосудов, приводя к более низкой смертности и заболеваемости пациентов с данными имплантатами.
В предпочтительном варианте воплощения антрациклин (например, доксорубицин или митоксантрон), фторпиримидин (например, 5-FU), антагонист фолиевой кислоты (например, метотрексат) и/или подофилотоксин (например, этопозид) включают в покрытие, наносимое на поверхность компонентов имплантата сосудов. Лекарственный препарат(ы) можно наносить несколькими способами: а) в виде покрытия, нанесенного на внешнюю поверхность имплантата; b) в виде покрытия, нанесенного на внутреннюю (просветную) поверхность имплантата; с) в виде покрытия, нанесенного на все или части обеих поверхностей.
Покрытие с лекарственным препаратом или включение лекарственного препарата в имплантаты сосудов позволит обеспечить концентрации бактерицидного препарата местно на поверхности имплантата, тем самым снижая частоту колонизации бактерий и последующего развития инфекционных осложнений, одновременно обеспечивая незначительное системное действие препаратов. Несмотря на то, что для некоторых средств не требуется полимерных носителей для прикрепления лекарственного препарата, некоторые полимерные носители особенно подходят для применения в данном варианте воплощения. Особый интерес представляют такие полимерные носители, как полиуретаны (например, ChronoFlex AL 85A [CT Biomaterials], HydroMed640 [CT Biomaterials], HYDROSLIP C [CT Biomaterials], HYDROSLIP C [CT Biomaterials], HYDROTHANE [CT Biomaterials], HYDROTHANE [CT Biomaterials]), акриловые и метакриловые сополимеры (например, поли(этилен-со-акриловая кислота), полимеры, производные целлюлозы (например, нитроцеллюлоза, ацетобутират целлюлозы, ацетопропионат целлюлозы), сополимеры акрилата и метакрилата (например, поли(этилен-со-винилацетат)), а также их смеси. [CT Biomaterials]), акриловые и метакриловые сополимеры (например, поли(этилен-со-акриловая кислота), полимеры, производные целлюлозы (например, нитроцеллюлоза, ацетобутират целлюлозы, ацетопропионат целлюлозы), сополимеры акрилата и метакрилата (например, поли(этилен-со-винилацетат)), а также их смеси.
Поскольку имплантаты сосудов изготавливают в самых различных конфигурациях и размерах, точное вводимое количество будет варьироваться в зависимости от размера, площади поверхности, конструкции и участков устройства, покрываемого имплантата. Однако можно использовать определенные принципы при применении в данной области. Количество лекарственного препарата можно рассчитать как функцию количества на единицу площади (участка устройства, который подлежит покрытию), можно определить общее количество препарата для введения и соответствующие поверхностные концентрации активного препарата. Независимо от способа нанесения препарата на имплантат сосудов предпочтительные противоопухолевые препараты, используемые по отдельности или в комбинации, следует вводить, руководствуясь следующими правилами дозирования:
(а) Антрациклины. При использовании доксорубицина в качестве примера антрациклинов, в виде полимерного покрытия, включения в полимеры, из которых изготовлены компоненты имплантата сосудов (такие, как дакрон или тефлон), или нанесенного без полимерного носителя, общее количество наносимого доксорубицина не должно превышать 25 мг (в пределах от 0,1 мкг до 25 мг). В особо предпочтительном варианте воплощения общее количество нанесенного препарата должно находиться в пределах от 1 мкг до 5 мг. Доза на единицу площади устройства (т.е. количество препарата как функция площади поверхности участка имплантата сосудов, на который наносится и/или в который включают лекарственный препарат), должна находиться в пределах 0,01 мкг-100 мкг на 1 мм2 площади поверхности. В особо предпочтительном варианте воплощения доксорубицин следует наносить на поверхность имплантата сосудов в дозе в пределах 0,1-10 мкг/мм2. Поскольку различные полимерные и неполимерные оболочки будут высвобождать доксорубицин с различной скоростью, вышеуказанные параметры дозирования следует использовать с учетом скорости высвобождения лекарственного препарата с поверхности имплантата сосудов так, чтобы на поверхности поддерживалась минимальная концентрация доксорубицина 10-7-10-4 М. Необходимо обеспечить гарантию того, чтобы концентрации лекарственного препарата превышали концентрации доксорубицина, известные как летальные для многих видов бактерий и грибов (т.е. выше 10-4 М, хотя для некоторых вариантов воплощения требуются более низкие концентрации). В предпочтительном варианте воплощения доксорубицин высвобождается с поверхности имплантата сосудов таким образом, что противоинфекционная активность сохраняется в течение периода времени от нескольких часов до нескольких месяцев. В особо предпочтительном варианте воплощения лекарственный препарат высвобождается в эффективных концентрациях в течение периода времени в пределах 1 недели - 6 месяцев. Из представленного здесь обсуждения понятно, что аналоги и производные доксорубицина (описанные ранее) с аналогичной функциональной активностью можно использовать для целей настоящего изобретения; кроме того, указанные выше параметры дозирования можно скорректировать с учетом относительной активности аналога или производного по сравнению с исходным соединением (например, соединение, которое активнее доксорубицина в два раза, вводят в половинной части указанных параметров, в то время как соединение, наполовину менее активное чем доксорубицин, вводят в количестве, в два раза превышающем вышеуказанные параметры, и т.д.).
При использовании митоксантрона в качестве другого примера антрациклина в виде полимерного покрытия, включения в полимеры, из которых изготовлен имплантат сосудов (такие, как дакрон или тефлон), или нанесенного без полимера-носителя, общее количество нанесенного митоксантрона не должно превышать 5 мг (в пределах от 0,01 мкг до 5 мг). В особо предпочтительном варианте воплощения общее количество нанесенного препарата должно находиться в пределах от 0,1 мкг до 1 мг. Доза на единицу площади устройства (т.е. количество лекарственного препарата как функция площади поверхности участка имплантата сосудов, на который наносят и/или в который включают лекарственный препарат) должна находиться в пределах 0,01 мкг-20 мкг на мм2 площади поверхности. В особо предпочтительном варианте воплощения митоксантрон следует наносить на поверхность имплантата сосудов в дозе в пределах 0,05 мкг/мм2-3 мкг/мм2. Поскольку различные полимерные и неполимерные оболочки будут высвобождать метоксантрон с различной скоростью, вышеуказанные параметры дозирования следует использовать с учетом скорости высвобождения лекарственного препарата с поверхности имплантата сосудов так, чтобы поддерживалась минимальная концентрация митоксантрона 10-5-10-6 М. Необходимо обеспечить гарантию того, чтобы концентрации лекарственного препарата на поверхности превышали концентрации митоксантрона, известные как летальные для многих видов бактерий и грибов (т.е. выше 10-5 М, хотя для некоторых вариантов воплощения требуются более низкие концентрации). В предпочтительном варианте воплощения митоксантрон высвобождается с поверхности имплантата сосудов таким образом, что противоинфекционная активность сохраняется в течение периода времени от нескольких часов до нескольких месяцев. В особо предпочтительном варианте воплощения лекарственный препарат высвобождается в эффективных концентрациях в течение периода времени в пределах 1 недели - 6 месяцев. Из представленного здесь обсуждения понятно, что аналоги и производные митоксантрона (описанные ранее) с аналогичной функциональной активностью можно использовать для целей настоящего изобретения; кроме того, указанные выше параметры дозирования можно скорректировать с учетом относительной активности аналога или производного по сравнению с исходным соединением (например, соединение, которое активнее митоксантрона в два раза, вводят в половинной части указанных параметров, в то время как соединение, наполовину менее активное чем митоксантрон, вводят в количестве, в два раза превышающем вышеуказанные параметры, и т.д.).
(b) Фторпиримидины. При использовании 5-фторурацила в качестве примера фторпиримидина в виде полимерного покрытия, включения в полимеры, из которых изготовлен имплантат сосудов (такие, как дакрон или тефлон), или нанесенного без полимера-носителя, общее количество нанесенного 5-фторурацила не должно превышать 250 мг (в пределах от 1,0 мкг до 250 мг). В особо предпочтительном варианте воплощения общее количество нанесенного препарата должно находиться в пределах от 10 мкг до 25 мг. Доза на единицу площади устройства (т.е. количество лекарственного препарата как функция площади поверхности участка имплантата сосудов, на который наносят и/или в который включают лекарственный препарат) должна находиться в пределах 0,1 мкг-1 мг на 1 мм2 площади поверхности. В особо предпочтительном варианте воплощения 5-фторурацил следует наносить на поверхность имплантата сосудов в дозе в пределах 1,0-50 мкг/мм2. Поскольку различные полимерные и неполимерные оболочки будут высвобождать 5-фторурацил с различной скоростью, вышеуказанные параметры дозирования следует использовать с учетом скорости высвобождения лекарственного препарата с поверхности имплантата сосудов так, чтобы поддерживалась минимальная концентрация 5-форурацила 10-4-10-7 М. Необходимо обеспечить гарантию того, чтобы концентрации лекарственного препарата на поверхности превышали концентрации 5-фторурацила, известные как летальные для многих видов бактерий и грибов (т.е. выше 10-4 М, хотя для некоторых вариантов воплощения требуются более низкие концентрации). В предпочтительном варианте воплощения 5-форурацил высвобождается с поверхности имплантата сосудов таким образом, что противоинфекционная активность сохраняется в течение периода времени от нескольких часов до нескольких месяцев. В особо предпочтительном варианте воплощения лекарственный препарат высвобождается в эффективных концентрациях в течение периода времени в пределах 1 недели - 6 месяцев. Из представленного здесь обсуждения понятно, что аналоги и производные 5-фторурацила (описанные ранее) с аналогичной функциональной активностью можно использовать для целей настоящего изобретения; кроме того, указанные выше параметры дозирования можно скорректировать с учетом относительной активности аналога или производного по сравнению с исходным соединением (например, соединение, которое активнее 5-форурацила в два раза, вводят в половинной части указанных параметров, в то время как соединение, наполовину менее активное чем 5-фторурацил, вводят в количестве, в два раза превышающем вышеуказанные параметры, и т.д.).
(с) Подофилотоксины. При использовании этопозида в качестве примера подофилотоксина в виде полимерного покрытия, включения в полимеры, из которых изготовлен имплантат сосудов (такие, как дакрон или тефлон) или нанесенного без полимера-носителя, общее количество нанесенного этопозида не должно превышать 25 мг (в пределах от 0,1 мкг до 25 мг). В особо предпочтительном варианте воплощения общее количество нанесенного препарата должно находиться в пределах от 1 мкг до 5 мг. Доза на единицу площади устройства (т.е. количество лекарственного препарата как функция площади поверхности участка имплантата сосудов, на который наносят и/или в который включают лекарственный препарат) должна находиться в пределах 0,01 мкг-100 мкг на 1 мм2 площади поверхности. В особо предпочтительном варианте воплощения этопозид следует наносить на поверхность имплантата сосудов в дозе в пределах 0,1 мкг/мм2-10 мкг/мм2. Поскольку различные полимерные и неполимерные оболочки будут высвобождать этопозид с различной скоростью, вышеуказанные параметры дозирования следует использовать с учетом скорости высвобождения лекарственного препарата с поверхности имплантата сосудов так, чтобы поддерживалась минимальная концентрация этопозида 10-5-10-6 М. Необходимо обеспечить гарантию того, чтобы концентрации лекарственного препарата на поверхности превышали концентрации этопозида, известные как летальные для многих видов бактерий и грибов (т.е. выше 10-5 М, хотя для некоторых вариантов воплощения требуются более низкие концентрации). В предпочтительном варианте воплощения этопозид высвобождается с поверхности имплантата сосудов таким образом, что противоинфекционная активность сохраняется в течение периода времени от нескольких часов до нескольких месяцев. В особо предпочтительном варианте воплощения лекарственный препарат высвобождается в эффективных концентрациях в течение периода времени в пределах 1 недели - 6 месяцев. Из представленного здесь обсуждения понятно, что аналоги и производные этопозида (описанные ранее) с аналогичной функциональной активностью можно использовать для целей настоящего изобретения; кроме того, указанные выше параметры дозирования можно скорректировать с учетом относительной активности аналога или производного по сравнению с исходным соединением (например, соединение, которое активнее этопозида в два раза, вводят в половинной части указанных параметров, в то время как соединение, наполовину менее активное чем этопозид, вводят в количестве, в два раза превышающем вышеуказанные параметры, и т.д.).
(d) Комбинированная терапия. Из представленного выше обсуждения понятно, что можно использовать комбинации антрациклинов (например, доксорубицина или митоксантрона), фторпиримидинов (например, 5-фторурацила), антагонистов фолиевой кислоты (например, метотрексата) и подофилотоксинов (например, этопозида) для повышения антибактериальной активности покрытия имплантата сосудов. Аналогичным образом антрациклины (например, доксорубицин или митоксантрон), фторпиримидины (например, 5-форурацил), антагонисты фолиевой кислоты (например, метотрексат) и/или подофилотоксины (например, этопозид) можно сочетать с обычными антибиотиками и/или противогрибковыми препаратами для усиления эффективности. Поскольку способность к тромбообразованию у имплантата сосудов связана с повышенным риском возникновения инфекции антрациклины (например, доксорубицин или митоксантрон), фторпиримидины (например, 5-форурацил), антагонисты фолиевой кислоты (например, метотрексат) и/или подофилотоксины (например, этопозид) можно сочетать со средствами против тромбообразования и/или противотромбоцитарными средствами (например, гепарином, декстраном сульфатом, данапароидом, лепирудином, гирудином, АМФ, аденозином, 2-хлораденозином, аспирином, фенилбутазоном, индометацином, меклофенаматом, гидрохлорохином, дипиридамолом, илопростом, тиклопидином, клопидогрелом, абциксамабом, эптифибатидом, тирофибаном, стрептокиназой и/или активатором тканевого плазминогена) для усиления эффективности.
F. Инфекции, связанные с ушными, носовыми и горловыми имплантатами
Бактериальные инфекции уха, носа и горла являются частыми явлениями у детей и взрослых. Для устранения хронической обструкции, вторичной по отношению к устойчивым инфекциям, распространенной формой лечения является применение имплантированных медицинских трубок. Конкретнее, хронические отиты среднего уха часто лечат хирургической имплантацией тимпаностомических трубок, и хронический синусит часто лечат хирургическим дренированием и постановкой синусного стента.
Тимпаностомические трубки
Острый отит среднего уха представляет собой наиболее распространенную бактериальную инфекцию, наиболее частое показание для хирургического лечения, основную причину потери слуха и наиболее частую причину нарушения развития речи у детей. Затраты на лечение данного заболевания у детей в возрасте до пяти лет составляют только в США ежегодно 5 билл. долларов. Фактически 85% всех детей имеют, по меньшей мере, один случай отита среднего уха, и 600000 пациентов ежегодно нуждаются в хирургическом лечении. Частота развития отита среднего уха возрастает и в тяжелых случаях хирургическое лечение является наиболее эффективным по сравнению с консервативным.
Острый отит среднего уха (бактериальная инфекция среднего уха) характеризуется нарушением функции евстахиевой трубы, приводящим к отсутствию механизма очистки среднего уха. Наиболее распространенными возбудителями отита среднего уха являются Staphylococcus pneumoniae (30%), Haemophilus influenza (20%), Branhamella catarrhalis (12%), Streptococcus pyogenes (3%) и Staphylococcus aureus (1,5%). Конечным итогом является скопление бактерий, лейкоцитов и жидкости, что при отсутствии возможности удаления через евстахиевую трубу приводит к повышенному давлению в среднем ухе. Во многих случаях терапия антибиотиками является достаточным лечением и заболевание излечивается. Однако у значительного числа пациентов заболевание часто становится рецидивирующим или полностью не излечивается. При рецидивирующем отите среднего уха или хроническом отите среднего уха с выпотом, имеется постоянное скопление жидкости и бактерий, которые создают градиент давления через барабанную перепонку, вызывая боль и нарушение слуха. Фенестрация барабанной перепонки (обычно посредством постановки тимпаностомической трубки) уменьшает градиент давления и облегчает дренирование среднего уха (через внешнее ухо вместо евстахиевой трубы - форма «обходного пути евстахиевой трубы»).
Хирургическая установка тимпаностомических трубок является наиболее широко используемым видом лечения хронического отита среднего уха, поскольку, хотя она и не является лечебной процедурой, она улучшает слух (что в свою очередь улучшает развитие речи) и уменьшает частоту развития острого отита среднего уха. Постановка тимпаностомических трубок является одним из наиболее распространенных хирургических вмешательств в США при проведении 1,3 млн установок в год. Почти для всех детей раннего возраста и большого процента детей более старшего возраста для проведения установки требуется общая анестезия. Поскольку общая анестезия имеет высокую частоту проявления тяжелых побочных эффектов у детей (представляет большой риск и является дорогостоящей), желательно ограничить количество анестетиков для применения у детей. Наиболее распространенные осложнения при установке тимпаностомических трубок включают хроническую оторею (часто за счет инфицирования S. pneumoniae, H. influenza, Pseudomonas aerugenosa, S. aureus или Candida), реакцию на чужеродное тело с образованием грануляционной ткани и развитием инфекции, образование пробки (часто обструктированной грануляционной тканью, бактериями и/или кровяным сгустком), перфорацию барабанной перепонки, мирингосклероз, атрофию барабанной перепонки (ретракция, ателектаз) и образование холестеатомы.
Покрытие тимпаностомических трубок эффективным препаратом позволит легко проводить ее установку, оставлять на месте так долго, как это требуется, легко удалять в амбулаторных условиях без анестезии, избежать развития инфекции и предупреждать образование грануляционной ткани в трубке (которое может привести не только к обструкции, но к «прикреплению» трубки так, что становится необходимым хирургическое удаление трубки под анестезией). Эффективная тимпаностомическая трубка будет также снижать частоту развития осложнений таких, как хроническая оторея (часто за счет инфицирования, вызванного S. pneumoniae, H. influenza, Pseudomonas aerugenosa, S. aureus или Candida); сохранять функциональную активность (предупреждать обструкцию грануляционной тканью, бактериями и/или кровяным сгустком) и/или снижать вероятность перфорации барабанном перепонки, развития мирингосклероза, атрофии барабанной перепонки и образования холестеатомы. Следовательно, разработка трубки, которая не становится обструктированной грануляционной тканью, не рубцуется на месте и менее подвержена инфицированию (тем самым снижается необходимость в удалении/замене трубки), будет значительным достижением в медицине.
В предпочтительном варианте воплощения доксорубицин, митоксантрон, 5-фторурацил и/или этопозид включают в покрытие, наносимое на поверхность тимпаностомической трубки. Лекарственный препарат(ы) можно наносить несколькими способами: а) в виде покрытия, нанесенного на внешнюю поверхность тимпаностомической трубки; b) в виде покрытия, нанесенного на внутреннюю (просветную) поверхность тимпаностомической трубки; с) в виде покрытия, нанесенного на все или части обеих поверхностей и/или d) в виде включения в полимеры, входящие в состав материала тимпаностомической трубки.
Покрытие лекарственным препаратом или включение лекарственного препарата в тимпаностомическую трубку позволит обеспечить концентрации бактерицидного препарата местно на поверхности трубки, тем самым снижая частоту колонизации бактерий (и последующего развития инфекции среднего уха), одновременно обеспечивая незначительно системное действие препаратов. Несмотря на то, что для некоторых средств не требуется полимерных носителей для присоединения лекарственного препарата к поверхности тимпаностомической трубки, некоторые полимерные носители особенно подходят для применения в данном варианте воплощения. Особый интерес представляют такие полимерные носители, как полиуретаны (например, ChronoFlex AL 85A [CT Biomaterials], HydroMed640 [CT Biomaterials], HYDROSLIP C [CT Biomaterials], HYDROSLIP C [CT Biomaterials], HYDROTHANE [CT Biomaterials], HYDROTHANE [CT Biomaterials]), акриловые и метакриловые сополимеры (например, поли(этилен-со-акриловая кислота), полимеры, производные целлюлозы (например, нитроцеллюлоза, ацетобутират целлюлозы, ацетопропионат целлюлозы), сополимеры акрилата и метакрилата (например, поли(этилен-со-винилацетат)), а также их смеси. [CT Biomaterials]), акриловые и метакриловые сополимеры (например, поли(этилен-со-акриловая кислота), полимеры, производные целлюлозы (например, нитроцеллюлоза, ацетобутират целлюлозы, ацетопропионат целлюлозы), сополимеры акрилата и метакрилата (например, поли(этилен-со-винилацетат)), а также их смеси.
Существуют две основные конструкции тимпаностомических трубок: трубки в форме кольца, которые оставляют на месте менее чем на 1 год, и при этом имеет место низкая частота постоянной перфорации барабанной перепонки (1%) и Т-трубки, которые оставляют на месте в течение нескольких лет, но при этом существует более высокая частота постоянной перфорации (5%). Поскольку тимпаностомические трубки изготавливают в самых различных конфигурациях и размерах, точное вводимое количество будет варьироваться в зависимости от размера, площади поверхности и конструкции устройства. Однако можно использовать определенные принципы при применении в данной области. Количество лекарственного препарата можно рассчитать, как функцию количества на единицу площади (участка устройства, который подлежит покрытию), можно определить общее количество препарата для введения и соответствующие поверхностные концентрации активного препарата. Независимо от способа нанесения препарата на тимпаностомическую трубку предпочтительные противоопухолевые препараты, используемые по отдельности или в комбинации, следует вводить, руководствуясь следующими правилами дозирования:
(а) Антрациклины. При использовании доксорубицина в качестве примера антрациклинов, в виде полимерного покрытия, включения в полимеры, из которых изготовлены компоненты тимпаностомической трубки, или нанесенного без полимерного носителя общее количество наносимого доксорубицина не должно превышать 25 мг (в пределах от 0,1 мкг до 25 мг). В особо предпочтительном варианте воплощения общее количество нанесенного препарата должно находиться в пределах от 1 мкг до 5 мг. Доза на единицу площади устройства (т.е. количество препарата, как функция площади поверхности участка тимпаностомической трубки, на который наносится и/или в который включают лекарственный препарат) должна находиться в пределах 0,01 мкг-100 мкг на 1 мм2 площади поверхности. В особо предпочтительном варианте воплощения доксорубицин следует наносить на поверхность тимпаностомической трубки в дозе в пределах 0,1 мкг/мм2-10 мкг/мм2. Поскольку различные полимерные и неполимерные оболочки будут высвобождать доксорубицин с различной скоростью, вышеуказанные параметры дозирования следует использовать с учетом скорости высвобождения лекарственного препарата с поверхности тимпаностомической трубки так, чтобы на поверхности поддерживалась минимальная концентрация доксорубицина 10-7-10-4 М. Необходимо обеспечить гарантию того, чтобы концентрации лекарственного препарата на поверхности превышали концентрации доксорубицина, известные как летальные для многих видов бактерий и грибов (т.е. выше 10-4 М, хотя для некоторых вариантов воплощения требуются более низкие концентрации). В предпочтительном варианте воплощения доксорубицин высвобождается с поверхности тимпаностомической трубки таким образом, что противоинфекционная активность сохраняется в течение периода времени от нескольких часов до нескольких месяцев. В особо предпочтительном варианте воплощения лекарственный препарат высвобождается в эффективных концентрациях в течение периода времени в пределах 1 недели - 6 месяцев. Из представленного здесь обсуждения понятно, что аналоги и производные доксорубицина (описанные ранее) с аналогичной функциональной активностью можно использовать для целей настоящего изобретения; кроме того, указанные выше параметры дозирования можно скорректировать с учетом относительной активности аналога или производного по сравнению с исходным соединением (например, соединение, которое активнее доксорубицина в два раза, вводят в половинной части указанных параметров, в то время как соединение, наполовину менее активное чем доксорубицин, вводят в количестве, в два раза превышающем вышеуказанные параметры, и т.д.).
При использовании митоксантрона в качестве другого примера антрациклина в виде полимерного покрытия, включения в полимеры, из которых изготовлена тимпаностомическая трубка, или нанесенного без полимера-носителя, общее количество нанесенного митоксантрона не должно превышать 5 мг (в пределах от 0,01 мкг до 5 мг). В особо предпочтительном варианте воплощения общее количество нанесенного препарата должно находиться в пределах от 0,1 мкг до 1 мг. Доза на единицу площади устройства (т.е. количество лекарственного препарата, как функция площади поверхности участка тимпаностомической трубки, на который наносят и/или в который включают лекарственный препарат) должна находиться в пределах 0,01 мкг-20 мкг на мм2 площади поверхности. В особо предпочтительном варианте воплощения митоксантрон следует наносить на поверхность тимпаностомической трубки в дозе в пределах 0,05 мкг/мм2-3 мкг/мм2. Поскольку различные полимерные и неполимерные оболочки будут высвобождать митоксантрон с различной скоростью, вышеуказанные параметры дозирования следует использовать с учетом скорости высвобождения лекарственного препарата с поверхности тимпаностомической трубки так, чтобы поддерживалась минимальная концентрация митоксантрона 10-5-10-6 М. Необходимо обеспечить гарантию того, чтобы концентрации лекарственного препарата на поверхности устройства превышали концентрации митоксантрона, известные как летальные для многих видов бактерий и грибов (т.е. выше 10-5 М, хотя для некоторых вариантов воплощения требуются более низкие концентрации). В предпочтительном варианте воплощения митоксантрон высвобождается с поверхности тимпаностомической трубки таким образом, что противоинфекционная активность сохраняется в течение периода времени от нескольких часов до нескольких месяцев. В особо предпочтительном варианте воплощения лекарственный препарат высвобождается в эффективных концентрациях в течение периода времени в пределах 1 недели - 6 месяцев. Из представленного здесь обсуждения понятно, что аналоги и производные митоксантрона (описанные ранее) с аналогичной функциональной активностью можно использовать для целей настоящего изобретения; кроме того, указанные выше параметры дозирования можно скорректировать с учетом относительной активности аналога или производного по сравнению с исходным соединением (например, соединение, которое активнее митоксантрона в два раза, вводят в половинной части указанных параметров, в то время как соединение, наполовину менее активное чем митоксантрон, вводят в количестве, в два раза превышающем вышеуказанные параметры, и т.д.).
(b) Фторпиримидины. При использовании 5-фторурацила в качестве примера фторпиримидина в виде полимерного покрытия, включения в полимеры, из которых изготовлена тимпаностомическая трубка, или нанесенного без полимера-носителя, общее количество нанесенного 5-фторурацила не должно превышать 250 мг (в пределах от 1,0 мкг до 250 мг). В особо предпочтительном варианте воплощения общее количество нанесенного препарата должно находиться в пределах от 10 мкг до 25 мг. Доза на единицу площади устройства (т.е. количество лекарственного препарата как функция площади поверхности участка тимпаностомической трубки, на который наносят и/или в который включают лекарственный препарат) должна находиться в пределах 0,1 мкг-1 мг на мм2 площади поверхности. В особо предпочтительном варианте воплощения 5-фторурацил следует наносить на поверхность тимпаностомической трубки в дозе в пределах 1,0 мкг/мм2-50 мкг/мм2. Поскольку различные полимерные и неполимерные оболочки будут высвобождать 5-фторурацил с различной скоростью, вышеуказанные параметры дозирования следует использовать с учетом скорости высвобождения лекарственного препарата с поверхности тимпаностомической трубки так, чтобы поддерживалась минимальная концентрация 5-фторурацила 10-4-10-7 М. Необходимо обеспечить гарантию того, чтобы концентрации лекарственного препарата на поверхности превышали концентрации 5-фторурацила, известные как летальные для многих видов бактерий и грибов (т.е. выше 10-4 М, хотя для некоторых вариантов воплощения требуются более низкие концентрации). В предпочтительном варианте воплощения 5-фторурацил высвобождается с поверхности тимпаностомической трубки таким образом, что противоинфекционная активность сохраняется в течение периода времени от нескольких часов до нескольких месяцев. В особо предпочтительном варианте воплощения лекарственный препарат высвобождается в эффективных концентрациях в течение периода времени в пределах 1 недели - 6 месяцев. Из представленного здесь обсуждения понятно, что аналоги и производные 5-форурацила (описанные ранее) с аналогичной функциональной активностью можно использовать для целей настоящего изобретения; кроме того, указанные выше параметры дозирования можно скорректировать с учетом относительной активности аналога или производного по сравнению с исходным соединением (например, соединение, которое активнее 5-фторурацила в два раза, вводят в половинной части указанных параметров, в то время как соединение, наполовину менее активное чем 5-фторурацил, вводят в количестве, в два раза превышающем вышеуказанные параметры, и т.д.).
(с) Подофилотоксины. При использовании этопозида в качестве примера подофилотоксина в виде полимерного покрытия, включения в полимеры, из которых изготовлена тимпаностомическая трубка, или нанесенного без полимера-носителя, общее количество нанесенного этопозида не должно превышать 25 мг (в пределах от 0,1 мкг до 25 мг). В особо предпочтительном варианте воплощения общее количество нанесенного препарата должно находиться в пределах от 1 мкг до 5 мг. Доза на единицу площади устройства (т.е. количество лекарственного препарата, как функция площади поверхности участка тимпаностомической трубки, на который наносят и/или в который включают лекарственный препарат) должна находиться в пределах 0,01 мкг-100 мкг на 1 мм2 площади поверхности. В особо предпочтительном варианте воплощения этопозид следует наносить на поверхность тимпаностомической трубки в дозе в пределах 0,1-10 мкг/мм2. Поскольку различные полимерные и неполимерные оболочки будут высвобождать этопозид с различной скоростью, вышеуказанные параметры дозирования следует использовать с учетом скорости высвобождения лекарственного препарата с поверхности тимпаностомической трубки так, чтобы поддерживалась концентрация этопозида 10-5-10-6 М. Необходимо обеспечить гарантию того, чтобы концентрации лекарственного препарата на поверхности превышали концентрации этопозида, известные как летальные для многих видов бактерий и грибов (т.е. выше 10-5 М, хотя для некоторых вариантов воплощения требуются более низкие концентрации). В предпочтительном варианте воплощения этопозид высвобождается с поверхности тимпаностомической трубки таким образом, что противоинфекционная активность сохраняется в течение периода времени от нескольких часов до нескольких месяцев. В особо предпочтительном варианте воплощения лекарственный препарат высвобождается в эффективных концентрациях в течение периода времени в пределах 1 недели - 6 месяцев. Из представленного здесь обсуждения понятно, что аналоги и производные этопозида (описанные ранее) с аналогичной функциональной активностью можно использовать для целей настоящего изобретения; кроме того, указанные выше параметры дозирования можно скорректировать с учетом относительной активности аналога или производного по сравнению с исходным соединением (например, соединение, которое активнее этопозида в два раза, вводят в половинной части указанных параметров, в то время как соединение, наполовину менее активное чем этопозид, вводят в количестве, в два раза превышающем вышеуказанные параметры, и т.д.).
(d) Комбинированная терапия. Из представленного выше обсуждения понятно, что можно использовать комбинации антрациклинов (например, доксорубицина или митоксантрона), фторпиримидинов (например, 5-фторурацила), антагонистов фолиевой кислоты (например, метотрексата) и подофилотоксинов (например, этопозида) для повышения антибактериальной активности покрытия тимпаностомической трубки. Аналогичным образом антрациклины (например, доксорубицин или митоксантрон), фторпиримидины (например, 5-фторурацил), антагонисты фолиевой кислоты (например, метотрексат) и/или подофилотоксины (например, этопозид) можно сочетать с обычными антибиотиками и/или противогрибковыми препаратами для усиления эффективности.
Синусные стенты
Синусы представляют собой четыре пары полых областей, находящихся в костях черепа, имеющих название костей, в которых они располагаются (решетчатой, верхнечелюстной или гайморовой, лобной и клиновидной). Они все покрыты дыхательной слизистой, которая непосредственно прилегает к кости. После развития воспаления, такого как инфекция верхних дыхательных путей или аллергический ринит, может развиться гнойная форма синусита. В некоторых случаях секреты могут задерживаться в синусе за счет измененной функции ресничек респираторного эпителия или обструкции отверстия (остеи), через которое происходит дренирование синуса. Неполное дренирование делает синус предрасположенным к инфекции, обычно вызванной Haemophilus influenza, Streptococcus pneumoniae, Moraxella catarrhalis, Veillonella, Peptococcus, Corynebacterium acnes и некоторыми видами грибов.
Когда первоначальное лечение, такое как антибиотиками, интраназальными спреями со стероидами и противоотечными средствами не эффективно, может возникнуть необходимость в проведении хирургического дренирования инфицированного синуса. Хирургическое лечение часто включает санацию остеи для удаления анатомических обструкций и удаление части слизистой. В некоторых случаях стент (цилиндрическая трубка, которая физически поддерживает полость остеи открытой) оставляют в кости для гарантии того, что дренирование сохраняется даже при наличии отека после операции. Как правило, стенты, выполненные из нержавеющей стали или пластика, оставляют на месте в течение нескольких дней или нескольких недель перед удалением.
К сожалению, стенты становятся инфицированными или зарастают грануляционной тканью, что делает их неэффективными. Покрытие стента эффективным лекарственным препаратом позволит легко проводить его установку, оставлять на месте в течение такого длительного периода времени, как это требуется, легко удалять в амбулаторных условиях без анестезии, противостоять инфекции и предупреждать образование грануляционной ткани в стенте (что может привести не только к обструкции, но также «прикреплению» стента так, что в результате становится необходимым его хирургическое удаление). Следовательно, будет полезной разработка синусового стента, который не становится обструктированным грануляционной тканью, не рубцуется на месте и менее подвержен инфицированию.
В предпочтительном варианте воплощения доксорубицин, митоксантрон, 5-фторурацил и этопозид включают в покрытие, наносимое на поверхность синусового стента. Лекарственный препарат(ы) можно наносить несколькими способами: а) в виде покрытия, нанесенного на внешнюю поверхность синусового стента; b) в виде покрытия, нанесенного на внутреннюю (просветную) поверхность синусового стента; с) в виде покрытия, нанесенного на все или части обеих поверхностей и/или d) в виде включения в полимеры, которые входят в состав материала синусового стента.
Покрытие лекарственным препаратом или включение лекарственного препарата в синусовый стент позволит обеспечить концентрации бактерицидного препарата местно на поверхности трубки, тем самым снижая частоту колонизации бактерий (и последующего развития синусита), одновременно обеспечивая пренебрежимо малое системное действие препаратов. Несмотря на то, что для некоторых средств не требуется полимерных носителей для прикрепления лекарственного препарата к поверхности синусового стента, некоторые полимерные носители особенно подходят для применения в данном варианте воплощения. Особый интерес представляют такие полимерные носители, как полиуретаны (например, ChronoFlex AL 85A [CT Biomaterials], HydroMed640 [CT Biomaterials], HYDROSLIP C [CT Biomaterials], HYDROSLIP C [CT Biomaterials], HYDROTHANE [CT Biomaterials], HYDROTHANE [CT Biomaterials]), акриловые и метакриловые сополимеры (например, поли(этилен-со-акриловая кислота), полимеры, производные целлюлозы (например, нитроцеллюлоза, ацетобутират целлюлозы, ацетопропионат целлюлозы), сополимеры акрилата и метакрилата (например, поли(этилен-со-винилацетат)), а также их смеси. [CT Biomaterials]), акриловые и метакриловые сополимеры (например, поли(этилен-со-акриловая кислота), полимеры, производные целлюлозы (например, нитроцеллюлоза, ацетобутират целлюлозы, ацетопропионат целлюлозы), сополимеры акрилата и метакрилата (например, поли(этилен-со-винилацетат)), а также их смеси.
Поскольку синусовые стенты предрасположены к тем же осложнениям и инфекциям, вызванным теми же бактериями, то правила дозирования доксорубицина, митоксантрона, 5-фторурацила и этопозида при покрытии синусовых стентов являются аналогичными описанным выше для тимпаностомических трубок.
G. Инфекции, связанные с урологическими имплантатами
Имплантируемые медицинские устройства используют для органов мочевой системы гораздо чаще, чем для органов любой другой системы организма, и они имеют наиболее высокую частоту инфицирования. Фактически большая часть урологических устройств становится инфицированной, если они остаются на месте в течение длительного периода времени и являются наиболее частой причиной нозокомиальной инфекции.
Уретральные катетеры (Фолея)
Каждый год в США проводят установку 4-5 млн катетеров для мочевого пузыря госпитализированным пациентам. Продолжительность катетеризации является важным фактором риска для пациентов с развитием клинически значимой инфекции - частота развития инфекции повышается на 5-10% в день при удлинении периода катетеризации пациента. Несмотря на то, что обычный цистит можно лечить с помощью короткого курса антибиотиков (с удалением катетера или без него), довольно часто имеют место серьезные осложнения и они могут быть очень тяжелыми. Инфекция может распространиться на почки, вызвав развитие острого пиелонефрита, который, в свою очередь, может привести к рубцеванию и длительному повреждению функции почек. Возможно, наибольшую тревогу вызывает риск, оцениваемый 1-2%, развития сепсиса, вызванного грамотрицательными бактериями (риск в 3 раза выше у катетеризированных больных и составляет 30% от всех случаев), который очень трудно лечить и который может привести к септическому шоку и смерти (до 50% пациентов). Следовательно, в медицине существует большая потребность в производстве усовершенствованных уретральных катетеров, способных снижать частоту инфекций мочевых путей у катетеризированных больных.
Наиболее частой причиной инфекции являются бактерии, обычно обнаруживаемые в пищеварительном тракте или промежности, которые способны обсеменить катетер с получением доступа к стерильному в норме мочевому пузырю. Бактерии могут попасть в мочевой пузырь при введении катетера, получить доступ через оболочку экссудата, который окружает катетер и/или попасть через просвет катетерной трубки. Несколько видов бактерий способны прикрепляться к катетеру и образовывать биопленку, которая обеспечивает защищенное место для их роста. При кратковременной катетеризации наиболее часты инфекции, вызываемые одним микроорганизмом, и, как правило, он относится к Escherichia coli, энтерококки, Pseudomonas aeruginosa, Klebsiella, Proteus, Enterobacter, Staphylicoccus epidermidis, Staphylococcus aureus и Staphylococcus saprophyticus. Пациенты с катетеризацией на длительное время предрасположены к полимикробным инфекциям, вызванным всеми упомянутыми выше микроорганизмами, а также Providencia stuartii, Morganella morganii и Candida. Доказано, что применение антибиотиков, системное или местное, является неэффективным, поскольку оно приводит только к появлению резистентных к лекарственным препаратам бактерий.
Покрытие уретрального катетера эффективным лекарственным препаратом позволит с легкостью осуществлять введение катетера в мочевой пузырь, противостоять инфекции и предупреждать образование биопленки на катетере. Эффективное покрытие будет предупреждать или снижать частоту развития инфекции мочевых путей, пиелонефрита и/или сепсиса. В предпочтительном варианте воплощения доксорубицин, митоксантрон, 5-фторурацил и/или этопозид включают в покрытие, наносимое на поверхность уретрального катетера. Лекарственный препарат(ы) можно наносить несколькими способами: а) в виде покрытия, нанесенного на внешнюю поверхность уретрального катетера; b) в виде покрытия, нанесенного на внутреннюю (просветную) поверхность уретрального катетера; с) в виде покрытия, нанесенного на все или части обеих поверхностей и/или d) в виде включения в полимеры, которые входят в состав материала уретрального катетера.
Покрытие лекарственным препаратом или включение лекарственного препарата в уретральный катетер позволит обеспечить концентрации бактерицидного препарата местно на поверхности катетера, тем самым снижая частоту колонизации бактерий (и последующего развития инфекции мочевых путей и бактериемии), одновременно обеспечивая незначительное системное действие препаратов. Несмотря на то, что для некоторых средств не требуется полимерных носителей для прикрепления лекарственного препарата к поверхности уретрального катетера, некоторые полимерные носители особенно подходят для применения в данном варианте воплощения. Особый интерес представляют такие полимерные носители, как полиуретаны (например, ChronoFlex AL 85A [CT Biomaterials], HydroMed640 [CT Biomaterials], HYDROSLIP C [CT Biomaterials], HYDROSLIP C [CT Biomaterials], HYDROTHANE [CT Biomaterials], HYDROTHANE [CT Biomaterials]), акриловые и метакриловые сополимеры (например, поли(этилен-со-акриловая кислота), полимеры, производные целлюлозы (например, нитроцеллюлоза, ацетобутират целлюлозы, ацетопропионат целлюлозы), сополимеры акрилата и метакрилата (например, поли(этилен-со-винилацетат)), а также их смеси. [CT Biomaterials]), акриловые и метакриловые сополимеры (например, поли(этилен-со-акриловая кислота), полимеры, производные целлюлозы (например, нитроцеллюлоза, ацетобутират целлюлозы, ацетопропионат целлюлозы), сополимеры акрилата и метакрилата (например, поли(этилен-со-винилацетат)), а также их смеси.
Поскольку уретральные катетеры (например, катетеры Фолея, надлобковые катетеры) изготавливают в самых различных конфигурациях и размерах, точное вводимое количество будет варьироваться в зависимости от размера, площади поверхности и конструкции устройства. Однако можно использовать определенные принципы при применении в данной области. Количество лекарственного препарата можно рассчитать как функцию количества на единицу площади (участка устройства, который подлежит покрытию), можно определить общую концентрацию препарата для введения и соответствующие поверхностные концентрации активного препарата. Независимо от способа нанесения препарата на уретральный катетер предпочтительные противоопухолевые препараты, используемые по отдельности или в комбинации, следует вводить, руководствуясь следующими правилами дозирования:
(а) Антрациклины. При использовании доксорубицина в качестве примера антрациклинов, в виде полимерного покрытия, включения в полимеры, из которых изготовлен уретральный катетер, или нанесенного без полимерного носителя, общее количество нанесенного доксорубицина не должно превышать 25 мг (в пределах от 0,1 мкг до 25 мг). В особенно предпочтительном варианте воплощения общее количество нанесенного препарата должно находиться в пределах от 1 мкг до 5 мг. Доза на единицу площади устройства (т.е. количество препарата как функция площади поверхности участка уретрального катетера, на который наносят и/или в который включают лекарственный препарат) должна находиться в пределах 0,01 мкг-100 мкг на 1 мм2 площади поверхности. В особо предпочтительном варианте воплощения доксорубицин следует наносить на поверхность уретрального катетера в дозе в пределах 0,1 мкг/мм2-10 мкг/мм2. Поскольку различные полимерные и неполимерные оболочки будут высвобождать доксорубицин с различной скоростью, вышеуказанные параметры дозирования следует использовать с учетом скорости высвобождения лекарственного препарата с поверхности уретрального катетера так, чтобы на поверхности поддерживалась минимальная концентрация доксорубицина 10-7-10-4 М. Необходимо обеспечить гарантию того, чтобы концентрации лекарственного препарата на поверхности превышали концентрации доксорубицина, известные как летальные для многих видов бактерий и грибов (т.е. выше 10-4 М, хотя для некоторых вариантов воплощения требуются более низкие концентрации). В предпочтительном варианте воплощения доксорубицин высвобождается с поверхности уретрального катетера таким образом, что противоинфекционная активность сохраняется в течение периода времени от нескольких часов до нескольких месяцев. В особо предпочтительном варианте воплощения лекарственный препарат высвобождается в эффективных концентрациях в течение периода времени в пределах 1 недели-1 месяца. Из представленного здесь обсуждения понятно, что аналоги и производные доксорубицина (описанные ранее) с аналогичной функциональной активностью можно использовать для целей настоящего изобретения; кроме того, указанные выше параметры дозирования можно скорректировать с учетом относительной активности аналога или производного по сравнению с исходным соединением (например, соединение, которое активнее доксорубицина в два раза, вводят в половинной части указанных параметров, в то время как соединение, наполовину менее активное чем доксорубицин, вводят в количестве, в два раза превышающем вышеуказанные параметры, и т.д.).
При использовании митоксантрона в качестве другого примера антрациклина в виде полимерного покрытия, включения в полимеры, из которых изготовлен уретральный катетер, или нанесенного без полимера-носителя, общее количество нанесенного митоксантрона не должно превышать 5 мг (в пределах от 0,01 мкг до 5 мг). В особо предпочтительном варианте воплощения общее количество нанесенного препарата должно находиться в пределах от 0,1 мкг до 1 мг. Доза на единицу площади устройства (т.е. количество лекарственного препарата как функция площади поверхности участка уретрального катетера, на который наносят и/или в который включают лекарственный препарат) должна находиться в пределах 0,01 мкг-20 мкг на 1 мм2 площади поверхности. В особо предпочтительном варианте воплощения митоксантрон следует наносить на поверхность уретрального катетера в дозе в пределах 0,05-3 мкг/мм2. Поскольку различные полимерные и неполимерные оболочки будут высвобождать митоксантрон с различной скоростью, вышеуказанные параметры дозирования следует использовать с учетом скорости высвобождения лекарственного препарата с поверхности уретрального катетера так, чтобы поддерживалась минимальная концентрация митоксантрона 10-5-10-6 М. Необходимо обеспечить гарантию того, чтобы концентрации лекарственного препарата на поверхности превышали концентрации митоксантрона, известные как летальные для многих видов бактерий и грибов (т.е. выше 10-5 М, хотя для некоторых вариантов воплощения требуются более низкие концентрации). В предпочтительном варианте воплощения митоксантрон высвобождается с поверхности уретрального катетера таким образом, что противоинфекционная активность сохраняется в течение периода времени от нескольких часов до нескольких месяцев. В особо предпочтительном варианте воплощения лекарственный препарат высвобождается в эффективных концентрациях в течение периода времени в пределах 1 недели-1 месяца. Из представленного здесь обсуждения понятно, что аналоги и производные митоксантрона (описанные ранее) с аналогичной функциональной активностью можно использовать для целей настоящего изобретения; кроме того, указанные выше параметры дозирования можно скорректировать с учетом относительной активности аналога или производного по сравнению с исходным соединением (например, соединение, которое активнее митоксантрона в два раза, вводят в половинной части указанных параметров, в то время как соединение, наполовину менее активное чем митоксантрон, вводят в количестве, в два раза превышающем вышеуказанные параметры и т.д.).
(b) Фторпиримидины. При использовании 5-фторурацила в качестве примера фторпиримидина в виде полимерного покрытия, включения в полимеры, из которых изготовлен уретральный катетер, или нанесенного без полимера-носителя, общее количество нанесенного 5-фторурацила не должно превышать 250 мг (в пределах от 1,0 мкг до 250 мг). В особо предпочтительном варианте воплощения общее количество нанесенного препарата должно находиться в пределах от 10 мкг до 25 мг. Доза на единицу площади устройства (т.е. количество лекарственного препарата как функция площади поверхности участка уретрального катетера, на который наносят и/или в который включают лекарственный препарат) должна находиться в пределах 0,1 мкг-1 мг на мм2 площади поверхности. В особо предпочтительном варианте воплощения 5-фторурацил следует наносить на поверхность уретрального катетера в дозе в пределах 1,0-50 мкг/мм2. Поскольку различные полимерные и неполимерные оболочки будут высвобождать 5-фторурацил с различной скоростью, вышеуказанные параметры дозирования следует использовать с учетом скорости высвобождения лекарственного препарата с поверхности уретрального катетера так, чтобы поддерживалась минимальная концентрация 5-фторурацила 10-4-10-7 М. Необходимо обеспечить гарантию того, чтобы концентрации лекарственного препарата на поверхности устройства превышали концентрации 5-фторурацила, известные как летальные для многих видов бактерий и грибов (т.е. выше 10-4 М, хотя для некоторых вариантов воплощения требуются более низкие концентрации). В предпочтительном варианте воплощения 5-фторурацил высвобождается с поверхности уретрального катетера таким образом, что противоинфекционная активность сохраняется в течение периода времени от нескольких часов до нескольких месяцев. В особо предпочтительном варианте воплощения лекарственный препарат высвобождается в эффективных концентрациях в течение периода времени в пределах 1 недели - 1 месяца. Из представленного здесь обсуждения понятно, что аналоги и производные 5-фторурацила (описанные ранее) с аналогичной функциональной активностью можно использовать для целей настоящего изобретения; кроме того, указанные выше параметры дозирования можно скорректировать с учетом относительной активности аналога или производного по сравнению с исходным соединением (например, соединение, которое активнее 5-форурацила в два раза, вводят в половинной части указанных параметров, в то время как соединение, наполовину менее активное чем 5-фторурацил, вводят в количестве, в два раза превышающем вышеуказанные параметры, и т.д.).
(с) Подофилотоксины. При использовании этопозида в качестве примера подофилотоксина в виде полимерного покрытия, включения в полимеры, из которых изготовлен уретральный катетер, или нанесенного без полимера-носителя, общее количество нанесенного этопозида не должно превышать 25 мг (в пределах от 0,1 мкг до 25 мг). В особо предпочтительном варианте воплощения общее количество нанесенного препарата должно находиться в пределах от 1 мкг до 5 мг. Доза на единицу площади устройства (т.е. количество лекарственного препарата, как функция площади поверхности участка уретрального катетера, на который наносят и/или в который включают лекарственный препарат) должна находиться в пределах 0,01-100 мкг на 1 мм2 площади поверхности. В особо предпочтительном варианте воплощения этопозид следует наносить на поверхность уретрального катетера в дозе в пределах 0,1-10 мкг/мм2. Поскольку различные полимерные и неполимерные оболочки будут высвобождать этопозид с различной скоростью, вышеуказанные параметры дозирования следует использовать с учетом скорости высвобождения лекарственного препарата с поверхности уретрального катетера так, чтобы поддерживалась минимальная концентрация этопозида 10-5-10-6 М. Необходимо обеспечить гарантию того, чтобы концентрации лекарственного препарата на поверхности устройства превышали концентрации этопозида, известные как летальные для многих видов бактерий и грибов (т.е. выше 10-5 М, хотя для некоторых вариантов воплощения требуются более низкие концентрации). В предпочтительном варианте воплощения этопозид высвобождается с поверхности уретрального катетера таким образом, что противоинфекционная активность сохраняется в течение периода времени от нескольких часов до нескольких месяцев. В особо предпочтительном варианте воплощения лекарственный препарат высвобождается в эффективных концентрациях в течение периода времени в пределах 1 недели-1 месяца. Из представленного здесь обсуждения понятно, что аналоги и производные этопозида (описанные ранее) с аналогичной функциональной активностью можно использовать для целей настоящего изобретения; кроме того, указанные выше параметры дозирования можно скорректировать с учетом относительной активности аналога или производного по сравнению с исходным соединением (например, соединение, которое активнее этопозида в два раза, вводят в половинной части указанных параметров, в то время как соединение, наполовину менее активное чем этопозид, вводят в количестве, в два раза превышающем вышеуказанные параметры, и т.д.).
(d) Комбинированная терапия. Из представленного выше обсуждения понятно, что можно использовать комбинации антрациклинов (например, доксорубицина или митоксантрона), фторпиримидинов (например, 5-фторурацила), антагонистов фолиевой кислоты (например, метотрексата) и подофилотоксинов (например, этопозида) для повышения антибактериальной активности покрытия уретрального катетера. Аналогичным образом антрациклины (например, доксорубицин или митоксантрон), фторпиримидины (например, 5-фторурацил), антагонисты фолиевой кислоты (например, метотрексат) и/или подофилотоксины (например, этопозид) можно сочетать с обычными антибиотиками и/или противогрибковыми препаратами для усиления эффективности.
Мочеточниковые стенты
Мочеточниковые стенты представляют собой полые трубки с отверстиями по боковым сторонам и спиралями на каждом конце для предупреждения миграции. Мочеточниковые стенты применяются для оказания помощи при обструкциях (вызванных камнями или злокачественными опухолями) для облегчения прохождения камней или предоставления возможности для заживления анастомозов мочеточников или дренирования после операции или травмы. Их установку проводят эндоскопически через мочевой пузырь или перкутанно через почку. Биопленка из микроорганизмов образуется на 90% мочеточниковых стентов, и в 30% случаев развивается высокая бактеурия с частотой, возрастающей с увеличением продолжительности сохранения стента на месте. Наиболее распространенным патогеном является Pseudomonas aeruginosa, но энтерококки, Staphylococcus aureus и Candida также могут быть возбудителями инфекции. Для эффективного лечения часто необходимо удаление стента в дополнении к терапии антибиотиками.
К сожалению, мочеточниковые стенты могут стать инфицированными или покрыться мочевыми солями, что делает их неэффективными. Покрытие мочеточникового стента эффективным лекарственным препаратом будет упрощать его установку, обеспечит возможность оставлять его на месте в течение периода времени, насколько это требуется, легко удалять, противостоять инфекции и предупреждать отложение мочевых солей. Следовательно, будет полезной разработка мочеточникового стента, который не будет обструктироваться грануляционной тканью, не будет рубцеваться на месте и будет менее предрасположенным к инфицированию.
В предпочтительном варианте воплощения доксорубицин, митоксантрон, 5-фторурацил и этопозид включают в покрытие, наносимое на поверхность мочеточникового стента. Лекарственный препарат(ы) можно наносить несколькими способами: а) в виде покрытия, нанесенного на внешнюю поверхность мочеточникового стента; b) в виде покрытия, нанесенного на внутреннюю (просветную) поверхность мочеточникового стента; с) в виде покрытия на все или части обеих поверхностей и/или d) в виде включения в полимеры, которые входят в состав материала мочеточникового стента.
Покрытие лекарственным препаратом или включение лекарственного препарата в мочеточниковый стент позволит обеспечить концентрации бактерицидного препарата местно на поверхности стента, тем самым снижая частоту колонизации бактерий (и последующего развития пиелонефрита и/или бактериемии), одновременно обеспечивая незначительно системное действие препаратов. Несмотря на то, что для некоторых средств не требуется полимерных носителей для прикрепления лекарственного препарата к поверхности мочеточникового стента, некоторые полимерные носители особенно подходят для применения в данном варианте воплощения. Особый интерес представляют такие полимерные носители, как полиуретаны (например, ChronoFlex AL 85A [CT Biomaterials], HydroMed640 [CT Biomaterials], HYDROSLIP C [CT Biomaterials], HYDROSLIP C [CT Biomaterials], HYDROTHANE [CT Biomaterials], HYDROTHANE [CT Biomaterials]), акриловые и метакриловые сополимеры (например, поли(этилен-со-акриловая кислота), полимеры, производные целлюлозы (например, нитроцеллюлоза, ацетобутират целлюлозы, ацетопропионат целлюлозы), сополимеры акрилата и метакрилата (например, поли(этилен-со-винилацетат)), а также их смеси. [CT Biomaterials]), акриловые и метакриловые сополимеры (например, поли(этилен-со-акриловая кислота), полимеры, производные целлюлозы (например, нитроцеллюлоза, ацетобутират целлюлозы, ацетопропионат целлюлозы), сополимеры акрилата и метакрилата (например, поли(этилен-со-винилацетат)), а также их смеси.
Поскольку мочеточниковые стенты подвержены тем же самым осложнениям и инфекциям, возбудителями которых являются те же бактерии, то правила дозирования доксорубицина, митоксантрона, 5-фторурацила и этопозида в покрытии мочеточниковых стентов аналогичны описанным выше для уретральных катетеров. Однако в отличие от композиций, описанных для уретральных катетеров, высвобождение лекарственного препарата будет иметь место в течение 2-24 недель.
Уретральные стенты
Уретральные стенты используют для лечения рецидивирующих уретральных структур, диссинергии детрузо-внешнего сфинктера и обструкции выходного отверстия мочевого пузыря за счет доброкачественной гипертрофии простаты. Как правило, стенты являются саморасширяющимися и состоят из металлического сверхсплава, титана, нержавеющей стали или полиуретана. Возбудителями инфекций наиболее часто являются отрицательные на коагулазу стафилококки, Pseudomonas aeruginosa, энтерококки, Staphylococcus aureus, Serratia и Candida. Для лечения инфицированных стентов часто требуется терапия системными антибиотиками и удаление устройства.
Эффективное покрытие уретрального стента будет делать простым его установку, обеспечит возможность его нахождения на месте в течение периода времени, насколько это требуется, упростит удаление, позволит противостоять инфекции и предупреждать образование мочевых солей. Следовательно, будет полезной разработка уретрального стента, который не будет обструктироваться грануляционной тканью, не будет рубцеваться на месте и будет менее предрасположенным к инфицированию.
В предпочтительном варианте воплощения доксорубицин, митоксантрон, 5-фторурацил и/или этопозид включают в покрытие, наносимое на поверхность уретрального стента. Лекарственный препарат(ы) можно наносить несколькими способами: а) в виде покрытия, нанесенного на внешнюю поверхность уретрального стента; b) в виде покрытия, нанесенного на внутреннюю (просветную) поверхность уретрального стента; с) в виде покрытия на все или части обеих поверхностей и/или d) в виде включения в полимеры, входящие в состав материала уретрального стента.
Покрытие лекарственным препаратом или включение лекарственного препарата в уретральный стент позволит обеспечить концентрации бактерицидного препарата местно на поверхности стента, тем самым снижая частоту колонизации бактерий (и последующего развития пиелонефрита и/или бактериемии), одновременно обеспечивая незначительное системное действие препаратов. Несмотря на то, что для некоторых средств не требуется полимерных носителей для прикрепления лекарственного препарата к поверхности уретрального стента, некоторые полимерные носители особенно подходят для применения в данном варианте воплощения. Особый интерес представляют такие полимерные носители, как полиуретаны (например, ChronoFlex AL 85A [CT Biomaterials], HydroMed640 [CT Biomaterials], HYDROSLIP C [CT Biomaterials], HYDROSLIP C [CT Biomaterials], HYDROTHANE [CT Biomaterials], HYDROTHANE [CT Biomaterials]), акриловые и метакриловые сополимеры (например, поли(этилен-со-акриловая кислота), полимеры, производные целлюлозы (например, нитроцеллюлоза, ацетобутират целлюлозы, ацетопропионат целлюлозы), сополимеры акрилата и метакрилата (например, поли(этилен-со-винилацетат)), а также их смеси. [CT Biomaterials]), акриловые и метакриловые сополимеры (например, поли(этилен-со-акриловая кислота), полимеры, производные целлюлозы (например, нитроцеллюлоза, ацетобутират целлюлозы, ацетопропионат целлюлозы), сополимеры акрилата и метакрилата (например, поли(этилен-со-винилацетат)), а также их смеси.
Поскольку уретральные стенты предрасположены к тем же осложнениям и инфекциям, вызванным теми же бактериями, то правила дозирования доксорубицина, митоксантрона, 5-фторурацила и этопозида при покрытии уретральных стентов являются аналогичными описанным для уретральных катетеров. Однако в отличие от уретральных катетеров высвобождение лекарственных препаратов будет иметь место в течение 2-24 недель.
Искусственные сфинктеры мочевого пузыря
Искусственные сфинктеры мочевого пузыря применяются для лечения недержания мочи и в основном состоят из периуретрального имплантата. Установка искусственных сфинктеров мочевого пузыря может быть осложнена инфекцией (обычно в первые 6 месяцев после операции), вызванной отрицательными на коагулазу стафилококками (включая Staphylococcus epidermidis), Staphylococcus aureus, Pseudomonas aeruginosa, энтерококками, Serratia и Candida. Инфекция характеризуется лихорадкой, эритемой, индурацией и гнойными истечениями из места операции. Обычно инфекция распространяется через разрез во время операции и примерно до 3% искусственных сфинктеров мочевого пузыря становятся инфицированными, несмотря на самые идеальные стерильные условия, в которых проводится операция. Для борьбы с этим часто применяют внутриоперационное орошение растворами антибиотиков.
Для лечения инфекций, связанных с искусственными сфинктерами мочевого пузыря, требуется полное удаление устройства и лечение антибиотиками; замена устройства часто может быть отсрочена на 3-6 месяцев после подавления инфекции. Эффективное покрытие искусственного сфинктера мочевого пузыря будет противостоять инфекции и снижать частоту необходимости в повторном вмешательстве.
В предпочтительном варианте воплощения доксорубицин, митоксантрон, 5-фторурацил и/или этопозид включают в покрытие, наносимое на поверхность искусственного сфинктера мочевого пузыря. Лекарственный препарат(ы) можно наносить несколькими способами: а) в виде покрытия, нанесенного на внешнюю поверхность искусственного сфинктера мочевого пузыря, и/или b) в виде включения в полимеры, которые входят в состав материала искусственного сфинктера мочевого пузыря.
Покрытие лекарственным препаратом или включение лекарственного препарата в искусственный сфинктер мочевого пузыря позволит обеспечить концентрации бактерицидного препарата местно, тем самым снижая частоту колонизации бактерий (и последующего развития уретрита и/или инфицирования раны), одновременно обеспечивая незначительное системное действие препаратов. Несмотря на то, что для некоторых средств не требуется полимерных носителей для прикрепления лекарственного препарата к поверхности искусственного сфинктера мочевого пузыря, некоторые полимерные носители особенно подходят для применения в данном варианте воплощения. Особый интерес представляют такие полимерные носители, как полиуретаны (например, ChronoFlex AL 85A [CT Biomaterials], HydroMed640 [CT Biomaterials], HYDROSLIP C [CT Biomaterials], HYDROSLIP C [CT Biomaterials], HYDROTHANE [CT Biomaterials], HYDROTHANE [CT Biomaterials]), акриловые и метакриловые сополимеры (например, поли(этилен-со-акриловая кислота), полимеры, производные целлюлозы (например, нитроцеллюлоза, ацетобутират целлюлозы, ацетопропионат целлюлозы), сополимеры акрилата и метакрилата (например, поли(этилен-со-винилацетат)), а также их смеси. [CT Biomaterials]), акриловые и метакриловые сополимеры (например, поли(этилен-со-акриловая кислота), полимеры, производные целлюлозы (например, нитроцеллюлоза, ацетобутират целлюлозы, ацетопропионат целлюлозы), сополимеры акрилата и метакрилата (например, поли(этилен-со-винилацетат)), а также их смеси.
Поскольку искусственные сфинктеры мочевого пузыря предрасположены к инфекциям, вызываемым теми же самыми бактериями, которые имеют место с уретральными катетерами, то правила дозирования доксорубицина, митоксантрона, 5-фторурацила и этопозида при покрытии искусственных сфинктеров мочевого пузыря аналогичны описанным выше для уретральных катетеров. Однако в отличие от композиций, описанных для уретральных катетеров, высвобождение лекарственного препарата будет иметь место в течение 2-24 недель.
Имплантаты полового члена
Имплантаты полового члена применяются для лечения нарушения эрекции и, как правило, представляют собой гибкие стержни, шарнирные стержни или надувные устройства с насосом. Установка имплантатов полового члена может осложняться инфекцией (обычно в первые 6 месяцев после операции), возбудителями которой являются отрицательные на коагулазу стафилококки (включая Staphylococcus epidermis), Staphylococcus aureus, Pseudomonas aeruginosa, энтерококки, Serratia и Candida. Тип устройства и путь введения не оказывают влияния на частоту инфицирования. Инфекция характеризуется лихорадкой, эритемой, индурацией и гнойными истечениями из места операции. Обычный путь инфицирования имеет место через разрез во время операции и до 3% имплантатов полового члена инфицируются, несмотря на самые идеальные стерильные условия во время операции. Для борьбы с этим часто применяют внутриоперационное орошение растворами антибиотиков.
Для лечения инфекций, связанных с имплантатом полового члена, требуется полное удаление устройства и лечение антибиотиками; замена устройства часто может быть отсрочена на 3-6 месяцев после устранения инфекции. Эффективное покрытие имплантата полового члена будет противостоять инфекции и снижать частоту необходимости в повторном вмешательстве.
В предпочтительном варианте воплощения доксорубицин, митоксантрон, 5-фторурацил и/или этопозид включают в покрытие, наносимое на поверхность имплантата полового члена. Лекарственный препарат(ы) можно наносить несколькими способами: а) в виде покрытия, нанесенного на внешнюю поверхность имплантата полового члена, и/или b) в виде включения в полимеры, которые входят в состав материала имплантата полового члена.
Покрытие лекарственным препаратом или включение лекарственного препарата в имплантат полового члена позволит обеспечить концентрации бактерицидного препарата местно, тем самым снижая частоту колонизации бактерий (и последующего развития местной инфекции и повреждения устройства), одновременно обеспечивая незначительно системное действие препаратов. Несмотря на то, что для некоторых средств не требуется полимерных носителей для прикрепления лекарственного препарата к поверхности имплантата полового члена, некоторые полимерные носители особенно подходят для применения в данном варианте воплощения.
Поскольку имплантаты полового члена предрасположены к инфекциям, вызываемым теми же самыми бактериями, которые имеют место в связи с уретральными катетерами, то правила дозирования доксорубицина, митоксантрона, 5-фторурацила и этопозида при покрытии имплантатов полового члена аналогичны описанным выше для уретральных катетеров. Однако в отличие от композиций, описанных для уретральных катетеров, высвобождение лекарственного препарата будет иметь место в течение 2-24 недель.
H. Инфекции, связанные с эндотрахеальными и трахеостомическими трубками
Эндотрахеальные и трахеостомические трубки применяются для поддержания воздушных путей, когда требуется вентиляция. Эндотрахеальные трубки используются для обеспечения воздушных путей в реанимационных отделениях, в то время как трахеостомические трубки применяются при необходимости длительной вентиляции или когда имеется постоянная обструкция верхних дыхательных путей. У госпитализированных пациентов ежегодно нозокомиальная пневмония имеет место в 300000 случаев, и она представляет собой вторую наиболее распространенную приобретенную в больнице инфекцию (после инфекции мочевых путей) и наиболее частую инфекцию у пациентов в отделениях интенсивной терапии (ICU). В отделениях интенсивной терапии нозокомиальная пневмония является частой причиной смерти с показателем смертности, равным 50%. Выжившие пациенты проводят в больнице на 2 недели дольше, и ежегодная стоимость лечения близка к 2 биллионам долларов.
Бактериальная пневмония является наиболее частой причиной повышенной заболеваемости и смертности у пациентов, для которых необходима интубация. У менее чем 1% пациентов, которые были интубированы избирательно (т.е. для избирательной операции), развивается нозокомиальная пневмония. Однако у пациентов, страдающих ARDS (синдром нарушения дыхания у взрослых), имеется более чем 50% вероятность развития нозокомиальной пневмонии. Полагают, что новые микроорганизмы колонизируются в ротоглотке у интубированных пациентов, заглатываются с обсеменением желудка, аспирируются с заражением нижних дыхательных путей и в конечном итоге обсеменяют эндотрахеальную трубку. Бактерии прикрепляются к трубке, образуют биослой и служат в качестве источника бактерий, которые могут вдыхаться и переноситься далее в легкие. Хронические трахеостомические трубки также часто становятся колонизированными патогенными бактериями, о которых известно, что они вызывают пневмонию. Наиболее распространенными возбудителями пневмонии у пациентов с вентиляцией легких являются Staphylococcus aureus (17%), Pseudomonas aeruginosa (18%), Klebsiella pneumoniae (9%), Enterobacter (9%) и Haemophilus influenza (5%). Для лечения необходима эффективная терапия антибиотиками.
Покрытие эндотрахеальной трубки или трахеостомической трубки эффективным лекарственным препаратом может снижать частоту развития инфекции и предупреждать образование биопленки в трубке. Эффективное покрытие будет предупреждать или снижать частоту развития пневмонии, сепсиса и смертность. В предпочтительном варианте воплощения доксорубицин, митоксантрон, 5-фторурацил и/или этопозид включают в покрытие, наносимое на поверхность эндотрахеальной трубки или трахеостомической трубки. За счет активности против Klebsiella pneumonia для данного варианта воплощения можно также использовать метотрексат. Поскольку цисплатин и гидроксимочевина обладают некоторой активностью против Pseudomonas aeruginosa, их также можно применять в практике данного варианта воплощения. Лекарственный препарат(ы) можно наносить несколькими способами: а) в виде покрытия, нанесенного на внешнюю поверхность эндотрахеальной трубки или трахеостомической трубки; b) в виде покрытия, нанесенного на внутреннюю (просветную) поверхность эндотрахеальной трубки или трахеостомической трубки; с) в виде включения в полимеры, которые составляют эндотрахеальную трубку или трахеостомическую трубку.
Покрытие лекарственным препаратом или включение лекарственного препарата в эндотрахеальную трубку или трахеостомическую трубку позволит обеспечить концентрации бактерицидного препарата местно на поверхности катетера, тем самым снижая частоту колонизации бактерий (и последующего развития пневмонии и сепсиса), одновременно обеспечивая незначительное системное действие препаратов. Несмотря на то, что для некоторых средств не требуется полимерных носителей для прикрепления лекарственного препарата к поверхности эндотрахеальной трубки или трахеостомической трубки, некоторые полимерные носители особенно подходят для применения в данном варианте воплощения. Особый интерес представляют такие полимерные носители, как полиуретаны (например, ChronoFlex AL 85A [CT Biomaterials], HydroMed640 [CT Biomaterials], HYDROSLIP C [CT Biomaterials], HYDROSLIP C [CT Biomaterials], HYDROTHANE [CT Biomaterials], HYDROTHANE [CT Biomaterials]), акриловые и метакриловые сополимеры (например, поли(этилен-со-акриловая кислота), полимеры, производные целлюлозы (например, нитроцеллюлоза, ацетобутират целлюлозы, ацетопропионат целлюлозы), сополимеры акрилата и метакрилата (например, поли(этилен-со-винилацетат)), а также их смеси. [CT Biomaterials]), акриловые и метакриловые сополимеры (например, поли(этилен-со-акриловая кислота), полимеры, производные целлюлозы (например, нитроцеллюлоза, ацетобутират целлюлозы, ацетопропионат целлюлозы), сополимеры акрилата и метакрилата (например, поли(этилен-со-винилацетат)), а также их смеси.
Поскольку эндотрахеальные трубки или трахеостомические трубки изготавливают в самых различных конфигурациях и размерах, точное вводимое количество будет варьироваться в зависимости от размера, площади поверхности и конструкции устройства. Однако можно использовать определенные принципы при применении в данной области. Количество лекарственного препарата можно рассчитать как функцию количества на единицу площади (участка устройства, который подлежит покрытию), можно определить общее количество препарата для введения и соответствующие поверхностные концентрации активного препарата. Независимо от способа нанесения препарата на эндотрахеальную трубку или трахеостомическую трубку предпочтительные противоопухолевые препараты, используемые по отдельности или в комбинации, следует вводить, руководствуясь следующими правилами дозирования:
(а) Антрациклины. При использовании доксорубицина в качестве примера антрациклинов, в виде полимерного покрытия, включения в полимеры, из которых изготовлены компоненты эндотрахеальной трубки или трахеостомической трубки, или нанесенного без полимерного носителя, общее количество нанесенного доксорубицина не должно превышать 25 мг (в пределах от 0,1 мкг до 25 мг). В особо предпочтительном варианте воплощения общее количество нанесенного препарата должно находиться в пределах от 1 мкг до 5 мг. Доза на единицу площади устройства (т.е. количество препарата как функция площади поверхности участка эндотрахеальной трубки или трахеостомической трубки, на который наносят и/или в который включают лекарственный препарат) должна находиться в пределах 0,01 мкг-100 мкг на 1 мм2 площади поверхности. В особо предпочтительном варианте воплощения доксорубицин следует наносить на поверхность эндотрахеальной трубки или трахеостомической трубки в дозе в пределах 0,1-10 мкг/мм2. Поскольку различные полимерные и неполимерные оболочки будут высвобождать доксорубицин с различной скоростью, вышеуказанные параметры дозирования следует использовать с учетом скорости высвобождения лекарственного препарата с поверхности эндотрахеальной трубки или трахеостомической трубки так, чтобы на поверхности поддерживалась минимальная концентрация доксорубицина 10-7-10-4 М. Необходимо обеспечить гарантию того, чтобы концентрации лекарственного препарата на поверхности превышали концентрации доксорубицина, известные как летальные для многих видов бактерий и грибов (т.е. выше 10-4 М, хотя для некоторых вариантов воплощения требуются более низкие концентрации). В предпочтительном варианте воплощения доксорубицин высвобождается с поверхности эндотрахеальной трубки или трахеостомической трубки таким образом, что противоинфекционная активность сохраняется в течение периода времени от нескольких часов до нескольких месяцев. В особо предпочтительном варианте воплощения лекарственный препарат высвобождается в эффективных концентрациях из эндотрахеальной трубки в течение периода времени в пределах 1 часа-1 месяца, в то время как из трахеостомической трубки в пределах от 1 суток до 3 месяцев. Из представленного здесь обсуждения понятно, что аналоги и производные доксорубицина (описанные ранее) с аналогичной функциональной активностью можно использовать для целей настоящего изобретения; кроме того, указанные выше параметры дозирования можно скорректировать с учетом относительной активности аналога или производного по сравнению с исходным соединением (например, соединение, которое активнее доксорубицина в два раза, вводят в половинной части указанных параметров, в то время как соединение, наполовину менее активное чем доксорубицин, вводят в количестве, в два раза превышающем вышеуказанные параметры, и т.д.).
При использовании митоксантрона в качестве другого примера антрациклина в виде полимерного покрытия, включения в полимеры, из которых изготовлена эндотрахеальная трубка или трахеостомическая трубка, или нанесенного без полимера-носителя, общее количество нанесенного митоксантрона не должно превышать 5 мг (в пределах от 0,01 мкг до 5 мг). В особо предпочтительном варианте воплощения общее количество нанесенного препарата должно находиться в пределах от 0,1 мкг до 1 мг. Доза на единицу площади устройства (т.е. количество лекарственного препарата как функция площади поверхности участка эндотрахеальной трубки или трахеостомической трубки, на который наносят и/или в который включают лекарственный препарат) должна находиться в пределах 0,01 мкг-20 мкг на 1 мм2 площади поверхности. В особо предпочтительном варианте воплощения митоксантрон следует наносить на поверхность эндотрахеальной трубки или трахеостомической трубки в дозе в пределах 0,05-3 мкг/мм2. Поскольку различные полимерные и неполимерные оболочки будут высвобождать митоксантрон с различной скоростью, вышеуказанные параметры дозирования следует использовать с учетом скорости высвобождения лекарственного препарата с поверхности эндотрахеальной трубки или трахеостомической трубки так, чтобы поддерживалась минимальная концентрация митоксантрона 10-5-10-6 М. Необходимо обеспечить гарантию того, чтобы концентрации лекарственного препарата на поверхности превышали концентрации митоксантрона, известные как летальные для многих видов бактерий и грибов (т.е. выше 10-5 М, хотя для некоторых вариантов воплощения требуются более низкие концентрации). В предпочтительном варианте воплощения митоксантрон высвобождается с поверхности эндотрахеальной трубки или трахеостомической трубки таким образом, что противоинфекционная активность сохраняется в течение периода времени от нескольких часов до нескольких месяцев. В особо предпочтительном варианте воплощения лекарственный препарат высвобождается в эффективных концентрациях из эндотрахеальной трубки в течение периода времени в пределах 1 часа-1 месяца, в то время как из трахеостомической трубки в пределах 1 суток-3 месяцев. Из представленного здесь обсуждения понятно, что аналоги и производные митоксантрона (описанные ранее) с аналогичной функциональной активностью можно использовать для целей настоящего изобретения; кроме того, указанные выше параметры дозирования можно скорректировать с учетом относительной активности аналога или производного по сравнению с исходным соединением (например, соединение, которое активнее митоксантрона в два раза, вводят в половинной части указанных параметров, в то время как соединение, наполовину менее активное чем митоксантрон, вводят в количестве, в два раза превышающем вышеуказанные параметры, и т.д.).
(b) Фторпиримидины. При использовании 5-фторурацила в качестве примера фторпиримидина в виде полимерного покрытия, включения в полимеры, из которых изготовлена эндотрахеальная трубка или трахеостомическая трубка, или нанесенного без полимера-носителя, общее количество нанесенного 5-фторурацила не должно превышать 250 мг (в пределах от 1,0 мкг до 250 мг). В особо предпочтительном варианте воплощения общее количество нанесенного препарата должно находиться в пределах от 10 мкг до 25 мг. Доза на единицу площади устройства (т.е. количество лекарственного препарата как функция площади поверхности участка эндотрахеальной трубки или трахеостомической трубки, на который наносят и/или в который включают лекарственный препарат) должна находиться в пределах 0,1 мкг-1 мг на 1 мм2 площади поверхности. В особо предпочтительном варианте воплощения 5-форурацил следует наносить на поверхность эндотрахеальной трубки или трахеостомической трубки в дозе в пределах 1,0-50 мкг/мм2. Поскольку различные полимерные и неполимерные оболочки будут высвобождать 5-фторурацил с различной скоростью, вышеуказанные параметры дозирования следует использовать с учетом скорости высвобождения лекарственного препарата с поверхности эндотрахеальной трубки или трахеостомической трубки так, чтобы поддерживалась минимальная концентрация 5-фторурацила 10-4-10-7 М. Необходимо обеспечить гарантию того, чтобы концентрации лекарственного препарата на поверхности устройства превышали концентрации 5-фторурацила, известные как летальные для многих видов бактерий и грибов (т.е. выше 10-4 М, хотя для некоторых вариантов воплощения требуются более низкие концентрации). В предпочтительном варианте воплощения 5-фторурацил высвобождается с поверхности эндотрахеальной трубки или трахеостомической трубки таким образом, что противоинфекционная активность сохраняется в течение периода времени от нескольких часов до нескольких месяцев. В особо предпочтительном варианте воплощения лекарственный препарат высвобождается в эффективных концентрациях из эндотрахеальной трубки в течение периода времени в пределах 1 часа-1 месяца, в то время как из трахеостомической трубки в пределах 1 суток-3 месяцев. Из представленного здесь обсуждения понятно, что аналоги и производные 5-фторурацила (описанные ранее) с аналогичной функциональной активностью можно использовать для целей настоящего изобретения; кроме того, указанные выше параметры дозирования можно скорректировать с учетом относительной активности аналога или производного по сравнению с исходным соединением (например, соединение, которое активнее 5-форурацила в два раза, вводят в половинной части указанных параметров, в то время как соединение, наполовину менее активное чем 5-форурацил, вводят в количестве, в два раза превышающем вышеуказанные параметры, и т.д.).
(с) Подофилотоксины. При использовании этопозида в качестве примера подофилотоксина в виде полимерного покрытия, включения в полимеры, из которых изготавлена эндотрахеальная трубка или трахеостомическая трубка, или нанесенного без полимера-носителя, общее количество нанесенного этопозида не должно превышать 25 мг (в пределах от 0,1 мкг до 25 мг). В особо предпочтительном варианте воплощения общее количество нанесенного препарата должно находиться в пределах от 1 мкг до 5 мг. Доза на единицу площади устройства (т.е. количество лекарственного препарата как функция площади поверхности участка эндотрахеальной трубки или трахеостомической трубки, на который наносят и/или в который включают лекарственный препарат) должна находиться в пределах 0,01 мкг-100 мкг на 1 мм2 площади поверхности. В особо предпочтительном варианте воплощения этопозид следует наносить на поверхность эндотрахеальной трубки или трахеостомической трубки в дозе в пределах 0,1-10 мкг/мм2. Поскольку различные полимерные и неполимерные оболочки будут высвобождать этопозид с различной скоростью, вышеуказанные параметры дозирования следует использовать с учетом скорости высвобождения лекарственного препарата с поверхности эндотрахеальной трубки или трахеостомической трубки так, чтобы поддерживалась минимальная концентрация этопозида 10-5-10-6 М. Необходимо обеспечить гарантию того, чтобы концентрации лекарственного препарата на поверхности превышали концентрации этопозида, известные как летальные для многих видов бактерий и грибов (т.е. выше 10-5 М, хотя для некоторых вариантов воплощения требуются более низкие концентрации). В предпочтительном варианте воплощения этопозид высвобождается с поверхности эндотрахеальной трубки или трахеостомической трубки таким образом, что противоинфекционная активность сохраняется в течение периода времени от нескольких часов до нескольких месяцев. В особо предпочтительном варианте воплощения лекарственный препарат высвобождается в эффективных концентрациях из эндотрахеальной трубки в течение периода времени в пределах 1 часа-1 месяца, в то время как из трахеостомической трубки в пределах 1 суток-3 месяцев. Из представленного здесь обсуждения понятно, что аналоги и производные этопозида (описанные ранее) с аналогичной функциональной активностью можно использовать для целей настоящего изобретения; кроме того, указанные выше параметры дозирования можно скорректировать с учетом относительной активности аналога или производного по сравнению с исходным соединением (например, соединение, которое активнее этопозида в два раза, вводят в половинной части указанных параметров, в то время как соединение, наполовину менее активное чем этопозид, вводят в количестве, в два раза превышающем вышеуказанные параметры, и т.д.).
(d) Комбинированная терапия. Из представленного выше обсуждения понятно, что можно использовать комбинации антрациклинов (например, доксорубицина или митоксантрона), фторпиримидинов (например, 5-фторурацила), антагонистов фолиевой кислоты (например, метотрексата) и подофилотоксинов (например, этопозида) для повышения антибактериальной активности покрытия эндотрахеальной трубки или трахеостомической трубки. Аналогичным образом антрациклины (например, доксорубицин или митоксантрон), фторпиримидины (например, 5-фторурацил), антагонисты фолиевой кислоты (например, метотрексат) и/или подофилотоксины (например, этопозид) можно сочетать с обычными антибиотиками и/или противогрибковыми препаратами для усиления эффективности.
I. Инфекции, связанные с катетерами для диализа
В 1997 году в США насчитывалось 300000 пациентов с заболеванием почек в конечной стадии. Из них 63% подвергалось лечению гемодиализом, 9% подвергались перитонеальному диализу, и у 38% больных была проведена трансплантация почки. Для гемодиализа требуется надежный доступ в сосудистую систему, создаваемый, как правило, хирургически посредством артериовенозной фистулы (AVF; 18%), синтетического «мостикового» имплантата (обычно артериовенозный промежуточный имплантат PTFE на руке или ноге; 50%) или катетера для центральных вен (32%). Для проведения перитонеального диализа необходим постоянный обмен диализата через брюшину через двухманжетный и туннелизированный катетер для перитонеального диализа. Независимо от используемого вида диализа инфекция является второй основной причиной смерти у пациентов с почечной недостаточностью (15,5% всех смертельных случаев) после заболевания сердца. Значительное число данных инфекций является вторичным по отношению к самой процедуре диализа.
Имплантаты для доступа при диализе
У пациентов с почечной недостаточностью имеется нарушение иммунного ответа, что делает их особенно расположенными к инфекции. Инфекции, связанные с имплантатами для доступа при гемодиализе, характеризуются как либо ранние (в течение месяца; полагают, что они представляют собой осложнение после операции), либо поздние (через 1 месяц; полагают, что они связаны с уходом за местом для доступа). В течение 2-летнего периода примерно 2% AVF были инфицированными, в то время как имплантаты 11-16% PTFE становились инфицированными, по меньшей мере, случайно. Несмотря на то, что инфекция может развиваться в результате распространения инфекции со смежной инфицированной ткани или гематогенным путем, наиболее частой причиной инфекции является обсеменение во время операции. Наиболее распространенные возбудители инфекции включают Staphylococcus aureus, Enterobacteriaceae, Pseudomonas aeruginosa и отрицательные на коагулазу стафилококки.
Осложнения, возникающие в результате инфицирования имплантата для доступа при гемодиализе, включают сепсис, подкожную инфекцию, образование ложной аневризмы, эндокардит, остеомиелит, септический артрит, кровотечение, септическую или тромботическую эмболию, тромбоз имплантата и смерть в результате сепсиса (2-4% всех инфекций). Для лечения часто требуется удаление части или всего имплантата в сочетании с лечением системными антибиотиками.
В предпочтительном варианте воплощения доксорубицин, митоксантрон, 5-фторурацил и/или этопозид включают в покрытие, наносимое на поверхность компонентов синтетического имплантата для доступа при гемодиализе. Лекарственный препарат(ы) можно наносить несколькими способами: а) в виде покрытия, нанесенного на внешнюю поверхность имплантата; b) в виде покрытия, нанесенного на внутреннюю (просветную) поверхность имплантата, и/или с) в виде покрытия, нанесенного на все или части обеих поверхностей. Для AVF препарат должен включаться в хирургический имплантат, помещенный вокруг внешней стороны фистулы, во время операции.
Покрытие лекарственным препаратом или включение лекарственного препарата в имплантаты для доступа при гемодиализе позволит обеспечить концентрации бактерицидного препарата местно на поверхности имплантата, тем самым снижая частоту колонизации бактерий и последующего развития инфекционных осложнений, одновременно обеспечивая незначительное системное действие препаратов. Несмотря на то, что для некоторых средств не требуется полимерных носителей для прикрепления лекарственного препарата, некоторые полимерные носители особенно подходят для применения в данном варианте воплощения. Особый интерес представляют такие полимерные носители, как полиуретаны (например, ChronoFlex AL 85A [CT Biomaterials], HydroMed640 [CT Biomaterials], HYDROSLIP C [CT Biomaterials], HYDROSLIP C [CT Biomaterials], HYDROTHANE [CT Biomaterials], HYDROTHANE [CT Biomaterials]), акриловые и метакриловые сополимеры (например, поли(этилен-со-акриловая кислота), полимеры, производные целлюлозы (например, нитроцеллюлоза, ацетобутират целлюлозы, ацетопропионат целлюлозы), сополимеры акрилата и метакрилата (например, поли(этилен-со-винилацетат)), а также их смеси. [CT Biomaterials]), акриловые и метакриловые сополимеры (например, поли(этилен-со-акриловая кислота), полимеры, производные целлюлозы (например, нитроцеллюлоза, ацетобутират целлюлозы, ацетопропионат целлюлозы), сополимеры акрилата и метакрилата (например, поли(этилен-со-винилацетат)), а также их смеси.
Покрытие имплантата для доступа при гемодиализе эффективным препаратом снизит частоту развития осложнений, таких как сепсис, кровотечение, тромбоз, эмболия, эндокардит, остеомиелит и даже смерть. Эффективное покрытие также будет уменьшать число имплантатов для доступа при гемодиализе, нуждающихся в замене, приводя к пониженной смертности и заболеваемости пациентов с данными имплантатами.
Поскольку имплантаты для доступа при гемодиализе изготавливают в самых различных конфигурациях и размерах, точное вводимое количество будет варьироваться в зависимости от размера, площади поверхности, конструкции устройства и частей покрываемого имплантата. Однако можно использовать определенные принципы при применении в данной области. Количество лекарственного препарата можно рассчитать, как функцию количества на единицу площади (участка устройства, который подлежит покрытию), можно определить общее количество препарата для введения и соответствующие поверхностные концентрации активного препарата. Независимо от способа нанесения препарата на имплантат для доступа при гемодиализе предпочтительные противоопухолевые препараты, используемые по отдельности или в комбинации, следует вводить, руководствуясь следующими правилами дозирования:
(а) Антрациклины. При использовании доксорубицина в качестве примера антрациклинов, в виде полимерного покрытия, включения в полимеры, из которых изготовлены компоненты имплантата для доступа при гемодиализе (такие, как дакрон или тефлон) или нанесенного без полимерного носителя, общее количество нанесенного доксорубицина не должно превышать 25 мг (в пределах от 0,1 мкг до 25 мг). В особо предпочтительном варианте воплощения общее количество нанесенного препарата должно находиться в пределах от 1 мкг до 5 мг. Доза на единицу площади устройства (т.е. количество препарата как функция площади поверхности участка имплантата для доступа при гемодиализе, на который наносится и/или в который включается лекарственный препарат) должна находиться в пределах 0,01 мкг-100 мкг на 1 мм2 площади поверхности. В особо предпочтительном варианте воплощения доксорубицин следует наносить на поверхность имплантата для доступа при гемодиализе в дозе в пределах 0,1-10 мкг/мм2. Поскольку различные полимерные и неполимерные оболочки будут высвобождать доксорубицин с различной скоростью, вышеуказанные параметры дозирования следует использовать с учетом скорости высвобождения лекарственного препарата с поверхности имплантата для доступа при гемодиализе так, чтобы на поверхности поддерживалась минимальная концентрация доксорубицина 10-7-10-4 М. Необходимо обеспечить гарантию того, чтобы концентрации лекарственного препарата на поверхности превышали концентрации доксорубицина, известные как летальные для многих видов бактерий и грибов (т.е. выше 10-4 М, хотя для некоторых вариантов воплощения требуются более низкие концентрации). В предпочтительном варианте воплощения доксорубицин высвобождается с поверхности имплантата для доступа при гемодиализе таким образом, что противоинфекционная активность сохраняется в течение периода времени от нескольких часов до нескольких месяцев. В особо предпочтительном варианте воплощения лекарственный препарат высвобождается в эффективных концентрациях в течение периода времени в пределах 1 недели-6 месяцев. Из представленного здесь обсуждения понятно, что аналоги и производные доксорубицина (описанные ранее) с аналогичной функциональной активностью можно использовать для целей настоящего изобретения; кроме того, указанные выше параметры дозирования можно скорректировать с учетом относительной активности аналога или производного по сравнению с исходным соединением (например, соединение, которое активнее доксорубицина в два раза, вводят в половинной части указанных параметров, в то время как соединение, наполовину менее активное чем доксорубицин, вводят в количестве, в два раза превышающем вышеуказанные параметры, и т.д.).
При использовании митоксантрона в качестве другого примера антрациклина в виде полимерного покрытия, включения в полимеры, из которых изготовлен имплантат для доступа при гемодиализе (такие, как дакрон или тефлон), или нанесенного без полимера-носителя, общее количество нанесенного митоксантрона не должно превышать 5 мг (в пределах от 0,01 мкг до 5 мг). В особо предпочтительном варианте воплощения общее количество нанесенного препарата должно находиться в пределах от 0,1 мкг до 1 мг. Доза на единицу площади устройства (т.е. количество лекарственного препарата как функция площади поверхности участка имплантата для доступа при гемодиализе, на который наносят и/или в который включают лекарственный препарат) должна находиться в пределах 0,01 мкг-20 мкг на 1 мм2 площади поверхности. В особо предпочтительном варианте воплощения митоксантрон следует наносить на поверхность имплантата для доступа при гемодиализе в дозе в пределах 0,05-3 мкг/мм2. Поскольку различные полимерные и неполимерные оболочки будут высвобождать митоксантрон с различной скоростью, вышеуказанные параметры дозирования следует использовать с учетом скорости высвобождения лекарственного препарата с поверхности имплантата для доступа при гемодиализе так, чтобы поддерживалась минимальная концентрация митоксантрона 10-5-10-6 М. Необходимо обеспечить гарантию того, чтобы концентрации лекарственного препарата на поверхности превышали концентрации митоксантрона, известные как летальные для многих видов бактерий и грибов (т.е. выше 10-5 М, хотя для некоторых вариантов воплощения требуются более низкие концентрации). В предпочтительном варианте воплощения митоксантрон высвобождается с поверхности имплантата для доступа при гемодиализе таким образом, что противоинфекционная активность сохраняется в течение периода времени от нескольких часов до нескольких месяцев. В особо предпочтительном варианте воплощения лекарственный препарат высвобождается в эффективных концентрациях в течение периода времени в пределах 1 недели - 6 месяцев. Из представленного здесь обсуждения понятно, что аналоги и производные митоксантрона (описанные ранее) с аналогичной функциональной активностью можно использовать для целей настоящего изобретения; кроме того, указанные выше параметры дозирования можно скорректировать с учетом относительной активности аналога или производного по сравнению с исходным соединением (например, соединение, которое активнее митоксантрона в два раза, вводят в половинной части указанных параметров, в то время как соединение, наполовину менее активное чем митоксантрон, вводят в количестве,
в два раза превышающем вышеуказанные параметры, и т.д.).
(b) Фторпиримидины. При использовании 5-фторурацила в качестве примера фторпиримидина в виде полимерного покрытия, включения в полимеры, из которых изготовлен имплантат для доступа при гемодиализе (такие, как дакрон или тефлон), или нанесенного без полимера-носителя, общее количество нанесенного 5-фторурацила не должно превышать 250 мг (в пределах от 1,0 мкг до 250 мг). В особо предпочтительном варианте воплощения общее количество нанесенного препарата должно находиться в пределах от 10 мкг до 25 мг. Доза на единицу площади устройства (т.е. количество лекарственного препарата как функция площади поверхности участка имплантата для доступа при гемодиализе, на который наносят и/или в который включают лекарственный препарат) должна находиться в пределах 0,1 мкг-1 мг на 1 мм2 площади поверхности. В особо предпочтительном варианте воплощения 5-форурацил следует наносить на поверхность имплантата для доступа при гемодиализе в дозе в пределах 1,0-50 мкг/мм2. Поскольку различные полимерные и неполимерные оболочки будут высвобождать 5-фторурацил с различной скоростью, вышеуказанные параметры дозирования следует использовать с учетом скорости высвобождения лекарственного препарата с поверхности имплантата для доступа при гемодиализе так, чтобы поддерживалась минимальная концентрация 5-фторурацила 10-4-10-7 М. Необходимо обеспечить гарантию того, чтобы концентрации лекарственного препарата на поверхности превышали концентрации 5-фторурацила, известные как летальные для многих видов бактерий и грибов (т.е. выше 10-4 М, хотя для некоторых вариантов воплощения требуются более низкие концентрации). В предпочтительном варианте воплощения 5-фторурацил высвобождается с поверхности имплантата для доступа при гемодиализе таким образом, что противоинфекционная активность сохраняется в течение периода времени от нескольких часов до нескольких месяцев. В особо предпочтительном варианте воплощения лекарственный препарат высвобождается в эффективных концентрациях в течение периода времени в пределах 1 недели - 6 месяцев. Из представленного здесь обсуждения понятно, что аналоги и производные 5-форурацила (описанные ранее) с аналогичной функциональной активностью можно использовать для целей настоящего изобретения; кроме того, указанные выше параметры дозирования можно скорректировать с учетом относительной активности аналога или производного по сравнению с исходным соединением (например, соединение, которое активнее 5-фторурацила в два раза, вводят в половинной части указанных параметров, в то время как соединение, наполовину менее активное чем 5-фторурацил, вводят в количестве, в два раза превышающем вышеуказанные параметры, и т.д.).
(с) Подофилотоксины. При использовании этопозида в качестве примера подофилотоксина в виде полимерного покрытия, включения в полимеры, из которых изготовлен имплантат для доступа при гемодиализе (такие, как дакрон или тефлон), или нанесенного без полимера-носителя, общее количество нанесенного этопозида не должно превышать 25 мг (в пределах от 0,1 мкг до 25 мг). В особо предпочтительном варианте воплощения общее количество нанесенного препарата должно находиться в пределах от 1 мкг до 5 мг. Доза на единицу площади устройства (т.е. количество лекарственного препарата как функция площади поверхности участка имплантата для доступа при гемодиализе, на который наносят и/или в который включают лекарственный препарат) должна находиться в пределах 0,01 мкг-100 мкг на 1 мм2 площади поверхности. В особо предпочтительном варианте воплощения этопозид следует наносить на поверхность имплантата для доступа при гемодиализе в дозе в пределах 0,1-10 мкг/мм2. Поскольку различные полимерные и неполимерные оболочки будут высвобождать этопозид с различной скоростью, вышеуказанные параметры дозирования следует использовать с учетом скорости высвобождения лекарственного препарата с поверхности имплантата для доступа при гемодиализе так, чтобы поддерживалась минимальная концентрация этопозида 10-5-10-6 М. Необходимо обеспечить гарантию того, чтобы концентрации лекарственного препарата на поверхности превышали концентрации этопозида, известные как летальные для многих видов бактерий и грибов (т.е. выше 10-5 М, хотя для некоторых вариантов воплощения требуются более низкие концентрации). В предпочтительном варианте воплощения этопозид высвобождается с поверхности имплантата для доступа при гемодиализе таким образом, что противоинфекционная активность сохраняется в течение периода времени от нескольких часов до нескольких месяцев. В особо предпочтительном варианте воплощения лекарственный препарат высвобождается в эффективных концентрациях в течение периода времени в пределах 1 недели - 6 месяцев. Из представленного здесь обсуждения понятно, что аналоги и производные этопозида (описанные ранее) с аналогичной функциональной активностью можно использовать для целей настоящего изобретения; кроме того, указанные выше параметры дозирования можно скорректировать с учетом относительной активности аналога или производного по сравнению с исходным соединением (например, соединение, которое активнее этопозида в два раза, вводят в половинной части указанных параметров, в то время как соединение, наполовину менее активное чем этопозид, вводят в количестве, в два раза превышающем вышеуказанные параметры, и т.д.).
(d) Комбинированная терапия. Из представленного выше обсуждения понятно, что можно использовать комбинации антрациклинов (например, доксорубицина или митоксантрона), фторпиримидинов (например, 5-фторурацила), антагонистов фолиевой кислоты (например, метотрексата) и подофилотоксинов (например, этопозида) для повышения антибактериальной активности покрытия имплантата для доступа при гемодиализе. Аналогичным образом антрациклины (например, доксорубицин или митоксантрон), фторпиримидины (например, 5-фторурацил), антагонисты фолиевой кислоты (например, метотрексат) и/или подофилотоксины (например, этопозид) можно сочетать с обычными антибиотиками и/или противогрибковыми препаратами для усиления эффективности. Поскольку способность к тромбообразованию у имплантата для доступа при гемодиализе связана с повышенным риском возникновения инфекции антрациклины (например, доксорубицин или митоксантрон), фторпиримидины (например, 5-фторурацил), антагонисты фолиевой кислоты (например, метотрексат) и/или подофилотоксины (например, этопозид) можно сочетать со средствами против тромбообразования и/или противотромбоцитарными средствами (например, гепарином, декстраном сульфатом, данапароидом, лепирудином, гирудином, АМФ, аденозином, 2-хораденозином, аспирином, фенилбутазоном, индометацином, меклофенаматом, гидрохлорохином, дипиридамолом, илопростом, тиклопидином, клопидогрелом, абциксамабом, эптифибатидом, тирофибаном, стрептокиназой и/или активатором тканевого плазминогена) для усиления эффективности.
Катетеры для центральных вен
Самые разнообразные катетеры для центральных вен являются промышленно доступными для применения во время гемодиализа, включая, но не ограничиваясь только ими, катетеры, которые имплантируют полностью такие, как Lifesite (Vasca Inc., Tewksbury, Mass) и Dialock (Biolink Corp., Middleboro, Mass.). Катетеры для центральных вен расположены к инфицированию, и выше описаны варианты воплощения для данной цели.
Катетеры для перитонеального диализа
Катетеры для перитонеального диализа, как правило, представляют собой двухманжетные и туннелизированные катетеры, которые обеспечивают доступ к брюшине. Наиболее распространенные конструкции катетеров для перитонеального диализа включают катетер Tenckhoff, катетер Swan Neck Missouri и катетер Toronto Western. При перитонеальном диализе брюшина функционирует в качестве полупроницаемой мембраны, через которую может происходить обмен растворенных веществ в направлении градиента концентрации.
Как правило, инфекции при перитонеальном диализе подразделяются на перитонит и входные/«туннельные» инфекции (т.е. инфекции, связанные с катетером). Входные/«туннельные» инфекции характеризуются покраснением, индурацией и гнойными истечениями из места входа или подкожных участков катетера. Перитонит является более тяжелой инфекций, которая вызывает боль в брюшной полости, тошноту, лихорадку и системные признаки инфекции. К сожалению, вероятно, катетер для перитонеального диализа играет роль в развитии обоих типов инфекций. При входной/«туннельной» инфекции катетер сам становится инфицированным. При перитоните возбудителем инфекции часто являются бактерии, проходящие с кожи через просвет катетера, или мигрирующие по внешней поверхности (перикатетерный путь) катетера в брюшину. Возбудителями инфекций, связанных с перитонеальным катетером, как правило, являются Staphylococcus aureus, отрицательные на коагулазу стафилококки, Escherichia coli, Viridans group streptococci, Enterobacteriacae, Corynebacterium, Branhamella, Acrinobacter, Serratia, Proteus, Pseudomonas aeruginosa и грибы.
Лечение перитонита включает быстрый обмен диализата внутрь-наружу, курс системными антибиотиками (при внутривенном и/или внутрибрюшинном введении), и часто требуется удаление катетера. Осложнения включают госпитализацию, необходимость проведения диализа другого вида (30%) и смерть (2%; показатель выше, если возбудителями инфекции являются энтерококки, S. aureus, или имеется полимикробная этиология).
В предпочтительном варианте воплощения доксорубицин, митоксантрон, 5-фторурацил и/или этопозид включают в покрытие, наносимое на поверхность компонентов синтетического имплантата для перитонеального диализа. Лекарственный препарат(ы) можно наносить несколькими способами: а) в виде покрытия, нанесенного на внешнюю поверхность имплантата; b) в виде покрытия, нанесенного на внутреннюю (просветную) поверхность имплантата; с) в виде покрытия, нанесенного на поверхностную «манжету»; d) в виде покрытия, нанесенного на глубокую «манжету»; е) в виде включения в полимеры, которые входят в состав имплантата, и/или f) в виде покрытия, нанесенного на сочетание данных поверхностей.
Покрытие лекарственным препаратом или включение лекарственного препарата в имплантаты для перитонеального диализа позволит обеспечить концентрации бактерицидного препарата местно на поверхности имплантата, тем самым снижая частоту колонизации бактерий и последующего развития инфекционных осложнений, одновременно обеспечивая незначительное системное действие препаратов. Несмотря на то, что для некоторых средств не требуется полимерных носителей для прикрепления лекарственного препарата, некоторые полимерные носители особенно подходят для применения в данном варианте воплощения. Особый интерес представляют такие полимерные носители, как полиуретаны (например, ChronoFlex AL 85A [CT Biomaterials], HydroMed640 [CT Biomaterials], HYDROSLIP C [CT Biomaterials], HYDROSLIP C [CT Biomaterials], HYDROTHANE [CT Biomaterials], HYDROTHANE [CT Biomaterials]), акриловые и метакриловые сополимеры (например, поли(этилен-со-акриловая кислота), полимеры, производные целлюлозы (например, нитроцеллюлоза, ацетобутират целлюлозы, ацетопропионат целлюлозы), сополимеры акрилата и метакрилата (например, поли(этилен-со-винилацетат)), а также их смеси. [CT Biomaterials]), акриловые и метакриловые сополимеры (например, поли(этилен-со-акриловая кислота), полимеры, производные целлюлозы (например, нитроцеллюлоза, ацетобутират целлюлозы, ацетопропионат целлюлозы), сополимеры акрилата и метакрилата (например, поли(этилен-со-винилацетат)), а также их смеси.
Покрытие имплантата для перитонеального диализа эффективным препаратом будет снижать частоту осложнений, таких как госпитализация, перитонит, сепсис и даже смерть. Эффективное покрытие будет также уменьшать число имплантатов для перитонеального диализа, требующих замены, приводя к более низкой смертности и заболеваемости пациентов с данными имплантатами.
Поскольку имплантаты для перитонеального диализа изготавливают в самых различных конфигурациях и размерах, точное вводимое количество будет варьироваться в зависимости от размера, площади поверхности, конструкции устройства и участков покрываемого имплантата. Однако можно использовать определенные принципы при применении в данной области. Количество лекарственного препарата можно рассчитать, как функцию количества на единицу площади (участка устройства, который подлежит покрытию), можно определить общее количество препарата для введения и соответствующие поверхностные концентрации активного препарата. Независимо от способа нанесения препарата на имплантат для перитонеального диализа предпочтительные противоопухолевые препараты, используемые по отдельности или в комбинации, следует вводить, руководствуясь следующими правилами дозирования:
(а) Антрациклины. При использовании доксорубицина в качестве примера антрациклинов, в виде полимерного покрытия, включения в полимеры, из которых изготовлены компоненты имплантата для перитонеального диализа (такие, как дакрон или тефлон), или нанесенного без полимерного носителя, общее количество нанесенного доксорубицина не должно превышать 25 мг (в пределах от 0,1 мкг до 25 мг). В особо предпочтительном варианте воплощения общее количество нанесенного препарата должно находиться в пределах от 1 мкг до 5 мг. Доза на единицу площади устройства (т.е. количество препарата, как функция площади поверхности участка имплантата для перитонеального диализа, на который наносится и/или в который включается лекарственный препарат) должна находиться в пределах 0,01 мкг-100 мкг на 1 мм2 площади поверхности. В особо предпочтительном варианте воплощения доксорубицин следует наносить на поверхность имплантата для перитонеального диализа в дозе в пределах 0,1-10 мкг/мм2. Поскольку различные полимерные и неполимерные оболочки будут высвобождать доксорубицин с различной скоростью, вышеуказанные параметры дозирования следует использовать с учетом скорости высвобождения лекарственного препарата с поверхности имплантата для перитонеального диализа так, чтобы на поверхности поддерживалась минимальная концентрация доксорубицина 10-7-10-4 М. Необходимо обеспечить гарантию того, чтобы концентрации лекарственного препарата на поверхности превышали концентрации доксорубицина, известные как летальные для многих видов бактерий и грибов (т.е. выше 10-4 М, хотя для некоторых вариантов воплощения требуются более низкие концентрации). В предпочтительном варианте воплощения доксорубицин высвобождается с поверхности имплантата для перитонеального диализа таким образом, что противоинфекционная активность сохраняется в течение периода времени от нескольких часов до нескольких месяцев. В особо предпочтительном варианте воплощения лекарственный препарат высвобождается в эффективных концентрациях в течение периода времени в пределах 1 недели-6 месяцев. Из представленного здесь обсуждения понятно, что аналоги и производные доксорубицина (описанные ранее) с аналогичной функциональной активностью можно использовать для целей настоящего изобретения; кроме того, указанные выше параметры дозирования можно скорректировать с учетом относительной активности аналога или производного по сравнению с исходным соединением (например, соединение, которое активнее доксорубицина в два раза, вводят в половинной части указанных параметров, в то время как соединение, наполовину менее активное чем доксорубицин, вводят в количестве, в два раза превышающем вышеуказанные параметры, и т.д.).
При использовании митоксантрона в качестве другого примера антрациклина в виде полимерного покрытия, включения в полимеры, из которых изготовлен имплантат для перитонеального диализа (такие, как дакрон или тефлон), или нанесенного без полимера-носителя, общее количество нанесенного митоксантрона не должно превышать 5 мг (в пределах от 0,01 мкг до 5 мг). В особо предпочтительном варианте воплощения общее количество нанесенного препарата должно находиться в пределах от 0,1 мкг до 1 мг. Доза на единицу площади устройства (т.е. количество лекарственного препарата, как функция площади поверхности участка имплантата для перитонеального диализа, на который наносят и/или в который включают лекарственный препарат) должна находиться в пределах 0,01 мкг-20 мкг на 1 мм2 площади поверхности. В особо предпочтительном варианте воплощения митоксантрон следует наносить на поверхность имплантата для перитонеального диализа в дозе в пределах 0,05-3 мкг/мм2. Поскольку различные полимерные и неполимерные оболочки будут высвобождать митоксантрон с различной скоростью, вышеуказанные параметры дозирования следует использовать с учетом скорости высвобождения лекарственного препарата с поверхности имплантата для перитонеального диализа так, чтобы поддерживалась минимальная концентрация митоксантрона 10-5-10-6 М. Необходимо обеспечить гарантию того, чтобы концентрации лекарственного препарата на поверхности превышали концентрации митоксантрона, известные как летальные для многих видов бактерий и грибов (т.е. выше 10-5 М, хотя для некоторых вариантов воплощения требуются более низкие концентрации). В предпочтительном варианте воплощения митоксантрон высвобождается с поверхности имплантата для перитонеального диализа таким образом, что противоинфекционная активность сохраняется в течение периода времени от нескольких часов до нескольких месяцев. В особо предпочтительном варианте воплощения лекарственный препарат высвобождается в эффективных концентрациях в течение периода времени в пределах 1 недели - 6 месяцев. Из представленного здесь обсуждения понятно, что аналоги и производные митоксантрона (описанные ранее) с аналогичной функциональной активностью можно использовать для целей настоящего изобретения; кроме того, указанные выше параметры дозирования можно скорректировать с учетом относительной активности аналога или производного по сравнению с исходным соединением (например, соединение, которое активнее митоксантрона в два раза, вводят в половинной части указанных параметров, в то время как соединение, наполовину менее активное чем митоксантрон, вводят в количестве, в два раза превышающем вышеуказанные параметры, и т.д.).
(b) Фторпиримидины. При использовании 5-фторурацила в качестве примера фторпиримидина в виде полимерного покрытия, включения в полимеры, из которых изготовлен имплантат для перитонеального диализа (такие, как дакрон или тефлон), или нанесенного без полимера-носителя, общее количество нанесенного 5-фторурацила не должно превышать 250 мг (в пределах от 1,0 мкг до 250 мг). В особо предпочтительном варианте воплощения общее количество нанесенного препарата должно находиться в пределах от 10 мкг до 25 мг. Доза на единицу площади устройства (т.е. количество лекарственного препарата как функция площади поверхности участка имплантата для перитонеального диализа, на который наносят и/или в который включают лекарственный препарат) должна находиться в пределах 0,1 мкг-1 мг на мм2 площади поверхности. В особо предпочтительном варианте воплощения 5-форурацил следует наносить на поверхность имплантата для перитонеального диализа в дозе в пределах 1,0-50 мкг/мм2. Поскольку различные полимерные и неполимерные оболочки будут высвобождать 5-фторурацил с различной скоростью, вышеуказанные параметры дозирования следует использовать с учетом скорости высвобождения лекарственного препарата с поверхности имплантата для перитонеального диализа так, чтобы поддерживалась минимальная концентрация 5-фторурацила 10-4-10-7 М. Необходимо обеспечить гарантию того, чтобы концентрации лекарственного препарата на поверхности превышали концентрации 5-фторурацила, известные как летальные для многих видов бактерий и грибов (т.е. выше 10-4 М, хотя для некоторых вариантов воплощения требуются более низкие концентрации). В предпочтительном варианте воплощения 5-фторурацил высвобождается с поверхности имплантата для перитонеального диализа таким образом, что противоинфекционная активность сохраняется в течение периода времени от нескольких часов до нескольких месяцев. В особо предпочтительном варианте воплощения лекарственный препарат высвобождается в эффективных концентрациях в течение периода времени в пределах 1 недели - 6 месяцев. Из представленного здесь обсуждения понятно, что аналоги и производные 5-форурацила (описанные ранее) с аналогичной функциональной активностью можно использовать для целей настоящего изобретения; кроме того, указанные выше параметры дозирования можно скорректировать с учетом относительной активности аналога или производного по сравнению с исходным соединением (например, соединение, которое активнее 5-фторурацила в два раза, вводят в половинной части указанных параметров, в то время как соединение, наполовину менее активное чем 5-фторурацил, вводят в количестве, в два раза превышающем вышеуказанные параметры, и т.д.).
(с) Подофилотоксины. При использовании этопозида в качестве примера подофилотоксина в виде полимерного покрытия, включения в полимеры, из которых изготовлен имплантат для перитонеального диализа (такие, как дакрон или тефлон), или нанесенного без полимера-носителя, общее количество нанесенного этопозида не должно превышать 25 мг (в пределах от 0,1 мкг до 25 мг). В особо предпочтительном варианте воплощения общее количество нанесенного препарата должно находиться в пределах от 1 мкг до 5 мг. Доза на единицу площади устройства (т.е. количество лекарственного препарата как функция площади поверхности участка имплантата для перитонеального диализа, на который наносят и/или в который включают лекарственный препарат) должна находиться в пределах 0,01 мкг-100 мкг на мм2 площади поверхности. В особо предпочтительном варианте воплощения этопозид следует наносить на поверхность имплантата для перитонеального диализа в дозе в пределах 0,1-10 мкг/мм2. Поскольку различные полимерные и неполимерные оболочки будут высвобождать этопозид с различной скоростью, вышеуказанные параметры дозирования следует использовать с учетом скорости высвобождения лекарственного препарата с поверхности имплантата для перитонеального диализа так, чтобы поддерживалась минимальная концентрация этопозида 10-5-10-6 М. Необходимо обеспечить гарантию того, чтобы концентрации лекарственного препарата на поверхности превышали концентрации этопозида, известные как летальные для многих видов бактерий и грибов (т.е. выше 10-5 М, хотя для некоторых вариантов воплощения требуются более низкие концентрации). В предпочтительном варианте воплощения этопозид высвобождается с поверхности имплантата для перитонеального диализа таким образом, что противоинфекционная активность сохраняется в течение периода времени от нескольких часов до нескольких месяцев. В особо предпочтительном варианте воплощения лекарственный препарат высвобождается в эффективных концентрациях в течение периода времени в пределах 1 недели - 6 месяцев. Из представленного здесь обсуждения понятно, что аналоги и производные этопозида (описанные ранее) с аналогичной функциональной активностью можно использовать для целей настоящего изобретения; кроме того, указанные выше параметры дозирования можно скорректировать с учетом относительной активности аналога или производного по сравнению с исходным соединением (например, соединение, которое активнее этопозида в два раза, вводят в половинной части указанных параметров, в то время как соединение, наполовину менее активное чем этопозид, вводят в количестве, в два раза превышающем вышеуказанные параметры, и т.д.).
(d) Комбинированная терапия. Из представленного выше обсуждения понятно, что можно использовать комбинации антрациклинов (например, доксорубицина или митоксантрона), фторпиримидинов (например, 5-фторурацила), антагонистов фолиевой кислоты (например, метотрексата) и подофилотоксинов (например, этопозида) для повышения антибактериальной активности покрытия имплантата для перитонеального диализа. Аналогичным образом антрациклины (например, доксорубицин или митоксантрон), фторпиримидины (например, 5-фторурацил), антагонисты фолиевой кислоты (например, метотрексат) и/или подофилотоксины (например, этопозид) можно сочетать с обычными антибиотиками и/или противогрибковыми препаратами для усиления эффективности.
J. Инфекции, вызванные шунтами для центральной нервной системы (ЦНС)
Гидроцефалия или скопление спинномозговой жидкости (CSF) в мозге является распространенным нейрохирургическим заболеванием, возникающим в результате врожденных аномалий развития, инфекции, кровотечения или злокачественной опухоли. Несжимаемая жидкость оказывает давление на мозг, приводя к повреждению мозга и даже смерти при отсутствии лечения. Шунты для ЦНС представляют собой трубки, размещаемые в желудочках мозга для отведения потока CSF из мозга в другие отделы организма и снижения давления жидкости. Вентрикулярную CSF направляют через искусственный шунт в ряд мест для дренирования, включая плевру (вентрикулоплевральный шунт), яремную вену, полую вену (VA-шунт), желчный пузырь и брюшину (VP-шунт; наиболее распространенный).
К сожалению, шунты для CSF относительно предрасположены к инфицированию, хотя частота случаев развития упала с 25% двадцать лет тому назад до 10% в настоящее время в результате совершенствования техники операции. Примерно 25% всех осложнений с шунтами возникают за счет инфицирования шунта, и это может привести к серьезным клиническим проблемам, таким как вентрикулит, компартментализация желудочков, менингит, субдуральная эмпиема, нефрит (при VA-шунтах), эпилептические припадки, истончение кортикального покрывающего слоя, отставание в умственном развитии или смерть. Для большинства инфекций характерны лихорадка, тошнота, рвота, дисфория и признаки повышенного внутричерепного давления, такие как головная боль или измененное сознание. Наиболее распространенными возбудителями инфекций, связанных с шунтами ЦНС, являются отрицательные на коагулазу стафилококки (67%; Staphylococcus epidermidis представляет наиболее часто выделяемый микроорганизм), Staphylococcus aureus (10-20%), viridans streptococci, Staphylococcus pyogenes, Enterococcus, Corynebacterium, Escherichia coli, Klebsiella, Proteus и Pseudomonas aeruginosa. Полагают, что большая часть инфекций возникает в результате обсеменения микроорганизмами во время операции или во время функционирования шунта в послеоперационном периоде. В результате большая часть инфекций проявляется в клинической форме в первые несколько недель после операции.
Поскольку многие инфекции вызываются S. epidermidis, зачастую обнаруживается, что катетер покрывается продуцированной бактериями «слизью», которая защищает микроорганизм от воздействия иммунной системы и делает трудной ликвидацию очагов инфекции. Следовательно, для лечения инфекций в большинстве случаев требуется удаление шунта (и часто замена на временный внешний вентрикулярный шунт для ослабления гидроцефалии) в дополнении к (системному и/или внутрижелудочковому) лечению антибиотиками. При сохранении шунта на месте во время лечения результативность терапии низкая. Лечение антибиотиками осложняется тем, что многие антибиотики не проникают эффективно через гемато-энцефалический барьер.
Покрытие шунта для ЦНС эффективным препаратом будет снижать частоту развития осложнений, таких как вентрикулит, компартментализация желудочков, менингит, субдуральная эмпиема, нефрит (при VA-шунтах), эпилептические припадки, истончение покрывающего кортикального слоя, отставание в умственном развитии или смерть. Эффективное покрытие будет уменьшать число шунтов для ЦНС, требующих замены, приводя к пониженной смертности и заболеваемости у пациентов с данными имплантатами.
В предпочтительном варианте воплощения антрациклин (например, доксорубицин или митоксантрон), фторпиримидин (например, 5-FU), антагонист фолиевой кислоты (например, метотрексат) и/или подофилотоксин (например, этопозид) включают в покрытие, наносимое на поверхность компонентов шунта для ЦНС. Лекарственный препарат(ы) можно наносить несколькими способами: а) в виде покрытия, нанесенного на внешнюю поверхность шунта; b) в виде покрытия, нанесенного на внутреннюю (просветную) поверхность шунта и/или с) в виде покрытия, нанесенного на все или части обеих поверхностей.
Покрытие лекарственным препаратом или включение лекарственного препарата в шунты для ЦНС позволит обеспечить концентрации бактерицидного препарата местно на поверхности шунта, тем самым снижая частоту колонизации бактерий и последующего развития инфекционных осложнений, одновременно обеспечивая незначительное системное действие препаратов. Несмотря на то, что для некоторых средств не требуется полимерных носителей для прикрепления лекарственного препарата, некоторые полимерные носители особенно подходят для применения в данном варианте воплощения. Особый интерес представляют такие полимерные носители, как полиуретаны (например, ChronoFlex AL 85A [CT Biomaterials], HydroMed640 [CT Biomaterials], HYDROSLIP C [CT Biomaterials], HYDROSLIP C [CT Biomaterials], HYDROTHANE [CT Biomaterials], HYDROTHANE [CT Biomaterials]), акриловые и метакриловые сополимеры (например, поли(этилен-со-акриловая кислота), полимеры, производные целлюлозы (например, нитроцеллюлоза, ацетобутират целлюлозы, ацетопропионат целлюлозы), сополимеры акрилата и метакрилата (например, поли(этилен-со-винилацетат)), а также их смеси. [CT Biomaterials]), акриловые и метакриловые сополимеры (например, поли(этилен-со-акриловая кислота), полимеры, производные целлюлозы (например, нитроцеллюлоза, ацетобутират целлюлозы, ацетопропионат целлюлозы), сополимеры акрилата и метакрилата (например, поли(этилен-со-винилацетат)), а также их смеси.
Поскольку шунты для ЦНС изготавливают в самых различных конфигурациях и размерах, точное вводимое количество будет варьироваться в зависимости от размера, площади поверхности, конструкции устройства и участков покрываемого шунта. Однако можно использовать определенные принципы при применении в данной области. Количество лекарственного препарата можно рассчитать как функцию количества на единицу площади (участка устройства, который подлежит покрытию), можно определить общее количество препарата для введения и соответствующие поверхностные концентрации активного препарата. Независимо от способа нанесения препарата на шунт для ЦНС предпочтительные противоопухолевые препараты, используемые по отдельности или в комбинации, следует вводить, руководствуясь следующими правилами дозирования:
(а) Антрациклины. При использовании доксорубицина в качестве примера антрациклинов, в виде полимерного покрытия, включения в полимеры, из которых изготовлены компоненты шунта для ЦНС (такие, как дакрон или тефлон), или наносят без полимерного носителя, общее количество наносимого доксорубицина не должно превышать 25 мг (в пределах от 0,1 мкг до 25 мг). В особо предпочтительном варианте воплощения общее количество нанесенного препарата должно находиться в пределах от 1 мкг до 5 мг. Доза на единицу площади устройства (т.е. количество препарата как функция площади поверхности участка шунта для ЦНС, на который наносится и/или в который включается лекарственный препарат) должна находиться в пределах 0,01 мкг-100 мкг на 1 мм2 площади поверхности. В особо предпочтительном варианте воплощения доксорубицин следует наносить на поверхность шунта для ЦНС в дозе в пределах 0,1-10 мкг/мм2. Поскольку различные полимерные и неполимерные оболочки будут высвобождать доксорубицин с различной скоростью, вышеуказанные параметры дозирования следует использовать с учетом скорости высвобождения лекарственного препарата с поверхности шунта для ЦНС так, чтобы на поверхности поддерживалась минимальная концентрация доксорубицина 10-7-10-4 М. Необходимо обеспечить гарантию того, чтобы концентрации лекарственного препарата на поверхности превышали концентрации доксорубицина, известные как летальные для многих видов бактерий и грибов (т.е. выше 10-4 М, хотя для некоторых вариантов воплощения требуются более низкие концентрации). В предпочтительном варианте воплощения доксорубицин высвобождается с поверхности шунта для ЦНС таким образом, что противоинфекционная активность сохраняется в течение периода времени от нескольких часов до нескольких месяцев. В особо предпочтительном варианте воплощения лекарственный препарат высвобождается в эффективных концентрациях в течение периода времени в пределах 1-12 недель. Из представленного здесь обсуждения понятно, что аналоги и производные доксорубицина (описанные ранее) с аналогичной функциональной активностью можно использовать для целей настоящего изобретения; кроме того, указанные выше параметры дозирования можно скорректировать с учетом относительной активности аналога или производного по сравнению с исходным соединением (например, соединение, которое активнее доксорубицина в два раза, вводят в половинной части указанных параметров, в то время как соединение, наполовину менее активное чем доксорубицин, вводят в количестве, в два раза превышающем вышеуказанные параметры, и т.д.).
При использовании митоксантрона в качестве другого примера антрациклина в виде полимерного покрытия, включения в полимеры, из которых изготовлен шунт для ЦНС (такие, как дакрон или тефлон), или нанесенного без полимера-носителя, общее количество нанесенного митоксантрона не должно превышать 5 мг (в пределах от 0,01 мкг до 5 мг). В особо предпочтительном варианте воплощения общее количество нанесенного препарата должно находиться в пределах от 0,1 мкг до 1 мг. Доза на единицу площади устройства (т.е. количество лекарственного препарата как функция площади поверхности участка шунта для ЦНС, на который наносят и/или в который включают лекарственный препарат) должна находиться в пределах 0,01 мкг-20 мкг на мм2 площади поверхности. В особо предпочтительном варианте воплощения митоксантрон следует наносить на поверхность шунта для ЦНС в дозе в пределах 0,05-3 мкг/мм2. Поскольку различные полимерные и неполимерные оболочки будут высвобождать митоксантрон с различной скоростью, вышеуказанные параметры дозирования следует использовать с учетом скорости высвобождения лекарственного препарата с поверхности шунта для ЦНС так, чтобы поддерживалась минимальная концентрация митоксантрона 10-5-10-6 М. Необходимо обеспечить гарантию того, чтобы концентрации лекарственного препарата на поверхности превышали концентрации митоксантрона, известные как летальные для многих видов бактерий и грибов (т.е. выше 10-5 М, хотя для некоторых вариантов воплощения требуются более низкие концентрации). В предпочтительном варианте воплощения митоксантрон высвобождается с поверхности шунта для ЦНС таким образом, что противоинфекционная активность сохраняется в течение периода времени от нескольких часов до нескольких месяцев. В особо предпочтительном варианте воплощения лекарственный препарат высвобождается в эффективных концентрациях в течение периода времени в пределах 1-12 недель. Из представленного здесь обсуждения понятно, что аналоги и производные митоксантрона (описанные ранее) с аналогичной функциональной активностью можно использовать для целей настоящего изобретения; кроме того, указанные выше параметры дозирования можно скорректировать с учетом относительной активности аналога или производного по сравнению с исходным соединением (например, соединение, которое активнее митоксантрона в два раза, вводят в половинной части указанных параметров, в то время как соединение, наполовину менее активное чем митоксантрон, вводят в количестве, в два раза превышающем вышеуказанные параметры, и т.д.).
(b) Фторпиримидины. При использовании 5-фторурацила в качестве примера фторпиримидина в виде полимерного покрытия, включения в полимеры, из которых изготовлен шунт для ЦНС (такие, как дакрон или тефлон), или нанесенного без полимера-носителя, общее количество нанесенного 5-фторурацила не должно превышать 250 мг (в пределах от 1,0 мкг до 250 мг). В особо предпочтительном варианте воплощения общее количество нанесенного препарата должно находиться в пределах от 10 мкг до 25 мг. Доза на единицу площади устройства (т.е. количество лекарственного препарата как функция площади поверхности участка шунта для ЦНС, на который наносят и/или в который включают лекарственный препарат) должна находиться в пределах 0,1 мкг-1 мг на 1 мм2 площади поверхности. В особо предпочтительном варианте воплощения 5-фторурацил следует наносить на поверхность шунта для ЦНС в дозе в пределах 1,0-50 мкг/мм2. Поскольку различные полимерные и неполимерные оболочки будут высвобождать 5-фторурацил с различной скоростью, вышеуказанные параметры дозирования следует использовать с учетом скорости высвобождения лекарственного препарата с поверхности шунта для ЦНС так, чтобы поддерживалась минимальная концентрация 5-фторурацила 10-4-10-7 М. Необходимо обеспечить гарантию того, чтобы концентрации лекарственного препарата на поверхности превышали концентрации 5-фторурацила, известные как летальные для многих видов бактерий и грибов (т.е. выше 10-4 М, хотя для некоторых вариантов воплощения требуются более низкие концентрации). В предпочтительном варианте воплощения 5-фторурацил высвобождается с поверхности шунта для ЦНС таким образом, что противоинфекционная активность сохраняется в течение периода времени от нескольких часов до нескольких месяцев. В особо предпочтительном варианте воплощения лекарственный препарат высвобождается в эффективных концентрациях в течение периода времени в пределах 1-12 недель. Из представленного здесь обсуждения понятно, что аналоги и производные 5-фторурацила (описанные ранее) с аналогичной функциональной активностью можно использовать для целей настоящего изобретения; кроме того, указанные выше параметры дозирования можно скорректировать с учетом относительной активности аналога или производного по сравнению с исходным соединением (например, соединение, которое активнее 5-фторурацила в два раза, вводят в половинной части указанных параметров, в то время как соединение, наполовину менее активное чем 5-фторурацил, вводят в количестве, в два раза превышающем вышеуказанные параметры, и т.д.).
(с) Подофилотоксины. При использовании этопозида в качестве примера подофилотоксина в виде полимерного покрытия, включения в полимеры, из которых изготовлен шунт для ЦНС (такие, как дакрон или тефлон), или нанесенного без полимера-носителя, общее количество нанесенного этопозида не должно превышать 25 мг (в пределах от 0,1 мкг до 25 мг). В особо предпочтительном варианте воплощения общее количество нанесенного препарата должно находиться в пределах от 1 мкг до 5 мг. Доза на единицу площади устройства (т.е. количество лекарственного препарата как функция площади поверхности участка шунта для ЦНС, на который наносят и/или в который включают лекарственный препарат) должна находиться в пределах 0,01-100 мкг на 1 мм2 площади поверхности. В особо предпочтительном варианте воплощения этопозид следует наносить на поверхность шунта для ЦНС в дозе в пределах 0,1-10 мкг/мм2. Поскольку различные полимерные и неполимерные оболочки будут высвобождать этопозид с различной скоростью, вышеуказанные параметры дозирования следует использовать с учетом скорости высвобождения лекарственного препарата с поверхности шунта для ЦНС так, чтобы поддерживалась минимальная концентрация этопозида 10-5-10-6 М. Необходимо обеспечить гарантию того, чтобы концентрации лекарственного препарата на поверхности устройства превышали концентрации этопозида, известные как летальные для многих видов бактерий и грибов (т.е. выше 10-5 М, хотя для некоторых вариантов воплощения требуются более низкие концентрации). В предпочтительном варианте воплощения этопозид высвобождается с поверхности шунта для ЦНС таким образом, что противоинфекционная активность сохраняется в течение периода времени от нескольких часов до нескольких месяцев. В особо предпочтительном варианте воплощения лекарственный препарат высвобождается в эффективных концентрациях в течение периода времени в пределах 1-12 недель. Из представленного здесь обсуждения понятно, что аналоги и производные этопозида (описанные ранее) с аналогичной функциональной активностью можно использовать для целей настоящего изобретения; кроме того, указанные выше параметры дозирования можно скорректировать с учетом относительной активности аналога или производного по сравнению с исходным соединением (например, соединение, которое активнее этопозида в два раза, вводят в половинной части указанных параметров, в то время как соединение, наполовину менее активное чем этопозид, вводят в количестве, в два раза превышающем вышеуказанные параметры, и т.д.).
(d) Комбинированная терапия. Из представленного выше обсуждения понятно, что можно использовать комбинации антрациклинов (например, доксорубицина или митоксантрона), фторпиримидинов (например, 5-фторурацила), антагонистов фолиевой кислоты (например, метотрексата) и подофилотоксинов (например, этопозида) для повышения антибактериальной активности покрытия шунта для ЦНС. Аналогичным образом антрациклины (например, доксорубицин или митоксантрон), фторпиримидины (например, 5-форурацил), антагонисты фолиевой кислоты (например, метотрексат) и/или подофилотоксины (например, этопозид) можно сочетать с обычными антибиотиками и/или противогрибковыми препаратами для усиления эффективности.
(g) Внешнее устройство для вентрикулярного дренирования (EVD) и устройства для регистрации внутричерепного давления (ICP)
Устройства для мониторинга EVD и ICP также применяют при лечении гидроцефалии. Терапевтические средства, параметры дозирования, покрытия и параметры кинетики высвобождения для разработки устройств для мониторинга, покрытых лекарственным препаратом EVD и покрытых лекарственным препаратом ICP, аналогичны описанным для шунтов для ЦНС.
K. Инфекции, вызванные ортопедическими имплантатами
Имплантированные ортопедические устройства, такие как искусственные суставы, такие как протезы бедра, колена, локтя, плеча, запястья, пястья и плюсны, подвергаются осложнениям в результате инфицирования имплантата. Инфекции, связанные с ортопедическими имплантатами, проявляются в виде различных последствий, включая боль, неподвижность, отсутствие функционирования самого протеза, потерю/удаление протеза, повторную операцию, потерю пораженной конечности и даже смерть. Стоимость лечения каждой инфекции превышает стоимость самой первичной артропластики сустава в 3-4 раза (более 50000 долл./в каждом случае). Другие ортопедические имплантируемые устройства, такие как внутренние и внешние фиксирующие устройства, пластинки и винты, также подвержены инфицированию и осложнениям, связанным с инфекцией. Лечение в настоящее время включает ряд операций для удаления инфицированных протезов, с присущими им рисками, в сочетании с лечением антибиотиками.
Частота инфицирования ортопедических протезов является самой высокой в первый месяц после операции, затем постепенно снижается. В качестве примера, общая частота развития инфекции искусственных суставов в течение 2 лет составляет примерно 5,9% на 1000 суставов; затем частота падает до 2,3% на 1000 суставов, начиная с 2 лет до 10 лет. Частота инфицирования также зависит от самого сустава. Коленные протезы инфицируются в два раза чаще по сравнению с бедренными. Частота инфекции плечевых протезов находится в пределах 0,5-3%, локтевых - до 12%, запястья - 1,5-5,0% и голеностопных - 1,4-2,4%.
Существуют три основных механизма развития инфекции. Наиболее частой является колонизация имплантата (протеза, пластинки для фиксации, винтов - любого имплантируемого ортопедического устройства) во время имплантации либо непосредственно, либо посредством обсеменения раны воздушным путем. Вторым путем является распространение инфекции из смежного очага инфекции, такого как инфицированная рана, абсцесс или синусный путь. Третий путь представляет собой гематогенное обсеменение во время системной бактериемии, вероятно, ответственное примерно за 7% всех инфекций имплантатов.
Факторы риска многочисленны. Хозяин может быть ослаблен в результате системного состояния, болезни, локального состояния или в результате лечения, которое снижает защитные способности хозяина. Также имеется предрасположенность к инфекциям, если у пациента была перед этим операция, раневые осложнения после операции или ревматоидный артрит. Повторные хирургические вмешательства повышают вероятность развития инфекции, так, например, в таких случаях имеется повышенный в 8 раз риск инфицирования по сравнению с первичной операцией установки протеза. Наличие глубокой инфекции повышает риск инфицирования протеза в 6 раз. Различные заболевания также увеличивают риск развития инфекции. Например, у пациентов с ревматоидным артритом имеется повышенный риск развития инфекции, возможно, в результате лечения, ослабляющего иммунную систему организма, в то время как у пациентов с псориазом повышенный риск, возможно, связан с ослаблением барьерной функции кожи, что позволяет проникать микробам.
Сам по себе имплантат и цементы, которые обеспечивают его крепление на месте, могут вызывать местное нарушение иммунной функции, причину которого трудно понять. Различные имплантационные материалы имеют их собственную частоту инфицирования. Например, шарнирный коленный протез металл-к-металлу имеет риск развития инфекции в 20 раз выше по сравнению с коленным протезом металл-к-пластмассе.
Имплантированное устройство наиболее расположено к инфицированию на ранних стадиях. На модели на кроликах было показано, что для развития инфекции во время имплантации необходимо очень небольшое количество Staphylococcus aureus, но бактериемическое (гематогенное) заражение через 3 недели после операции происходит значительно труднее, и при этом требуется существенно большее число бактерий. Это подчеркивает важность антимикробной стратегии, начатой в раннем периоде после имплантации.
Возбудителями инфекции искусственных суставов в 65% случаев являются грамположительные кокки (Staphylococcus aureus, отрицательные на коагулазу стафилококки, бета-гемолитические стрептококки, Viridans Group Streptococci) и энтерококки. Часто при одной инфекции протеза может присутствовать несколько штаммов стафилококков. Другие микроорганизмы включают аэробные грамотрицательные бациллы, Enterobacteriacea, Pseudomonas aeruginosa и Anaerobes (такие, как виды Peptostreptococcus и Bacteroides). 12% инфекций имеют полимикробную этиологию.
Диагностировать инфицированный имплантат трудно ввиду существенных различий в проявлении; лихорадка, общее недомогание, отек, эритема, боль в суставе, ослабление имплантата и даже острая септицемия. Быстрое развитие симптомов, как правило, вызывается более вирулентными микроорганизмами, такими как Staphylococcus aureus и пиогенные бета-гемолитические стрептококки. Хроническое бессимптомное течение более характерно для отрицательных на коагулазу стафилококков.
Для лечения инфицированного ортопедического имплантата обычно требуется длительная терапия антибиотиками и операция для удаления инфицированного устройства. При операции необходима санация инфицированной ткани, мягкой ткани, кости, цемента и удаление инфицированного имплантата. После длительного лечения антибиотиками (в течение недель, месяцев, а иногда и года для гарантии уничтожения микробов) становится возможным имплантировать замещающий протез. Некоторые авторы пропагандируют применение пропитанного антибиотиками цемента, но при этом возникает риск развития резистентности к антибиотикам; особенно резистентности к метециллину. Если потеря кости является существенной, то часто проводят артродез, и в некоторых случаях необходима ампутация. Даже, когда инфекция устранена, пациент может оставаться очень ослабленным, ощущать боль и иметь высокий риск повторного инфицирования.
Следовательно, очень важно для клиники разработать ортопедические имплантаты, способные противостоять инфицированию или снижать частоту развития инфекции. Эффективное покрытие ортопедического имплантата будет снижать частоту инфицирования суставов и устройств; снижать частоту несостоятельности протеза, сепсиса, ампутации и даже смерти; и также уменьшать число ортопедических имплантатов, для которых требуется замена, приводя к пониженной заболеваемости пациентов с данными имплантатами.
В предпочтительном варианте воплощения доксорубицин, митоксантрон, 5-фторурацил и/или этопозид включают в покрытие, наносимое на поверхность компонентов ортопедического имплантата. Лекарственный(ые) препарат(ы) можно наносить несколькими способами: а) в виде покрытия, нанесенного на внешнюю внутрикостную поверхность протеза; b) в виде покрытия, нанесенного на внешнюю (суставную) поверхность протеза; с) в виде покрытия, нанесенного на все или части обеих поверхностей; d) в виде покрытия, нанесенного на поверхность ортопедического устройства (пластин, винтов и т.д.); е) в виде включения в полимеры, входящие в состав материала искусственных суставов (например, суставные поверхности и покрытия других поверхностей), и устройств (например, винты и пластины на основе полимолочной кислоты) и/или f) в виде включения в компоненты цементов, использованных для фиксации ортопедических имплантатов на месте.
Покрытие лекарственным препаратом или включение лекарственного препарата в ортопедический имплантат позволит обеспечить концентрации бактерицидного препарата местно на поверхности имплантата, тем самым снижая частоту колонизации бактерий и последующего развития инфекционных осложнений, одновременно обеспечивая незначительное системное действие препаратов. Несмотря на то, что для некоторых средств не требуется полимерных носителей для прикрепления лекарственного препарата, некоторые полимерные носители особенно подходят для применения в данном варианте воплощения. Особый интерес представляют такие полимерные носители, как полиуретаны (например, ChronoFlex AL 85A [CT Biomaterials], HydroMed640 [CT Biomaterials], HYDROSLIP C [CT Biomaterials], HYDROSLIP C [CT Biomaterials], HYDROTHANE [CT Biomaterials], HYDROTHANE [CT Biomaterials]), акриловые и метакриловые сополимеры (например, поли(этилен-со-акриловая кислота), полимеры, производные целлюлозы (например, нитроцеллюлоза, ацетобутират целлюлозы, ацетопропионат целлюлозы), сополимеры акрилата и метакрилата (например, поли(этилен-со-винилацетат)), а также их смеси. [CT Biomaterials]), акриловые и метакриловые сополимеры (например, поли(этилен-со-акриловая кислота), полимеры, производные целлюлозы (например, нитроцеллюлоза, ацетобутират целлюлозы, ацетопропионат целлюлозы), сополимеры акрилата и метакрилата (например, поли(этилен-со-винилацетат)), а также их смеси.
Интересующие лекарственные препараты можно также включать в покрытия из кальция фосфата или гидроксиапатита на медицинских устройствах.
Поскольку ортопедические имплантаты изготавливают в самых различных конфигурациях и размерах, точное вводимое количество будет варьироваться в зависимости от размера, площади поверхности, конструкции устройства и участков имплантата для покрытия. Однако можно использовать определенные принципы при применении в данной области. Количество лекарственного препарата можно рассчитать, как функцию количества на единицу площади (участка имплантата, который подлежит покрытию), можно определить общее количество препарата для введения и соответствующие поверхностные концентрации активного препарата. Независимо от способа нанесения препарата на ортопедический имплантат предпочтительные противоопухолевые препараты, используемые по отдельности или в комбинации, следует вводить, руководствуясь следующими правилами дозирования:
(а) Антрациклины. При использовании доксорубицина в качестве примера антрациклинов, в виде полимерного покрытия, включения в полимеры, из которых изготовлены компоненты ортопедического имплантата, или нанесенного без полимерного носителя, общее количество наносимого доксорубицина не должно превышать 25 мг (в пределах от 0,1 мкг до 25 мг). В особо предпочтительном варианте воплощения общее количество нанесенного препарата должно находиться в пределах от 1 мкг до 5 мг. Доза на единицу площади устройства (т.е. количество препарата, как функция площади поверхности участка ортопедического имплантата, на который наносят и/или в который включается лекарственный препарат) должна находиться в пределах 0,01-100 мкг на 1 мм2 площади поверхности. В особо предпочтительном варианте воплощения доксорубицин следует наносить на поверхность ортопедического имплантата в дозе в пределах 0,1-10 мкг/мм2. Поскольку различные полимерные и неполимерные оболочки будут высвобождать доксорубицин с различной скоростью, вышеуказанные параметры дозирования следует использовать с учетом скорости высвобождения лекарственного препарата с поверхности ортопедического имплантата так, чтобы на поверхности поддерживалась минимальная концентрация доксорубицина 10-7-10-4 М. Необходимо обеспечить гарантию того, чтобы концентрации лекарственного препарата на поверхности превышали концентрации доксорубицина, известные как летальные для многих видов бактерий и грибов (т.е. выше 10-4 М, хотя для некоторых вариантов воплощения требуются более низкие концентрации). В предпочтительном варианте воплощения доксорубицин высвобождается с поверхности ортопедического имплантата таким образом, что противоинфекционная активность сохраняется в течение периода времени от нескольких часов до нескольких месяцев. Как указывалось выше, риск инфицирования имплантата является самым высоким в течение 3 первых суток. Следовательно, в особо предпочтительном варианте воплощения большая часть (или весь) лекарственный препарат высвобождается в течение первых 72 ч для профилактики развития инфекции, одновременно обеспечивая протекание нормального заживления. Из представленного здесь обсуждения понятно, что аналоги и производные доксорубицина (описанные ранее) с аналогичной функциональной активностью можно использовать для целей настоящего изобретения; кроме того, указанные выше параметры дозирования можно скорректировать с учетом относительной активности аналога или производного по сравнению с исходным соединением (например, соединение, которое активнее доксорубицина в два раза, вводят в половинной части указанных параметров, в то время как соединение, наполовину менее активное чем доксорубицин, вводят в количестве, в два раза превышающем вышеуказанные параметры, и т.д.).
При использовании митоксантрона в качестве другого примера антрациклина в виде полимерного покрытия, включения в полимеры, из которых изготовлен ортопедический имплантат, или нанесенного без полимера-носителя, общее количество нанесенного митоксантрона не должно превышать 5 мг (в пределах от 0,01 мкг до 5 мг). В особо предпочтительном варианте воплощения общее количество нанесенного препарата должно находиться в пределах от 0,1 мкг до 1 мг. Доза на единицу площади устройства (т.е. количество лекарственного препарата, как функция площади поверхности участка ортопедического имплантата, на который наносят и/или в который включают лекарственный препарат) должна находиться в пределах 0,01 мкг-20 мкг на 1 мм2 площади поверхности. В особо предпочтительном варианте воплощения митоксантрон следует наносить на поверхность ортопедического имплантата в дозе в пределах 0,05-3 мкг/мм2. Поскольку различные полимерные и неполимерные оболочки будут высвобождать митоксантрон с различной скоростью, вышеуказанные параметры дозирования следует использовать с учетом скорости высвобождения лекарственного препарата с поверхности ортопедического имплантата так, чтобы поддерживалась минимальная концентрация митоксантрона 10-5-10-6 М. Необходимо обеспечить гарантию того, чтобы концентрации лекарственного препарата на поверхности превышали концентрации митоксантрона, известные как летальные для многих видов бактерий и грибов (т.е. выше 10-5 М, хотя для некоторых вариантов воплощения требуются более низкие концентрации). В предпочтительном варианте воплощения митоксантрон высвобождается с поверхности ортопедического имплантата таким образом, что противоинфекционная активность сохраняется в течение периода времени от нескольких часов до нескольких месяцев. Как указывалось выше, риск инфицирования имплантата является самым высоким в течение 3 первых суток. Следовательно, в одном варианте воплощения большая часть (или весь) лекарственный препарат высвобождается в течение первых 72 ч для профилактики развития инфекции, одновременно обеспечивая протекание нормального заживления. Из представленного здесь обсуждения понятно, что аналоги и производные митоксантрона (описанные ранее) с аналогичной функциональной активностью можно использовать для целей настоящего изобретения; кроме того, указанные выше параметры дозирования можно скорректировать с учетом относительной активности аналога или производного по сравнению с исходным соединением (например, соединение, которое активнее митоксантрона в два раза, вводят в половинной части указанных параметров, в то время как соединение, наполовину менее активное чем митоксантрон, вводят в количестве, в два раза превышающем вышеуказанные параметры, и т.д.).
(b) Фторпиримидины. При использовании 5-фторурацила в качестве примера фторпиримидина в виде полимерного покрытия, включения в полимеры, из которых изготовлен ортопедический имплантат, или нанесенного без полимера-носителя, общее количество нанесенного 5-фторурацила не должно превышать 250 мг (в пределах от 1,0 мкг до 250 мг). В особо предпочтительном варианте воплощения общее количество нанесенного препарата должно находиться в пределах от 10 мкг до 25 мг. Доза на единицу площади устройства (т.е. количество лекарственного препарата, как функция площади поверхности участка ортопедического имплантата, на который наносят и/или в который включают лекарственный препарат) должна находиться в пределах 0,1 мкг-1 мг на 1 мм2 площади поверхности. В особо предпочтительном варианте воплощения 5-фторурацил следует наносить на поверхность ортопедического имплантата в дозе в пределах 1,0-50 мкг/мм2. Поскольку различные полимерные и неполимерные оболочки будут высвобождать 5-фторурацил с различной скоростью, вышеуказанные параметры дозирования следует использовать с учетом скорости высвобождения лекарственного препарата с поверхности ортопедического имплантата так, чтобы поддерживалась минимальная концентрация 5-фторурацила 10-4-10-7 М. Необходимо обеспечить гарантию того, чтобы концентрации лекарственного препарата на поверхности превышали концентрации 5-фторурацила, известные как летальные для многих видов бактерий и грибов (т.е. выше 10-4 М, хотя для некоторых вариантов воплощения требуются более низкие концентрации). В предпочтительном варианте воплощения 5-фторурацил высвобождается с поверхности ортопедического имплантата таким образом, что противоинфекционная активность сохраняется в течение периода времени от нескольких часов до нескольких месяцев. Как указывалось выше, риск инфицирования имплантата является самым высоким в течение 3 первых суток. Следовательно, в особо предпочтительном варианте воплощения большая часть (или весь) лекарственный препарат высвобождается в течение первых 72 ч для профилактики развития инфекции, одновременно обеспечивая протекание нормального заживления. Из представленного здесь обсуждения понятно, что аналоги и производные 5-фторурацила (описанные ранее) с аналогичной функциональной активностью можно использовать для целей настоящего изобретения; кроме того, указанные выше параметры дозирования можно скорректировать с учетом относительной активности аналога или производного по сравнению с исходным соединением (например, соединение, которое активнее 5-фторурацила в два раза, вводят в половинной части указанных параметров, в то время как соединение, наполовину менее активное чем 5-фторурацил, вводят в количестве, в два раза превышающем вышеуказанные параметры, и т.д.).
(с) Подофилотоксины. При использовании этопозида в качестве примера подофилотоксина в виде полимерного покрытия, включения в полимеры, из которых изготовлен ортопедический имплантат, или нанесенного без полимера-носителя, общее количество нанесенного этопозида не должно превышать 25 мг (в пределах от 0,1 мкг до 25 мг). В особо предпочтительном варианте воплощения общее количество нанесенного препарата должно находиться в пределах от 1 мкг до 5 мг. Доза на единицу площади устройства (т.е. количество лекарственного препарата как функция площади поверхности участка ортопедического имплантата, на который наносят и/или в который включают лекарственный препарат) должна находиться в пределах 0,01-100 мкг на 1 мм2 площади поверхности. В особо предпочтительном варианте воплощения этопозид следует наносить на поверхность ортопедического имплантата в дозе в пределах 0,1-10 мкг/мм2. Поскольку различные полимерные и неполимерные оболочки будут высвобождать этопозид с различной скоростью, вышеуказанные параметры дозирования следует использовать с учетом скорости высвобождения лекарственного препарата с поверхности ортопедического имплантата так, чтобы поддерживалась минимальная концентрация этопозида 10-5-10-6 М. Необходимо обеспечить гарантию того, чтобы концентрации лекарственного препарата на поверхности устройства превышали концентрации этопозида, известные как летальные для многих видов бактерий и грибов (т.е. выше 10-5 М, хотя для некоторых вариантов воплощения требуются более низкие концентрации). В предпочтительном варианте воплощения этопозид высвобождается с поверхности ортопедического имплантата таким образом, что противоинфекционная активность сохраняется в течение периода времени от нескольких часов до нескольких месяцев. Как указывалось выше, риск инфицирования имплантата является самым высоким в течение 3 первых суток. Следовательно, в особо предпочтительном варианте воплощения большая часть (или весь) лекарственный препарат высвобождается в течение первых 72 ч для профилактики развития инфекции, одновременно обеспечивая протекание нормального заживления. Из представленного здесь обсуждения понятно, что аналоги и производные этопозида (описанные ранее) с аналогичной функциональной активностью можно использовать для целей настоящего изобретения; кроме того, указанные выше параметры дозирования можно скорректировать с учетом относительной активности аналога или производного по сравнению с исходным соединением (например, соединение, которое активнее этопозида в два раза, вводят в половинной части указанных параметров, в то время как соединение, наполовину менее активное чем этопозид, вводят в количестве, в два раза превышающем вышеуказанные параметры, и т.д.).
(d) Комбинированная терапия. Из представленного выше обсуждения понятно, что можно использовать комбинации антрациклинов (например, доксорубицина или митоксантрона), фторпиримидинов (например, 5-фторурацила), антагонистов фолиевой кислоты (например, метотрексата) и подофилотоксинов (например, этопозида) для повышения антибактериальной активности покрытия ортопедического имплантата. Аналогичным образом антрациклины (например, доксорубицин или митоксантрон), фторпиримидины (например, 5-фторурацил), антагонисты фолиевой кислоты (например, метотрексат) и/или подофилотоксины (например, этопозид) можно сочетать с обычными антибиотиками и/или противогрибковыми препаратами для усиления эффективности.
L. Инфекции, связанные с другими медицинскими устройствами и имплантатами
Имплантаты широко применяются в практике медицины и хирургии для самых разнообразных целей. Они включают такие мплантаты, как дренажные трубки, желчные Т-трубки, скобы, шовные материалы, сита, барьеры (для предупреждения адгезии), анастомозные устройства, устройства для перемещения жидкостей, орошающие жидкости, упаковочные средства, стенты, сшивающие аппараты, фильтры для нижней полой вены, средства против эмболизации, насосы (для введения лекарственных препаратов), гемостатические имплантаты (губки), тканевые наполнители, косметические имплантаты (имплантаты молочной железы, имплантаты для лица, протезы), костные имплантаты, кожные имплантаты, внутриматочные устройства (IUD), лигатуры, титаниевые имплантаты (особенно в стоматологии), трубки для грудной полости, назожелудочные трубки, трубки для перкутанного питания, колостомные устройства, костный воск и дренажи Пенроуза, волосяные пробки, ушные кольца, носовые кольца и другие связанные с пирсингом имплантаты, а также растворы анестетиков. При размещении любого чужеродного тела в организме существует риск развития инфекции - особенно в период сразу же после имплантации.
Покрытие лекарственным препаратом, параметры дозирования, концентрации на поверхности и параметры кинетики высвобождения из данных имплантатов аналогичны вариантам воплощения, описанным выше для ортопедических имплантатов. В дополнение доксорубицин, митоксантрон, 5-фторурацил и/или этопозид можно добавить к растворам, используемым в медицине (растворам для хранения, орошающим жидкостям, физиологическому раствору, растворам маннита, глюкозы, липидам, питательным жидкостям и растворам анестетиков) для профилактики инфекции, передаваемой через инфицированные растворы/жидкости, используемые при лечении пациентов.
M. Инфекции, связанные с офтальмологическими имплантатами
Основными инфекциями, связанными с медицинскими имплантатами в глазу, являются эндофтальмит, связанный с имплантацией внутриглазных линз при операции по поводу катаракты, и инфекции роговицы, вторичные к применению контактных линз.
Инфекции, связанные с внутриглазными линзами
В последней декаде число имплантаций внутриглазных линз в США возросло экспонентициально. В настоящее время 1 млн внутриглазных линз имплантируется ежегодно при установке преобладающего большинства (90%) в заднюю камеру глаза. Эндофтальмит представляет собой наиболее распространенное инфекционное осложнение при установке внутриглазных линз, и оно имеет место примерно при 0,3% операций (3000 случаев в год). Подавляющее большинство является результатом инфицирования во время операции и начинается в течение 48 ч после операции.
Наиболее распространенными возбудителями эндофтальмита является отрицательные на коагулазу стафилококки (в основном Staphylococcus epidermidis), Staphylococcus aureus, энтерококки и Proteus mirabilis. Симптомы заболевания включают затуманенное зрение, боль в глазах, головную боль, фотофобию и отек роговицы. Лечение эндофтальмита, связанного с операцией по поводу удаления катаракты, включает витрэктомию и терапию антибиотиками системно и/или при внутриглазном введении. Несмотря на то, что в большинстве случаев не требуется удаления линз, в сложных случаях острота зрения может быть временно нарушена, и/или линзы необходимо удалить и заменить позднее. Эффективное покрытие внутриглазных линз будет снижать частоту развития эндофтальмита и также уменьшать число внутриглазных линз, требующих замены, приводя к пониженной заболеваемости пациентов с данными имплантатами.
В предпочтительном варианте воплощения доксорубицин, митоксантрон, 5-фторурацил и/или этопозид включают в покрытие, наносимое на поверхность компонентов внутриглазных линз. Лекарственный(ые) препарат(ы) можно наносить несколькими способами: а) в виде покрытия, нанесенного на внешнюю поверхность линз; b) в виде покрытия, нанесенного на внутреннюю (просветную) поверхность линз; с) в виде покрытия, нанесенного на все или части обеих поверхностей линз, и/или d) в виде включения в полимеры, входящие в состав линзы.
Покрытие лекарственным препаратом или включение лекарственного препарата во внутриглазные линзы позволит обеспечить концентрации бактерицидного препарата местно на поверхности линз, тем самым снижая частоту колонизации бактерий и последующего развития инфекционных осложнений, одновременно обеспечивая незначительно системное действие препаратов. Несмотря на то, что для некоторых средств не требуется полимерных носителей для прикрепления лекарственного препарата, некоторые полимерные носители особенно подходят для применения в данном варианте воплощения. Особый интерес представляют такие полимерные носители, как полиуретаны (например, ChronoFlex AL 85A [CT Biomaterials], HydroMed640 [CT Biomaterials], HYDROSLIP C [CT Biomaterials], HYDROSLIP C [CT Biomaterials], HYDROTHANE [CT Biomaterials], HYDROTHANE [CT Biomaterials]), акриловые и метакриловые сополимеры (например, поли(этилен-со-акриловая кислота), полимеры, производные целлюлозы (например, нитроцеллюлоза, ацетобутират целлюлозы, ацетопропионат целлюлозы), сополимеры акрилата и метакрилата (например, поли(этилен-со-винилацетат)), а также их смеси. [CT Biomaterials]), акриловые и метакриловые сополимеры (например, поли(этилен-со-акриловая кислота), полимеры, производные целлюлозы (например, нитроцеллюлоза, ацетобутират целлюлозы, ацетопропионат целлюлозы), сополимеры акрилата и метакрилата (например, поли(этилен-со-винилацетат)), а также их смеси.
Поскольку внутриглазные линзы изготавливают в самых различных конфигурациях и размерах, точное вводимое количество будет варьироваться в зависимости от размера, площади поверхности, конструкции линз и участков линз для покрытия. Однако можно использовать определенные принципы при применении в данной области. Количество лекарственного препарата можно высчитать как функцию количества на единицу площади (участка линз, который подлежит покрытию), можно определить общее количество препарата для введения и соответствующие поверхностные концентрации активного препарата. Независимо от способа нанесения препарата на внутриглазные линзы предпочтительные противоопухолевые препараты, используемые по отдельности или в комбинации, следует вводить, руководствуясь следующими правилами дозирования:
(а) Антрациклины. При использовании доксорубицина в качестве примера антрациклинов, в виде полимерного покрытия, включения в полимеры, из которых изготовлены компоненты внутриглазных линз, или нанесенного без полимерного носителя, общее количество наносимого доксорубицина не должно превышать 25 мг (в пределах от 0,1 мкг до 25 мг). В особо предпочтительном варианте воплощения общее количество нанесенного препарата должно находиться в пределах от 1 мкг до 5 мг. Доза на единицу площади устройства (т.е. количество препарата как функция площади поверхности участка внутриглазных линз, на который наносят и/или в который включают лекарственный препарат) должна находиться в пределах 0,01-100 мкг на 1 мм2 площади поверхности. В особо предпочтительном варианте воплощения доксорубицин следует наносить на поверхность внутриглазных линз в дозе в пределах 0,1-10 мкг/мм2. Поскольку различные полимерные и неполимерные оболочки будут высвобождать доксорубицин с различной скоростью, вышеуказанные параметры дозирования следует использовать с учетом скорости высвобождения лекарственного препарата с поверхности внутриглазных линз так, чтобы на поверхности поддерживалась минимальная концентрация доксорубицина 10-7-10-4 М. Необходимо обеспечить гарантию того, чтобы концентрации лекарственного препарата на поверхности превышали концентрации доксорубицина, известные как летальные для многих видов бактерий и грибов (т.е. выше 10-4 М, хотя для некоторых вариантов воплощения требуются более низкие концентрации). В предпочтительном варианте воплощения доксорубицин высвобождается с поверхности внутриглазных линз таким образом, что противоинфекционная активность сохраняется в течение периода времени от нескольких часов до нескольких месяцев. В особо предпочтительном варианте воплощения лекарственный препарат высвобождается в эффективных концентрациях в течение периода времени в пределах 1-12 недель. Из представленного здесь обсуждения понятно, что аналоги и производные доксорубицина (описанные ранее) с аналогичной функциональной активностью можно использовать для целей настоящего изобретения; кроме того, указанные выше параметры дозирования можно скорректировать с учетом относительной активности аналога или производного по сравнению с исходным соединением (например, соединение, которое активнее доксорубицина в два раза, вводят в половинной части указанных параметров, в то время как соединение, наполовину менее активное чем доксорубицин, вводят в количестве, в два раза превышающем вышеуказанные параметры, и т.д.).
При использовании митоксантрона в качестве другого примера антрациклина в виде полимерного покрытия, включения в полимеры, из которых изготовлены внутриглазные линзы, или нанесенного без полимера-носителя, общее количество нанесенного митоксантрона не должно превышать 5 мг (в пределах от 0,01 мкг до 5 мг). В особо предпочтительном варианте воплощения общее количество нанесенного препарата должно находиться в пределах от 0,1 мкг до 1 мг. Доза на единицу площади устройства (т.е. количество лекарственного препарата как функция площади поверхности участка внутриглазных линз, на который наносят и/или в который включают лекарственный препарат) должна находиться в пределах 0,01 мкг-20 мкг на мм2 площади поверхности. В особо предпочтительном варианте воплощения митоксантрон следует наносить на поверхность внутриглазных линз в дозе в пределах 0,05-3 мкг/мм2. Поскольку различные полимерные и неполимерные оболочки будут высвобождать митоксантрон с различной скоростью, вышеуказанные параметры дозирования следует использовать с учетом скорости высвобождения лекарственного препарата с поверхности внутриглазных линз так, чтобы поддерживалась минимальная концентрация митоксантрона 10-5-10-6 М. Необходимо обеспечить гарантию того, чтобы концентрации лекарственного препарата на поверхности превышали концентрации митоксантрона, известные как летальные для многих видов бактерий и грибов (т.е. выше 10-5 М, хотя для некоторых вариантов воплощения требуются более низкие концентрации). В предпочтительном варианте воплощения митоксантрон высвобождается с поверхности внутриглазных линз таким образом, что противоинфекционная активность сохраняется в течение периода времени от нескольких часов до нескольких месяцев. В особо предпочтительном варианте воплощения лекарственный препарат высвобождается в эффективных концентрациях в течение периода времени в пределах 1-12 недель. Из представленного здесь обсуждения понятно, что аналоги и производные митоксантрона (описанные ранее) с аналогичной функциональной активностью можно использовать для целей настоящего изобретения; кроме того, указанные выше параметры дозирования можно скорректировать с учетом относительной активности аналога или производного по сравнению с исходным соединением (например, соединение, которое активнее митоксантрона в два раза, вводят в половинной части указанных параметров, в то время как соединение, наполовину менее активное чем митоксантрон, вводят в количестве, в два раза превышающем вышеуказанные параметры, и т.д.).
(b) Фторпиримидины. При использовании 5-фторурацила в качестве примера фторпиримидина в виде полимерного покрытия, включения в полимеры, из которых изготовлены внутриглазные линзы, или нанесенного без полимера-носителя, общее количество нанесенного 5-фторурацила не должно превышать 250 мг (в пределах от 1,0 мкг до 250 мг). В особо предпочтительном варианте воплощения общее количество нанесенного препарата должно находиться в пределах от 10 мкг до 25 мг. Доза на единицу площади устройства (т.е. количество лекарственного препарата как функция площади поверхности участка внутриглазных линз, на который наносят и/или в который включают лекарственный препарат) должна находиться в пределах 0,1 мкг-1 мг на 1 мм2 площади поверхности. В особо предпочтительном варианте воплощения 5-форурацил следует наносить на поверхность внутриглазных линз в дозе в пределах 1,0-50 мкг/мм2. Поскольку различные полимерные и неполимерные оболочки будут высвобождать 5-форурацил с различной скоростью, вышеуказанные параметры дозирования следует использовать с учетом скорости высвобождения лекарственного препарата с поверхности внутриглазных линз так, чтобы поддерживалась минимальная концентрация 5-фторурацила 10-4-10-7 М. Необходимо обеспечить гарантию того, чтобы концентрации лекарственного препарата на поверхности превышали концентрации 5-фторурацила, известные как летальные для многих видов бактерий и грибов (т.е. выше 10-4 М, хотя для некоторых вариантов воплощения требуются более низкие концентрации). В предпочтительном варианте воплощения 5-фторурацил высвобождается с поверхности внутриглазных линз таким образом, что противоинфекционная активность сохраняется в течение периода времени от нескольких часов до нескольких месяцев. В особо предпочтительном варианте воплощения лекарственный препарат высвобождается в эффективных концентрациях в течение периода времени в пределах 1-12 недель. Из представленного здесь обсуждения понятно, что аналоги и производные 5-фторурацила (описанные ранее) с аналогичной функциональной активностью можно использовать для целей настоящего изобретения; кроме того, указанные выше параметры дозирования можно скорректировать с учетом относительной активности аналога или производного по сравнению с исходным соединением (например, соединение, которое активнее 5-фторурацила в два раза, вводят в половинной части указанных параметров, в то время как соединение, наполовину менее активное чем 5-фторурацил, вводят в количестве, в два раза превышающем вышеуказанные параметры, и т.д.).
(с) Подофилотоксины. При использовании этопозида в качестве примера подофилотоксина в виде полимерного покрытия, включения в полимеры, из которых изготовлены внутриглазные линзы, или нанесенного без полимера-носителя, общее количество нанесенного этопозида не должно превышать 25 мг (в пределах от 0,1 мкг до 25 мг). В особо предпочтительном варианте воплощения общее количество нанесенного препарата должно находиться в пределах от 1 мкг до 5 мг. Доза на единицу площади устройства (т.е. количество лекарственного препарата как функция площади поверхности участка внутриглазных линз, на который наносят и/или в который включают лекарственный препарат) должна находиться в пределах 0,01-100 мкг на 1 мм2 площади поверхности. В особо предпочтительном варианте воплощения этопозид следует наносить на поверхность внутриглазных линз в дозе в пределах 0,1-10 мкг/мм2. Поскольку различные полимерные и неполимерные оболочки будут высвобождать этопозид с различной скоростью, вышеуказанные параметры дозирования следует использовать с учетом скорости высвобождения лекарственного препарата с поверхности внутриглазных линз так, чтобы поддерживалась минимальная концентрация этопозида 10-5-10-6 М. Необходимо обеспечить гарантию того, чтобы концентрации лекарственного препарата на поверхности устройства превышали концентрации этопозида, известные как летальные для многих видов бактерий и грибов (т.е. выше 10-5 М, хотя для некоторых вариантов воплощения требуются более низкие концентрации). В предпочтительном варианте воплощения этопозид высвобождается с поверхности внутриглазных линз таким образом, что противоинфекционная активность сохраняется в течение периода времени от нескольких часов до нескольких месяцев. В особо предпочтительном варианте воплощения лекарственный препарат высвобождается в эффективных концентрациях в течение периода времени в пределах 1-12 недель. Из представленного здесь обсуждения понятно, что аналоги и производные этопозида (описанные ранее) с аналогичной функциональной активностью можно использовать для целей настоящего изобретения; кроме того, указанные выше параметры дозирования можно скорректировать с учетом относительной активности аналога или производного по сравнению с исходным соединением (например, соединение, которое активнее этопозида в два раза, вводят в половинной части указанных параметров, в то время как соединение, наполовину менее активное чем этопозид, вводят в количестве, в два раза превышающем вышеуказанные параметры, и т.д.).
(d) Комбинированная терапия. Из представленного выше обсуждения понятно, что можно использовать комбинации антрациклинов (например, доксорубицина или митоксантрона), фторпиримидинов (например, 5-фторурацила), антагонистов фолиевой кислоты (например, метотрексата) и подофилотоксинов (например, этопозида) для повышения антибактериальной активности покрытия внутриглазных линз. Аналогичным образом антрациклины (например, доксорубицин или митоксантрон), фторпиримидины (например, 5-форурацил), антагонисты фолиевой кислоты (например, метотрексат) и/или подофилотоксины (например, этопозид) можно сочетать с обычными антибиотиками и/или противогрибковыми препаратами для усиления эффективности.
Инфекции роговицы, вторичные к применению контактных линз
Контактные линзы в основном применяют для коррекции ошибок рефракции, но также используют после операции по поводу удаления катаракты (линзы Афаки), и «бандажные» линзы используют после травмы роговицы. Более 24 млн человек носят контактные линзы и многие из них страдают язвенным кератитом в результате инфицирования контактных линз. По своей природе данные инфекции являются, как правило, бактериальными, вторичными повреждению/дефектам роговицы, и возбудителями в основном являются грамположительные кокки и Pseudomonas aeruginosa.
Покрытие лекарственным препаратом контактных линз аналогично варианту воплощения, описанному выше для внутриглазных линз. В дополнение доксорубицин, митоксантрон, 5-фторурацил и/или этопозид можно добавлять в раствор для хранения контактных линз для профилактики инфекции, передаваемой через инфицированные растворы для промывания/хранения.
Очевидно, специалисты в данной области понимают, что любое из вышеуказанных средств или его производных, или аналогов можно применять с вариациями вышеуказанных композиций, не отступая от сущности и объема изобретения.
ПРИМЕРЫ
Пример 1
Определение MIC методом микротитрования при разбавлении бульона
А. Определение MIC различных грамотрицательных и грамположительных бактерий
Определение MIC проводили в основном, как описано в публикации Amsterdam D. 1996. Susceptibility testing of antimicrobials in liquid media, p. 52-111. In Loman V. ed. Antibiotics in laboratory medicine, 4th ed. Williams and Wilkins, Baltimore, MD. Кратко различные соединения тестировали на антибактериальную активность в отношении изолятов Р. aeruginosa, K. pneumoniae, E. coli, S. epidermidus и S. aureus по определению MIC (тест определения минимальной ингибирующей концентрации в аэробных условиях с использованием 96-луночных микротитрационных планшетов из полистирола (Falcon 1177) и в бульоне Mueller Hinton при инкубации при 37°С в течение 24 ч. (МНВ использовали для большинства тестов за исключением С721 (S. pyogenes), для которых использовали бульон Todd Hewitt, и Haemophilus influenzae, для которых использовали тест-среду Haemophilus (HTM).) Тесты ставили в трех параллелях. Результаты приведены в таблице 1 ниже.
| Таблица 1 |
| Минимальные инкубирующие концентрации терапевтических средств для различных грамотрицательных и грамположительных бактерий |
| Штамм бактерий |
P. aeruginosa |
K. pneumoniae |
E. coli |
S. aureus |
S. epidermidis |
S. pyogenes |
| |
PAE/K799 |
ATCC13883 |
UB1005 |
ATCC25923 |
|
|
| |
H187 |
C238 |
C498 |
C622 |
C621 |
C721 |
| |
Wt |
Wt |
Wt |
Wt |
Wt |
Wt |
| Лекарственный препарат |
Грам- |
Грам- |
Грам- |
Грам+ |
Грам+ |
Грам+ |
| Доксорубицин |
10-5 |
10-6 |
10-4 |
10-5 |
10-6 |
10-7 |
| Митоксантрон |
10-5 |
10-6 |
105 |
10-5 |
10-5 |
10-6 |
| 5-Фторурацил |
10-5 |
10-6 |
10-6 |
10-7 |
10-7 |
10-4 |
| Метотрексат |
N |
10-6 |
N |
10-5 |
N |
10-6 |
| Этопозид |
N |
10-5 |
N |
10-5 |
10-6 |
10-5 |
| Камптотецин |
N |
N |
N |
N |
10-4 |
N |
| Гидроксимочевина |
10-4 |
N |
N |
N |
N |
10-4 |
| Цисплатин |
10-4 |
N |
N |
N |
N |
N |
| Туберцидин |
N |
N |
N |
N |
N |
N |
| 2-Меркаптопурин |
N |
N |
N |
N |
N |
N |
| 6-Меркаптопурин |
N |
N |
N |
N |
N |
N |
| Цитарабин |
N |
N |
N |
N |
N |
N |
Активность выражена в молярной концентрации
Wt = дикий тип
N = активность отсутствует |
В. MIC для резистентных к антибиотикам бактерий
Различные концентрации следующих соединений: митоксантрона, цисплатина, туберцидина, метотрексата, 5-фторурацила, этопозида, 2-меркаптопурина, доксорубицина, 6-меркаптопурина, камптотецина, гидроксимочевины и цитарабина тестировали на антибактериальную активность в отношении клинических изолятов, резистентных к метициллину S. aureus, и клинического изолята резистентных к ванкомицину педиококков в тесте определения MIC, как описано выше. Соединения, показывающие подавление роста (значение MIC < 1,0×10-3), включали: митоксантрон (оба штамма), метотрексат (резистентные к ванкомицину педиококки), 5-фторурацил (оба штамма), этопозид (оба штамма) и 2-меркаптопурин (резистентные к ванкомицину педиококки).
Пример 2
Катетер - Покрытие погружением - Неразлагаемый полимер
Раствор для покрытия готовили растворением 20 г ChronoFlex Al 85A (CT Biomaterials) в 100 мл смеси DMAC:ТГФ (40:60) при 50°С при перемешивании. После растворения раствор полимера охлаждали до комнатной температуры. 20 мг митоксантрона добавляли к 2 мл раствора полиуретана. Раствор перемешивали до получения гомогенной смеси. Полиуретановую трубку Френча 7 погружали в раствор полимера/лекарственного препарата и затем извлекали. Покрытую трубку высушивали на воздухе (80°С). Затем образец высушивали в вакууме для дополнительного уменьшения остаточного содержания растворителя в покрытии.
Пример 3
Катетер - Покрытие погружением - Разлагаемый полимер
Раствор для покрытия готовили растворением 2 г PLD (50:50) в 10 мл смеси дихлорметан:метанол (70:30). После растворения 20 мг митоксантрона вносили в раствор полимера. После превращения раствора в гомогенный раствор полиуретановую трубку Френча 7 погружали в раствор и затем извлекали. Покрытую трубку высушивали на воздухе. Затем образец высушивали в вакууме для дополнительного уменьшения остаточного содержания растворителя в покрытии.
Пример 4
Катетер - Покрытие погружением - Только лекарственный препарат
1 мл метанола добавляли к 20 мг митоксантрона. Полиуретановую трубку Френча 7 погружали в раствор и затем извлекали. Покрытую трубку высушивали на воздухе. Затем образец высушивали в вакууме для дополнительного уменьшения остаточного содержания растворителя в покрытии.
Пример 5
Катетер - Покрытие погружением - Пропитка лекарственным препаратом
0,6 мл метанола добавляли к 20 мл митоксантрона. Медленно добавляли 1,4 мл DMAC. Полиуретановую трубку Френча 7 погружали в раствор. Через различные интервалы времени (2 мин, 5 мин, 10 мин, 20 мин, 30 мин) трубку извлекали. Покрытую трубку высушивали на воздухе (80°С). Затем образец высушивали в вакууме для дополнительного уменьшения остаточного содержания растворителя в покрытии.
Пример 6
Тимпаностомические трубки - Покрытие погружением - Неразлагаемый полимер
Раствор для покрытия готовили растворением 20 г ChronoFlex Al 85A (CT Biomaterials) в 100 мл смеси DMAC:ТГФ (50:50) при 50°С при перемешивании. После растворения раствор полимера охлаждали до комнатной температуры. 20 мг митоксантрона добавляли к 2 мл раствора полиуретана. Раствор перемешивали до получения гомогенной смеси. Тимпаностомическую трубку погружали в раствор полимера/лекарственного препарата и затем извлекали. Покрытую трубку высушивали на воздухе (80°С). Затем образец высушивали в вакууме для дополнительного уменьшения остаточного содержания растворителя в покрытии.
Пример 7
Катетер - Покрытие погружением - Неразлагаемый полимер
Раствор для покрытия готовили растворением 20 г ChronoFlex Al 85A (CT Biomaterials) в 100 мл ТГФ при 50°С при перемешивании. После растворения раствор полимера охлаждали до комнатной температуры. 20 г этопозида добавляли к 2 мл раствора полиуретана. Раствор перемешивали до получения гомогенной смеси. Полиуретановую трубку Френча 7 погружали в раствор полимера/лекарственного препарата и затем извлекали. Покрытую трубку высушивали на воздухе (80°С). Затем образец высушивали в вакууме для дополнительного уменьшения остаточного содержания растворителя в покрытии.
Пример 8
Катетер - Покрытие погружением - Разлагаемый полимер
Раствор для покрытия готовили растворением 2 г PLG (50:50) в 10 мл смеси дихлорметан:метанол (70:30). После растворения 20 мг этопозида добавляли в раствор полимера. После того, как раствор становился гомогенным раствором, полиуретановую трубку Френча 7 погружали в раствор и затем извлекали. Покрытую трубку высушивали на воздухе. Затем образец высушивали в вакууме для дополнительного уменьшения остаточного содержания растворителя в покрытии.
Пример 9
Катетер - Покрытие погружением - Только лекарственный препарат
1 мл ТГФ добавляли к 20 мг этопозида. Полиуретановую трубку Френча 7 погружали в раствор и затем извлекали. Покрытую трубку высушивали на воздухе. Затем образец высушивали в вакууме для дополнительного уменьшения остаточного содержания растворителя в покрытии.
Пример 10
Катетер - Покрытие погружением - Пропитка лекарственным препаратом
0,6 мл метанола добавляли к 1,4 мл DMAC, который содержал 20 мг этопозида. Полиуретановую трубку Френча 7 погружали в раствор. Через различные интервалы времени (2 мин, 5 мин, 10 мин, 20 мин, 30 мин) трубку извлекали. Покрытую трубку высушивали на воздухе (80°С). Затем образец высушивали в вакууме для дополнительного уменьшения остаточного содержания растворителя в покрытии.
Пример 11
Тимпаностомические трубки- Покрытие погружением - Неразлагаемый полимер
Раствор для покрытия готовили растворением 20 г ChronoFlex Al 85A (CT Biomaterials) в 100 мл смеси DMAC:ТГФ (50:50) при 50°С при перемешивании. После растворения раствор полимера охлаждали до комнатной температуры. 20 мг митоксантрона добавляли к 2 мл раствора полиуретана. Раствор перемешивали до получения гомогенной смеси. Тимпаностомическую трубку из нержавеющей стали погружали в раствор полимера/лекарственного препарата и затем извлекали. Покрытую трубку высушивали на воздухе (80°С). Затем образец высушивали в вакууме для дополнительного уменьшения остаточного содержания растворителя в покрытии.
Пример 12
Ковалентное прикрепление доксорубицина к покрытому полимером устройству
Кусок полиуретановой трубки Френча 7 со стадии предварительной обработки кислородной плазмой и без этой стадии погружали в 5% (мас./мас.) раствор поли(этилен-со-акриловой кислоты) в ТГФ. Образец высушивали при 45°С в течение 3 ч. Затем покрытую трубку погружали в раствор вода:метанол (30:70), который содержал 1-(3-диметиламинопропил)-3-этилкарбодиимид (EDC) и 20 мг/мл доксорубицина. Через различные интервалы времени (15 мин, 30 мин, 60 мин, 120 мин) трубку извлекали из раствора и высушивали при 60°С в течение 2 ч с последующим высушиванием в вакууме в течение 24 ч.
Пример 13
Ковалентное прикрепление доксорубицина к поверхности устройства
Кусок полиуретановой трубки Френча 7, прошедшей стадию предварительной обработки кислородной плазмой, погружали в раствор вода:метанол (30:70), который содержал 1-(3-диметиламинопропил)-3-этилкарбодиимид (EDC) и 20 мг/мл доксорубицина. Через различные интервалы времени (15 мин, 30 мин, 60 мин, 120 мин) трубку извлекали из раствора и высушивали при 60°С в течение 2 ч с последующим высушиванием в вакууме в течение 24 ч.
Пример 14
Пропитывание 5-фторурацилом полиуретанового катетера
Раствор готовили растворением 100 мг 5-фторурацила в 20 мл безводного метанола. Полиуретановую катетерную трубку погружали в данный раствор на 16 ч. Катетерную трубку сушили в вакууме при 50°С в течение 16 ч.
Пример 15
Пропитывание митоксантроном полиуретанового катетера
Раствор готовили растворением 20 мг митоксантрона-2НCl в 20 мл безводного метанола. Полиуретановую катетерную трубку погружали в данный раствор на 16 ч. Катетерную трубку сушили в вакууме при 50°С в течение 16 ч.
Пример 16
Пропитывание доксорубицином полиуретанового катетера
Раствор готовили растворением 20 мг доксорубицина-HCl в 20 мл безводного метанола. Полиуретановую катетерную трубку погружали в данный раствор на 16 ч. Катетерную трубку сушили в вакууме при 50°С в течение 16 ч.
Пример 17
Покрытие полиуретана 5-фторурацилом погружением
Раствор готовили растворением 125 мг 5-фторурацила и 2,5 г ChronoFlex Al 85A (CT Biomaterials) в 50 мл ТГФ при 55°С. Раствор охлаждали до комнатной температуры. Полиуретановые катетеры взвешивали в одном конце и погружали в раствор и затем сразу же извлекали. Данную процедуру повторяли три раза с 1 мин интервалом высушивания между каждым погружением. Катетерную трубку сушили в вакууме при 50°С в течение 16 ч.
Пример 18
Покрытие полиуретана 5-фторурацилом и пальмитиновой кислотой погружением
Раствор готовили растворением 125 мг 5-фторурацила, 62,5 мг пальмитиновой кислоты и 2,437 г ChronoFlex Al 85A (CT Biomaterials) в 50 мл ТГФ при 55°С. Раствор охлаждали до комнатной температуры. Полиуретановый катетер отягощали с одного конца и погружали в раствор и затем сразу же извлекали. Данную процедуру повторяли три раза с 1 мин интервалом высушивания между каждым погружением. Катетерную трубку сушили в вакууме при 50°С в течение 16 ч.
Пример 19
Покрытие катетера нафионом и митоксантроном погружением
Катетеры отягощали с одного конца и погружали в 5% раствор нафиона (Dupont) и затем сразу же извлекали. Данную процедуру повторяли три раза с 1 мин интервалами высушивания между каждым погружением. Катетерную трубку высушивали при комнатной температуре в течение 2 ч. Готовили раствор 1 мг митоксантрона-2HCl в 40 мл деионизированной воды. Катетерную трубку погружали в раствор на 5 мин и затем промывали деионизированной водой и высушивали при комнатной температуре.
Пример 20
Покрытие катетера нафионом и доксорубицином погружением
Катетеры отягощали с одного конца и погружали в 5% раствор нафиона (Dupont) и затем сразу же извлекали. Данную процедуру повторяли три раза с 1 мин интервалами высушивания между каждым погружением. Катетерную трубку высушивали при комнатной температуре в течение 2 ч. Готовили раствор 1 мг доксорубицина-HCl в 40 мл деионизированной воды. Катетерную трубку погружали в раствор на 5 мин и затем промывали деионизированной водой и высушивали при комнатной температуре.
Пример 21
Приготовление буфера для высвобождения
Буфер для высвобождения готовили добавлением 8,22 г хлорида натрия, 0,32 г первичного кислого фосфата натрия (моногидрата) и 2,60 г вторичного кислого фосфата натрия (безводного) в стакан. Добавляли 1 л воды для ВЭЖХ и раствор перемешивали до растворения всех солей. Если необходимо рН раствора доводили до 7,4±0,2 с использованием 0,1 н. NaOH или 0,1 н. фосфорной кислоты.
Пример 22
Исследование профиля высвобождения терапевтического средства из катетера
Образец нагруженного лекарственным препаратом катетера помещали в культуральную пробирку емкостью 15 мл. В культуральную пробирку вносили 15 мл буфера для высвобождения (пример 21). Трубку закрывали тефлоновой завинчивающейся пробкой и помещали на карусельный стол термостата при 37°С. Через различные интервалы времени буфер извлекали из культуральной пробирки и замещали свежим буфером. Затем изъятую порцию буфера анализировали для определения количества терапевтического средства, содержащегося в данном буферном растворе.
Пример 23
Анализ ВЭЖХ терапевтических средств в буфере для высвобождения
Для количественного определения терапевтического средства в среде для высвобождения использовали следующие условия хроматографии:
| Лекарственное средство |
Колонка |
Подвижная фаза |
Скорость потока (мл/мин) |
Время выхода (мин) |
Объем введения (мкл) |
Длина волны определения (нм) |
| 5-Фторурацил |
YMC ODS-AQ 150x4,6 мм, 5 мкм |
Физиологический раствор, рН 6,8 |
1 |
8 |
100 |
268 |
| Доксорубицин |
ACE 5 (V02-742) 150x4 мм |
20% CAN, 26% метанола, 54% физиологического раствора (рН 3,6) |
1 |
10 |
10 |
254 |
| Митоксантрон |
ACE 5 C18, 150x4 мм, 5 мкм |
Фосфатный буфер, рН 2,3 |
1 |
4 |
10 |
658 |
Пример 24
Влияние пальмитиновой кислоты на профиль высвобождения 5-фторурацила из полиуретановой пленки
Готовили 25% (мас./об.) раствор ChronoFlex Al 85A (CT Biomaterials) в ТГФ. Отвешивали 50 мг 5-фторурацила в каждый из 4 стеклянных флаконов для сцинтилляции. В каждый флакон вносили различное количество пальмитиновой кислоты. В каждый флакон для сцинтилляции добавляли 20 мл раствора полиуретана. Пробы вращали при 37°С до растворения твердых веществ. Затем пробы формовали в виде пленок с использованием формовочного ножа на кусочках покрытия. Пробы сушили на воздухе и затем в течение ночи сушили в вакууме. Часть данных проб использовали для проведения исследований по высвобождению (пример 22). На чертеже 1 показано влияние пальмитиновой кислоты на профиль высвобождения 5-фторурацила.
Пример 25
Тест радиальной диффузии для тестирования пропитанных лекарственным препаратом катетеров против различных штаммов бактерий
Ночную культуру бактерий разводили от 1 до 5 до конечного объема 5 мл свежим бульоном Mueller Hinton. Затем 100 мкл разбавленной культуры бактерий высевали на чашках с агаром Mueller Hinton. Тестируемый материал (например, катетерную трубку) с лекарственным препаратом и без препарата помещали в центр чашки. Например, катетеры представляли собой, как правило, образцы длиной 1 см и диаметром примерно 3 мм (которые могли быть изготовлен из полиуретана, силикона и другого подходящего материала) и нагружали препаратом посредством покрытия погружением или использования пропитанной препаратом оболочки. Чашки инкубировали при 37°С в течение 16-18 ч. Измеряли зону осветления вокруг тестируемого материала (например, расстояние от катетера до места ингибирования роста бактерий), которая указывала на степень подавления роста бактерий. Можно тестировать различные штаммы бактерий, которые включают, но не ограничиваются следующими: E. coli C498 UB1005, P. aeruginosa H187, S. aureus C622 ATCC 25923 и S. epidermidis C621.
Определяли активность образцов полиуретановых катетеров размером 1 см, покрытых 5-фторурацилом, в нескольких концентрациях (2,5 мг/мл и 5,0 мг/мл) против S. aureus. Зона подавления роста вокруг катетеров, покрытых раствором 5-фторурацила с концентрацией 2,5 мг/мл и помещенных на чашки с агаром Mueller Hinton, как описано выше, равнялась 35×39 мм, а вокруг катетеров, покрытых раствором 5-фторурацила с концентрацией 5,0 мг/мл, равнялась 30×37 мм. Для катетеров без лекарственного препарата зона подавления роста отсутствовала. Данные результаты показывают эффективность покрытия катетера 5-фторурацилом по ингибированию роста S. aureus.
Из вышепредставленного становится очевидным, что, несмотря на описанные конкретные варианты воплощения изобретения в целях иллюстрации, могут быть сделаны различные модификации без отступления от сущности и объема изобретения. Следовательно, изобретение не ограничивается ничем иным, кроме прилагаемой формулы изобретения.
Формула изобретения
1. Медицинский имплантат, характеризующийся тем, что включает фторпиримидин или композицию, содержащую фторпиримидин, причем фторпиримидин присутствует в количестве, эффективном для снижения или подавления инфекции, связанной с медицинским имплататом.
2. Медицинский имплантат по п.1, отличающийся тем, что указанный имплантат обернут или покрыт полностью или частично композицией, содержащей фторпиримидин.
3. Медицинский имплантат по п.1 или 2, отличающийся тем, что указанный фторпиримидин представляет собой 5-фторурацил.
4. Медицинский имплантат по п.1 или 2, отличающийся тем, что указанный имплантат содержит от 1,0 мкг до 250 мг фторпиримидина.
5. Медицинский имплантат по п.4, отличающийся тем, что указанный имплантат содержит от 10 мкг до 25 мг фторпиримидина.
6. Медицинский имплантат по п.1 или 2, отличающийся тем, что указанный имплантат содержит от 0,1 мкг до 1 мг фторпиримидина на мм2 площади поверхности участка имплантата, на который нанесен или в который включен фторпиримидин.
7. Медицинский имплантат по п.6, отличающийся тем, что указанный имплантат содержит от 1 до 50 мкг фторпиримидина на мм2 площади поверхности участка имплантата, на который нанесен или в который включен фторпиримидин.
8. Медицинский имплантат по п.1 или 2, отличающийся тем, что указанный фторпиримидин присутствует в количестве, эффективном для снижения или подавления роста бактерии, связанного с медицинским имплантатом.
9. Медицинский имплантат по п.8, отличающийся тем, что бактерии являются резистентными к действию антибиотиков.
10. Медицинский имплантат по п.1 или 2, отличающийся тем, что указанный фторпиримидин присутствует в количестве, эффективном для снижения или подавления бактериальной колонизации медицинского имплантата.
11. Медицинский имплантат по п.1 или 2, отличающийся тем, что композиция дополнительно содержит один или более полимеров.
12. Медицинский имплантат по п.11, отличающийся тем, что композиция содержит бионеразлагаемый полимер.
13. Медицинский имплантат по п.12, отличающийся тем, что указанный бионеразлагаемый полимер выбирают из полиуретанов, акриловых или метакриловых сополимеров, целлюлозы или полимеров на основе производных целлюлозы, и их смесей.
14. Медицинский имплантат по п.13, отличающийся тем, что указанный полиуретан представляет собой поли(карбонатуретан) поли(сложный эфир уретана) или поли(простой эфир уретана).
15. Медицинский имплантат по п.13, отличающийся тем, что полимер на основе производного целлюлозы выбирают из нитроцеллюлозы, ацетобутирата целлюлозы и ацетопропионата целлюлозы.
16. Медицинский имплантат по п.13, отличающийся тем, что указанный имплантат содержит полиуретан и нитроцеллюлозу.
17. Медицинский имплантат по п.1 или 2, отличающийся тем, что указанный медицинский имплантат представляет собой искусственный сердечный клапан, кардиостимулятор, имплантируемый дефибриллятор сердца, сосудистый имплантат, ушной, носовой или горловой имплантат, урологический имплантат, эндотрахеальную или трахеостомическую трубку, катетер для диализа, шунт для ЦНС, ортопедический имплантат или глазной имплантат.
18. Медицинский имплантат по п.1 или 2, отличающийся тем, что указанный медицинский имплантат представляет собой катетер.
19. Медицинский имплантат по п.18, отличающийся тем, что катетер представляет собой сосудистый катетер.
20. Медицинский имплантат по п.19, отличающийся тем, что сосудистый катетер представляет собой катетер для центральных вен.
21. Медицинский имплантат по п.19, отличающийся тем, что сосудистый катетер представляет собой катетер для периферических вен.
22. Медицинский имплантат по п.18, отличающийся тем, что катетер представляет собой желудочно-кишечный катетер для длительного ношения, катетер для диализа, мочеполовой катетер для длительного ношения или мочевой катетер.
23. Медицинский имплантат по п.18, отличающийся тем, что катетер представляет собой катетер для гемодиализа.
24. Медицинский имплантат по п.18, отличающийся тем, что катетер выполнен из полиуретана.
25. Медицинский имплантат по п.1 или 2, отличающийся тем, что указанный медицинский имплантат представляет собой нить или шовный материал.
26. Медицинский имплантат по п.1 или 2, отличающийся тем, что указанный медицинский имплантат дополнительно содержит второе противоинфекционное средство.
27. Медицинский имплантат по п.26, отличающийся тем, что указанное противоинфекционное средство представляет собой антибиотик.
28. Медицинский имплантат по п.26, отличающийся тем, что указанное противоинфекционное средство представляет собой противогрибковое средство.
29. Медицинский имплантат по п.1 или 2, отличающийся тем, что указанный медицинский имплантат дополнительно содержит средство против тромбообразования или противотромбоцитарное средство.
30. Медицинский имплантат по п.29, отличающийся тем, что указанное средство против тромбообразования или противотромбоцитарное средство выбирают из гепарина, декстрана сульфата, данапароида, лепирудина, гирудина, АМФ, аденозина, 2-хлораденозина, аспирина, фенилбутазона, индометацина, меклофенамата, гидрохлорохина, дипиридамола, илопроста, тиклопидина, клопидогрела, абциксамаба, эптифибатида, тирофибана, стрептокиназы и/или активатора тканевого плазминогена.
31. Медицинский имплантат по п.1, отличающийся тем, что имплантат представляет собой катетер для центральных вен, изготовленный из полиуретанта и покрытый композицией, содержащей полиуретан, нитроцелюлозу и 5-фторурацил в количестве от 0,1 мкг до 1 мг на мм2 площади поверхности участка катетера, на который нанесен или в который включен 5-фторурацил, и катетер высвобождает 5-фторурацил в количестве, эффективном для снижения или подавления инфекции, связанной с катетером.
32. Медицинский имплантат по п.31, отличающийся тем, что катетер содержит внутрисосудистый участок, и покрытие находится на внешней поверхности внутрисосудистого участка.
33. Медицинский имплантат по п.1, отличающийся тем, что имплантат представляет собой катетер для гемодиализа, изготовленный из полиуретанта и покрытый композицией, содержащей полиуретан, нитроцелюлозу и 5-фторурацил в количестве от 0,1 мкг до 1 мг на мм2 площади поверхности участка катетера, на который нанесен или в который включен 5-фторурацил, и катетер высвобождает 5-фторурацил в количестве, эффективном для снижения или подавления инфекции, связанной с катетером.
34. Способ изготовления медицинских имплантатов, включающий обертывание, покрытие, комбинирование, загрузку, связывание или пропитывание медицинского имплантата фторпиримидином или композицией, содержащей фторпиримидин, в количестве, эффективном для снижения или подавления инфекции, связанной с медицинским имплататом.
35. Способ по п.34, отличающийся тем, что указанный медицинский имплантат покрывают погружением, распылением или пропитыванием.
36. Способ по п.34 или 35, отличающийся тем, что указанный фторпиримидин представляет собой 5-фторурацил.
37. Способ по п.34 или 35, отличающийся тем, что указанный имплантат содержит от 1,0 мкг до 250 мг фторпиримидина.
38. Способ по п.37, отличающийся тем, что указанный имплантат содержит от 10 мкг до 25 мг фторпиримидина.
39. Способ по п.34 или 35, отличающийся тем, что указанный имплантат содержит от 0,1 мкг до 1 мг фторпиримидина на мм2 площади поверхности участка имплантата, на который нанесен или в который включен фторпиримидин.
40. Способ по п.39, отличающийся тем, что указанный имплантат содержит от 1 до 50 мкг фторпиримидина на мм2 площади поверхности участка имплантата, на который нанесен или в который включен фторпиримидин.
41. Способ по п.34 или 35, отличающийся тем, что указанный фторпиримидин присутствует в количестве, эффективном для снижения или подавления роста бактерий, связанного с медицинским имплантатом.
42. Способ по п.41, отличающийся тем, что бактерии являются резистентными к действию антибиотиков.
43. Способ по п.34 или 35, отличающийся тем, что указанный фторпиримидин присутствует в количестве, эффективном для снижения или подавления бактериальной колонизации медицинского имплантата.
44. Способ по п.34 или 35, отличающийся тем, что композиция дополнительно содержит один или более полимеров.
45. Способ по п.44, отличающийся тем, что композиция содержит бионеразлагаемый полимер.
46. Способ по п.45, отличающийся тем, что указанный бионеразлагаемый полимер выбирают из полиуретанов, акриловых или метакриловых сополимеров, целлюлозы или полимеров на основе производных целлюлозы, и их смесей.
47. Способ по п.46, отличающийся тем, что указанный полиуретан представляет собой поли(карбонатуретан) поли(сложный эфир уретана) или поли(простой эфир уретана).
48. Способ по п.46, отличающийся тем, что полимер на основе производного целлюлозы выбирают из нитроцеллюлозы, ацетобутирата целлюлозы и ацетопропионата целлюлозы.
49. Способ по п.46, отличающийся тем, что указанный имплантат содержит полиуретан и нитроцеллюлозу.
50. Способ по п.34 или 35, отличающийся тем, что указанный медицинский имплантат представляет собой искусственный сердечный клапан, кардиостимулятор, имплантируемый дефибриллятор сердца, сосудистый имплантат, ушной, носовой или горловой имплантат, урологический имплантат, эндотрахеальную или трахеостомическую трубку, катетер для диализа, шунт для ЦНС, ортопедический имплантат или глазной имплантат.
51. Способ по п.34 или 35, отличающийся тем, что указанный медицинский имплантат представляет собой катетер.
52. Способ по п.51, отличающийся тем, что катетер представляет собой сосудистый катетер.
53. Способ по п.52, отличающийся тем, что сосудистый катетер представляет собой катетер для центральных вен.
54. Способ по п.52, отличающийся тем, что сосудистый катетер представляет собой катетер для периферических вен.
55. Способ по п.51, отличающийся тем, что катетер представляет собой желудочно-кишечный катетер для длительного ношения, катетер для диализа, мочеполовой катетер для длительного ношения или мочевой катетер.
56. Способ по п.51, отличающийся тем, что катетер представляет собой катетер для гемодиализа.
57. Способ по п.51, отличающийся тем, что катетер выполнен из полиуретана.
58. Способ по п.34 или 35, отличающийся тем, что указанный медицинский имплантат представляет собой нить или шовный материал.
59. Способ по п.34 или 35, отличающийся тем, что указанный медицинский имплантат дополнительно содержит второе противоинфекционное средство.
60. Способ по п.59, отличающийся тем, что указанное противоинфекционное средство представляет собой антибиотик.
61. Способ по п.59, отличающийся тем, что указанное противоинфекционное средство представляет собой противогрибковое средство.
62. Способ по п.34 или 35, отличающийся тем, что указанный медицинский имплантат дополнительно содержит средство против тромбообразования или противотромбоцитарное средство.
63. Способ по п.62, отличающийся тем, что указанное средство против тромбообразования или противотромбоцитарное средство выбирают из гепарина, декстрана сульфата, данапароида, лепирудина, гирудина, АМФ, аденозина, 2-хлораденозина, аспирина, фенилбутазона, индометацина, меклофенамата, гидрохлорохина, дипиридамола, илопроста, тиклопидина, клопидогрела, абциксамаба, эптифибатида, тирофибана, стрептокиназы и/или активатора тканевого плазминогена.
64. Способ по п.34, отличающийся тем, что имплантат представляет собой катетер для центральных вен, изготовленный из полиуретанта и покрытый композицией, содержащей полиуретан, нитроцелюлозу и 5-фторурацил в количестве от 0,1 мкг до 1 мг на мм2 площади поверхности участка катетера, на который нанесен или в который включен 5-фторурацил, и катетер высвобождает 5-фторурацил в количестве, эффективном для снижения или подавления инфекции, связанной с катетером.
65. Способ по п.64, отличающийся тем, что катетер содержит внутрисосудистый участок, и покрытие находится на внешней поверхности внутрисосудистого участка.
66. Способ по п.34, отличающийся тем, что имплантат представляет собой катетер для гемодиализа, изготовленный из полиуретанта и покрытый композицией, содержащей полиуретан, нитроцелюлозу и 5-фторурацил в количестве от 0,1 мкг до 1 мг на мм2 площади поверхности участка катетера, на который нанесен или в который включен 5-фторурацил, и катетер высвобождает 5-фторурацил в количестве, эффективном для снижения или подавления инфекции, связанной с катетером.
67. Композиция для нанесения покрытия на медицинский имплантат, содержащая один или более полимеров и фторпиримидин, характеризующаяся тем, что покрытый медицинский имплантат высвобождает фторпиримидин в количестве, эффективном для снижения или подавления роста бактерий в тесте радиальной диффузии.
68. Композиция по п.67, отличающаяся тем, что один или более полимеров содержат бионеразлагаемый полимер.
69. Композиция по п.67, отличающаяся тем, что один или более полимеров содержат полиуретан.
70. Композиция по п.69, отличающаяся тем, что указанный полиуретан представляет собой поли(карбонатуретан) поли(сложный эфир уретана) или поли(простой эфир уретана).
71. Композиция по пп.67-70, отличающаяся тем, что один или более полимеров содержат целлюлозу или полимер на основе производных целлюлозы.
72. Композиция по п.71, отличающаяся тем, что полимер на основе производного целлюлозы выбирают из нитроцеллюлозы, ацетобутирата целлюлозы и ацетопропионата целлюлозы.
73. Композиция по п.67, отличающаяся тем, что один или более полимеров содержит полиуретан, акриловый или метакриловый сополимер, целлюлозу или полимер на основе производных целлюлозы, или их смесь.
74. Композиция по п.67, отличающаяся тем, что один или более полимеров содержат полиуретан и нитроцеллюлозу.
75. Композиция по п.67, отличающаяся тем, что указанный фторпиримидин представляет собой 5-фторурацил.
76. Композиция по любому из пп.67-70, отличающаяся тем, что композиция предназначена для покрытия нанесения на катетер.
77. Композиция по п.76, отличающаяся тем, что катетер представляет собой сосудистый катетер.
78. Композиция по п.77, отличающаяся тем, что сосудистый катетер представляет собой катетер для центральных вен.
79. Композиция по п.76, отличающаяся тем, что катетер представляет собой катетер для гемодиализа.
80. Композиция по любому из пп.67-70, отличающаяся тем, что композиция предназначена для нанесения покрытия на нить или шовный материал.
81. Композиция по п.69 или 70, отличающаяся тем, что содержит
полиуретан, целюлозу или полимер на основе производного целлюлозы и 5-фторурацил.
82. Композиция по любому из пп.68-70, отличающаяся тем, что находится в форме спрея, гидрогеля или раствора.
83. Медицинский имплантат по п.1 или 2, отличающийся тем, что указанный имплантат высвобождает фторпиримидин в концентрации, эффективной для снижения или подавления инфекции, связанной с медицинским имплантатом, в течение периода времени в пределах 1-30 сут.
|