
СПИСОК ПАТЕНТОВ С УПОМИНАНИЕМ ГИАЛУРОНОВОЙ КИСЛОТЫ
-
- 2017751 Способ получения гиалурона
- 2192150 БАД для профилактики йодной недостаточности
- 2112542 Препарат для лечения патологий соединительных тканей
- 2225206 Препарат для лечения рака молочной железы
- 2299733 Лечение опорно-двигательного аппарата
- 2299732 Способ лечения глаукомы
- 2299726 Противоинфекционная губная помада
- 2299725 Косметическое средство для ухода за кожей
- 2198878 Ароматическое соединение
- 2198702 Способ подготовки трофических язв к аутодермапластике
- 2198653 Вагинальные суппозитории
- 2197946 Композиция для ухода за волосами
- 2197923 Фармацевтическая композиция для лечения отеков роговицы
- 2298410 Биотрансплантант и способ лечения ревматических и аутоиммунных заболеваний
- 2197501 Фотоотверженный гель на основе сшитой гиалуроновой кислоты
- 2197228 Твердые лекарственные формы
- 2197222 Водная компазиция для ухода за волосами, лица и тела
- 2297425 Полипептиды
- 2297240 Композиция с гиалуроновой кислотой
- 2297230 Фармацевтическая компазиция с ксантоновой смолой
- 2196588 Глазные капли
- 2195955 Применение биологически активных веществ
- 2195926 Дерматологические композиции
- 2295954 Микрочастицы для доставки нуклеиновых кислот
- 2295951 Косметика для ухода за кожей лица и век
- 2195262 Фармакологическое средство на основе гиалуроновой кислоты
- 2194512 Способ профилактики и коррекции процесса старения кожи
- 2194478 Лечение экземы
- 2294716 Расширяемый стент
- 2194055 Сшитые сополимеры
- 2099350 Ассоциаты депротонированной гиалуроновой кислоты
- 2293557 Средство для лечения кожи и слизистых
- 2292878 Приготовление микроцастиц, содержащих метопропол
- 2292746 БАД
- 2192256 Защита кишечника
- 2191782 Получение модифицированной гиалуроновой кислоты
- 2292219 Паратиреоидный гормон человека
- 2291686 Микроцастицы
- 2191000 Косметическая маска
- 2290921 Фармацевтические и косметические средства против старения кожи
- 2290900 Модифицированный биоматериал для использования в офтальмологии
- 2290899 Получение биоматерьяла
- 2290397 Новые инданилиденовые соединения
- 2290186 Лечение сирингомиелии
- 2288702 Иррингационный раствор для офтальмологии
- 2288699 Гель для лечения стоматологических заболеваний
- 2188011 Активирующая остеогенез фармацевтическая композиция
- 2187327 Средство с антисептиком
- 2187325 Средство с радиопротекторным действием
- 2287330 Композиции миноксидила
- 2186786 Способ получения гиалуроновой кислоты
- 2186593 Лечение раненого процесса кожи
- 2286801 Очищение воды
- 2286781 Лечение ожогов пищевода у детей
- 2286764 Средство лечения воспалений полости рта
- 2185840 Лечение инфекционных заболеваний
- 2286151 Альфа-2-Дельта-Лиганда
- 2185149 Ранозаживляющий гель
- 2285527 Лечение ИЛ-6 заболеваний
- 2184448 Раствор хранения роговицы, включающий гиалуроновую кислоту
- 2090179 Крем для кожи
- 2183961 Способ лечения кожи
- 2284331 Соли алифотических аминов
- 2284187 Производные амида
- 2089191 Снизить внутрение давление
- 2283320 Получение гликозаминогликанов
- 2283129 Лечение опухолей
- 2283098 Косметические средства с Q
- 2182574 Ароматические соединения
- 2088257 Средство с гипохолестеролемическим действием
- 2088218 Состав для гигиенических салфеток
- 2088206 Способ получения препарата, создающего исскуственный загар
- 2282462 Противомикробные средства
- 2182008 Интровагинальная компазиция
- 2181999 Препарат с отсроченным высвобождением
- 2181998 Новые композиции липидов
- 2181995 Лечение болевого синдрома
- 2181295 Вирионная вакцина
- 2087144 Витамин Е
- 2379336 Способ стирки
- 2379052 Вакцинация
- 2180855Композиция в виде ионного комплекса
- 2379025 Противоинфекционный гель
- 2180825 Лечение травм роговицы
- 2281082 Способ коррекции эстетических и возрастных проблем кожи
- 2180576 Биоактивная добавка для косметических средств
- 2280459 Средство для изменения скорости роста или репродукции клеток
- 2179981 Соли переходного металла
- 2378010 Жидкие вакцины
- 2378008 Комбинированные вакцины
- 2378007 Анаболическое средство
- 2377973 Растительные экстракты
- 2280041 Способ получения водорастворимых комплексов гиалурил
- 2280038 Биополимеры
- 2323733 Йодный обмен
- 2377260 Гель
- 2178693 Противовирусное средство на основе гиалуроновой кислоты
- 2178692 Облегчающие зуд косметическое средство
- 2377022 Гемостатические спреи
- 2376982 Увлажняющая сыворотка для лица
- 2376974 Трансдермальный гель для лица
- 2362784 Гипо-и гиперацетилированные менингокковые капсульные сахариды
- 2177789 Устройство для доставки лекарства к шейке матки
- 2277954 Крем для лица омолаживающий
- 2376378 Способ получения метионина
- 2177332 Биоматериал для предотвращения послеоперационных спаек, с производной гиалуроновой кислотой
- 2177310 Способ получения таблеток
- 2376011 Средство для позвоночника
- 2277410 Косметическое средство
- 2323748 Медицинская повязка
- 2276998 Гидрогелевые композиции
- 2082416 Способ получения препарата с коллагенном из животного сырья
- 2375081 Адсорбирующее изделие
- 2375049 Охлаждающий пластырь
- 2346049 Способ получения гиалурона
- 2275913 Фармацевтические средства
- 2174985 Полисахарид с антиоксидантом
- 2373957 Носитель для лекарственных средств и биологически активных веществ
- 2373941 Способ коррекции возрастных и патологических изменений кожных покров
- 2174845 Композиции и способы доставки генетического материала
- 2174830 Средство для укрепления волос
- 2373769 Синбиотическая композиция
- 2274472 Лечение апорно-двигательного аппарата и болевых синдромов
- 2372929 Профилактическая композиция на основе веществ фенольной природы в липосомной форме
- 2173563 Способ нанесения на поверхность предметов покрытия на основе гиалуроновой кислоты, её производных и полусинтетических полимеров
- 2079304 фармацевтическая композиция, обладающая иммуносупрессорной и антимикробной активностью
- 2273645 Полипептид ожирения
- 2173154 Фракция кератансульфатолигосахаридов и содержащий ее фармацевтический препарат
- 2173136 Грязная мазь
- 2173128 Способ хирургического лечения центральных разрывов сечатки
- 2078561 Косметическое средство предотвращающее старение кожи
- 2172490 Способ прогнозирования воспалительных заболеваний молочной железы при эндопластике
- 2272645 Способ лечения ЦМВ-Инфекции у детей раннего возроста
- 2272636 Фармацевтическая композиция для местного лечения воспаления
- 2272635 Фармацевтически активная субстанция для офтальмологии
- 2272599 Биоматерьял для стабилизации прогрессирующей миопии "Коллаплант"
- 2172168 Средство для заживления ран на основе гиалуроновой кислоты
- 2371172 Фармацевтическая композиция для лечения нервной системы на основе стефаглабрина
- 2171470 Способ прогнозирования послеоперационной трансформации доброкачественных опухолей нервной системы
- 2077317 Состав для ванн
- 2271213 Комбинированные композиции, содержащие экстракты из растений и морских животных
- 2076872 Способ получения окрашенной гиалуроновой кислоты
- 2076671 Раствор для защиты роговицы
- 2370281 Конъюгаты гидроксиалкилкрахмал
- 2370275 Способ лечения (коррекции) косметических и возрастных дефектов кожи
- 2370258 Фармацевтическая композиция для парентальной доставки в форме лиофилизата
- 2270023 Способ экстракции и очистки протеогликана хрящего типа (варианты)
- 2369408 Гемостатическая композиция, включающая гиалуроновую кислоту
- 2369387 Фармацевтическая композиция для лечения нервной системы
- 2369379 Нетаблитированные жевательные формы для индивидуального введения
- 2169136 Производное коричной кислоты
- 70792 Медицинский аппликатор
- 20741717 Способ стабилизации аскорбиновой кислоты
- 2074712 Способ получения препарата, препятствующего преждевременной эякуляции
- 2367954 Способ прогнозирования развития кожной патологии у женщин с синдромом склерополикистозных яичников (СПКЯ)
- 2268075 Устройство для электрокинетической доставки
- 2268052 Средство для лечения воспалительных и дегенеративных заболеваний суставов
- 2167649 Способ получения твердой дисперсии умеренного водорастворимого лекарственного вещества
- 2167647 Гель для бритья
- 2073520 Лечение урологических инфекций
- 2367476 Биопластический материал
- 2367475 Мембрана для использования при направленной регенерации тканей
- 2367469 Фармацевтическая композиция на основе лизоамидазы
- 2367456 Фармацевтическая композиция обладающая антибактериальным и некролитическим действием
- 2367455 Фармацевтическая композиция обладающая некролитическим и антибактериальным действием
- 2267324 Применение антиадгезивных углеводов, препарат для уменьшения и /или блокирования адгезии патогенных веществ
- 2166934 Композиции включающие биологический агент
- 2166510 Псевдодипептиды
- 2366460 Композиции, имеющие высокую противовирусную и антибактериальную активность
- 2360901 Производные феноксиуксусной кислоты
- 2165749 Способ восстановления эндотелия роговицы
- 2265441 Способ укрепления склеры
- 2365382 Композиции и способы для регуляции развития сосудов
- 2070879 Соли гликозаминогликанов
- 2164914 Циклические и гетероциклические N - замещенные - иминогидроксамовые карбоновые кислоты
- 2264627 Хламидийный конъюктивит
- 2364399 Фармацевтический препарат на основе стефаглабрина
- 2264230 Препарат с замедленным высвобождением активного вещества
- 2363497 Фармацевтические композиции
- 2363496 Способ увеличения объема мягких тканей
- 2363473 Способ антифлогистической активации в эксперементе
- 2363461 Фармацевтический препарат на основе сигетина
- 2363459 Средства для введения в роговицу глаз для предотвращения офтальмологических нарушений
- 2363448 Фармацевтические композиции
- 2163123 Глазные капли
- 2162687 Усовершенствованнная лекарственная форма индуктора интерферана
- 2162343 Биосовместимый полимерный материал и способ его получения
- 2162327 Лечение рака
- 2067841 Способ получения ароматизатора
- 2161478 Способ консервированого лечения гонартроза
- 2361617 Вольфрамовые частицы в качестве рентгеноконтрастных веществ
- 2361552 Способы и устройства для дренирования жидкостей и понижения внутриглазного давления
- 2066996 Способ изготовления пленочного материала для офтальмохирургии
- 2361417 Корм с глюкозамином и экстрактом ивы для профилактики артроза у животных
- 2161002 Пищевой общеукрепляющий лечебно-профилактический продукт из хрящевой ткани акул
- 2360928 Комплексная матрица для медико-биологического применения
- 2160574 Способ лечения глаукомы
- 2360688 Способ лечения повреждений переферических нервов
- 2360670 Фармацевтическая композиция при климактерических расстройствах
- 2360646 Эндолюминальный протез
- 2260445 Способ усовершенствования транспортировки через легко прспосабливаемый полупроницаемый барьер
- 2260007 Производные амида
- 2359975 Способ получения модифицированных арабиногалактанов
- 2359974 Антигенные Пептиды
- 2159775 Псевдопептидный продукт
- 2259833 Фармацевтическая композиция для лечения роговицы глаза
- 2259816 Ранозаживляющее средство
- 2259815 Способ коррекции возрастных изменений, связанных с процессами старения кожи
- 2359706 Способ сохранения офтальмологических растворов
- 2359704 Антисептическое средство
- 2359662 Микрокапсулы
- 2159253 Катионные полимеры
- 2159111 Средство для ухода за кожей лица
- 2159105 Композиция для защиты кожи от опасных химических веществ Получение
- 2158593 Биосовместимый водный раствор
- 2358728 Способ лечения и предупреждения потери костной ткани
- 2258517 Способ хирургического лечения травмотических повреждений селезенки пленкой на основе гиалуроновой кислоты
- 2357968 Кристалические формы производной имидазола
- 2357957 Ингибиторы P38 и их применение
- 2157647 Пищевая добавка и ее получение
- 2357758 Препараты для чрескожной и чересслизистой добавки
- 2063244 Способ стабилизации растворов
- 2063140 Способ получения препарата для консервирования мяса
- 2157381 Способ получения гиалуроновой кислоты
- 2257198 Композиции микроцастиц
- 2356909 Белковый комплекс
- 2356570 Косметическая композиция
- 2256434 Способ закрытия перфорации барабанной перепонки
- 2356520 Способ лечения постконтузионного повреждения сечатки глаза
- 2156133 Гель
- 2255945 Полимерная композиция
- 2355761 Средства повторной дифференцировки
- 2061043 Способ повышения устойчивости урокиназы к нагреванию
- 2061005 Способ получения красителей для гистологических исследований
- 2355420 Зубная паста
- 2355385 Композиции пролонгированного действия с контролируемым высвобождением
- 2355240 Способ получения пищевого препарата хондропротекторного действия
- 2155057 Пихтово репейный бальзам
- 2354409 Способ производства высвобождающих лекарственные средчтва медицинских устройств
- 2254145 Раневое покрытие на основе коллаген-хитозанового комплекса
- 2254133 Лечение и профилактика ВИЧ-инфекции у человека
- 2253439 Фармацевтическая композиция для защиты и улучшения оптических свойств роговици при проведении эндовитреальных вмешательств
- 2253437 Способ омоложения кожи
- 2153352 Фармацевтическая композиция обладающая ранозаживляющим и противовоспалительным действием
- 2353354 Фармацевтический препарат на основе низкомолекулярного индуктора интерферона
- 2252787 Способ получения искусственной матрицы кожи
- 2252767 Способ нормализации иммунобиохимического гомеостаза коров в предродовом и послеродовом периодах
- 2352583 Фармацевтическая композиция содержащая Fc-область иммуноглобулина в качестве носителя
- 2152403 Модифицированные полисахариды
- 2352356 Иммуногенная композиция
- 2352342 Исскусственный физиологический солевый раствор Способ его получения
- 2352330 Фармацевтический препарат на основе низкомолекулярного индуктора интерферона
- 2352323 Фармацевтический препарат с модифицированным высвобождением
- 2152027 Способ подготовки ткани мозга для определения гликозаминогликанов
- 2251842 Интектицидный состав для борьбы с личинками оводов
- 2151580 Способ активации пролиферации эндотелия роговицы
- 2351648 Дифференцировка стромальных клеток, полученных из жировой ткани, в эндокринные клетки поджелудочной железы и их использование
- 2351595 N - гидроксиформамидные соединения в качестве ингибиторов металлопротеина
- 2251411 Косметическое средство в лиофилизированной фармацевтической форме
- 2251405 Косметика...ее композиции для косметических препаратов
- 2251367 Средство со сшитой гиалуроновой кислотой для наращивания тканей
- 2351359 Косметика для профилактики и лечения избыточной массы тела
- 2351322 Препарат на основе низкомолекулярного индуктора интерферона
- 2351153 Диета при остеортрите собак
- 2350958 Способ определения групповой принадлежности синовальной жидкости
- 2350625 Производные гиалуроновой кислоты с пониженной биодеградируемостью
- 2150266 Крем после бритья
- 2350354 Фармацевтическое средство содержащие антагонист и фактор некроза
- 2350340 Способ коррекции процессов регенерации
- 2350309 Способ лечения избыточной массы тела с помощью рефлексотерапии
- 2250047 Профилактический продукт из хрящевой ткани гидробионтов
- 2249467 Медицинский матерьял и изделия на его основе
- 2055079 Способ получения препарата гиалуроновой кислоты
- 2349599 Биоадгезив мидии
- 2054903 Способ лечения коллагеноза у бычков на откорме
- 2249210 Способ прогнозирования предрасположенности к развитию и тяжести течения деформирующего остеоартроза коленного сустава у взрослых
- 2349339 Средство для соединительной ткани
- 2148988 Человеческий интерферона
- 2148399 Лечение атеросклероза
- 2148396 Способ определения активного вещества в дифильных мазевых основах
- 2148375 Способ диагностики близорукости
- 2348415 Способ противоспаечной терапии после хирургического вмешательства
- 2348400 Препарат на основе низкомолекулярного индуктора интерферона
- 2348386 Способ непроникающего хирургического лечения первичной открытоугольной глаукомы
- 2248213 Лечение Галактозидальной А недостаточности
- 2347586 Микрофлюидизированные эмульсии типа "масло в воде" и вакцинные средства
- 2147243 Контрастное средство
- 2146526 Лечебный препарат дисбактериоза и урогенитальных инфекций
- 2146148 Терапевтическое применение фактора роста кератиноцитов (ФРК)
- 2146139 Способ повышения активности макрофагов и комбинации для его осуществления
- 2346277 Способ диагностики специфического синовита
- 2345793 Ультразвуковые контрастные вещества и их получение
- 2345782 Терапевтические комбинации на основе PORIFERA для лечения и предотвращения кожных заболеваний
- 2245131 Способ коррекции косметических недостатков кожи
- 2245130 Способ активации восстановительных процессов в коже
- 2144833 Хондроитиназа
- 2344809 Получение твердых дозированных форм с использованием сшитого нетермопластичного носителя
- 2244540 Косметический гель для ухода за кожей лица
- 2244536 Способ лечения дегенеративно-дистрофических заболеваний тазобедренного сустава
- 2344167 Хмелевый экстракт
- 2143884 Агент регулирования дифференциации клеток кожи, культурная среда для клеток или тканей и способ регулирования дифференциации клеток кожи
- 2343932 Способ получения обладающих пониженной растворимостью в воде пленночных материалов
- 2343903 Устройство доставки лекарств для контролируемого введения препаратов
- 2048817 Способ получения материала для лечения ожогов и гнойно - некронических ран
- 2048803 Гидратантный крем
- 2242974 Средства и способы лечения воспалительных заболнваний
- 2142816 Способ получения антигерпетической вакцины
- 2342923 Средство для обработки рук с увлажняющим эффектом
- 2142781 Косметика для макияжа ресниц и бровей и агент ингирирующий рост микроорганизмов в косметических средствах
- 2242251 Трансплантируемые стенты с биоактивными покрытиями
- 2142257 Способ обработки глазных имплантантов и контакных линз
- 2342389 Мононатриевая соль
- 2342107 Способ устранения западения верхнего века при анофтальме
- 2141828 Средство, пролонгирующее эффективность чесночного порошка
- 2241489 Косметическое средство матриксных протеинов для залечивания ран
- 2241443 Средство для лечения герпеса
- 2241414 Способ получения протезов кровеносных сосудов
- 2341539 Гидрогель
- 2141324 Регулятор скорости воздействия препарата для инъекций
- 2141312 Косметическое средство для ухода за кожей лица
- 2341296 Средства и способы покрытия медицинских имплантантов
- 2341272 Средство для неспецифической иммунотерапии
- 2341266 Стенты с нанесенным покрытием содержащим N - (5-(4-(4-
- 2341257 Иммуномодулирующее средство
- 2341255 Средство для лечения климактерических расстройств
- 2240821 Способ лечения урологических инфекций
- 2140786 Способ лечения лишая
- 2140243 Способ хирургического лечения диабетической ретинопатии и отслоек сечатной оболочки
- 2240140 Медицинская многослойная повязка и изделия на ее основе
- 2240135 Культура клеток, содержащая клетки - предшественники остеонегеза, имплантант на ее основе и его использование для восстановления целостности кости
- 2240123 Экзогенные биологически активные коньюгирующие вещества
- 2139886 Фотоотвержаемое производное гликозаминогликата, сшитое производное гликозаминогликата и способы их получения, способ предотвращения клеточной и тканевой адгезии
- 2139729 Вакцина. Способ стимулирования иммунной системы
- 2339386 Средство обладающее радио - и химиозащитным действием
- 2339369 Лечение офтальмологических нарушений с использованием мочевины и ее производных
- 2139041 Гидратантный регенерирующий крем и способ его получения
- 2139039 Косметический суперкрем для ухода за кожей
- 2139017 Способ получения боисовместимого материала
- 2138503 Производные камптотецина, способы их получения, уникальное средство
- 2338556 Средство содержащие антагонист Р2Х - рецептора и нестероидное противоспалительное лекарственное средство
- 2338514 Косметическое средство для профилактики старения кожи
- 2138297 Медицинские устройства, подверженные вызываемому разложению
- 2138295 Покрытие для ран
- 2337906 Ингибиторы цитозольной фосфолипазы А2 Применение физиологически допустимого корпускулярного ферримагнитного или ферромагнитного материала. Способ формирования магнитометрического изображения
- 2137501 Устройство формирования изображения
- 2137477 Способ лечения заболеваний характеризующихся аутоиммунной агрессией
- 2137467 Крем для кожи лица и тела
- 2137449 Способ коррекции дефектов преломления в глазу млекопитающего
- 2137402 Пищевая Добавка БАД
- 2336899 Способ стимуляции миелопоэза
- 2336862 Способ получения раствора для лечения роговицы
- 2336830 Способ восстановления костных структур челюсти
- 2136696 Новый полипептид и средство против ВИЧ - Инфекции
- 2336092 Биоадгезивное средство, по существу свободное от воды
- 2336089 Средство и способ лечения заболеваний периодонтальных и пульпы
- 2336074 Средства и способы лечения заднего сегмента глаза
- 2235548 Ранозаживляющее средство
- 2135186 Способ лечения рефлекторных синдромов при остеохондрозе
- 2234945 Стабилизатор водного раствора и водосодержащего сырья
- 2334762 Растворимая ассоциативная карбоксиметилцеллюлоза
- 2234514 Макропористые хитозановые гранулы и способ их получения. Способ культивирования клеток
- 2133615 Средство для лечения неврологических заболеваний
- 2233164 Способ профилактики развития послеоперационных спаек брюшной полости
- 2133127 Неткатный материал, способ его получения и способ лечения
- 2333223 Альдегидные производные сиаловой кислоты и средства на их основе
- 2333007 Полипептидные вакцины для широкой защиты против рядов поколений менингококов с повышенной вирулентностью
- 2332985 Дозированные формы анестезирующих средств с длительным высвобождением для обезболивания
- 2132677 Косметическая маска
- 38603 Пленочный аппликатор
- 2232594 Средство содержащие ингибирующие остеокластогенез фактор и полисахарид
- 2332238 Средство для прокладок, раневых повязок и других изделий, контактирующих с кожей
- 2331668 Стромальные клетки, получение из жировой ткани, для заживления дефектов роговицы и внутриглазных дефектов и их использование
- 2331438 Альфа - 2 - Дельта Лигант для лечения симптомов нижних мочевыводящих путей
- 2331411Электропряденые аморфные фармоцевтические средства
- 2331367 Способ профилактики образования спаек и их рецидива
- 2130767 Масло в воде для получения косметических и дерматологических средств, способ косметической обработки
- 2230752 Поперечносшитые гиалуроновые кислоты и их применение в медицине
- 2230558 Способ восстановления и сохранения здоровья скмьи
- 2230550 Средства длительного высвобождения, способ их получения и применения
- 2230458 Поддержания здоровья суставов
- 2330290 Способ определения состояния метаболических процессов в ткани суставного хряща
- 2230073 Способ поперечного сшивания карбоксилированных полисахаридов
- 2329059 Способ лечения полипозного риносинусита
- 2329037 Комбинированная терапия для лечения иммуновоспалительных заболеваний
- 2128666 Гиалуроновая кислота и ее соли, способ очистки гиалуроновой кислоты, способ получения гиалуроновой кислоты. Фармацевтический препарат с гиалуроновой кислотой и средства с гиалуроновой кислотой используемые в офтальмологии
- 2328740 Способ экспресс - оценки действия зубных паст
- 2128502 Косметический гель
- 2328272 Суппозитории индуктора интерферона
- 2328268 Косметика содержащая амфолитный сополимер
- 2128057 Композиционная мембрана, способ ее получения и способ направленной регенерации тканей с ее применением
- 2128055 Средство замедленного освобождения и способ его получения
- 2128049 Свечи
- 2227743 Полипептидные варианты с повышенной гепаринсвязывающей способностью
- 2326893 Ковалентное и нековалентное сшивание гидрофильных полимеров
- 2326697 Новый перевязочный материал для быстрого заживления раневой поверхности кожи
- 2126264 Фармацевтическое средство с гиалуроновой кислотой
- 2326137 Способ получения содержащих альгинат пористых формованных изделий
- 2325902 Способ выделения гликозаминогликанов из минерализованной соединительной ткани
- 2225195 Репелленты против насекомых
- 2325193 Сосудистый стент
- 2325184 Улучшенные везикулы наружной мембраны бактерий
- 2325153 Многокомпонентная фармацевтическая дозированная форма
- 2325152 Удерживаемая в желудке система регулируемой доставки лекарственного средства
- 2029955 Способ предоперационного определения помутнения задней капсулы хрусталика при экстракции катаракты
- 2324688 Производные бисбензизоселеназолонила с противоопухолевым, противовоспалительным и антитромбоническим действием
- 2323017 Устройство и способ контролируемый доставки активных веществ в кожу
- 2323011 Содержащий Коллаген I и Коллаген II способный к рассасыванию внеклеточный матрикс, предназначенный для реконструирования хряща
- 2322955 Способ изготовления имплантанта для пластики дефектов хрящевой ткани
- 2322454 Антитело против CCR5
- 2322263 Система продолжительного высвобождения растворимого лекарственного средства
- 2221561 Витамин Е и его сложные эфиры
- 2321634 Гены участвующие в метаболизме углерода и продуцировании энергии
- 2321597 Биоматерьял, способ его приготовления и его применение, медицинское средство, имплантант и вкладыш
- 2121340 Средство для похудения
- 2220737 Средство для улучшения состояния опорно-двигательного аппарата
- 2220729 Гель используемый в стоматологии
- 2320720 Способ культивирования фибропластов для заместительной терапии
- 2320378 Накожный аппликатор
- 2320369 Средства, содержащие Альфа - 2 - Дельта Лиганды и ингибиторы обратного захвата серотонина/норадреналина
- 2320362 Местные фармацевтические средства, содержащие проантоцианидины, для лечения дерматитов
- 2320322 Биоадгезивная доставка лекарств
- 2320318 Чувствительное к температуре изменяющие состояние средство гидрогеля
- 2025120 Способ получения препарата, содержащего Фактор /G-CSF/, стимулирующий рост колоний гранулоцитов
- 2319490 Средство для введения железа при лечении синдрома беспокойных ног
- 25995 Содержащее адгезив приспособление для фиксации зубных протезов в полости рта
- 2218907 Средство для ухода за кожей лица и веками
- 2318830 Способ получения модифицированного дерматансульфата
- 2118153 Косметика - туш для ресниц
- 2217441 Способ получения полимера
- 2317296 Изетионатная соль селективного ингибитора CDK4
- 2217171 Мембрана для использования при направленной регенерации тканей
- 2317095 Экстракты ECHINACEA ANGUSTIFOLIA
- 2216332 Препарат для лечения астроза
- 2216314 Крем - маска для обезвоженной кожи
- 2316333 Средство оздоровительно-восстановительных косметических панто-магниевых ванн
- 2021304 Способ получения биологически активного средства
- 2115662 Способ получения гиалуроновой кислоты
- 2315627 Впрыскиваемые имплантанты на керамической основе для заполнения морщин, кожных впадин, шрамов
- 2315623 Средство получаемое путем лиофилизации препарата
- 2114862 Способ получения гиалуроновой кислоты
- 2314791 Лечебно-Косметическое средство
- 2314791 Косметический крем-бальзам для ухода за кожей лица и шеи
- 2214600 Способ оценки эффективности лечения неврологических проявлений
- 2114602 Способ косметической обработки
- 2114587 Раствор для защиты роговицы
- 2214283 Имплантант для подкожного или внутрикожного введения
- 2313370 Медицинские протезы, имеющие улучшенную биологическую совместимость
- 2313356 Препарат для лечения демодекоза
- 2313338 Средство на основе этиллинолеата и триэтилцитрата для лечения себореи и угрей
- 2313328 Косметика содержащая тонкодисперный и пористый порошок
- 2212880 Способ получения препарата содержащего антибиотик, с замедленным высвобождением активного вещества
- 2312640 Способ лечения Блефароконьюнктивальной формы синдрома сухого глаза
- 2017751 Способ получения гиалуроновой кислоты
- 2312145 Гены CORYNEBACTERIUM GLUTAMICUM, кодирующие белки, участвующие в синтезе мембран и мембранном транспорте
- 2311458 Белки вызывающие измененную иммуногенную реакцию. Способ их получения и использования
- 2311183 Улучшенное разделение с использованием гталуроновой кислоты
- 2311177 Ингибиторы интегрина для лечения заболевания глаз
- 2300069 Косметическая маска
- 2211024 Уход за сухой кожей
- 2310440 Раствор для защиты роговицы от повреждений
- 2309684 Лечение межфалангового остеоатроза узелковой формы
- 2309406 Способ мониторинга фиброза печени у больных хроническим гепатитом с (ХГС)
- 2209088 Опосредованная рецепторами доставка генов с использованием векторов на основе бактериофагов
- 2308967 Уменьшение объема ткани
- 2308962 Средство для опорно-дигательного аппарата
- 2308957 Способ получения препарата для мезотерапии
- 2308954 Средство для лечения ран, содержащее плазму или сыворотку крови
- 2308951 Комплексный способ профилактики вагинальных дисбактериозов
- 2308937 Косметическая биологически активная добавка и косметический литофитокомплекс на ее основе
- 2208638 ДНК (варианты), способ получения белка
- 2207885 Способ подачи небольшого объема лечебного раствора к целевому месту
- 2207858 Лишенные побочных эффектов производные простагландинов для лечения глаукомы
- 2207845 Твердая лекарственная форма пролонгированного действия
- 2207844 Препарат для местного неинвазивного применения
- 2207841 Средства с антиферментативным действием
- 2306335 Стволовые клетки и решетки полученные из жировой ткани
- 2306140 Новые рецепторы для Helicobacter pylori и их применение
- 2205612 Способ эндотелизации IN VITRO протезов кровеносных сосудов
- 2105540 Депигментирующее средство
- 2304960 Косметическое средство для кожи
- 2304616 Гены участвующие в гомеостазе и адаптации
- 2204550Способ получения длинноцепочечной N-Ацилированной кислотой Аминокислот
- 2204415 Способ получения изображения
- 2204394 Средство для лечения грибковых инфекций, желудочных язв
- 2204366 Способ хирургического лечения глаукомы
- 2104034 Вагинальное увлажняющие средство, способ его получения
- 2303991 Биологически активная добавка
- 2303990 БАД
- 2303973 Адсорбирующее изделие
- 2203676 Средство обладающее иммунокорригирующим действием
- 2203672 Способ предупреждения беременности
- 2303635 Гены кодирующие белки резистентности и толерантности к стрессам
- 2303529 Способ фиксации альгинатного геля на твердой фазе, способ получения клеточного чипа на его основе
- 2203078 Способ лечения гнойных ран
- 2302412 Гидразоно-малонитрилы
- 2102400 Способ получения гиалуроновой кислоты
- 2202356 Способ стимуляции репаративных процессов длительно незаживающих ран и трофических язв
- 2202336 Средство для ухода за кожей
- 2302231 Глазные капли
- 2102082 Способ магнитометрического исследования тела человека или животного
- 2301814 Полиакриламидный гидрогель
- 2201765 Гибридные матричные имплантанты и эксплантанты
- 2301677 Биотрансплантант для лечения дегенеративных и трвматических заболеваний хрящевой ткани и способ его получения
- 2301676 Способ лечения ревматизма
- 2301674 Способ лечения больных с переломами нижней челюсти
- 2301661 Средство с регулируемым освобождением и способ его получения
- 2005488 Средство для лечения болезней соединительной ткани
- 2200001 Крем для кожи
|
РОССИЙСКАЯ ФЕДЕРАЦИЯ

ФЕДЕРАЛЬНАЯ СЛУЖБА
ПО ИНТЕЛЛЕКТУАЛЬНОЙ СОБСТВЕННОСТИ
ПАТЕНТАМ И ТОВАРНЫМ ЗНАКАМ
|
Патент №2284187 |
(54) ПРОИЗВОДНЫЕ АМИДА, СПОСОБЫ ИХ ПОЛУЧЕНИЯ, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ, СПОСОБ ЛЕЧЕНИЯ
(57) Реферат:
Изобретение относится к производным амида общей формулы I, где Х - СН; Y - СН или N; m=1 или 2, R1 - C1-С6алкил, C1-С6алкокси, N,N-ди[(C1-С6)алкил]амино, гетероциклил-C1-С6алкил, где гетероциклил - пиперазинил или гомопиперазинил, n=3; R2 - галоген, алкилС1-С6; R3 - водород, Q - фенил, необязательно замещенный циано, или пиридил, необязательно замещенный морфолино, или их фармацевтически приемлемым солям, способам получения указанных соединений, содержащим их фармацевтическим композициям и их применению при лечении заболеваний или состояний, опосредуемых цитокинами.

5 н. и 5 з.п. ф-лы, 2 табл.
Данное изобретение относится к производным амида, полезным в качестве ингибиторов цитокинопосредованных заболеваний. Изобретение также относится к способам получения производных амида изобретения, фармацевтическим композициям, содержащим указанные соединения, и к их применению в способах лечения, например, ингибированием цитокинопосредованного заболевания.
Производные амида, описываемые в настоящем изобретении, являются ингибиторами продуцирования цитокинов, таких как фактор некроза опухоли (далее TNF), например TNF , и различных представителей семейства интерлейкинов (далее IL), например IL-1, IL-6 и IL-8. Соответственно, соединения изобретения будут полезны при лечении заболеваний или состояний, при которых происходит избыточное продуцирование цитокинов, например избыточное продуцирование TNF , и различных представителей семейства интерлейкинов (далее IL), например IL-1, IL-6 и IL-8. Соответственно, соединения изобретения будут полезны при лечении заболеваний или состояний, при которых происходит избыточное продуцирование цитокинов, например избыточное продуцирование TNF или IL-1. Известно, что цитокины продуцируются широким рядом клеток, таких как моноциты и макрофаги, и что они вызывают самые разные физиологические действия, которые, как полагают, важны при заболеваниях или состояниях, таких как воспаление и иммунорегуляция. Например, TNF или IL-1. Известно, что цитокины продуцируются широким рядом клеток, таких как моноциты и макрофаги, и что они вызывают самые разные физиологические действия, которые, как полагают, важны при заболеваниях или состояниях, таких как воспаление и иммунорегуляция. Например, TNF и IL-1 вовлекаются в каскад передачи клеточных сигналов, который, как полагают, вносит вклад в патологию болезненных состояний, таких как воспалительные и аллергические заболевания, и цитокин-индуцированную токсичность. Также известно, что в некоторых клеточных системах продуцирование TNF и IL-1 вовлекаются в каскад передачи клеточных сигналов, который, как полагают, вносит вклад в патологию болезненных состояний, таких как воспалительные и аллергические заболевания, и цитокин-индуцированную токсичность. Также известно, что в некоторых клеточных системах продуцирование TNF предшествует и опосредует продуцирование других цитокинов, таких как IL-1. предшествует и опосредует продуцирование других цитокинов, таких как IL-1.
Аномальные уровни цитокинов также вовлечены, например, в продуцирование физиологически активных эйкозаноидов, таких как простагландины и лейкотриены, стимуляцию выделения протеолитических ферментов, таких как коллагеназа, активацию иммунной системы, например, путем стимуляции хелперных Т-клеток, активацию остеокластной активности, ведущей к резорбции кальция, стимуляции высвобождения протеогликанов, например из хряща, стимуляции клеточной пролиферации и ангиогенезу.
Также полагают, что цитокины замешаны в появлении и развитии болезненных состояний, таких как воспалительные и аллергические заболевания, например воспаление суставов (в частности, ревматоидный артрит, остеоартрит и подагра), воспаление желудочно-кишечного тракта (в частности, воспаление кишечника, неспецифический язвенный колит, болезнь Крона и гастрит), кожное заболевание (в частности, псориаз, экзема и дерматит) и респираторное заболевание (в частности, астма, бронхит, аллергический ринит, респираторный дистресс-синдром взрослых и хроническая обструктивная болезнь легких), и в появлении и развитии различных сердечно-сосудистых и цереброваскулярных расстройств, таких как застойная сердечная недостаточность, инфаркт миокарда, формирование атеросклеротических бляшек, гипертензия, агрегация тромбоцитов, стенокардия, удар, болезнь Альцгеймера, травма при реперфузии, сосудистая травма, включая рестеноз, и болезнь периферических сосудов, и, например, различные расстройства костного метаболизма, такие как остеопороз (включая сенильный и постменопаузальный остеопороз), болезнь Педжета, костные метастазы, гиперкальциемия, гиперпаратиреоидизм, остеосклероз, остеопетроз и периодонтит, и аномальные изменения в костном метаболизме, которые могут сопровождать ревматоидный артрит и остеоартрит. Цитокины при избыточном продуцировании также вовлекаются в опосредование некоторых осложнений бактериальных, грибковых и/или вирусных инфекций, таких как эндотоксиновый шок, септический шок и токсический шок, и в опосредование некоторых осложнений при операции на ЦНС или травме, такой как нейротравма и ишемический удар. Цитокины при избыточном продуцировании также вовлекаются в опосредование или обострение развития заболеваний, включая резорбцию хряща или мышцы, фиброз легких, цирроз, фиброз почек, кахексию, обнаруживаемую при некоторых хронических заболеваниях, таких как злокачественное заболевание и синдром приобретенного иммунодефицита (СПИД), опухолевая инвазивность и опухолевые метастазы и рассеянный склероз.
Доказательством центральной роли TNF , исполняемой им в каскаде передач клеточных сигналов, приводящей к появлению ревматоидного артрита, является эффективность при клинических исследованиях антител TNF , исполняемой им в каскаде передач клеточных сигналов, приводящей к появлению ревматоидного артрита, является эффективность при клинических исследованиях антител TNF (The Lancet, 1994, 344, 1125 и British Journal of Rheumatology, 1995, 34, 334). (The Lancet, 1994, 344, 1125 и British Journal of Rheumatology, 1995, 34, 334).
Таким образом, полагают, что цитокины, такие как TNF и IL-1, являются важными медиаторами значительного ряда заболеваний и болезненных состояний. Соответственно, ожидается, что ингибирование продуцирования и/или действия указанных цитокинов будет благоприятным фактором при профилактике, регуляции или лечении таких заболеваний и состояний. и IL-1, являются важными медиаторами значительного ряда заболеваний и болезненных состояний. Соответственно, ожидается, что ингибирование продуцирования и/или действия указанных цитокинов будет благоприятным фактором при профилактике, регуляции или лечении таких заболеваний и состояний.
При отсутствии желания утверждать на основании только одного биологического процесса, что соединения, описываемые в настоящем изобретении, обладают фармакологической активностью, предполагается, что на основании ингибирования фермента киназы р38 соединения ингибируют действие цитокинов. Киназа р38, иначе известная как цитокин-супрессорный связывающий белок (далее CSBP) и реактивирующая киназа (далее RK), является членом семейства ферментов киназ - митогенактивированных белков (MAP), которые, как известно, активируются физиологическим стрессом, таким как стресс, вызванный ионизирующим излучением, цитотоксичными веществами и токсинами, например эндотоксинами, такими как бактериальный липополисахарид, и многими веществами, такими как цитокины, например TNF и IL-1. Известно, что киназа р38 фосфорилирует некоторые внутриклеточные белки, участвующие в каскаде ферментативных стадий, ведущих к биосинтезу и выделению цитокинов, таких как TNF и IL-1. Известно, что киназа р38 фосфорилирует некоторые внутриклеточные белки, участвующие в каскаде ферментативных стадий, ведущих к биосинтезу и выделению цитокинов, таких как TNF и IL-1. Обзор известных ингибиторов киназы р38 приводится G.J. Hanson в Expert Opinions on Therapeutic Patents, 1997, 7, 729-733. Известно, что киназа р38 существует в изоформах, идентифицированных как р38 и IL-1. Обзор известных ингибиторов киназы р38 приводится G.J. Hanson в Expert Opinions on Therapeutic Patents, 1997, 7, 729-733. Известно, что киназа р38 существует в изоформах, идентифицированных как р38 и р38 и р38 . .
Соединения, описываемые в настоящем изобретении, являются ингибиторами продуцирования цитокинов, таких как TNF, в частности TNF , и различных интерлейкинов, в частности IL-1. , и различных интерлейкинов, в частности IL-1.
В соответствии со своим первым аспектом настоящее изобретение относится к соединению формулы I

где Х представляет СН или N;
Y представляет СН или N;
m равен 0, 1, 2 или 3;
R1 представляет гидрокси, галоген, трифторметил, циано, меркапто, нитро, амино, карбокси, карбамоил, формил, (C1-С6)алкил, (C2-С6)алкенил, (C2-С6)алкинил, (C1-С6)алкокси, (C1-С6)алкилтио, (C1-С6)алкилсульфинил, (C1-С6)алкилсульфонил, (C1-С6)алкиламино, ди-[(C1-С6)алкил]амино, (C1-С6)алкоксикарбонил, N-(C1-С6)алкилкарбамоил, N,N-ди-[(C1-С6)алкил]карбамоил, (C2-С6)алканоил, (C1-С6)алканоилокси, (C1-С6)алканоиламино, N-(C1-С6)алкилсульфамоил, N,N-ди-[(C1-С6)алкил]сульфамоил, (C1-С6)алкансульфониламино, N-(C1-С6)алкил-(C1-С6)алкансульфониламино, галоген-(C1-С6)алкил, гидрокси-(C1-С6)алкил, (C1-С6)алкокси-(C1-С6)алкил, циано-(C1-С6)алкил, амино-(C1-С6)алкил, (C1-С6)алкиламино-(C1-С6)алкил, ди-[(C1-С6)алкил]амино-(C1-С6)алкил, карбокси-(C1-С6)алкил, (C1-С6)алкоксикарбонил-(C1-С6)алкил, карбамоил-(C1-С6)алкил, N-(C1-С6)алкилкарбамоил-(C1-С6)алкил, N,N-ди-[(C1-С6)алкил] карбамоил-(C1-С6)алкил, галоген-(C2-С6)алкокси, гидрокси-(C2-С6)алкокси, (C1-С6)алкокси-(C2-С6)алкокси, циано-(C1-С6)алкокси, карбокси-(C1-С6)алкокси, (C1-С6)алкоксикарбонил-(C1-С6)алкокси, карбамоил-(C1-С6)алкокси, N-(C1-С6)алкилкарбамоил-(C1-С6)алкокси, N,N-ди-[(C1-С6)алкил]карбамоил-(C1-С6)алкокси, амино-(C2-С6)алкокси, (C1-С6)алкиламино-(C2-С6)алкокси, ди-[(C1-С6)алкил]амино-(C2-С6)алкокси, галоген-(C2-С6)алкиламино, гидрокси-(C2-С6)алкиламино, (C1-С6)алкокси-(C2-С6)алкиламино, циано-(C1-С6)алкиламино, карбокси-(C1-С6)алкиламино, (C1-С6)алкоксикарбонил-(C1-С6)алкиламино, карбамоил-(C1-С6)алкиламино, N-(C1-С6)алкилкарбамоил-(C1-С6)алкиламино, N,N-ди-[(C1-С6)алкил]карбамоил-(C1-С6)алкиламино, амино-(C2-С6)алкиламино, (C1-С6)алкиламино-(C1-С6)алкиламино, ди-[(C1-С6)алкил]амино-(C2-С6)алкиламино, N-(C1-С6)алкилгалоген-(C1-С6)алкиламино, N-(C1-С6)алкилгидрокси-(C2-С6)алкиламино, N-(C1-С6)алкил-(C1-С6)алкокси-(C2-С6)алкиламино, N-(C1-С6)алкилциано-(C1-С6)алкиламино, N-(C1-С6)алкилкарбокси-(C1-С6)алкиламино, N-(C1-С6)алкил-(C1-С6)алкоксикарбонил-(C1-С6)алкиламино, N-(C1-С6)алкилкарбамоил-(C1-С6)алкиламино, N-(C1-С6)алкил-N-(C1-С6)алкилкарбамоил-(C1-С6)алкиламино, N-(C1-С6)алкил-N,N-ди-[(C1-С6)алкил]карбамоил-(C1-С6)алкиламино, N-(C1-C6)алкиламино-(C2-C6)алкиламино, N-(C1-C6)алкил-(C1-С6)алкиламино-(C2-С6)алкиламино, N-(C1-С6)алкил-ди-[(C1-С6)алкил]амино-(C2-С6)алкиламино, галоген-(C2-С6)алканоиламино, гидрокси-(C2-С6)алканоиламино, (C1-С6)алкокси-(C2-С6)алканоиламино, циано-(C2-С6)алканоиламино, карбокси-(C2-С6)алканоиламино, (C1-С6)алкоксикарбонил-(C2-С6)алканоиламино, карбамоил-(C2-С6)алканоиламино, N-(C1-С6)алкилкарбамоил-(C2-С6)алканоиламино, N,N-ди-[(C1-С6)алкил]карбамоил-(C2-С6)алканоиламино, амино-(C2-С6)алканоиламино, (C1-С6)алкиламино-(C2-С6)алканоиламино или ди-[(C1-С6)алкил]амино-(C1-С6)алканоиламино,
или R1 представляет арил, арил-(C1-С6)алкил, арил-(C1-С6)алкокси, арилокси, ариламино, N-(C1-С6)алкилариламино, арил-(C1-С6)алкиламино, N-(C1-С6)алкиларил-(C1-С6)алкиламино, ароиламино, арилсульфониламино, N-арилсульфамоил, арил-(С2-С6)алканоиламино, гетероарил, гетероарил-(C1-С6)алкил, гетероарилокси, гетероарил-(C1-С6)алкокси, гетероариламино, N-(C1-С6)алкилгетероариламино, гетероарил-(C1-С6)алкиламино, N-(C1-С6)алкилгетероарил-(C1-С6)алкиламино, гетероарилкарбониламино, гетероарилсульфониламино, N-гетероарилсульфамоил, гетероарил-(C2-С6)алканоиламино, гетероарил-(C1-С6)алкокси-(C1-С6)алкил, гетероарил-(C1-С6)алкиламино-(C1-С6)алкил, N-(C1-С6)алкилгетероарил-(C1-С6)алкиламино-(C1-С6)алкил, гетероциклил, гетероциклил-(C1-С6)алкил, гетероциклилокси, гетероциклил-(C1-С6)алкокси, гетероциклиламино, N-(C1-С6)алкилгетероциклиламино, гетероциклил-(C1-С6)алкиламино, N-(C1-С6)алкилгетероциклил-(C1-С6)алкиламино, гетероциклилкарбониламино, гетероциклилсульфониламино, N-гетероциклилсульфамоил, гетероциклил-(C2-С6)алканоиламино, гетероциклил-(C1-С6)алкокси-(C1-С6)алкил, гетероциклил-(C1-С6)алкиламино-(C1-С6)алкил или N-(C1-С6)алкилгетероциклил-(C1-С6)алкиламино-(C1-С6)алкил,
или (R1)m представляет (C1-С3)алкилендиоксигруппу,
и где любой из заместителей R1, имеющих указанные выше значения, содержащий СН2-группу, связанную с 2 атомами углерода, или СН3-группу, связанную с атомом углерода, может, необязательно, содержать в каждой указанной CH2- или СН3-группе заместитель, выбранный из гидрокси, амино, (C1-С6)алкокси, (C1-С6)алкиламино, ди-[(C1-С6)алкил]амино и гетероциклила,
и где любая арильная, гетероарильная или гетероциклильная группа в заместителе R1 может, необязательно, содержать 1 или 2 заместителя, выбранных из гидрокси, галогена, (C1-С6)алкила, (C1-С6)алкокси, карбокси, (C1-С6)алкоксикарбонила, N-(C1-С6)алкилкарбамоила, N,N-ди-[(C1-С6)алкил]карбамоила, (C2-С6)алканоила, амино, (C1-С6)алкиламино, ди-[(C1-С6)алкил]амино, галоген-(C1-С6)алкила, гидрокси-(C1-С6)алкила, (C1-С6)алкокси-(C1-С6)алкила, циано-(C1-С6)алкила, амино-(C1-С6)алкила, (C1-С6)алкиламино-(C1-С6)алкила, ди-[(C1-С6)алкил]амино-(C1-С6)алкила, арила и арил-(C1-С6)алкила,
n равен 0, 1, 2 или 3;
R2 представляет гидрокси, галоген, трифторметил, циано, меркапто, нитро, амино, карбокси, (C1-С6)алкоксикарбонил, (C1-С6)алкил, (C2-С6)алкенил, (C2-С6)алкинил, (C1-С6)алкокси, (C1-С6)алкиламино или ди-[(C1-С6)алкил]амино;
R3 представляет водород, галоген, (C1-С6)алкил или (C1-С6)алкокси;
q равен 0, 1, 2, 3 или 4; и
Q представляет арил, арилокси, арил-(C1-С6)алкокси, ариламино, N-(C1-С6)алкилариламино, арил-(C1-С6)алкиламино, N-(C1-С6)алкиларил-(C1-С6)алкиламино, ароиламино, арилсульфониламино, N-арилкарбамоил, N-арилсульфамоил, арил-(C2-С6)алканоиламино, (С3-С7)циклоалкил, гетероарил, гетероарилокси, гетероарил-(C1-С6)алкокси, гетероариламино, N-(C1-С6)алкилгетероариламино, гетероарил-(C1-С6)алкиламино, N-(C1-С6)алкилгетероарил-(C1-С6)алкиламино, гетероарилкарбониламино, гетероарилсульфониламино, N-гетероарилкарбамоил, N-гетероарилсульфамоил, гетероарил-(С2-С6)алканоиламино, гетероциклил, гетероциклилокси, гегероциклил-(C1-С6)алкокси, гетероциклиламино, N-(C1-С6)алкилгетероциклиламино, гетероциклил-(C1-С6)алкиламино, N-(C1-С6)алкилгетероциклил-(C1-С6)алкиламино, гетероциклилкарбониламино, гетероциклилсульфониламино, N-гетероциклилкарбамоил, N-гетероциклилсульфамоил или гетероциклил-(C2-С6)алканоиламино,
и Q, необязательно, замещен 1, 2 или 3 заместителями, выбранными из гидрокси, галогена, трифторметила, циано, меркапто, нитро, амино, карбокси, карбамоила, формила, (C1-С6)алкила, (C2-С6)алкенила, (C1-С6)алкинила, (C1-С6)алкокси, (C1-С6)алкилтио, (C1-С6)алкилсульфинила, (C1-С6)алкилсульфонила, (C1-С6)алкиламино, ди-[(C1-С6)алкил]амино, (C1-С6)алкоксикарбонила, N-(C1-С6)алкилкарбамоила, N,N-ди-[(C1-С6)алкил]карбамоила, (C2-С6)алканоила, (C2-С6)алканоилокси, (C1-С6)алканоиламино, N-(С1-С6)алкилсульфамоила, N,N-ди-[(C1-C6)алкил]сульфамоила, (C1-С6)алкансульфониламино, N-(C1-С6)алкил-(C1-С6)алкансульфониламино, галоген-(C1-С6)алкила, гидрокси-(C1-С6)алкила, (C1-С6)алкокси-(C1-С6)алкила, циано-(C1-С6)алкила, амино-(C1-С6)алкила, (C1-С6)алкиламино-(C1-С6)алкила, ди-[(C1-С6)алкил]амино-(C1-С6)алкила, карбокси-(C1-С6)алкила, (C1-С6)алкоксикарбонил-(C1-С6)алкила, карбамоил-(C1-С6)алкила, N-(C1-C6)алкилкарбамоил-(C1-C6)алкила, N,N-ди-[(C1-C6)алкил]карбамоил-(C1-C6)алкила, галоген-(C2-C6)алкокси, гидрокси-(C2-C6)алкокси, (C1-C6)алкокси-(C2-C6)алкокси, циано-(C1-C6)алкокси, карбокси-(C1-C6)алкокси, (C1-C6)алкоксикарбонил-(C1-C6)алкокси, карбамоил-(C1-C6)алкокси, N-(C1-C6)алкилкарбамоил-(C1-C6)алкокси, N,N-ди-[(C1-C6)алкил] карбамоил-(C1-C6)алкокси, амино-(C2-C6)алкокси, (C1-C6)алкиламино-(C2-C6)алкокси, ди-[(C1-C6)алкил]амино-(C2-C6)алкокси, галоген-(C2-C6)алкиламино, гидрокси-(C2-C6)алкиламино, (C1-C6)алкокси-(C2-C6)алкиламино, циано-(C1-C6)алкиламино, карбокси-(C1-C6)алкиламино, (C1-C6)алкоксикарбонил-(C1-C6)алкиламино, карбамоил-(C1-C6)алкиламино, N-(C1-C6)алкилкарбамоил-(C1-C6)алкиламино, N,N-ди-[(C1-C6)алкил]карбамоил-(C1-C6)алкиламино, амино-(C2-C6)алкиламино, (C1-C6)алкиламино-(C2-C6)алкиламино, ди-[(C1-C6)алкил]амино-(C2-C6)алкиламино, N-(C1-C6)алкилгалоген-(C1-C6)алкиламино, N-(C1-C6)алкилгидрокси-(C2-C6)алкиламино, N-(C1-C6)алкил-(C1-C6)алкокси-(C2-C6)алкиламино, N-(C1-C6)алкилциано-(C1-C6)алкиламино, N-(C1-C6)алкилкарбокси-(C1-C6)алкиламино, N-(C1-C6)алкил-(C1-C6)алкоксикарбонил-(C1-C6)алкиламино, N-(C1-C6)алкилкарбамоил-(C1-C6)алкиламино, N-(C1-C6 )алкил-N-(C1-C6)алкилкарбамоил-(C1-C6)алкиламино, N-(C1-C6)алкил-N,N-ди-[(C1-C6)алкил]карбамоил-(C1-C6)алкиламино, N-(C1-C6)алкиламино-(C2-C6)алкиламино, N-(C1-C6)алкил-(C1-C6)алкиламино-(C2-C6)алкиламино, N-(C1-C6)алкил-ди-[(C1-C6)алкил]амино-(C2-C6)алкиламино, галоген-(C2-C6)алканоиламино, гидрокси-(C2-C6)алканоиламино, (C1-C6)алкокси-(C2-C6)алканоиламино, циано-(C2-C6)алканоиламино, карбокси-(C2-C6) алканоиламино, (С1-С6)алкоксикарбонил-(C2-C6)алканоиламино, карбамоил-(C2-C6)алканоиламино, N-(C1-C6)алкилкарбамоил-(C2-C6)алканоиламино, N,N-ди-[(C1-C6)алкил]карбамоил-(C2-C6)алканоиламино, амино-(C2-C6)алканоиламино, (C1-C6)алкиламино-(C2-C6)алканоиламино, ди-[(C1-C6)алкил]амино-(C2-C6)алканоиламино, арила, арил-(C1-C6)алкила, арил-(C1-C6)алкокси, арилокси, ариламино, N-(С1-С6)алкилариламино, арил-(C1-C6)алкиламино, N-(C1-C6)алкиларил-(C1-C6)алкиламино, ароиламино, арилсульфониламино, N-арилсульфамоила, арил-(C2-C6)алканоиламино, гетероарила, гетероарил-(C1-C6)алкила, гетероарилокси, гетероарил-(C1-C6)алкокси, гетероариламино, N-(C1-C6)алкилгетероариламино, гетероарил-(C1-C6)алкиламино, N-(C1-C6)алкилгетероарил-(C1-C6)алкиламино, гетероарилкарбониламино, гетероарилсульфониламино, N-гетероарилсульфамоила, гетероарил-(C2-C6) алканоиламино, гетероарил-(C1-C6)алкокси-(C1-C6)алкила, гетероарил-(C1-C6)алкиламино-(C1-C6)алкила, N-(C1-C6)алкилгетероарил-(C1-C6)алкиламино-(C1-C6)алкила, гетероциклила, гетероциклил-(C1-C6)алкила, гетероциклилокси, гетероциклил-(C1-C6)алкокси, гетероциклиламино, N-(C1-C6)алкилгетероциклиламино, гетероциклил-(C1-C6)алкиламино, N-(C1-C6)алкилгетероциклил-(C1-C6)алкиламино, гетероциклилкарбониламино, гетероциклилсульфониламино, N-гетероциклилсульфамоила, гетероциклил-(C2-C6)алканоиламино, гетероциклил-(C1-C6)алкокси-(C1-C6)алкила, гетероциклил-(C1-C6)алкиламино-(C1-C6)алкила и N-(C1-C6)алкилгетероциклил-(C1-C6)алкиламино-(C1-C6)алкила,
или Q замещен (C1-C3)алкилендиоксигруппой,
и где любые заместители для Q, имеющие значения, указанные выше, содержащие СН2-группу, связанную с 2 атомами углерода, или СН3-группу, связанную с атомом углерода, могут, необязательно, содержать в каждой указанной СН2- или СН3-группе заместитель, выбранный из гидрокси, амино, (C1-C6)алкокси, (C1-C6)алкиламино, ди-[(C1-C6)алкил]амино и гетероциклила,
и где любая арильная, гетероарильная или гетроциклильная группа в заместителе для Q может, необязательно, содержать 1 или 2 заместителя, выбранных из гидрокси, галогена, (C1-C6)алкила, (C1-C6)алкокси, карбокси, (C1-C6)алкоксикарбонила, N-(C1-C6)алкилкарбамоила, N,N-ди-[(C1-C6)алкил]карбамоила, (C2-C6)алканоила, амино, (C1-C6)алкиламино, ди-[(C1-C6)алкил]амино, галоген-(C1-C6)алкила, гидрокси-(C1-C6)алкила, (C1-C6)алкокси-(C1-C6)алкила, циано-(C1-C6)алкила, амино-(C1-C6)алкила, (C1-C6)алкиламино-(C1-C6)алкила, ди-[(C1-C6)алкил]амино-(C1-C6)алкила, арила и арил-(C1-C6)алкила,
или к его фармацевтически приемлемой соли или его сложному эфиру, расщепляемому in vivo.
В соответствии с другим аспектом, настоящее изобретение относится к соединению формулы I, где каждый из X, Y, R1, R2, m, n, q и Q имеет любое из указанных выше значений и R3 выбран из галогена и (C1-C6)алкила; или к его фармацевтически приемлемой соли или его сложному эфиру, расщепляемому in vivo.
В данном описании термин "(C1-C6)алкил" включаеталкильные группы с линейными или разветвленными цепями, такие как пропил, изопропил и трет-бутил, и (C3-C6)циклоалкильные группы, такие как циклопропил, циклобутил, циклопентил и циклогексил. Однако ссылки на отдельные алкильные группы, такие как "пропил", характерны только для версии с линейной цепью, ссылки на отдельные алкильные группы с разветвленными цепями, такие как "изопролил", характерны только для версии с разветвленной цепью, и ссылки на отдельные циклоалкильные группы, такие как "циклопентил", характерны только для 5-членных колец. Аналогичный подход применяется и к другим общим терминам, например (C1-C6)алкокси включает метокси, этокси, циклопропилокси и циклопентилокси, (C1-C6)алкиламино включает метиламино, этиламино, циклобутиламино и циклогексиламино, и ди-[(C1-C6)алкил]амино включает диметиламино, диэтиламино, N-циклобутил-N-циклометиламино и N-циклогексил-N-этиламино.
Следует иметь в виду, что поскольку некоторые соединения формулы I, описанной выше, могут существовать в оптически активных или рацемических формах, вследствие наличия одного или нескольких асимметричных атомов углерода, изобретение в своем определении включает любую такую оптически активную или рацемическую форму, обладающую свойством ингибирования цитокинов, в частности TNF. Синтез оптически активных форм можно осуществить обычными методами органической химии, хорошо известными в данной области, например путем синтеза из оптически активных исходных веществ или путем расщепления рацемической формы. Подобным образом ингибирующие свойства в отношении TNF можно оценить, используя стандартные лабораторные методы, указанные ниже.
Подходящими значениями радикалов, указанных выше, являются значения, перечисленные ниже.
Подходящим значением "арил" в определениях R1 и Q, когда они представляют собой арил, в определении заместителя на Q, когда он представляет собой арил, или в определении арильной группы в заместителе R1 или Q группе, или в заместителе на Q является, например, фенил, инденил, инданил, нафтил, тетрагидронафтил или флуоренил, более предпочтительно фенил.
Подходящим значением "гетероарил" в определении R1 или Q, когда они представляют собой гетероарил, в определении гетероарильной группы в заместителе R1 или группе Q, в определении заместителя на Q, когда такой заместитель представляет собой гетероарил, или в определении гетероарильной группы в заместителе на Q является, например, ароматическое 5- или 6-членное моноциклическое кольцо, 9- или 10-членное бициклическое кольцо или 13- или 14-членное трициклическое кольцо, содержащее каждое до пяти гетероатомов в кольце, выбранных из атомов кислорода, азота и серы, например фурил, пирролил, тиенил, оксазолил, изоксазолил, имидазолил, пиразолил, тиазолил, изотиазолил, оксадиазолил, тиадиазолил, триазолил, тетразолил, пиридил, пиридазинил, пиримидинил, пиразинил, 1,3,5-триазенил, бензофуранил, индолил, бензотиенил, бензоксазолил, бензимидазолил, бензотиазолил, индазолил, бензофуразанил, хинолил, изохинолил, хиназолинил, хиноксалинил, циннолинил, нафтиридинил, карбазолил, дибензофуранил, дибензотиофенил, S,S-диоксодибензотиофенил, ксантенил, дибензо-1,4-диоксинил, феноксатиинил, феноксазинил, дибензотиинил, фенотиазинил, тиантренил, бензофуропиридил, пиридоиндолил, акридинил или фенантридинил, более предпочтительно фурил, тиенил, оксазолил, изоксазолил, имидазолил, пиразолил, тиазолил, изотиазолил, пиридил, пиридазинил, пиримидинил, пиразинил, бензофуранил, индолил, бензотиенил, бензоксазолил, бензимидазолил, бензотиазолил, индазолил, бензофуразанил, хинолил, изохинолил, хиназолинил, хиноксалинил, нафтиридинил, карбазолил, дибензофуранил, дибензотиофенил или ксантенил, более предпочтительно фурил, тиенил, изоксазолил, тиазолил, пиридил, бензотиенил, бензофуразанил, хинолил, карбазолил, дибензофуранил или дибензотиофенил.
Подходящим значением "гетероциклил" в определении R1 или Q, когда они представляют собой гетероциклил, в определении заместителя на Q, когда такой заместитель представляет собой гетероциклил, или гетероциклильной группы в заместителе R1 или группе Q, или в заместителе для Q, является, например, неароматическое насыщенное или частично насыщенное 3-10-членное моноциклическое или бициклическое кольцо, содержащее до пяти гетероатомов, выбранных из атомов кислорода, азота и серы, например оксиранил, оксетанил, азетидинил, тетрагидрофуранил, тетрагидропиранил, пирролинил, пирролидинил, 1,1-диоксидоизотиазолидинил, морфолинил, тетрагидро-1,4-тиазинил, 1,1-диоксотетрагидро-1,4-тиазинил, пиперидинил, гомопиперидинил, пиперазинил, гомопиперазинил, дигидропиридинил, тетрагидропиридинил, дигидропиримидинил или тетрагидропиримидинил, или, например, имидазолинил, имидазолидинил, пиразолинил, пиразолидинил, или, например, их бензопроизводные, такие как 2,3-дигидробензофуранил, 2,3-дигидробензотиенил, индолинил, изоиндолинил, хроманил и изохроманил, предпочтительно гетероциклильная группа представляет собой пирролидин-1-ил, пирролидин-2-ил, морфолино, пиперидино, пиперазин-1-ил или гомопиперазин-1-ил.
Подходящим значением Q, когда Q представляет (C3-C7)циклоалкил, является, например, неароматическое моно- или бициклическое 3-7-членное углеродное кольцо, такое как циклопропил, циклобутил, циклопентил, циклогексил, циклогептил или бицикло[2.2,1]гептил, предпочтительно циклобутил, циклопентил, циклогексил или циклогептил, более предпочтительно циклогексил.
Подходящие значения различных групп R1, R2 или R3 или различных заместителей на Q или на арильной, гетероарильной или гетероциклильной группах в R1 или на арильной, гетероарильной или гетероциклильной группах в заместителе на Q включают:
для галогена: фтор, хлор, бром и йод;
для (C1-C6)алкила: метил, этил, пропил, изопропил, трет-бутил, циклобутил, циклопентил и циклогексил;
для (C2-C6)алкенила: винил и аллил;
для (C2-C6)алкинила: этинил и 2-пропинил;
для (C1-C6)алкокси: метокси, этокси, пропокси, изопропокси, циклопропилокси, бутокси, циклобутилокси и циклопентилокси;
для (C1-C6)алкиламино: метиламино, этиламино, пропиламино, циклобутиламино и циклогексиламино;
для ди-[(C1-C6)алкил]амино: диметиламино, диэтиламино и N-этил-N-метиламино;
для (C1-C6)алкоксикарбонила: метоксикарбонил, этоксикарбонил, пропоксикарбонил и трет-бутоксикарбонил;
для N-(C1-C6)алкилкарбамоила: N-метилкарбамоил, N-этилкарбамоил и N-пропилкарбамоил;
для N,N-ди-[(C1-C6)алкил]карбамоила: N,N-диметилкарбамоил, N-этил-N-метилкарбамоил и N,N-диэтилкарбамоил;
для (C2-C6)алканоила: ацетил и пропионил;
для галоген-(C1-C6)алкила: фторметил, хлорметил, бромметил, дифторметил, дихлорметил, дибромметил, 2-фторэтил, 2-хлорэтил и 2-бромэтил;
для гидрокси-(C1-C6)алкила: гидроксиметил, 2-гидроксиэтил, 1-гидроксиэтил и 3-гидроксипропил;
для (C1-C6)алкокси-(C1-C6)алкила: метоксиметил, этоксиметил, 1-метоксиэтил, 2-метоксиэтил, 2-этоксиэтил и 3-метоксипропил;
для циано-(C1-C6)алкила: цианометил, 2-цианоэтил, 1-цианоэтил и 3-цианопропил;
для амино-(C1-C6)алкила: аминометил, 2-аминоэтил, 1-аминоэтил и 3-аминопропил;
для (C1-C6)алкиламино-(C1-C6)алкила: метиламинометил, этиламинометил, 1-метиламиноэтил, 2-метиламиноэтил, 2-этиламиноэтил и 3-метиламинопропил;
для ди-[(C1-C6)алкил]амино-(C1-C6)алкила: диметиламинометил, диэтиламинометил, 1-диметиламиноэтил, 2-диметиламиноэтил и 3-диметиламинопропил.
Подходящие значения R1 или Q и подходящие значения заместителей для R1 или Q включают:
для арил-(C1-C6)алкила: бензил, 2-фенилэтил, 2-фенилпропил и 3-фенилпропил;
для арил-(C1-C6)алкокси: бензилокси и 2-фенилэтокси;
для арилокси: фенокси и 2-нафтилокси;
для ариламино: анилино;
для N-(C1-C6)алкилариламино: N-метиланилино и N-этиланилино;
для арил-(C1-C6)алкиламино: бензиламино, 2-фенилэтиламино, 2-фенилпропиламино и 3-фенилпропиламино;
для N-(C1-C6)алкиларил-(C1-C6)алкиламино: N-бензил-N-метиланилино;
для ароиламино: бензамидо и 2-нафтоиламино;
для арилсульфониламино: бензолсульфониламидо;
для N-арилкарбамоила: N-фенилкарбамоил;
для N-арилсульфамоила: N-фенилсульфамоил;
для арил-(C2-C6)алканоиламино: фенилацетамидо и 3-фенилпропионамидо;
для гетероарил-(C1-C6)алкила: гетероарилметил, 2-гетероарилэтил, 2-гетероарилпропил и 3-гетероарилпропил;
для гетероарил-(C1-C6)алкокси: гетероарилметокси и 2-гетероарилэтокси;
для N-(C1-C6)алкилгетероариламино: N-метилгетероариламино;
для гетероарил-(C1-C6)алкиламино: гетероарилметиламино, 2-гетероарилэтиламино и 3-гетероарилпропиламино;
для N-(C1-C6)алкилгетероарил-(C1-C6)алкиламино: N-метилгетероарилметиламино и N-метил-2-гетероарилэтиламино;
для гетероарил-(C2-C6)алканоиламино: гетероарилацетамидо и 3-гетероарилпропионамидо;
для гетероарил-(C1-C6)алкокси-(C1-C6)алкила: гетероарилметоксиметил, 2-гетероарилэтоксиметил и 3-гетероарилпропоксиметил;
для гетероарил-(C1-C6)алкиламино-(C1-C6)алкила: гетероарилметиламинометил, 2-гетероарилэтиламинометил и 3-гетероарилпропиламинометил;
для N-(C1-С6)алкилгетероарил-(C1-С6)алкиламино-(C1-С6)алкила: N-гетероарилметил-N-метиламинометил, N-(2-гетероарилэтил)-N-метиламинометил и N-(3-гетероарилпропил)-N-метиламинометил;
для гетероциклил-(C1-С6)алкила: гетероциклилметил, 2-гетероциклилэтил, 2-гетероциклиллропил и 3-гетероциклилпропил;
для гетероциклил-(C1-С6)алкокси: гетероциклилметокси и 2-гетероциклилэтокси;
для N-(C1-С6)алкилгетероциклиламино: N-метилгетероциклиламино;
для гетероциклил-(C1-С6)алкиламино: гетероциклилметиламино, 2-гетероциклилэтиламино и 3-гетероциклилпропиламино;
для N-(C1-С6)алкилгетероциклил-(C1-С6)алкиламино: N-метилгетероциклилметиламино и N-метил-2-гетероциклилэтиламино;
для гетероциклил-(С2-С6)алканоиламино: гетероциклилацетамидо и 3-гетероциклилпропионамидо;
для гетероциклил-(C1-С6)алкокси-(C1-С6)алкила: гетероциклилметоксиметил, 2-гетероциклилэтоксиметил и 3-гетероциклилпропоксиметил;
для гетероциклил-(C1-С6)алкиламино-(C1-С6)алкила: гетероциклилметиламинометил, 2-гетероциклилэтиламинометил и 3-гетероциклилэтиламинометил;
для N-(C1-С6)алкилгетероциклил-(C1-С6)алкиламино-(C1-С6)алкила: N-гетероциклилметил-N-метиламинометил, N-(2-гетероциклилэтил)-N-метиламинометил и N-(3-гетероциклилпропил)-N-метиламинометил;
для (С1-С3)алкилендиокси: метилендиокси, этилендиокси и триметилендиокси;
для (C1-С6)алкилтио: метилтио, этилтио и пропилтио;
для (C1-С6)алкилсульфинила: метилсульфинил, этилсульфинил и пропилсульфинил;
для (C1-С6)алкилсульфонила: метилсульфонил, этилсульфонил и пропилсульфонил;
для (С2-С6)алканоилокси: ацетокси и пропионилокси;
для (C1-С6)алканоиламино: формамидо, ацетамидо и пропионамидо;
для N-(C1-С6)алкилсульфамоила: N-метилсульфамоил и N-этилсульфамоил;
для N,N-ди-[(C1-С6)алкил]сульфамоила: N,N-диметилсульфамоил;
для (C1-С6)алкансульфониламино: метансульфониламино и этансульфониламино;
для N-(C1-С6)алкил-(C1-С6)алкансульфониламино: N-метилметансульфониламино и N-метилэтансульфониламино;
для карбокси-(C1-С6)алкила: карбоксиметил, 1-карбоксиэтил, 2-карбоксиэтил, 3-карбоксипропил и 4-карбоксибутил;
для (C1-С6)алкоксикарбонил-(C1-С6)алкила: метоксикарбонилметил, этоксикарбонилметил, трет-бутоксикарбонилметил, 1-метоксикарбонилэтил, 1-этоксикарбонилэтил, 2-метоксикарбонилэтил, 2-этоксикарбонилэтил, 3-метоксикарбонилпропил и 3-этоксикарбонилпропил;
для карбамоил-(C1-С6)алкила: карбамоилметил, 1-карбамоилэтил, 2-карбамоилэтил и 3-карбамоилпропил;
для N-(С1-С6)алкилкарбамоил-(C1-С6)алкила: N-метилкарбамоилметил, N-этилкарбамоилметил, N-пропилкарбамоилметил, 1-(N-метилкарбамоил)этил, 1-(N-этил-карбамоил)этил, 2-(N-метилкарбамоил)этил, 2-(N-этилкарбамоил)этил и 3-(N-метилкарбамоил)пропил;
для N,N-ди[(C1-С6)алкил]карбамоил-(C1-С6)алкила: N,N-диметилкарбамоилметил, N-этил-N-метилкарбамоилметил, N,N-диэтилкарбамоилметил, 1-(N,N-диметилкарбамоил)этил, 1-(N,N-диэтилкарбамоил)этил, 2-(N,N-диметилкарбамоил)этил, 2-(N,N-диэтилкарбамоил)этил, 3-(N,N-диметилкарбамоил)пропил и 4-(N,N-диметилкарбамоил)бутил;
для галоген-(С2-С6)алкокси: 2-хлорэтокси, 2-бромэтокси, 3-хлорпропокси, 1,1,2,2-тетрафторэтокси и 2,2,2-трифторэтокси;
для гидрокси-(С2-С6)алкокси: 2-гидроксиэтокси, 3-гидроксипропокси, 2-гидрокси-1-метилэтокси, 2-гидрокси-2-пропокси и 4-гидроксибутокси;
для (C1-С6)алкокси-(C2-C6)алкокси: 2-метоксиэтокси, 2-этоксиэтокси, 3-метоксипропокси, 2-метокси-1-метоксиэтокси и 4-этоксибутокси;
для циано-(C1-С6)алкокси: цианометокси, 2-цианоэтокси и 3-цианопропокси;
для карбокси-(C1-С6)алкокси: карбоксиметокси, 1-карбоксиэтокси, 2-карбоксиэтокси и 3-карбоксипропокси;
для (C1-С6)алкоксикарбонил-(C1-С6)алкокси: метоксикарбонилметокси, этоксикарбонилметокси, трет-бутоксикарбонилметокси, 2-метоксикарбонилэтокси и 3-этоксикарбонилпропокси;
для карбамоил-(C1-С6)алкокси: карбамоилметокси и 2-карбамоилэтокси;
для N-(C1-С6)алкилкарбамоил-(C1-С6)алкокси: N-метилкарбамоилметокси, 2-(N-этил-карбамоил)этокси и 3-(N-метилкарбамоил)пропокси;
для N,N-ди-[(C1-С6)алкил]карбамоил-(C1-С6)алкокси: N,N-диметилкарбамоилметокси, 2-(N,N-диметилкарбамоил)этокси и 3-(N,N-диэтилкарбамоил)пропокси;
для амино-(С2-С6)алкокси: 2-аминоэтокси, 2-амино-1-метилэтокси, 3-аминопропокси, 2-амино-2-метилпропокси и 4-аминобутокси;
для (C1-С6)алкиламино-(С2-С6)алкокси: 2-метиламиноэтокси, 2-метиламино-1-метилэтокси и 3-этиламинопропокси;
для ди-[(C1-С6)алкил]амино-(С2-С6)алкокси: 2-диметиламиноэтокси, 2-диэтиламиноэтокси, 2-диметиламинопропокси, 2-диметиламино-2-метилэтокси, 3-диметиламинопропокси и 4-диметиламинобутокси;
для галоген-(C2-C6)алкиламино: 2-фторэтиламино, 2-хлорэтиламино, 2-бромэтиламино, 3-фторпропиламино и 3-хлорпропиламино;
для гидрокси-(С2-С6)алкиламино: 2-гидроксиэтиламино, 3-гидроксипропиламино, 2-гидрокси-2-метилпропиламино и 4-гидроксибутиламино;
для (C1-С6)алкокси-(С2-С6)алкиламино: 2-метоксиэтиламино, 2-этоксиэтиламино, 3-метоксипропиламино и 3-этоксипропиламино;
для циано-(C1-С6)алкиламино: цианометиламино, 2-цианоэтиламино и 3-цианопропиламино;
для карбокси-(C1-С6)алкиламино: карбоксиметиламино, 1-карбоксиэтиламино, 2-карбоксиэтиламино и 3-карбоксипропиламино;
для (C1-С6)алкоксикарбонил-(C1-С6)алкиламино: метоксикарбонилметиламино, 2-(этоксикарбонил)этиламино и 3-(трет-бутоксикарбонил)пропиламино;
для карбамоил-(C1-С6)алкиламино: карбамоилметиламино и 2-карбамоилэтиламино;
для N-(C1-С6)алкилкарбамоил-(C1-С6)алкиламино: N-метилкарбамоилметиламино, N-этилкарбамоилметиламино и 2-(N-метилкарбамоил)этиламино;
для N,N-ди-[(C1-С6)алкил]карбамоил-(C1-С6)алкиламино: N,N-диметилкарбамоилметиламино, N,N-диэтилкарбамоилметиламино и 2-(N,N-диметилкарбамоил)этиламино;
для амино-(C2-C6)алкиламино: 2-аминоэтиламино, 3-аминопропиламино, 2-амино-2-метилпропиламино и 4-аминобутиламино;
для (C1-С6)алкиламино-(С2-С6)алкиламино: 2-метиламиноэтиламино, 2-этиламиноэтиламино, 2-пропиламиноэтиламино, 3-метиламинопропиламино, 3-этиламинопропиламино, 2-метиламино-2-метилпропиламино и 4-метиламинобутиламино;
для ди-[(C1-С6)алкил]амино-(С2-С6)алкиламино: 2-диметиламиноэтиламино, 2-(N-этил-N-метиламино)этиламино, 2-диэтиламиноэтиламино, 2-дипропиламиноэтиламино, 3-диметиламинопропиламино, 3-диэтиламинопропиламино, 2-диметиламино-2-метилпропиламино и 4-диметиламинобутиламино;
для N-(C1-С6)алкилгалоген-(C2-C6)алкиламино: N-(2-хлорэтил)-N-метиламино, N-(2-бромэтил)-N-метиламино и N-(2-бромэтил)-N-этиламино;
для N-(C1-С6)алкилгидрокси-(C2-C6)алкиламино: N-(2-гидроксиэтил)-N-метиламино, N-(3-гидроксипропил)-N-метиламино и N-этил-N-(2-гидроксиэтил)амино;
для N-(C1-С6)алкил-(C1-С6)алкокси-(C2-C6)алкиламино: N-метил-N-(2-метоксиэтил)амино, N-метил-N-(3-метоксипропил)амино и N-этил-N-(2-метоксиэтил)амино;
для N-(C1-С6)алкилциано-(C1-С6)алкиламино: N-(цианометил)-N-метиламино;
для N-(C1-С6)алкилкарбокси-(C1-С6)алкиламино: N-карбоксиметил-N-метиламино и N-(2-карбоксиэтил)-N-метиламино;
для N-(C1-С6)алкил-(C1-С6)алкоксикарбонил-(C1-С6)алкиламино: N-метоксикарбонилметил-N-метиламино, N-(2-этоксикарбонилэтил)-N-этиламино и N-(2-трет-бутоксикарбонилэтил)-N-метиламино;
для N-(C1-С6)алкилкарбамоил-(C1-С6)алкиламино: N-карбамоилметил-N-метиламино и N-(2-карбамоилэтил)-N-метиламино;
для N-(C1-С6)алкил-N-(C1-С6)алкилкарбамоил-(C1-С6)алкиламино: N-(N-метилкарбамоилметил)-N-метиламино, N-(N-этилкарбамоилметил)-N-метиламино и N-[2-(N-метилкарбамоил)этил]-N-метиламино;
для N-(C1-С6)алкил-N,N-ди-[(C1-С6)алкил]карбамоил(C1-С6)алкиламино: N-(N,N-диметилкарбамоилметил)-N-метиламино и N-[2-(N,N-диметилкарбамоил)этил]-N-метиламино;
для N-(C1-С6)алкиламино-(C2-C6)алкиламино: N-(2-аминометил)-N-метиламино, N-(3-аминопропил)-N-метиламино и N-(4-аминобутил)-N-метиламино;
для N-(C1-С6)алкил-(C1-С6)алкиламино-(C2-C6)алкиламино: N-(2-метиламиноэтил)-N-метиламино, N-(3-метиламинопропил)-N-метиламино, N-(3-этиламинопропил)-N-этиламино и N-(4-метиламинобутил)-N-метиламино;
для N-(C1-С6)алкилди-[(C1-С6)алкил]амино-(С2-С6)алкиламино: N-(2-диметиламиноэтил)-N-метиламино, N-(2-диэтиламиноэтил)-N-метиламино, N-(3-диэтиламинопропил)-N-метиламино и N-(4-диметиламинобутил)-N-метиламино;
для галоген-(C2-C6)алканоиламино: 2-хлорацетамидо и 3-хлорпропионамидо;
для гидрокси-(С2-С6)алканоиламино: 2-гидроксиацетамидо и 3-гидроксипропионамидо;
для (C1-С6)алкокси-(С2-С6)алканоиламино: 2-метоксиацетамидо и 3-метоксипропионамидо;
для циано-(С2-С6)алканоиламино: 2-цианоацетамидо и 3-цианопропионамидо;
для карбокси-(С2-С6)алканоиламино: 2-карбоксиацетамидо и 3-карбоксипропионамидо;
для (C1-С6)алкоксикарбонил-(C2-C6)алканоиламино: 2-метоксикарбонилацетамидо, 2-(трет-бутоксикарбонил)ацетамидо и 3-метоксикарбонилпропионамидо;
для карбамоил-(С2-С6)алканоиламино: 2-карбамоилацетамидо, 3-карбамоилпропионамидо и 4-карбамоилбутирамидо;
для N-(C1-С6)алкилкарбамоил-(C2-C6)алканоиламино: 2-(N-метилкарбамоил)ацетамидо и 3-(N-этилкарбамоил)пропионамидо;
для N,N-ди-[(C1-C6)алкил]карбамоил-(С2-С6)алканоиламино: 2-(N,N-диметилкарбамоил)ацетамидо, 2-(N,N-диэтилкарбамоил)ацетамидо и 3-(N,N-диметилкарбамоил)пропионамидо;
для амино-(С2-С6)алканоиламино: 2-аминоацетамидо, 2-аминопропионамидо и 3-аминопропионамидо;
для (C1-С6)алкиламино-(С2-С6)алканоиламино: 2-метиламиноацетамидо, 2-этиламиноацетамидо, 2-метиламинопропионамидо и 3-метиламинопропионамидо;
для ди-[(C1-С6)алкил]амино-(С2-С6)алканоиламино: 2-диметиламиноацетамидо, 2-диэтиламиноацетамидо, 2-диметиламинопропионамидо и 3-диметиламинопропионамидо.
Когда, как определено здесь ранее, любой из заместителей в R1 или Q, содержащий СН2-группу, связанную с 2 атомами углерода, или СН3-группу, связанную с атомом углерода, может содержать, необязательно, в каждой из указанной СН2- или СН3-группе заместитель, выбранный из гидрокси, амино, (C1-С6)алкокси, (C1-С6)алкиламино, ди-[(C1-С6)алкил]амино и гетероциклила, подходящими заместителями, образованными таким образом, являются, например, замещенные гетероциклил-(C1-С6)алкоксигруппы, такие как 2-гидрокси-3-пиперидинопропокси и 2-гидрокси-3-морфолинопропокси, замещенные амино-(C2-C6)алкоксигруппы, такие как 3-амино-2-гидроксипропокси, замещенные (C1-С6)алкиламино-(C2-C6)алкоксигруппы, такие как 2-гидрокси-3-метиламинопропокси, замещенные ди-[(C1-С6)алкил]амино-(С2-С6)алкоксигруппы, такие как 3-диметиламино-2-гидроксипропокси, 3-[N-(3-диметиламинопропил)-N-метиламино]пропокси и 3-[N-(3-диметиламинопропил)-N-метиламино]-2-гидроксипропокси, замещенные гетероциклил-(C1-С6)алкиламиногруппы, такие как 2-гидрокси-3-пиперидинопропиламино и 2-гидрокси-3-морфолинопропиламино, замещенные амино-(C2-C6)алкиламиногруппы, такие как 3-амино-2-гидроксипропиламино, замещенные (C1-С6)алкиламино-(C2-C6)алкиламиногруппы, такие как 2-гидрокси-3-метиламинопропиламино, замещенные ди-[(C1-С6)алкил]амино-(С2-С6)алкиламиногруппы, такие как 3-диметиламино-2-гидроксипропиламино, 3-[N-(3-диметиламинопропил)-N-метиламино]пропиламино и 3-[N-(3-диметиламинопропил)-N-метиламино]-2-гидроксипропиламино, и замещенные (C1-С6)алкиламино-(С2-С6)алкильные группы, такие как 2-диметиламиноэтиламинометил, 3-диметиламинопропиламинометил, 3-диметиламино-2,2-диметилпропиламинометил, 2-морфолиноэтиламинометил, 2-пиперазин-1-илэтиламинометил и 3-морфолинопропиламинометил.
Во избежание каких-либо недоразумений, следует иметь в виду, что, когда Х или Y представляет СН-группу, и кольцо, в которое входят группы Х и Y, содержит один или несколько заместителей R1, заместитель R1 может располагаться в любом подходящем месте кольца, включая положение у атома углерода Х или Y.
Подходящей фармацевтически приемлемой солью соединения формулы I является, например, аддитивная соль кислоты соединения формулы I, которое является достаточно основным, например аддитивная соль неорганической или органической кислоты, такой как хлористоводородная, бромистоводородная, серная, трифторуксусная, лимонная или малеиновая кислота; или соль соединения формулы I, которое является достаточно кислотным, например соль щелочного или щелочно-земельного металла, такая как кальциевая или магниевая соль, или соль аммония, или соль органического основания, такого как метиламин, диметиламин, триметиламин, пиперидин, морфолин или трис-(2-гидроксиэтил)амин.
В данной области техники известны различные формы пролекарств. В качестве примеров, описывающих такие пролекарственные производные, см.:
a) Design of Prodrugs, edited by H. Bundgaard (Elsevier, 1985) and Methods in Enzvmology. Vol.42, p.309-396, edited by K. Widder, et al. (Academic Press, 1985);
b) A Textbook of Drug Design and Development, edited by Krogsgaard-Larsen and H.Bundgaard, Chapter 5 "Design and Application of Prodrugs", by H.Bundgaard p.113-191 (1991);
c) H.Bundgaard, Advanced Drug Delivery Reviews, 8, 1-38 (1992);
d) H.Bundgaard. el al., Journal of Pharmaceutical Sciences, 77, 285 (1988); and
e) N.Kakeya. el al., Chem. Pharm. Bull., 32, 692 (1984).
Примером таких пролекарств являются образованные сложные эфиры соединения формулы I, расщепляемые in vivo. Расщепляемый in vivo сложный эфир соединения формулы I, содержащий карбоксигруппу, представляет собой, например, фармацевтически приемлемый сложный эфир, который расщепляется в организме человека или животного с образованием исходной кислоты. Подходящими фармацевтически приемлемыми сложными эфирами для карбокси являются (C1-С6)алкоксиметиловые эфиры, например метоксиметиловый эфир; (C1-С6)алканоилоксиметиловые эфиры, например пивалоилоксиметиловый эфир; фталидиловые эфиры; (С3-С8)циклоалкоксикарбонилокси-(C1-С6)алкиловые эфиры, например 1-циклогексилкарбонилоксиэтиловый эфир; 1,3-диоксолан-2-илметиловые эфиры, например 5-метил-1,3-диоксолан-2-илметиловый эфир; и (C1-С6)алкоксикарбонилоксиэтиловые эфиры, например 1-метоксикарбонилоксиэтиловый эфир; и такие эфиры могут образовываться по любой карбоксигруппе в соединениях данного изобретения.
Специфическими новыми соединениями по первому аспекту изобретения являются, например, амидные производные формулы I или их фармацевтически приемлемые соли, где
(a) R3 представляет водород, галоген (такой, как фтор, хлор или бром) или (C1-С6)алкил (такой, как метил, этил, пропил и изопропил), предпочтительно R3 представляет водород, хлор, метил или этил, более предпочтительно водород, хлор или метил; и X, Y, R1, R2, Q, m, n и q имеют любые значения из указанных выше или в данном разделе, относящемся к новым специфическим соединениям изобретения;
(b) Q представляет фенил или гетероароматическое 5- или 6-членное моноциклическое кольцо или 9- или 10-членное бициклическое кольцо с вплоть до пятью гетероатомами, выбранными из атомов кислорода, азота и серы, содержащее основной заместитель, выбранный из заместителей для Q, указанных выше; и X, Y, R1, R2, R3, m, n и q имеют любые значения из указанных выше или в данном разделе, относящемся к новым специфическим соединениям изобретения;
(c) Q представляет фенил, инденил, инданил или флуоренил, которые, необязательно, содержат 1, 2 или 3 заместителя, выбранных из заместителей для Q, указанных здесь выше; и Х, Y, R1, R2, R3, m, n и q имеют любые значения из указанных выше или в данном разделе, относящемся к новым специфическим соединениям изобретения;
(d) Q представляет фенил или гетероароматическое 5- или 6-членное моноциклическое кольцо или 9- или 10-членное бициклическое кольцо с вплоть до пятью гетероатомами, выбранными из атомов кислорода, азота и серы, содержащее основной заместитель, выбранный из амино, (C1-С6)алкиламино, ди-[(C1-С6)алкил]амино, амино-(C1-С6)алкила, (C1-С6)алкиламино-(C1-С6)алкила, ди-[(C1-С6)алкил]амино-(C1-С6)алкила, амино-(С2-С6)алкокси, (C1-С6)алкиламино-(С2-С6)алкокси, ди-[(C1-С6)алкил]амино-(С2-С6)алкокси, амино-(C2-C6)алкиламино, (C1-С6)алкиламино-(С2-С6)алкиламино, ди-[(C1-С6)алкил]амино-(С2-С6)алкиламино, N-(C1-С6)алкиламино-(С2-С6)алкиламино, N-(C1-С6)алкил-(C1-С6)алкиламино-(C2-C6)алкиламино, N-(C1-С6)алкил-ди-[(C1-С6)алкил]амино-(С2-С6)алкиламино, амино-(С2-С6)алканоиламино, (C1-С6)алкиламино-(C2-C6)алканоиламино, ди-[(C1-С6)алкил]амино-(С2-С6)алканоиламино, гетероарила, гетероарил-(C1-С6)алкила, гетероарил-(C1-С6)алкокси, гетероциклила, гетероциклил-(C1-С6)алкила и гетероциклил-(C1-С6)алкокси, и где любая гетероарильная или гетероциклильная группа в основном заместителе на Q может, необязательно, содержать 1 или 2 заместителя, выбранных из галогена, (C1-С6)алкила, (C2-C6)алканоила, амино, (C1-С6)алкиламино и ди-[(C1-С6)алкил]амино; и X, Y, R1, R2, R3, m, n и q имеют любые значения из указанных выше или в данном разделе, относящемся к новым специфическим соединениям изобретения;
(е) Q представляет фенил или гетероароматическое 5- или 6-членное моноциклическое кольцо или 9- или 10-членное бициклическое кольцо с вплоть до пятью гетероатомами, выбранными из атомов кислорода, азота и серы, содержащее, необязательно, 1, 2 или 3 заместителя, выбранных из гидрокси, галогена, трифторметила, циано, нитро, амино, карбокси, (C1-С6)алкила, (C1-С6)алкокси, (C1-С6)алкиламино, ди-[(C1-С6)алкил]амино, (C1-С6)алкоксикарбонила, (С2-С6)алканоила, галоген-(C1-С6)алкила, (C1-С6)алкокси-(C1-С6)алкила, амино-(С1-С6)алкила, (C1-С6)алкиламино-(C1-С6)алкила, ди-[(C1-С6)алкил]амино-(C1-С6)алкила, галоген-(С2-С6)алкокси, гидрокси-(C2-C6)алкокси, (C1-С6)алкокси-(С2-С6)алкокси, циано-(C1-С6)алкокси, карбокси-(C1-С6)алкокси, (C1-С6)алкоксикарбонил-(C1-С6)алкокси, амино-(С2-С6)алкокси, (C1-С6)алкиламино-(C2-C6)алкокси, ди-[(C1-С6)алкил] амино-(С2-С6)алкокси, пиридила, имидазолила, пиридил-(C1-С6)алкила, имидазолил-(C1-С6)алкила, пиридил-(C1-С6)алкокси, имидазолил-(C1-С6)алкокси, пирролидинила, пиперидинила, морфолинила, пиперазинила, 4-(C1-С6)алкилпиперазинила, 4-(C2-C6)алканоилпиперазинила, пирролидинил-(C1-С6)алкила, пиперидинил-(C1-С6)алкила, морфолинил-(C1-С6)алкила, пиперазинил-(C1-С6)алкила, 4-(C1-С6)алкилпиперазинил-(C1-С6)алкила, 4-(С2-С6)алканоилпиперазинил-(C1-С6)алкила, пирролидинилокси, пиперидинилокси, 1-(C1-С6)алкилпиперидинилокси, пирролидинил-(C2-C6)алкокси, пиперидинил-(С2-С6)алкокси, морфолинил-(С2-С6)алкокси, пиперазинил-(С2-С6)алкокси, 4-(C1-С6)алкилпиперазинил-(C2-C6)алкокси и 4-(С2-С6)алканоилпиперазинил-(С2-С6)алкокси, или Q содержит заместитель (C1-С3)алкилендиокси; и X, Y, R1, R2, R3, m, n и q имеют любые значения из указанных выше или в данном разделе, относящемся к специфическим новым соединениям изобретения;
(f) Q представляет фенил, инденил, инданил, флуоренил или гетероароматическое 5- или 6-членное моноциклическое кольцо с вплоть до тремя гетероатомами, выбранными из атомов кислорода, азота и серы, содержащее, необязательно, 1, 2 или 3 заместителя, выбранных из гидрокси, галогена, трифторметила, циано, нитро, амино, карбокси, (C1-С6)алкила, (С1-С6)алкокси, (C1-С6)алкиламино, ди-[(C1-С6)алкил]амино, (C1-С6)алкоксикарбонила, (С2-С6)алканоила, (C1-С6)алканоиламино, (C1-С6)алкансульфониламино, N-(C1-С6)алкил-(C1-С6)алкансульфониламино, фенила, фурила, тиенила, азетидинила, пирролинила, пирролидинила, 1,1-диоксидоизотиазолидинила, пиперидинила, гомопиперидинила, морфолинила, пиперазинила, гомопиперазинила, пирролидинил-(C1-С6)алкила, пиперидинил-(C1-С6)алкила, морфолинил-(C1-С6)алкила и пиперазинил-(C1-С6)алкила, и где любая фенильная, фурильная, тиенильная или гетероциклильная группа в заместителе на Q может, необязательно, содержать 1 или 2 заместителя, выбранных из галогена, (C1-С6)алкила, (C1-С6)алкокси и (C2-C6)алканоила; и X, Y, R1, R2, R3, m, n и q имеют любые значения из указанных выше или в данном разделе, относящемся к специфическим новым соединениям изобретения;
(g) Q представляет фенил, фурил, тиенил, оксазолил, изоксазолил, имидазолил, пиразолил, тиазолил, изотиазолил, пиридил, пиридазинил, пиримидинил, пиразинил, бензофуранил, индолил, бензотиенил, бензоксазолил, бензимидазолил, бензотиазолил, индазолил, бензофуразанил, хинолил, изохинолил, хиназолинил, хиноксалинил или нафтиридинил, которые, необязательно, содержат 1 или 2 заместителя, выбранных из заместителей, указанных ранее в параграфах (b), (d) или (е); и X, Y, R1, R2, R3, m, n и q имеют любые значения из указанных выше или в данном разделе, относящемся к специфическим новым соединениям изобретения;
(h) Q представляет фенил, 2- или 3-фурил, 2- или 3-тиенил, 2-, 4- или 5-оксазолил, 3-, 4- или 5-изоксазолил, 2-, 4- или 5-имидазолил, 3- или 4-пиразолил, 2-, 4- или 5-тиазолил, 3-, 4- или 5-изотиазолил, 2-, 3- или 4-пиридил, 3- или 4-пиридазинил, 2-, 4- или 5-пиримидинил, 2-пиразинил, 2-, 3-, 5- или 6-бензофуранил, 2-, 3-, 5- или 6-индолил, 2-, 3-, 5- или 6-бензотиенил, 2-, 5- или 6-бензоксазолил, 2-, 5- или 6-бензимидазолил, 2-, 5- или 6-бензотиазолил, 3-, 5- или 6-индазолил, 5-бензофуразанил, 2-, 3-, 6-или 7-хинолил, 3-, 6- или 7-изохинолил, 2-, 6- или 7-хиназолинил, 2-, 6- или 7-хиноксалинил или 1,8-нафтиридин-2-ил или 1,8-нафтиридин-3-ил, которые, необязательно, содержат 1 или 2 заместителя, выбранных из заместителей, указанных ранее в параграфах (b), (d) или (е); и X, Y, R1, R2, R3, m, n и q имеют любые значения из указанных выше или в данном разделе, относящемся к специфическим новым соединениям изобретения;
(i) Q представляет гетероароматическое 5- или 6-членное моноциклическое кольцо, или 9- или 10-членное бициклическое кольцо, или 13- или 14-членное трициклическое кольцо с вплоть до пятью гетероатомами, выбранными из атомов кислорода, азота и серы, содержащее, необязательно, 1, 2 или 3 заместителя, выбранных из гидрокси, галогена, трифторметила, циано, нитро, амино, карбокси, (C1-С6)алкила, (C1-С6)алкокси, (С1-С3)алкилендиокси, (C1-С6)алкиламино, ди-[(C1-С6)алкил]амино и (C1-С6)алкоксикарбонила; и X, Y, R1, R2, R3, m, n и q имеют любые значения из указанных выше или в данном разделе, относящемся к специфическим новым соединениям изобретения;
(j) Q представляет гетероароматическое 13- или 14-членное трициклическое кольцо с вплоть до пятью гетероатомами, выбранными из атомов кислорода, азота и серы, содержащее, необязательно, 1, 2 или 3 заместителя, выбранных из гидрокси, галогена, трифторметила, циано, нитро, амино, карбокси, (C1-С6)алкила, (C1-С6)алкокси, (C1-С3)алкилендиокси, (C1-С6)алкиламино, ди-[(C1-С6)алкил]амино и (С1-С6)алкоксикарбонила; и X, Y, R1, R2, R3, m, n и q имеют любые значения из указанных выше или в данном разделе, относящемся к специфическим новым соединениям изобретения;
(k) Q представляет фурил, тиенил, оксазолил, изоксазолил, имидазолил, пиразолил, тиазолил, изотиазолил, пиридил, пиридазинил, пиримидинил, пиразинил, бензофуранил, индолил, бензотиенил, бензоксазолил, бензимидазолил, бензотиазолил, индазолил, бензофуразанил, хинолил, изохинолил, хиназолинил, хиноксалинил, нафтиридинил, карбазолил, дибензофуранил, дибензотиофенолил или ксантенил, которые, необязательно, содержат 1 или 2 заместителя, выбранных из заместителей, указанных ранее в параграфе (i); и X, Y, R1, R2, R3, m, n и q имеют любые значения из указанных выше или в данном разделе, относящемся к специфическим новым соединениям изобретения;
(l) Q представляет 1-, 2- или 3-карбазолил, 1-, 2-, 3- или 4-дибензофуранил или 1-, 2-, 3- или 4-дибензотиофенил, которые, необязательно, содержат 1 или 2 заместителя, выбранных из заместителей, указанных ранее в параграфе (i); и X, Y, R1, R2, R3, m, n и q имеют любые значения из указанных выше или в данном разделе, относящемся к специфическим новым соединениям изобретения;
(m) n равен 0 и X, Y, R1, R3, Q, m и q имеют любые значения из указанных выше или в данном разделе, относящемся к специфическим новым соединениям изобретения;
(n) n равен 1 и R2 представляет галоген или (C1-С6)-алкил; и Х, Y, R1, R3, Q, m и q имеют любые значения из указанных выше или в данном разделе, относящемся к специфическим новым соединениям изобретения;
(о) q равен 0 и X, Y, R1, R2, R3, Q, m и n имеют любые значения из указанных выше или в данном разделе, относящемся к специфическим новым соединениям изобретения;
(р) m равен 1 и R1 представляет амино, (C1-С6)алкиламино, ди-[(C1-С6)алкил]амино, амино-(C1-С6)алкил, (С1-С6)алкиламино-(C1-С6)алкил, ди-[(C1-С6)алкил]амино-(C1-С6)алкил, амино-(С2-С6)алкокси, (C1-С6)алкиламино-(С2-С6)алкокси, ди-[(C1-С6)алкил]амино-(С2-С6)алкокси, амино-(C2-C6)алкиламино, (C1-С6)алкиламино-(С2-С6)алкиламино, ди-[(C1-С6)алкил]амино-(С2-С6)алкиламино, N-(C1-С6)алкиламино-(С2-С6)алкиламино, N-(C1-С6)алкил-(C1-С6)алкиламино-(С2-С6)алкиламино, N-(C1-С6)алкилди-[(C1-С6)алкил]амино-(С2-С6)алкиламино, гетероарил, гетероарил-(C1-С6)алкил, гетероарил-(C1-С6)алкокси, гетероциклил, гетероциклил-(C1-С6)алкил, гетероциклилокси или гетероциклил-(C1-С6)алкокси, и где любая гетероарильная или гетероциклильная группа в заместителе R1 может содержать, необязательно, 1 или 2 заместителя, выбранных из гидрокси, галогена, (C1-С6)алкила, (C1-С6)алкокси, (C2-C6)алканоила, амино, (C1-С6)алкиламино и ди-[(C1-С6)алкил]амино; и X, Y, R2, R3, Q, n и q имеют любые значения из указанных выше или в данном разделе, относящемся к специфическим новым соединениям изобретения;
(q) m равен 1 и R1 представляет амино, (C1-С6)алкил-амино, ди-[(C1-С6)алкил]амино, амино-(C1-С6)алкил, (C1-С6)алкиламино-(C1-С6)алкил, ди-[(C1-С6)алкил] амино-(C1-С6)алкил, амино-(С2-С6)алкокси, (C1-С6)алкиламино-(С2-С6)алкокси, ди-[(C1-С6)алкил]амино-(C2-C6)алкокси, амино-(C2-C6)алкиламино, (C1-С6)алкиламино-(С2-С6)алкиламино, ди-[(C1-С6)алкил] амино-(С2-С6)алкиламино, N-(C1-С6)алкиламино-(С2-С6)алкиламино, N-(C1-С6)алкил-(C1-С6)алкиламино-(C2-C6)алкиламино, N-(C1-С6)алкилди-[(C1-С6)алкил]амино-(С2-С6)алкиламино, пиридил, имидазолил, пиридил-(C1-С6)алкил, имидазолил-(C1-С6)алкил, пиридил-(C1-С6)алкокси, имидазолил-(C1-С6)алкокси, пирролидинил, пиперидинил, морфолинил, пиперазинил, 4-(C1-С6)алкилпиперазинил, гомопиперазинил, 4-(C1-С6)алкилгомопиперазинил, 4-(С2-С6) алканоилпиперазинил, пирролидинил-(C1-С6)алкил, пиперидинил-(C1-С6)алкил, морфолинил-(C1-С6)алкил, пиперазинил-(C1-С6)алкил, 4-(C1-С6)алкилпиперазинил-(C1-С6)алкил, 4-(С2-С6)алканоилпиперазинил-(C1-С6)алкил, пирролидинилокси, пиперидинилокси, 1-(C1-С6)алкилпиперидинилокси, пирролидинил-(С2-С6)алкокси, пиперидинил-(С2-С6)алкокси, морфолинил-(С2-С6)алкокси, пиперазинил-(С2-С6)алкокси, 4-(C1-С6)алкилпиперазинил-(С2-С6)алкокси или 4-(С2-С6)алканоилпиперазинил-(C2-C6)алкокси; и X, Y, R2, R3, Q, n и q имеют любые значения из указанных выше или в данном разделе, относящемся к специфическим новым соединениям изобретения;
(r) m равен 1 и R1 представляет гидрокси, галоген, трифторметил, циано, меркапто, нитро, карбокси, (C1-С6)алкоксикарбонил, (C1-С6)алкил или (C1-С6)алкокси; и X, Y, R2, R3, Q, n и q имеют любые значения из указанных выше или в данном разделе, относящемся к специфическим новым соединениям изобретения;
(s) m равен 2 и первый заместитель R1 выбран из заместителей, описанных ранее в параграфе (q), а второй заместитель R1 выбран из заместителей, описанных ранее в параграфе (r); и X, Y, R2, R3, Q, n и q имеют любые значения из указанных выше или в данном разделе, относящемся к специфическим новым соединениям изобретения;
(t) каждый из Х и Y представляет СН-группу; и R1, R2, R3, Q, m, n и q имеют любые значения из указанных выше или в данном разделе, относящемся к специфическим новым соединениям изобретения; и
(u) один или оба из Х и Y представляют N-группу; и R1, R2, R3, Q, m, n и q имеют любые значения из указанных выше или в данном разделе, относящемся к специфическим новым соединениям изобретения.
Особыми новыми соединениями по второму аспекту изобретения являются, например, производные амида формулы I или их фармацевтически приемлемые соли, где
(a) R3 представляет галоген (такой, как фтор, хлор или бром) или (C1-С6)алкил (такой, как метил, этил, пропил и изопропил), предпочтительно R3 представляет хлор, метил или этил, более предпочтительно хлор или метил; и X, Y, R1, R2, Q, m, n и q имеют любые указанные выше значения.
Предпочтительное соединение по первому аспекту изобретения представляет собой производное амида формулы I, где
Х представляет СН или N;
Y представляет СН или N;
R3 представляет водород, фтор, хлор, бром, метил или этил;
m равен 0, 1 или 2;
R1 представляет гидрокси, фтор, хлор, бром, трифторметил, циано, метил, этил, пропил, метокси, этокси, амино, метиламино, этиламино, диметиламино, диэтиламино, метиламинометил, этиламинометил, диметиламинометил, диэтиламинометил, 2-аминоэтокси, 3-аминопропокси, 2-метиламиноэтокси, 2-этиламиноэтокси, 3-метиламинопропокси, 3-этиламинопропокси, 2-диметиламиноэтокси, 2-диэтиламиноэтокси, 3-диметиламинопропокси, 3-диэтиламинопропокси, 2-аминоэтиламино, 3-аминопропиламино, 2-метиламиноэтиламино, 2-этиламиноэтиламино, 3-метиламинопропиламино, 3-этиламинопропиламино, 2-диметиламиноэтиламино, 2-диэтиламиноэтиламино, 3-диметиламинопропиламино, 3-диэтиламинопропиламино, N-(2-аминоэтил)-N-метиламино, N-(3-аминопропил)-N-метиламино, N-(2-метиламиноэтил)-N-метиламино, N-(2-этиламиноэтил)-N-метиламино, N-(3-метиламинопропил)-N-метиламино, N-(3-этиламинопропил)-N-метиламино, N-(2-диметиламиноэтил)-N-метиламино, N-(2-диэтиламиноэтил)-N-метиламино, N-(3-диметиламинопропил)-N-метиламино, N-(3-диэтиламинопропил)-N-метиламино, пиридил, пиридилметил, пиридилметокси, пирролидинил, пиперидинил, морфолинил, пиперазинил, 4-метилпиперазинил, гомопиперазинил, 4-метилгомопиперазинил, 4-ацетилпиперазинил, пирролидинилметил, пиперидинилметил, морфолинилметил, пиперазинилметил, 4-метилпиперазинилметил, 4-ацетилпиперазинилметил, пирролидинилокси, 1-метилпирролидинилокси, пиперидинилокси, 1-метилпиперидинилокси, 2-(пирролидинил)этокси, 3-(пирролидинил)пролокси, 2-(пиперидинил)этокси, 3-(пиперидинил)пропокси, 2-(морфолинил)этокси, 3-(морфолинил)пропокси, 2-(пиперазинил) этокси, 3-(пиперазинил)пропокси, 2-(4-метилпиперазинил) этокси, 3-(4-метилпиперазинил)пропокси, 2-(4-ацетилпиперазинил)этокси или 3-(4-ацетилпиперазинил)пропокси;
n равен 0 или 1;
R2 представляет фтор, хлор, бром, метил или этил;
q равен 0;
Q представляет фенил, фурил, тиенил, оксазолил, изоксазолил, имидазолил, пиразолил, тиазолил, изотиазолил, пиридил, пиридазинил, пиримидинил, пиразинил, бензофуранил, индолил, бензотиенил, бензоксазолил, бензимидазолил, бензотиазолил, индазолил, бензофуразанил, хинолил, изохинолил, хиназолинил, хиноксалинил или нафтиридинил, которые, необязательно, содержат 1 или 2 заместителя, выбранных из гидрокси, фтора, хлора, трифторметила, циано, амино, метила, этила, метокси, этокси, метилендиокси, метиламино, этиламино, диметиламино, диэтиламино, аминометила, метиламинометила, этиламинометила, диметиламинометила, диэтиламинометила, 2-гидроксиэтокси, 3-гидроксипропокси, 2-метоксиэтокси, 2-этоксиэтокси, 3-метоксипропокси, 3-этоксипропокси, 2-аминоэтокси, 3-аминопропокси, 2-метиламиноэтокси, 2-этиламиноэтокси, 3-метиламинопропокси, 3-этиламинопропокси, 2-диметиламиноэтокси, 2-диэтиламиноэтокси, 3-диметиламинопропокси, 3-диэтиламинопропокси, пиридила, пиридилметила, пиридилметокси, пирролидинила, пиперидинила, морфолинила, пиперазинила, 4-метилпиперазинила, гомопиперазинила, 4-метилгомопиперазинила, 4-ацетилпиперазинила, пирролидинилметила, пиперидинилметила, морфолинилметила, пиперазинилметила, 4-метилпиперазинилметила, 4-ацетилпиперазинилметила, пирролидинилокси, 1-метилпирролидинилокси, пиперидинилокси, 1-метил-пиперидинилокси, 2-(пирролидинил)этокси, 3-(пирролидинил)пропокси, 2-(пиперидинил)этокси, 3-(пиперидинил)пропокси, 2-(морфолинил)этокси, 3-(морфолинил)пропокси, 2-(пиперазинил)этокси, 3-(пиперазинил)пропокси, 2-(4-метилпиперазинил)этокси, 3-(4-метилпиперазинил)пропокси, 2-(4-ацетилпиперазинил)этокси и 3-(4-ацетилпиперазинил)пропокси;
или его фармацевтически приемлемую соль.
Другое предпочтительное соединение по первому аспекту изобретения представляет собой производное амида формулы I, где
Х представляет СН;
Y представляет СН или N;
R3 представляет водород, хлор или метил;
m равен 0, 1 или 2;
R1 представляет гидрокси, фтор, хлор, бром, трифторметил, циано, метил, этил, пропил, метокси, этокси, амино, метиламино, этиламино, диметиламино, диэтиламино, метиламинометил, этиламинометил, диметиламинометил, диэтиламинометил, 2-аминоэтокси, 3-аминопропокси, 2-метиламиноэтокси, 2-этиламиноэтокси, 3-метиламинопропокси, 3-этиламинопропокси, 2-диметиламиноэтокси, 2-диэтиламиноэтокси, 3-диметиламинопропокси, 3-диэтиламинопропокси, 2-аминоэтиламино, 3-аминопропиламино, 2-метиламиноэтиламино, 2-этиламиноэтиламино, 3-метиламинопропиламино, 3-этиламинопропиламино, 2-диметиламиноэтиламино, 2-диэтиламиноэтиламино, 3-диметиламинопропиламино, 3-диэтиламинопропиламино, N-(2-аминоэтил)-N-метиламино, N-(3-аминопропил)-N-метиламино, N-(2-метиламиноэтил)-N-метиламино, N-(2-этиламиноэтил)-N-метиламино, N-(3-метиламинопропил)-N-метиламино, N-(3-этиламинопропил)-N-метиламино, N-(2-диметиламиноэтил)-N-метиламино, N-(2-диэтиламиноэтил)-N-метиламино, N-(3-диметиламинопропил)-N-метиламино, N-(3-диэтиламинопропил)-N-метиламино, 2-пиридил-метил, 3-пиридилметил, 4-пиридилметил, 2-пиридилметокси, 3-пиридилметокси, 4-пиридилметокси, пирролидин-1-ил, пиперидино, морфолино, пиперазин-1-ил, 4-метилпилеразин-1-ил, гомопиперазин-1-ил, 4-метилгомопиперазин-1-ил, 4-ацетил-пиперазин-1-ил, пирролидин-1-илметил, пиперидинометил, морфолинометил, пиперазин-1-илметил, 4-метилпиперазин-1-илметил, 4-ацетилпиперазин-1-илметил, пирролидин-3-илокси, 1-метилпирролидин-3-илокси, пиперидин-4-илокси, 1-метилпиперидин-4-илокси, 2-(пирролидин-1-ил)этокси, 3-(пирролидин-1-ил)пропокси, 2-пиперидиноэтокси, 3-пиперидинопропокси, 2-морфолиноэтокси, 3-морфолинопропокси, 2-пиперазин-1-илэтокси, 3-пиперазин-1-илпропокси, 2-(4-метилпиперазин-1-ил)этокси, 3-(4-метилпиперазин-1-ил)пропокси, 2-(4-ацетилпиперазин-1-ил)-этокси или 3-(4-ацетилпиперазин-1-ил)пропокси;
n равен 0;
q равен 0 и
Q представляет фенил, 2-фурил, 2-тиенил, 4-оксазолил, 5-изоксазолил, 4-тиазолил, 5-изотиазолил, 2-пиридил, 3-пиридил, 4-пиридил, 2-бензофуранил, 2-индолил, 2-бензотиенил, 2-бензоксазолил, 2-бензимидазолил, 2-бензотиазолил, 4-бензофуранил, 2-хинолил, 6-хинолил, 7-хинолил, 3-изохинолил, 6-хиназолинил, 7-хиназолинил, 6-хиноксалинил или 7-хиноксалинил, которые, необязательно, содержат 1 или 2 заместителя, выбранных из гидрокси, фтора, хлора, трифторметила, циано, амино, метила, этила, метокси, этокси, метилендиокси, метиламино, этиламино, диметиламино, диэтиламино, аминометила, метиламинометила, этиламинометила, диметиламинометила, диэтиламинометила, 2-гидроксиэтокси, 3-гидроксипропокси, 2-метоксиэтокси, 2-этоксиэтокси, 3-метоксипропокси, 3-этоксипропокси, 2-аминоэтокси, 3-аминопропокси, 2-метиламиноэтокси, 2-этиламиноэтокси, 3-метиламинопропокси, 3-этиламинопропокси, 2-диметиламиноэтокси, 2-диэтиламиноэтокси, 3-диметиламинопропокси, 3-диэтиламинопропокси, 2-пиридила, 3-пиридила, 4-пиридила, 2-пиридилметила, 3-пиридилметила, 4-пиридилметила, 2-пиридилметокси, 3-пиридилметокси, 4-пиридилметокси, пирролидин-1-ила, пиперидино, морфолино, пиперазин-1-ила, 4-метил-пиперазин-1-ила, гомопиперазин-1-ила, 4-метилгомопиперазин-1-ила, 4-ацетилпиперазин-1-ила, пирролидинилметила, пиперидинометила, морфолинометила, пиперазин-1-илметила, 4-метилпиперазин-1-илметила, 4-ацетилпиперазин-1-илметила, пирролидин-3-илокси, 1-метиллирролидин-3-илокси, пиперидин-4-илокси, 1-метилпиперидин-4-илокси, 2-пирролидин-1-илэтокси, 3-пирролидин-1-илпропокси, 2-пиперидиноэтокси, 3-пиперидинопропокси, 2-морфолиноэтокси, 3-морфолинопропокси, 2-пиперазин-1-илэтокси, 3-пиперазин-1-илпропокси, 2-(4-метил-пиперазин-1-ил)этокси, 3-(4-метилпиперазин-1-ил) пропокси, 2-(4-ацетилпиперазин-1-ил)этокси и 3-(4-ацетилпиперазин-1-ил)-пропокси;
или его фармацевтически приемлемую соль.
Другое предпочтительное соединение по первому аспекту изобретения представляет собой производное амида формулы I,
где Х представляет СН;
Y представляет СН или N;
R3 представляет водород, хлор или метил;
m равен 0, 1 или 2;
R1 представляет гидрокси, фтор, хлор, бром, трифторметил, циано, метил, этил, пропил, метокси, этокси, амино, метиламино, этиламино, диметиламино, диэтиламино, метиламинометил, этиламинометил, диметиламинометил, диэтиламинометил, 2-аминоэтокси, 3-аминопропокси, 2-метиламиноэтокси, 2-этиламиноэтокси, 3-метиламинопропокси, 3-этиламинопропокси, 2-диметиламиноэтокси, 2-диэтиламиноэтокси, 3-диметиламинопропокси, 3-диэтиламинопропокси, 2-аминоэтиламино, 3-аминопропиламино, 2-метиламиноэтиламино, 2-этиламиноэтиламино, 3-метиламинопропиламино, 3-этиламинопропиламино, 2-диметиламиноэтиламино, 2-диэтиламиноэтиламино, 3-диметиламинопропиламино, 3-диэтиламинопропиламино, N-(2-аминоэтил)-N-метиламино, N-(3-аминопропил)-N-метиламино, N-(2-метиламиноэтил)-N-метиламино, N-(2-этиламиноэтил)-N-метиламино, N-(3-метиламинопропил)-N-метиламино, N-(3-этиламинопропил)-N-метиламино, N-(2-диметиламиноэтил)-N-метиламино, N-(2-диэтиламиноэтил)-N-метиламино, N-(3-диметиламинопропил)-N-метиламино, N-(3-диэтиламинопропил)-N-метиламино, 2-пиридилметил, 3-пиридилметил, 4-пиридилметил, 2-пиридилметокси, 3-пиридилметокси, 4-пиридилметокси, пирролидин-1-ил, пиперидино, морфолино, пиперазин-1-ил, 4-метилпиперазин-1-ил, гомопиперазин-1-ил, 4-метилгомопиперазин-1-ил, 4-ацетилпиперазин-1-ил, пирролидин-1-илметил, пиперидинометил, морфолинометил, пиперазин-1-илметил, 4-метилпиперазин-1-илметил, 4-ацетилпиперазин-1-илметил, пирролидин-3-илокси, 1-метилпирролидин-3-илокси, пиперидин-4-илокси, 1-метилпиперидин-4-илокси, 2-(пирролидин-1-ил)этокси, 3-(пирролидин-1-ил)пропокси, 2-пиперидиноэтокси, 3-пиперидинопропокси, 2-морфолиноэтокси, 3-морфолинопропокси, 2-пиперазин-1-илэтокси, 3-пиперазин-1-илпропокси, 2-(4-метилпиперазин-1-ил)этокси, 3-(4-метилпиперазин-1-ил)пропокси, 2-(4-ацетилпиперазин-1-ил)этокси или 3-(4-ацетилпиперазин-1-ил)пропокси;
n равен 0;
q равен 0 и
Q представляет фенил, 2-пиридил, 3-пиридил или 4-пиридил, которые, необязательно, содержат 1 или 2 заместителя, выбранных из гидрокси, фтора, хлора, трифторметила, циано, амино, метила, этила, метокси, этокси, метилендиокси, метиламино, этиламино, диметиламино, диэтиламино, аминометила, метиламинометила, этиламинометила, диметиламинометила, диэтиламинометила, 2-гидроксиэтокси, 3-гидроксипропокси, 2-метоксиэтокси, 2-этоксиэтокси, 3-метоксипропокси, 3-этоксипропокси, 2-аминоэтокси, 3-аминопропокси, 2-метиламиноэтокси, 2-этиламиноэтокси, 3-метиламинопропокси, 3-этиламинопропокси, 2-диметиламиноэтокси, 2-диэтиламиноэтокси, 3-диметиламинопропокси, 3-диэтиламинопропокси, 2-пиридила, 3-пиридила, 4-пиридила, 2-пиридилметила, 3-пиридилметила, 4-пиридилметила, 2-пиридилметокси, 3-пиридилметокси, 4-пиридилметокси, пирролидин-1-ила, пиперидино, морфолино, пиперазин-1-ила, 4-метилпилеразин-1-ила, гомопиперазин-1-ила, 4-метилгомопиперазин-1-ила, 4-ацетилпиперазин-1-ила, пирролидин-1-илметила, пиперидинометила, морфолинометила, пиперазин-1-илметила, 4-метил-пиперазин-1-илметила, 4-ацетилпиперазин-1-илметила, пирролидин-3-илокси, 1-метилпирролидин-3-илокси, пиперидин-4-илокси, 1-метилпиперидин-4-илокси, 2-пирролидин-1-илэтокси, 3-пирролидин-1-илпропокси, 2-пиперидиноэтокси, 3-пиперидинопропокси, 2-морфолиноэтокси, 3-морфолинопропокси, 2-пиперазин-1-илэтокси, 3-пиперазин-1-илпропокси, 2-(4-метилпиперазин-1-ил)этокси, 3-(4-метилпиперазин-1-ил)пропокси, 2-(4-ацетилпиперазин-1-ил)этокси и 3-(4-ацетилпиперазин-1-ил)пропокси;
или его фармацевтически приемлемую соль.
Другое предпочтительное соединение по первому аспекту изобретения представляет собой производное амида формулы I,
где Х представляет СН;
Y представляет СН или N;
R3 представляет водород, хлор или метил;
m равен 1 или 2;
R1 представляет гидрокси, фтор, хлор, бром, метил, этил, пропил, метокси, диметиламинометил, диэтиламинометил, 2-диметиламиноэтокси, 2-диэтиламиноэтокси, 3-диметиламинопропокси, 3-диэтиламинопропокси, 2-диметиламино-2-гидроксипропокси, 3-диэтиламино-2-гидроксипропокси, 2-аминоэтиламино, 3-аминопропиламино, 4-аминобутиламино, 3-метиламинопропиламино, 2-диметиламиноэтиламино, 2-диэтиламиноэтиламино, 3-диметиламинопропиламино, 4-диметиламинобутиламино, 3-амино-2-гидроксипропиламино, 3-диметиламино-2-гидроксипропиламино, N-(2-диметиламиноэтил)-N-метиламино, N-(3-диметиламинопропил)-N-метиламино, пирролидин-1-ил, морфолино, пиперидино, пиперазин-1-ил, 4-метилпиперазин-1-ил, 4-этилпиперазин-1-ил, 4-(2-гидроксиэтил)пиперазин-1-ил, гомопиперазин-1-ил, 4-метилгомопиперазин-1-ил, пиперазин-1-илметил, 4-метилпиперазин-1-илметил, гомопиперазин-1-илметил, 4-метилгомопиперазин-1-илметил, морфолинометил, 3-аминопирролидин-1-илметил, 3-гидроксипирролидин-1-илметил, 4-(2-гидроксиэтил)пиперазин-1-илметил, пирролидин-3-илокси, 1-метилпирролидин-3-илокси, пиперидин-4-илокси, 1-метилпиперидин-4-илокси, 1-бензилпиперидин-4-илокси, 2-пирролидин-1-илэтокси, 3-пирролидин-1-илпропокси, 2-пиперидиноэтокси, 3-пиперидинопропокси, 2-морфолиноэтокси, 3-морфолинопропокси, 2-пиперазин-1-илэтокси, 3-пиперазин-1-илпропокси, 2-(4-метилпиперазин-1-ил)этокси, 3-(4-метилпилеразин-1-ил)пропокси, 2-гидрокси-3-пирролидин-1-илпропокси, 2-гидрокси-3-пиперидинопропокси, 2-гидрокси-3-морфолинопропокси, пиперидин-4-иламино, 1-метилпиперидин-4-иламино, 1-бензилпиперидин-4-иламино, 2-пирролидин-1-илэтиламино, 3-пирролидин-1-илпропиламино, 2-морфолиноэтиламино, 3-морфолинопропиламино, 2-пиперидиноэтиламино, 3-пиперидинопропиламино, 2-пиперазин-1-илпропиламино, 3-пиперазин-1-илпропиламино, 2-(4-метилпиперазин-1-ил)этиламино, 3-(4-метилпиперазин-1-ил)пропиламино, 2-(1-метилпирролидин-2-ил)этиламино, 3-(1-метилпирролидин-2-ил) пропиламино, 2-диметиламиноэтиламинометил, 3-диметиламинопропиламинометил, 3-диметиламино-2,2-диметилпропиламинометил, 2-(1-метилпирролидин-2-илэтил)аминометил, 3-пирролидин-1-илпропиламинометил, 2-морфолиноэтиламинометил, 3-морфолинопропиламинометил, 2-пиперазин-1-илэтиламинометил, 3-(4-метилпиперазин-1-илпропил)аминометил или 2-пиридилметокси;
n равен 0;
q равен 0 и
Q представляет 2-пиридил, 3-пиридил или 4-пиридил, которые, необязательно, содержат заместитель, выбранный из пирролидин-1-ила, 3-гидроксипирролидин-1-ила, 2-гидроксиметилпирролидин-1-ила, морфолино, пиперидино, 4-гидроксипиперидин-1-ила, пиперазин-1-ила и 4-метилпиперазин-1-ила;
или его фармацевтически приемлемую соль.
Особенно предпочтительное соединение по первому аспекту изобретения представляет собой производное амида формулы I,
где Х представляет СН;
Y представляет СН или N;
R3 представляет водород, хлор или метил;
m равен 1 и R1 выбран из диэтиламинометила, N-(3-диметиламинопропил)-N-метиламино, пирролидин-1-ила, морфолино, пиперидино, пиперазин-1-ила, 4-метилпиперазин-1-ила, 4-этилпиперазин-1-ила, гомопиперазин-1-ила, 4-метилгомопиперазин-1-ила, пиперазин-1-илметила, 4-метилпиперазин-1-илметила, 4-метилгомопиперазин-1-илметила, морфолинометила, 3-аминопирролидин-1-илметила, 3-гидроксипирролидин-1-илметила, пирролидин-3-илокси, пирролидин-4-илокси, 2-пирролидин-1-илэтокси, 2-пиперидиноэтокси, 2-морфолиноэтокси, 3-диметиламинопропиламинометила, 3-диметиламино-2,2-диметил-пропиламинометила, 2-(1-метилпирролидин-2-илэтил)аминометила, 3-пирролидин-1-илпропиламинометила, 2-морфолиноэтиламино-метила, 3-морфолинопропиламинометила, 2-пиперазин-1-илэтиламинометила, 3-(4-метилпиперазин-1-илпропил)аминометила и 2-пиридилметокси;
n равен 0;
q равен 0 и
Q представляет 3-пиридил или 4-пиридил, которые, необязательно, содержат заместитель, выбранный из пирролидин-1-ила, морфолино, пиперидино, пиперазин-1-ила и 4-метилпиперазин-1-ила;
или его фармацевтически приемлемую соль.
Другим особенно предпочтительным соединением по первому аспекту изобретения является производное амида формулы I,
где Х представляет СН;
Y представляет СН или N;
R3 представляет водород, хлор или метил;
m равен 1 и R1 представляет N-(3-диметиламинопропил)-N-метиламино, 4-метилпиперазин-1-ил, 4-метилгомопиперазин-1-ил, 4-метилпиперазин-1-илметил или пирролидин-3-илокси;
n равен 0;
q равен 0 и
Q представляет 2-морфолинопирид-4-ил;
или его фармацевтически приемлемую соль.
Конкретными предпочтительными соединениями изобретения являются, например,
N-[3-(4-метилпиперазин-1-илметил)фенил]-2-метил-5-(2-морфолинопирид-4-илкарбониламино)бензамид,
N-[6-(4-этилпиперазин-1-ил)пирид-3-ил]-2-хлор-5-(2-морфолинопирид-4-илкарбониламино)бензамид,
N-[6-(4-метилпиперазин-1-ил)пирид-3-ил]-2-хлор-5-(2-морфолинопирид-4-илкарбониламино)бензамид или
N-{6-[N-(3-диметиламинопропил)-N-метиламино]пирид-3-ил}-2-хлор-5-(2-морфолинопирид-4-илкарбониламино)бензамид;
или их фармацевтически приемлемые соли.
Предпочтительное соединение по второму аспекту изобретения представляет собой производное амида формулы I,
где X представляет СН или N;
Y представляет СН или N;
R3 представляет фтор, хлор, бром, метил или этил;
m равен 0, 1 или 2;
R1 представляет гидрокси, фтор, хлор, бром, трифторметил, циано, метил, этил, метокси, этокси, амино, метиламино, этиламино, диметиламино, диэтиламино, метиламинометил, этиламинометил, диметиламинометил, диэтиламинометил, 2-аминоэтокси, 3-аминопропокси, 2-метиламиноэтокси, 2-этиламиноэтокси, 3-метиламинопропокси, 3-этиламинопропокси, 2-диметиламиноэтокси, 2-диэтиламиноэтокси, 3-диметиламинопропокси, 3-диэтиламинопропокси, 2-аминоэтиламино, 3-аминопропиламино, 2-метиламиноэтиламино, 2-этиламиноэтиламино, 3-метиламинопропиламино, 3-этиламинопропиламино, 2-диметиламиноэтиламино, 2-диэтиламиноэтиламино, 3-диметиламинопропиламино, 3-диэтиламинопропиламино, N-(2-аминоэтил)-N-метиламино, N-(3-аминопропил)-N-метиламино, N-(2-метиламиноэтил)-N-метиламино, N-(2-этиламиноэтил)-N-метиламино, N-(3-метиламинопропил)-N-метиламино, N-(3-этиламинопропил)-N-метиламино, N-(2-диметиламиноэтил)-N-метиламино, N-(2-диэтиламиноэтил)-N-метиламино, N-(3-диметиламинопропил)-N-метиламино, N-(3-диэтиламинопропил)-N-метиламино, пиридил, пиридилметил, пиридилметокси, 3-пирролинил, пирролидинил, пиперидинил, гомопиперидинил, морфолинил, пиперазинил, 4-метилпиперазинил, 4-этилпиперазинил, гомопиперазинил, 4-метилгомопиперазинил, 4-ацетилпиперазинил, пирролидинилметил, пиперидинилметил, морфолинилметил, пиперазинилметил, 4-метилпиперазинилметил, гомопиперазинилметил, 4-метилгомопиперазинилметил, 4-ацетилпиперазинилметил, пирролидинилокси, 1-метилпирролидинилокси, пиперидинилокси, 1-метилпиперидинилокси, гомопиперидинилокси, 1-метилгомопиперидинилокси, 2-(пирролидинил)этокси, 3-(пирролидинил)пропокси, 2-(пиперидинил)этокси, 3-(пиперидинил)пропокси, 2-(морфолинил)этокси, 3-(морфолинил)пропокси, 2-(пиперазинил)этокси, 3-(пиперазинил)пропокси, 2-(4-метилпиперазинил)этокси, 3-(4-метилпиперазинил)пропокси, 2-(4-ацетилпиперазинил)этокси, 3-(4-ацетилпиперазинил)пропокси, 3-диметиламинопропиламинометил, 3-диметиламино-2,2-диметилпропиламинометил, 2-(1-метилпирролидинилэтил)аминометил, 3-пирролидинилпропиламинометил, 2-морфолинилэтиламинометил, 3-морфолинилпропиламинометил, 2-пиперазинилэтиламинометил, 3-(4-метилпиперазинилпропил)аминометил, пиридилметокси, имидазолилметокси, тиазолилметокси и 2-метилтиазолилметокси;
n равен 0 или 1;
R2 представляет фтор, хлор, бром, метил или этил;
q равен 0 и
Q представляет фенил, инденил, инданил, тетрагидронафтил, флуоренил, фурил, тиенил, оксазолил, изоксазолил, имидазолил, пиразолил, тиазолил, изотиазолил, пиридил, пиридазинил, пиримидинил, пиразинил, бензофуранил, индолил, бензотиенил, бензоксазолил, бензимидазолил, бензотиазолил, индазолил, бензофуразанил, хинолил, изохинолил, хиназолинил, хиноксалинил, нафтиридинил, карбазолил, дибензофуранил, дибензотиенил или ксантенил, которые, необязательно, содержат 1 или 2 заместителя, выбранных из гидрокси, фтора, хлора, трифторметила, циано, амино, метила, этила, метокси, этокси, пропокси, изопропокси, циклопентилокси, метилендиокси, метиламино, этиламино, диметиламино, диэтиламино, ацетамидо, пропионамидо, метансульфонамидо, N-метилметансульфонамидо, аминометила, метиламинометила, этиламинометила, диметиламинометила, диэтиламинометила, 2-гидроксиэтокси, 3-гидроксипропокси, 2-метоксиэтокси, 2-этоксиэтокси, 3-метоксипропокси, 3-этоксипропокси, 2-аминоэтокси, 3-аминопропокси, 2-метиламиноэтокси, 2-этиламиноэтокси, 3-метиламинопропокси, 3-этиламинопропокси, 2-диметиламиноэтокси, 2-диэтиламиноэтокси, 3-диметиламинопропокси, 3-диэтиламинопропокси, фенила, фурила, тиенила, пиридила, пиридилметила, пиридилметокси, азетидинила, 3-пирролинила, пирролидинила, пиперидинила, гомопиперидинила, морфолинила, пиперазинила, 4-метилпиперазинила, гомопиперазинила, 4-метилгомопиперазинила, 4-ацетилпиперазинила, пирролидинилметила, пиперидинилметила, морфолинилметила, пиперазинилметила, 4-метилпиперазинилметила, 4-ацетилпиперазинилметила, пирролидинилокси, 1-метилпирролидинилокси, пиперидинилокси, 1-метилпиперидинилокси, 2-(пирролидинил)этокси, 3-(пирролидинил)пропокси, 2-(пиперидинил)этокси, 3-(пиперидинил)пропокси, 2-(морфолинил)этокси, 3-(морфолинил)пропокси, 2-(пиперазинил)этокси, 3-(пиперазинил)пропокси, 2-(4-метилпиперазинил)этокси, 3-(4-метилпиперазинил)пропокси, 2-{4-ацетилпиперазинил)этокси и 3-(4-ацетил-пиперазинил)пропокси, и где любая фенильная, фурильная, тиенильная, пиридильная или гетероциклильная группа в заместителе Q может, необязательно, содержать 1 или 2 заместителя, выбранных из фтора, хлора, метила и метокси;
или его фармацевтически приемлемую соль.
Другое предпочтительное соединение по второму аспекту изобретения представляет собой производное амида формулы I, где
Х представляет СН;
Y представляет СН или N;
R3 представляет хлор или метил;
m равен 0, 1 или 2;
R1 представляет гидрокси, фтор, хлор, бром, трифторметил, циано, метил, этил, пропил, метокси, этокси, амино, метиламино, этиламино, диметиламино, диэтиламино, метиламинометил, этиламинометил, диметиламинометил, диэтиламинометил, 2-аминоэтокси, 3-аминопропокси, 2-метиламиноэтокси, 2-этиламиноэтокси, 3-метиламинопропокси, 3-этиламинопропокси, 2-диметиламиноэтокси, 2-диэтиламиноэтокси, 3-диметиламинопропокси, 3-диэтиламинопропокси, 2-аминоэтиламино, 3-аминопропиламино, 2-метиламиноэтиламино, 2-этиламиноэтиламино, 3-метиламинопропиламино, 3-этиламинопропиламино, 2-диметиламиноэтиламино, 2-диэтиламиноэтиламино, 3-диметиламинопропиламино, 3-диэтиламинопропиламино, N-(2-аминоэтил)-N-метиламино, N-(3-аминопропил)-N-метиламино, N-(2-метиламиноэтил)-N-метиламино, N-(2-этиламиноэтил)-N-метиламино, N-(3-метиламинопропил)-N-метиламино, N-(3-этиламинопропил)-N-метиламино, N-(2-диметиламиноэтил)-N-метиламино, N-(2-диэтиламиноэтил)-N-метиламино, N-(3-диметиламинопропил)-N-метиламино, N-(3-диэтиламинопропил)-N-метиламино, 2-пиридилметил, 3-пиридилметил, 4-пиридилметил, 2-пиридилметокси, 3-пиридилметокси, 4-пиридилметокси, пирролидин-1-ил, пиперидино, морфолино, пиперазин-1-ил, 4-метилпиперазин-1-ил, гомопиперазин-1-ил, 4-ацетилгомопиперазин-1-ил, 4-ацетилпиперазин-1-ил, пирролидин-1-илметил, пиперидинометил, морфолинометил, пиперазин-1-илметил, 4-метилпиперазин-1-илметил, 4-ацетил-пиперазин-1-илметил, пирролидин-3-илокси, 1-метилпирролидин-3-илокси, пиперидин-4-илокси, 1-метилпиперидин-4-илокси, 2-(пирролидин-1-ил)этокси, 3-(пирролидин-1-ил)пропокси, 2-пиперидиноэтокси, 3-пиперидинопропокси, 2-морфолиноэтокси, 3-морфолинопропокси, 2-пиперазин-1-илэтокси, 3-пиперазин-1-ил-пропокси, 2-(4-метилпиперазин-1-ил)этокси, 3-(4-метилпиперазин-1-ил)пропокси, 2-(4-ацетилпиперазин-1-ил)этокси или 3-(4-ацетилпиперазин-1-ил)пропокси;
n равен 0;
q равен 0 и
Q представляет фенил, 2-фурил, 2-тиенил, 4-оксазолил, 5-изоксазолил, 4-тиазолил, 5-изотиазолил, 2-пиридил, 3-пиридил, 4-пиридил, 2-бензофуранил, 2-индолил, 2-бензотиенил, 2-бензоксазолил, 2-бензимидазолил, 2-бензотиазолил, 4-бензо-фуразанил, 2-хинолил, 6-хинолил, 7-хинолил, 3-изохинолил, 6-хиназолинил, 7-хиназолинил или 7-хиноксалинил, которые, необязательно, содержат 1 или 2 заместителя, выбранных из гидрокси, фтора, хлора, трифторметила, циано, амино, метила, этила, метокси, этокси, метилендиокси, метиламино, этиламино, диметиламино, диэтиламино, аминометила, метиламинометила, этиламинометила, диметиламинометила, диэтиламинометила, 2-гидроксиэтокси, 3-гидроксипропокси, 2-метоксиэтокси, 2-этоксиэтокси, 3-метоксипропокси, 3-этоксипропокси, 2-аминоэтокси, 3-аминопропокси, 2-метиламиноэтокси, 2-этиламиноэтокси, 3-метиламинопропокси, 3-этиламинопропокси, 2-диметиламиноэтокси, 2-диэтиламиноэтокси, 3-диметиламинопропокси, 3-диэтиламинопропокси, 2-пиридила, 3-пиридила, 4-пиридила, 2-пиридилметила, 3-пиридилметила, 4-пиридилметила, 2-пиридилметокси, 3-пиридилметокси, 4-пиридилметокси, пирролидин-1-ила, пиперидино, морфолино, пиперазин-1-ила, 4-метилпиперазин-1-ила, гомопиперазин-1-ила, 4-метилгомопиперазин-1-ила, 4-ацетилпиперазин-1-ила, пирролидин-1-илметила, пиперидинометила, морфолинометила, пиперазин-1-илметила, 4-метилпиперазин-1-илметила, 4-ацетилпиперазин-1-илметила, пирролидин-3-илокси, 1-метилпирролидин-3-илокси, пиперидин-4-илокси, 1-метилпиперидин-4-илокси, 2-пирролидин-1-илэтокси, 3-пирролидин-1-илпропокси, 2-пиперидиноэтокси, 3-пиперидинопропокси, 2-морфолиноэтокси, 3-морфолинопропокси, 2-пиперазин-1-илэтокси, 3-пиперазин-1-илпропокси, 2-(4-метилпиперазин-1-ил)этокси, 3-(4-метилпиперазин-1-ил)пропокси, 2-(4-ацетилпиперазин-1-ил)этокси и 3-(4-ацетилпиперазин-1-ил)пропокси;
или его фармацевтически приемлемую соль.
Другое предпочтительное соединение по второму аспекту изобретения представляет собой производное амида формулы I, где
Х представляет СН;
Y представляет СН или N;
R3 представляет хлор или метил;
m равен 0, 1 или 2;
R1 представляет гидрокси, фтор, хлор, бром, трифторметил, циано, метил, этил, пропил, метокси, этокси, амино, метиламино, этиламино, диметиламино, диэтиламино, метиламинометил, этиламинометил, диметиламинометил, диэтиламинометил, 2-аминоэтокси, 3-аминопропокси, 2-метиламиноэтокси, 2-этиламиноэтокси, 3-метиламинопропокси, 3-этиламинопропокси, 2-диметиламиноэтокси, 2-диэтиламиноэтокси, 3-диметиламинопропокси, 3-диэтиламинолропокси, 2-аминоэтиламино, 3-аминопропиламино, 2-метиламиноэтиламино, 2-этиламиноэтиламино, 3-метиламинопропиламино, 3-этиламинопропиламино, 2-диметиламиноэтиламино, 2-диэтиламиноэтиламино, 3-диметиламинопропиламино, 3-диэтиламинопропиламино, N-(2-аминоэтил)-N-метиламино, N-(3-аминопропил)-N-метиламино, N-(2-метиламиноэтил)-N-метиламино, N-(2-этиламиноэтил)-N-метиламино, N-(3-метиламинопропил)-N-метиламино, N-(3-этиламинопропил)-N-метиламино, N-(2-диметиламиноэтил)-N-метиламино, N-(2-диэтиламиноэтил)-N-метиламино, N-(3-диметиламинопропил)-N-метиламино, N-(3-диэтиламинопропил)-N-метиламино, 2-пиридилметил, 3-пиридилметил, 4-пиридилметил, 2-пиридилметокси, 3-пиридилметокси, 4-пиридилметокси, пирролидин-1-ил, пиперидино, морфолино, пиперазин-1-ил, 4-метилпиперазин-1-ил, гомопипе-разин-1-ил, 4-метилгомопиперазин-1-ил, 4-ацетилпиперазин-1-ил, пирролидин-1-илметил, пиперидинометил, морфолинометил, пиперазин-1-илметил, 4-метилпиперазин-1-илметил, 4-ацетилпиперазин-1-илметил, пирролидин-3-илокси, 1-метилпирролидин-3-илокси, пиперидин-4-илокси, 1-метилпиперидин-4-илокси, 2-(пирролидин-1-ил)этокси, 3-(пирролидин-1-ил)пропокси, 2-пиперидиноэтокси, 3-пиперидинопропокси, 2-морфолиноэтокси, 3-морфолинопропокси, 2-пиперазин-1-илэтокси, 3-пиперазин-1-илпропокси, 2-(4-метилпиперазин-1-ил)этокси, 3-(4-метилпиперазин-1-ил)пропокси, 2-(4-ацетилпиперазин-1-ил)этокси или 3-(4-ацетилпиперазин-1-ил)пропокси;
n равен 0;
q равен 0 и
Q представляет фенил, 2-пиридил, 3-пиридил или 4-пиридил, которые, необязательно, содержат 1 или 2 заместителя, выбранных из гидрокси, фтора, хлора, трифторметила, циано, амино, метила, этила, метокси, этокси, метилендиокси, метиламино, этиламино, диметиламино, диэтиламино, аминометила, метиламинометила, этиламинометила, диметиламинометила, диэтиламинометила, 2-гидроксиэтокси, 3-гидроксипропокси, 2-метоксиэтокси, 2-этоксиэтокси, 3-метоксипропокси, 3-этоксипропокси, 2-аминоэтокси, 3-аминопропокси, 2-метиламиноэтокси, 2-этиламиноэтокси, 3-метиламинопропокси, 3-этиламинопропокси, 2-диметиламиноэтокси, 2-диэтиламиноэтокси, 3-диметиламинопропокси, 3-диэтиламинопропокси, 2-пиридила, 3-пиридила, 4-пиридила, 2-пиридилметила, 3-пиридилметила, 4-пиридилметила, 2-пиридилметокси, 3-пиридилметокси, 4-пиридилметокси, пирролидин-1-ила, пиперидино, морфолино, пиперазин-1-ила, 4-метилпиперазин-1-ила, гомопиперазин-1-ила, 4-метилгомопиперазин-1-ила, 4-ацетилпиперазин-1-ила, пирролидин-1-илметила, пиперидинометила, морфолинометила, пиперазин-1-илметила, 4-метилпиперазин-1-илметила, 4-ацетилпиперазин-1-илметила, пирролидин-3-илокси, 1-метилпирролидин-3-илокси, пиперидин-4-илокси, 1-метил-пиперидин-4-илокси, 2-пирролидин-1-илэтокси, 3-пирролидин-1-илпропокси, 2-пиперидиноэтокси, 3-пиперидинопропокси, 2-морфолиноэтокси, 3-морфолинопропокси, 2-пиперазин-1-илэтокси, 3-пиперазин-1-илпропокси, 2-(4-метилпиперазин-1-ил)этокси, 3-(4-метилпиперазин-1-ил)пропокси, 2-(4-ацетилпиперазин-1-ил)этокси и 3-(4-ацетилпиперазин-1-ил)пропокси;
или его фармацевтически приемлемую соль.
Другое предпочтительное соединение по второму аспекту изобретения представляет собой производное амида формулы I, где
Х представляет СН;
Y представляет СН или N;
R3 представляет хлор или метил;
m равен 1 или 2;
R1 представляет гидрокси, фтор, хлор, метил, этил, пропил, метокси, диметиламинометил, диэтиламинометил, 2-диметиламиноэтокси, 2-диэтиламиноэтокси, 3-диметиламинопропокси, 3-диэтиламинопролокси, 3-диметиламино-2-гидроксипропокси, 3-диэтиламино-2-гидроксипропокси, 2-аминоэтиламино, 3-аминопропиламино, 4-аминобутиламино, 3-метиламинопропиламино, 2-диметиламиноэтиламино, 2-диэтиламиноэтиламино, 3-диметиламинопропиламино, 4-диметиламинобутиламино, 3-амино-2-гидроксипропиламино, 3-диметиламино-2-гидроксипропиламино, N-(2-диметиламиноэтил)-N-метиламино, N-(3-диметиламинопропил)-N-метиламино, пирролидин-1-ил, морфолино, пиперидино, пиперазин-1-ил, 4-метилпиперазин-1-ил, 4-этилпиперазин-1-ил, 4-(2-гидроксиэтил)пиперазин-1-ил, гомопиперазин-1-ил, 4-метилгомопиперазин-1-ил, пиперазин-1-илметил, 4-метилпиперазин-1-илметил, гомопиперазин-1-илметил, 4-метилгомопиперазин-1-илметил, морфолинометил, 3-аминопирролидин-1-илметил, 3-гидроксипирролидин-1-илметил, 4-(2-гидроксиэтил)пиперазин-1-илметил, пирролидин-3-илокси, 1-метилпирролидин-3-илокси, пиперидин-4-илокси, 1-метилпиперидин-4-илокси, 1-бензопиперидин-4-илокси, 2-пирролидин-1-илэтокси, 3-пирролидин-1-илпропокси, 2-пиперидиноэтокси, 3-пиперидинопропокси, 2-морфолиноэтокси, 3-морфолинопропокси, 2-пиперазин-1-илэтокси, 3-пиперазин-1-илпропокси, 2-(4-метилпиперазин-1-ил)этокси, 3-(4-метилпиперазин-1-ил)пропокси, 2-гидрокси-3-пирролидин-1-илпропокси, 2-гидрокси-3-пиперидинопропокси, 2-гидрокси-3-морфолинопропокси, пиперидин-4-иламино, 1-метилпиперидин-4-иламино, 1-бензилпиперидин-4-иламино, 2-пирролидин-1-илэтиламино, 3-пирролидин-1-илпропиламино, 2-морфолиноэтиламино, 3-морфолинопропиламино, 2-пиперидиноэтиламино, 3-пиперидино-пропиламино, 2-пиперазин-1-илпропиламино, 3-пиперазин-1-илпропиламино, 2-(4-метилпиперазин-1-ил)этиламино, 3-(4-метилпиперазин-1-ил)пропиламино, 2-(1-метилпирролидин-2-ил)этиламино, 3-(1-метилпирролидин-2-ил)пропиламино, 2-диметиламиноэтиламинометил, 3-диметиламинопропиламинометил, 3-диметиламино-2,2-диметилпропиламинометил, 2-(1-метилпирролидин-2-илэтил)аминометил, 3-пирролидин-1-илпропиламинометил, 2-морфолиноэтиламинометил, 3-морфолинопропиламинометил, 2-пиперазин-1-илэтиламинометил, 3-(4-метилпиперазин-1-илпропил)аминометил или 2-пиридилметокси;
n равен 0;
q равен 0 и
Q представляет 2-пиридил, 3-пиридил или 4-пиридил, которые содержит заместитель, выбранный из пирролидин-1-ила, 3-гидроксипирролидин-1-ила, 2-гидроксиметилпирролидин-1-ила, морфолино, пиперидино, 4-гидроксипиперидин-1-ила, пиперазин-1-ила и 4-метилпиперазин-1-ила;
или его фармацевтически приемлемую соль.
Особенно предпочтительное соединение по второму аспекту изобретения представляет собой производное амида формулы I, где
Х представляет СН;
Y представляет СН или N;
R3 представляет хлор или метил;
m равен 1 и R1 выбран из диэтиламинометила, N-(2-диметиламиноэтил)-N-метиламино, N-(3-диметиламинопропил)-N-метиламино, пирролидин-1-ила, морфолино, пиперидино, пиперазин-1-ила, 4-метилпиперазин-1-ила, 4-этилпиперазин-1-ила, гомопиперазин-1-ила, 4-метилгомопилеразин-1-ила, пиперазин-1-илметила, 4-метилпилеразин-1-илметила, 4-метилгомопиперазин-1-илметила, морфолинометила, 3-аминопирролидин-1-илметила, 3-гидроксипирролидин-1-илметила, пирролидин-3-илокси, пиперидин-4-илокси, 2-пирролидин-1-илэтокси, 2-пиперидиноэтокси, 2-морфолиноэтокси, 3-диметиламинопропиламинометила, 3-диметиламино-2,2-диметилпропиламинометила, 2-(1-метилпирролидин-2-илэтил)аминометила, 3-пирролидин-1-илпропиламинометила, 2-морфолиноэтиламинометила, 3-морфолинопропиламинометила, 2-пиперазин-1-илэтиламинометила, 3-(4-метилпиперазин-1-илпропил)аминометила и 2-пиридилметокси;
n равен 0;
q равен 0 и
Q представляет 3-пиридил или 4-пиридил, который содержит заместитель, выбранный из пирролидин-1-ила, морфолино, пиперидино, пиперазин-1-ила и 4-метилпиперазин-1-ила;
или его фармацевтически приемлемую соль.
Другое особенно предпочтительное соединение по второму аспекту изобретения представляет собой производное амида формулы I, где
Х представляет СН;
Y представляет СН или N;
R3 представляет хлор или метил;
m равен 1 и R1 выбран из диэтиламинометила, N-(2-ди-метиламиноэтил)-N-метиламино, N-(3-диметиламинопропил)-N-метиламино, 3-пирролин-1-ила, пирролидин-1-ила, морфолино, пиперидино, гомопиперазин-1-ила, пиперазин-1-ила, 4-метилпиперазин-1-ила, 4-этилпиперазин-1-ила, гомопиперазин-1-ила, 4-метилгомопиперазин-1-ила, пиперазин-1-илметила, 4-метилпиперазин-1-илметила, гомопиперазин-1-илметила, 4-метилгомопиперазин-1-илметила, морфолинометила, 3-аминопирролидин-1-илметила, 3-гидроксипирролидин-1-илметила, пирролидин-3-илокси, N-метилпирролидин-3-илокси, пиперидин-4-илокси, N-метилпиперидин-4-илокси, гомопиперидин-4-илокси, N-метилгомопиперидин-4-илокси, 2-пирролидин-1-илэтокси, 2-пиперидиноэтокси, 2-морфолиноэтокси, 3-диметиламинопропиламинометила, 3-диметиламино-2,2-диметилпропиламинометила, 2-(1-метилпирролидин-2-илэтил)аминометила, 3-пирролидин-1-илпропиламинометила, 2-морфолиноэтиламинометила, 3-морфолинопропиламинометила, 2-пиперазин-1-илэтиламинометила, 3-(4-метилпиперазин-1-илпропил)аминометила, 2-пиридилметокси, 4-тиазолилметокси и 2-метилтиазол-4-илметокси;
n равен 0;
q равен 0 и
Q представляет фенил, содержащий 1 или 2 заместителя, выбранных из фтора, хлора, трифторметила, метокси, циклопентилокси, ацетамидо, N-метилметансульфонамидо, 2-фурила, азетидин-1-ила, 3-пирролин-1-ила, пирролидин-1-ила, морфолино, пиперидино, гомопиперидино, пиперазин-1-ила, гомопиперазин-1-ила, 4-метилпиперазин-1-ила и 4-метилгомопиперазин-1-ила;
или Q представляет 1-флуоренил или 4-дибензофуранил, или Q представляет 3-пиридил или 4-пиридил, который содержит заместитель, выбранный из азетидин-1-ила, 3-пирролин-1-ила, пирролидин-1-ила, морфолино, пиперидино, гомопиперидино, пиперазин-1-ила, гомопиперазин-1-ила, 4-метилпиперазин-1-ила и 4-метилгомопиперазин-1-ила;
или его фармацевтически приемлемую соль.
Другое особенно предпочтительное соединение по второму аспекту изобретения представляет собой производное амида формулы I, где
Х представляет СН;
Y представляет СН или N;
R3 представляет хлор или метил;
m равен 1 и R1 представляет N-(2-диметиламиноэтил)-N-метиламино, N-(3-диметиламинопропил)-N-метиламино, 4-метилпиперазин-1-ил, 4-этилпиперазин-1-ил, 4-метилгомопиперазин-1-ил или 4-метилпиперазин-1-илметил;
n равен 0;
q равен 0 и
Q представляет 2-(пирролидин-1-ил)пирид-4-ил, 2-(3-пирролин-1-ил)пирид-4-ил, 2-пиперидинопирид-4-ил, 2-морфолинопирид-4-ил, 1-флуоренил, дибензофуран-4-ил, 3-ацетамидофенил или 3-(2-фурил)фенил;
или его фармацевтически приемлемую соль.
Другое особенно предпочтительное соединение по второму аспекту изобретения представляет собой производное амида формулы I, где
Х представляет СН;
Y представляет СН или N;
R3 представляет хлор или метил;
m равен 1 и R1 представляет N-(3-диметиламинопропил)-N-метиламино, 4-метилпиперазин-1-ил, 4-метилгомопиперазин-1-ил или 4-метилпиперазин-1-илметил;
n равен 0;
q равен 0 и
Q представляет 2-морфолинопирид-4-ил;
или его фармацевтически приемлемую соль.
Производное амида формулы I или его фармацевтически приемлемая соль или его расщепляемый in vivo сложный эфир можно получить любым известным способом, который применяют для получения химически родственных соединений. Такие способы, используемые для получения нового производного амида формулы I, даются как другая особенность изобретения и иллюстрируются приведенными далее характерными вариантами способов, где, если нет иных указаний, X, Y, R1, R2, R3, m, n, q и Q имеют любые указанные ранее значения. Необходимые исходные вещества можно получить стандартными методами органической химии. Получение таких исходных веществ описано в связи с приведенными далее характерными вариантами способов и в приведенных примерах. Альтернативно, необходимые исходные вещества получают способами (аналогично иллюстрируемым способам), обычными для специалиста в области органической химии.
(а) Соединение формулы I или его фармацевтически приемлемая соль, или его расщепляемый in vivo сложный эфир можно получить взаимодействием анилина формулы II
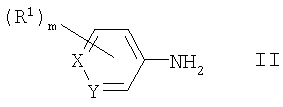
с бензойной кислотой формулы III или ее активированным производным
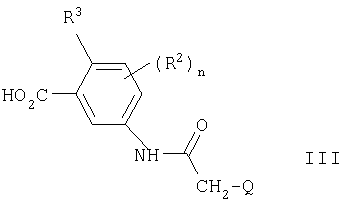
в стандартных условиях образования амидной связи, где изменяющиеся группы имеют значения, указанные выше, и где любая функциональная группа при необходимости защищена,
(i) удалением любых защитных групп; и
(ii) необязательно, образованием фармацевтически приемлемой соли или расщепляемого in vivo сложного эфира.
Подходящим реакционно-способным производным карбоновой кислоты формулы III является, например, ацилгалогенид, например хлористый ацил, образованный реакцией взаимодействия кислоты и хлорангидрида неорганической кислоты, например тионилхлорида; смешанный ангидрид, например ангидрид, образованный реакцией взаимодействия кислоты и хлорформиата, такого как изобутилхлорформиат; и активный сложный эфир, например эфир, образованный взаимодействием кислоты с фенолом, таким как пентафторфенол, со сложным эфиром, таким как пентафторфенилтрифторацетат, или со спиртом, таким как N-гидроксибензотриазол; ацилазид, например азид, образованный взаимодействием кислоты и азида, такого как дифенилфосфорилазид; ацилцианид, например цианид, образованный взаимодействием кислоты и цианида, такого как диэтилфосфорилцианид; или продукт взаимодействия кислоты и карбодиимида, такого как дициклогексилкарбодиимид.
Стандартные условия образования амидной связи обычно включают присутствие подходящего основания, такого как, например, карбонат, алкоксид, гидроксид или гидрид щелочного или щелочно-земельного металла, например карбоната натрия, карбоната калия, этоксида натрия, бутоксида калия, гидроксида натрия, гидроксида калия, гидрида натрия или гидрида калия, или металлоорганического основания, такого как алкиллитий, например н-бутиллития, или диалкиламинолитий, например литийдиизопропиламида, или, например, органический амин, например, пиридина, 2,6-лутидина, коллидина, 4-диметиламинопиридина, триэтиламина, морфолина или диазабицикло [5.4.0]ундец-7-ена.
Взаимодействие также осуществляют, предпочтительно, в подходящем инертном растворителе или разбавителе, таком как, например, метанол, этанол, тетрагидрофуран, метиленхлорид, 1,2-диметоксиэтан, N,N-диметилформамид, N,N-диметилацетамид, N-метилпирролидин-2-он, диметилсульфоксид или ацетон, и при температуре в интервале, например, 0-100°С, предпочтительно при температуре окружающей среды или близкой к ней.
Как правило, карбодиимидный реагент сочетания используют в присутствии органического растворителя (предпочтительно, безводного полярного апротонного органического растворителя) при невысоких температурах, например в интервале от -10 до 40°С, как правило, при температуре окружающей среды примерно 20°С.
Типичные стандартные условия образования амидной связи включают активирование карбоксигруппы, например, путем обработки галогенсодержащим реагентом (например, оксалилхлоридом) с образованием ацилгалогенида, в органическом растворителе при температуре окружающей среды и последующего взаимодействия активированного соединения с анилином. При необходимости защищают любые функциональные группы и удаляют защитные группы. Подходит использование карбодиимидного реагента сочетания в присутствии органического растворителя (предпочтительно, безводного полярного апротонного органического растворителя) при невысоких температурах, например в интервале от -10 до 40°С, как правило, при температуре окружающей среды примерно 20°С.
Защитные группы, как правило, можно выбирать из любых групп, описанных в литературе или известных специалистам как подходящие для защиты представляющей интерес группы, и их можно вводить обычными способами. Защитные группы можно удалить подходящим способом, описанным в литературе или известным специалистам как подходящий для удаления защитной группы из представляющей интерес группы, причем такие способы выбирают так, чтобы осуществить удаление защитной группы с минимальным воздействием на другие группы, присутствующие в молекуле.
Конкретные примеры защитных групп приведены для удобства, где "низший", как например, в определении "низший алкил", означает, что группа, к которой относится определение, содержит, предпочтительно, 1-4 атома углерода. Следует иметь в виду, что указанные примеры не являются исчерпывающими. Приведенные ниже конкретные примеры способов удаления защитных групп также не являются исчерпывающими. Применение защитных групп и способы удаления конкретно не указанных защитных групп, конечно, также входят в объем изобретения.
Защитная группа для карбоксигруппы может представлять собой остаток эфирообразующего алифатического или арилалифатического спирта или эфирообразующего силанола (причем указанные спирт или силанол, предпочтительно, содержат 1-20 атомов углерода). Примерами карбокси защитных групп являются линейные или разветвленные (C1-C12)алкильные группы (например, изопропил, трет-бутил); (низший алкокси) (низшие алкильные) группы (например, метоксиметил, этоксиметил, изобутоксиметил); (низший алифатический ацилокси) (низшие алкильные) группы (например, ацетоксиметил, пропионилоксиметил, бутирилоксиметил, пивалоилоксиметил); (низший алкоксикарбонилокси) (низшие алкильные) группы (например, 1-метоксикарбонилоксиэтил, 1-этоксикарбонилоксиэтил); арил(низшие алкильные) группы (например, бензил, п-метоксибензил, о-нитробензил, п-нитробензил, бензгидрил и фталидил); три(низший алкил) силильные группы (например, триметилсилил и трет-бутилдиметилсилил); три(низший алкил) силил-(низшие алкильные) группы (например, триметилсилилэтил) и (С2-С6)алкенильные группы (например, аллил и винилэтил). Способы, подходящие, в частности, для удаления карбокси защитных групп, включают, например, кислотный основный и катализируемый металлом или ферментом гидролиз.
Примерами гидрокси защитных групп являются низшие алкильные группы (например, трет-бутил), низшие алкенильные группы (например, аллил); низшие алканоильные группы (например, ацетил); низшие алкоксикарбонильные группы (например, трет-бутилоксикарбонил); низшие алкенилоксикарбонильные группы (например, аллилоксикарбонил); арил-(низшие алкоксикарбонильные) группы (например, бензилоксикарбонил, п-метоксибензилоксикарбонил, о-нитробензилоксикарбонил, п-нитробензилоксикарбонил); три(низший алкил)-силилил (например, триметилсилил, трет-бутилдиметилсилил) и арил(низшие алкильные) (например, бензил) группы.
Примерами амино защитных групп являются формил, аралкильные группы (например, бензил и замещенный бензил, п-метоксибензил, нитробензил и 2,4-диметоксибензил и трифенилметил); ди-п-анизилметильная и фурилметильная группы; низший алкоксикарбонил (например, трет-бутилоксикарбонил); низший алкенилоксикарбонил (например, аллилоксикарбонил); арил (низшие алкоксикарбонильные) группы (например, бензилоксикарбонил, п-метоксибензилоксикарбонил, о-нитробензилоксикарбонил, п-нитробензилоксикарбонил); триалкилсилилил (например, триметилсилил и трет-бутилдиметилсилил); алкилиден (например, метилиден); бензилиденовая и замещенная бензилиденовая группы.
Способы, подходящие для удаления гидрокси и амино защитных групп, включают, например, кислотный, щелочной и катализируемый металлом или ферментом гидролиз для таких групп, как п-нитробензилоксикарбонил, гидрирование в случае таких групп, как бензил, и фотолитическое отщепление в случае таких групп, как о-нитробензилоксикарбонил.
Следует обратиться к Advanced Organic Chemistry, 4th Edition, by Jerry March, published by John Wiley & Sons, 1992, как общему руководству по условиям взаимодействия и реагентам, и к Protective Groups in Organic Synthesis, 2nd Edition, by Green et al., published by John Wiley & Sons, как общему руководству по защитным группам.
Бензойную кислоту формулы III можно получить расщеплением ее соответствующего эфира, который, в свою очередь, можно получить взаимодействием анилина формулы IV
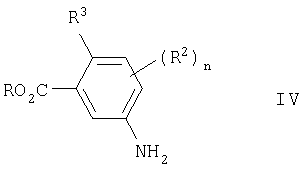
где R представляет, например, низшийалкил или бензил,
с карбоновой кислотой формулы V или ее активированным производным, указанным ранее,
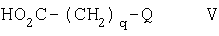
в стандартных условиях образования амидной связи, указанных выше, где изменяющиеся группы имеют значения, указанные выше, и где функциональная группа, при необходимости, защищена.
(b) Соединение формулы I или его фармацевтически приемлемую соль, или его расщепляемый in vivo эфир, можно получить взаимодействием анилина формулы VI
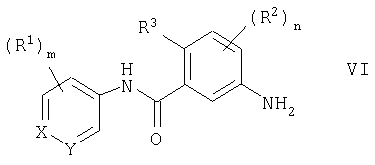
с карбоновой кислотой формулы V или ее реакционно-способным производным, указанным выше,
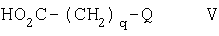
в стандартных условиях образования амидной связи, указанных выше, где изменяющиеся группы имеют значения, указанные выше, и где функциональная группа, при необходимости, защищена, и
(i) удалением любых защитных групп; и
(ii) необязательно, образованием фармацевтически приемлемой соли или расщепляемого in vivo эфира.
Анилин формулы VI можно получить восстановлением соответствующего нитробензола формулы VII
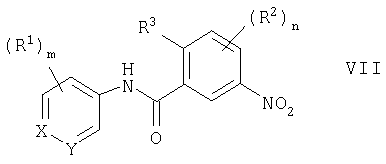
где изменяющиеся группы имеют значения, указанные выше, и где функциональная группа, при необходимости, защищена.
Типичные условия взаимодействия при восстановлении включают использование формиата аммония или газообразного водорода в присутствии катализатора, например металлического катализатора, такого как палладий-на-угле. Альтернативно, можно осуществить восстановление металлом при растворении, например, с использованием железа в присутствии кислоты, например неорганической или органической кислоты, такой как хлористоводородная, бромистоводородная, серная или уксусная кислота. Взаимодействие хорошо осуществлять в присутствии органического растворителя (предпочтительно, полярного протонного растворителя) и, предпочтительно, при нагревании, например, до примерно 60°С. При необходимости защищают любые функциональные группы и отщепляют защитные группы.
Нитробензол формулы VII можно получить взаимодействием анилина формулы II

с карбоновой кислотой формулы VIII или ее реакционно-способным производным, указанным выше
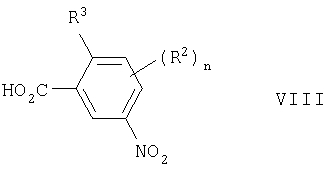
в стандартных условиях образования амидной связи, указанных выше, где изменяющиеся группы имеют значения, указанные выше, и где функциональная группа, при необходимости, защищена.
(с) Соединение формулы I, где R1 или заместитель на Q представляет (C1-С6)алкокси или замещенный (C1-С6)алкокси, (C1-С6)алкилтио, (C1-С6)алкиламино, ди-[(C1-С6)алкил]амино или замещенный (C1-С6)алкиламино, можно получить алкилированием, обычно в присутствии подходящего основания, указанного выше производного амида формулы I, где R1 или заместитель на Q представляет гидрокси, меркапто или амино, как подходит.
Взаимодействие осуществляют, предпочтительно, в присутствии подходящего инертного растворителя или разбавителя, например галогенсодержащего растворителя, такого как метиленхлорид, хлороформ или тетрахлорид углерода, простого эфира, такого как тетрагидрофуран или 1,4-диоксан, ароматического растворителя, такого как толуол, или биполярного апротонного растворителя, такого как N,N-диметилформамид, N,N-диметилацетамид, N-метилпирролиндин-2-он или диметилсульфоксид. Взаимодействие удобно осуществлять при температуре в интервале, например, 10-150°С, предпочтительно - в интервале 20-80°С.
Подходящим алкилирующим агентом является, например, любой агент, известный в технике алкилирования гидрокси до алкокси или замещенного алкокси, или алкилирования меркаптогруппы до алкилтиогруппы, или для алкилирования аминогруппы до алкиламино или замещенного алкиламино, например, алкил- или замещенный алкилгалогенид, например, (C1-С6)алкилхлорид, -бромид или -йодид, или замещенный (C1-С6)алкилхлорид, -бромид или -йодид, в присутствии подходящего основания, указанного выше, в подходящем инертном растворителе, указанном выше, и при температуре в интервале, например, 10-140°С, или, предпочтительно, при температуре окружающей среды или близкой к ней.
(d) Соединение формулы I, где заместитель на Q представляет амино, (C1-С6)алкиламино, ди-[(C1-С6)алкил]амино, замещенный (C1-С6)алкиламино, замещенный N-(C1-С6)алкил-(C2-С6)алкиламино или присоединенную по N гетероциклильную группу, можно удобно получать взаимодействием в присутствии подходящего основания, указанного выше, амидного производного формулы I, где заместитель на Q представляет подходящую отщепляемую группу, с соответствующим амином.
Подходящая отщепляемая группа представляет, например, галогеногруппу, такую как фтор, хлор или бром, (C1-С6)алкансульфонилоксигруппу, такую как метансульфонилоксигруппа, или арилсульфонилоксигруппу, такую как 4-толуолсульфонилокси.
Взаимодействие удобно осуществлять в присутствии подходящего инертного разбавителя или носителя, указанных выше, и при температуре в интервале, например, 20-200°С, предпочтительно в интервале 75-150°С.
(е) Соединение формулы I, где R1 или заместитель в Q представляет (C1-С6)алканоиламино или замещенный (С2-С6)алканоиламино, можно получить ацилированием соединения формулы I, где R1 или заместитель на Q представляет аминогруппу.
Подходящим ацилирующим агентом является, например, агент, известный в данной области для ацилирования амино до ациламино, например ацилгалогенид, например (С1-С6)алканоилхлорид или -бромид, обычно в присутствии подходящего основания, указанного выше, ангидрида алкановой кислоты или смешанного ангидрида, например ангидрида (C1-С6)алкановой кислоты, такого как уксусный ангидрид, или смешанного ангидрида, образованного взаимодействием алкановой кислоты и (C1-С6)алкоксикарбонилгалогенида, например (C1-С6)алкоксикарбонилхлорида, в присутствии подходящего основания, указанного выше. Как правило, ацилирование осуществляют в подходящем инертном растворителе или разбавителе, указанном выше, и при температуре в интервале, например, от -30 до 120°С, предпочтительно при температуре окружающей среды или близкой к ней.
(f) Соединение формулы I, где R1 или заместитель на Q представляет (C1-С6)алкансульфониламино, можно получать взаимодействием соединения формулы I, где R1 или заместитель на Q представляет амино, с (C1-С6)алкансульфоновой кислотой или ее активированным производным.
Подходящим активированным производным (C1-С6)алкансульфоновой кислоты является, например, алкансульфонилгалогенид, например алкансульфонилхлорид, полученный взаимодействием сульфоновой кислоты и хлорангидрида неорганической кислоты, например тионилхлорида. Взаимодействие, предпочтительно, осуществляют в присутствии подходящего основания, указанного выше, в частности пиридина, и в подходящем инертном растворителе или разбавителе, указанных выше, в частности метиленхлориде.
(g) Соединение формулы I, где R1 или заместитель на Q представляет карбокси, карбокси-(C1-С6)алкил, карбокси-(C1-С6)алкокси, карбокси-(C1-С6)алкиламино, N-(C1-С6)алкилкарбокси-(C1-С6)алкиламино или карбокси-(С2-С6)алканоиламино, можно получать расщеплением соединения формулы I, где R1 или заместитель на Q представляет (C1-С6)алкоксикарбонил, (C1-С6)алкоксикарбонил-(C1-С6)алкил, (C1-С6)алкоксикарбонил-(C1-С6)алкокси, (C1-С6)алкоксикарбонил-(C1-С6)алкиламино, N-(C1-С6)алкил-(C1-С6)алкоксикарбонил-(C1-С6)алкиламино или (C1-С6)алкоксикарбонил-(C2-C6)алканоиламино, что подходит.
Реакцию расщепления можно удобно осуществлять, например, гидролизом в кислой или щелочной среде. Подходящим основанием является, например, карбонат или гидроксид щелочного металла, щелочно-земельного металла или аммония, например карбонат натрия, гидроксид натрия, гидроксид калия или гидроксид аммония. Взаимодействие, предпочтительно, осуществляют в присутствии воды и подходящего растворителя или разбавителя, такого как метанол или этанол. Взаимодействие удобно осуществлять при температуре в интервале 10-150°С, предпочтительно при температуре окружающей среды или близкой к ней.
(h) Соединение формулы I, где R1 представляет амино-(C1-С6)алкил, (C1-С6)алкиламино-(C1-С6)алкил, ди-[(C1-С6)алкил]амино-(C1-С6)алкил или гетероциклил-(C1-С6)алкильную группу, можно получить взаимодействием, обычно, в присутствии подходящего основания, указанного выше, соединения формулы IX

где X, Y, R2, R3, n, q и Q имеют указанные выше значения и Z представляет подходящую отщепляемую группу, с подходящим амином или гетероциклическим соединением.
Подходящей отщепляемой группой Z является, например, галогеногруппа, такая как фтор, хлор или бром, (C1-С6)алкансульфонилоксигруппа, такая как метансульфонилокси, или арилсульфонилоксигруппа, такая как 4-толуолсульфонилокси.
Взаимодействие удобно осуществлять в присутствии подходящего инертного разбавителя или носителя, указанного выше, и при температуре в интервале, например, 20-200°С, предпочтительно в интервале 50-150°С.
Приведенные далее биологические анализы и примеры служат для пояснения настоящего изобретения.
Биологические анализы
Для определения ингибирующего действия соединений настоящего изобретения на киназу р38 и TNF и антиартритического действия можно использовать приведенные далее анализы.
Ферментативный анализ in vitro
Оценивают способность соединений изобретения ингибировать фермент киназу р38. Определяют активность испытываемых соединений против каждой изоформы фермента р38 и р38 и р38 . .
Рекомбинантные МКК6 человека (GenBank, инвентарный номер G1209672) выделяют из клона Image 45578 (Genomics, 1996, 33, 151) и используют для получения белка в форме GST-слитого белка в векторе pGEX с использованием процедур, аналогично описанным в J. Han et al., Journal of Biological Chemistry, 1996, 271, 2886-2891. Выделяют р38а (GenBank, инвентарный номер G529039) и p38 (GenBank, инвентарный номер G1469305) методом PCR-амплификации кДНК лимфобластоидов человека (GenBank, инвентарный номер GM1416) и кДНК фетального головного мозга человека [синтезированную из мРНК (Clontech, каталожный №6525-1) с использованием набора для синтеза кДНК Gibko], соответственно, с использованием олигонуклеотидов, созданных для 5'- и 3'-концов генов р38 (GenBank, инвентарный номер G1469305) методом PCR-амплификации кДНК лимфобластоидов человека (GenBank, инвентарный номер GM1416) и кДНК фетального головного мозга человека [синтезированную из мРНК (Clontech, каталожный №6525-1) с использованием набора для синтеза кДНК Gibko], соответственно, с использованием олигонуклеотидов, созданных для 5'- и 3'-концов генов р38 и р38 и р38 человека, с использованием процедур, аналогично описанным в J. Han et al., Biochimica et Biophisica Acta, 1995, 1265, 224-227, и Y. Jiang et al.. Journal of Biological Chemistry, 1996, 271, 17920-17926. человека, с использованием процедур, аналогично описанным в J. Han et al., Biochimica et Biophisica Acta, 1995, 1265, 224-227, и Y. Jiang et al.. Journal of Biological Chemistry, 1996, 271, 17920-17926.
Обе изоформы белка р38 экспрессируются в Е.coli в РЕТ-векторах. Рекомбинантные изоформы р38 и р38 и р38 человека получают в виде меченых 5' c-myc, 6His белков. Как МКК6, так и белки р38 очищают с использованием стандартных схем: GST МКК6 очищают с использованием колонки с глутатионсефарозой, а белки р38 очищают с использованием колонок с никелевым хелатным комплексом. человека получают в виде меченых 5' c-myc, 6His белков. Как МКК6, так и белки р38 очищают с использованием стандартных схем: GST МКК6 очищают с использованием колонки с глутатионсефарозой, а белки р38 очищают с использованием колонок с никелевым хелатным комплексом.
Ферменты р38 активируют перед применением путем инкубации с МКК6 в течение 3 часов при 30°С. Инактивированные экспрессированные в Е.coli МКК6 сохраняют достаточно активности для полной активации обеих изоформ р38. Активируемая инкубацией смесь содержит р38 (10 мкл, раствор 10 мг/мл) или р38 (10 мкл, раствор 10 мг/мл) или р38 (10 мкл, раствор 5 мг/мл) вместе с МКК6 (10 мкл, раствор 1 мг/мл), "буфером для киназы" [100 мкл; рН 7,4, буфер содержит трис (50 мМ), EGTA (0,1 мМ), ортованадат натрия (0,1 мМ) и (10 мкл, раствор 5 мг/мл) вместе с МКК6 (10 мкл, раствор 1 мг/мл), "буфером для киназы" [100 мкл; рН 7,4, буфер содержит трис (50 мМ), EGTA (0,1 мМ), ортованадат натрия (0,1 мМ) и  -меркаптоэтанол (0,1%)] и MgATP (30 мкл раствора 50 мМ Mg(ОСОСН3)2 и 0,5 мМ АТР). Этого достаточно для активации фермента р38 для 3 титрационных микропланшетов. -меркаптоэтанол (0,1%)] и MgATP (30 мкл раствора 50 мМ Mg(ОСОСН3)2 и 0,5 мМ АТР). Этого достаточно для активации фермента р38 для 3 титрационных микропланшетов.
Испытываемые соединения растворяют в ДМСО и в лунки титрационного микропланшета добавляют 10 мкл образца, разведенного 1:10 "буфером для киназы". В случае испытания с одной дозой соединения испытывают при 10 мкМ. Затем добавляют "смесь для анализа киназы" [30 мкл; содержит основной миелиновый белок (Gibco BRL, кат. № 1322В-010; 1 мл 3,33 мг/мл раствора в воде), активированный фермент р38 (50 мкл) и "буфер для киназы" (2 мл)] и затем "меченный АТР" [10 мкл раствора, содержащего 50 мкМ АТР, 0,1 мкМ Ки33P АТР (Amersham International, кат. №BF1000) и 50 мМ Mg(ОСОСН3)2]. Планшеты инкубируют при комнатной температуре при осторожном перемешивании. Планшеты, содержащие р38 , инкубируют в течение 90 мин, а планшеты, содержащие р38 , инкубируют в течение 90 мин, а планшеты, содержащие р38 , инкубируют в течение 45 мин. Инкубацию останавливают, добавляя 50 мкл 20% трихлоруксусной кислоты (ТСА). Выпавший в осадок белок фосфорилируют киназой р38 и оценивают испытываемые соединения на их способность ингибировать такое фосфорилирование. Планшеты фильтруют с использованием фильтра Canberra Packard Unifliter и промывают 2% ТСА, сушат в течение ночи и осуществляют подсчет с помощью сцинтилляционного счетчика Тор Count. , инкубируют в течение 45 мин. Инкубацию останавливают, добавляя 50 мкл 20% трихлоруксусной кислоты (ТСА). Выпавший в осадок белок фосфорилируют киназой р38 и оценивают испытываемые соединения на их способность ингибировать такое фосфорилирование. Планшеты фильтруют с использованием фильтра Canberra Packard Unifliter и промывают 2% ТСА, сушат в течение ночи и осуществляют подсчет с помощью сцинтилляционного счетчика Тор Count.
Соединения сначала испытывают при одной дозе и активные соединения испытывают повторно для определения величин IC50.
Клеточный анализ in vitro
(i) PBMC
Способность соединений данного изобретения ингибировать продуцирование TNF оценивают, используя мононуклеарные клетки периферической крови человека, которые синтезируют и выделяют TNF оценивают, используя мононуклеарные клетки периферической крови человека, которые синтезируют и выделяют TNF при стимуляции липополисахаридом. при стимуляции липополисахаридом.
Мононуклеарные клетки периферической крови (PBMC) выделяют из гепаринизированной (10 единиц/мл гепарина) крови человека путем центрифугирования в градиенте плотности (Lymphoprep ; Nycomed). Мононуклеарные клетки ресуспендируют в среде для культивирования [среда RPMI 1640 (Gibco) с добавлением 50 единиц/мл пенициллина, 50 мкг/мл стрептомицина, 2 мМ глутамина и 1% термоинактивированной сыворотки АВ человека (Sigma H-1513)]. Соединения растворяют в ДМСО при концентрации 50 мМ, разводят 1:100 средой для культивирования и затем осуществляют серийное разведение в среде для культивирования, содержащей 1% ДМСО. РВМС (2,4×105 клеток в 160 мкл среды для культивирования) инкубируют с 20 мкл растворов испытываемых соединений различных концентраций (три повторения) или 20 мкл среды для культивирования, содержащей 1% ДМСО (контрольные лунки), в течение 30 минут при 37°С во влажной (5% CO2/95% воздуха) камере (Falcon 3072; 96-луночные планшеты для культивирования тканей с плоскодонными лунками). В соответствующие лунки добавляют 20 мкл липополисахарида [LPS Е.coli 0111:B4 (Sigma L-4130), конечная концентрация 10 мкг/мл], растворенного в среде для культивирования. В контрольные лунки ""одна среда" добавляют по 20 мкл среды для культивирования. В каждом 96-луночном планшете отводят шесть лунок для контроля "один LPC" и четыре лунки для контроля "одна среда". В каждое испытание включают различные концентрации известного ингибитора TNF ; Nycomed). Мононуклеарные клетки ресуспендируют в среде для культивирования [среда RPMI 1640 (Gibco) с добавлением 50 единиц/мл пенициллина, 50 мкг/мл стрептомицина, 2 мМ глутамина и 1% термоинактивированной сыворотки АВ человека (Sigma H-1513)]. Соединения растворяют в ДМСО при концентрации 50 мМ, разводят 1:100 средой для культивирования и затем осуществляют серийное разведение в среде для культивирования, содержащей 1% ДМСО. РВМС (2,4×105 клеток в 160 мкл среды для культивирования) инкубируют с 20 мкл растворов испытываемых соединений различных концентраций (три повторения) или 20 мкл среды для культивирования, содержащей 1% ДМСО (контрольные лунки), в течение 30 минут при 37°С во влажной (5% CO2/95% воздуха) камере (Falcon 3072; 96-луночные планшеты для культивирования тканей с плоскодонными лунками). В соответствующие лунки добавляют 20 мкл липополисахарида [LPS Е.coli 0111:B4 (Sigma L-4130), конечная концентрация 10 мкг/мл], растворенного в среде для культивирования. В контрольные лунки ""одна среда" добавляют по 20 мкл среды для культивирования. В каждом 96-луночном планшете отводят шесть лунок для контроля "один LPC" и четыре лунки для контроля "одна среда". В каждое испытание включают различные концентрации известного ингибитора TNF , т.е. ингибитора фермента PDE типа IV (например, см. Seromler, J. Wachtel. Н. and Enders, S., Int. J. Immunopharmac. (1993), 15 (3), 409-413) или ингибитора про-TNF , т.е. ингибитора фермента PDE типа IV (например, см. Seromler, J. Wachtel. Н. and Enders, S., Int. J. Immunopharmac. (1993), 15 (3), 409-413) или ингибитора про-TNF -конвертазы (например, см. McGeehan, G.M., et al., Nature (1994), 370, 558-561). -конвертазы (например, см. McGeehan, G.M., et al., Nature (1994), 370, 558-561).
Планшеты инкубируют в течение 7 часов при 37°С (влажная камера), после чего из каждой лунки удаляют по 100 мкл супернатанта и хранят при -70°С (96-луночные планшеты с круглодонными лунками; Corning 25850). Содержание TNF в каждом образце определяют с использованием метода ELISA для TNFa (см. WO 92/10190 и Current Protocols in Molecular Biology, vol.2, Frederick M. Ausbel et al., John Wiley and Sons Inc.). в каждом образце определяют с использованием метода ELISA для TNFa (см. WO 92/10190 и Current Protocols in Molecular Biology, vol.2, Frederick M. Ausbel et al., John Wiley and Sons Inc.).

(ii) Цельная кровь человека
Способность соединений данного изобретения ингибировать продуцирование TNF также оценивают при анализе цельной крови человека. Цельная кровь человека секретирует TNF также оценивают при анализе цельной крови человека. Цельная кровь человека секретирует TNF при стимуляции LPS. Это свойство крови создает основу для анализа, который используют в качестве вторичного испытания соединений, показавших себя активными при испытании с РВМС. при стимуляции LPS. Это свойство крови создает основу для анализа, который используют в качестве вторичного испытания соединений, показавших себя активными при испытании с РВМС.
Гепаринизируют (10 единиц/мл) кровь, взятую у добровольцев. В лунки 96-луночных планшетов с круглодонными лунками (Corning 25850) добавляют по 160 мкл цельной крови. Соединения растворяют и разводят серийно в среде RPMI 1640 (Gibco) с добавлением 50 единиц/мл пенициллина, 50 мкг/мл стрептомицина и 2 мМ глутамина, как подробно описано выше. В соответствующие лунки добавляют по 20 мкл раствора испытываемого соединения каждой концентрации (три повторения). В контрольные лунки добавляют по 20 мкл среды RPMI 1640 с добавлением антибиотиков и глутамина. Планшеты инкубируют в течение 30 минут при 37°С (влажная камера) перед добавлением 20 мкл LPS (конечная концентрация 10 мкг/мл). В контрольные лунки добавляют среду RPMI 1640. В каждом планшете отводят шесть лунок для контроля "один LPS" и четыре лунки для контроля "одна среда". В каждое испытание также включают известный ингибитор синтеза/секреции TNF . Планшеты инкубируют в течение 6 часов при 37°С (влажная камера). Планшеты центрифугируют (2000 об/мин в течение 10 минут), удаляют по 100 мкл плазмы и хранят при -70°С (планшеты Corning 25850). Содержание TNF . Планшеты инкубируют в течение 6 часов при 37°С (влажная камера). Планшеты центрифугируют (2000 об/мин в течение 10 минут), удаляют по 100 мкл плазмы и хранят при -70°С (планшеты Corning 25850). Содержание TNF определяют методом ELISA (см. WO 92/10190 и Current Protocols in Molecular Biology, vol.2, Frederick M. Ausbel et al., John Wiley and Sons Inc.). Парные антитела, используемые при ELISA, получают от R&D Systems (кат. №№МАВ610, античеловеческое антитело оболочки против TNF определяют методом ELISA (см. WO 92/10190 и Current Protocols in Molecular Biology, vol.2, Frederick M. Ausbel et al., John Wiley and Sons Inc.). Парные антитела, используемые при ELISA, получают от R&D Systems (кат. №№МАВ610, античеловеческое антитело оболочки против TNF , BAF210, биотинилированные античеловеческие антитела для детекции TNF , BAF210, биотинилированные античеловеческие антитела для детекции TNF ). ).
Оценка ex vivo/in vivo
Возможности соединений данного изобретения как ех vivo ингибиторов TNF оценивают на крысах или мышах. Кратко, группам самцов крыс Wistar Alderley Park (АР) (180-210 г) вводят соединение (6 крысам) или носитель лекарственного средства (10 крысам) подходящим способом, например перорально (р.о.), интраперитонеально (i.p.) или подкожно (s.c.). Спустя девять минут крыс умерщвляют с использованием СО2 в возрастающей концентрации и спускают кровь из задней полой вены в гепариннатрий (5 единиц на мл крови). Образцы крови сразу же помещают на лед и центрифугируют при 2000 об/мин в течение 10 мин при 4°С и собранную плазму замораживают при -20°С для последующего анализа ее действия на продуцирование TNF оценивают на крысах или мышах. Кратко, группам самцов крыс Wistar Alderley Park (АР) (180-210 г) вводят соединение (6 крысам) или носитель лекарственного средства (10 крысам) подходящим способом, например перорально (р.о.), интраперитонеально (i.p.) или подкожно (s.c.). Спустя девять минут крыс умерщвляют с использованием СО2 в возрастающей концентрации и спускают кровь из задней полой вены в гепариннатрий (5 единиц на мл крови). Образцы крови сразу же помещают на лед и центрифугируют при 2000 об/мин в течение 10 мин при 4°С и собранную плазму замораживают при -20°С для последующего анализа ее действия на продуцирование TNF кровью человека, стимулированной LPS. Образцы плазмы крысы оттаивают и добавляют по 175 мкл каждого образца по установленной схеме в 96-луночный планшет с круглодонными лунками (Corning 25850). Затем в каждую лунку добавляют по 50 мкл гепаринизированной крови человека, перемешивают и планшет инкубируют в течение 30 мин при 37°С (влажная камера). В лунки добавляют LPS (25 мкл; конечная концентрация 10 мкг/мл) и продолжают инкубацию еще в течение 5,5 часов. В контрольные лунки перед инкубацией помещают только 25 мкл одной среды. Затем планшеты центрифугируют в течение 10 мин при 2000 об/мин и по 200 мкл супернатантов переносят в 96-луночный планшет и замораживают при -20°С для последующего анализа содержания TNF методом ELISA. кровью человека, стимулированной LPS. Образцы плазмы крысы оттаивают и добавляют по 175 мкл каждого образца по установленной схеме в 96-луночный планшет с круглодонными лунками (Corning 25850). Затем в каждую лунку добавляют по 50 мкл гепаринизированной крови человека, перемешивают и планшет инкубируют в течение 30 мин при 37°С (влажная камера). В лунки добавляют LPS (25 мкл; конечная концентрация 10 мкг/мл) и продолжают инкубацию еще в течение 5,5 часов. В контрольные лунки перед инкубацией помещают только 25 мкл одной среды. Затем планшеты центрифугируют в течение 10 мин при 2000 об/мин и по 200 мкл супернатантов переносят в 96-луночный планшет и замораживают при -20°С для последующего анализа содержания TNF методом ELISA.
Данные анализа с помощью специальной программы рассчитывают для каждого соединения на дозу:

Альтернативно, в описанной выше процедуре вместо крыс можно использовать мышей.
Испытания соединений как антиартритических средств
Активность соединения как антиартритического средства оценивают следующим образом. Trentham et al. [1] показали, что нативный коллаген типа II, растворимый в кислоте, является артритогенным для крыс; он вызывает полиартрит при введении в неполном адъюванте Фрейнда. Теперь это явление известно как коллагениндуцированный артрит (CIA), и подобные состояния можно вызвать у мышей и приматов. Недавние исследования показали, что моноклональные антитела против TNF [2] и слитые белки рецептора TNF и IgG [3] улучшают состояние при установившемся CIA, что указывает, что TNF играет ключевую роль в патофизиологии CIA. Более того, обнаруженная в последних клинических исследованиях заметная эффективность в случае моноклональных антител против TNF показывает, что TNF играет главную роль в указанном хроническом воспалительном заболевании. Таким образом, CIA у мышей DBA/1, как описывается в [2] и [3] является основной моделью, которую можно использовать для демонстрации антиартритической активности соединения. См. также [4]. [2] и слитые белки рецептора TNF и IgG [3] улучшают состояние при установившемся CIA, что указывает, что TNF играет ключевую роль в патофизиологии CIA. Более того, обнаруженная в последних клинических исследованиях заметная эффективность в случае моноклональных антител против TNF показывает, что TNF играет главную роль в указанном хроническом воспалительном заболевании. Таким образом, CIA у мышей DBA/1, как описывается в [2] и [3] является основной моделью, которую можно использовать для демонстрации антиартритической активности соединения. См. также [4].
Хотя фармакологические свойства соединений формулы I, как и ожидалось, изменяются с изменением строения, как правило, соединение формулы I дает ингибирование р38 и/или р38 и/или р38 , превышающее 30% при концентрациях до 10 мкМ. Для испытанных соединений настоящего изобретения неприемлемой токсичности при эффективной дозе не обнаружено. , превышающее 30% при концентрациях до 10 мкМ. Для испытанных соединений настоящего изобретения неприемлемой токсичности при эффективной дозе не обнаружено.
Например, соединение N-{6-[N-(3-диметиламинопропил)-N-метиламино]пирид-3-ил}-2-хлор-5-(2-морфолинопирид-4-илкарбониламино)бензамид имеет IC50 приблизительно 0,05 мкМ против р38 и IC50 приблизительно 5 мкМ при испытании с цельной кровью человека. и IC50 приблизительно 5 мкМ при испытании с цельной кровью человека.
В соответствии с другим аспектом изобретение относится к фармацевтической композиции, содержащей производное амида формулы I или его фармацевтически приемлемую соль, или его расщепляемый in vivo сложный эфир, определенные выше, в сочетании с фармацевтически приемлемым разбавителем или носителем.
Композиции изобретения могут находиться в форме, подходящей для перорального применения (например, в виде таблеток, лепешек, твердых и мягких желатиновых капсул, водных или масляных суспензий, эмульсий, диспергируемых порошков или гранул, сиропов или эликсиров), для местного применения (например, в форме кремов, мазей, гелей или водных или масляных растворов или суспензий), для введения путем ингаляции (например, в виде тонко измельченного порошка или жидкого аэрозоля), для введения путем инсуффляции (например, в виде тонко измельченного порошка) или для парентерального введения (например, в виде стерильного водного или масляного раствора для внутривенного, подкожного или внутримышечного введения дозы или в виде суппозитория для ректального введения).
Композиции изобретения можно получить обычными методами с использованием обычных фармацевтических эксципиентов, хорошо известных в данной области. Так, композиции, предназначенные для перорального применения, могут содержать, например, один или несколько красителей, подслащивателей, корригентов и/или консервантов.
Количество активного ингредиента, которое соединяют с одним или несколькими эксципиентами для получения отдельной лекарственной формы, естественно, будет изменяться в зависимости от реципиента, которого лечат, и конкретного способа введения. Например, композиция, предназначенная для перорального введения человеку, как правило, будет содержать, например, от 0,5 мг до 0,5 г активного вещества, соединенного с соответствующим и удобным количеством эксципиентов, содержание которых может изменяться от примерно 5 до примерно 98 мас.% от массы всей композиции.
Величина дозы соединения формулы I для лечебных и профилактических целей, естественно, будет изменяться в соответствии с характером и тяжестью состояния, возраста и пола животного или пациента и способа введения в соответствии с известными в медицине правилами.
При применении соединения формулы I для лечебных или профилактических целей его, как правило, вводят из расчета, чтобы получить суточную дозу в интервале, например, от 0,5 мг до 75 мг на кг массы тела, которую дают, при необходимости, в виде небольших доз. Как правило, при парентеральном способе введения будут вводиться меньшие дозы. Так, например, в случае внутривенного введения, как правило, будет использоваться доза в интервале, например, от 0,5 мг до 30 мг на кг массы тела. Подобным образом, для введения путем ингаляции будет использоваться доза в интервале, например, от 0,5 мг до 25 мг на кг массы тела. Однако предпочтительно пероральное введение, в частности в форме таблеток. Как правило, стандартные лекарственные формы будут содержать от примерно 1 мг до примерно 500 мг соединения данного изобретения.
В соответствии с другим аспектом изобретение относится к производному амида формулы I или его фармацевтически приемлемой соли, или его расщепляемому in vivo сложному эфиру, определенным выше, для применения в способе лечения организма человека или животного.
В соответствии с другим аспектом изобретение относится к производному амида формулы I или его фармацевтически приемлемой соли, или его расщепляемому in vivo сложному эфиру, определенным выше, для применения при изготовлении лекарственного средства для применения при лечении заболеваний или состояний, опосредуемых цитокинами.
В другом аспекте настоящее изобретение относится к способу лечения заболеваний или состояний, опосредуемых цитокинами, включающему введение теплокровному животному эффективного количества соединения формулы I или его фармацевтически приемлемой соли, или его расщепляемого in vivo сложного эфира.
В другом аспекте настоящее изобретение относится к применению соединения формулы I или его фармацевтически приемлемой соли, или его расщепляемого in vivo сложного эфира при изготовлении лекарственного средства для применения при лечении заболеваний или состояний, опосредуемых TNF, IL-1, IL-6 или IL-8.
В другом аспекте настоящее изобретение относится к способу лечения заболеваний или состояний, опосредуемых TNF, IL-1, IL-6 или IL-8, включающему введение теплокровному животному эффективного количества соединения формулы I или его фармацевтически приемлемой соли, или его расщепляемого in vivo сложного эфира.
В другом аспекте настоящее изобретение относится к применению соединения формулы I или его фармацевтически приемлемой соли, или, его расщепляемого in vivo сложного эфира при изготовлении лекарственного средства для применения при лечении заболеваний или состояний, опосредуемых TNF.
В другом аспекте настоящее изобретение относится к способу лечения заболеваний или состояний, опосредуемых TNF, включающему введение теплокровному животному эффективного количества соединения формулы I или его фармацевтически приемлемой соли, или его расщепляемого in vivo сложного эфира.
В другом аспекте настоящее изобретение относится к применению соединения формулы I или его фармацевтически приемлемой соли, или его расщепляемого in vivo сложного эфира при изготовлении лекарственного средства для ингибирования TNF, IL-1, IL-6 или IL-8.
В другом аспекте настоящее изобретение относится к способу ингибирования TNF, IL-1, IL-6 или IL-8, включающему введение теплокровному животному эффективного количества соединения формулы I или его фармацевтически приемлемой соли, или его расщепляемого in vivo сложного эфира.
В другом аспекте настоящее изобретение относится к применению соединения формулы I или его фармацевтически приемлемой соли, или его расщепляемого in vivo сложного эфира при изготовлении лекарственного средства для применения при ингибировании TNF.
В другом аспекте настоящее изобретение относится к способу ингибирования TNF, включающему введение теплокровному животному эффективного количества соединения формулы I или его фармацевтически приемлемой соли, или его расщепляемого in vivo сложного эфира.
В другом аспекте настоящее изобретение относится к применению соединения формулы I или его фармацевтически приемлемой соли, или его расщепляемого in vivo сложного эфира при изготовлении лекарственного средства для применения при лечении заболеваний или состояний, опосредуемых киназой р38.
В другом аспекте настоящее изобретение относится к способу лечения заболеваний или состояний, опосредуемых киназой р38, включающему введение теплокровному животному эффективного количества соединения формулы I или его фармацевтически приемлемой соли, или его расщепляемого in vivo сложного эфира.
В другом аспекте настоящее изобретение относится к применению соединения формулы I или его фармацевтически приемлемой соли, или его расщепляемого in vivo сложного эфира при изготовлении лекарственного средства для применения при получении ингибирующего действия на киназу р38.
В другом аспекте настоящее изобретение относится к способу обеспечения ингибирующего действия на киназу р38, включающему введение теплокровному животному эффективного количества соединения формулы I или его фармацевтически приемлемой соли, или его расщепляемого in vivo сложного эфира.
В другом аспекте настоящее изобретение относится к применению соединения формулы I или его фармацевтически приемлемой соли, или его расщепляемого in vivo сложного эфира при изготовлении лекарственного средства для применения при лечении ревматоидного артрита, астмы, слизистого колита, рассеянного склероза, СПИД, септического шока, ишемической болезни сердца или псориаза.
В другом аспекте настоящее изобретение относится к способу лечения ревматоидного артрита, астмы, слизистого колита, рассеянного склероза, СПИД, септического шока, ишемической болезни сердца или псориаза, включающему введение теплокровному животному эффективного количества соединения формулы I или его фармацевтически приемлемой соли, или его расщепляемого in vivo сложного эфира.
Соединения данного изобретения можно применять в сочетании с другими лекарственными средствами и способами лечения, используемыми при лечении болезненных состояний, при которых может помочь ингибирование цитокинов, в частности TNF и IL-1. Например, соединения формулы I можно применять в сочетании с лекарственными средствами и способами лечения ревматоидного артрита, астмы, слизистого колита, рассеянного склероза, СПИД, септического шока, ишемической болезни сердца, псориаза и других болезненных состояний, указанных выше в данном описании.
Например, в силу своей способности ингибировать цитокины, соединения формулы I представляют ценность при лечении некоторых воспалительных и невоспалительных заболеваний, которые в настоящее время лечат ингибирующими циклооксигеназу нестероидными противовоспалительными лекарственными средствами (NSAID), такими как индометацин, кеторолак, ацетилсалициловая кислота, ибупрофен, сулиндак, толметин и пироксикам. Совместное введение соединения формулы I и NSAID может привести к уменьшению количества последнего средства, необходимого для получения лечебного действия. Посредством этого снижается вероятность вредного побочного действия NSAID, такого как действие на желудочно-кишечный тракт. Таким образом, в соответствии с еще одной своей особенностью, изобретение относится к фармацевтической композиции, содержащей соединение формулы I или его фармацевтически приемлемую соль, или его расщепляемый in vivo сложный эфир в сочетании или в смеси с ингибирующим циклооксигеназу нестероидным противовоспалительным лекарственным средством и фармацевтически приемлемым разбавителем или носителем.
Соединения изобретения также можно применять с противовоспалительными средствами, такими как ингибитор фермента 5-липоксигеназы.
Соединения формулы I также можно применять при лечении состояний, таких как ревматоидный артрит, в сочетании с противоартритическими средствами, такими как золото, метотрексат, стероиды и пенициллинамин, и при состояниях, таких как остеоартрит, в сочетании со стероидами.
Соединения изобретения также можно назначать при заболеваниях, связанных с деградацией, например остеоартрита, с хондропротекторами, антидегративными и/или восстанавливающими средствами, такими как диацереин, композиции с гиалуроновой кислотой, такие как гиалан, румолан, артепарон, и соли глюкозамина, такие как антрил.
Соединения формулы I можно применять при лечении астмы в сочетании с противоастматическими средствами, такими как бронхолитические средства и антагонисты лейкотриена.
Если композиция создается в виде фиксированной дозы, в таких комбинированных продуктах соединения данного изобретения используют в пределах интервала доз, описанного здесь, а другое фармацевтически активное средство используют в пределах одобренного для него интервала доз. Предполагается последовательное применение, когда не подходит комбинированная композиция.
Хотя соединения формулы I, в первую очередь, представляют ценность как лечебные средства для применения к теплокровным животным (включая человека), они также полезны в любом случае, когда требуется ингибирование действия цитокинов. Так, они полезны в качестве фармакологических стандартов для применения при разработке новых биологических испытаний и при исследовании новых фармакологических средств.
Теперь изобретение будет иллюстрироваться приведенными далее примерами, не являющимися ограничительными, в которых, если нет иных указаний,
(i) операции осуществляют при температуре окружающей среды, т.е. в интервале 17-25°С, и в атмосфере инертного газа, такого как аргон, если нет иных указаний;
(ii) выпаривание осуществляют с применением роторного испарителя в вакууме, и процедуры заключительной обработки осуществляют после удаления оставшихся твердых веществ фильтрацией;
(iii) колоночную хроматографию (флэш-метод) и жидкостную хроматографию среднего давления (MPLC) осуществляют на двуокиси кремния Merck Kieselgel (арт. 9385) или Merck Lichroprep RP10 (арт. 9303) для хроматографии с обращенной фазой, получаемых от Е.Merck, Дармштадт, Германия, или жидкостную хроматографию высокого давления (ВЭЖХ) осуществляют на двуокиси кремния для хроматографии с обращенной фазой С18, например Dynamax C-18, 60 Å на препаративной колонке для хроматографии с обращенной фазой;
(iv) выходы даются только для иллюстрации и это необязательно максимально достижимые выходы;
(v) как правило, конечные продукты формулы I дают удовлетворительные результаты при микроанализе, и их строение подтверждают методом ядерного магнитного резонанса (ЯМР) и/или масс-спектральными методами; масс-спектральные данные при бомбардировке быстрыми атомами (FAB) получают с использованием спектрометра Platform и, где это подходит, собирают данные с положительными или отрицательными ионами; величины химического сдвига при ЯМР измеряют по дельта-шкале [спектр протонного магнитного резонанса определяют с использованием спектрометра Varian Gemini 2000, работающего при напряженности поля 300 МГц, или спектрометра Bruker АМ250, работающего при напряженности поля 250 МГц]; и используются следующие аббревиатуры: с - синглет; д - дублет; т - триплет; м - мультиплет; уш - уширенный;
(vi) промежуточные соединения, как правило, полностью не характеризуют и их чистоту оценивают при анализе методом тонкослойной хроматографии, ВЭЖХ, инфракрасной спектрометрии (ИК) и/или ЯМР;
(vii) температуры плавления не корректируют и определяют с использованием прибора для автоматического определения температуры плавления Mettler SP62 или прибора с масляной баней; температуры плавления конечных продуктов формулы I определяют после перекристаллизации из обычных органических растворителей, таких как этанол, метанол, ацетон, эфир или гексан, как таковых или их смесей; и
(viii) используются следующие аббревиатуры:
ДМФА - диметилформамид,
ДМСО - диметилсульфоксид,
ТГФ - тетрагидрофуран.
Пример 1
N-(4-Пропилфенил)-5-(4-цианобензамидо)-2-метилбензамид
4-н-Пропиланилин (0,11 г) добавляют к перемешиваемой суспензии 5-(4-цианобензамидо)-2-метилбензоилхлорида (0,224 г), триэтиламина (0,21 мл) и метиленхлорида (5 мл) и полученную смесь перемешивают при температуре окружающей среды в течение 16 часов. Смесь фильтруют и фильтрат выпаривают. Остаток очищают колоночной хроматографией на двуокиси, кремния с использованием в качестве элюента смесей метиленхлорида и метанола с возрастающей полярностью. Таким образом получают названное в заголовке соединение (0,049 г). Спектр ЯМР: (ДМСОd6) 0,87 (т, 3Н), 1,56 (м, 2Н), 2,33 (с, 3Н), 2,48 (м, 2Н), 7,13 (д, 2Н), 7,28 (д, 1Н), 7,63 (м, 2Н), 7,83 (м, 3Н), 8,01 (д, 1Н), 8,1 (м, 2Н). Масс-спектр: М+Н+ 398.
5-(4-Цианобензамидо)-2-метилбензоилхлорид, используемый в качестве исходного соединения, получают следующим образом.
4-Цианобензоилхлорид (4,50 г) добавляют к перемешиваемой суспензии метил 5-амино-2-метилбензоата (J. Med. Chem., 1991, 34, 2176-2186; 3 г), триэтиламина (2,54 мл) и метиленхлорида (100 мл) и полученную смесь перемешивают при температуре окружающей среды в течение 16 часов. Смесь подкисляют, добавляя 1 N соляную кислоту, и смесь перемешивают при температуре окружающей среды в течение 30 минут. Полученное твердое вещество отделяют и сушат в вакууме при 40°С, получая метил 5-(4-цианобензамидо)-2-метилбензоат (5,32 г). Спектр ЯМР: (ДМСОd6) 2,47 (с, 3Н), 3,83 (с, 3Н), 7,31 (д, 1Н), 7,88 (д, 1Н), 8,0 (д, 2Н), 8,1 (д, 2Н), 8,27 (с, 1Н), 10,57 (с, 1Н). Масс-спектр: М+Н+ 295.
Смесь порции (3 г) полученного таким образом вещества, 2 N водного раствора гидроксида натрия (20,4 мл), воды (10 мл) и метанола (80 мл) перемешивают при температуре окружающей среды в течение 16 часов и затем нагревают при 50°С в течение 5 часов. Полученный раствор выпаривают и остаток обрабатывают этилацетатом и водой. Водную фазу подкисляют до рН 5, добавляя 1 N соляную кислоту, и полученное твердое вещество отделяют и сушат в вакууме при 40°С. Таким образом получают 5-(4-цианобензамидо)-2-метилбензойную кислоту (1,79 г). Спектр ЯМР: (ДМСОd6) 2,45 (с, 3Н), 7,24 (д, 1Н), 7,84 (м, 1Н), 8,02 (м, 4Н), 8,26 (с, 1Н), 10,41 (д, 1Н). Масс-спектр: М+H+ 279.
Оксалилхлорид (0,104 г) добавляют по каплям к перемешиваемой смеси 5-(4-цианобензамидо)-2-метилбензойной кислоты (0,21 г), ДМФА (несколько капель) и метиленхлорида (10 мл), охлажденной до 0°С. Смесь нагревают до температуры окружающей среды и перемешивают в течение 4 часов. Смесь выпаривают, получая требуемое исходное вещество, которое используют без дополнительной очистки.
Пример 2
С использованием процедуры, аналогичной описанной в примере 1, соответствующий бензоилхлорид подвергают взаимодействию с соответствующим анилином, получая соединения, описанные в табл.1.
Таблица 1
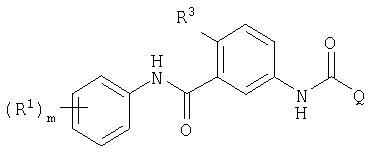 |
| № |
(R1)m |
R3 |
Q |
Примечание |
| 1 |
4-пропил |
метил |
фенил |
а |
| 2 |
3,4-диметокси |
метил |
фенил |
b |
| 3 |
3,4-диметокси |
метил |
4-цианофенил |
с |
Примечания
а) Продукт имеет следующие данные: спектр ЯМР: (ДМСОd6) 0,87 (т, 3Н), 1,52-1,56 (м, 2Н), 2,32 (с, 3Н), 2,48-2,53 (м, 2Н), 7,13 (д, 2Н), 7,26 (д, 1Н), 7,51-7,63 (м, 5Н), 7,8 (д, 1Н), 7,86 (С, 1Н), 7,95 (д, 2Н), 10,21 (с, 1Н), 10,29 (с, 1Н); масс-спектр: М+Н+ 373.
5-Бензамидо-2-метилбензоилхлорид, используемый в качестве исходного вещества, получают из метил 5-амино-2-метилбензоата и бензоилхлорида с использованием процедур, аналогичных описанным в разделе примера 1, касающегося получения исходных веществ. Таким образом получают, поочередно,
метил 5-бензамидо-2-метилбензоат, спектр ЯМР: (ДМСОd6) 2,43 (С, 3Н), 3,83 (с, 3Н), 7,29 (д, 1Н), 7,49-7,61 (м, 3Н), 7,88 (д, 1Н), 7,95 (д, 2Н), 8,29 (с, 1Н), 10,33 (с, 1Н); масс-спектр: М+Н+ 270;
5-бензамидо-2-метилбензоат, спектр ЯМР: (ДМСОd6) 2,43 (с, 3Н), 7,24 (д, 1Н), 7,44-7,6 (м, 3Н), 7,84 (д, 1Н), 7,94 (д, 2Н), 8,25 (с, 1Н), 10,39 (с, 1Н), 12,80 (с, 1Н); масс-спектр: M+H+ 254; и
5-бензамидо-2-метилбензоилхлорид, который используют без дополнительной очистки.
b) После перемешивания при температуре окружающей среды в течение 16 часов реакционную смесь фильтруют и фильтрат последовательно промывают 1 N соляной кислотой и насыщенным водным раствором бикарбоната натрия. Органическую фазу выпаривают и остаток растирают со смесью изогексана и этилацетата. Полученное твердое вещество отделяют, промывают диэтиловым эфиром и сушат. Полученный таким образом продукт имеет следующие данные: спектр ЯМР: (ДМСОd6) 2,33 (с, 3Н), 3,72 (с, 6Н), 6,9 (д, 1Н), 7,25 (д, 2Н), 7,43-7,58 (м, 4Н), 7,78 (д, 1Н), 7,87 (с, 1Н), 7,95 (д, 2Н), 10,13 (с, 1Н), 10,29 (с, 1Н); масс-спектр: М+H+ 391.
c) После перемешивания при температуре окружающей среды в течение 16 часов реакционную смесь фильтруют и фильтрат последовательно промывают 1 N соляной кислотой и насыщенным водным раствором бикарбоната натрия. Органическую фазу выпаривают и остаток растирают со смесью изогексана и этилацетата. Полученное твердое вещество отделяют, промывают диэтиловым эфиром и сушат. Полученный таким образом продукт имеет следующие данные: масс-спектр: М+Н+ 416.
Пример 3
N-[3-(4-Метилпиперазин-1-илметил)фенил]-2-метил-5-(2-морфолинопирид-4-илкарбониламино)бензамид
С использованием процедуры, аналогичной процедуре, описанной в примере 1, 2-морфолинопиридин-4-карбонилхлорид подвергают взаимодействию с N-[3-(4-метилпиперазин-1-илметил)фенил]-5-амино-2-метилбензамидом. Остаток очищают колоночной хроматографией на ионообменной колонке (колонка с изолют-SCX от International Sorbent Technology Limited, Hengoed, Mid-Glamorgan, UK) с использованием в качестве элюента сначала метанола, а затем смеси 99:1 метанола и насыщенного водного раствора гидроксида аммония. Таким образом получают названное в заголовке соединение с выходом 27%. Масс-спектр: М+H+ 529.
2-Морфолинопиридин-4-карбонилхлорид, используемый в качестве исходного вещества, получают следующим образом.
2-Хлорпиридин-4-карбонилхлорид (11,2 г) добавляют к перемешиваемой смеси трет-бутоксида калия (7,15 г) и ТГФ (50 мл), охлажденной до 0°С. Смесь нагревают до температуры окружающей среды и перемешивают в течение 16 часов. Смесь выпаривают и остаток обрабатывают этилацетатом и водой. Органическую фазу промывают насыщенным водным раствором бикарбоната натрия, сушат (MgSO4) и выпаривают. Таким образом получают трет-бутил 2-хлорпиридин-4-карбоксилат (10,5 г). Спектр ЯМР: (CDCl3) 1,6 (с, 9Н), 7,72 (д, 1Н), 7,82 (с, 1Н), 8,51 (д, 1Н).
После повторения предыдущего взаимодействия смесь полученного таким образом пиридин-4-карбоксилата (18,3 г) и морфолина (30 мл) перемешивают и нагревают при 100°С в течение 40 часов. Смесь выливают в воду и экстрагируют метиленхлоридом. Органическую фазу выпаривают и остаток очищают колоночной хроматографией на двуокиси кремния с использованием в качестве элюента сначала смеси 5:1 изогексана и этилацетата и затем смеси 10:3 тех же растворителей. Таким образом получают трет-бутил 2-морфолинопиридин-4-карбоксилат (15 г). Спектр ЯМР: (ДМСОd6) 1,52 (с, 9Н), 3,46-3,55 (м, 4Н), 3,62-3,7 (м, 4Н), 7,09 (д, 1Н), 7,13 (с, 1Н), 8,24 (д, 1Н).
Смесь полученного таким образом вещества, воды (10 мл) и трифторуксусной кислоты (90 мл) перемешивают при температуре окружающей среды в течение 3 часов. Смесь выпаривают и остаток обрабатывают смесью изогексана и этилацетата. Полученное твердое вещество отделяют, промывают этилацетатом и сушат, получая 2-морфолинопиридин-4-карбоновую кислоту (13,2 г). Спектр ЯМР: (ДМСОd6) 3,46-3,51 (м, 4Н), 3,62-3,7 (м, 4Н), 7,07 (д, 1Н), 7,25 (с, 1Н), 8,24 (д, 1Н).
Полученное таким образом вещество подвергают взаимодействию с оксалилхлоридом с использованием процедуры, аналогичной процедуре, описанной в последнем параграфе раздела примера 1, касающегося получения исходных веществ. Таким образом получают 2-морфолинопиридин-4-карбонилхлорид, который используют без дополнительной очистки.
N-[3-(4-Метилпиперазин-1-илметил)фенил]-5-амино-2-метилбензамид, используемый в качестве исходного вещества, получают следующим образом.
Смесь 3-нитробензилхлорида (1 г) и N-метилпиперазина (3 мл) перемешивают и нагревают при 100°С в течение 4 часов. Смесь охлаждают до температуры окружающей среды и обрабатывают метиленхлоридом и водой. Органическую фазу выпаривают, получая 3-(4-метилпиперазин-1-илметил) нитробензол (1,05 г). Спектр ЯМР: (ДМСОd6) 2,14 (с, 3Н), 2,31-2,38 (м, 8Н), 3,57 (с, 2Н), 7,6 (т, 1Н), 7,54 (д, 1Н), 8,07-8,13 (м, 2Н).
К перемешиваемой суспензии полученного таким образом вещества в смеси этанола (30 мл), воды (2 мл) и уксусной кислоты (0,5 мл) добавляют порошок железа (2,47 г). Смесь перемешивают и кипятят с обратным холодильником в течение 4 часов. Смесь охлаждают до температуры окружающей среды. Добавляют воду (30 мл) и полученную смесь подщелачивают, добавляя карбонат натрия. Смесь фильтруют и фильтрат выпаривают. Остаток обрабатывают водой. Полученное твердое вещество отделяют и сушат в вакууме при 40°С. Таким образом получают 3-(4-метилпиперазин-1-илметил)анилин (0,51 г). Спектр ЯМР: (ДМСОd6) 2,11 (с, 3Н), 2,24-2,36 (м, 8Н), 3,28 (с, 2Н), 4,92 (с, 2Н), 6,37-6,41 (м, 2Н), 6,49 (с, 1Н), 7,9 (т, 1Н).
Оксалилхлорид (0,31 г) добавляют по каплям к перемешиваемой смеси 2-метил-5-нитробензойной кислоты (0,4 г), ДМФА (несколько капель) и метиленхлорида (25 мл), охлажденной до 0°С. Смесь нагревают до комнатной температуры и перемешивают в течение пяти часов. Смесь выпаривают, получая 2-метил-5-нитробензоилхлорид, который растворяют в метиленхлориде (10 мл) и полученный раствор добавляют по каплям к перемешиваемой смеси 3-(4-метилпиперазин-1-илметил) анилина (0,44 г), триэтиламина (0,49 г) и метиленхлорида (10 мл). Смесь перемешивают при температуре окружающей среды в течение 16 часов. Смесь промывают насыщенным водным раствором бикарбоната натрия. Органическую фазу выпаривают и остаток очищают колоночной хроматографией на ионообменной колонке изолют-SCX, используя в качестве элюента сначала метанол, а затем смесь 99:1 метанола и насыщенного водного раствора гидроксида аммония. Таким образом получают N-[3-(4-метилпиперазин-1-илметил)фенил]-2-метил-5-нитробензамид (0,46 г). Масс-спектр: М+Н+ 369.
Смесь полученного таким образом 5-нитробензамида, порошка железа (2,79 г), воды (1 мл), уксусной кислоты (0,25 мл) и этанола (15 мл) перемешивают и нагревают при кипячении с обратным холодильником в течение 5 часов. Смесь охлаждают до температуры окружающей среды. Добавляют воду (50 мл) и смесь подщелачивают, добавляя карбонат натрия. Полученную смесь фильтруют и фильтрат выпаривают. Остаток обрабатывают метиленхлоридом и водой. Органическую фазу выпаривают и остаток очищают колоночной хроматографией на ионообменной колонке изолют-SCX, используя в качестве элюента сначала метанол, а затем смесь 99:1 метанола и насыщенного водного раствора гидроксида аммония. Таким образом получают N-[3-(4-метилпиперазин-1-илметил)фенил]-5-амино-2-метилбензамид (0,194 г). Спектр ЯМР: (CDCl3) 2,28 (с, 3Н), 2,37 (с, 3Н), 2,42-2,58 (м, 8Н), 3,5 (с, 2Н), 3,64 (уширенный с, 2Н), 5,29 (с, 1Н), 6,67-6,81 (м, 2Н), 7,02 (т, 1Н), 7,10 (д, 1Н), 7,3-7,6 (м, 1Н). Масс-спектр: М+Н+ 339.
Пример 4
N-[6-(4-Этилпиперазин-1-ил)пирид-3-ил]-2-хлор-5-(2-морфолинопирид-4-илкарбониламино)бензамид
2-Хлор-5-(2-морфолинопирид-4-илкарбониламино)бензойную кислоту (0,162 г) добавляют к перемешиваемой смеси 5-амино-2-(4-этилпиперазин-1-ил)пиридина (0,093 г), диизопропилэтиламина (0,232 г), гексафторфосфата (V) 2-(7-азабензотриазол-1-ил)-1,1,3,3-тетраметилурония (0,176 г) и ДМФА (10 мл) и смесь перемешивают при температуре окружающей среды в течение 16 часов. Смесь обрабатывают этилацетатом и водой. Органическую фазу промывают насыщенным водным раствором бикарбоната натрия и выпаривают. Остаток обрабатывают смесью изогексана и этилацетата. Полученное твердое вещество отделяют и сушат в вакууме при 40°С, получая названное в заголовке соединение (0,071 г). Спектр ЯМР: (ДМСОd6) 1,02 (т, 3Н), 2,34 (м, 2Н), 2,4-2,46 (м, 4Н), 3,38-3,42 (м, 4Н), 3,5-3,53 (м, 4Н), 3,69-3,71 (м, 4Н), 6,82 (д, 1Н), 7,08 (д, 2Н), 7,22 (с, 1Н), 7,62 (д, 1Н), 7,82-7,98 (м, 3Н), 8,28 (д, 1Н), 8,39 (с, 1Н). Масс-спектр: M+H+ 550 и 552.
2-Хлор-5-(2-морфолинопирид-4-илкарбониламино)бензойную кислоту, используемую в качестве исходного вещества, получают следующим образом.
С использованием процедуры, аналогичной описанной в последнем параграфе раздела примера 3, касающегося получения исходных веществ, восстанавливают метил 2-хлор-5-нитробензоат, получая метил 5-амино-2-хлорбензоат с выходом 38%. Спектр ЯМР: (ДМСОd6) 3,79 (с, 3Н), 5,46 (с, 2Н), 6,66 (д, 1Н), 6,97 (с, 1Н), 7,1 (д, 1Н).
С использованием процедуры, аналогичной описанной в примере 1, 2-морфолинопиридин-4-карбонилхлорид подвергают взаимодействию с метил 5-амино-2-хлорбензоатом. Продукт реакции обрабатывают смесью изогексана и этилацетата. Полученное твердое вещество отделяют и промывают диэтиловым эфиром. Таким образом получают метил 2-хлор-5-(2-морфолинопирид-4-илкарбониламино)бензоат с выходом 63%. Спектр ЯМР: (ДМСОd6) 3,49-3,53 (м, 4Н), 3,69-3,72 (м, 4Н), 3,86 (С, 3Н), 7,09 (д, 1Н), 7,23 (с, 1Н), 7,56 (д, 1Н), 7,96 (д, 1Н), 8,25-8,28 (м, 2Н), 10,55 (с, 1Н). Масс-спектр: M+H+ 376 и 378.
Смесь полученного таким образом метилбензоата (3 г), 2 N водного раствора гидроксида натрия (16 мл), воды (25 мл) и метанола (100 мл) перемешивают при температуре окружающей среды в течение 16 часов. Полученный раствор выпаривают и остаток подкисляют до рН 1, добавляя 1 N соляную кислоту. Добавляют воду (1 мл) и метанол (1 мл) и смесь перемешивают в течение 1 часа. Полученное твердое вещество отделяют и сушат в вакууме при 40°С, получая требуемое исходное вещество (2,83 г). Спектр ЯМР: (ДМСОd6) 3,62-3,74 (м, 8Н), 7,21 (д, 1Н), 7,53 (д, 1Н), 7,63 (с, 1Н), 8,01 (д, 1Н), 8,21 (д, 1Н), 8,28 (с, 1Н), 10,98 (с, 1Н). Масс-спектр: M+H+ 360 и 362.
5-Амино-2-(4-этилпиперазин-1-ил)пиридин, используемый в качестве исходного вещества, получают следующим образом.
Смесь 2-хлор-5-нитропиридина (1 г) и N-этилпиперазина (4 мл) перемешивают и нагревают при 100°С в течение 16 часов. Смесь охлаждают до температуры окружающей среды и выливают в воду. Полученное твердое вещество отделяют, промывают последовательно водой и диэтиловым эфиром и сушат в вакууме при 40°С. Таким образом получают 2-(4-этилпиперазин-1-ил)-5-нитропиридин (0,22 г). Спектр ЯМР: (ДМСОd6) 1,01 (т, 3Н), 2,33-2,41 (м, 2Н), 2,42-2,44 (м, 4Н), 3,71-3,75 (м, 4Н), 6,91 (д, 1Н), 8,17 (д, 1Н), 8,92 (с, 1Н).
Смесь полученного таким образом вещества, 10% палладия-на-угле (0,095 г) и метанола (20 мл) перемешивают в атмосфере водорода. После прекращения поглощения водорода катализатор удаляют фильтрацией и фильтрат выпаривают. Таким образом получают требуемое исходное вещество (0,18 г). Спектр ЯМР: (ДМСОd6) 1,0 (т, 3Н), 2,28-2,36 (м, 2Н), 2,38-2,41 (м, 4Н), 3,15-3,21 (м, 4Н), 4,5 (уширенный с, 2Н), 6,58 (д, 1Н), 6,85 (д, 1Н), 7,57 (с, 1Н). Масс-спектр: М+Н+ 207.
Пример 5
С использованием процедуры, аналогичной процедуре, описанной в примере 4, соответствующий 5-аминопиридин подвергают взаимодействию с 2-хлор-5-(2-мофролинопирид-4-илкарбониламино)бензойной кислотой, получая соединения, описанные в табл.II.
Таблица II
 |
| № |
R1 |
R3 |
Примечание |
| 1 |
N-(2-диметиламиноэтил)-N-метиламино |
хлор |
а |
| 2 |
N-(3-диметиламинопропил)-N-метиламино |
хлор |
b |
| 3 |
4-метилпиперазин-1-ил |
хлор |
с |
| 4 |
4-метилгомопиперазин-1-ил |
хлор |
d |
Примечания
а) Продукт имеет следующие данные: Спектр ЯМР: (ДМСОd6) 2,4-2,49 (м, 8Н), 2,98 (с, 3Н), 3,48-3,53 (м, 4Н), 3,66-3,72 (м, 6Н), 6,61 (м, 1Н), 7,1 (д, 1Н), 7,23 (с, 1Н), 7,53 (д, 1Н), 7,78-7,82 (м, 1Н), 7,88-7,93 (м, 1Н), 8,27-8,38 (м, 2Н), 10,26 (с, 1Н), 10,51 (с, 1Н). Масс-спектр: M+H+ 538 и 540.
5-Амино-2-[N-(2-диметиламиноэтил)-N-метиламино]пиридин, используемый в качестве исходного вещества, получают из 2-хлор-5-нитропиридина и N-(2-диметиламиноэтил)-N-метиламина с использованием процедур, аналогичных процедурам, описанным в разделе примера 4, касающегося получения 5-амино-2-(4-этилпиперазин-1-ил)пиридина. Требуемое исходное вещество имеет следующие данные: Спектр ЯМР: (ДМСОd6) 2,35 (т, 2Н), 2,48 (с, 6Н), 2,82 (с, 3Н), 3,32-3,44 (м, 6Н), 6,4 (м, 1Н), 6,84-6,9 (м, 1Н), 7,53-7,56 (м, 1Н). Масс-спектр: М+Н+ 195.
b) Продукт очищают колоночной хроматографией на ионообменной колонке изолют-SCX с использованием в качестве элюента сначала метанола, а затем смеси 99:1 метанола и насыщенного водного раствора гидроксида аммония. Продукт имеет следующие данные: Масс-спектр: М+Н+ 552 и 554.
5-Амино-2-[N-(3-диметиламинопропил)-N-метиламино]пиридин, используемый в качестве исходного вещества, получают из 2-хлор-5-нитропиридина и N-(3-диметиламинопропил)-N-метиламина с использованием процедур, аналогичных процедурам, описанным в разделе примера 4, касающегося получения 5-амино-2-(4-этилпиперазин-1-ил)пиридина. Требуемое исходное вещество имеет следующие данные: Спектр ЯМР: (ДМСОd6) 1,48-1,56 (м, 2Н), 2,08 (с, 6Н), 2,16 (т, 2Н), 2,49 (с, 3Н), 3,29-3,36 (м, 2Н), 4,28 (уширенный с, 2Н), 6,37-6,42 (м, 1Н), 6,84-6,9 (м, 1Н), 7,53 (с, 1Н). Масс-спектр: M+H+ 209.
c) Продукт имеет следующие данные: Спектр ЯМР: (ДМСОd6) 2,19 (с, 3Н), 2,36-2,39 (м, 4Н), 3,39-3,43 (м, 4Н), 3,39-3,52 (м, 4Н), 3,68-3,71 (м, 4Н), 6,84 (д, 1Н), 7,08 (д, 1Н), 7,23 (с, 1Н), 7,52 (д, 1Н), 7,84-7,94 (м, 3Н), 8,27 (д, 1Н), 8,39 (с, 1Н). Масс-спектр: М+Н+ 536 и 538.
5-Амино-2-(4-метилпиперазин-1-ил)пиридин, используемый в качестве исходного вещества, получают из 2-хлор-5-нитропиридина и N-метилпиперазина с использованием процедур, аналогичных процедурам, описанным в разделе примера 4, касающегося получения 5-амино-2-(4-этилпиперазин-1-ил) пиридина. Требуемое исходное вещество имеет следующие данные: Спектр ЯМР: (ДМСОd6) 2,26 (с, 3Н), 2,47-2,49 (м, 4Н), 3,21-3,25 (м, 4Н), 6,6 (д, 1Н), 6,9 (д, 1Н), 7,57 (с, 1Н). Масс-спектр: М+Н+ 193.
d) Продукт очищают колоночной хроматографией на ионообменной колонке изолют-SCX с использованием в качестве элюента сначала метанола, а затем смеси 99:1 метанола и насыщенного водного раствора гидроксида аммония. Продукт имеет следующие данные: Масс-спектр: М+Н+ 550 и 552.
5-Амино-2-(4-метилгомопиперазин-1-ил)пиридин, используемый в качестве исходного вещества, получают из 2-хлор-5-нитропиридина и N-метилгомопиперазина с использованием процедур, аналогичных процедурам, описанным в разделе примера 4, касающегося получения 5-амино-2-(4-этилпиперазин-1-ил) пиридина. Требуемое исходное вещество имеет следующие данные: масс-спектр: М+Н+ 207.
Пример 6
N-[3-(4-Метилпиперазин-1-илметил)фенил]-2-хлор-5-(2-морфолинопирид-4-илкарбониламино)бензамид
С использованием процедуры, аналогично описанной в примере 4, 3-(4-метилпиперазин-1-илметил)анилин подвергают взаимодействию с 2-хлор-5-(2-морфолинопирид-4-илкарбониламино)бензойной кислотой, получая названное в заголовке соединение с выходом 32%. Спектр ЯМР: (ДМСОd6) 2,13 (с, 3Н), 2,31-2,35 (м, 8Н), 3,42 (с, 2Н), 3,49-3,53 (м, 4Н), 3,69-3,72 (м, 4Н), 7,02 (д, 1Н), 7,1 (д, 1Н), 7,22-7,3 (м, 2Н), 7,57-7,65 (м, 3Н), 7,84-7,94 (м, 2Н), 8,28 (д, 1Н), 10,47 (с, 1Н), 10,52 (с, 1Н). Масс-спектр: М+Н+ 549 и 551.
Пример 7
Фармацевтические композиции.
Далее приводятся характерные фармацевтические лекарственные формы изобретения, как они определены здесь (причем активный ингредиент обозначается "Соединение X"), для лечебного или профилактического применения на людях.
| (а) Таблетка I |
мг/таблетка |
| Соединение X |
100 |
| Лактоза (евр.фарм.) |
182,75 |
| Кросскармелозанатрий |
12,0 |
| Паста из маисового крахмала (5% паста, мас./об.) |
2,25 |
| Стеарат магния |
3,0 |
| (b) Таблетка II |
мг/таблетка |
| Соединение Х |
50 |
| Лактоза (евр.фарм.) |
223,75 |
| Кросскармелозанатрий |
6,0 |
| Маисовый крахмал |
15,0 |
| Поливинилпирролидон (5% паста, мас./об.) |
2,25 |
| Стеарат магния |
3,0 |
| (с) Таблетка III |
мг/таблетка |
| Соединение Х |
1,0 |
| Лактоза (евр.фарм.) |
93,25 |
| Кросскармелозанатрий |
4,0 |
| Паста из маисового крахмала(5% паста, мас./об.) |
0,75 |
| Стеарат магния |
1,0 |
| (d) Капсула |
мг/капсула |
| Соединение Х |
10 |
| Лактоза (евр.фарм.) |
488,5 |
| Стеарат магния |
1,5 |
| (e) Инъекция I |
(50 мг/мл) |
| Соединение X |
5,0% (мас./об.) |
| 1 М раствор гидроксида натрия |
15,0% (об./об.) |
| 0,1 М соляная кислота (для доведения рН до 7,6) |
|
| Полиэтиленгликоль 400 |
4,5% (мас./об.) |
| Вода для инъекций до 100% |
|
| (f) Инъекция II |
(10 мг/мл) |
| Соединение Х |
1,0% (мас./об.) |
| Фосфат натрия, ВР |
3,6% (мас./об.) |
| 0,1 М раствор гидроксида натрия |
15,0% (об./об.) |
| Вода для инъекций до 100% |
|
| (g) Инъекция III |
(1 мг/мл, забуф. до рН 6) |
| Соединение X |
0,1% (мас./об.) |
| Фосфат натрия, ВР |
2,26% (мас./об.) |
| Лимонная кислота |
0,38% (мас./об.) |
| Полиэтиленгликоль 400 |
3,5% (мас./об.) |
| Вода для инъекций до 100% |
|
| (h) Аэрозоль I |
мг/мл |
| Соединение X |
10,0 |
| Триолеат сорбитана |
13,5 |
| Трихлорфторметан |
910,0 |
| Дихлордифторметан |
490,0 |
| (i) Аэрозоль II |
мг/мл |
| Соединение Х |
0,2 |
| Триолеат сорбитана |
0,27 |
| Трихлорфторметан |
70,0 |
| Дихлордифторметан |
280,0 |
| Дихлортетрафторметан |
1094,0 |
| (j) Аэрозоль III |
мг/мл |
| Соединение X |
2,5 |
| Триолеат сорбитана |
3,38 |
| Трихлорфторметан |
67,5 |
| Дихлордифторметан |
1086,0 |
| Дихлортетрафторметан |
191,6 |
| (k) Аэрозоль IV |
мг/мл |
| Соединение Х |
2,5 |
| Соевый лецитин |
2,7 |
| Трихлорфторметан |
67,5 |
| Дихлордифторметан |
1086,0 |
| Дихлортетрафторметан |
191,6 |
| (l) Мазь |
мл |
| Соединение Х |
40 мг |
| Этанол |
300 мкл |
| Вода |
300 мкл |
| 1-Додецилазациклогептан-2-он |
50 мкл |
| Пропиленгликоль |
до 1 мл |
Примечание
Вышеуказанные композиции можно получить обычными процедурами, известными в фармацевтической области. На таблетки (а)-(с) можно нанести энтеросолюбильные покрытия удобными способами, например, сформировать покрытие из ацетофталата целлюлозы. Аэрозольные композиции (h)-(k) можно применять в сочетании с распределителями, отмеряющими стандартную дозу аэрозоля, а суспендирующие агенты триолеат сорбитана и соевый лецитин можно заменить на другие суспендирующие агенты, такие как моноолеат сорбитана, сесквиолеат сорбитана, полисорбат 80, олеат полиглицерина или олеиновая кислота.
Источники информации
1. Trentham, D.E. etc al. (1997), J. Exp.Med., 146, 857.
2. Williams, R.O. et al. (1992), Proc. Natl. Acad. Sci. 89, 9784.
3. Williams, R.O. et al. (1995), Immunoiogy, 84, 433.
4. Badger, M,B. et al (1996), The Jornal of Pharmacology and Experimtntal Therapeutics, 279, 1453-1461.
Формула изобретения
1. Производное амида формулы I
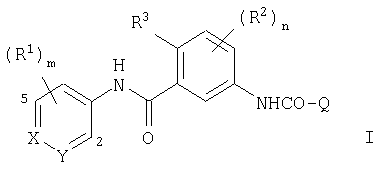
где X представляет СН;
Y представляет СН или N;
m равен 1 или 2;
R1 представляет (C1-С6)алкил, (C1-С6)алкокси, N,N-ди[(C1-С6)алкил]амино, гетероциклил-(C1-С6)алкил, где гетероциклил представляет пиперазинил или гомопиперазинил, и
любой из заместителей R1, имеющих указанные выше значения, содержащий СН2-группу, связанную с 2 атомами углерода, или СН3-группу, связанную с атомом углерода, может, необязательно, содержать в каждой указанной СН2- или СН2-группе заместитель, выбранный из ди[(C1-С6)алкил]амино;
R2 представляет галоген, (C1-С6)алкил;
n равен 3;
R3 представляет водород;
Q представляет фенил, необязательно, замещенный циано, или пиридил, необязательно замещенный морфолино, или их фармацевтически приемлемые соли.
2. Производное амида формулы I по п.1, где
Х представляет СН;
Y представляет СН или N;
m равен 1 или 2;
R1 представляет пропил, метокси, N-(2-диметиламиноэтил)-N-метиламино, N-(3-диметиламинопропил)-N-метиламино, 4-метилпиперазинил, 4-метилгомопиперазинил;
R2 представляет метил, хлор;
Q представляет фенил, необязательно замещенный циано, или пиридил, замещенный морфолино, или их фармацевтически приемлемые соли.
3. Производное амида формулы I по п.1, где
Х представляет СН;
Y представляет СН или N;
m равен 1;
R1 выбран из N-(3-диметиламинопропил)-N-метиламино, 4-метилпиперазин-1-ила и 4-метилгомопиперазин-1-ила;
R2 представляет метил, хлор;
Q представляет 4-пиридил, замещенный морфолино, и или их фармацевтически приемлемые соли.
4. Производное амида формулы I по п.1, где Х представляет СН;
Y представляет СН или N;
m равен 1;
R выбран из N-(3-диметиламинопропил)-N-метиламино, 4-метилпиперазин-1-ила и 4-метилгомопиперазин-1-ила;
R2 представляет метил, хлор;
Q представляет 2-морфолинопирид-4-ил, или их фармацевтически приемлемые соли.
5. Производное амида формулы I по п.1, выбранное из
N-[3-(4-метилпиперазин-1-илметил)фенил]-2-метил-5-(2-морфолинопирид-4-илкарбониламино)бензамида,
N-[6-(4-этилпиперазин-1-ил)пирид-3-ил]-2-хлор-5-(2-морфолинопирид-4-илкарбониламино)бензамида,
N-[6-(4-метилпиперазин-1-ил)пирид-3-ил]-2-хлор-5-(2-морфолинопирид-4-илкарбониламино)бензамида и
N-{6-[N-(3-диметиламинопропил)-N-метиламино]пирид-3-ил}-2-хлор-5-(2-морфолинопирид-4-илкарбониламино)бензамида, или его фармацевтически приемлемая соль.
6. Способ получения производного амида формулы I или его фармацевтически приемлемой соли, включающий взаимодействие анилина формулы II
с бензойной кислотой формулы III или ее активированным производным
в стандартных условиях образования амидной связи, где изменяющиеся группы имеют значения, указанные в п.1, и где любая функциональная группа при необходимости является защищенной, и
(i) удаление любых защитных групп; и
(ii) необязательно, образование фармацевтически приемлемой соли.
7. Способ получения производного амида формулы I или его фармацевтически приемлемой соли, включающий взаимодействие анилина формулы VI
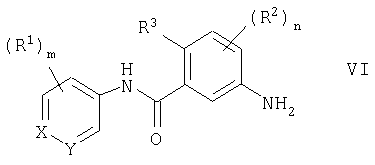
с карбоновой кислотой формулы V или ее реакционно-способным производным
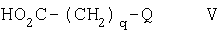
в стандартных условиях образования амидной связи, где изменяющиеся группы имеют значения, указанные в п.1, и где любая функциональная группа при необходимости является защищенной, и
(i) удаление любых защитных групп; и
(ii) необязательно, образование фармацевтически приемлемой соли.
8. Фармацевтическая композиция для лечения заболеваний или состояний, опосредуемых цитокинами р38 и TNF , содержащая производное амида формулы I или его фармацевтически приемлемую соль по п.1 в сочетании с фармацевтически приемлемым носителем или разбавителем. , содержащая производное амида формулы I или его фармацевтически приемлемую соль по п.1 в сочетании с фармацевтически приемлемым носителем или разбавителем.
9. Производное амида формулы I или его фармацевтически приемлемая соль по п.1 для применения в производстве лекарственного средства для лечения заболеваний или состояний, опосредуемых цитокинами р38 и TNF . .
10. Способ лечения заболеваний или состояний, опосредуемых цитокинами р38 и TNF , включающий введение теплокровному животному эффективного количества соединения формулы I или его фармацевтически приемлемой соли по п.1. , включающий введение теплокровному животному эффективного количества соединения формулы I или его фармацевтически приемлемой соли по п.1. |
|
|
|